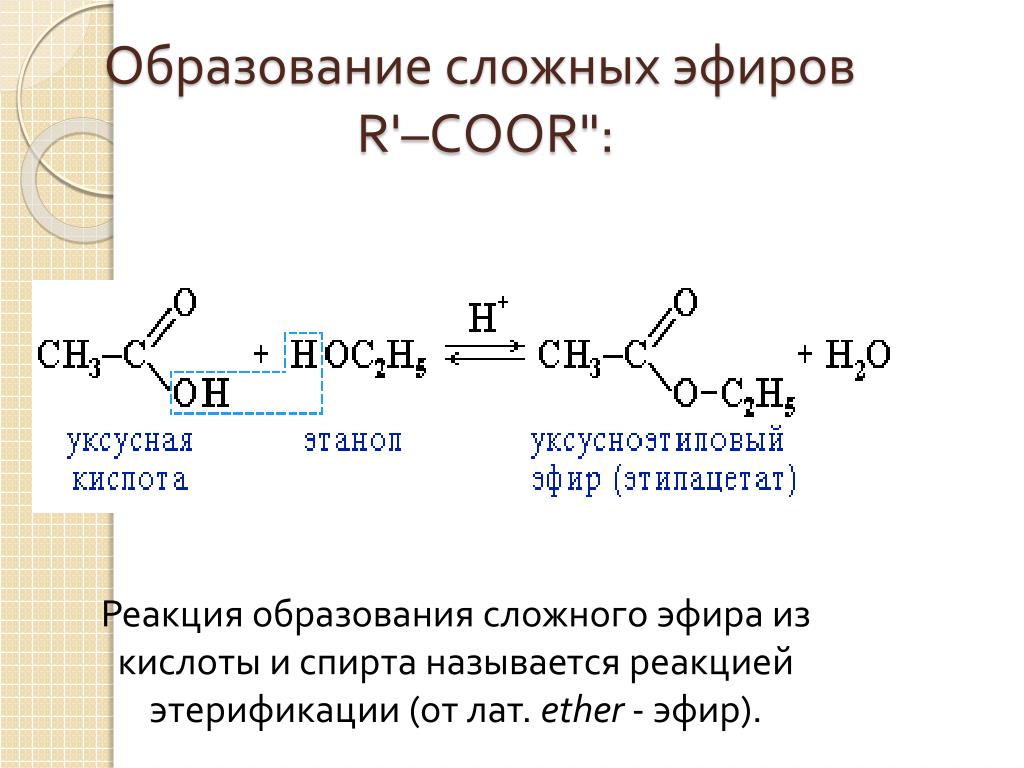
Содержание
Этиловый эфир — бензойная кислота
Cтраница 1
Этиловый эфир бензойной кислоты ( этилбензоат) — бесцветная жидкость с фруктовым запахом; нерастворим в воде; смешивается со спиртом, эфиром, хлороформом.
[1]
Этиловый эфир бензойной кислоты СвНГ) СООС2Н5 получается при взаимодействии бензойной кислоты С6Н5СООН с этиловым спиртом при участии серной кислоты.
[2]
Этиловый эфир бензойной кислоты ( этилбеизоат) — бесцветная жидкость с фруктовым запахом; нерастворим в воде; смешивается со спиртом, эфиром, хлороформом.
[3]
Этиловый эфир бензойной кислоты ( этилбэнзоат) — бесцветная жидкость с фруктовым запахом; нерастворим в воде; смешивается со спиртом, эфиром, хлороформом.
[4]
Этиловый эфир бензойной кислоты ингибирует кор розию углеродистой стали в жидкой и газовой фазах.
[5]
Этиловые эфиры бензойной кислоты не попадают в этот рядг построенный на основе индукционных и мезомерных эффектов: по своей основности они располагаются между бензальдегидом и бен-зоилхлоридом.
[6]
Этиловый эфир бензойной кислоты СвНяС; — жидкость с темп.
[7]
Гидрирование этилового эфира бензойной кислоты на никеле при 225 и давлении 92 am приводит [183, 241] к образованию этилового эфира циклогексан-карбоновой кислоты с теоретическим выходом.
[8]
Получение этилового эфира бензойной кислоты [137], Раствор бромистого фенилмагния, полученный из 53 г бромбензола и 7 7 г магния в 400 мл эфира, постепенно прибавлен к 40 г хлоругольного эфира в равном объеме эфира.
[9]
Конденсация этилового эфира бензойной кислоты с этиловым эфиром изомасляной кислоты, приводящая к образованию этилового эфира а-бензоилизомасляной кислоты, в которой проявляется лишь первый фактор и которую ранее не удалось осуществить, была проведена Хаузером и Ренфроу с помощью предложенного ими метода.
[10]
Так как этиловый эфир бензойной кислоты, имеющий высокую температуру кипения, трудно удалить из сферы реакции и применяется не абсолютный этиловый спирт, то для смещения равновесия вправо приходится брать значительный избыток этилового спирта.
[11]
Так как этиловый эфир бензойной кислоты, имеющий высокую температуру кипения, трудно удалить из сферы реакции и применяется не абсолютный этанол, то для смещения равновесия вправо приходится брать значительный избыток этанола.
[12]
Этилбензоат ( этиловый эфир бензойной кислоты) — бесцветная жидкость с фруктовым запахом; нерастворим в воде; смешивается с этанолом, диэтиловым Эфиром, хлороформом.
[13]
Так как этиловый эфир бензойной кислоты, имеющий высокую температуру кипения, трудно удалить-из сферы реакции и применяется не абсолютный этиловый спирт, то для смещения равновесия4 вправо приходится брать значительный избыток этилового спирта.
[14]
Так как этиловый эфир бензойной кислоты, имеющий высокую температуру кипения, трудно удалить из сферы реакции и применяется не абсолютный этиловый спирт, то для смещения равновесия вправо приходится брать значительный избыток этилового спирта.
[15]
Страницы:
1
2
3
LumiTracker Mito TMRE
- Товары и услуги
- Клеточная биология
- Визуализация клеток
- LumiTracker Mito TMRE
Клеточные структуры и органеллы Клеточная выживаемость и апоптоз Клеточная биология
| Артикул | Фасовка | Цена | Срок поставки | Купить товар |
|---|---|---|---|---|
| 2274-1mg | 1 mg | – | в наличии | |
| 2274-25mg | 25 mg | $190. 00 00 | в наличии |
Запросить образец
TMRE широко используется для окрашивания митохондрий в живых клетках и не подходит для протоколов с фиксацией клеток. Этот липофильный и положительно заряженный краситель проникает через плазматическую мембрану клеток, при этом не взаимодействуя с мембранными белками и не образуя агрегатов. Краситель TMRE селективно накапливается в активных митохондриях благодаря трансмембранному потенциалу, который митохондрии поддерживают в нормальном состоянии.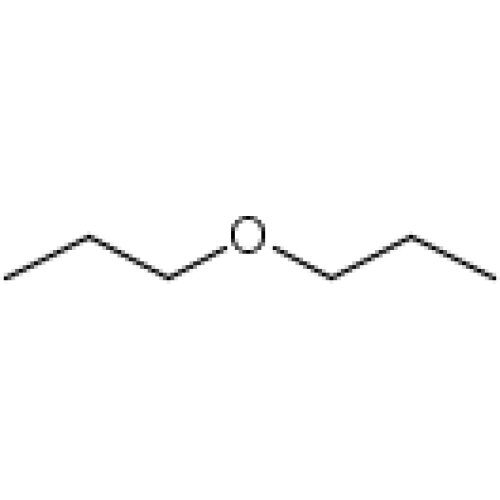
Кроме окрашивания митохондрий для их визуализации, TMRE используется для количественной оценки митохондриального мембранного потенциала с помощью уравнения Нернста. Краситель служит инструментом для изучения изменений функционирования митохондрий и жизнеспособности клеток в ответ на исследуемые агенты. Деполяризация митохондрий вследствие запуска процессов апоптоза, некроза или других факторов характеризуется уменьшением мембранного потенциала и, как следствие, уменьшением накопления красителя и его флуоресценции, по сравнению с интактными клетками, имеющими поляризованные митохондрии.
Краситель TMRE применяется в флуоресцентной микроскопии, проточной цитофлуориметрии, экспериментах с использованием планшетных ридеров. Краситель имеет максимум возбуждения при 549 нм — он совместим с голубым (488 нм) и желто-зеленым (561 нм) лазерами. Флуоресценция красителя детектируется в канале фикоэритрина (PE) (максимум при 574 нм).
Скачать в формате
ChemDraw
Спектры поглощения и эмиссии TMRE
С этим продуктом также покупают
BDP 630/650 краситель для липидов
Дальне-красный флуоресцентный краситель BDP 630/650, способный окрашивать липиды и другие липофильные соединения.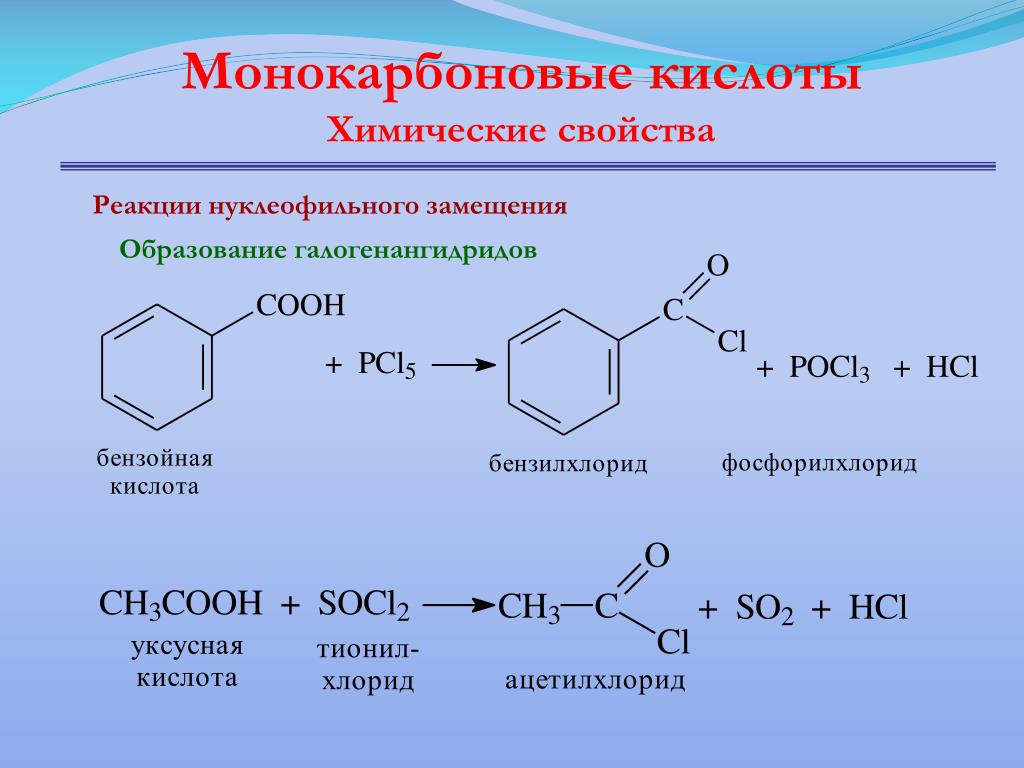
25 mg – $ 330.005 mg – $ 110.00
BDP 493/503 краситель для липидов
BDP 493/503 — липофильный зелёный флуоресцентный краситель для прокрашивания клеточных мембран, липидов и других гидрофобных сред.
25 mg – $ 190.00
h3DCFDA (2′,7′-Дихлородигидрофлуоресцеин диацетат)
Реагент для обнаружения активных форм кислорода в живых клетках.
100 mg – $ 110. 00250 mg – $ 190.00
00250 mg – $ 190.00
Общие свойства
| Вид продукта: | темное твердое вещество |
| Молекулярная масса: | 514.96 |
| CAS-номер: | 115532-52-0 |
| Брутто-формула: | C26H27N2ClO7 |
| Название IUPAC: | 3,6-bis(dimethylamino)-9-(2-ethoxycarbonylphenyl)xanthylium perchlorate |
| Растворимость: | хорошая в ДМФА, ДМСО |
| Контроль качества: | ЯМР 1H, ВЭЖХ-МС (95%) |
| Условия хранения: | 24 месяца (с момента доставки) при -20°C в темноте. Транспортировка: до трех недель при комнатной температуре. Избегайте хранения на свету. Берегите от влаги. Транспортировка: до трех недель при комнатной температуре. Избегайте хранения на свету. Берегите от влаги. |
| Паспорт безопасности: | Скачать |
| Спецификация продукта |
Спектральные свойства
| Максимум возбуждения/поглощения, нм: | 552 |
| ε, л⋅моль−1⋅см−1: | 156000 |
| Длина волны флуоресценции, нм: | 575 |
| Квантовый выход флуоресценции: | 0.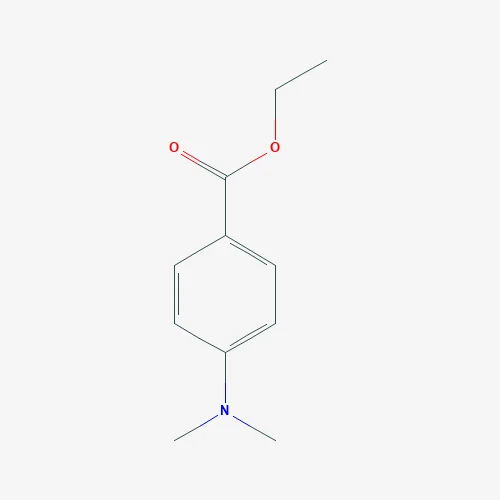 66 66 |
Товар добавлен.
Просмотрите
корзину покупок
или
оформите заказ
Введено некорректное число товаров для добавления.
Бензойная кислота — Sciencemadness Wiki
Бензойная кислота — бесцветное кристаллическое твердое вещество и простейшая ароматическая карбоновая кислота.
Он имеет формулу C 7 H 6 O 2 , хотя удобнее писать так: C 6 H 5 COOH
4. Его также иногда обозначают аббревиатурой
PhCOOH .
Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.
 1 Безопасность
1 Безопасность - 5.2 Хранение
- 5.3 Утилизация
- 5.
- 6 Галерея
- 7 Каталожные номера
- 7.1 Соответствующие темы Sciencemadness
Свойства
Химический
Окислительное декарбоксилирование бензойной кислоты при температуре 300–400 °C дает фенол. Если используются соли Cu(II), реакция может протекать при более низких температурах, около 200 °C:
- C 6 H 5 COOH + ½ O 2 → C 6 H 5 OH + CO 2
Декарбоксилирование бензойновой кислоты или его соли даст бензоен.
Физический
Бензойная кислота представляет собой бесцветное твердое вещество, плохо растворимое в воде, но более растворимое в органических растворителях.
Доступность
Бензойную кислоту иногда можно найти в продовольственных магазинах в качестве пищевого консерванта, хотя в большинстве случаев это просто старый добрый бензоат натрия, так как последний лучше растворим в воде.
Бензойную кислоту более высокой чистоты можно приобрести у поставщиков химикатов или, что удобнее, на eBay или Amazon.
Подготовка
Бензойная кислота может быть получена путем окисления толуола перманганатом калия.
- C 6 H 5 CH 3 + KMNO 4 → C 6 H 5 COOH + MNO 2 + H 2 O
ASE COMBERITIT Путь включает добавление кислоты, такой как разбавленная соляная кислота, к бензоату натрия.
- C 6 H 5 COONa + HCl → C 6 H 5 COOH + NaCl
Бензойная кислота, будучи менее растворимой, чем бензоат натрия, будет осаждаться из раствора. Затем сырую бензойную кислоту фильтруют, промывают холодной водой и сушат.
Окисление бензальдегида на воздухе дает бензойную кислоту.
Проекты
- Производство бензола
- Сделать метилбензоат
- Сделать бензоат аммония
- Получение бензоата меди(II)
Обращение
Безопасность
Бензойная кислота практически нетоксична, хотя порошкообразная форма вызывает раздражение при вдыхании.
Хранение
Бензойную кислоту следует хранить в закрытых бутылях, вдали от щелочных оснований и аммиака.
Утилизация
Бензойная кислота не требует специальной утилизации, так как она безвредна. Откажитесь от него, как хотите.
Галерея
Ссылки
Соответствующие темы Sciencemadness
- толуол —> бензойная кислота…
- Бензоат натрия в бензойную кислоту
- Растворитель для хлорирования бензойной кислоты
- Бензойная кислота из бензоиновой смолы
4.4 Растворимость — химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 17044
Понимание диполей связи и различных типов нековалентных межмолекулярных сил позволяет нам объяснить на молекулярном уровне многие наблюдаемые физические свойства органических соединений. В этом разделе мы сосредоточимся на растворимости, температуре плавления и температуре кипения.
В этом разделе мы сосредоточимся на растворимости, температуре плавления и температуре кипения.
Растворимость
Практически вся органическая химия, которую вы увидите в этом курсе, проходит в фазе раствора. В органической лаборатории реакции часто проводят в неполярных или слабополярных растворителях, таких как толуол (метилбензол), гексан, дихлорметан или диэтиловый эфир. В последние годы было предпринято много усилий, чтобы адаптировать условия реакции, чтобы можно было использовать «более экологичные» (другими словами, более безвредные для окружающей среды) растворители, такие как вода или этанол, которые являются полярными и способны образовывать водородные связи. В органических реакциях, протекающих в цитозольной области клетки, растворителем, конечно же, является вода. Для любого химика-органика крайне важно понимать факторы, влияющие на растворимость различных молекул в различных растворителях.
Вы, наверное, помните правило общей химии о растворимости: «подобное растворяется в подобном» (и даже до того, как вы вообще занялись какой-либо химией, вы, вероятно, в какой-то момент своей жизни заметили, что масло не смешивается с водой). Давайте вернемся к этому старому правилу и задействуем наши знания о ковалентных и нековалентных связях.
Давайте вернемся к этому старому правилу и задействуем наши знания о ковалентных и нековалентных связях.
Представьте, что у вас есть колба, наполненная водой, и набор веществ, которые вы будете проверять, насколько хорошо они растворяются в воде. Первым веществом является поваренная соль, или хлорид натрия. Как вы почти наверняка догадались, особенно если вы когда-либо случайно набирали глоток воды во время плавания в океане, это ионное соединение легко растворяется в воде. Почему? Потому что вода, как очень полярная молекула, способна образовывать множество ион-дипольных взаимодействий как с катионом натрия, так и с анионом хлорида, энергии от которых более чем достаточно, чтобы компенсировать энергию, необходимую для разрыва ион-ионных взаимодействий. в кристалле соли и некоторых водородных связях вода-вода.
Таким образом, конечным результатом является то, что вместо кристаллов хлорида натрия у нас есть отдельные катионы натрия и анионы хлорида, окруженные молекулами воды — соль теперь в растворе .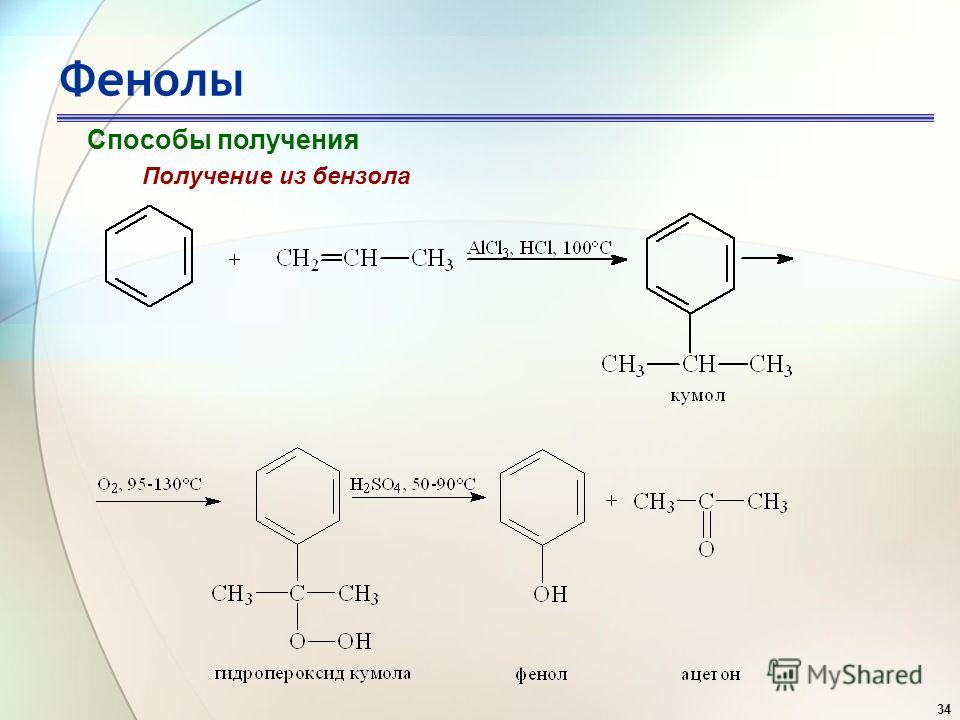 Заряженные виды, как правило, хорошо растворяются в воде, другими словами, они очень гидрофильны (водолюбивы).
Заряженные виды, как правило, хорошо растворяются в воде, другими словами, они очень гидрофильны (водолюбивы).
Теперь попробуем соединение под названием бифенил, которое, как и хлорид натрия, представляет собой бесцветное кристаллическое вещество (однако два соединения легко различимы на вид — кристаллы выглядят совершенно по-разному).
Бифенил вообще не растворяется в воде. Почему это? Потому что это очень неполярная молекула, имеющая только связи углерод-углерод и углерод-водород. Он способен очень хорошо связываться сам с собой за счет неполярных ван-дер-ваальсовых взаимодействий, но не способен формировать значительные притягивающие взаимодействия с очень полярными молекулами растворителя. Таким образом, энергетические затраты на разрушение взаимодействий бифенила и бифенила в твердом теле высоки, и очень мало выиграно с точки зрения новых взаимодействий бифенил-вода. Вода — ужасный растворитель для неполярных молекул углеводородов: они очень гидрофобный (водоотталкивающий).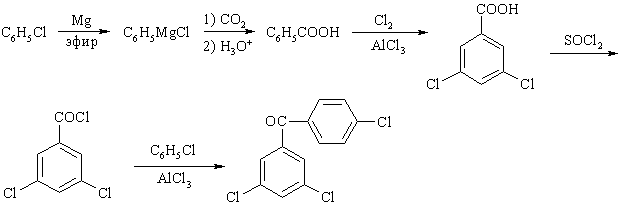
Затем вы пробуете серию все более крупных спиртовых соединений, начиная с метанола (1 атом углерода) и заканчивая октанолом (8 атомов углерода).
Вы обнаружите, что более мелкие спирты — метанол, этанол и пропанол — легко растворяются в воде. Это связано с тем, что вода способна образовывать водородные связи с гидроксильной группой в этих молекулах, и суммарная энергия образования этих водно-спиртовых водородных связей более чем достаточна для восполнения энергии, теряемой при взаимодействии спирта со спиртом. водородные связи разрываются. Однако когда вы пробуете бутанол, вы начинаете замечать, что по мере того, как вы добавляете в воду все больше и больше, он начинает формировать свой собственный слой поверх воды.
Спирты с более длинной цепью — пентанол, гексанол, гептанол и октанол — становятся все более нерастворимыми. Что здесь происходит? Ясно, что такие же благоприятные водородные связи вода-спирт все еще возможны с этими более крупными спиртами. Разница, конечно, в том, что более крупные спирты имеют более крупные неполярные гидрофобные области в дополнение к их гидрофильной гидроксильной группе. Примерно при четырех-пяти атомах углерода гидрофобный эффект начинает преобладать над гидрофильным эффектом, и растворимость в воде теряется.
Разница, конечно, в том, что более крупные спирты имеют более крупные неполярные гидрофобные области в дополнение к их гидрофильной гидроксильной группе. Примерно при четырех-пяти атомах углерода гидрофобный эффект начинает преобладать над гидрофильным эффектом, и растворимость в воде теряется.
Теперь попробуйте растворить глюкозу в воде — хотя она имеет шесть атомов углерода, как и гексанол, она также имеет пять гидрофильных гидроксильных групп, образующих водородные связи, в дополнение к шестому кислороду, который способен быть акцептором водородных связей.
Мы склонили чашу весов в сторону гидрофильности и обнаружили, что глюкоза хорошо растворима в воде.
Мы видели, что этанол очень хорошо растворим в воде (в противном случае пить пиво или водку было бы довольно неудобно!) А как насчет диметилового эфира, который является структурным изомером этанола, но с функциональной группой эфира, а не спирта? Мы находим, что диэтиловый эфир гораздо менее растворим в воде.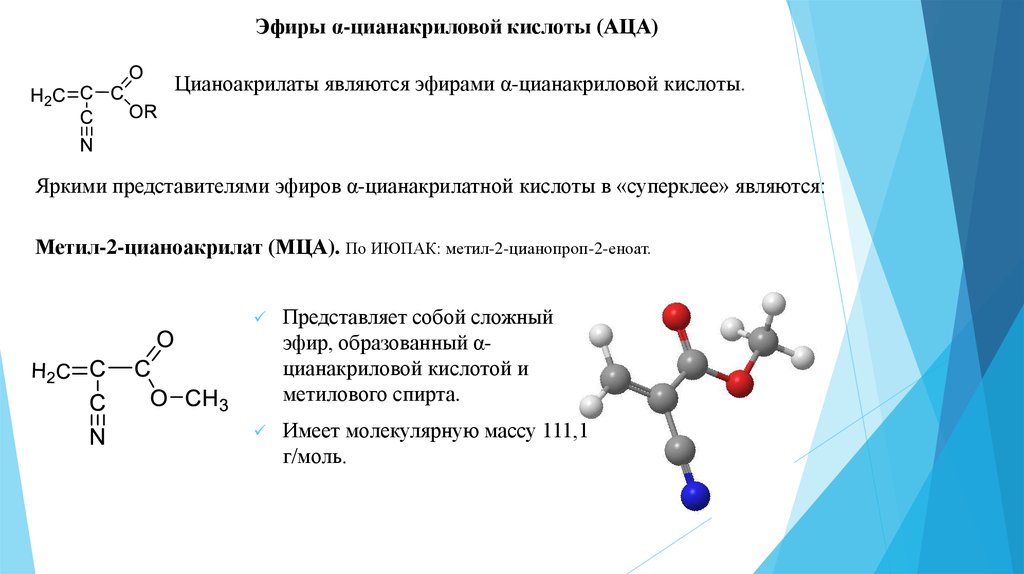 Способен ли он образовывать водородные связи с водой? Да, действительно, кислород эфира может выступать акцептором водородной связи. Однако разница между эфирной группой и спиртовой группой состоит в том, что спиртовая группа одновременно является донором водородной связи 9.Акцептор 0216 и .
Способен ли он образовывать водородные связи с водой? Да, действительно, кислород эфира может выступать акцептором водородной связи. Однако разница между эфирной группой и спиртовой группой состоит в том, что спиртовая группа одновременно является донором водородной связи 9.Акцептор 0216 и .
В результате спирт способен образовывать более энергетически выгодные взаимодействия с растворителем по сравнению с эфиром, и поэтому спирт более растворим.
Вот еще один простой эксперимент, который можно провести (при должном надзоре) в органической лаборатории. Попробуйте растворить кристаллы бензойной кислоты в воде комнатной температуры — вы обнаружите, что она не растворяется. Как мы узнаем из одной из последующих глав, изучая кислотно-основную химию, карбоновые кислоты, такие как бензойная кислота, являются относительно слабыми кислотами и, таким образом, существуют в основном в кислой (протонированной) форме при добавлении к чистой воде.
Уксусная кислота, однако, хорошо растворима. Это легко объяснить, используя аргумент «малый спирт против большого спирта»: гидрофильный эффект водородной связи группы карбоновой кислоты достаточно силен, чтобы преодолеть гидрофобный эффект одной метильной группы на уксусную кислоту, но не больший гидрофобный эффект спирта. 6-углеродная бензольная группа бензойной кислоты.
Это легко объяснить, используя аргумент «малый спирт против большого спирта»: гидрофильный эффект водородной связи группы карбоновой кислоты достаточно силен, чтобы преодолеть гидрофобный эффект одной метильной группы на уксусную кислоту, но не больший гидрофобный эффект спирта. 6-углеродная бензольная группа бензойной кислоты.
Теперь попробуйте медленно добавить немного водного раствора гидроксида натрия в колбу с нерастворенной бензойной кислотой. По мере того как растворитель становится все более щелочным, бензойная кислота начинает растворяться, пока полностью не растворится.
Здесь происходит превращение бензойной кислоты в сопряженное с ней основание, бензоат. Нейтральная карбоксильная группа не была достаточно гидрофильной, чтобы компенсировать гидрофобное бензольное кольцо, но карбоксилатная группа с ее полным отрицательным зарядом гораздо более гидрофильна. Теперь баланс склоняется в пользу растворимости в воде, поскольку сильно гидрофильная анионная часть молекулы увлекает гидрофобную часть, лягаясь и крича (если бензольное кольцо может пинаться и кричать) в раствор. Если вы хотите снова осадить бензойную кислоту из раствора, вы можете просто добавить достаточное количество соляной кислоты, чтобы нейтрализовать раствор и повторно протонировать карбоксилат.
Если вы хотите снова осадить бензойную кислоту из раствора, вы можете просто добавить достаточное количество соляной кислоты, чтобы нейтрализовать раствор и повторно протонировать карбоксилат.
Если вы изучаете лабораторный компонент курса органической химии, вы, вероятно, проведете по крайней мере один эксперимент, в котором будете использовать это явление для отделения органической кислоты, такой как бензойная кислота, от углеводородного соединения, такого как бифенил.
Аналогичные аргументы можно привести для обоснования растворимости различных органических соединений в неполярных или слабополярных растворителях. В общем, чем выше содержание заряженных и полярных групп в молекуле, тем менее растворима она в таких растворителях, как гексан. Ионный и очень гидрофильный хлорид натрия, например, совсем не растворяется в растворителе гексане, тогда как гидрофобный бифенил хорошо растворяется в гексане.
| Пример |
|---|
Упражнение 2. Упражнение 2.13 : И анилин, и фенол нерастворимы в чистой воде. Предскажите растворимость этих двух соединений в 10% водном растворе соляной кислоты и объясните свои рассуждения. Подсказка – в данном контексте анилин является основным, фенол – нет! Растворы |
Иллюстрации концепций растворимости: промежуточные продукты метаболизма, липидные двухслойные мембраны, мыла и детергенты
Поскольку вода является биологическим растворителем, большинство биологических органических молекул для поддержания растворимости в воде содержат один или более заряженных функциональных групп. Чаще всего это фосфат, аммоний или карбоксилат, все они заряжаются при растворении в водном растворе, забуференном до pH 7.
В сахарах часто отсутствуют заряженные группы, но, как мы обсуждали в нашем «мысленном эксперименте» с глюкозой, они вполне растворимы в воде благодаря наличию нескольких гидроксильных групп.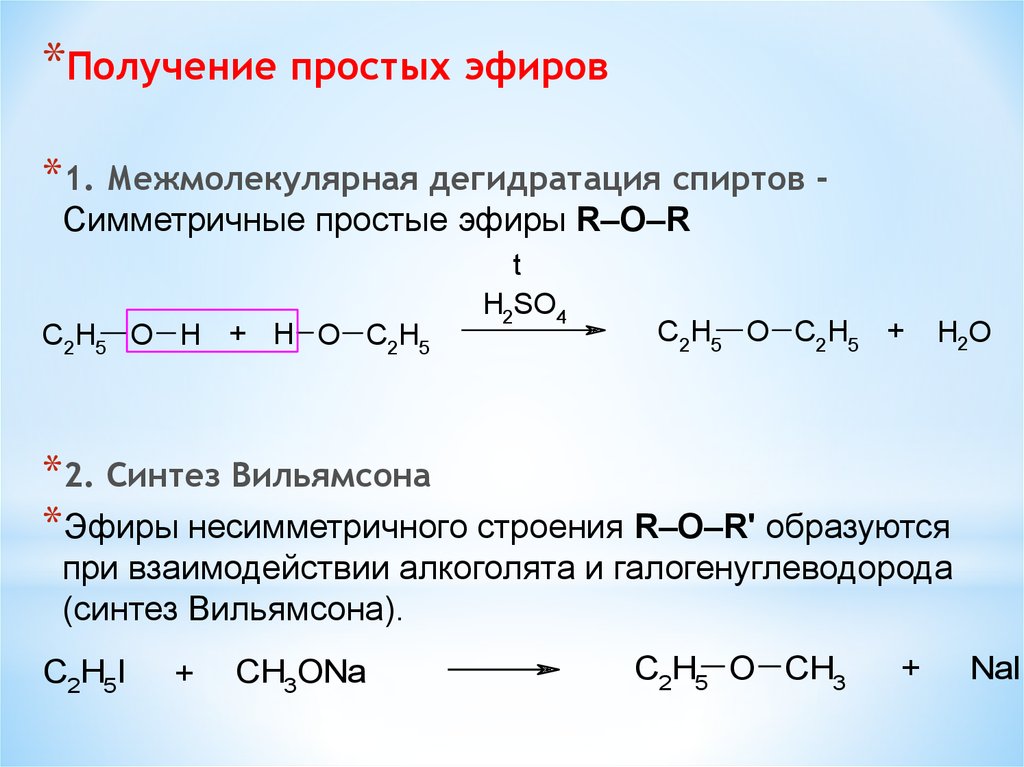
Некоторые биомолекулы, напротив, содержат отчетливо гидрофобные компоненты. Мембраны «липидного двойного слоя» клеток и субклеточных органелл служат для заключения объемов воды и множества биомолекул в растворе. Молекулы липидов (жиров), из которых состоят мембраны, являются 90–218 амфипатическими : они имеют заряженную гидрофильную «голову» и гидрофобный углеводородный «хвост».
интерактивное трехмерное изображение мембранного фосфолипида (BioTopics)
Обратите внимание, что вся молекула построена на «основе» глицерина, простой трехуглеродной молекулы с тремя спиртовыми группами. В структуре биологической мембраны молекулы липидов располагаются в виде сферического бислоя: гидрофобные хвосты направлены внутрь и связываются между собой силами Ван-дер-Ваальса, а гидрофильные головные группы образуют внутреннюю и внешнюю поверхности, контактирующие с водой.
Интерактивное трехмерное изображение липидного двойного слоя (BioTopics)
Поскольку внутренняя часть двойного слоя чрезвычайно гидрофобна, биомолекулы (которые, как мы знаем, обычно являются заряженными частицами) не могут диффундировать через мембрану – они просто не растворяется в гидрофобном интерьере.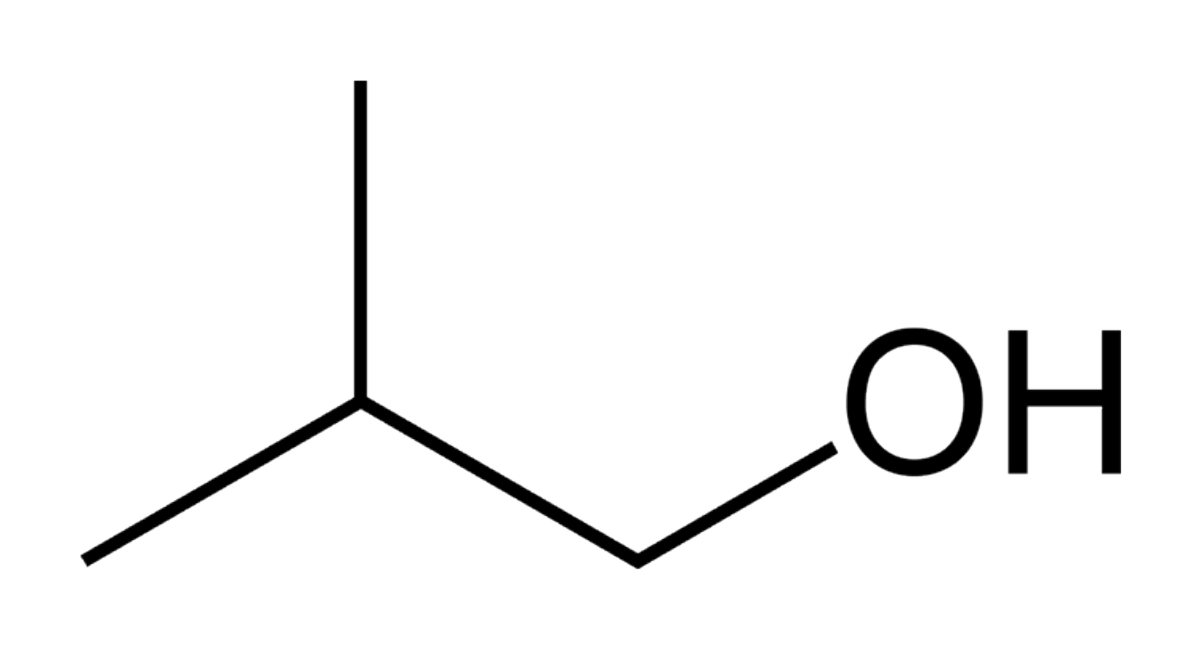 Таким образом, транспорт молекул через мембрану клетки или органеллы может осуществляться контролируемым и специфическим образом с помощью специальных трансмембранных транспортных белков — увлекательная тема, о которой вы узнаете больше, если будете посещать занятия по биохимии.
Таким образом, транспорт молекул через мембрану клетки или органеллы может осуществляться контролируемым и специфическим образом с помощью специальных трансмембранных транспортных белков — увлекательная тема, о которой вы узнаете больше, если будете посещать занятия по биохимии.
Аналогичный принцип лежит в основе действия мыла и моющих средств. Мыла состоят из жирных кислот, которые представляют собой длинные (обычно 18-углеродные) гидрофобные углеводородные цепи с (заряженной) карбоксилатной группой на одном конце,
Жирные кислоты получают из животных и растительных жиров и масел. В водном растворе молекулы жирных кислот в мылах спонтанно образуют мицелл , сферическую структуру, которая позволяет гидрофобным хвостам избегать контакта с водой и одновременно образовывать благоприятные ван-дер-ваальсовые контакты.
Интерактивные трехмерные изображения молекулы мыла жирной кислоты и мыльной мицеллы (Edutopics)
Поскольку внешняя часть мицеллы заряжена и гидрофильна, вся структура растворима в воде.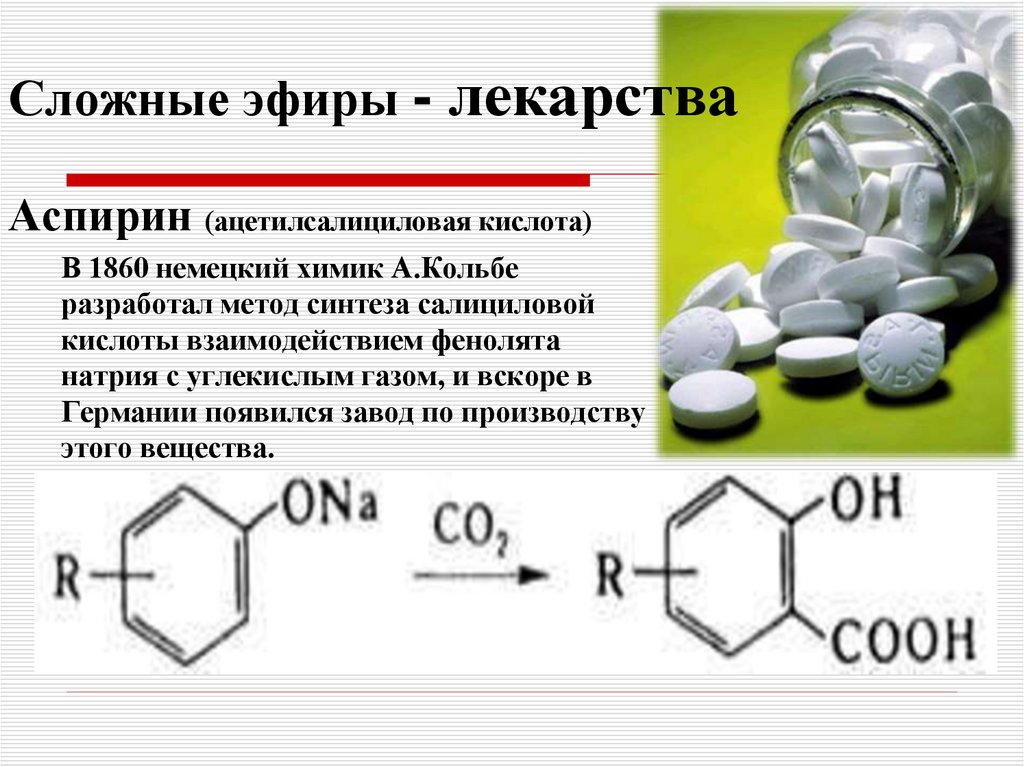 Мицеллы спонтанно образуются вокруг небольших частиц масла, которые обычно не растворяются в воде (например, жирное пятно на вашей рубашке от ломтика пепперони, отпавшего от пиццы), и уносят частицу с собой в раствор. Мы узнаем больше о химии мыловарения в следующей главе (раздел 12.4B).
Мицеллы спонтанно образуются вокруг небольших частиц масла, которые обычно не растворяются в воде (например, жирное пятно на вашей рубашке от ломтика пепперони, отпавшего от пиццы), и уносят частицу с собой в раствор. Мы узнаем больше о химии мыловарения в следующей главе (раздел 12.4B).
Синтетические моющие средства представляют собой ненатуральные амфипатические молекулы, работающие по тому же принципу, что и мыло.
Органическая химия с акцентом на биологию Тима Содерберга (Университет Миннесоты, Моррис)
Водородные связи и растворимость
На физические свойства спиртов влияет способность группы -ОН образовывать водородные связи. Группы -ОН могут связываться водородом друг с другом и с другими молекулами.
Водородная связь метанола
Водородная связь повышает температуру кипения спиртов. Это происходит из-за объединенной силы столь многих водородных связей, образующихся между атомами кислорода одной молекулы спирта и гидроксильными атомами H другой. Чем длиннее углеродная цепь в спирте, тем ниже растворимость в полярных растворителях и выше растворимость в неполярных растворителях.
Чем длиннее углеродная цепь в спирте, тем ниже растворимость в полярных растворителях и выше растворимость в неполярных растворителях.
| Compound | IUPAC Name | Common Name | Melting Poing ( o C) | Boiling Point ( o C) | Solubility in H 2 O at 23 o C |
| CH 3 OH | Methanol | Methyl alcohol | -97.8 | 65.0 | Infinite |
| CH 3 Cl | Chloromethane | Methyl chloride | -97.7 | -24.2 | 0. 74 g/100 mL 74 g/100 mL |
| CH 4 | Methane | -182.5 | -161.7 | 3.5 mL (gas)/ 100 mL | |
| CH 3 CH 2 OH | Ethanol | Ethyl alcohol | -114.7 | 78.5 | Infinite |
| CH 3 CH 2 Cl | Chloroethane | Ethyl chloride | -136.4 | 12.3 | 0.447 g/100 mL |
| CH 3 CH 3 | Ethane | -183.3 | -88.6 | 4.7 mL (gas)/ 100 mL | |
| CH 3 CH 2 CH 2 OH | 1-Propanol | Propyl alcohol | -126.5 | 97.4 | Infinite |
| CH 3 CH 2 CH 3 | Propane | -187. 7 7 | -42.1 | 6.5 mL (gas) / 100 mL | |
| CH 3 CH 2 CH 2 CH 2 OH | 1-Butanol | Butyl alcohol | -89.5 | 117.3 | 8.0 g/100 mL |
| CH 3 (CH 2 ) 4 OH | 1-Pentanol | Pentyl alcohol | -79 | 138 | 2.2 g/100 mL |
This table shows that спирты (выделены красным) имеют более высокие температуры кипения и большую растворимость в H 2 O, чем галогеналканы и алканы с таким же числом атомов углерода. Это также показывает, что температура кипения спиртов увеличивается с увеличением числа атомов углерода.
Ссылки
- Шор, Нил Э. и Фоллхардт, К. Питер К. Органическая химия: структура и функции . Нью-Йорк: Блейер, Бреннан, 2007.
- Аллен, Фрэнк; Кеннард.
 Ольга; Уотсон, Дэвид Г .; Браммер, Ли; Орпен, Гай; Тейлор, Робин, J. Chem Soc. Перкин Транс II , 1987, S1-S19.
Ольга; Уотсон, Дэвид Г .; Браммер, Ли; Орпен, Гай; Тейлор, Робин, J. Chem Soc. Перкин Транс II , 1987, S1-S19.
Внешние ссылки
- http://en.wikipedia.org/wiki/Alcohol#Physical_and_chemical_properties
- http://www.chemguide.co.uk/organicprops/alcohols/background.html
Проблемы
Расположить по возрастанию температуры кипения. (Начните с самой низкой точки кипения)
- Ch 4 , Ch 3 OH, Ch 3 CH 3
- CH 3 Ch 2 CL, Ch 3 CH 2 2 2 CH 2 CL, CH 3 Ch 2 2 2 2 CH 2 CL, Ch 3 CH 2 Ch 2 OH, Ch 3 Ch 2 Ch 3
- CH 3 CH 2 OH, Ch 3 CH 2 CL, Ch 4
CH 2 CL, Ch 4
Arrange according to increasing solubility (start with lowest solubility)
- CH 4 , CH 3 OH, CH 3 CH 3
- CH 4 , CH 3 CH 2 CL, Ch 3 Ch 2 OH,
- CH 3 CH 2 CL, Ch 3 CH 2 CH 2 OH, Ch 3 Ch 2 CH 3
Ответы
- CH 4 , Ch 3 CH 3 , CH 3 OH
- CH 3 CH 2 CH 3 , Ch 3 CH 2 CL, Ch 3 3.


 1 Безопасность
1 Безопасность 12 . Витамины можно классифицировать как водорастворимые и жирорастворимые (считайте жир очень неполярным, гидрофобным «растворителем»). Определите классификацию для каждого из них.
12 . Витамины можно классифицировать как водорастворимые и жирорастворимые (считайте жир очень неполярным, гидрофобным «растворителем»). Определите классификацию для каждого из них. Ольга; Уотсон, Дэвид Г .; Браммер, Ли; Орпен, Гай; Тейлор, Робин, J. Chem Soc. Перкин Транс II , 1987, S1-S19.
Ольга; Уотсон, Дэвид Г .; Браммер, Ли; Орпен, Гай; Тейлор, Робин, J. Chem Soc. Перкин Транс II , 1987, S1-S19.