Бензоат калия или Е212 — разрешен и опасен. Бензоат калия получение из эфира
Кислота бензойная Натрия бензоат
| Структура. Химическое название | МНН, латинское название. Формы выпуска. Фармакологическое действие |
| Кислота бензойная бензолкарбоновая кислота | Benzoic acid Acidum benzoicum Субстанция Дерматологическое, Антисептическое средство |
|
Натрия бензоат | Natrii benzoas Субстанция Отхаркивающее средство |
Получение
Кислота бензойная содержится во многих плодах и ягодах. Но для медицинских целей её получают окислением толуола различными окислителями (азотная или хромовая кислота, калия дихромат, диоксид марганца) в кислой среде.
Современный промышленный способ основан на жидкофазном окислении толуола кислородом воздуха при 130-160 оС и давлении 308-790 кПа.
2
+ 3O2 2
+ 2h3O
Натрия бензоат получают, выпаривая досуха раствор соответствующей бензойной кислоты , нейтрализованный эквивалентным количеством Nа2СО3 (натрия карбоната)
Описанне
Кислота бензойная – бесцветные игольчатые кристаллы или белый мелкокристаллический порошок, без запаха. При нагревании возгоняется, перегоняется с водяным паром.
Натрия бензоат – белый кристаллический или аморфный порошок без запаха или с очень слабым запахом.
Растворимость
Кислота мало растворима в воде (растворима в кипящей), легко растворяется в этаноле, эфире.
Натриевая соль легко растворима в воде, трудно в спирте, не растворима в эфире.
Подлинность
1. ФС УФ-спектр водного раствора натрия бензоата в области 220-300 нм должен иметь максимум поглощения при 226±2 нм.
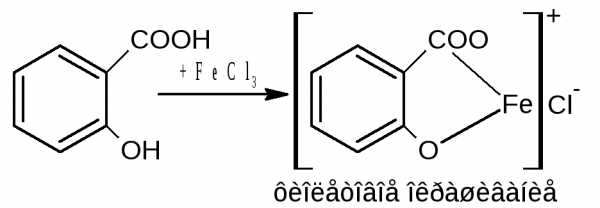
2. ФС. Реакция солеобразования с солями тяжелых металлов (с FеСl3). Реакция на бензоат-ион. Кислоту предварительно переводят в натриевую соль. Проводится в нейтральной среде, т.к. в кислой среде осадок комплексной соли растворяется (поэтому кислоту предварительно растворяют в 0,1н NаОН), а в щелочной – выпадает бурый осадок Fе(ОН)3.
Эффект реакции - образование труднорастворимой комплексной соли железа окрашенной в розовато-желтый цвет (телесный цвет).
или
С6Н5СООН + NаОН → C6H5COONa + Н2О (до нейтральной рН)
бензойная кислота экв.
6C6H5COONa + 2FеСl3 + 10Н2О →
→ (С6Н5СОО-)3 Fе3+ · Fе(ОН) 3 · 7Н2О ↓ + 3С6Н5СООН + NаСl
осадок розовато-желтого цвета
3. ФС температура плавления бензойной кислоты. В натрия бензоате её получают, обработав препарат азотной кислотой, определяют температуру плавления выпавшей в осадок бензойной кислоты.
C6H5COONa + HNO3 → C6H5COOН ↓ + NaNO3
4.ФС Соль натрия, внесенная в бесцветное пламя, окрашивает его в желтый цвет (катион натрия).
Не фармакопейные реакции:
5. с Н2О2 в присутствии катализатора FеSО4 из бензойной образуется салициловая кислота и последующее добавление FеСl3вызывает появление фиолетового окрашивания, а не розовато-желтого.
6. С CuSO4 в нейтральной среде образуется осадок соли меди сине-зеленого цвета. При последующем добавлении хлороформа, слой хлороформа окрашивается в голубой цвет, водный – обесцвечивается (экстракция продукта реакции, т.к. неполярное соединение).
2C6H5COONa + CuSО4 → (C6H5COO-)2Сu2+↓ + Nа2 SО4
осадок сине-зелёноro цвета
7. В нейтральной среде при добавлении к раствору АgNO3 образуется осадок белого цвета. C6H5COOАg↓.
studfiles.net
Использование консерванта Е212 (бензоат калия) в пищевой промышленности
Е212 — пищевой консервант, который также известен как бензоат калия и бензойнокислый калий, Potassium Benzoate, Kalium Benzoat, Е-212.
Данное химическое соединение относят к солям, производным от бензойной кислоты при взаимодействии с калием или в окислительной реакции толуола.
Свойства
E212 имеет химическую формулу KC7H5O2 и состоит на 52 процента из углерода, на 24 из калия, на 19 из кислорода и на три процента из водорода.
Допускается наличие примесей, таких как свободная бензойная кислота, пероксибензоаты и карбонаты.
Внешне E212 выглядит как кристаллический (гигроскопический) белый порошок, у которого нет запаха и различимого вкуса. Е212 имеет некоторые свойства антибиотика и может усилить цвет продукта.
Хорошо, особенно при воздействии высоких температур, растворяется в воде, а также в этаноле. Не вступает в реакцию с диэтиловым эфиром.
| Показатель | Стандартные значения |
| Цвет | белый |
| Состав | 52% углерода, 24% калия, 19% кислорода, 3% водорода |
| Внешний вид | твердый и сыпучий гигроскопичный порошок |
| Запах | отсутствует |
| Растворимость | растворимый в этиловом спирте, частично — в метиловом; растворимость в воде 65 г/100 мл при температуре 20 °C; в эфире не растворяется |
| Плотность | 1,5 г/см3 |
| Другие |
Упаковка
При продаже и транспортировке бензоат калия упаковывается в прозрачные плотные пакеты из полиэтилена по 25 килограмм каждый. Также типовой упаковкой является картонная коробка по типу барабана и бумажные плотные пакеты.
Допускается фасовка менее крупными партиями на усмотрение поставщика.
Вещество необходимо хранить в удаленных от источников света и сухих местах не более двух лет.Производители
 Самым доступным поставщиком Е212 выступает Китай. В интернете можно найти массу предложений от различных компаний, в числе которых Foodchem International Corporation или Nanjing Yeshun Industry & International Trading Co., Ltd.
Самым доступным поставщиком Е212 выступает Китай. В интернете можно найти массу предложений от различных компаний, в числе которых Foodchem International Corporation или Nanjing Yeshun Industry & International Trading Co., Ltd.
В России найти производителя сложнее. Купить бензоат калия можно у компаний, работающих под брендом GLOBAR® (например, «БАРГУС ТРЕЙД»), а также в ООО «Промхим».
Применение
Бензоат калия является отличным угнетателем плесени и бактерий и чаще всего в пищевой промышленности применяется для производства товаров с кислой средой.
E212 добавляется в качестве консерванта при изготовлении газированных и безалкогольных напитков, соков из фруктов, плодово-ягодной и рыбной продукции. Есть вещество в горчице, соусах и некоторых товарах для диетического питания, в пюре и фруктовых консервах, леденцах, маргарине, кремах в кондитерских изделиях.
Данная добавка была запрещена в СССР, но разрешена в современной России, а также в странах ЕС, Украине, США и Канаде. Однако для производителей имеется ряд ограничений.
Приложение под восьмым номером к «Требованиям безопасности пищевых добавок, ароматизаторов и технологических вспомогательных средств» также определяет, что допускается обработка поверхностей продуктов бензоатом калия при изготовлении колбас и изделий из них, сыров, вяленого мяса, оболочек, пищевых покрытий и пленок.
Также выступает добавкой в пиротехнических составах и косметических средствах.
Пищевой краситель Е172 (оксид железа) вреден только при вдыхании порошка.Промышленная овощемойка должна быть мощной и надежной. Как правильно подобрать подходящую модель, читайте в нашей статье.
Сорбиновая кислота (Е200) является одним из самых безопасных консервантов. Подробно о данном веществе читайте здесь.
Польза или вред
E212, взаимодействуя с некоторыми другими химическими веществами, проявляет канцерогенный эффект и может стать причиной развития онкологических заболеваний.
Особенно опасно сочетание E212 с аскорбиновой кислотой, которая превращает бензоат калия во вредоносный бензол. Зловредное влияние на человеческий организм добавка будет иметь и при неправильном или длительном хранении, нагревании. Ее употребление в больших количествах вызывает раздражение желудка и кишечника, различного характера аллергические проявления, может спровоцировать приступ астмы.
Зловредное влияние на человеческий организм добавка будет иметь и при неправильном или длительном хранении, нагревании. Ее употребление в больших количествах вызывает раздражение желудка и кишечника, различного характера аллергические проявления, может спровоцировать приступ астмы.
Так как пищевой консервант разрешен при производстве многих продуктов, употребляемых человеком внутрь, врачи рекомендуют самостоятельно следить и превышать допустимую дозировку. Установленный предел — до пяти миллиграммов на килограмм веса. Детям добавка противопоказана, как и животным.
vkusologia.ru
Получение бензоатов - Справочник химика 21
Эфиры 3,5-динитробензойной кислоты (ди-н и т р о б е и 3 о а т ы) и эфиры бензойной кислоты (бензоаты). В пробирке смешивают 0,5 г 3,5-динитробензоилхлорида или бензоил-хлорида (при получении бензоатов) с 1 г или 1 мл вещества. Смесь слабо нагревают на кипящей водяной бане 5 мин. Прибавляют 10 мл дистиллированной воды. Раствор охлаждают во льду, пока продукт реакции не затвердеет . Его отфильтровывают, промывают на фильтре Ю мл 2%-ного раствора соды и перекристаллизовывают из 5—10 мл [c.127]
Получение бензоата калия обработкой бензойной кислоты едким кали [c.663]Восстановление проходит количественно. Метод носит обш,ий характер и применим также для получения бензоатов сахаров в фуранозной форме. [c.134]
Методика 3. Получение бензоатов и -нитробензоатов [c.181]
Применяются и другие катализаторы, помимо указанных на схемах (5) —(26). Так, эфират трифторида бора [15] использован в качестве катализатора этерификации некоторых кислот, и в примере, представленном на схеме (27), конечный продукт образуется с высоким выходом, не претерпевая перегруппировку двойных связей. Смесь борной и серной кислот катализирует ацилирование фенолов [16] по этой методике фенилбензоат можно получить с почти количественным выходом схема (28) . Фениловые эфиры можно синтезировать также при использовании полифосфорной кислоты в качестве катализатора [17] этот метод использован для получения бензоата салициловой кислоты (И). Наряду с три-фторидом бора находят применение в качестве катализаторов этерификации и другие кислоты Льюиса, например сульфат железа и хлорид алюминия [18]. [c.293]
Для приготовления сухого бензоатного ингибитора к 20— 25-процентному раствору аммиака добавляется бензойная кислота при постепенном нагревании до прекращения растворения ее, после чего раствор охлаждается. С выделившихся кристаллов бензоата аммония раствор сливается, а кристаллы сушатся на воздухе. Полученный бензоат аммония смешивается с нитритом натрия в пропорции 66 34. [c.81]
Получение бензоата (тяга ). В пробирке растворяют 0,5 г фенола в 4—5 мл 2 н. раствора гидроксида натрия. К раствору прибавляют 0,5 мл хлористого бензоила. Пробирку закрывают пробкой со вставленной вертикально стеклянной трубкой и энергично встряхивают 3—5 мин, при этом происходит разогревание смеси. [c.209]
К основньш методам получения бензоатов относятся взаимодействие бензойной кислоты со спиртами, солей кислоты с галогеналкилами, а также алкоголиз эфиров бензойной кислоты, последний способ является бессточным. [c.114]
Определение суммы свободного эвгенола и его ацетата реакцией бензоилирования [18, 19]. Метод основан на образовании кристаллического бензоата эвгенола под действием хлористого бензоила. Количество полученного бензоата измеряется по массе [c.202]
Для отделения терпинеола от первичных и вторичных спиртов предложено превращать последние в бензоаты под действием бензоилхлорида в растворе пиридина. Терпинеол отделяют от полученных бензоатов перегонкой с паром. Содержание отдельных изомеров терпинеола определяют методом газовой хроматографии [45]. [c.242]
Получение бензоата калия [c.311]
I - реактор окисления 2 - реактор получения бензоата калия [c.97]
Получение бензоатов целлюлозы с у = 300 может быть достигнуто обработкой целлюлозы хлористым бензоилом при ПО—130° в присутствии пиридина или нитробензола, растворяющих образующийся эфир. Этерификация может быть проведена и в гетерогенной среде, получаемый при этом эфир сохраняет волокнистую структуру. [c.448]
При воздействии на сорбит хлористого водорода и соляной кислоты образуется смесь кристаллического диангидрида сорбита и его монохлоргидрина из монохлоргидрина диангидрида и из самого диангидрида получен бензоат, отвечающий диангидриду. При обработке указанной смеси едкой щелочью получается только диангидрид сорбита. [c.1650]
Методы получения бензоатов и 3,5-динитробензоатов [c.439]
Динитробензоаты и уретаны нельзя приготовить в присутствии боль-ншх количеств воды, а получение бензоатов нецелесообразно, поскольку бензоаты низших спиртов, как / ранило, жидкие. [c.455]
Этим путем из толуола через бензойную кислоту и ее соль можно получать терефталевую кислоту, однако в первоначальном варианте метод не нашел применения из-за двух главных недостатков смесь находится в твердом состоянии, что неудобно для транспортирования и других операций, и велик расход щелочи (для получения солей) и серной кислоты (для выделения свободной терефталевой кислоты), причем в виде трудноиспользуемого отхода образуется сульфат калия. В последнее время сообщается об устранении этих недостатков процесс ведут в легко транспортируемой суспензии солей в диметилтерефталате, а для получения бензоата калия и выделения свободной терефталевой кислоты используют реакцию солевого обмена [c.396]
Относительно высокий выход терефталевой кислоты можно получать при атмосферном давлении, но максимальный выход кислоты достигается в среде двуокиси углерода под повыщенным давлением. При применении соединений кадмия в качестве катализатора для получения фталатов достаточно давления СОг в пределах 3—8 ат, а для получения бензоатов на том же катализаторе требуется давление СОг 10—15 ат. При катализаторе на основе цинка (вместо кадмия) давление СОг должно быть вдвое больше. Применение вместо СО2 других инертных газов, в частности азота, приводит к уменьшению выхода терефталевой кислоты. [c.179]
Для получения бензоата моноэтаноламина бензойную кислоту растворяют в спирте, после чего небольшими порциями в нее прибавляют моиоэтаноламин. Бензоат моноэтаноламина выпадает в осадок. Поскольку реакция экзотермична, то производится охлаждение водой. Полученный бензоат моноэтаноламина растворяется в воде (в 1 л воды растворяется 60 г БМЭА). [c.80]
Получение бензоата или нафтоата калия может быть осуществлено также и путем сплавления монокарбоновых кислот с поташом или гидроокисью калия при температуре 230—250°С [2]. В этом случае для осуществления реакции (1 н >1а) исходная с.месь хорошо измельчается и перемешивается для лучшего контакта компонентов. [c.13]
Для увеличения конкурентоспосроности метода диспропорционирования проводились исследования по разработке способа регенерации ионов калия. По мнению сиециалистов некоторых стран, в частности фирмы "Мицубиси Касэй", наиболее целесообразными способами выделения ТФК из ее дикалиевой соли являются методы с использованием двуокиси серы или двуокиси углерода. Образовавшийся бисульфит или бикарбонат калия обрабатывают бензойной кислотой с получением бензоата калия, который возвращается в цикл, а 802 или СО2 направляются вновь на выделение. [c.98]
Получение бензоата холестерина-4- из Д -холестенона-3-[4-С ] по трехстадийному методу описано Хунцикером [12]. EhOvT-ацетат Л -холестенона-3-[4-С ], полученный из А -холестенона-3-[4-С 4] действием уксусного ангидрида и ацетилхлорида [4] с выходом 93%, был восстановлен до холестерина-4- борогидридом натрия в метанольно-эфирной среде и очищен хроматографированием на неактивированной окиси алюминия с использованием петролейного эфира выход 72%. В качестве побочного продукта был выделен эпихолестерин-4-С после перекристаллизации из метанола т. пл. 140—141°. Бензойный эфир был получен действием хлористого бензоила в пиридине выход 94%, т. пл. 146—148°, [а]ц — 16,5 Г (с 0,842 г в. хлороформе). [c.518]
Полученные бензоаты смешивают с 1,5 л ацетона, содержащего 5 мл концентрированной серной кислоты и 60 г безводного сульфата меди(II), встряхивают в течение 36 ч, нейтрализуют аммиаком, осадок сульфата аммония отфильтровывают и фильтрат упаривают. Сиропообразный остаток (144 г) растворяют в 200 мл сухого пиридина и повторно бен-зоилируют 60 мл (0,5 моль) хлористого бензоила. Реакционную массу выливают в воду, осадок отфильтровывают, промывают водой и перекристаллизовывают из 1,5 л метанола. Выход II 145 г (75%), т. пл. 117—119°С. После перекристаллизации из спирта II имеет т. пл. 121— 123 °С, [u]d —1,5° (с 2 в хлороформе). [c.299]
chem21.info
Бензоат калия — Википедия (с комментариями)
Ты - не раб! Закрытый образовательный курс для детей элиты: "Истинное обустройство мира". http://noslave.org
Материал из Википедии — свободной энциклопедии
Бензоат калия — химическое соединение, соль калия и бензойной кислоты с формулой KC7H5O2, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты.
Получение
<math>\mathsf{ K_2CO_3 + 2C_6H_5COOH \ \xrightarrow{100^oC}\ 2KC_7H_5O_2 + CO_2\uparrow + H_2O }</math>Физические свойства
Бензоат калия образует бесцветные кристаллы.
Хорошо растворяется в воде, растворяется в этаноле, не растворяется в диэтиловом эфире.
Образует кристаллогидрат состава KC7H5O2•3h3O, который теряет воду при 110°С.
Применение
- Пищевая добавка E212, используется для подавления плесени и роста бактерий.
- Добавка в пиротехнических составах.
Напишите отзыв о статье "Бензоат калия"
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Отрывок, характеризующий Бензоат калия
Кроме этих поименованных лиц, русских и иностранных (в особенности иностранцев, которые с смелостью, свойственной людям в деятельности среди чужой среды, каждый день предлагали новые неожиданные мысли), было еще много лиц второстепенных, находившихся при армии потому, что тут были их принципалы. В числе всех мыслей и голосов в этом огромном, беспокойном, блестящем и гордом мире князь Андрей видел следующие, более резкие, подразделения направлений и партий. Первая партия была: Пфуль и его последователи, теоретики войны, верящие в то, что есть наука войны и что в этой науке есть свои неизменные законы, законы облического движения, обхода и т. п. Пфуль и последователи его требовали отступления в глубь страны, отступления по точным законам, предписанным мнимой теорией войны, и во всяком отступлении от этой теории видели только варварство, необразованность или злонамеренность. К этой партии принадлежали немецкие принцы, Вольцоген, Винцингероде и другие, преимущественно немцы. Вторая партия была противуположная первой. Как и всегда бывает, при одной крайности были представители другой крайности. Люди этой партии были те, которые еще с Вильны требовали наступления в Польшу и свободы от всяких вперед составленных планов. Кроме того, что представители этой партии были представители смелых действий, они вместе с тем и были представителями национальности, вследствие чего становились еще одностороннее в споре. Эти были русские: Багратион, начинавший возвышаться Ермолов и другие. В это время была распространена известная шутка Ермолова, будто бы просившего государя об одной милости – производства его в немцы. Люди этой партии говорили, вспоминая Суворова, что надо не думать, не накалывать иголками карту, а драться, бить неприятеля, не впускать его в Россию и не давать унывать войску. К третьей партии, к которой более всего имел доверия государь, принадлежали придворные делатели сделок между обоими направлениями. Люди этой партии, большей частью не военные и к которой принадлежал Аракчеев, думали и говорили, что говорят обыкновенно люди, не имеющие убеждений, но желающие казаться за таковых. Они говорили, что, без сомнения, война, особенно с таким гением, как Бонапарте (его опять называли Бонапарте), требует глубокомысленнейших соображений, глубокого знания науки, и в этом деле Пфуль гениален; но вместе с тем нельзя не признать того, что теоретики часто односторонни, и потому не надо вполне доверять им, надо прислушиваться и к тому, что говорят противники Пфуля, и к тому, что говорят люди практические, опытные в военном деле, и изо всего взять среднее. Люди этой партии настояли на том, чтобы, удержав Дрисский лагерь по плану Пфуля, изменить движения других армий. Хотя этим образом действий не достигалась ни та, ни другая цель, но людям этой партии казалось так лучше. Четвертое направление было направление, которого самым видным представителем был великий князь, наследник цесаревич, не могший забыть своего аустерлицкого разочарования, где он, как на смотр, выехал перед гвардиею в каске и колете, рассчитывая молодецки раздавить французов, и, попав неожиданно в первую линию, насилу ушел в общем смятении. Люди этой партии имели в своих суждениях и качество и недостаток искренности. Они боялись Наполеона, видели в нем силу, в себе слабость и прямо высказывали это. Они говорили: «Ничего, кроме горя, срама и погибели, из всего этого не выйдет! Вот мы оставили Вильну, оставили Витебск, оставим и Дриссу. Одно, что нам остается умного сделать, это заключить мир, и как можно скорее, пока не выгнали нас из Петербурга!» Воззрение это, сильно распространенное в высших сферах армии, находило себе поддержку и в Петербурге, и в канцлере Румянцеве, по другим государственным причинам стоявшем тоже за мир. Пятые были приверженцы Барклая де Толли, не столько как человека, сколько как военного министра и главнокомандующего. Они говорили: «Какой он ни есть (всегда так начинали), но он честный, дельный человек, и лучше его нет. Дайте ему настоящую власть, потому что война не может идти успешно без единства начальствования, и он покажет то, что он может сделать, как он показал себя в Финляндии. Ежели армия наша устроена и сильна и отступила до Дриссы, не понесши никаких поражений, то мы обязаны этим только Барклаю. Ежели теперь заменят Барклая Бенигсеном, то все погибнет, потому что Бенигсен уже показал свою неспособность в 1807 году», – говорили люди этой партии. Шестые, бенигсенисты, говорили, напротив, что все таки не было никого дельнее и опытнее Бенигсена, и, как ни вертись, все таки придешь к нему. И люди этой партии доказывали, что все наше отступление до Дриссы было постыднейшее поражение и беспрерывный ряд ошибок. «Чем больше наделают ошибок, – говорили они, – тем лучше: по крайней мере, скорее поймут, что так не может идти. А нужен не какой нибудь Барклай, а человек, как Бенигсен, который показал уже себя в 1807 м году, которому отдал справедливость сам Наполеон, и такой человек, за которым бы охотно признавали власть, – и таковой есть только один Бенигсен». Седьмые – были лица, которые всегда есть, в особенности при молодых государях, и которых особенно много было при императоре Александре, – лица генералов и флигель адъютантов, страстно преданные государю не как императору, но как человека обожающие его искренно и бескорыстно, как его обожал Ростов в 1805 м году, и видящие в нем не только все добродетели, но и все качества человеческие. Эти лица хотя и восхищались скромностью государя, отказывавшегося от командования войсками, но осуждали эту излишнюю скромность и желали только одного и настаивали на том, чтобы обожаемый государь, оставив излишнее недоверие к себе, объявил открыто, что он становится во главе войска, составил бы при себе штаб квартиру главнокомандующего и, советуясь, где нужно, с опытными теоретиками и практиками, сам бы вел свои войска, которых одно это довело бы до высшего состояния воодушевления.wiki-org.ru
Бензоат калия - Справочник химика 21
Аммоний (натрий) бензоат Калий олеат Вода 0,1. .. 1 0,1. .. 1 Остальное [c.96]
Смеси солей (салицилат натрия бензоат калия и др.) [c.436]Реакция осаждения протона. К небольшому количеству (несколько капель) разбавленной НС1 добавляют 1,5%-ный раствор бензоата калия до выпадения белого осадка труднорастворимой бензойной кислоты. Эта реакция может рассматриваться также как реакция кислотно-основного взаимодействия [c.469]
По аналогичной реакции бензоат калия при нагревании с солями кадмия диспропорционирует на бензол и ион 43. Такие перегруппировки называются реакциями Хенкеля (по названию компании, владеющей патентами па этот процесс) [402]. Для этих превращений предложен механизм SeI [403]. Основным продуктом является терефталат он кристаллизуется из реакционной смеси, смещая тем самым равновесие в желаемом направлении [404]. [c.385]Может происходить также диспропорционирование. бензоата калия с образованием терефталата калия (выход около 75%). [c.176]
Диспропорционированием бензоата калия в присутствии оксида углерода(IV) может быть получена терефталевая кислота через ее дикалиевую соль [78] [c.335]
К нескольким каплям 10%-ного спиртового раствора едкого кали добавьте 1 каплю бензальдегида. При сильном встряхивании образуется осадок бензоата калия по реакции [c.132]
При нагревании безводного бензоата калия до 350—450°С под давлением углекислого газа в присутствии иодида кадмия образуется терефталат калия и бензол с выходом, близким к теоретическому [c.143]
При нагревании бензоата калия в автоклаве при 450—500 °С в присутствии иодида кадмия в атмосфере углекислого газа образуется терефталат калия. Какой еще продукт образуется Напишите механизм этой реакции. [c.318]
Получение бензоата калия обработкой бензойной кислоты едким кали [c.663]
Бензолсульфокислота 5. Бензоат калия [c.124]
КИНЕТИЧЕСКОЕ УРАВНЕНИЕ ДЛЯ РЕАКЦИИ ДИСПРОПОРЦИОНИРОВАНИЯ БЕНЗОАТА КАЛИЯ [c.70]
При проведении исследований данного процесса нами было изучено влияние температуры и времени на степень превращения бензоата калия в присутствии окиси кадмия в качестве катализатора, результаты которого показаны на рис. 1. [c.70]
В связи с тем, что выявление числа работающих центров затруднительно, кинетической обработке подвергалась только часть кривых без начального участка, так как скорость процесса на этом участке определяется не химической кинетикой, а степенью контактирования бензоата калия с активными центрами катализатора. Поэтому при данном методе обработки результатов расчетное время опыта будет равно разности между измеренным временем реакции и временем достижения предельного контактирования (х к) [c.72]
Хлк — определялось из уравнения (7), которое для двух значений степени превращения бензоата калия записывалось так [c.73]
ДИСПРОПОРЦИОНИРОВАНИЕ БЕНЗОАТА КАЛИЯ [c.169]
Этим путем из толуола через бензойную кислоту и ее соль можно получать терефталевую кислоту, однако в первоначальном варианте метод не нашел применения из-за двух главных недостатков смесь находится в твердом состоянии, что неудобно для транспортирования и других операций, и велик расход щелочи (для получения солей) и серной кислоты (для выделения свободной терефталевой кислоты), причем в виде трудноиспользуемого отхода образуется сульфат калия. В последнее время сообщается об устранении этих недостатков процесс ведут в легко транспортируемой суспензии солей в диметилтерефталате, а для получения бензоата калия и выделения свободной терефталевой кислоты используют реакцию солевого обмена [c.396]
С целью количественной оценки воздействия бензоата кали на превращение бензолкарбоксилатов были определены начальные скорости декарбоксилирования и карбоксилирования при перегруппировке смесей, соотношение бензоат бензолкарбокснлат в кото рых поддерживалось эквимолярньш [6]. [c.166]
Из таблицы видно, что для всех рассмотренных случаев (з исключением превращения орто- и изофталатов) введение в реакци онную смесь бензоата калия ускоряет перегруппировку (см. табл. статьи Термокаталитическое превращение калиевых солей бензол карбоновых кислот в настоящем сб.), а скорости декарбоксилиро вания бензолкарбоксилата и карбоксилирования бензоата калия 1 [c.166]
Пределах прогрешности опытов равны между собой. Это свидетель ствует о том, что превращение смеси бензолкарбоксилатов калия бензоатом можно рассматривать как перенос карбоксилатной груп пы от молекулы соли бензолкарбоновой кислоты к бензоату калия При этом независимый обмен группами между молекулами одног и того же вещества не имеет места. [c.168]
Методом начальных скоростей реакций изучена иерегруппировка калиевых солей бензолкарбоновых кислот в смеси с бензоатом калия. Предложена схема химизма перегруппировки, учитывающая влияние бензоата калия на реакцию. [c.190]
Большие ресурсы толуола в продуктах риформинга и его более низкая по сравнению с л-ксилолом стоимость привлекли внимание ряда специалистов в СССР и за рубежом к синтезу терефталевой кислоты диспропорционированием бензоата калия. Процесс проходит при 410—420 °С в атмосфере диоксида углерода и давлении не ниже 0,98 МПа (предпочтительнее 1,96 МПа). В качестве катализатора (3,5—4,0 мол.) используют солй кадмия, которые можно промогировать кислотами Льюиса, например, хлоридом алюминия. Продолжительность реакции 20—30 мин. Выход дикалийтерефталата достигает 90% при степени конверсии бензоата калия 87—92% [58]. Однако процесс протекает в твердой фазе, что осложняет создание реакторов большой единичной мощности. [c.72]
Современные способы производства терефталевой кислоты и диметилтерефталата основаны преимущественно на окислении и-ксилола [69, 70]. Другие потенциально возможные виды сырья для окисления — п-диэтилбензол, п-цимол, диизопропилбензол — дороги, и для их синтеза необходимы дефицитные и ценные олефины и бензол. Поэтому использование их маловероятно. Не нашел широкого применения и описанный выше метод диспропорционирования бензоата калия и подобный ему по условиям процесса метод изомеризации дикалий-о-фталата из-за высокой стоимости получаемых мономеров и сложного аппаратурного оформления процесса. п-Ксилол и до конца XX века останется единственным реальным сырьем. [c.76]
Изомеризация дикалий-о-фталата аналогична процессу диспропорционирования бензоата калия. Она вызывала определенный интерес в период, когда фталевый ангидрид считался доступным и дешевым сырьем по сравнению с л-ксилолом. Этим методом удается получить очень чистую терефталевую кислоту. Однако по причинам, указанным ранее (см. стр. 72), метод не мог конкурировать с основными технологическими процессами производства сырья для полиэфирных волокон. [c.80]
Изменить распределение ароматических углеводородов можно двумя способами. Первый — использовать менее дефицитное и более доступное сырье для получения той же продукции. Например, разработаны способы синтеза фенола из толуола [147, с. 147— 172], капролактама из толуола [148], заменены стирол винилто-луолами или винилксилолами, п-ксилол толуолом при производстве терефталевой кислоты (диспропорционирование бензоата калия). Однако в таком варианте процессов технико-экономические показатели уступали хорошо отработанным технологиям синтеза, причем существенно влияло на экономику выполнение сложного комплекса опытно-конструкторских работ. Поэтому более [c.192]
Превращение цинкохина [246] достигнуто нри действии бензоата калия на л-толуолсульфонат в спиртовом растворе. [c.372]
По окончании и охлаадеаии отфильтровывают выпавший диоксид Мп(1 на маленькой воронке Бюхнера и два раза промывают небольшим количеством горячей воды. Цри необходимости фильтрат упариваш до объема 15-20 мд. Снова отфильтровывают выпавший диоксид марганца и промывают один раз 5 мл горячей воды. Фильтрат-раствор бензоата калия - действием концентрированной хлороводородной кислоты (ее добавляют до явно кислой реакции по конго красному) переводят в свободную бензойную кислогу. [c.84]
Одним из возможных синтезов терефталевой кислоты является диспропорционирование бензоата калия по схеме [c.70]
Принимая количество образующегося дикалийтерефталата пропорциональным количеству превращенного бензоата калия, будем иметь [c.72]
При рассматриваемом дисиропорционировании начальным актом каталитической реакции является контакт порошкообразного или плавящегося бензоата калия с активными центрами катализатора. Поскольку в начале реакции имеет место неполное контактирование катализатора с реагентом, то значительная часть активных центров в процессе не примет участия. По истечении времени упомянутое контактирование улучшается и, по-видимому, наступает некоторая его предельная степень, при которой будут работать все активные центры катализатора. Результатом хода процесса подобного характера является 5 — образный вид кривых в координатах степень превращения — время опыта, показанных на рис. 1. [c.72]
При осуществлении диспропорционирования бензоата калия в дикалийтерефталат выявлена возможность применения устройства с бесконечной транспортной лентой, проходящей через зону обогрева, и найдено, что в интервале 440—460° и при давлении 10 ат углекислоты выход терефталевой кислоты достигает 86— 94,6% от теории на превращенное сырье [1]. Производительность реактора составляла 10 кг в сутки. [c.169]
Опыты показали, что при температуре в пределах 430—460 , времени реакции 10—20 мин и содержании 2% вес. катализатора (Сс10) в сырье степень превращения исходного бензоата калия достигает 82,3—94,7% вес, а выход терефталевой кислоты от теоретически возможного составляет 84—86,5% на превращенное сырье. [c.171]
chem21.info
Способ получения ароматических дикарбоновыхкислот
О П И С А Н И Е (и) 432I24
ИЗОБРЕТЕН ИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
Союз Советских
Социалистических
Республик (61) Зависимое от а вт. свидетельства (22) Заявлено 24.03.72 (21) 1763748/23-4 (51) М. Кл. С 07с 51/00
С 07с 63/14 с присоединением :ая1вки №
Государственный КоМКТВ>
Совета Ииниотров СССР па делам изобретений
Ч OTKPblTMN (32) Приоритет
Опубликовано 15.06.74. Бюллетень № 22
Дата опубликования описания 13.11.74 (53) УДК 547.584.07 (088.8) (72) Авторы изобретения В. Н. Кулаков, Н. В. Щельцына, И. М. Никифоров, Н. Н. Дрюкова, P. П. Шумилова, Е. А. Алитовская, А. Г. Артюх и Н. M. Евсюхина (71) Заявитель Всесоюзный научно-исследовательский и проектный институт мономеров (54) СПОСОБ ПОЛУЧЕНИЯ АРОМАТИЧЕСКИХ ДИКАРБОНОВЫХ
КИСЛОТ
Изобретение относится к способу получения ароматических дикарбоновых кислот, например терефталевой или 2,6-нафталиндикарбоновой, из алкилпроизводных бензольного или нафталинового ряда (толуола или Р-метилнафталина). Указанные кислоты являются исходными мономерами для производства термостойких и высокопрочных материалов и полиэфирных волокон.
Известен способ получения щелочных солей ароматических дикарбоновых кислот, заключающийся в следующем.
Исходную щелочную соль монокарбоновой кислоты приготавливают нейтрализацией бензойной кислоты едким калием или поташом в разбавленных водных растворах (-20%).
Водный раствор упаривают, бензоат калия высушивают досуха и в присутствии катализатора — окиси кадмия или иодида кадмия, нагревают до 450 С в течение 6 час. Реакционный продукт кипятят с водой и далее подкислением выделяют 40,3% терефталевой кислоты.
Однако по этому способу выход целевого продукта низкий, так как при приготовлении щелочных солей, например бензойной или р-нафтойной кислот, все примеси этих кислот, содержащиеся даже в микроколичествах, в момент упаривания раствора переходят в бензоат или нафтоат калия что сильно тормозит реакцию диспропорционирования.
Кроме того, для осуществления процесса диспропорционирования необходимо, чтобы
5 бензоат или нафтоат калия были свободные от влаги, поэтому водные растворы упаривают, а полученные соли высушивают досуха.
Эта стадия требует больших затрат тепла, так как необходимо испарить -8,4 т воды в рас10 чете на 1 т ТФК.
Целью предлагаемого способа является обеспечить повышение выхода целевого продукта, упростить процесс его получения и, кроме того, сделать процесс более экономич)5 ным. Для достижения этой цели раствор монокарбоновой кислоты в органическом растворителе, например спирте, ацетоне, обрабатывают раствором едкого кали в метиловом или этиловом спирте. Полученный при этом оса20 док щелочной соли отфильтровывают, высушивают и нагревают в присутствии катализатора с последующим выделением дикарбоновой кислоты известными приемами. Сущность предлагаемого способа заключается в том, 25 что, например бензойную или р-нафтойную кислоту, полученную окислением толуола или
2-метилнафталина воздухом в среде уксусной кислоты в присутствии ацетата кобальта бромистого натрия, растворяют без предварирО тельной очистки в органическом растворителе, 432124
3 например спирте, ацетоне и др.; полученный раствор нейтрализуют спиртовым раствором едкого кали. Образовавшийся осадок бензоата калия или нафтоата калия отфильтровывают, сушат. Органические растворители из маточника после ректификации вновь возвращают на стадию растворения монокарбоновой кислоты и едкого кали, а смесь щелочной соли с катализатором нагревают до температуры 450 С в атмосфере СО в течение одного часа. Из реакционной смеси выделяют терефталевую или 2,6-нафталиндикарбоновую кислоту с выходом соответственно 95 или 70 /,.
По предлагаемому способу снижается себестоимость, например терефталевой кислоты, так как в данном способе используется сырая, т, е. неочищенная бензойная или Р-нафтойная кислота, а в результате использования органического растворителя для приготовления щелочных солей монокарбоновых кислот исключается трудоемкая стадия выпаривания большого количества воды, требующая бо.пьших затрат тепла. Используя вместо воды органические растворители, получают щелочные соли высокой чистоты, так как примеси бензойной и р-нафтойной кислот (например, бензальдегид, дифенил, эфиры кислот, р-нафтальдегид, Р-метилнафталин и смолистые вещества) хорошо растворимы в органических растворителях, таких как этиловый или метиловый спирт, ацетон и другие. Осадок щелочных солей отфильтровывают, а в маточнике остаются примеси.
Так как чистота получаемой исходной соли (бензоата или нафтоата калия) в предлагаемом способе выше (цветность водного раствора калиевой соли 2-нафтойной кислоты, определенная на спектрофотометре СФ-4А при длине волны 450 нм составляет 3 — 9), чем в способах с упариванием водных растворов (цветность водного раствора калиевой соли
2-нафтойной кислоты, определенная в тех же условиях, составляет 30,7), поэтому достигается повышение выхода щелочной соли дикарбоновой кислоты в процессе диспропорцио,нирования.
Так, например при осуществлении диспропорционирования бензоата калия, полученноге нейтрализацией неочищенной бензойной кислоты в водной среде с последующей упаркой, выход терефталата калия не достигает
70 / . Применение бензоата калия, полученного из той же,неочищенной бензойной кислоты, но по способу с органическим растворителем, позволяет повысить выход терефталата калия до 95 /о.
Предлагаемый способ благодаря замене воды на органический растворитель дает возможность совместить три крупные стадии— очистку бензойной кислоты, получение бензоата калия и упаривание водного раствора — в одну стадию.
Пример 1. В реактор барботажного типа загружают 351,7 г толуола, 1,4 г стеарата кобальта, 0,05 г бромистого натрия. Окисление
ЗО
65 осуществляют при давлении 10 атм и температуре 180 С в течение 4 час. Расход воздуха составляет 180 кг/час. После разделения продуктов реакции получено 249,75 r непрореагировавшего толуола и 127,5 г бензойной кислоты, содержащей (): основного вещества
98,7, бензальдегида 0,6, дифенила 0,2, эфиров 0,1.
Бензойную кислоту растворяют в 238 мл
96 / -ного этилового спирта при 50 С. Раствор бензойной кислоты приливают к раствору 6,8 г
КОН (85/ ) в 240 мл 96/ -ного этилового спирта. Выпавший осадок бензоата калия отфильтровывают, затем высушивают. 155,5 г бензоата калия перемешивают с 4,8 г С10 и таблетируют (диаметр и высота таблеток
5 мм). 155 г таблетированной смеси нагревают в реакторе диспропорционирования при
440 †4 С в течение одного часа под давлением углекислого газа 10 атм. Получают
130 г продуктов диспропорционирования с содержанием терефталата калия 83 /ц. Выход терефталата калия, считая на загруженный бензоат калия составляет 95 / от теоретического.
Суммарный выход терефталата калия, считая на превращенный толуол, составляет
80 2о/о
Пример 2. В процессе окисления получают бензойную кислоту, содержащую (/в): основного вещества 95,3, бензальдегида 2,8, дифенила 0,5, смолообразных продуктов 1,2.
130 r бензойной кислоты указанного со тава растворяют при перемешивании и 40 С в
250 мл ацетона.
В полученный раствор загружают 4 r активированного угля марки КАД. После перемешивания в течение 20 мин активированный уголь отфильтровывают. Раствор бензойной кислоты в ацетоне приливают к раствору
68,5 г КОН (содержание основного вещества
85 / ) в 255 мл этилового спирта. Смесь перемешивают в течение 40 мин. Осадок бензоата калия отфильтровывают, сушат до постоянного веса при 120 С. 148,0 г бензоата калия тщательно перемешивают с 4,6 г окиси кадмия и после таблетирования нагревают в реакторе диспропорционирования в течение
1 часа при 450 С и давлении 10 атм. Получено 131 r продуктов диспропорционирования с содержанием терефталата калия 80,5 / . Выход терефталата калия составляет 94,2 / от теоретического.
Пример 3. 74,5 г 2-нафтойной кислоты, полученной окислением 2-метилнафталина кислородом воздуха в среде 98 / -ной уксусной кислоты в присутствии ацетата кобальта и бромистого натрия при 120 — 125 С и давлении
20 атм, с содержанием основного вещества
98,4 /ю, растворяют при перемешивании в
685 мл этилового спирта при 40 — 50 С. К раствору добавляют 20 г активированного угля марки «КАД вЂ” молотый».
После 20-минутного размешивания уголь отфильтровывают, а спиртовый раствор 2-наф432124
Составитель Т. Лавриненко
Техред Л. Акимова
Редактор Л. Емельянова
Корректор 3. Тарасова
Заказ 2914, 4 Изд. № Г75б Тираж 505 Подписан
ЦНИИПИ Государственного комитета Совета Министров СССР по делам изобретений и открытий
Москва, K-35, Раушская наб., д. 4/5
Типография, пр. Сапунова, 2
5 тойной кислоты приливают при размешивании к раствору 27,5 г 85%-ной КОН в 80 мл этилового спирта. Образовавшийся осадок калиевой соли 2-нафтойной кислоты отфильтровывают и высушивают при 120 С.
Полученную калиевую соль 2-нафтойной кислоты в количестве 74,7 г смешивают с 3,9 г катализатора CdJq, смесь таблетируют и помещают в реактор диспропорционирования. В реакторе смесь выдерживают в течение 1 часа при 450 С и давлении СОз 40 атм. По окончании реакции из реактора выгружают 55,7 г продуктов диспропорционирования с содержанием 64,5% дикалиевой соли 2,6-нафталиндикарбоновой кислоты, что соответствует выходу 70 5%.
П р и м ер 4. 35 г р-нафтойной кислоты, полученной как в предыдущем опыте окислением 2-метилнафталина с содержанием основного вещества 98,33%, растворяют в 344 г ацетона при 25 — 30 С. Ацетоновый раствор
2-нафтойной кислоты осветляют активированным углем и добавляют к раствору 12,9 г
85%-ной КОН в 30 г этилового спирта. Образовавшийся осадок калиевой соли 2-нафтойной кислоты отфильтровывают, промываю!
30 мл ацетона и сушат. Получают 39,8 г калиевой соли 2-нафтойной кислоты, которую смешивают с 2,1 r катализатора CdJ и подвергают диспропорционированию при 400—
450 С под давлением СО 20 — 40 атм в течение 1 часа. По окончании реакции получа!От
27,65 r продуктов диспропорционирования с содержанием 66,8% дикалиевой соли 2,6нафталиндикарбоновой кислоты, что соответствует выходу 2,6-нафталиндикарбоновой кис5 лоты, считая на загруженную калиевую соль
2-нафтойной кислоты, 67%.
Предмет изобретения
1. Способ получения ароматических дикар10 боновых кислот, например терефталевой, 2.6нафталиндикарбоновой, путем нейтрализации ароматической монокарбоновой кислоты, получаемой окислением алкилзамещенного арсматического углеводорода, водным раствором
15 едкого кали или поташа с последующим упариванием полученного при этом раствора калиевой соли ароматической монокарбоновой кислоты, сушки, нагревания ее в присутствии катализатора и выделением целевого продук20 та известными приемами. о тл и ч а ющийс я тем, что, с целью повышения выхода продукта и у.".рошения процесса, ароматическую»о:,окзрбоновую кислоту берут в виде расгворз в Органическом растворителе, а нейгрализа25 ци!О ведут спиртовы» раствором едкого кали или пот ша с последующей фильтраци . "! о-здк2 кя,!!!ево!! соли ароматической монокзрооновой кислоты.
2. Способ по и. 1. отличающийся тем, Ч0 что з качестве органического растворителя используют метиловый спирт, этиловый спирт. ацетон.
www.findpatent.ru
Консервант Е212 (Бензоат калия) » Пищевые добавки
Название: Бензоат калия, Е212Другие названия: Е212, Е-212, Анг: E212, E-212, Potassium benzoateГруппа: Пищевая добавкаВид: КонсервантыВлияние на организм: ракообразующийРазрешена в странах: Россия, Украина, ЕС
Характеристика:Калийная соль бензойной кислоты по физическим свойствам - это твердый гигроскопичный порошок белого цвета, без запаха, растворимый в этиловом спирте, слегка - в метиловом. Растворимость в воде 65 г/100 мл при температуре 20 °C. В эфире не растворяется. Плотность бензоата калия составляет 1,5 г/см3 . Его температура плавления превышает 300 °C. Самовозгорается при температуре свыше 950 °C.Синтетическое вещество, образуется в результате реакции бензойной кислоты с едким кали или карбонатом калия. Другими способами его получения являются окисление толуола и реакция между метилбензоатом и теоацетатом калия.Может содержать примеси: свободную бензойную кислоту, карбонаты, пероксибензоаты. Обладает свойством ингибировать рост плесени, дрожжей и некоторых бактерий. Лучше всего проявляет свои свойства в средах с низким значением pH, ниже 4,5, где он существует в виде бензойной кислоты.
Применение:В отличие от бензойной кислоты и ее натриевой соли, E-212 используется довольно редко.Продукты и напитки с кислой реакцией среды, такие как фруктовые соки (с лимонной кислотой), газированные напитки (с угольной кислотой), безалкогольные напитки (с фосфорной кислотой), маринованные огурцы (с уксусом) могут консервироваться бензоатом калия.Используется при продления срока годности низкокалорийных джемов, засахаренной вишни, косметических средств.Механизм консервирования продукта начинается с проникновения бензойной кислоты в клетку. Если значение кислотности внутриклеточного пространства менее или равно 5 pH, интенсивность анаэробного брожения глюкозы, проходящего под действием фермента фосфофрутокиназы, снижается на 95 %.Одобрен для применения в большинстве стран, включая Канаду, США, страны еврозоны. В Европе E212 не рекомендован для потребления детьми.
Влияние на организм человека:В комбинации с аскорбиновой кислотой , бензоаты натрия и калия могут принимать форму бензола, известного своими канцерогенными свойствами. Нагревание, свет и длительное хранение влияют на уровень формирования бензола.Бензоат калия усваивается в желудочно-кишечном тракте, выводится через почки. На животных оказывает токсичное действие даже в малых количествах.Допустимое суточное потребление 5 мг/кг веса тела в день. E-212 является ракообразующей (канцерогенный эффект) пищевой добавкой. Провоцирует аллергические реакции, астму, крапивницу, раздражение желудка, нарушение поведения.Детям, особенно в возрасте до 12 месяцев, не рекомендуется употреблять его в пищу, т. к. он провоцирует повышенную возбудимость и оказывает влияние на эмоциональное и интеллектуальное развитие.
am-am.su