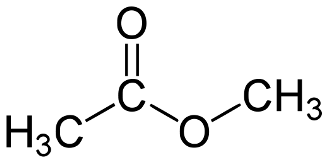
Метиловый эфир уксусной кислоты. Уксусно метиловый эфир
Формула Метилацетат структурная химическая
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: C3H6O2
Химический состав Метилацетата
| C | Углерод | 12,011 | 3 | 48,6% |
| H | Водород | 1,008 | 6 | 8,2% |
| O | Кислород | 15,999 | 2 | 43,2% |
Молекулярная масса: 74,079
Метилацетат (метиловый эфир уксусной кислоты, метиловый эфир этановой кислоты, уксуснометиловый эфир, MeOAc) Ch4COOCh4 — органическое вещество класса сложных эфиров. Встречается в природе, большей частью в эфирных маслах растений (например, до 8,9 % в различных видах мяты, до 28,2 % в лабазнике, до 44 % в жасмине), и в пищевых продуктах (например, в коньяках многолетней выдержки).
Физические свойства
Бесцветная прозрачная жидкость с фруктовым запахом. Хорошо смешивается с органическими растворителями. По растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель. Смешивается в любых соотношениях с этанолом и этиловым эфиром, хорошо растворим в ацетоне и хлороформе, растворим в бензоле. Некоторые свойства отличаются по разным источникам: плотность 0,9330 и 0,9244г/см3; показатель преломления 1,3619 и 1,3593; динамическая вязкость 0,362 и 0,381. Растворимость в воде 31,9 %, образует с водой азеотропную смесь (температура кипения 56,4 °C, 96,7 % метилацетата). Образует азеотропные смеси с метанолом (температура кипения 54 °C, 81 % метилацетата) и ацетоном (температура кипения 56,1 °C, 45 % метилацетата). Образует аддукты: метилацетат•SbCl5, метилацетат•HSbCl6 и метилацетат•BF3, плавящиеся, соответственно, при 87-88, 81-82 и 65,5 °С. Взрывоопасные концентрации в смеси с воздухом 3,15 — 15,60 %.
Химические свойства
По химическим свойствам метилацетат представляет собой типичный сложный эфир алифатической монокарбоновой кислоты. Легко гидролизуется (омыляется) на исходные спирт и кислоту водой (обратимо) или щелочами (необратимо, так как образующаяся карбоновая кислота превращается в соль): Ch4COOCh4 + h3O → Ch4COOH + Ch4OH Восстановление метилацетата приводит к образованию двух спиртов: Ch4COOCh4 + 2h3 → Ch4Ch3OH + Ch4OH Под действием аммиака метилацетат превращается в ацетамид и спирт: Ch4COOCh4 + Nh4 → Ch4CONh3 + Ch4OH
Получение
Метилацетат получают этерификацией уксусной кислоты метанолом в жидкой фазе в присутствии серной кислоты (или при пропускании смеси паров указанных жидкостей над нагретыми катализаторами: FeCl3, AlCl3): Ch4COOH + Ch4OH → Ch4COOCh4 + h3O а также из уксусного ангидрида и метанола (реакция протекает в жидкой фазе в отсутствии катализатора и является практически необратимой): (Ch4CO)2O + Ch4OH → Ch4COOCh4 + Ch4COOH Кроме синтетических методов, также производится пиролизом древесины.
Применение
Метилацетат применяют, в основном, в качестве растворителя в производстве лакокрасочных материалов и как компонент многих промышленных и бытовых растворителей. Является составной частью (7-75 %) лесохимических растворителей. Используется при производстве клеев, композиционных лаков, шпатлевок, магнитных лент, автокосметики, эфиров целлюлозы, поливинилацетата, полиметилметакрилата, растительных и животных жиров, многих синтетических смол. Применяется как экстрагент в аналитической химии, в том числе для отделения LiCl от хлоридов других щелочных металлов. Метилацетат является ценным компонентом для промышленного синтеза, в том числе — из него карбонилированием получают уксусный ангидрид (процесс Реппеruen): Ch4CO2Ch4 + CO → (Ch4CO)2O Используется в пищевой промышленности в качестве ароматизатора и экстрактивного растворителя в процессе декофеинизирования чая и кофе. В качестве ароматизатора и растворителя также входит в состав ряда косметических средств.
Токсичность
Слабо раздражает слизистые оболочки глаз и дыхательных путей (при концентрации 15 мг/л химически чистого метилацетата для ощущения раздражения требуется 5-минутная экспозиция). В высоких концентрациях оказывает лёгкое наркотическое воздействие, — в основном, за счёт действия самого сложного эфира, и, в меньшей степени, — за счёт образующегося из него спирта. При пероральном введении ЛД50 = 2,9 г/кг (белые крысы), 2,4 г/кг (мыши и кролики), 3,6 г/кг (морские свинки). ПДК в воздухе рабочих зон 100 мг/м³. ПДК в атмосферном воздухе населенных мест 0,07 мг/м³.
keywords формула, Метилацетата, структурная, химическая, брутто, химия Description Формула Метилацетат химическая структурная, брутто. Формулы химических элементов и веществ. Сайт о Формулах. Формулы по математике. Формулы по физике.formula-info.ru
Уксуснометиловый эфир Википедия
| Метилацетат | |
 | |
 | |
| метиловый эфир этановой кислоты | |
| MeOAc | |
| метиловый эфир уксусной кислоты,уксуснометиловый эфир | |
| C3H6O2 | |
| Ch4COOCh4 | |
| жидкость | |
| 74.08 г/моль | |
| 0.9330 г/см³ | |
| 0.362 Па·с | |
| 10,27±0,01 эВ[1] | |
| 0,52 Ом·м | |
| -98.1 °C | |
| 57.1 °C | |
| -9.4 °C | |
| -10 °C | |
| 470 °C | |
| 3,15 — 15,60 % | |
| 233.70 | |
| 156.19 Дж/(моль·К) | |
| 0,2224 атм | |
| 31,9 г/100 мл | |
| 1.3619 | |
| 1.72±0.09 Д | |
| 79-20-9 | |
| 6584 | |
| 201-185-2 | |
| 607-021-00-X | |
| AI9100000 | |
| 77700 | |
| 1231 | |
| 6335 | |
| 100 мг/м³ | |
| низкая | |
| R11, R36, R66, R67 | |
| S16, S26, S29, S33 | |
  | |
 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Метилацета́т (метиловый эфир уксусной кислоты, метиловый эфир этановой кислоты, уксуснометиловый эфир, MeOAc) Ch4COOCh4 — органическое вещество класса сложных эфиров.
Встречается в природе, большей частью в эфирных маслах растений (например, до 8,9 % в различных видах мяты[2][3], до 28,2 % в лабазнике[4], до 44 % в жасмине[5]), и в пищевых продуктах (например, в коньяках многолетней выдержки[6]).
Физические свойства
Бесцветная прозрачная жидкость с фруктовым запахом[7].
Хорошо смешивается с органическими растворителями[7]. По растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель. Смешивается в любых соотношениях с этанолом и этиловым эфиром, хорошо растворим в ацетоне и хлороформе, растворим в бензоле[8].
Некоторые свойства отличаются по разным источникам: плотность 0,9330[7] и 0,9244[8][9]г/см3; показатель преломления 1,3619[7] и 1,3593[8]; динамическая вязкость 0,362[7] и 0,381[8].
Растворимость в воде 31,9 %[8], образует с водой азеотропную смесь (температура кипения 56,4 °C, 96,7 % метилацетата)[7]. Образует азеотропные смеси с метанолом (температура кипения 54 °C, 81 % метилацетата) и ацетоном (температура кипения 56,1 °C, 45 % метилацетата)[10].
Образует аддукты: метилацетат•SbCl5, метилацетат•HSbCl6 и метилацетат•BF3, плавящиеся, соответственно, при 87-88, 81-82 и 65,5 °С.
Взрывоопасные концентрации в смеси с воздухом 3,15 — 15,60 %[9].
Химические свойства
По химическим свойствам метилацетат представляет собой типичный сложный эфир алифатической монокарбоновой кислоты.
Легко гидролизуется (омыляется) на исходные спирт и кислоту водой (обратимо) или щелочами (необратимо, так как образующаяся карбоновая кислота превращается в соль)[11][12]:
Ch4COOCh4+h3O → Ch4COOH+Ch4OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+H_{2}O\ \rightarrow \ CH_{3}COOH+CH_{3}OH} }Восстановление метилацетата приводит к образованию двух спиртов[13] (этанол и метанол):
Ch4COOCh4+2h3 → Ch4Ch3OH+Ch4OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+2H_{2}\ \rightarrow \ CH_{3}CH_{2}OH+CH_{3}OH} }Под действием аммиака метилацетат превращается в ацетамид и метанол[14]:
Ch4COOCh4+Nh4 → Ch4CONh3+Ch4OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+NH_{3}\ \rightarrow \ CH_{3}CONH_{2}+CH_{3}OH} }Получение
Метилацетат получают:
Ch4COOH+Ch4OH → Ch4COOCh4+h3O{\displaystyle \mathrm {CH_{3}COOH+CH_{3}OH\ \rightarrow \ CH_{3}COOCH_{3}+H_{2}O} }- из уксусного ангидрида и метанола[7] (реакция протекает в жидкой фазе в отсутствии катализатора и является практически необратимой[15]):
Применение
Метилацетат применяют, в основном, в качестве растворителя в производстве лакокрасочных материалов и как компонент многих промышленных и бытовых растворителей. Является составной частью (7-75 %) лесохимических растворителей[16][9].
Используется при производстве клеев, композиционных лаков, шпатлевок, магнитных лент, автокосметики, эфиров целлюлозы, поливинилацетата, полиметилметакрилата, растительных и животных жиров, многих синтетических смол[16][9].
Применяется как экстрагент в аналитической химии, в том числе для отделения LiCl от хлоридов других щелочных металлов[17].
Метилацетат является ценным компонентом для промышленного синтеза, в том числе — из него карбонилированием получают уксусный ангидрид (процесс Реппеruen)[18][19]:
Ch4CO2Ch4+CO→(Ch4CO)2O{\displaystyle {\rm {CH_{3}CO_{2}CH_{3}+CO\rightarrow (CH_{3}CO)_{2}O}}}Используется в пищевой промышленности в качестве ароматизатора[17][20] и экстрактивного растворителя в процессе декофеинизирования чая и кофе[21]. В качестве ароматизатора и растворителя также входит в состав ряда косметических средств.
Токсичность
Слабо раздражает слизистые оболочки глаз и дыхательных путей (при концентрации 15 мг/л химически чистого метилацетата для ощущения раздражения требуется 5-минутная экспозиция). В высоких концентрациях оказывает лёгкое наркотическое воздействие, — в основном, за счёт действия самого сложного эфира, и, в меньшей степени, — за счёт образующегося из него спирта[9].
При пероральном введении ЛД50 = 2,9 г/кг (белые крысы), 2,4 г/кг (мыши и кролики), 3,6 г/кг (морские свинки)[9].
ПДК в воздухе рабочих зон 100 мг/м³[9][22]. ПДК в атмосферном воздухе населенных мест 0,07 мг/м³[23].
Примечания
- ↑ http://www.cdc.gov/niosh/npg/npgd0391.html
- ↑ Мяделец М. А., Домрачев Д. В., Черемушкина В. А. Исследование химического состава эфирных масел некоторых видов семейства Lamiaceae L., стр. 113. Проверено 28 февраля 2016.
- ↑ Изучение минерального состава лекарственного растительного сырья, содержащего эфирные масла. Проверено 28 февраля 2016.
- ↑ Зыкова И. Д., Ефремов А. А. Компонентный состав эфирного масла из надземной части лабазника вязолистного. Проверено 28 февраля 2016.
- ↑ Горяев М. И. Эфирные масла флоры СССР, стр. 223. Проверено 28 февраля 2016.
- ↑ Урсул О. Н., Алексанян К. А., Ткачук Л. А. Сырьевые и технологические факторы выдержки коньячных спиртов. журнал «Пищевая промышленность: наука и технологии», Минск, ISSN 2073-4794 (№ 1(15) 2012 года). Проверено 28 февраля 2016.
- ↑ 1 2 3 4 5 6 7 8 9 Химическая энциклопедия, том 3, 1992, с. 107.
- ↑ 1 2 3 4 5 Краткий химический справочник, 1977, с. 186.
- ↑ 1 2 3 4 5 6 7 8 Вредные вещества в промышленности. том 2, 1976, с. 155.
- ↑ Козлов П.В., Герц И.Б. Химия и технология полимерных плёнок, стр. 269. М., "Искусство" (1965). Проверено 28 февраля 2016.
- ↑ «Кинетика щелочного гидролиза метилацетата, бутилацетата и изобутилацетата в растворах вода-ацетонитрил» / М. Ю. Панов, О. Б. Соколова // Журнал физической химии . — 15/07/1997 . — Т. 71, N 7 . — 1199—1203
- ↑ Менделеев Д. И., Монастырский Д. Н. Эфиры сложные // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ Павлов Б.А., Терентьев А.П. Курс органической химии, стр. 256. М., "Химия" (1965). Проверено 28 февраля 2016.
- ↑ Theodore A. Koch, John G. Miller, Allan R. Day. AEffect of Structure on Reactivity. VI. Catalysis in the Ammonolysis and Hydrolysis of Methyl Acetate // Journal of the American Chemical Society (J AM CHEM SOC). — February 1953. — DOI:10.1021/ja01100a054.
- ↑ Получение метилацетата этерификацией уксусного ангидрида метанолом. Проверено 28 февраля 2016.
- ↑ 1 2 Химическая энциклопедия, том 3, 1992, с. 107-108.
- ↑ 1 2 Химическая энциклопедия, том 3, 1992, с. 108.
- ↑ Ullmann, 2000, p. 244.
- ↑ Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. (1992). «Eastman Chemical Company Acetic Anhydride Process». Catalysis Today 13: 73–91. DOI:10.1016/0920-5861(92)80188-S.
- ↑ Санитарно-эпидемиологические правила и нормативы СанПиН 2.3.2.1293-03 «Гигиенические требования по применению пищевых добавок». Приложение 6, № 861. Москва (15.06.2003 с изменениями от 26.05.2008). Проверено 28 февраля 2016.
- ↑ Курс лекций по товароведению вкусовых товаров (ЭУМК). БГУ. Проверено 28 февраля 2016.
- ↑ Санитарные нормы проектирования промышленных предприятий (СН245-71). Приложение 4. Издание официальное. Москва, Стройиздат, 1972
- ↑ Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест. Проверено 28 февраля 2016.
Источники
- Редкол.: Кнунянц И. Л. и др. Химическая энциклопедия, том 3. — М.: Советская энциклопедия, 1992. — 639 с. — ISBN 5-85270-039-8.
- Kirk-Othmer Encyclopedia, 3 td., v. 4, N.Y., 1978, p. 142—143
- Held H., Rengst A., Mayer D. Acetic Anhydride and Mixed Fatty Acid Anhydrides // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2000. — DOI:10.1002/14356007.a01_065.
- Лазарев Н. В.. Вредные вещества в промышленности. том 2. — Л.: Химия, 1976. — 624 с.
- Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л.: Химия, 1977. — 376 с.
- «NIOSH Pocket Guide to Chemical Hazards. Methyl acetate» (англ.). Национальный институт охраны труда (NIOSH). Проверено 28 февраля 2016.
- Метилацетат. Паспорт безопасности. Проверено 28 февраля 2016.
wikiredia.ru
Метиловый эфир уксусной кислоты Википедия
| Метилацетат | |
 | |
 | |
| метиловый эфир этановой кислоты | |
| MeOAc | |
| метиловый эфир уксусной кислоты,уксуснометиловый эфир | |
| C3H6O2 | |
| Ch4COOCh4 | |
| жидкость | |
| 74.08 г/моль | |
| 0.9330 г/см³ | |
| 0.362 Па·с | |
| 10,27±0,01 эВ[1] | |
| 0,52 Ом·м | |
| -98.1 °C | |
| 57.1 °C | |
| -9.4 °C | |
| -10 °C | |
| 470 °C | |
| 3,15 — 15,60 % | |
| 233.70 | |
| 156.19 Дж/(моль·К) | |
| 0,2224 атм | |
| 31,9 г/100 мл | |
| 1.3619 | |
| 1.72±0.09 Д | |
| 79-20-9 | |
| 6584 | |
| 201-185-2 | |
| 607-021-00-X | |
| AI9100000 | |
| 77700 | |
| 1231 | |
| 6335 | |
| 100 мг/м³ | |
| низкая | |
| R11, R36, R66, R67 | |
| S16, S26, S29, S33 | |
  | |
 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Метилацета́т (метиловый эфир уксусной кислоты, метиловый эфир этановой кислоты, уксуснометиловый эфир, MeOAc) Ch4COOCh4 — органическое вещество класса сложных эфиров.
Встречается в природе, большей частью в эфирных маслах растений (например, до 8,9 % в различных видах мяты[2][3], до 28,2 % в лабазнике[4], до 44 % в жасмине[5]), и в пищевых продуктах (например, в коньяках многолетней выдержки[6]).
Физические свойства
Бесцветная прозрачная жидкость с фруктовым запахом[7].
Хорошо смешивается с органическими растворителями[7]. По растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель. Смешивается в любых соотношениях с этанолом и этиловым эфиром, хорошо растворим в ацетоне и хлороформе, растворим в бензоле[8].
Некоторые свойства отличаются по разным источникам: плотность 0,9330[7] и 0,9244[8][9]г/см3; показатель преломления 1,3619[7] и 1,3593[8]; динамическая вязкость 0,362[7] и 0,381[8].
Растворимость в воде 31,9 %[8], образует с водой азеотропную смесь (температура кипения 56,4 °C, 96,7 % метилацетата)[7]. Образует азеотропные смеси с метанолом (температура кипения 54 °C, 81 % метилацетата) и ацетоном (температура кипения 56,1 °C, 45 % метилацетата)[10].
Образует аддукты: метилацетат•SbCl5, метилацетат•HSbCl6 и метилацетат•BF3, плавящиеся, соответственно, при 87-88, 81-82 и 65,5 °С.
Взрывоопасные концентрации в смеси с воздухом 3,15 — 15,60 %[9].
Химические свойства
По химическим свойствам метилацетат представляет собой типичный сложный эфир алифатической монокарбоновой кислоты.
Легко гидролизуется (омыляется) на исходные спирт и кислоту водой (обратимо) или щелочами (необратимо, так как образующаяся карбоновая кислота превращается в соль)[11][12]:
Ch4COOCh4+h3O → Ch4COOH+Ch4OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+H_{2}O\ \rightarrow \ CH_{3}COOH+CH_{3}OH} }Восстановление метилацетата приводит к образованию двух спиртов[13] (этанол и метанол):
Ch4COOCh4+2h3 → Ch4Ch3OH+Ch4OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+2H_{2}\ \rightarrow \ CH_{3}CH_{2}OH+CH_{3}OH} }Под действием аммиака метилацетат превращается в ацетамид и метанол[14]:
Ch4COOCh4+Nh4 → Ch4CONh3+Ch4OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+NH_{3}\ \rightarrow \ CH_{3}CONH_{2}+CH_{3}OH} }Получение
Метилацетат получают:
Ch4COOH+Ch4OH → Ch4COOCh4+h3O{\displaystyle \mathrm {CH_{3}COOH+CH_{3}OH\ \rightarrow \ CH_{3}COOCH_{3}+H_{2}O} }- из уксусного ангидрида и метанола[7] (реакция протекает в жидкой фазе в отсутствии катализатора и является практически необратимой[15]):
Применение
Метилацетат применяют, в основном, в качестве растворителя в производстве лакокрасочных материалов и как компонент многих промышленных и бытовых растворителей. Является составной частью (7-75 %) лесохимических растворителей[16][9].
Используется при производстве клеев, композиционных лаков, шпатлевок, магнитных лент, автокосметики, эфиров целлюлозы, поливинилацетата, полиметилметакрилата, растительных и животных жиров, многих синтетических смол[16][9].
Применяется как экстрагент в аналитической химии, в том числе для отделения LiCl от хлоридов других щелочных металлов[17].
Метилацетат является ценным компонентом для промышленного синтеза, в том числе — из него карбонилированием получают уксусный ангидрид (процесс Реппеruen)[18][19]:
Ch4CO2Ch4+CO→(Ch4CO)2O{\displaystyle {\rm {CH_{3}CO_{2}CH_{3}+CO\rightarrow (CH_{3}CO)_{2}O}}}Используется в пищевой промышленности в качестве ароматизатора[17][20] и экстрактивного растворителя в процессе декофеинизирования чая и кофе[21]. В качестве ароматизатора и растворителя также входит в состав ряда косметических средств.
Токсичность
Слабо раздражает слизистые оболочки глаз и дыхательных путей (при концентрации 15 мг/л химически чистого метилацетата для ощущения раздражения требуется 5-минутная экспозиция). В высоких концентрациях оказывает лёгкое наркотическое воздействие, — в основном, за счёт действия самого сложного эфира, и, в меньшей степени, — за счёт образующегося из него спирта[9].
При пероральном введении ЛД50 = 2,9 г/кг (белые крысы), 2,4 г/кг (мыши и кролики), 3,6 г/кг (морские свинки)[9].
ПДК в воздухе рабочих зон 100 мг/м³[9][22]. ПДК в атмосферном воздухе населенных мест 0,07 мг/м³[23].
Примечания
- ↑ http://www.cdc.gov/niosh/npg/npgd0391.html
- ↑ Мяделец М. А., Домрачев Д. В., Черемушкина В. А. Исследование химического состава эфирных масел некоторых видов семейства Lamiaceae L., стр. 113. Проверено 28 февраля 2016.
- ↑ Изучение минерального состава лекарственного растительного сырья, содержащего эфирные масла. Проверено 28 февраля 2016.
- ↑ Зыкова И. Д., Ефремов А. А. Компонентный состав эфирного масла из надземной части лабазника вязолистного. Проверено 28 февраля 2016.
- ↑ Горяев М. И. Эфирные масла флоры СССР, стр. 223. Проверено 28 февраля 2016.
- ↑ Урсул О. Н., Алексанян К. А., Ткачук Л. А. Сырьевые и технологические факторы выдержки коньячных спиртов. журнал «Пищевая промышленность: наука и технологии», Минск, ISSN 2073-4794 (№ 1(15) 2012 года). Проверено 28 февраля 2016.
- ↑ 1 2 3 4 5 6 7 8 9 Химическая энциклопедия, том 3, 1992, с. 107.
- ↑ 1 2 3 4 5 Краткий химический справочник, 1977, с. 186.
- ↑ 1 2 3 4 5 6 7 8 Вредные вещества в промышленности. том 2, 1976, с. 155.
- ↑ Козлов П.В., Герц И.Б. Химия и технология полимерных плёнок, стр. 269. М., "Искусство" (1965). Проверено 28 февраля 2016.
- ↑ «Кинетика щелочного гидролиза метилацетата, бутилацетата и изобутилацетата в растворах вода-ацетонитрил» / М. Ю. Панов, О. Б. Соколова // Журнал физической химии . — 15/07/1997 . — Т. 71, N 7 . — 1199—1203
- ↑ Менделеев Д. И., Монастырский Д. Н. Эфиры сложные // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ Павлов Б.А., Терентьев А.П. Курс органической химии, стр. 256. М., "Химия" (1965). Проверено 28 февраля 2016.
- ↑ Theodore A. Koch, John G. Miller, Allan R. Day. AEffect of Structure on Reactivity. VI. Catalysis in the Ammonolysis and Hydrolysis of Methyl Acetate // Journal of the American Chemical Society (J AM CHEM SOC). — February 1953. — DOI:10.1021/ja01100a054.
- ↑ Получение метилацетата этерификацией уксусного ангидрида метанолом. Проверено 28 февраля 2016.
- ↑ 1 2 Химическая энциклопедия, том 3, 1992, с. 107-108.
- ↑ 1 2 Химическая энциклопедия, том 3, 1992, с. 108.
- ↑ Ullmann, 2000, p. 244.
- ↑ Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. (1992). «Eastman Chemical Company Acetic Anhydride Process». Catalysis Today 13: 73–91. DOI:10.1016/0920-5861(92)80188-S.
- ↑ Санитарно-эпидемиологические правила и нормативы СанПиН 2.3.2.1293-03 «Гигиенические требования по применению пищевых добавок». Приложение 6, № 861. Москва (15.06.2003 с изменениями от 26.05.2008). Проверено 28 февраля 2016.
- ↑ Курс лекций по товароведению вкусовых товаров (ЭУМК). БГУ. Проверено 28 февраля 2016.
- ↑ Санитарные нормы проектирования промышленных предприятий (СН245-71). Приложение 4. Издание официальное. Москва, Стройиздат, 1972
- ↑ Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест. Проверено 28 февраля 2016.
Источники
- Редкол.: Кнунянц И. Л. и др. Химическая энциклопедия, том 3. — М.: Советская энциклопедия, 1992. — 639 с. — ISBN 5-85270-039-8.
- Kirk-Othmer Encyclopedia, 3 td., v. 4, N.Y., 1978, p. 142—143
- Held H., Rengst A., Mayer D. Acetic Anhydride and Mixed Fatty Acid Anhydrides // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2000. — DOI:10.1002/14356007.a01_065.
- Лазарев Н. В.. Вредные вещества в промышленности. том 2. — Л.: Химия, 1976. — 624 с.
- Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л.: Химия, 1977. — 376 с.
- «NIOSH Pocket Guide to Chemical Hazards. Methyl acetate» (англ.). Национальный институт охраны труда (NIOSH). Проверено 28 февраля 2016.
- Метилацетат. Паспорт безопасности. Проверено 28 февраля 2016.
wikiredia.ru
Метилацетат — WiKi
Метилацета́т (метиловый эфир уксусной кислоты, метиловый эфир этановой кислоты, уксуснометиловый эфир, MeOAc) Ch4COOCh4 — органическое вещество класса сложных эфиров.
| Метилацетат | |
 | |
 | |
| метиловый эфир этановой кислоты | |
| MeOAc | |
| метиловый эфир уксусной кислоты,уксуснометиловый эфир | |
| C3H6O2 | |
| Ch4COOCh4 | |
| жидкость | |
| 74.08 г/моль | |
| 0.9330 г/см³ | |
| 0.362 Па·с | |
| 10,27±0,01 эВ[1] | |
| 0,52 Ом·м | |
| -98.1 °C | |
| 57.1 °C | |
| -9.4 °C | |
| -10 °C | |
| 470 °C | |
| 3,15 — 15,60 % | |
| 233.70 | |
| 156.19 Дж/(моль·К) | |
| 0,2224 атм | |
| 31,9 г/100 мл | |
| 1.3619 | |
| 1.72±0.09 Д | |
| 79-20-9 | |
| 6584 | |
| 201-185-2 | |
| 607-021-00-X | |
| AI9100000 | |
| 77700 | |
| 1231 | |
| 6335 | |
| 100 мг/м³ | |
| низкая | |
| R11, R36, R66, R67 | |
| S16, S26, S29, S33 | |
|
| |
 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Встречается в природе, большей частью в эфирных маслах растений (например, до 8,9 % в различных видах мяты[2][3], до 28,2 % в лабазнике[4], до 44 % в жасмине[5]), и в пищевых продуктах (например, в коньяках многолетней выдержки[6]).
Физические свойства
Бесцветная прозрачная жидкость с фруктовым запахом[7].
Хорошо смешивается с органическими растворителями[7]. По растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель. Смешивается в любых соотношениях с этанолом и этиловым эфиром, хорошо растворим в ацетоне и хлороформе, растворим в бензоле[8].
Некоторые свойства отличаются по разным источникам: плотность 0,9330[7] и 0,9244[8][9]г/см3; показатель преломления 1,3619[7] и 1,3593[8]; динамическая вязкость 0,362[7] и 0,381[8].
Растворимость в воде 31,9 %[8], образует с водой азеотропную смесь (температура кипения 56,4 °C, 96,7 % метилацетата)[7]. Образует азеотропные смеси с метанолом (температура кипения 54 °C, 81 % метилацетата) и ацетоном (температура кипения 56,1 °C, 45 % метилацетата)[10].
Образует аддукты: метилацетат•SbCl5, метилацетат•HSbCl6 и метилацетат•BF3, плавящиеся, соответственно, при 87-88, 81-82 и 65,5 °С.
Взрывоопасные концентрации в смеси с воздухом 3,15 — 15,60 %[9].
Химические свойства
По химическим свойствам метилацетат представляет собой типичный сложный эфир алифатической монокарбоновой кислоты.
Легко гидролизуется (омыляется) на исходные спирт и кислоту водой (обратимо) или щелочами (необратимо, так как образующаяся карбоновая кислота превращается в соль)[11][12]:
Ch4COOCh4+h3O → Ch4COOH+Ch4OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+H_{2}O\ \rightarrow \ CH_{3}COOH+CH_{3}OH} }Восстановление метилацетата приводит к образованию двух спиртов[13] (этанол и метанол):
Ch4COOCh4+2h3 → Ch4Ch3OH+Ch4OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+2H_{2}\ \rightarrow \ CH_{3}CH_{2}OH+CH_{3}OH} }Под действием аммиака метилацетат превращается в ацетамид и метанол[14]:
Ch4COOCh4+Nh4 → Ch4CONh3+Ch4OH{\displaystyle \mathrm {CH_{3}COOCH_{3}+NH_{3}\ \rightarrow \ CH_{3}CONH_{2}+CH_{3}OH} }Получение
Метилацетат получают:
Ch4COOH+Ch4OH → Ch4COOCh4+h3O{\displaystyle \mathrm {CH_{3}COOH+CH_{3}OH\ \rightarrow \ CH_{3}COOCH_{3}+H_{2}O} }- из уксусного ангидрида и метанола[7] (реакция протекает в жидкой фазе в отсутствии катализатора и является практически необратимой[15]):
Применение
Метилацетат применяют, в основном, в качестве растворителя в производстве лакокрасочных материалов и как компонент многих промышленных и бытовых растворителей. Является составной частью (7-75 %) лесохимических растворителей[16][9].
Используется при производстве клеев, композиционных лаков, шпатлевок, магнитных лент, автокосметики, эфиров целлюлозы, поливинилацетата, полиметилметакрилата, растительных и животных жиров, многих синтетических смол[16][9].
Применяется как экстрагент в аналитической химии, в том числе для отделения LiCl от хлоридов других щелочных металлов[17].
Метилацетат является ценным компонентом для промышленного синтеза, в том числе — из него карбонилированием получают уксусный ангидрид (процесс Реппеruen)[18][19]:
Ch4CO2Ch4+CO→(Ch4CO)2O{\displaystyle {\rm {CH_{3}CO_{2}CH_{3}+CO\rightarrow (CH_{3}CO)_{2}O}}}Используется в пищевой промышленности в качестве ароматизатора[17][20] и экстрактивного растворителя в процессе декофеинизирования чая и кофе[21]. В качестве ароматизатора и растворителя также входит в состав ряда косметических средств.
Токсичность
Слабо раздражает слизистые оболочки глаз и дыхательных путей (при концентрации 15 мг/л химически чистого метилацетата для ощущения раздражения требуется 5-минутная экспозиция). В высоких концентрациях оказывает лёгкое наркотическое воздействие, — в основном, за счёт действия самого сложного эфира, и, в меньшей степени, — за счёт образующегося из него спирта[9].
При пероральном введении ЛД50 = 2,9 г/кг (белые крысы), 2,4 г/кг (мыши и кролики), 3,6 г/кг (морские свинки)[9].
ПДК в воздухе рабочих зон 100 мг/м³[9][22]. ПДК в атмосферном воздухе населенных мест 0,07 мг/м³[23].
Примечания
- ↑ http://www.cdc.gov/niosh/npg/npgd0391.html
- ↑ Мяделец М. А., Домрачев Д. В., Черемушкина В. А. Исследование химического состава эфирных масел некоторых видов семейства Lamiaceae L., стр. 113. Проверено 28 февраля 2016.
- ↑ Изучение минерального состава лекарственного растительного сырья, содержащего эфирные масла. Проверено 28 февраля 2016.
- ↑ Зыкова И. Д., Ефремов А. А. Компонентный состав эфирного масла из надземной части лабазника вязолистного. Проверено 28 февраля 2016.
- ↑ Горяев М. И. Эфирные масла флоры СССР, стр. 223. Проверено 28 февраля 2016.
- ↑ Урсул О. Н., Алексанян К. А., Ткачук Л. А. Сырьевые и технологические факторы выдержки коньячных спиртов. журнал «Пищевая промышленность: наука и технологии», Минск, ISSN 2073-4794 (№ 1(15) 2012 года). Проверено 28 февраля 2016.
- ↑ 1 2 3 4 5 6 7 8 9 Химическая энциклопедия, том 3, 1992, с. 107.
- ↑ 1 2 3 4 5 Краткий химический справочник, 1977, с. 186.
- ↑ 1 2 3 4 5 6 7 8 Вредные вещества в промышленности. том 2, 1976, с. 155.
- ↑ Козлов П.В., Герц И.Б. Химия и технология полимерных плёнок, стр. 269. М., "Искусство" (1965). Проверено 28 февраля 2016.
- ↑ «Кинетика щелочного гидролиза метилацетата, бутилацетата и изобутилацетата в растворах вода-ацетонитрил» / М. Ю. Панов, О. Б. Соколова // Журнал физической химии . — 15/07/1997 . — Т. 71, N 7 . — 1199—1203
- ↑ Менделеев Д. И., Монастырский Д. Н. Эфиры сложные // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ Павлов Б.А., Терентьев А.П. Курс органической химии, стр. 256. М., "Химия" (1965). Проверено 28 февраля 2016.
- ↑ Theodore A. Koch, John G. Miller, Allan R. Day. AEffect of Structure on Reactivity. VI. Catalysis in the Ammonolysis and Hydrolysis of Methyl Acetate // Journal of the American Chemical Society (J AM CHEM SOC). — February 1953. — DOI:10.1021/ja01100a054.
- ↑ Получение метилацетата этерификацией уксусного ангидрида метанолом. Проверено 28 февраля 2016.
- ↑ 1 2 Химическая энциклопедия, том 3, 1992, с. 107-108.
- ↑ 1 2 Химическая энциклопедия, том 3, 1992, с. 108.
- ↑ Ullmann, 2000, p. 244.
- ↑ Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. (1992). «Eastman Chemical Company Acetic Anhydride Process». Catalysis Today 13: 73–91. DOI:10.1016/0920-5861(92)80188-S.
- ↑ Санитарно-эпидемиологические правила и нормативы СанПиН 2.3.2.1293-03 «Гигиенические требования по применению пищевых добавок». Приложение 6, № 861. Москва (15.06.2003 с изменениями от 26.05.2008). Проверено 28 февраля 2016.
- ↑ Курс лекций по товароведению вкусовых товаров (ЭУМК). БГУ. Проверено 28 февраля 2016.
- ↑ Санитарные нормы проектирования промышленных предприятий (СН245-71). Приложение 4. Издание официальное. Москва, Стройиздат, 1972
- ↑ Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест. Проверено 28 февраля 2016.
Источники
- Редкол.: Кнунянц И. Л. и др. Химическая энциклопедия, том 3. — М.: Советская энциклопедия, 1992. — 639 с. — ISBN 5-85270-039-8.
- Kirk-Othmer Encyclopedia, 3 td., v. 4, N.Y., 1978, p. 142—143
- Held H., Rengst A., Mayer D. Acetic Anhydride and Mixed Fatty Acid Anhydrides // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2000. — DOI:10.1002/14356007.a01_065.
- Лазарев Н. В.. Вредные вещества в промышленности. том 2. — Л.: Химия, 1976. — 624 с.
- Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л.: Химия, 1977. — 376 с.
- «NIOSH Pocket Guide to Chemical Hazards. Methyl acetate» (англ.). Национальный институт охраны труда (NIOSH). Проверено 28 февраля 2016.
- Метилацетат. Паспорт безопасности. Проверено 28 февраля 2016.
ru-wiki.org
уксусно метиловый эфир - это... Что такое уксусно метиловый эфир?
уксусно метиловый эфир advtextile. Methylacetat
Универсальный русско-немецкий словарь. Академик.ру. 2011.
- уксусная эссенция
- уксусно-амиловый эфир
Смотреть что такое "уксусно метиловый эфир" в других словарях:
Изомерия — (хим.). В 1824 г. Либихом и Гей Люссаком был установлен состав гремучекислого серебра (см.), при чем, на основании полученных данных, они признали безводную [Согласно господствовавшему в химии в начале нынешнего столетия взгляду, кислотами… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Мята перечная — (английская мята, холодная мята, мята холодянка, холодка мята) Menta piperita L. Семейство губоцветные. Многолетнее травянистое растение высотой 30 100 см, с характерным сильным запахом и холодящим ощущением при разжевывании листьев. Корневище… … Энциклопедия лекарственных растений
Химических типов теория — Под этим названием известны несколько взглядов, появившихся в химии в разное время. Впервые выражение химический тип введено, кажется, Дюма [Может быть оно принадлежит Бодримону; по крайней мере Лоран ( Méthode de Chimie , 1854, 358), говорит: M … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Эссенции фруктовые и ликерные — Под этим названием в технике известны различного рода смеси из сложных эфиров (см.), подражающие запаху разнообразных фруктов, цветов и растений и применяемые в кондитерском, ликерном и парфюмерном (отчасти) производствах. Иногда к сложным эфирам … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Фенолы — (хим.) представляют ароматические углеводороды (см.), в которых один или несколько атомов водорода бензольного или вообще ароматического ядра замещены гидроксилами (ОН). По числу этих замещающих водород гидроксилов Ф. разделяются на одно , дву ,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Терпены и их производные — класс соединений, важных в практическом отношении и весьма интересных в теоретическом; большею частью вырабатываются и выделяются растениями в виде так наз. эфирных масел (см.), но известно также много искусственно получаемых представителей этого … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Опиум — (хим.). Под этим названием в продаже известен высушенный млечный сок, добываемый из семянных коробочек мака (Papaver somniferum). С химической точки зрения О. представляет смесь весьма многих веществ, причем количественные отношения их, по… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Пропионовая кислота — (этилкарбоновая, метилуксусная) C3H6O2 = C2H5COOH третья кислота ряда Cnh3nO2 (см. Предельные кислоты), открытая Готтлибом в 1844 г.; он получил ее при сплавлении тростникового сахара с едким кали и назвал метацетоновой кислотой. Потом кислота… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
МОЧА — (урина, urina), жидкость, отде ляемая почками и выделяемая из организ ма наружу через систему мочевыводящих путей. СМ. удаляются из организма почти все азотистые продукты обмена веществ (за исключением небольших количеств, поступающих в пот и в… … Большая медицинская энциклопедия
Химическое строение — Настоящая статья имеет задачей изложение истории возникновения теории X. строения органических соединений и ее связи с предыдущими теориями. В значительной мере это уже выяснено в статьях Замещение, Унитарная система, Химических типов теория и… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
ФАРМАЦЕВТИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ — ФАРМАЦЕВТИЧЕСКАЯ ПРОМЫШЛЕННОСТЬ, отрасль хозяйства, объединяющая производство лекарственных препаратов и лечебно профилактических средств. К Ф. п. относятся производства: 1) хим. фармацевтических препаратов, получаемых путем хим. синтеза и… … Большая медицинская энциклопедия
universal_ru_de.academic.ru
Метилацетат (метиловый эфир уксусной кислоты)
Метилацетат (метиловый эфир уксусной кислоты).
Метилацетат формула (СН3СООСН3)— сложный метиловый эфир алифатической монокарбоновой кислоты. Оно представляет собой прозрачную бесцветную жидкость, с приятным фруктовым запахом. Такое вещество хорошо смешивается с различными органическими растворителями и принимает участие в ряде химических реакций. Своими растворяющими характеристиками он схож с ацетоном. Раздражает слизистые глаз и дыхательные пути метилацетат плотность этого вещества составляет 0.9330 г/см3.Он легко растворяется в бензоле, хлороформе или ацетоне, а также смешивается с этиловым эфиром и этанолом. При этом — достаточно плохо растворим в воде. Молярная масса метилацетата 74,08 г/моль. Взрывоопасной концентрацией данного вещества в воздухе является насыщение парами 3,5-16%. Смертельная доза метилацетата при приеме внутрь составляет 30 г.Метилацетат получениеДанный химический состав в лабораторных условиях производят в присутствии серной кислоты с помощью процесса этерификации уксусной кислоты метанолом в жидкой фазе. Его можно получать из уксусного ангидрида или метанола без катализаторов. Помимо синтетических методов производства, метилацетат получают и в ходе пиролиза древесины.
Сфера применения метилацетатаУксусная кислота метилацетат применяется в качестве растворителя при изготовлении лакокрасочных материалов. Он также выступает основным компонентом при производстве бытовых и промышленных лесохимических растворителей. Используют метиловый эфир этановой кислоты и как ароматизирующее вещество в производстве пищевых продуктов. С его помощью можно растворять разные органические материалы.Данный состав применяют в качестве ценного компонента в промышленном синтезе уксусного ангидрида. Метилацетат нужен для производства клеевых составов и автокосметики, магнитных лент и шпатлевок. С его помощью изготавливают синтетические смолы, эфиры целлюлозы, полиметилметакрилат, поливинилацетат, животные и растительные жиры.Способ храненияМетилацетат рекомендуется хранить в закрытых емкостях при комнатной температуре.
В компании «Химсервис-Континент» можно выгодно метилацетат купить, получая отличные условия отгрузки любых партий товара в разные регионы страны.
Купить метилацетат (метиловый эфир уксусной кислоты) Вы можете у нас по следующим ценам, при фасовке 190кг:мин заказ от 380кг по 61 руб/кг, цена с НДС и таройот 1тн по 59 руб/кг, цена с НДС и тарой.

www.him-kont.ru
Метилацетат — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
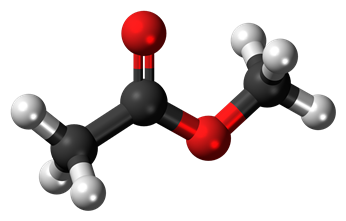
| Метилацетат | |
| Methyl acetate 3D ball.png | |
| Систематическоенаименование | метиловый эфир этановой кислоты |
| Сокращения | MeOAc |
| Традиционные названия | метиловый эфир уксусной кислоты,уксуснометиловый эфир |
| Хим. формула | C3H6O2 |
| Рац. формула | Ch4COOCh4 |
| Состояние | жидкость |
| Молярная масса | 74.08 г/моль |
| Плотность | 0.9330 г/см³ |
| Динамическая вязкость | 0.362 Па·с |
| Удельное электрическое сопротивление | 0,52 Ом·м |
| Т. плав. | -98.1 °C |
| Т. кип. | 57.1 °C |
| Т. всп. | -9.4 °C |
| Т. воспл. | -10 °C |
| Т. свспл. | 470 °C |
| Пр. взрв. | 3,15 — 15,60 % |
| Кр. точка | 233.70 |
| Мол. теплоёмк. | 156.19 Дж/(моль·К) |
| Давление пара | 0,2224 атм |
| Растворимость в воде | 31,9 г/100 мл |
| Показатель преломления | 1.3619 |
| Дипольный момент | 1.72±0.09 Д |
| Рег. номер CAS | 79-20-9 |
| Рег. номер EINECS | 201-185-2 |
| SMILES |
[chemapps.stolaf.edu/jmol/jmol.php?model=O%3DC%28OC%29C O=C(OC)C] |
| InChI |
[chemapps.stolaf.edu/jmol/jmol.php?&model=InChI=1S%2FC3H6O2%2Fc1-3%284%295-2%2Fh2-2h4 1S/C3H6O2/c1-3(4)5-2/h2-2h4] |
| Рег. номер EC | 607-021-00-X |
| RTECS | AI9100000 |
| Номер ООН | 1231 |
| ПДК | 100 мг/м³ |
| Токсичность | низкая |
| R-фразы | R11, R36, R66, R67 |
| S-фразы | S16, S26, S29, S33 |
| Пиктограммы СГС | |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Метилацета́т (метиловый эфир уксусной кислоты, метиловый эфир этановой кислоты, уксуснометиловый эфир, MeOAc) Ch4COOCh4 — органическое вещество класса сложных эфиров.
Встречается в природе, большей частью в эфирных маслах растений (например, до 8,9 % в различных видах мяты[1][2], до 28,2 % в лабазнике[3], до 44 % в жасмине[4]), и в пищевых продуктах (например, в коньяках многолетней выдержки[5]).
Физические свойства
Бесцветная прозрачная жидкость с фруктовым запахом[6].
Хорошо смешивается с органическими растворителями[6]. По растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель. Смешивается в любых соотношениях с этанолом и этиловым эфиром, хорошо растворим в ацетоне и хлороформе, растворим в бензоле[7].
Некоторые свойства отличаются по разным источникам: плотность 0,9330[6] и 0,9244[7][8]г/см3; показатель преломления 1,3619[6] и 1,3593[7]; динамическая вязкость 0,362[6] и 0,381[7].
Растворимость в воде 31,9 %[7], образует с водой азеотропную смесь (температура кипения 56,4 °C, 96,7 % метилацетата)[6]. Образует азеотропные смеси с метанолом (температура кипения 54 °C, 81 % метилацетата) и ацетоном (температура кипения 56,1 °C, 45 % метилацетата)[9].
Образует аддукты: метилацетат•SbCl5, метилацетат•HSbCl6 и метилацетат•BF3, плавящиеся, соответственно, при 87-88, 81-82 и 65,5 °С.
Взрывоопасные концентрации в смеси с воздухом 3,15 — 15,60 %[8].
Химические свойства
По химическим свойствам метилацетат представляет собой типичный сложный эфир алифатической монокарбоновой кислоты.
Легко гидролизуется (омыляется) на исходные спирт и кислоту водой (обратимо) или щелочами (необратимо, так как образующаяся карбоновая кислота превращается в соль)[10][11]:
<math>\mathrm{CH_3COOCH_3 + H_2O \ \rightarrow \ CH_3COOH + CH_3OH}</math>Восстановление метилацетата приводит к образованию двух спиртов[12]:
<math>\mathrm{CH_3COOCH_3 + 2H_2 \ \rightarrow \ CH_3CH_2OH + CH_3OH}</math>Под действием аммиака метилацетат превращается в ацетамид и спирт[13]:
<math>\mathrm{CH_3COOCH_3 + NH_3 \ \rightarrow \ CH_3CONH_2 + CH_3OH}</math>Получение
Метилацетат получают этерификацией уксусной кислоты метанолом в жидкой фазе в присутствии серной кислоты (или при пропускании смеси паров указанных жидкостей над нагретыми катализаторами: FeCl3, AlCl3)[6]:
<math>\mathrm{CH_3COOH + CH_3OH \ \rightarrow \ CH_3COOCH_3 + H_2O}</math>а также из уксусного ангидрида и метанола[6] (реакция протекает в жидкой фазе в отсутствии катализатора и является практически необратимой[14]):
<math>\mathrm{(CH_3CO)_2O + CH_3OH \ \rightarrow \ CH_3COOCH_3 + CH_3COOH}</math>,Кроме синтетических методов, также производится пиролизом древесины[6][8].
Применение
Метилацетат применяют, в основном, в качестве растворителя в производстве лакокрасочных материалов и как компонент многих промышленных и бытовых растворителей. Является составной частью (7-75 %) лесохимических растворителей[15][8].
Используется при производстве клеев, композиционных лаков, шпатлевок, магнитных лент, автокосметики, эфиров целлюлозы, поливинилацетата, полиметилметакрилата, растительных и животных жиров, многих синтетических смол[15][8].
Применяется как экстрагент в аналитической химии, в том числе для отделения LiCl от хлоридов других щелочных металлов[16].
Метилацетат является ценным компонентом для промышленного синтеза, в том числе — из него карбонилированием получают уксусный ангидрид (процесс Реппе</span>ruen)[17][18]:
<math>\rm CH_3CO_2CH_3 + CO \rightarrow (CH_3CO)_2O</math>Используется в пищевой промышленности в качестве ароматизатора[16][19] и экстрактивного растворителя в процессе декофеинизирования чая и кофе[20]. В качестве ароматизатора и растворителя также входит в состав ряда косметических средств.
Токсичность
Слабо раздражает слизистые оболочки глаз и дыхательных путей (при концентрации 15 мг/л химически чистого метилацетата для ощущения раздражения требуется 5-минутная экспозиция). В высоких концентрациях оказывает лёгкое наркотическое воздействие, — в основном, за счёт действия самого сложного эфира, и, в меньшей степени, — за счёт образующегося из него спирта[8].
При пероральном введении ЛД50 = 2,9 г/кг (белые крысы), 2,4 г/кг (мыши и кролики), 3,6 г/кг (морские свинки)[8].
ПДК в воздухе рабочих зон 100 мг/м³[8][21]. ПДК в атмосферном воздухе населенных мест 0,07 мг/м³[22].
Напишите отзыв о статье "Метилацетат"
Примечания
- ↑ Мяделец М. А., Домрачев Д. В., Черемушкина В. А. [www.chem.asu.ru/chemwood/volume16/2012_01/1201_111.pdf Исследование химического состава эфирных масел некоторых видов семейства Lamiaceae L., стр. 113]. Проверено 28 февраля 2016.
- ↑ [medical-diss.com/medicina/izuchenie-mineralnogo-sostava-lekarstvennogo-rastitelnogo-syrya-soderzhaschego-efirnye-masla Изучение минерального состава лекарственного растительного сырья, содержащего эфирные масла]. Проверено 28 февраля 2016.
- ↑ Зыкова И. Д., Ефремов А. А. [cyberleninka.ru/article/n/komponentnyy-sostav-efirnogo-masla-stebley-listiev-i-sotsvetiy-filipendula-ulamaria-l-maxim Компонентный состав эфирного масла из надземной части лабазника вязолистного]. Проверено 28 февраля 2016.
- ↑ Горяев М. И. [bestbengals.ru/goryaev-efirnie-masla/index0223.php Эфирные масла флоры СССР, стр. 223]. Проверено 28 февраля 2016.
- ↑ Урсул О. Н., Алексанян К. А., Ткачук Л. А. [www.new.belproduct.com/assets/files/Pishhevaya-promyshlennost-nauka-i-tehnologii-%231(15)-2012.pdf Сырьевые и технологические факторы выдержки коньячных спиртов]. журнал «Пищевая промышленность: наука и технологии», Минск, ISSN 2073-4794 (№ 1(15) 2012 года). Проверено 28 февраля 2016.
- ↑ 1 2 3 4 5 6 7 8 9 Химическая энциклопедия, том 3, 1992, с. 107.
- ↑ 1 2 3 4 5 Краткий химический справочник, 1977, с. 186.
- ↑ 1 2 3 4 5 6 7 8 Вредные вещества в промышленности. том 2, 1976, с. 155.
- ↑ Козлов П.В., Герц И.Б. [chem21.info/page/203151226037218132208123239151078017068135089191/ Химия и технология полимерных плёнок, стр. 269]. М., "Искусство" (1965). Проверено 28 февраля 2016.
- ↑ «Кинетика щелочного гидролиза метилацетата, бутилацетата и изобутилацетата в растворах вода-ацетонитрил» / М. Ю. Панов, О. Б. Соколова // Журнал физической химии . — 15/07/1997 . — Т. 71, N 7 . — 1199—1203
- ↑ Менделеев Д. И., Монастырский Д. Н. Эфиры сложные // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ Павлов Б.А., Терентьев А.П. [chem21.info/page/112132070197164017038223071235073166240240077076/ Курс органической химии, стр. 256]. М., "Химия" (1965). Проверено 28 февраля 2016.
- ↑ Theodore A. Koch, John G. Miller, Allan R. Day. AEffect of Structure on Reactivity. VI. Catalysis in the Ammonolysis and Hydrolysis of Methyl Acetate // Journal of the American Chemical Society (J AM CHEM SOC). — February 1953. — DOI:10.1021/ja01100a054
- ↑ [studopedia.org/12-56214.html Получение метилацетата этерификацией уксусного ангидрида метанолом]. Проверено 28 февраля 2016.
- ↑ 1 2 Химическая энциклопедия, том 3, 1992, с. 107-108.
- ↑ 1 2 Химическая энциклопедия, том 3, 1992, с. 108.
- ↑ Ullmann, 2000, p. 244.
- ↑ Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. (1992). «Eastman Chemical Company Acetic Anhydride Process». Catalysis Today 13: 73–91. DOI:10.1016/0920-5861(92)80188-S.
- ↑ [pomni.info/files/2.3.2.1293-03.rtf Санитарно-эпидемиологические правила и нормативы СанПиН 2.3.2.1293-03 «Гигиенические требования по применению пищевых добавок». Приложение 6, № 861]. Москва (15.06.2003 с изменениями от 26.05.2008). Проверено 28 февраля 2016.
- ↑ [webcache.googleusercontent.com/search?q=cache:J7v4N_er4RMJ:bseu.by:8080/bitstream/edoc/20263/2/Kurs_lektsiy.docx+&cd=60&hl=ru&ct=clnk&gl=by Курс лекций по товароведению вкусовых товаров (ЭУМК)]. БГУ. Проверено 28 февраля 2016.
- ↑ Санитарные нормы проектирования промышленных предприятий (СН245-71). Приложение 4. Издание официальное. Москва, Стройиздат, 1972
- ↑ [www.dioxin.ru/doc/gn2.1.6.1338-03.htm Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест]. Проверено 28 февраля 2016.
Источники
- Редкол.: Кнунянц И. Л. и др. Химическая энциклопедия, том 3. — М.: Советская энциклопедия, 1992. — 639 с. — ISBN 5-85270-039-8.
- Kirk-Othmer Encyclopedia, 3 td., v. 4, N.Y., 1978, p. 142—143
- Held H., Rengst A., Mayer D. Acetic Anhydride and Mixed Fatty Acid Anhydrides // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2000. — DOI:10.1002/14356007.a01_065
- Лазарев Н. В.. Вредные вещества в промышленности. том 2. — Л.: Химия, 1976. — 624 с.
- Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л.: Химия, 1977. — 376 с.
- [www.cdc.gov/niosh/npg/npgd0391.html «NIOSH Pocket Guide to Chemical Hazards. Methyl acetate»] (англ.). Национальный институт охраны труда (NIOSH). Проверено 28 февраля 2016.
- [i.xn----7sbbfdfjate2a3bheecjjmr9b2b3j.xn--p1ai/u/cb/ea1b6a340e11e499046f3ac0679388/-/%D0%9C%D0%B5%D1%82%D0%B8%D0%BB%D0%B0%D1%86%D0%B5%D1%82%D0%B0%D1%82%20%D0%9F%D0%B0%D1%81%D0%BF%D0%BE%D1%80%D1%82%20%D0%B1%D0%B5%D0%B7%D0%BE%D0%BF%D0%B0%D1%81%D0%BD%D0%BE%D1%81%D1%82%D0%B8.pdf Метилацетат. Паспорт безопасности]. Проверено 28 февраля 2016.
Отрывок, характеризующий Метилацетат
На Праценской горе, на том самом месте, где он упал с древком знамени в руках, лежал князь Андрей Болконский, истекая кровью, и, сам не зная того, стонал тихим, жалостным и детским стоном. К вечеру он перестал стонать и совершенно затих. Он не знал, как долго продолжалось его забытье. Вдруг он опять чувствовал себя живым и страдающим от жгучей и разрывающей что то боли в голове. «Где оно, это высокое небо, которое я не знал до сих пор и увидал нынче?» было первою его мыслью. «И страдания этого я не знал также, – подумал он. – Да, я ничего, ничего не знал до сих пор. Но где я?» Он стал прислушиваться и услыхал звуки приближающегося топота лошадей и звуки голосов, говоривших по французски. Он раскрыл глаза. Над ним было опять всё то же высокое небо с еще выше поднявшимися плывущими облаками, сквозь которые виднелась синеющая бесконечность. Он не поворачивал головы и не видал тех, которые, судя по звуку копыт и голосов, подъехали к нему и остановились. Подъехавшие верховые были Наполеон, сопутствуемый двумя адъютантами. Бонапарте, объезжая поле сражения, отдавал последние приказания об усилении батарей стреляющих по плотине Аугеста и рассматривал убитых и раненых, оставшихся на поле сражения. – De beaux hommes! [Красавцы!] – сказал Наполеон, глядя на убитого русского гренадера, который с уткнутым в землю лицом и почернелым затылком лежал на животе, откинув далеко одну уже закоченевшую руку. – Les munitions des pieces de position sont epuisees, sire! [Батарейных зарядов больше нет, ваше величество!] – сказал в это время адъютант, приехавший с батарей, стрелявших по Аугесту. – Faites avancer celles de la reserve, [Велите привезти из резервов,] – сказал Наполеон, и, отъехав несколько шагов, он остановился над князем Андреем, лежавшим навзничь с брошенным подле него древком знамени (знамя уже, как трофей, было взято французами). – Voila une belle mort, [Вот прекрасная смерть,] – сказал Наполеон, глядя на Болконского. Князь Андрей понял, что это было сказано о нем, и что говорит это Наполеон. Он слышал, как называли sire того, кто сказал эти слова. Но он слышал эти слова, как бы он слышал жужжание мухи. Он не только не интересовался ими, но он и не заметил, а тотчас же забыл их. Ему жгло голову; он чувствовал, что он исходит кровью, и он видел над собою далекое, высокое и вечное небо. Он знал, что это был Наполеон – его герой, но в эту минуту Наполеон казался ему столь маленьким, ничтожным человеком в сравнении с тем, что происходило теперь между его душой и этим высоким, бесконечным небом с бегущими по нем облаками. Ему было совершенно всё равно в эту минуту, кто бы ни стоял над ним, что бы ни говорил об нем; он рад был только тому, что остановились над ним люди, и желал только, чтоб эти люди помогли ему и возвратили бы его к жизни, которая казалась ему столь прекрасною, потому что он так иначе понимал ее теперь. Он собрал все свои силы, чтобы пошевелиться и произвести какой нибудь звук. Он слабо пошевелил ногою и произвел самого его разжалобивший, слабый, болезненный стон. – А! он жив, – сказал Наполеон. – Поднять этого молодого человека, ce jeune homme, и свезти на перевязочный пункт! Сказав это, Наполеон поехал дальше навстречу к маршалу Лану, который, сняв шляпу, улыбаясь и поздравляя с победой, подъезжал к императору. Князь Андрей не помнил ничего дальше: он потерял сознание от страшной боли, которую причинили ему укладывание на носилки, толчки во время движения и сондирование раны на перевязочном пункте. Он очнулся уже только в конце дня, когда его, соединив с другими русскими ранеными и пленными офицерами, понесли в госпиталь. На этом передвижении он чувствовал себя несколько свежее и мог оглядываться и даже говорить. Первые слова, которые он услыхал, когда очнулся, – были слова французского конвойного офицера, который поспешно говорил: – Надо здесь остановиться: император сейчас проедет; ему доставит удовольствие видеть этих пленных господ. – Нынче так много пленных, чуть не вся русская армия, что ему, вероятно, это наскучило, – сказал другой офицер. – Ну, однако! Этот, говорят, командир всей гвардии императора Александра, – сказал первый, указывая на раненого русского офицера в белом кавалергардском мундире. Болконский узнал князя Репнина, которого он встречал в петербургском свете. Рядом с ним стоял другой, 19 летний мальчик, тоже раненый кавалергардский офицер. Бонапарте, подъехав галопом, остановил лошадь. – Кто старший? – сказал он, увидав пленных. Назвали полковника, князя Репнина. – Вы командир кавалергардского полка императора Александра? – спросил Наполеон. – Я командовал эскадроном, – отвечал Репнин. – Ваш полк честно исполнил долг свой, – сказал Наполеон. – Похвала великого полководца есть лучшая награда cолдату, – сказал Репнин. – С удовольствием отдаю ее вам, – сказал Наполеон. – Кто этот молодой человек подле вас? Князь Репнин назвал поручика Сухтелена. Посмотрев на него, Наполеон сказал, улыбаясь: – II est venu bien jeune se frotter a nous. [Молод же явился он состязаться с нами.] – Молодость не мешает быть храбрым, – проговорил обрывающимся голосом Сухтелен. – Прекрасный ответ, – сказал Наполеон. – Молодой человек, вы далеко пойдете! Князь Андрей, для полноты трофея пленников выставленный также вперед, на глаза императору, не мог не привлечь его внимания. Наполеон, видимо, вспомнил, что он видел его на поле и, обращаясь к нему, употребил то самое наименование молодого человека – jeune homme, под которым Болконский в первый раз отразился в его памяти. – Et vous, jeune homme? Ну, а вы, молодой человек? – обратился он к нему, – как вы себя чувствуете, mon brave? Несмотря на то, что за пять минут перед этим князь Андрей мог сказать несколько слов солдатам, переносившим его, он теперь, прямо устремив свои глаза на Наполеона, молчал… Ему так ничтожны казались в эту минуту все интересы, занимавшие Наполеона, так мелочен казался ему сам герой его, с этим мелким тщеславием и радостью победы, в сравнении с тем высоким, справедливым и добрым небом, которое он видел и понял, – что он не мог отвечать ему. Да и всё казалось так бесполезно и ничтожно в сравнении с тем строгим и величественным строем мысли, который вызывали в нем ослабление сил от истекшей крови, страдание и близкое ожидание смерти. Глядя в глаза Наполеону, князь Андрей думал о ничтожности величия, о ничтожности жизни, которой никто не мог понять значения, и о еще большем ничтожестве смерти, смысл которой никто не мог понять и объяснить из живущих. Император, не дождавшись ответа, отвернулся и, отъезжая, обратился к одному из начальников: – Пусть позаботятся об этих господах и свезут их в мой бивуак; пускай мой доктор Ларрей осмотрит их раны. До свидания, князь Репнин, – и он, тронув лошадь, галопом поехал дальше. На лице его было сиянье самодовольства и счастия. Солдаты, принесшие князя Андрея и снявшие с него попавшийся им золотой образок, навешенный на брата княжною Марьею, увидав ласковость, с которою обращался император с пленными, поспешили возвратить образок. Князь Андрей не видал, кто и как надел его опять, но на груди его сверх мундира вдруг очутился образок на мелкой золотой цепочке. «Хорошо бы это было, – подумал князь Андрей, взглянув на этот образок, который с таким чувством и благоговением навесила на него сестра, – хорошо бы это было, ежели бы всё было так ясно и просто, как оно кажется княжне Марье. Как хорошо бы было знать, где искать помощи в этой жизни и чего ждать после нее, там, за гробом! Как бы счастлив и спокоен я был, ежели бы мог сказать теперь: Господи, помилуй меня!… Но кому я скажу это! Или сила – неопределенная, непостижимая, к которой я не только не могу обращаться, но которой не могу выразить словами, – великое всё или ничего, – говорил он сам себе, – или это тот Бог, который вот здесь зашит, в этой ладонке, княжной Марьей? Ничего, ничего нет верного, кроме ничтожества всего того, что мне понятно, и величия чего то непонятного, но важнейшего!» Носилки тронулись. При каждом толчке он опять чувствовал невыносимую боль; лихорадочное состояние усилилось, и он начинал бредить. Те мечтания об отце, жене, сестре и будущем сыне и нежность, которую он испытывал в ночь накануне сражения, фигура маленького, ничтожного Наполеона и над всем этим высокое небо, составляли главное основание его горячечных представлений. Тихая жизнь и спокойное семейное счастие в Лысых Горах представлялись ему. Он уже наслаждался этим счастием, когда вдруг являлся маленький Напoлеон с своим безучастным, ограниченным и счастливым от несчастия других взглядом, и начинались сомнения, муки, и только небо обещало успокоение. К утру все мечтания смешались и слились в хаос и мрак беспамятства и забвения, которые гораздо вероятнее, по мнению самого Ларрея, доктора Наполеона, должны были разрешиться смертью, чем выздоровлением. – C'est un sujet nerveux et bilieux, – сказал Ларрей, – il n'en rechappera pas. [Это человек нервный и желчный, он не выздоровеет.] Князь Андрей, в числе других безнадежных раненых, был сдан на попечение жителей.
В начале 1806 года Николай Ростов вернулся в отпуск. Денисов ехал тоже домой в Воронеж, и Ростов уговорил его ехать с собой до Москвы и остановиться у них в доме. На предпоследней станции, встретив товарища, Денисов выпил с ним три бутылки вина и подъезжая к Москве, несмотря на ухабы дороги, не просыпался, лежа на дне перекладных саней, подле Ростова, который, по мере приближения к Москве, приходил все более и более в нетерпение. «Скоро ли? Скоро ли? О, эти несносные улицы, лавки, калачи, фонари, извозчики!» думал Ростов, когда уже они записали свои отпуски на заставе и въехали в Москву. – Денисов, приехали! Спит! – говорил он, всем телом подаваясь вперед, как будто он этим положением надеялся ускорить движение саней. Денисов не откликался. – Вот он угол перекресток, где Захар извозчик стоит; вот он и Захар, и всё та же лошадь. Вот и лавочка, где пряники покупали. Скоро ли? Ну! – К какому дому то? – спросил ямщик. – Да вон на конце, к большому, как ты не видишь! Это наш дом, – говорил Ростов, – ведь это наш дом! Денисов! Денисов! Сейчас приедем. Денисов поднял голову, откашлялся и ничего не ответил. – Дмитрий, – обратился Ростов к лакею на облучке. – Ведь это у нас огонь? – Так точно с и у папеньки в кабинете светится. – Еще не ложились? А? как ты думаешь? Смотри же не забудь, тотчас достань мне новую венгерку, – прибавил Ростов, ощупывая новые усы. – Ну же пошел, – кричал он ямщику. – Да проснись же, Вася, – обращался он к Денисову, который опять опустил голову. – Да ну же, пошел, три целковых на водку, пошел! – закричал Ростов, когда уже сани были за три дома от подъезда. Ему казалось, что лошади не двигаются. Наконец сани взяли вправо к подъезду; над головой своей Ростов увидал знакомый карниз с отбитой штукатуркой, крыльцо, тротуарный столб. Он на ходу выскочил из саней и побежал в сени. Дом также стоял неподвижно, нерадушно, как будто ему дела не было до того, кто приехал в него. В сенях никого не было. «Боже мой! все ли благополучно?» подумал Ростов, с замиранием сердца останавливаясь на минуту и тотчас пускаясь бежать дальше по сеням и знакомым, покривившимся ступеням. Всё та же дверная ручка замка, за нечистоту которой сердилась графиня, также слабо отворялась. В передней горела одна сальная свеча. Старик Михайла спал на ларе. Прокофий, выездной лакей, тот, который был так силен, что за задок поднимал карету, сидел и вязал из покромок лапти. Он взглянул на отворившуюся дверь, и равнодушное, сонное выражение его вдруг преобразилось в восторженно испуганное. – Батюшки, светы! Граф молодой! – вскрикнул он, узнав молодого барина. – Что ж это? Голубчик мой! – И Прокофий, трясясь от волненья, бросился к двери в гостиную, вероятно для того, чтобы объявить, но видно опять раздумал, вернулся назад и припал к плечу молодого барина. – Здоровы? – спросил Ростов, выдергивая у него свою руку. – Слава Богу! Всё слава Богу! сейчас только покушали! Дай на себя посмотреть, ваше сиятельство! – Всё совсем благополучно? – Слава Богу, слава Богу! Ростов, забыв совершенно о Денисове, не желая никому дать предупредить себя, скинул шубу и на цыпочках побежал в темную, большую залу. Всё то же, те же ломберные столы, та же люстра в чехле; но кто то уж видел молодого барина, и не успел он добежать до гостиной, как что то стремительно, как буря, вылетело из боковой двери и обняло и стало целовать его. Еще другое, третье такое же существо выскочило из другой, третьей двери; еще объятия, еще поцелуи, еще крики, слезы радости. Он не мог разобрать, где и кто папа, кто Наташа, кто Петя. Все кричали, говорили и целовали его в одно и то же время. Только матери не было в числе их – это он помнил. – А я то, не знал… Николушка… друг мой! – Вот он… наш то… Друг мой, Коля… Переменился! Нет свечей! Чаю! – Да меня то поцелуй! – Душенька… а меня то. Соня, Наташа, Петя, Анна Михайловна, Вера, старый граф, обнимали его; и люди и горничные, наполнив комнаты, приговаривали и ахали. Петя повис на его ногах. – А меня то! – кричал он. Наташа, после того, как она, пригнув его к себе, расцеловала всё его лицо, отскочила от него и держась за полу его венгерки, прыгала как коза всё на одном месте и пронзительно визжала.
wiki-org.ru





 ,(Ch4)2CO+RC(O)OOH →H+ Ch4COOCh4{\displaystyle \mathrm {(CH_{3})_{2}CO+RC(O)OOH\ {\xrightarrow {H^{+}}}\ CH_{3}COOCH_{3}} }
,(Ch4)2CO+RC(O)OOH →H+ Ch4COOCh4{\displaystyle \mathrm {(CH_{3})_{2}CO+RC(O)OOH\ {\xrightarrow {H^{+}}}\ CH_{3}COOCH_{3}} } ,
,