Содержание
Диэтиловый эфир
Диэтиловый эфир С2Н5ОС2Н5, чистый (для наркоза).[ …]
Диэтиловый эфир медицинский, для наркоза.[ …]
Метод прямой экстракции диэтиловым эфиром мы рекомендуем для анализа относительно концентрированных по содержанию органических загрязнений вод и в которых присутствующие загрязняющие вещества имеют высокий коэффициент распределения в системе: диэтиловый эфир —- вода.[ …]
Температура плавления от 0 до 2 °С, температура кипения — 282 °С, давление пара при 150 °С — 1,67 кПа. Растворяется в этаноле, бензоле, диэтиловом эфире, ацетоне, хлороформе, в воде (0,5 % вес. при 25 °С). В воздухе находится в виде паров или тумана.[ …]
Ход анализа. Пробу воды обрабатывают очищенным бензолом или диэтиловым эфиром трижды из расчета 100 мл на 1 л воды, деля экстрагент на три части. При использовании ди-этилового эфира в воду добавляют хлорид натрия до насыщения. Экстракцию проводят в делительных воронках при интенсивном встряхивании или в сосудах на аппарате для встряхивания 10 мин. Объединенные экстракты упаривают на водяной бане до 3 мл (бензольные) и до сухого остатка (эфирные). Бензольный экстракт переносят в пробирку и объем доводят бензолом до 5 мл. При анализе вод, загрязненных нефтепродуктами, отходами нефтехимического, коксохимического или других производств, экстракты подвергают хроматографическому фракционированию.[ …]
Объединенные экстракты упаривают на водяной бане до 3 мл (бензольные) и до сухого остатка (эфирные). Бензольный экстракт переносят в пробирку и объем доводят бензолом до 5 мл. При анализе вод, загрязненных нефтепродуктами, отходами нефтехимического, коксохимического или других производств, экстракты подвергают хроматографическому фракционированию.[ …]
Предельно допустимая максимальная разовая концентрация в воздухе: диэтилового эфира 1,0 мг/м3, среднесуточная концентрация— 0,6 мг/м3, этилхлорида — 0,2 мг/м3, кл. опасности для обоих веществ 4.[ …]
Ход определения. Вату из аллонжа переносят в стакан и 3 раза промывают диэтиловым эфиром по 5 мл. Промывают также гофрированную трубку с силикагелем 12—20 мл диэтилового эфира. Измеряют объем экстрактов, отбирают для анализа половину пробы и упаривают ее на водяной бане при 40 °С до 0,3—0,5 мл.[ …]
Принцип анализа. Определение основано на концентрировании этилхлорида и диэтилового эфира из воздуха на твердый сорбент с последующей термодесорбцией и газохроматографическим анализом на приборе с пламенно-ионизационным детектором.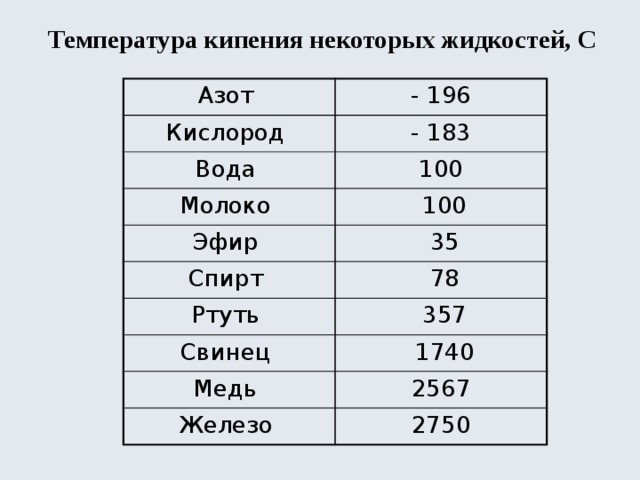 [ …]
[ …]
Так, для экстракции нефтепродуктов с преобладанием алифатических углеводоров можно использовать к-гексан [13], петролейный эфир [41], пентан [42] и др. Многие авторы применяют бензол для экстракции ароматических углеводородов [43]. Широкое применение нашли диэтиловый эфир [И, 44], хлороформ [45], четыреххлористый углерод [29, 32] и др. Однако ни один их этих растворителей не является селективным по отношению к нефтепродуктам и извлекает вместе с ними и другие классы органических соединений. Поэтому при выборе наиболее подходящего экстрагента следует учитывать, прежде всего, реальную полноту извлечения смеси углеводородов различного состава, а также удобство в практическом использовании (малая растворимость в воде, большая плотность, высокая температура кипения, малая токсичность, доступность, стоимость и т. д.).[ …]
Насадка для сорбционных трубок состоит из 25% полифенилметилсилок-сановой жидкости, нанесенной на ИНЗ-600. Навеску ПФМС-4 растворяют в диэтиловом эфире и заливают носитель при осторожном помешивании. Смесь •оставляют в вытяжном шкафу до полного удаления растворителя и подсушивают на песочной бане при 80—100 °С. Сухой насадкой заполняют сорбционные трубки, подключают их к хроматографу через кран-дозатор и кондиционируют в токе азота 2 ч при 200 °С, нагревая электропечью.[ …]
Смесь •оставляют в вытяжном шкафу до полного удаления растворителя и подсушивают на песочной бане при 80—100 °С. Сухой насадкой заполняют сорбционные трубки, подключают их к хроматографу через кран-дозатор и кондиционируют в токе азота 2 ч при 200 °С, нагревая электропечью.[ …]
Исходный раствор дивишлбензола для градуировки (с = 10 мг/сл?). 250 мг дивинилбензола вносят в мерную колбу вместимостью 25 см3, доводят до метки диэтиловым эфиром и тщательно перемешивают. Срок хранения — 3 дня.[ …]
Сточные воды установок гидратации непредельных углеводородов. Гидратация непредельных углеводородов обогащает стоки гли-колями, простыми и сложными эфирами и другими продуктами, например, побочными продуктами гидратации этилена являются диэтиловый эфир, ацетальдегид и смолоообразные продукты.[ …]
Ход определения. Отобранную пробу 25—1000 мл насыщают хлоридом натрия и приливают соляную кислоту до получения 5%-ной концентрации. Затем проводят экстракцию диэтиловым эфиром. Количество эфира и число экстракций зависят от объема взятой для анализа сточной воды. Общим правилом является многократное экстрагирование малыми порциями эфира. Все эфирные вытяжки соединяют и промывают небольшим количеством разбавленной (1 : 7) соляной кислоты, присоединяя промывные воды к первоначальному раствору.[ …]
Общим правилом является многократное экстрагирование малыми порциями эфира. Все эфирные вытяжки соединяют и промывают небольшим количеством разбавленной (1 : 7) соляной кислоты, присоединяя промывные воды к первоначальному раствору.[ …]
Насадка для хроматографической колонки состоит из полиметилсилокса-повой жидкости, нанесенной в количестве 10% от массы носителя на це-,шт-545. Навеску ПМС-100 растворяют в диэтиловом эфире и в раствор осторожно вносят целит-545, предварительно просушенный при 150 °С в течение 2 ч. Смесь оставляют на некоторое время, затем нагревают на водяной бане для удаления растворителя при осторожном помешивании, не доводя до кипения. После этого насадку переносят в колбу, подсоединяют к вакуумному насосу и в течение 1 ч отсасывают остатки растворителя до полного исчезновения его запаха. Сухой насадкой заполняют хроматографическую колонку, помещают ее в термостат прибора, не подсоединяя к детектору, и кондиционируют 8 ч при 150°С в токе газа-носителя.[ …]
Насадка для хроматографической колонки состоит из 10% (от массы носителя) полифенилметилсилоксановой жидкости, нанесенной на оксид алюминия. Навеску ПФМС-4 растворяют в диэтиловом эфире и раствором заливают соответствующее количество оксида алюминия. Смесь осторожно перемешивают, ставят под вытяжной шкаф для испарения растворителя при комнатной температуре. Затем смесь нагревают при 80—100 °С на песочной бане до полного отсутствия запаха растворителя. Сухой насадкой заполняют хроматографическую колонку, устанавливают ее в термостат колонок прибора в рабочем положении, не подсоединяя к детектору, и кондиционируют 24 ч при 160—170°С в токе газа-носителя.[ …]
Навеску ПФМС-4 растворяют в диэтиловом эфире и раствором заливают соответствующее количество оксида алюминия. Смесь осторожно перемешивают, ставят под вытяжной шкаф для испарения растворителя при комнатной температуре. Затем смесь нагревают при 80—100 °С на песочной бане до полного отсутствия запаха растворителя. Сухой насадкой заполняют хроматографическую колонку, устанавливают ее в термостат колонок прибора в рабочем положении, не подсоединяя к детектору, и кондиционируют 24 ч при 160—170°С в токе газа-носителя.[ …]
Насадка для хроматографической колонки состоит из метилсилоксановой жидкости, нанесенной в количестве 3% от массы носителя на хроматон. Хроматографическую колонку, промытую спиртом, диэтиловым эфиром и высушенную в токе азота при 150 °С, заполняют сухой насадкой, помещают в термостат колонок прибора, не подсоединяя к детектору, и кондиционируют в токе газа-носителя 20 ч при 270 °С.[ …]
Пластинку с нанесенными исследуемыми и стандартными растворами помещают в хроматографическую камеру, на дне которой налит подвижный растворитель: смесь четыреххлористого углерода и диэтилового эфира 1:1. Край пластинки должен быть погружен в растворитель не более чем на 0,5 см. После того как фронт растворителя поднимется на 10 см, пластинку вынимают из камеры и оставляют на несколько минут на воздухе для испарения растворителя. Затем пластинку помещают в сушильный шкаф, нагревают до 160—170°С и выдерживают при этой температуре в течение часа.. После охлаждения орошают пластинку проявляющим реактивом № 1 и сразу же реактивом № 2. В присутствии солана появляется розовое пятно.[ …]
Край пластинки должен быть погружен в растворитель не более чем на 0,5 см. После того как фронт растворителя поднимется на 10 см, пластинку вынимают из камеры и оставляют на несколько минут на воздухе для испарения растворителя. Затем пластинку помещают в сушильный шкаф, нагревают до 160—170°С и выдерживают при этой температуре в течение часа.. После охлаждения орошают пластинку проявляющим реактивом № 1 и сразу же реактивом № 2. В присутствии солана появляется розовое пятно.[ …]
Поэтому необходимо тщательное промывание исходного1капилляра, которое рекомендуется производить следующими растворителями и в следующей последовательности: промывание бензолом (сухим), диэтиловым эфиром, этиловым спиртом, водой, слабым (несколько процентов ) водным раствором аммиака и затем в обратном порядке — водой, спиртом, эфиром , бензолом, и, наконец, растворителем (ацетоном) наносимой стационарной фазы ( динонилфталата ) .[ …]
Универсальным и доступным осушителем для органических соединений является безводный карбонат калия. Через поглотительные колонки с поташом проходят практически без изменения пары углеводородов, альдегиды, кетоны, спирты, диэтиловый эфир и многие другие органические соединения. Необходимо отметить, что даже на самых инертных осушителях происходит некоторая адсорбция анализируемых примесей, особенно полярных, что приводит к потерям вещества пробы. Исключение составляют, пожалуй, лишь насыщенные углеводороды [168].[ …]
Через поглотительные колонки с поташом проходят практически без изменения пары углеводородов, альдегиды, кетоны, спирты, диэтиловый эфир и многие другие органические соединения. Необходимо отметить, что даже на самых инертных осушителях происходит некоторая адсорбция анализируемых примесей, особенно полярных, что приводит к потерям вещества пробы. Исключение составляют, пожалуй, лишь насыщенные углеводороды [168].[ …]
Пусковые и антидетонационные жидкости. Для облегчения пуска охлажденных двигателей применяют легковоспламеняющиеся жидкости марки «Холод Д 40» для дизелей и «Арктика» для карбюраторных двигателей. Основой обоих жидкостей является диэтиловый эфир в количестве 54 — 62 %, остальные составляющие: газовый бензин, газопропилнитрат и турбинное масло. В жидкости «Арктика» значительно снижено содержание турбинного масла для уменьшения замасливания электродов запальных свечей и повышения их надежности в процессе работы.[ …]
Концентрирование фенолов из анализируемых проб можно проводить экстракцией соответствующими растворителями. Из органической фазы можно потом опять перевести их в водный раствор обработкой 1 н. раствором щелочи и из водного раствора, подкислив его серной кислотой, выделить в чистом виде двукратной экстракцией диэтиловым эфиром порциями по 10 мл. Эфирный раствор можно выпарить, не теряя при этом фенолов, до объема приблизительно в 20 мкл в приборе, изображенном на рис. 3.3, после добавления 1000 мкл диэтиламина.[ …]
Из органической фазы можно потом опять перевести их в водный раствор обработкой 1 н. раствором щелочи и из водного раствора, подкислив его серной кислотой, выделить в чистом виде двукратной экстракцией диэтиловым эфиром порциями по 10 мл. Эфирный раствор можно выпарить, не теряя при этом фенолов, до объема приблизительно в 20 мкл в приборе, изображенном на рис. 3.3, после добавления 1000 мкл диэтиламина.[ …]
Из водных растворов; к навеске водного раствора (100 .мл) в делительной воронке добавляют 1 мл разбавленной (1 : 1) серной кислоты химически чистой и встряхивают 5 мин. Выделившуюся 2-ме-токси-3,6-дихлорбензойную кислоту экстрагируют 100 мл (5 раз по 20 мл) диэтилового эфира. Полученные экстракты сушат над безводным сульфатом натрия, фильтруют и отгоняют диэтиловый эфир на водяной бане до объема 3—5 мл.[ …]
Аэрозоль в количестве —250 -350 мг улавливают на стекловолокнистый фильтр, пропуская в течение 24 час. анализируемый воздух в объеме 2000— 2400 .к3, ц экстрагируют из фильтра бензолом. После соответствующей обработки растворов каждой фракции снимаются спектральные полосы УФ-светопоглощения пентаповою раствора в объеме 3 мл по оптической плотности, измеренной в кварцевой кювете ([— 1 см) относительно пентана на спектрофотометре с рекордером.[ …]
После соответствующей обработки растворов каждой фракции снимаются спектральные полосы УФ-светопоглощения пентаповою раствора в объеме 3 мл по оптической плотности, измеренной в кварцевой кювете ([— 1 см) относительно пентана на спектрофотометре с рекордером.[ …]
Ход анализа. Фильтр с отобранной пробой помещают в хи-мичсскии стакан, заливают 1и—10 мл дистиллированной воды и осторожно встряхивают 20 мин. Воду сливают в делительную воронку, фильтр промывают небольшим количеством воды, которую вносят в ту же делительную воронку. Затем к водному экстракту приливают 2 мл хлороводородной кислоты и экстрагируют а,а-дихлорпропионовую кислоту диэтиловым эфиром трижды порциями по 5 мл. Экстракты пропускают через слой безводного сульфата натрия в калиброванную пробирку и помещают в стакан с теплой водой для выпаривания диэтилового эфира в токе воздуха до объема 1 мл. На стартовую линию пластинки «Силуфол» наносят 100 мкл пробы и по обеим сторонам от пятна пробы— 100 мкл рабочих стандартных растворов.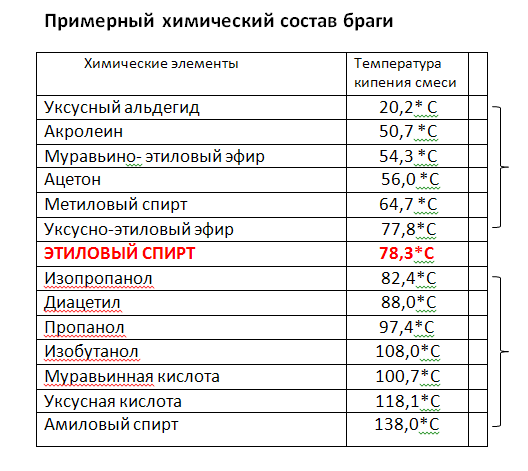 Пластинку с пробами помещают в хроматографическую камеру с системой растворителей, которую вносят в камеру за 30 мин до анализа. Когда подвижная фаза поднимется до верхнего края пластины, ее вынимают из камеры, подсушивают на воздухе, обрабатывают 0,5%-ным спиртовым раствором дифениламина и облучают ультрафиолетовым светом. Вычисляют площадь пятна далапона так же, как и стандартов, и содержание далапона в пробе находят по градуировочному графику.[ …]
Пластинку с пробами помещают в хроматографическую камеру с системой растворителей, которую вносят в камеру за 30 мин до анализа. Когда подвижная фаза поднимется до верхнего края пластины, ее вынимают из камеры, подсушивают на воздухе, обрабатывают 0,5%-ным спиртовым раствором дифениламина и облучают ультрафиолетовым светом. Вычисляют площадь пятна далапона так же, как и стандартов, и содержание далапона в пробе находят по градуировочному графику.[ …]
Обычно извлечение ХОС из проб атмосферного воздуха (фильтры, сорбенты и др.), воды и осадков осуществляют экстракцией дважды перегнанным л-гексаном без нагревания в течение 30-60 мин на механической качалке или с помощью ультразвуковой установки, а из почвы, донных отложений и биоты — смесью гексана и ацетона в соотношении 1:1 или 12 В случае тканей животных экстракцию выполняют смесью гексана и диэтилового эфира (9:1) или гексана и бензола (3:1). Все экстракты одной пробы объединяют и концентрируют до объема 3-5 мл на вакуумном ротационном испарителе. Очистку экстрактов осуществляют концентрированной серной кислотой порциями до получения бесцветного экстракта. Затем очищенный экстракт нейтрализуют раствором ЫаНСОз промы-вают водой до нейтральной реакции и сушат, фильтруя его через слой безводного сульфата натрия Высушенный экстракт вновь концентрируют на вакуумном ротационном испарителе до объема 0,5-2 мл. При извлечении ХОС из тканей животных навеску образца в сыром виде гомогенизируют и растирают с прокаленным силохромом С-120 или с кварцевым песком, а затем проводят экстракцию, отделяют экстракт фильтрованием или центрифугированием, обрабатывают его 1%-м раствором хлорида натрия и после отделения органического слоя подвергают его сернокислотной очистке [33].[ …]
Очистку экстрактов осуществляют концентрированной серной кислотой порциями до получения бесцветного экстракта. Затем очищенный экстракт нейтрализуют раствором ЫаНСОз промы-вают водой до нейтральной реакции и сушат, фильтруя его через слой безводного сульфата натрия Высушенный экстракт вновь концентрируют на вакуумном ротационном испарителе до объема 0,5-2 мл. При извлечении ХОС из тканей животных навеску образца в сыром виде гомогенизируют и растирают с прокаленным силохромом С-120 или с кварцевым песком, а затем проводят экстракцию, отделяют экстракт фильтрованием или центрифугированием, обрабатывают его 1%-м раствором хлорида натрия и после отделения органического слоя подвергают его сернокислотной очистке [33].[ …]
Подобным же образом концентрируют и группу органических оснований. Подкислив дистиллят (Л1), где находятся летучие основания и нейтральные соединения, отгоняют из кислой среды нейтральные соединения (£>3), а в остатке ( 9) в небольшом объеме остаются фосфорнокислые соли летучих органических оснований.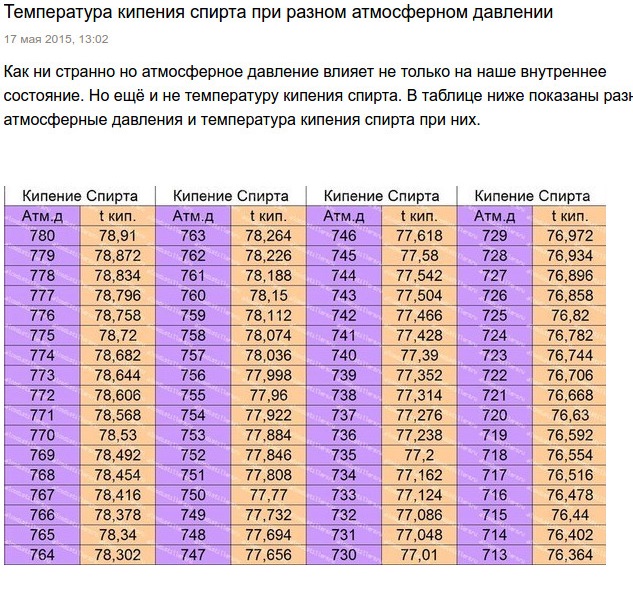 Этот остаток (/?9) подщелачивают и выделившиеся органические основания либо прямо экстрагируют многократно диэтиловым эфиром (512), либо отгоняют в раст-. вор хлористоводородной кислоты для получения их менее летучих солянокислых солей.[ …]
Этот остаток (/?9) подщелачивают и выделившиеся органические основания либо прямо экстрагируют многократно диэтиловым эфиром (512), либо отгоняют в раст-. вор хлористоводородной кислоты для получения их менее летучих солянокислых солей.[ …]
Предлагаемый метод извлечения железа, цинка и фосфата натрия из шламов, образующихся при обработке стальных поверхностей фосфорной кислотой, состоит в его растворении в горячей соляной кислоте, фильтровании для удаления примесей и масел и экстрагировании Ре3+ изопропил этилом. Затем органическую фазу реэкстрагировали водой и получали раствор хлорида железа. Выделенное в водную фазу Ре3+ осаждали едким натром, а цинк экстрагировали диэтиловым эфиром фосфорной кислоты с ими-додиацетатными группами [39].[ …]
Лучшим методом определения в воздухе низких концентраций сераорганических соединений является газовая хроматография1 с ПФД. Поскольку сернистые соединения взаимодействуют с активным углем, для концентрирования из воздуха примесей этих веществ применяют силикагель [324], пористые полимерные сорбенты (ХАД-4 и тенакс) при комнатной температуре [325] или колоночные сорбенты при глубоком охлаждении ловушки [29]. Эффективность десорбции сконцентрированных примесей ацетоном или диэтиловым эфиром составляет примерно 95% [325].[ …]
Эффективность десорбции сконцентрированных примесей ацетоном или диэтиловым эфиром составляет примерно 95% [325].[ …]
Градуировочную характеристику устанавливают методом абсолютной градуировки на стандартных растворах дивинилбензола (по м-этилстиролу). Каждую серию, состоящую из 6-ти растворов, готовят в мерных колбах вместимостью 50 см3. Для этого в каждую колбу вносят рабочий раствор для градуировки в соответствии с табл. 1, доводят объем диэтиловым эфиром до метки и тщательно перемешивают.[ …]
Из растительного материала: 10—50 г высушенного, измельченного и просеянного через сито (d = 2 мм) растительного материала (зеленые растения, солома, зерно,), помещают в круглодонную колбу емкостью 1 л, приливают десяти-, пятнадцатикратный объем б н. НС1 и кипятят 2 часа с обратным холодильником. Гомо-генат фильтруют через стеклянный фильтр (№ 2 или 3), остаток на фильтре промывают несколькими порциями 1 н. НС1 (общий объем 50—150 мл). Фильтраты объединяют, переносят в делительную воронку емкостью 1 л и трижды экстрагируют диэтиловым эфиром при 25° (100—75 и 75 мл).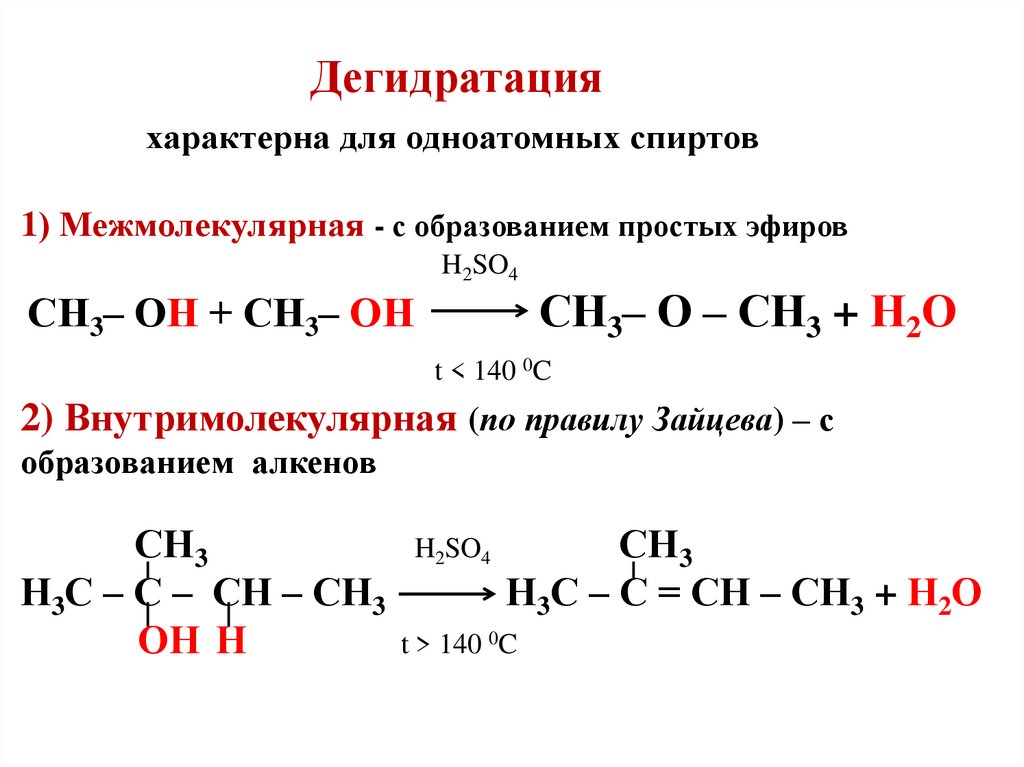 Оставшийся на фильтре осадок переносят в небольшую колбу, промывают несколькими порциями подкисленного диэтилового эфира (1 мл концентрированной НС1 на 100 мл эфира) при встряхивании и эфир фильтруют. Эфирные экстракты объединяют, высушивают над Na2S04, фильтруют и растворитель упаривают досуха.[ …]
Оставшийся на фильтре осадок переносят в небольшую колбу, промывают несколькими порциями подкисленного диэтилового эфира (1 мл концентрированной НС1 на 100 мл эфира) при встряхивании и эфир фильтруют. Эфирные экстракты объединяют, высушивают над Na2S04, фильтруют и растворитель упаривают досуха.[ …]
Нитрование проводят на кипящей водяной бане в течение 45 мин при использовании нитрующей cMtui из азиШои (d — 1430 — i5 ü кг/м3) и серной (d = 1840 т/м3) кислот в соотношении 1:1 и 20 мин при использовании iiaipaTa калия в концентрированной серной кислоте (2 г KN03 в 20-30 см3 концентрированной h3S04). После окончания нитроваиия раствор переносят в делительиую воронку, в которой находится 25 см3 охлажденной воды. Такой же водой трижды ополаскивают колбу для нитрования, собирая воду в делительной воронке. Трижды экстрагируют нитропродукты 10 см3 диэтилового эфира. Первый раз экстрагируют 10 мин, следующие — по 3 мин. Экстракт смешивают с 5 см3 раствора NaOH (50 г/дм3), взбалтывая до получения бесцветного водного слоя. Отделив водный слой, экстракт фильтруют через слой безводного Na2S04, переносят в коническую колбу вместимостью 50-100 см3. Эфиром 2-3 раза ополаскивают делительную воронку и сливают его в колбу. Затем эфир отгоняют, а остаток сушат при 80—100 °С в сушильном шкафу в течение 30 мин. Сухой остаток растворяют в 5 см3 бензола и смешивают с 2 см3 спиртового раствора КОН (5 г КОП на 100 см3 абсолютированного этилового спирта). Точно через 5 мин раствор фотометрируют при = 520 -г 550 нм (желтый светофильтр). Голубая окраска раствора устойчива в течение 10—15 мин.[ …]
Отделив водный слой, экстракт фильтруют через слой безводного Na2S04, переносят в коническую колбу вместимостью 50-100 см3. Эфиром 2-3 раза ополаскивают делительную воронку и сливают его в колбу. Затем эфир отгоняют, а остаток сушат при 80—100 °С в сушильном шкафу в течение 30 мин. Сухой остаток растворяют в 5 см3 бензола и смешивают с 2 см3 спиртового раствора КОН (5 г КОП на 100 см3 абсолютированного этилового спирта). Точно через 5 мин раствор фотометрируют при = 520 -г 550 нм (желтый светофильтр). Голубая окраска раствора устойчива в течение 10—15 мин.[ …]
Алифатические амины, растворы в толуоле. Основной раствор. Получают из того препарата, которым загрязнена сточная вода. Навеску 0,3—0,4 г технического продукта (АНП или другой марки) помещают в круглодонную колбу, приливают 100 мл дистиллированной воды, добавляют 5 мл: концентрированной хлористоводородной кислоты и перегоняют с водяным паром, собирая 200 мл отгона. К остатку в колбе приливают 50%-ный раствор-едкого натра до щелочной реакции по фенолфталеиновой бумаге и сверх того еще 3 мл избытка, насыщают раствор хлоридом натрия и извлекают амины тремя порциями диэтилового эфира по 20 мл каждая. Эфирные вытяжки соединяют, высушивают безводным сульфатом, натрия, фильтруют через сухой фильтр, собирая раствор в , предварительнЬ взвешенную маленькую колбу, и отгоняют эфир. Колбу с остатком аминов оставляют на некоторое-время для удаления последних следов эфира и взвешивают ее. По массе выделенных аминов и найеске препарата АНП рассчитывают содержание аминов в последнем.[ …]
Эфирные вытяжки соединяют, высушивают безводным сульфатом, натрия, фильтруют через сухой фильтр, собирая раствор в , предварительнЬ взвешенную маленькую колбу, и отгоняют эфир. Колбу с остатком аминов оставляют на некоторое-время для удаления последних следов эфира и взвешивают ее. По массе выделенных аминов и найеске препарата АНП рассчитывают содержание аминов в последнем.[ …]
Пластинки с нанесенными растворами помещают в хроматографическую камеру, на дно которой за 30 мин до начала хроматографирования наливают подвижный растворитель.[ …]
Ход анализа. Пробу воздуха из газовой пипетки вытесняют насыщенным раствором хлорида натрия со скоростью 0,1 л/мин в охлажденную сухим льдом сорбционную трубку с насадкой. Затем пробу вводят в хроматографическую колонку с помощью крана-дозатора после нагревания сорбционной трубки с пробой при 50 °С в течение 3 мин с помощью трубчатой электрической печи для хроматографического разделения в условиях: температура термостата колонок 35°С, испарителя — 50°С; расход азота и водорода по 45 мл/мин, воздуха — 400 мл/мин; скорость диаграммной ленты 600 мм/ч; времена удерживания этилхлорида 3 мни 30 с, диэтилового эфира — 5 мин 15 с. [ …]
[ …]
Для выяснения истинной природы эндогенного (т. е. синтезируемого в растениях) ауксина до сих пор проводятся интенсивные исследования с использованием современных химических, физических и биологических методов. Как мы уже говорили, первое выделение ауксина из растений было достигнуто благодаря способности гормона диффундировать из ткани растения в подходящую инертную среду, например агаровый гель. Этот метод используют и сейчас, и полученный таким способом ауксин называют диффундирующим. Обычно же ауксины экстрагируют из растительных тканей органическими растворителями, такими, как диэтиловый эфир или метанол. Ауксины в диффузатах и экстрактах даже из одной и той же ткани часто различаются как в количественном, так и в качественном отношениях.[ …]
Поведение полос валентных и деформационных ОН-колебаний воды при ее взаимодействии через Н-связь с органическими соединениями было предметом изучения многих авторов. Тем не менее ввиду сложности наблюдаемого поглощения ОН-групп, особенно в области их валентных колебаний, до настоящего времени спорным является отнесение полос поглощения воды в системе вода— растворитель. Окончательно не решен вопрос о типах ас-сопиятов, образуемых полой, растворенной в органических соединениях- Ранее Чулановским [132] высказывалось мнение, что даже при концентрации воды ниже 1 % в четыреххлористом углероде, ацетоне, диэтиловом эфире образуются не смешанные комплексы, а комплексы самой воды. К такому же выводу пришел и Буланин [133], анализируя поведение полосы 2100 см 1 воды, растворенной в диоксане, ацетоне, метилэтилкетоне (содержание воды варьировалось в пределах от 50 до 5%).[ …]
Окончательно не решен вопрос о типах ас-сопиятов, образуемых полой, растворенной в органических соединениях- Ранее Чулановским [132] высказывалось мнение, что даже при концентрации воды ниже 1 % в четыреххлористом углероде, ацетоне, диэтиловом эфире образуются не смешанные комплексы, а комплексы самой воды. К такому же выводу пришел и Буланин [133], анализируя поведение полосы 2100 см 1 воды, растворенной в диоксане, ацетоне, метилэтилкетоне (содержание воды варьировалось в пределах от 50 до 5%).[ …]
Температура — кипение — эфир
Cтраница 2
Однако, вопреки данным 4о э2, реакция протекает уже при температуре кипения эфира ( 36 С) и завершается за 1.5 — 2 часа.
[16]
Растворение 1 2324 г нафталина в 88 26 г этилового эфира повысило температуру кипения эфира на 0 234 С по сравнению с температурой кипения чистого эфира 34 0 С.
[17]
При других непрерывных процессах этерификации температура колонны поддерживалась на 5 — 10 выше температуры кипения эфира.
[18]
Для завершения реакпии смесь нагревают на водянной бане в течение 2 ч при температуре кипения эфира, йшавший белый кристаллический осадок отфильтровывают многократно промывают на фильтре абсолютным эфиром и высушивают в вакуум-эксикаторе над концентрированной серной кислотой.
[19]
Если же температура кипения алкооля больше 100, то разность температуры кипения алкооля минус температура кипения эфира будет отрицательная, и эфир будет иметь высшую точку кипения, чем алкооль.
[20]
Растворение магния и образозачие магнийорг нкческих соединений для простейших галоидных соединений обычно легко проходит при температуре кипения эфира, причем эфир кипит без внешнего нагревания благодаря теплоте реакции.
[21]
После прибавления раствора хлористого этила удаляют баню со льдом, в течение часа повышают температуру до температуры кипения эфира и кипятят 15 мин. Затем охлаждают реакционную смесь ниже 10 и при перемешивании прибавляют в течение часа холодный раствор 44 г ( 1 0 моль) окиси этилена в 100 мл эфира.
[22]
Триизоамилбор, ( i — C5Hu) 3B, получен из реактива Гриньяра и трехфтористого бора при температуре кипения эфира. Триизоамилбор-жидкость с неприятным запахом ( напоминающим изоамиловый спирт), окисляющаяся на воздухе без воспламенения, индиферентная к воде.
[23]
После добавления всего хлорангидрида реакционную массу перемешивают I ч при комнатной температуре и дополнительно еще 2 ч при температуре кипения эфира. Жидкость разделяется на два слоя.
[24]
Недостатками большинства предложенных химических методов очистки являются: во-первых, потребность применения вакуумной дистилляции и более высокотемпературного теплоносителя, так как температуры кипения эфиров и метилсилилацетатов значительно выше температур кипения исходных хлорсиланов, и, во-вторых, необходимость регенерации выделенных производных в соответствующие хлорсиланы.
[25]
Шах [89] указал, что сухой эфир может быть применен в качестве растворителя в реакциях Фриделя-Крафтса только в тех случаях, когда температура реакции лежит ниже температуры кипения эфира, в противном случае эфир может вступить в реакцию конденсации.
[26]
Хотя п большинстве случаев постановление гидридом проводилось л диэтиловом эфире, были применены также и другие растворитсли либо для того, чтобы вести реакцию при температуре, превышающей температуру кипения эфира, либо по иным соображениям. Из числа таких растворителей чаще других применялись тстрагидрофуран и, несколько реже, дибутило-вый эфир.
[27]
От 43 до 55 гнался йодистый метил ( при второй перегонке кипел 43 — 45), затем температура быстро поднялась до 181, нисколько не задерживаясь на температуре кипения метиловофосфористого эфира, и все перешло в одном градусе. Таким образом, и здесь изомеризация происходит количественно.
[28]
Обычно эфирный раствор восстанавливаемого соединения прибавляют по каплям к раствору литийачюмииий-гндрида, находящемуся в колбе Скорость прибавления регулируют так, чтобы температура смеси не превышала заданную Когда реакцию ведут при температуре кипения эфира, следует иметь в виду возможность образования пробок в холодильнике большим количеством пароп эфира Смесь оставляют иа некоторое время, не прекращая перемешивания а затем очень медленно, по каплям, прибавляют воду, охлаждая колбу снаружи льдом, пока не прекратится выделение водорода Вода разлагает избыток восстановителя, а также образовав мшеся при реакции комплексные соединения алюминия. Если литнйалюмнинйгидрид находится в растворе в большом количестве, то разложение его избытка воюй не допускается.
Если литнйалюмнинйгидрид находится в растворе в большом количестве, то разложение его избытка воюй не допускается.
[29]
В течение 1 часа из капельной воронки при постоянном перемешивании добавляют раствор 50 г ( 0 35 М) свежеперегнанного 5-нитрофурфурола в 500 мл диэтилового эфира ( температура реакционной смеси при этом была на уровне 18 — 21), затем нагревают на водяной бане при температуре кипения эфира в течение 2 часов. Образовавшийся осадок отфильтровывают от фильтрата, отделяют эфирный слой и экстрагируют водный слой 50 мл эфира. Объединенные эфирные вытяжки промывают водой ( 2 раза по 50-ил), сушат над безводным сульфатом натрия и удаляют эфир отгонкой. Остаток в количестве 42 3г ( 85 1 % от теоретического) представляет собой сырой 5-нитрофурфуриловый спирт в виде красно-коричневой вязкой жидкости. После перегонки в вакууме при 140 — 14Г / 4лш получают чистый 5-нитрофурфуриловый спирт в виде светло-желтой жидкости.
[30]
Страницы:
1
2
3
4
Диэтиловый эфир | 60-29-7
Химические свойства
Диэтиловый эфир неактивен при комнатной температуре, но также могут происходить некоторые реакции. Пероксиды склонны к длительному воздействию кислорода (или света) и превращаются в пероксид эфира (также известный как гидропероксид эфира). Эфир перекиси представляет собой вязкую жидкость, которая практически не испаряется. Антиоксиданты часто добавляют при хранении эфира, чтобы избежать медленного окисления. Диэтиловый эфир растрескивается в случае сильного окисления. В присутствии катализаторов он может распадаться на альдегиды или кислоты. Он реагирует с ангидридом органической кислоты с образованием сложного эфира в присутствии катализатора или реагирует с ангидридом неорганической кислоты с образованием сложного эфира без какого-либо катализатора. Он может реагировать с галогенидами металлов с образованием соединений присоединения, таких как аддукт хлорида церия 2(C2H5)2O•BeCl2. Он может реагировать с галогеном с образованием моногалогенированных эфиров и полигалогенэфиров. Эфир может реагировать с серной кислотой с образованием аддукта.
Пероксиды склонны к длительному воздействию кислорода (или света) и превращаются в пероксид эфира (также известный как гидропероксид эфира). Эфир перекиси представляет собой вязкую жидкость, которая практически не испаряется. Антиоксиданты часто добавляют при хранении эфира, чтобы избежать медленного окисления. Диэтиловый эфир растрескивается в случае сильного окисления. В присутствии катализаторов он может распадаться на альдегиды или кислоты. Он реагирует с ангидридом органической кислоты с образованием сложного эфира в присутствии катализатора или реагирует с ангидридом неорганической кислоты с образованием сложного эфира без какого-либо катализатора. Он может реагировать с галогенидами металлов с образованием соединений присоединения, таких как аддукт хлорида церия 2(C2H5)2O•BeCl2. Он может реагировать с галогеном с образованием моногалогенированных эфиров и полигалогенэфиров. Эфир может реагировать с серной кислотой с образованием аддукта.
Медицинское применение
Его можно использовать для проверки времени кровообращения рука-легкие. После инъекции в вену плеча лекарственная жидкость выходит из правого предсердия, проходит через правый желудочек и достигает легких, а затем выводится из дыхательных путей. В норме пациенту требуется от 4 до 6 секунд, чтобы пациент почувствовал запах эфира с момента инфузии (или от 3 до 8 секунд).
После инъекции в вену плеча лекарственная жидкость выходит из правого предсердия, проходит через правый желудочек и достигает легких, а затем выводится из дыхательных путей. В норме пациенту требуется от 4 до 6 секунд, чтобы пациент почувствовал запах эфира с момента инфузии (или от 3 до 8 секунд).
【Использование и дозировка】
- Взять 1 мл эфира и 2 мл 0,9% раствора натрия хлорида, смешать их и ввести через вену руки.
- Могут возникнуть побочные реакции, такие как временный дискомфорт в груди, кашель и местная боль.
【Меры предосторожности】
- Пациенты с потенциальной сердечной недостаточностью запрещены.
- Не вводите диэтиловый эфир вне кровеносных сосудов по ошибке.
- При воздействии воздуха или при длительном хранении эфир образует взрывоопасную смесь пероксидов эфира и альдегидов и т. д.
【Технические характеристики】 Инъекция: 3 мл.
【Предупреждение】
- Больным с выраженной внутричерепной гипертонией, острым воспалением верхних дыхательных путей, активным туберкулезом, тяжелыми заболеваниями органов дыхания, сердечно-сосудистыми заболеваниями, нарушениями функции печени и почек, тяжелыми метаболическими нарушениями и неконтролируемым сахарным диабетом категорически запрещен эфирный наркоз.
 При избыточном введении во время операции могут возникнуть опасные для органов дыхания проблемы, такие как слабость дыхания, падение кровяного давления, учащенный пульс и расширение зрачков.
При избыточном введении во время операции могут возникнуть опасные для органов дыхания проблемы, такие как слабость дыхания, падение кровяного давления, учащенный пульс и расширение зрачков. - Вдыхание при концентрации 10% может привести к смерти. Предельно допустимая концентрация на рабочем месте 400×10-6.
Первая помощь
- Промыть с мылом при попадании в глаза и на кожу.
- Помощь при дыхании с использованием газообразного кислорода, содержащего 5% углекислого газа, когда дыхание нарушено и лицо синеет.
- Пейте горячий чай и кофе, чтобы предотвратить рвоту.
Производство
Диэтиловый эфир получают дегидратацией этанола при 300°С в присутствии катализатора.
Описание
Диэтиловый эфир входит в состав пусковых жидкостей и используется в качестве
растворитель в производстве синтетических красителей и пластмасс.
Благодаря своим характеристикам диэтиловый эфир нашел широкое применение в
во многих странах в качестве анестетика, но затем был заменен на
другие вещества в 1960-е годы.
Химические свойства
Этиловый эфир представляет собой бесцветную подвижную легковоспламеняющуюся летучую жидкость. Характерный резкий запах.
Порог запаха составляет 0,63 промилле.
Химические свойства
Эфир (C2H5)2, также известный как этиловый эфир, представляет собой бесцветную жидкость. Он используется в качестве растворителя, денатуранта и анестетика в медицине. Это органическое соединение, в котором два углеводородных радикала соединены атомом кислорода.
Физические свойства
Бесцветная, гигроскопичная, летучая жидкость со сладким резким запахом. Пороговая концентрация запаха
330 частей на миллиард (цитируется по Кейт и Уолтерс, 1992 г. ).
).
История
Эфир был предположительно открыт Раймундом Луллием (1232–1315) около 1275 г.,
хотя в его трудах нет дошедших до нас свидетельств этого. Первооткрыватель эфира часто
приписывают немецкому врачу и ботанику Валериусу Кордусу (1515–1554), который дал
первое описание приготовления эфира в середине 16 века. Кордус назвал вещество
oleum vitrioli dulce, что переводится как сладкое масло купороса. Кордус использовал серную кислоту
(масло купороса) для катализа превращения спирта в эфир. Примерно в то же время
Парацельс (1493–1541), швейцарский врач, которого также называют первооткрывателем эфира, наблюдал
что цыплят благополучно усыпляли, вдыхая пары сладкого купороса. В 1730 г.
Август Зигмунд Фробениус изменил название сладкого купороса на эфир.
Использование
Этиловый эфир
является растворителем, который может вызвать раздражение кожи.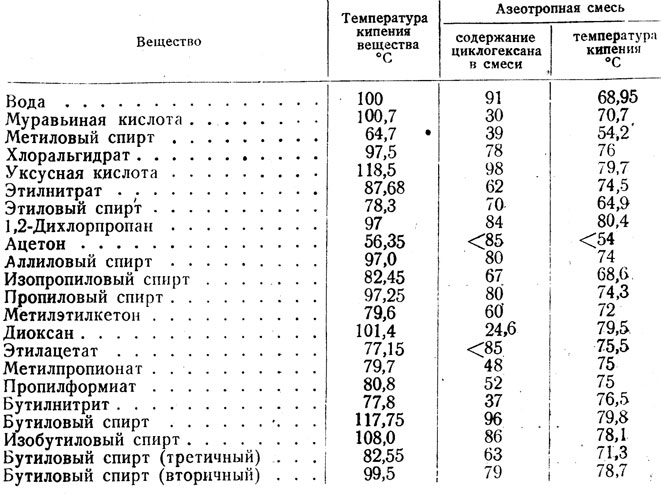 Хотя он считается некомедогенным сырьем, он редко используется в косметике.
Хотя он считается некомедогенным сырьем, он редко используется в косметике.
Использование
Этиловый эфир используется в качестве растворителя жиров, масел, восков, смол, духов и нитроцеллюлозы; при изготовлении пороха; как анестетик; и в органическом синтезе.
Использование
Диэтиловый эфир широко используется в качестве общего
анестетик.
Использование
Эфир применяли местно, вдыхали и употребляли в медицинских целях задолго до того, как его стали использовать в качестве анестетика. Эфир мало растворим в воде (6,9%), но является хорошим растворителем для неполярных органических соединений. Около 65% производимого эфира используется в качестве растворителя восков, жиров, масел, каучуков, смол, нитроцеллюлозы, натурального каучука и других органических веществ. В качестве растворителя он используется в качестве экстрагента для растительных и животных соединений в производстве фармацевтических препаратов и косметики. Еще 25% всего производства эфира используется в химическом синтезе. Это промежуточный продукт, используемый в производстве моноэтаноламина (MEA, C 2 H 7 НЕТ). Эфир используется в производстве реактивов Гриньяра. Реактив Гриньяра имеет общую форму RMgX, где R представляет собой алкильную или арильную группу, а X представляет собой галоген. Реактивы Гриньяра широко используются в промышленном органическом синтезе. Реактив Гриньяра обычно получают путем взаимодействия галогеналкана с магнием в эфирном растворе, например, CH 3 I + MgCH 3 MgI. Эфир является обычной пусковой жидкостью, особенно для дизельных двигателей.
Еще 25% всего производства эфира используется в химическом синтезе. Это промежуточный продукт, используемый в производстве моноэтаноламина (MEA, C 2 H 7 НЕТ). Эфир используется в производстве реактивов Гриньяра. Реактив Гриньяра имеет общую форму RMgX, где R представляет собой алкильную или арильную группу, а X представляет собой галоген. Реактивы Гриньяра широко используются в промышленном органическом синтезе. Реактив Гриньяра обычно получают путем взаимодействия галогеналкана с магнием в эфирном растворе, например, CH 3 I + MgCH 3 MgI. Эфир является обычной пусковой жидкостью, особенно для дизельных двигателей.
Использует
Растворитель для восков, жиров, масел, отдушек, алкалоидов, камедей. Отличный растворитель нитроцеллюлозы при смешивании со спиртом. Важный реагент в органическом синтезе, особенно в реакциях типа Гриньяра и Вюрца. Легко удаляемый экстрагент действующих веществ (гормонов и др. ) из тканей растений и животных. При производстве пороха. В качестве грунтовки для бензиновых двигателей.
) из тканей растений и животных. При производстве пороха. В качестве грунтовки для бензиновых двигателей.
Определение
ЧЭБИ: эфир, в котором атом кислорода связан с двумя этильными группами.
Методы производства
Эфир получают дегидратацией этанола серной кислотой: 2CH 3 CH 2 OH +2H 2 SO 4 → (CH 3 CH 2 90 7 H 6 900 8 8 ) 2 SO 4 + H 2 O. Для контроля нежелательных продуктов реакцию проводят при температуре около 140°C. Из смеси отгоняют летучий эфир. Эфир также можно получить синтезом Вильямсона. В этой реакции этанол реагирует с натрием с образованием этанолята натрия (Na+C 2 H 5 O?). Этанолат натрия затем реагирует с хлорэтаном с образованием эфира и хлорида натрия: Na+C 2 H 5 O? +C 2 H 5 Cl → C 2 H 5 OC 2 H 5 +NaCl. Эфир также производится как побочный продукт при производстве этанола.
Эфир также производится как побочный продукт при производстве этанола.
Определение
диэтиловый эфир: бесцветный легковоспламеняющийся летучий эфир, C2H5OC2H5; р.д. 0,71;т.пл. –116°С; б.п. 34,5°С. Его можно получить с помощью синтеза Вильямсона. Это анестетик и полезный органический растворитель.
Общее описание
Прозрачная бесцветная жидкость с запахом анестетика. Температура вспышки -49°F. Менее плотный, чем вода, и мало растворим в воде. Поэтому плавает на воде. Пары тяжелее воздуха. Используется в качестве растворителя и для производства других химикатов.
Реакции воздуха и воды
Легко воспламеняется. Легко окисляется на воздухе с образованием нестабильных пероксидов, которые могут самопроизвольно взрываться [Bretherick, 1979 с.151-154, 164]. Смесь жидкого воздуха и диэтилового эфира самопроизвольно взорвалась [MCA Case History 616 (1960)].
Профиль реактивности
Иногда происходили взрывы при хранении гидрида алюминия в эфире. Взрывы связывают с присутствием примеси углекислого газа в эфире [J. амер. хим. соц. 70:877 (1948)]. Диэтиловый эфир и триоксид хрома бурно реагируют при комнатной температуре. Твердый пероксид ацетила при контакте с эфиром или любым летучим растворителем может сильно взорваться. 5-граммовая порция эфира взорвалась при переноске [Chem. англ. Новости 27:175(1949)]. Нитрозилперхлорат воспламеняется и взрывается с диэтиловым эфиром. Смесь эфира и озона образует альдегид и уксусную кислоту и тяжелую жидкость, перекись этила, взрывчатое вещество [Mellor 1:911 (1946-1947)].
Опасность
Депрессант ЦНС при вдыхании и на коже
поглощение. Очень легко воспламеняется, сильная опасность возгорания и взрыва при воздействии тепла или пламени. Формы
взрывоопасные пероксиды. Пределы взрываемости в воздухе 1,85–
Пределы взрываемости в воздухе 1,85–
48%.
Опасность для здоровья
Острая токсичность диэтилового эфира низкая. Вдыхание высоких концентраций может
вызвать седативный эффект, потерю сознания и паралич дыхания. Эти эффекты обычно
обратимы при прекращении воздействия. Диэтиловый эфир слегка раздражает глаза.
и кожу, но обычно не вызывает необратимых повреждений. Повторный контакт может
вызвать сухость и растрескивание кожи из-за удаления кожного сала. Жидкость не
легко всасывается через кожу, отчасти из-за его высокой летучести. Диэтиловый эфир
слаботоксичен при приеме внутрь. Диэтиловый эфир считается имеющим адекватное предупреждение
характеристики.
Нет никаких доказательств канцерогенности диэтилового эфира и репродуктивных эффектов.
были сообщены. Хроническое воздействие паров диэтилового эфира может привести к потере
аппетит, истощение, сонливость, головокружение и другие эффекты центральной нервной системы.
Опасность для здоровья
Этиловый эфир является наркотическим веществом и оказывает легкое раздражающее действие на кожу, глаза и нос; при низких концентрациях Вдыхание его паров при высоких концентрациях, более 1% (по объему в воздухе), может быть опасным для здоровья человека.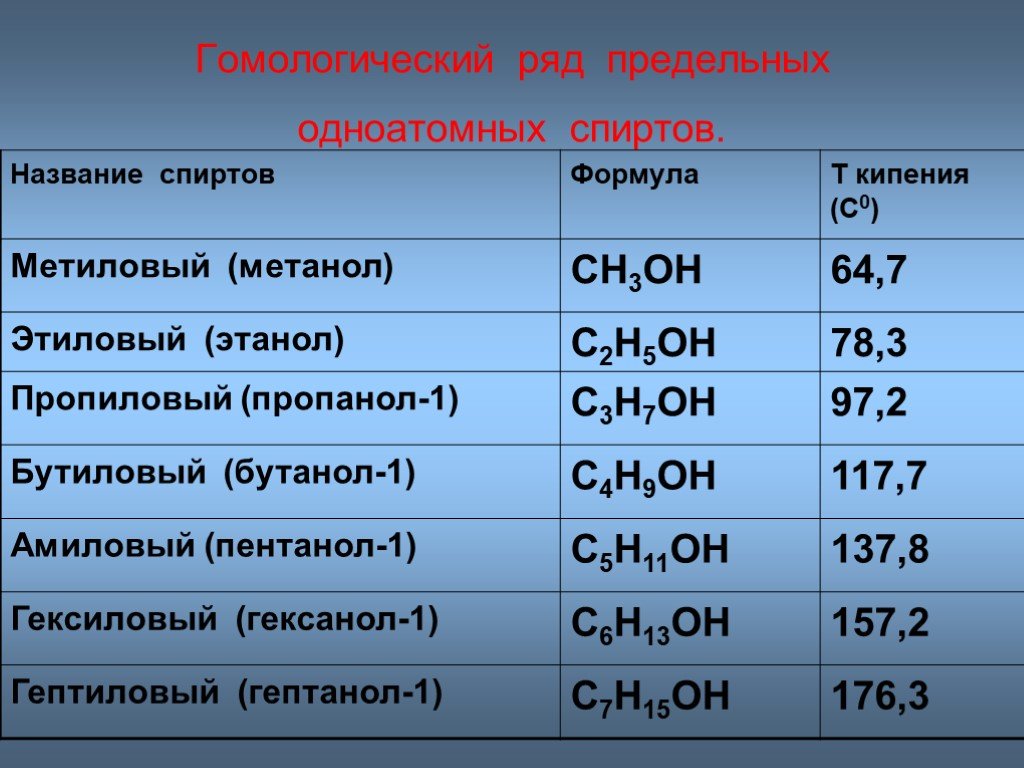 Концентрация 3,5–6,5% может оказывать анестезирующее действие; При превышении этой концентрации может произойти остановка дыхания (Hake and Rowe, 1963). Вдыхание 10% этилового эфира по объему в воздухе может привести к смерти (ACGIH 1986). Повторяющееся воздействие этого соединения вызывало симптомы истощения, потери аппетита, сонливости и головокружения.
Концентрация 3,5–6,5% может оказывать анестезирующее действие; При превышении этой концентрации может произойти остановка дыхания (Hake and Rowe, 1963). Вдыхание 10% этилового эфира по объему в воздухе может привести к смерти (ACGIH 1986). Повторяющееся воздействие этого соединения вызывало симптомы истощения, потери аппетита, сонливости и головокружения.
Было обнаружено, что острая пероральная токсичность этилового эфира была от низкой до умеренной и варьировала в зависимости от вида. Проглатывание 300–350 мл может привести к летальному исходу для человека.
Значение LC50, вдыхание (мыши): 6500 частей на миллион/100 мин
Значение LD50, пероральное (крысы): 1215 мг/кг
По сравнению с другими анестетиками, диэтиловый эфир менее токсичен, чем метоксифлуоран ], галотаном и изофлураном на подопытных животных при многократном воздействии субанестезирующих концентраций (Chenoweth et al. 19).72; Стивенс и др. 1975). В концентрации 2000 ppm он не вызывал гепатотоксических реакций. Мэтт и др. (1983) сообщили, что воздействие эфира в течение 6 минут вызывало значительное и переменное повышение сывороточного пролактина у самок золотистого хомячка
Мэтт и др. (1983) сообщили, что воздействие эфира в течение 6 минут вызывало значительное и переменное повышение сывороточного пролактина у самок золотистого хомячка
. В отличие от летучих углеводородов, остановка дыхания, вызванная этиловым эфиром, была обратимой (Swann et al., 1974). Такая обратимость, однако, наблюдалась при более низкой концентрации, около 105 частей на миллион, при 5-минутном периоде воздействия на мышей. Нет никаких сообщений о его канцерогенности для животных или людей.
Опасность для здоровья
Вдыхание паров может вызвать головную боль, тошноту, рвоту и потерю сознания. Контакт с глазами будет раздражать. Контакт кожи с одеждой, смоченной химическим веществом, может вызвать ожоги.
Пожарная опасность
Диэтиловый эфир чрезвычайно легко воспламеняется (рейтинг NFPA = 4) и является одним из наиболее
опасные пожары, обычно встречающиеся в лаборатории, из-за ее
летучесть и чрезвычайно низкая температура воспламенения. Пары эфира могут воспламениться от горячего
Пары эфира могут воспламениться от горячего
поверхностей, таких как горячие плиты и разряды статического электричества, и поскольку пар
тяжелее воздуха, он может перемещаться на значительное расстояние до источника воспламенения и вспыхивать
назад. Пары эфира образуют с воздухом взрывоопасные смеси при концентрации 1,9до 36%
(по объему). Для эфира следует использовать двуокись углерода или сухие химические огнетушители.
пожары. Диэтиловый эфир образует нестабильные перекиси на воздухе в результате реакции, которая
продвигается светом; присутствие этих пероксидов может привести к взрывоопасным остаткам
при перегонке.
Пожарная опасность
Поведение в огне: Пары тяжелее воздуха и могут перемещаться на значительное расстояние до источника воспламенения и вспыхивать обратно. Бурно разлагается при нагревании.
Воспламеняемость и взрывоопасность
Диэтиловый эфир чрезвычайно легко воспламеняется (рейтинг NFPA = 4) и является одним из наиболее опасных пожароопасных веществ, обычно встречающихся в лаборатории, из-за его летучести и чрезвычайно низкой температуры воспламенения. Пары эфира могут воспламеняться от горячих поверхностей, таких как электрические плиты и разряды статического электричества, а поскольку пары тяжелее воздуха, они могут перемещаться на значительное расстояние до источника воспламенения и возвращаться обратно. Пары эфира образуют с воздухом взрывоопасные смеси при концентрации 1,9до 36% (по объему). Для тушения эфирных пожаров следует использовать двуокись углерода или сухие химические огнетушители. Диэтиловый эфир образует нестабильные пероксиды на воздухе в реакции, которой способствует свет; присутствие этих пероксидов может привести к взрывоопасным остаткам при перегонке.
Пары эфира могут воспламеняться от горячих поверхностей, таких как электрические плиты и разряды статического электричества, а поскольку пары тяжелее воздуха, они могут перемещаться на значительное расстояние до источника воспламенения и возвращаться обратно. Пары эфира образуют с воздухом взрывоопасные смеси при концентрации 1,9до 36% (по объему). Для тушения эфирных пожаров следует использовать двуокись углерода или сухие химические огнетушители. Диэтиловый эфир образует нестабильные пероксиды на воздухе в реакции, которой способствует свет; присутствие этих пероксидов может привести к взрывоопасным остаткам при перегонке.
Химическая реактивность
Реакция с водой Нет реакции; Реактивность с обычными материалами: Нет реакции; Стабильность при транспортировке: стабильно; Нейтрализующие агенты для кислот и едких веществ: Не применимо; Полимеризация: Не относится; Ингибитор полимеризации: Не применимо.
Промышленное использование
Диэтиловый эфир в качестве
коммерческий продукт доступен в нескольких сортах и используется в качестве экстракции
растворитель, реакционный растворитель и как общий анестетик. Этиловый эфир является отличным
Этиловый эфир является отличным
растворитель для алкалоидов, красителей, жиров, камедей, масел, смол и восков. Смеси этила
эфир и этанол являются отличными растворителями для нитрата целлюлозы, используемого в производстве
пироксилина, в растворах коллодия и пироксилиновых пластмассах. Этиловый эфир используется в
восстановление уксусной кислоты из водных растворов в ацетате целлюлозы и
пластмассовая промышленность. Он используется в качестве пускового топлива для дизельных двигателей и в качестве денатуранта в
препараты денатурированного этанола. Использование реакций синтеза Гриньяра и Вюрца-Филлига
диэтиловый эфир в качестве безводной инертной реакционной среды.
Профиль безопасности
Умеренно токсичен для
человека при приеме внутрь. Отравить экспериментально
подкожным путем. Умеренно токсичен по
внутрибрюшинный и внутривенный пути.
сильно токсичен при вдыхании. Человеческий системный
эффекты при вдыхании: обонятельные изменения.
Сообщаются данные о мутациях. Серьезный взгляд и
умеренное раздражение кожи. Этиловый эфир не
коррозионные или опасно реактивные. Это должно
не считаться безопасным для людей
вдохнуть или проглотить. Это депрессант от
центральную нервную систему и способна
вызывает интоксикацию, сонливость, сопор,
и бессознательное состояние. Смерть из-за
дыхательная недостаточность может быть следствием тяжелой
и продолжение воздействия.
Очень опасный пожар и взрыв
опасность при воздействии тепла или пламени. А
опасность хранения. Он самоокисляется с образованием взрывоопасных полимерных 1-оксипероксидов.
Взрывная реакция с триазидом бора,
трифторид брома, пентафторид брома,
хлорная кислота, нитрат уранила + свет, дерево
экстракты мякоти + тепло. Бурная реакция или
воспламенение при контакте с галогенами (например,
бром, хлор), интергалогены (например,
гептафторид йода), окислители (например, серебро
перхлорат, нитрозилперхлорат, нитрил
перхлорат, хромилхлорид, фтор
нитраты, марганцовая кислота, азотная кислота,
перекись водорода, пероксодисерная кислота,
оксид йода (VⅡ), пероксид натрия, озон,
и жидкий воздух), сера и соединения серы
(например, сера при сушке перекисным
эфир, сульфурилхлорид). Может реагировать
Может реагировать
энергично перекисью ацетила, воздухом,
бромоазид, ClF3, CrO3, Cr(OCl)2, LiAlh3,
NOClO4,02, NClO2, (h3so4 +
перманганаты), K2O2, [(C2H5)3di + воздух],
[(Ch4)d + воздух]. Для борьбы с огнем используйте спирт
пена, CO2, сухая химия. Используется в
производство наркотических средств. При нагревании
при разложении выделяет едкий дым и
раздражающие пары. См. также ЭФИР.
Потенциальное воздействие
Этиловый эфир используется в качестве растворителя для
воски, жиры, масла, отдушки, алкалоиды, красители, камеди, смолы,
нитроцеллюлоза, углеводороды, сырой каучук и бездымные
пудра. Он также используется в качестве ингаляционного анестетика; хладагент; в дизельных топливах; в химчистке; как экстрагент; и
как химический реагент для различных органических реакций
Экологическая судьба
Фотолитический. Константа скорости реакции этилового эфира и радикалов ОН в атмосфере при
300 К составляет 5,4 х 10 -12 см 3 /молекула?сек (Hendry and Kenley, 1979).
Химический/физический. Атмосферное окисление этилового эфира радикалами ОН в присутствии
оксид азота давал этилформиат в качестве основного продукта. Второстепенные продукты включали формальдегид
и диоксид азота. В отсутствие оксида азота продукты представляли собой этилформиат и
ацетальдегид (Уоллингтон и Джапар, 1991).
Этиловый эфир не гидролизуется (Kollig, 1993).
хранилище
Эфир
следует применять только в помещениях, свободных от источников воспламенения (включая электроплитки, лампы накаливания, паровые бани), и это вещество следует хранить в плотно закрытых металлических емкостях в местах, отделенных от окислителей. Из-за склонности диэтилового эфира к образованию перекисей при контакте с воздухом контейнеры должны быть датированы при получении и в момент их открытия. Диэтиловый эфир обычно поставляется с добавками, препятствующими образованию перекиси; перегонка удаляет эти ингибиторы и делает жидкость более склонной к образованию перекиси.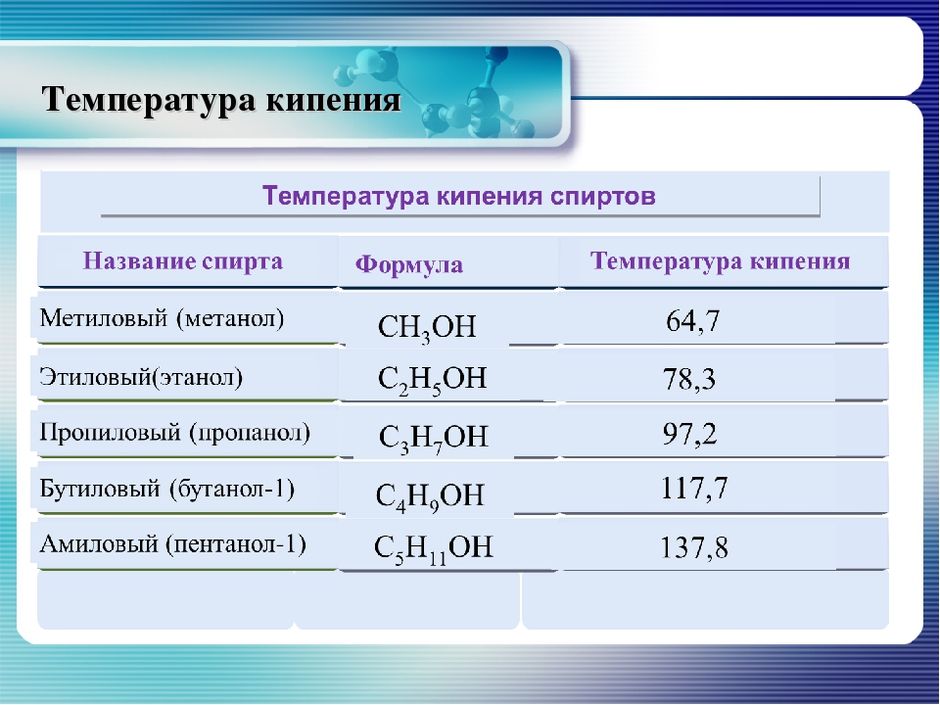 Материал, содержащий пероксиды, должен быть обработан для уничтожения пероксидов перед использованием или утилизирован должным образом.
Материал, содержащий пероксиды, должен быть обработан для уничтожения пероксидов перед использованием или утилизирован должным образом.
Доставка
UN1155 Диэтиловый эфир или этиловый эфир, опасность
Класс: 3; Метки: 3-легковоспламеняющаяся жидкость
Методы очистки
Обычными примесями являются вода, EtOH, диэтилпероксид (взрывоопасный при концентрации) и альдегиды. Пероксиды [определяются по выделению йода из слабокислых (HCl) растворов KI или по синей окраске эфирного слоя при взбалтывании 1 мг Na2Cr2O7 и 1 капли разбавленного h3SO4 в 1 мл воды с 10 мл эфира] могут быть удалены. несколькими различными способами. Простейший метод заключается в пропускании сухого эфира через колонку с активированным оксидом алюминия (80 г Al2O3/700 мл эфира). Чаще всего 1 л эфира многократно встряхивают с 5-10 мл раствора, содержащего 6,0 г сульфата железа и 6 мл концентрированного H3SO4 в 110 мл воды. Также можно использовать 10% водный раствор Na2SO3 или хлорид двухвалентного олова. Затем эфир промывают водой, сушат в течение 24 часов с помощью CaCl2, фильтруют и дополнительно сушат, добавляя натриевую проволоку, до тех пор, пока он не станет светлым. Эфир хранят в темном прохладном месте до отгонки от натрия перед употреблением. Пероксиды также можно удалить, смачивая эфир небольшим количеством воды, затем добавляя избыток LiAlh5 или Cah3 и оставляя на несколько часов. (Это также сушило эфир.) Вернер [Аналитик 58 335 1933] удаляли перекиси и альдегиды, добавляя 8 г AgNO3 в 60 мл воды к 1 л эфира, затем 100 мл 4% NaOH и встряхивая в течение 6 минут. Fierz-David [Chimia 1 246 1947] смешал 1 л эфира с 10 г цинк-медной пары. (Этот реагент готовят путем суспендирования цинковой пыли в 50 мл горячей воды, добавления 5 мл 2М HCl и декантации через 20 секунд, дважды промывая водой, покрывая 50 мл воды и 5 мл 5% сульфата меди при перемешивании. Жидкость декантируют и отбрасывают, а остаток промывают три раза по 20 мл этанола и дважды по 20 мл диэтилового эфира).
Также можно использовать 10% водный раствор Na2SO3 или хлорид двухвалентного олова. Затем эфир промывают водой, сушат в течение 24 часов с помощью CaCl2, фильтруют и дополнительно сушат, добавляя натриевую проволоку, до тех пор, пока он не станет светлым. Эфир хранят в темном прохладном месте до отгонки от натрия перед употреблением. Пероксиды также можно удалить, смачивая эфир небольшим количеством воды, затем добавляя избыток LiAlh5 или Cah3 и оставляя на несколько часов. (Это также сушило эфир.) Вернер [Аналитик 58 335 1933] удаляли перекиси и альдегиды, добавляя 8 г AgNO3 в 60 мл воды к 1 л эфира, затем 100 мл 4% NaOH и встряхивая в течение 6 минут. Fierz-David [Chimia 1 246 1947] смешал 1 л эфира с 10 г цинк-медной пары. (Этот реагент готовят путем суспендирования цинковой пыли в 50 мл горячей воды, добавления 5 мл 2М HCl и декантации через 20 секунд, дважды промывая водой, покрывая 50 мл воды и 5 мл 5% сульфата меди при перемешивании. Жидкость декантируют и отбрасывают, а остаток промывают три раза по 20 мл этанола и дважды по 20 мл диэтилового эфира). Альдегиды могут быть удалены из диэтилового эфира перегонкой гидразина гидросульфата, фенилгидразина или тиосемикарбазида. Пероксиды и окисляемые примеси также удаляли встряхиванием с сильнощелочным раствором KMnO4 (с которым эфир выдерживали в контакте в течение 24 часов), затем промывали водой, концентрировали H3SO4, снова водой, затем сушили (CaCl2) и перегоняли. из натрия или натрийсодержащего бензофенона с образованием кетила. Другие процедуры очистки включают дистилляцию из трифенилметида натрия или бромида бутилмагния и сушку твердым NaOH или P2O5. [Beilstein 1 IV 1314.] Быстрая очистка: То же, что и для 1,4-диоксана.
Альдегиды могут быть удалены из диэтилового эфира перегонкой гидразина гидросульфата, фенилгидразина или тиосемикарбазида. Пероксиды и окисляемые примеси также удаляли встряхиванием с сильнощелочным раствором KMnO4 (с которым эфир выдерживали в контакте в течение 24 часов), затем промывали водой, концентрировали H3SO4, снова водой, затем сушили (CaCl2) и перегоняли. из натрия или натрийсодержащего бензофенона с образованием кетила. Другие процедуры очистки включают дистилляцию из трифенилметида натрия или бромида бутилмагния и сушку твердым NaOH или P2O5. [Beilstein 1 IV 1314.] Быстрая очистка: То же, что и для 1,4-диоксана.
Оценка токсичности
Вдыхание является основным путем воздействия диэтилового эфира.
Воздействие диэтилового эфира на рабочем месте может происходить через:
вдыхание и кожный контакт с этим соединением на рабочих местах
где используется диэтиловый эфир. Воздействие этого химического вещества
также может произойти при вдыхании окружающего воздуха и проглатывании
загрязненной питьевой воды. Хотя редко, преднамеренно
Хотя редко, преднамеренно
Сообщается также о (суицидальном) воздействии.
Промышленное использование диэтилового эфира может привести к его выбросу в
в окружающую среду через различные потоки отходов. На воздухе диэтил
эфир будет существовать в виде пара и будет разлагаться в атмосфере
после взаимодействия с гидроксильными и нитратными радикалами. Период полураспада
этих реакций в воздухе оценивается в 1,2 и
5,8 дня соответственно. В почве и воде ожидается диэтиловый эфир
улетучивание и биоразложение, вероятно, будет медленным процессом.
Биоконцентрация диэтилового эфира в водных организмах низкая.
Несовместимость
Может образовывать взрывоопасную смесь с воздухом.
Несовместим с сильными кислотами; сильные окислители галогены,
сера, соединения серы, вызывающие пожаро- и взрывоопасность. Может образовывать перекиси из воздуха, тепла, солнечного света; май
взорваться, когда контейнер открыт или иным образом
открыт. Разъедает некоторые пластмассы, резину и покрытия. Существование
Разъедает некоторые пластмассы, резину и покрытия. Существование
непроводник, химическое вещество может накапливать статическое электричество
заряды, которые могут привести к воспламенению паров.
Удаление отходов
Концентрированные отходы, не содержащие пероксидов, – жидкость, выделяемая с контролируемой скоростью вблизи
пилотное пламя. Концентрированные отходы, содержащие пероксидыперфорация контейнера с отходами с безопасного расстояния
с последующим открытым сжиганием. Проконсультируйтесь с экологическими
регулирующие органы для получения рекомендаций по приемлемой утилизации
практики. Генераторы отходов, содержащих этот загрязнитель
(≥100 кг/мес) должны соответствовать правилам EPA, регулирующим хранение, транспортировку, обработку и утилизацию отходов
межмолекулярных сил. Почему температура кипения пентана (36,1 °C) немного выше, чем у диэтилового эфира (34,6 °C)?
спросил
Изменено
6 лет, 4 месяца назад
Просмотрено
8к раз
$\begingroup$
Обе цепи имеют одинаковую длину, за исключением того, что диэтиловый эфир имеет в середине атом кислорода вместо углерода. Диэтиловый эфир имеет небольшой диполь от атома кислорода, поэтому не должны ли межмолекулярные силы быть сильнее, чем у пентана, который придает ему более высокую температуру кипения?
Диэтиловый эфир имеет небольшой диполь от атома кислорода, поэтому не должны ли межмолекулярные силы быть сильнее, чем у пентана, который придает ему более высокую температуру кипения?
- межмолекулярные силы
$\endgroup$
7
$\begingroup$
Возможно, это не совсем научный ответ, но обратите внимание, почему разветвленные алканы имеют более низкую температуру кипения, чем алканы с прямой цепью. Это связано с неспособностью отдельных молекул «складываться» (если вы хотите получить техническую информацию, это связано с площадью поверхности). Теперь представьте, что молекулы диэтилового эфира складываются друг в друга. Проблема возникает из-за того, что две молекулы кислорода (по две неподеленные пары) на двух отдельных молекулах диэтилового эфира не хотят располагаться друг над другом, поскольку атомы кислорода имеют довольно высокую электронную плотность. Сила отталкивания, вероятно, будет минимальной, о чем свидетельствует незначительная разница температур кипения диэтилового эфира и н-пентана. Однако это только обоснованное предположение.
Сила отталкивания, вероятно, будет минимальной, о чем свидетельствует незначительная разница температур кипения диэтилового эфира и н-пентана. Однако это только обоснованное предположение.
Чтобы усилить мои аргументы, обратите внимание на диэтилсульфид, у которого гораздо более высокая точка кипения. чем н-пентан и диэтиловый эфир. Это может быть связано с большим атомным радиусом (и, следовательно, большей площадью поверхности) серы по сравнению с кислородом. Заряд имеет большую площадь для распределения, что приводит к меньшему отталкиванию между «уложенными друг на друга» атомами серы.
$\endgroup$
1
$\begingroup$
Хотя диэтиловый эфир является полярной молекулой, но из-за стерических затруднений между его молекулами существуют только слабые диполь-дипольные взаимодействия. Поэтому он имеет более низкую температуру кипения, чем пентан
$\endgroup$
1
$\begingroup$
Во-первых, этот эффект очень мал.

 При избыточном введении во время операции могут возникнуть опасные для органов дыхания проблемы, такие как слабость дыхания, падение кровяного давления, учащенный пульс и расширение зрачков.
При избыточном введении во время операции могут возникнуть опасные для органов дыхания проблемы, такие как слабость дыхания, падение кровяного давления, учащенный пульс и расширение зрачков.