Содержание
ХиМиК.ru — IV. Простые функции
17. Соединениями с простыми функциями называются вещества, содержащие функцию только одного рода, хотя бы она была многократно повторена в одной и той же молекуле.
18. Если в молекуле содержится только одна функциональная группа, основную цепь выбирают таким образом, чтобы функциональная группа находилась в этой цепи. Если функциональных групп несколько, то главную цепь выбирают таким образом, чтобы в ней оказалось максимальное число групп.
19. Галогензамещенные соединения называются по наименованиям углеводов родов, производными которых они являются, с добавлением префикса, указывающего природу и число атомов галогена.
20. Названия спиртов и фенолов строятся из названия углеводорода, производными которого они являются, с добавлением суффикса —ол. В соответствии с правилом 1 сохраняются общепринятые названия, как-то: фенол, крезол, нафтол и т. п. Это правило применимо и к гетероциклическим соединениям, например хинолинол.
21. В названиях многоатомных спиртов или фенолов между наименованием углеводорода и суффиксом вставляют частицы -ди-, -три-, -тетра- и т. д.
22. Слово меркаптан в качестве суффикса не применяется. Эта функция (SH) обозначается суффиксом -тиол.
23. Простые эфиры рассматриваются как углеводороды, в которых один или несколько атомов водорода замещены алкоксигруппами. Для симметричных эфиров может быть сохранена ныне принятая номенклатура.
Примеры:
метоксиэтан; метоксиметан, или метиловый эфир
24. Кислород, связанный с двумя атомами углерода одной и той же углеродной цепи, обозначается префиксом эпокси- в тех случаях, когда вещество нецелесообразно называть как циклическое соединение.
Примеры:
окись этилена — эпоксиэтан;
эпихлоргидрин — 3-хлор-1,2-эпоксипропан;
окись тетраметилена — тетрагидрофуран — 1,4-эпоксибутан
25. Сульфиды, дисульфиды, сульфоксиды и сульфоны называют подобно простым эфирам с заменой слова окси соответственно на тио, дитио, сульфинил, сульфонил.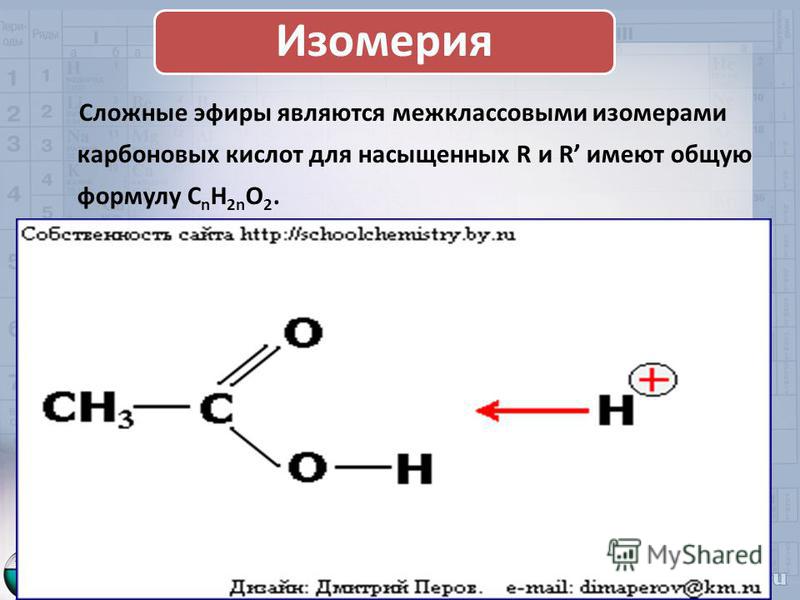
Примеры:
26. Альдегиды обозначаются суффиксом -ал, добавляемым к названию углеводорода, производными которого они являются. Тиоальдегиды — соответственно суффиксом -тиал. Ацетали называются 1,1-диалкоксиалканами.
27. Кетоны получают окончание -он. Дикетоны, трикетоны, тиокетоны обозначаются суффиксами -дион, -трион, -тион.
28. Наименование кетен сохраняется:
29. Для кислот сохраняется правило Женевской номенклатуры. Однако в тех случаях, когда применение этой номенклатуры неудобно, карбоксильную группу рассматривают как заместитель и наименование кислоты образуют, добавляя к названию углеводорода окончание -карбоновая кислота.
30. Кислоты, в которых атом или атомы кислорода замещены атомом или атомами серы, называются согласно Женевской номенклатуре. Примеры: этантиокислота, тиоловая, тионовая, тиолтионовая. Рассматривая карбоксил как заместитель, их можно называть карботиокислотами.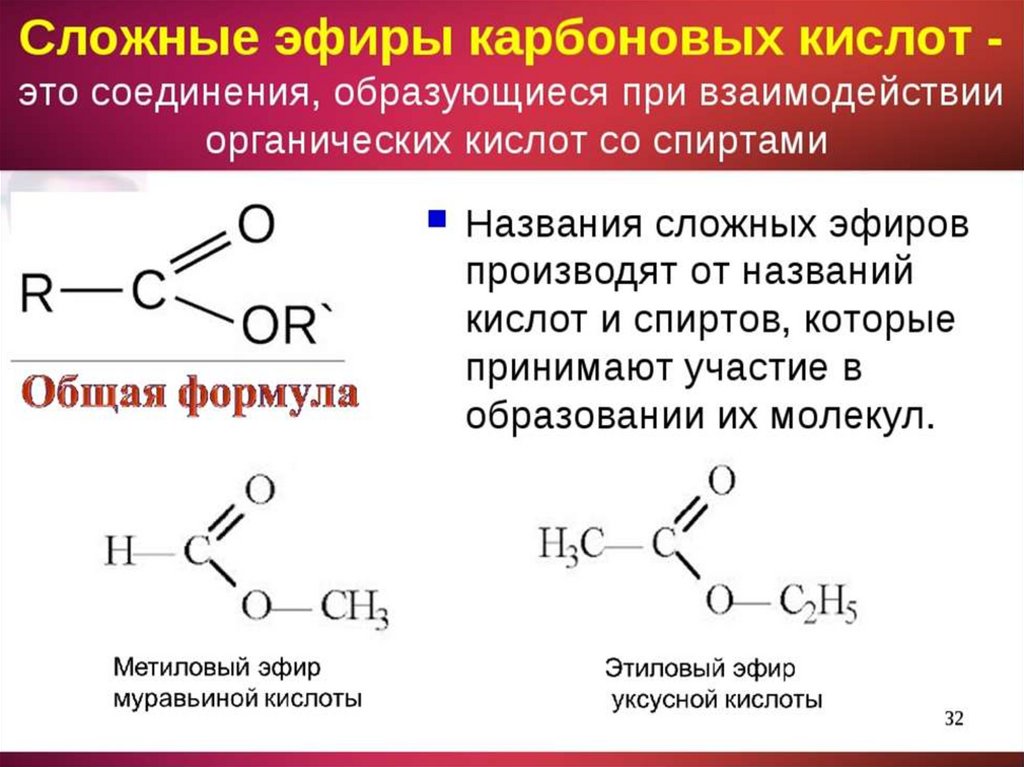 При замещении кислорода ОН-группы применяется суффикс -карботиоловая, при замещении кислорода С=О-группы — суффикс -карботионовая; при замещении обоих атомов кислорода — суффикс -карбодитио.
При замещении кислорода ОН-группы применяется суффикс -карботиоловая, при замещении кислорода С=О-группы — суффикс -карботионовая; при замещении обоих атомов кислорода — суффикс -карбодитио.
31. Для солей и сложных эфиров сохраняются принятые ныне правила. Например: бутаноат натрия, или натриевая соль бутановой кислоты; диэтил-1,2-этандикарбоксилат, или диэтиловый эфир янтарной кислоты,
32. Для ангидридов кислот сохраняется принятая ныне система обозначения по названиям соответствующих кислот. При применении наименований, составленных в соответствии с Женевской номенклатурой, амиды, амидоксимы, амидины, имины и нитрилы называются как кислоты с добавлением к названию углеводорода соответственно окончания -амид, -амидоксим, -амидин, -имид, -нитрил, в то время как галогенангидриды кислот называют, комбинируя название галогена с названием радикала. Например, хлористый бутаноил C3H7COOCl, бутанамид C3H7CONH2.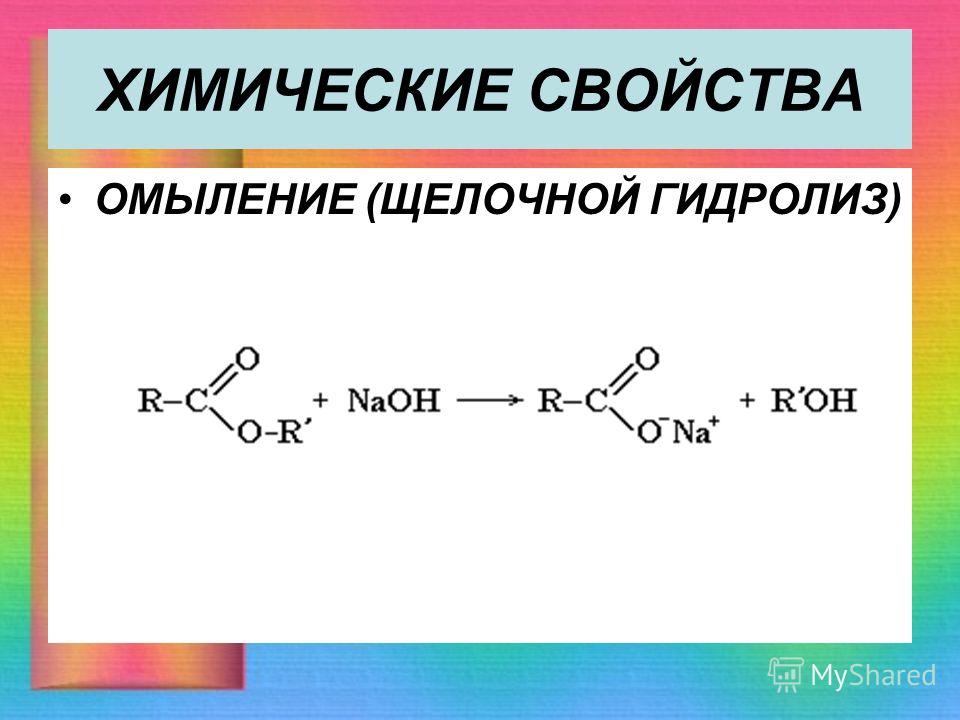
В тех случаях, когда карбоксил рассматривается как замещающая группа, применяются окончания -карбонамид, -карбонамидоксим, -карбонимид.
33. Для азотсодержащих оснований применяется окончание -ин [in в отличие от -упе из правила 9]. Ныне принятая номенклатура моноаминов сохраняется. Для полиаминов наименование углеводорода сопровождается префиксами ди-, триамино- и т. д. Для алифатических соединений, содержащих пятивалентный азот, окончание -ин меняется на -оний. Для циклических соединений, содержащих пятивалентный азот в циклической структуре, окончание -ин меняется на -иний, окончание -ол — на -олий.
Примеры:
пиридин — пиридиний; имидазол — имидазолий
34. (а) Производные мышьяковистого водорода AsH3 называют как соответствующие амины и их производные, используя окончание -арсин. Одновалентный радикал — AsH2 обозначают префиксом арсино-.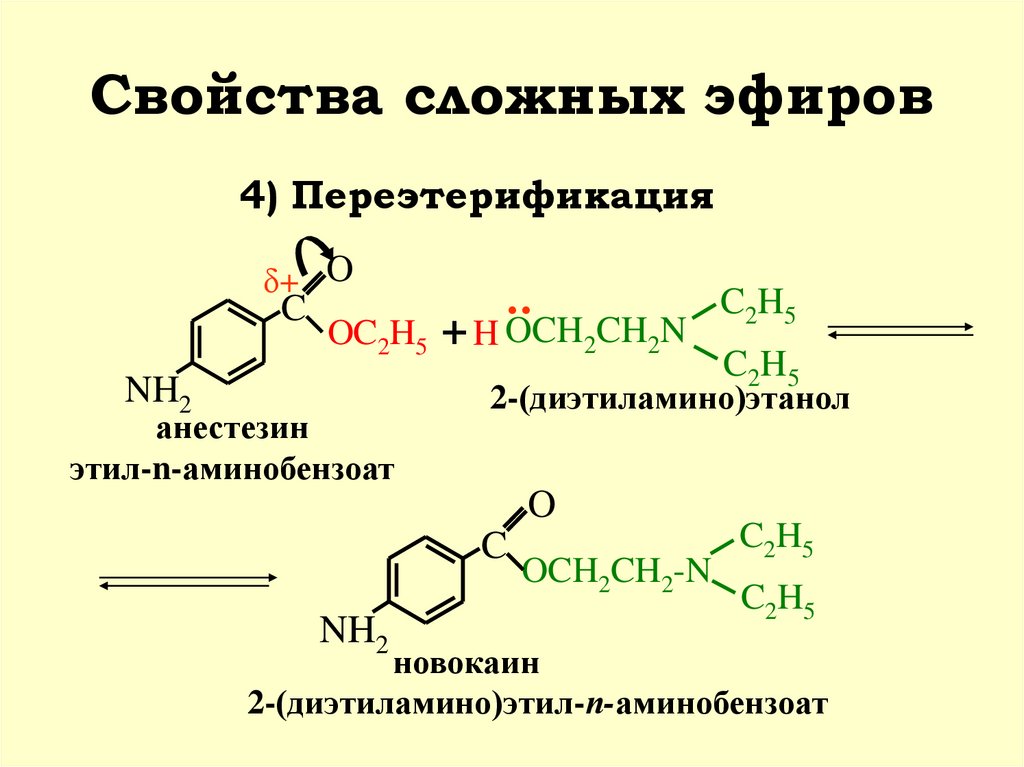
Примеры:
CH3AsH2 метиларсин
(СН3)3 As триметиларсин
(CH3)2AsCl хлордиметиларсин
(СН3)3 AsO триметиларсиноксид (окись триметиларсина)
H2AsCH2CH2AsH2 1,2-диарсиноэтан, или этан-1,2-диарсин
(С2Н5)4 AsOH тетраэтиларсоний (гидроокись тетраэтиларсония)
(СН3)2 AsAs (CH3)2 тетраметилбиарсин
(b) Кислоты типа
и
называют арсиновыми кислотами, кислоты типа RAsO(OH)2 — арсоновыми кислотами. Радикал — AsO(OH)2 обозначают префиксом арсоно-. Примеры:
(СН3)2 AsOOH диметиларсиновая кислота
C6H5AsO(OH)2 бензенарсоновая кислота
(c) Правила (а) и (b) применимы к аналогичным соединениям фосфора и сурьмы, причем слог арс заменяется, соответственно, на фосф или стиб.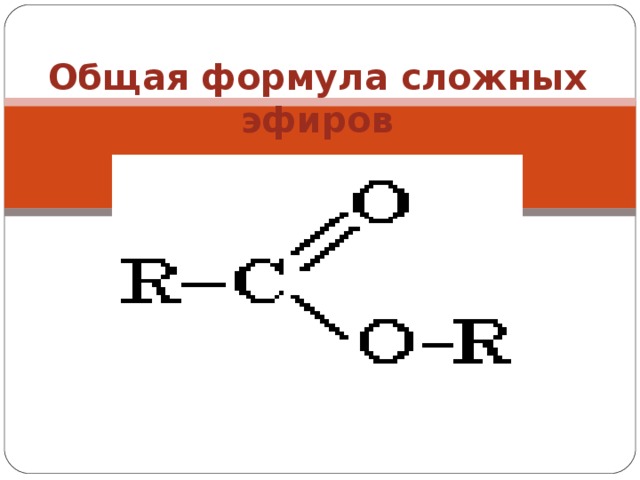
(d) Следующий список включает префиксы и суффиксы, применимые к большинству обычных соединений фосфора, мышьяка и сурьмы:
(e) Производные висмутина BiН3 называют подобно производным мышьяковистого водорода.
(f) Соединения мышьяка, фосфора, сурьмы и висмута, которые не могут быть четко названы по предыдущим правилам, называют как производные арсина, фосфина, стибина, висмутина или, если возможно, как металлорганические соединения (правило 48).
Примеры:
35. Производные гидроксиламина, полученные замещением водорода в гидроксиле, рассматриваются как алкоксильные производные: те же производные, в которых замещен один из атомов водорода группы NH2, рассматриваются как алкилгидроксиламины. Названия оксимов производятся из названия соответствующего альдегида, кетона или хинона с добавлением суффикса -оксим.
Примеры:
36. Групповой термин мочевина сохраняется. Его применяют как суффикс в наименовании алкильных и ацильных производных мочевины, например: бутилмочевина, бутирилмочевина.
Его применяют как суффикс в наименовании алкильных и ацильных производных мочевины, например: бутилмочевина, бутирилмочевина.
Двухвалентный радикал —NH—CO—NH— получает наименование уреилен.
37. Групповое название гуанидин сохраняется.
38. Название карбиламин сохраняется:
39. Изоциановые и изотиоциановые эфиры называются изоцианатами и изотиоцианатами.
40. Наименование цианат применяется для эфиров, которые при омылении дают циановую кислоту или продукты ее гидратации. Название сульфоцианат меняется на тиоцианат.
Примеры:
41. Полностью сохраняется принятая номенклатура нитропроизводных.
42. Сохраняются названия азо и азокси.
Примеры:
бензен-азо-бензен; бензен-азо-толуен; бензен-азокси-бензен
43. (а) Соединения диазония RN2X называют по наименованию основного вещества с добавлением суффикса -диазоний (хлористый бензендиазоний).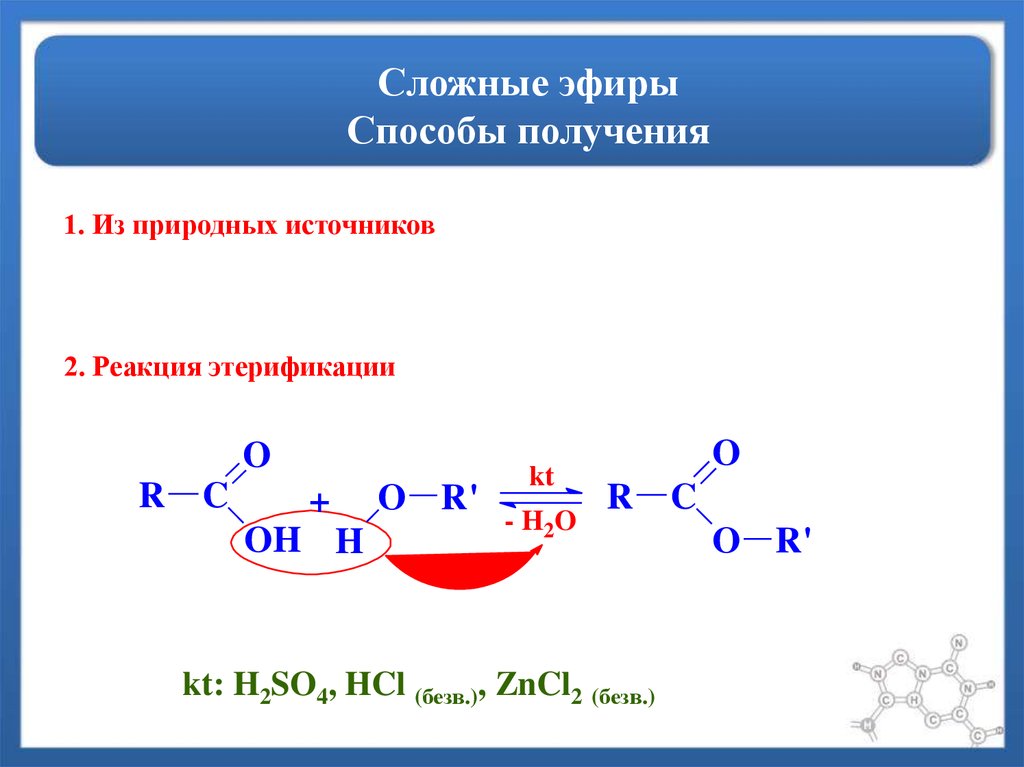
(b) Соединения той же общей формулы с трехвалентным азотом называют заменяя диазоний на диазо (бензендиазогидроксид).
(c) Соединения типа RN2OMe называют диазотатами.
(d) Соединения, в которых два атома азота связаны с одним атомом углерода, обозначаются префиксом диазо-: диазометан, диазоуксусная кислота.
(e) Наименование диазоамино сохраняется; в то же время эти соединения можно рассматривать как производные триазена.
(f) Производные веществ
NH2—NH—NH—NH2; NH=N—NH—NH2; NH=N—NH—N=NH
называются тетразанами, тетразенами, пентаздиенами.
44. Органические производные гидразина называются по наименованию алкильного радикала, от которого они производятся, добавлением суффикса -гидразин.
В случаях, когда аминогруппа карбонамидов замещается на гидразиногруппу, применяется суффикс -гидразид. Примеры:
45. Гидразоны и семикарбазоны называются так же, как и оксимы. Термин озазон сохраняется.
Гидразоны и семикарбазоны называются так же, как и оксимы. Термин озазон сохраняется.
46. Термин хинон сохраняется.
47. Сульфоновые и сульфиновые кислоты обозначаются добавлением к названию углеводорода суффиксов -сульфоновая и -сульфиновая (кислоты).
Аналогичные кислоты селена и теллура называются алканселеновыми, селениновыми, теллуроновыми и теллуриновыми кислотами.
48. Металлорганические соединения называются по наименованию органических радикалов, связанных с металлом, за которым следует название металла.
Примеры:
диметилцинк; тетраэтилсвинец; хлористый метилмагний
Однако, если металл связан со сложным радикалом, металл можно рассматривать как замещающую группу. Пример: хлормеркурибензойная кислота.
49. а. I. Циклические углеводороды с алифатической боковой цепью получают название по одному из следующих двух способов:
(α) Название радикала боковой алифатической цепи служит префиксом к названию циклического углеводорода.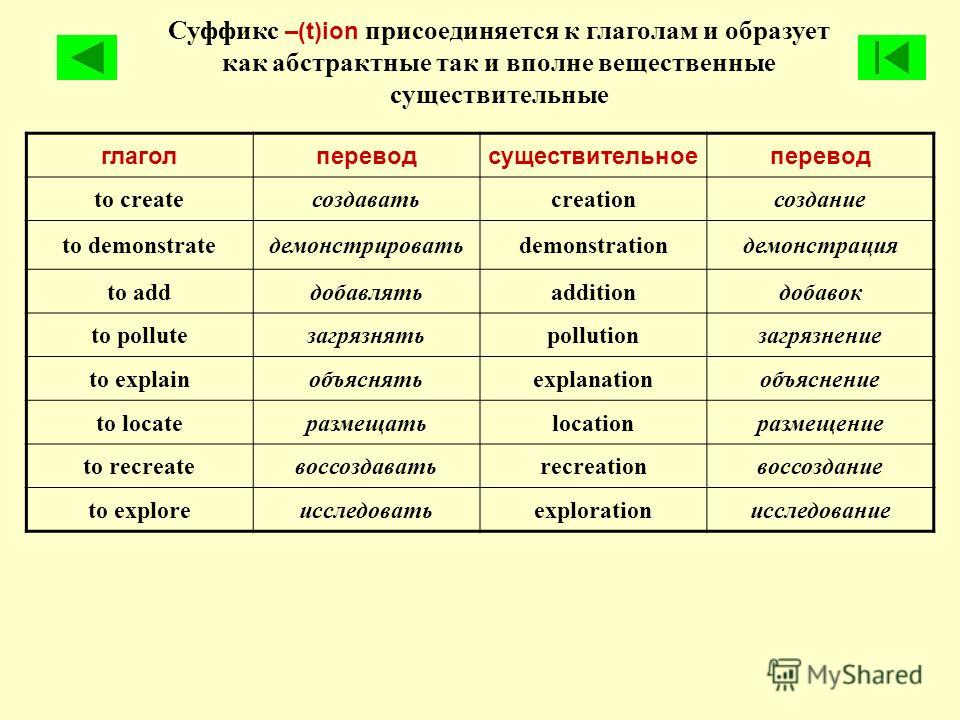
(β) Циклический углеводородный остаток, если название такого радикала существует, рассматривается как заместитель в алифатической цепи.
Названия, соответствующие (α), в общем предпочтительнее, если боковая цепь коротка или имеется несколько боковых цепей.
Названия, соответствующие (β), более удобны, когда боковая цепь длинна и, в частности, если циклический углеводородный остаток находится не в конце этой цепи.
Примеры:
Перед названием циклического углеводорода с боковой цепью, соответствующим (α), рекомендуется во многих случаях применять тривиальные названия простых ароматических углеводородов.
Примеры:
а. II. Когда несколько циклических остатков связаны с одной алифатической цепью, в основу названия соединения кладут название соответствующего алифатического углеводорода, если возможно построить названия для циклических радикалов.
Примеры:
В случае, если это невозможно или если возможность применения удобного названия радикала делает это желательным, название соединения образуют от одного из циклических углеводородов по принципу замещения.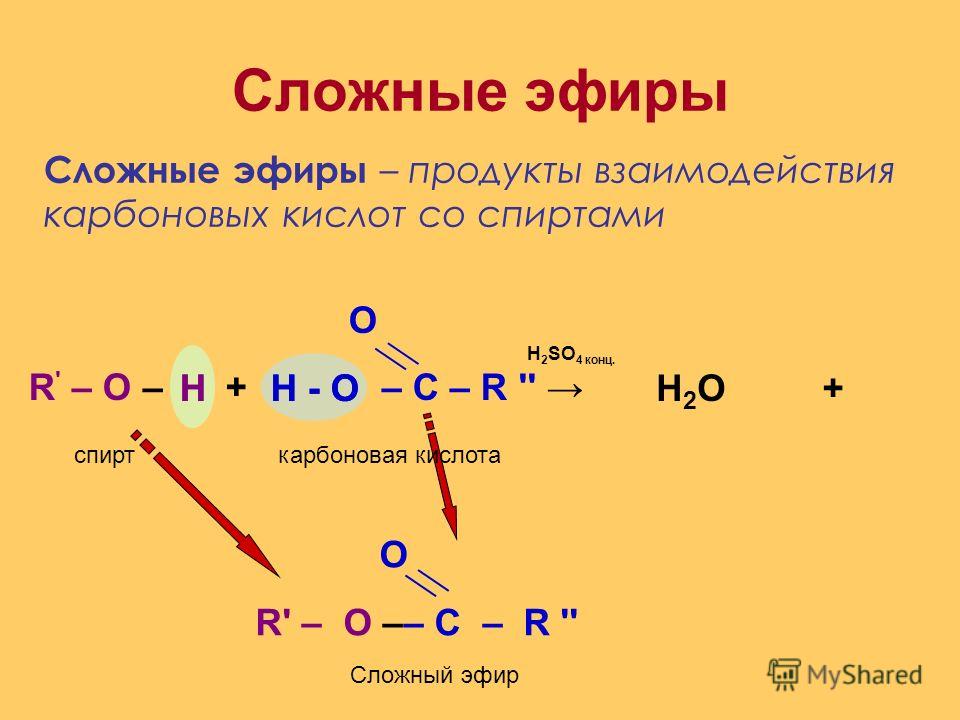
Примеры:
b. Если циклические углеводороды, рассматриваемые в соответствии с правилом 49-а, несут функциональные группы, которые могут быть выражены только префиксами, для построения названия имеются те же самые возможности, что и для углеводородных заместителей, предусмотренных правилом 49-а,
Примеры:
Для производных моноциклических углеводородов, имеющих тривиальные названия, употребляются преимущественно эти названия. Примеры:
50. В случае надобности, во избежание двусмысленности, названия сложных радикалов берутся в скобки. Примеры:
Сложные эфиры.. — Химия — Уроки
Сложные эфиры
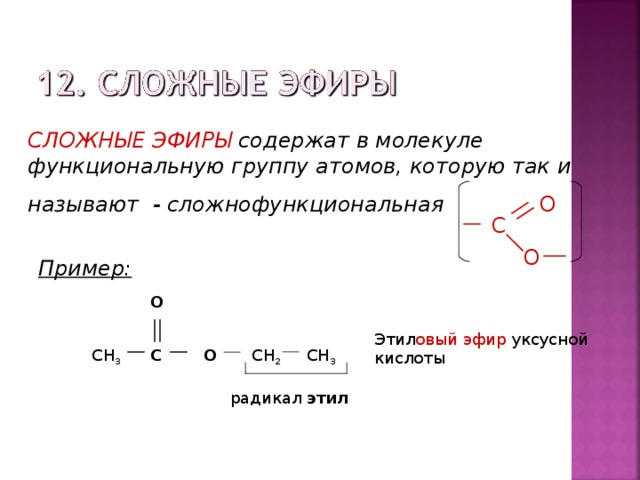
Сложные эфиры — производные кислот (карбоновых или минеральных, одноосновных или многоосновных), в которых атомы водорода гидроксильных групп -ОН замещены на углеводородные радикалы R.
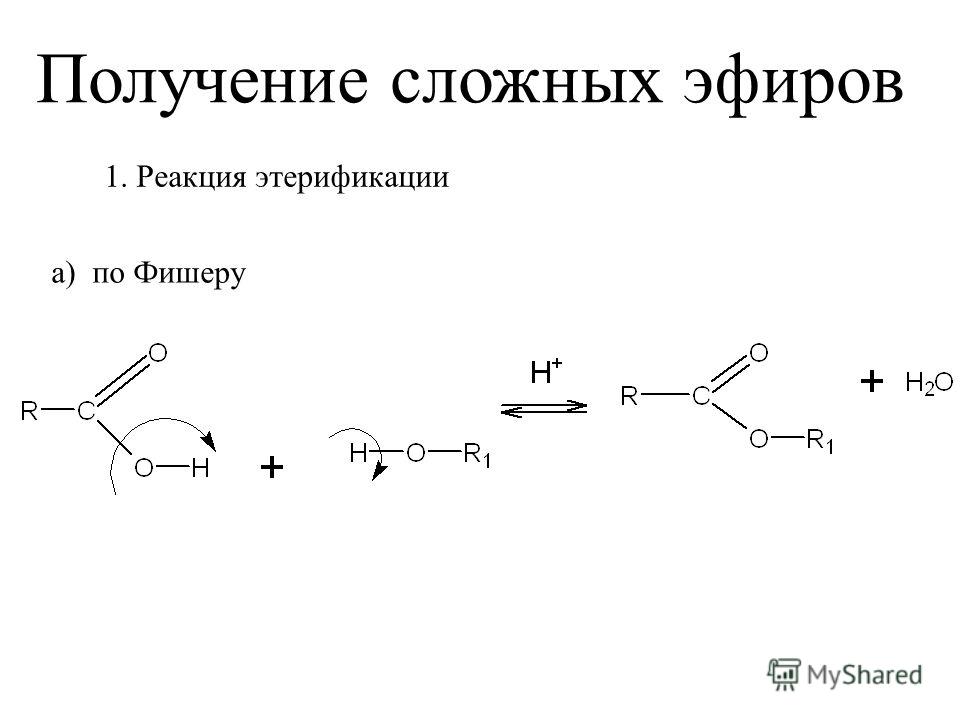
Сложные эфиры карбоновых кислот обычно рассматривают как продукты реакции между кислотой и спиртом (реакция этерификации)
Общая формула сложных эфиров карбоновых кислот R-C(O)-O-R’
Номенклатура сложных эфиров (Название)
Существует несколько вариантов названий сложных эфиров, при этом могут использоваться как систематические, так и тривиальные названия радикалов и кислот.
1. Сокращенный вариант (по аналогии с названием солей). В соответствии с систематической номенклатурой, название сложного эфира образуется следующим образом: первым указывается название радикала R, присоединенного к кислоте, затем – название кислоты (корень слова) с суффиксом «оат» (по аналогии с суффиксом «ат» в названиях неорганических солей: карбонат натрия, нитрат хрома). Например, этилпропаноат, метилэтаноат.
По сокращенному варианту может быть образовано и тривиальное название: к названию радикала R добавляется тривиальное название остатка кислоты (используется суффикс «ат»):
формиат — эфир мураьвиной кислоты (HCOOR),
ацетат — эфир уксусной кислоты (Ch4COOR)
бутират — эфир масляной (бутановой) кислоты (Ch4Ch3Ch3COOR).
2. Полный вариант. К названию радикала R (по систематической номенклатуре) добавляется суффикс «овый», затем вставляется слово «эфир» и указывается название кислоты, например, этиловый эфир этановой кислоты или этиловый эфир уксусной кислоты. Название сложного эфира бутилпропионат в полном варианте будет выглядеть следующим образом: бутиловый эфир пропановой (пропионовой) кислоты.
Таким образом, возможно четыре варианта названия одного и того же эфира:
Изомерия сложных эфиров одноосновных карбоновых кислот
Для сложных эфиров карбоновых кислот характерны следующие виды изомерии:
1. Изомерия углеродной цепи (углеродного скелета) начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки —С(О)—О—. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат.
3. Межклассовая изомерия с карбоновыми кислотами, например, изомером метилацетата является пропановая кислота:
Ch4COOCh4 метилацетат и Ch4−Ch3COOH пропановая кислота. Общая формула C3H6O2.
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и геометрическая (цис-, транс-) изомерия.
Физические свойства сложных эфиров карбоновых кислот
Сложные эфиры низших карбоновых кислот и простейших спиртов — бесцветные летучие жидкости, часто с приятным фруктовым запахом; сложные эфиры высших карбоновых кислот — твердые бесцветные воскообразные вещества, практически лишенные запаха, их температура плавления зависит как от длин углеродных цепей ацильного и спиртового остатков, так и от их структуры.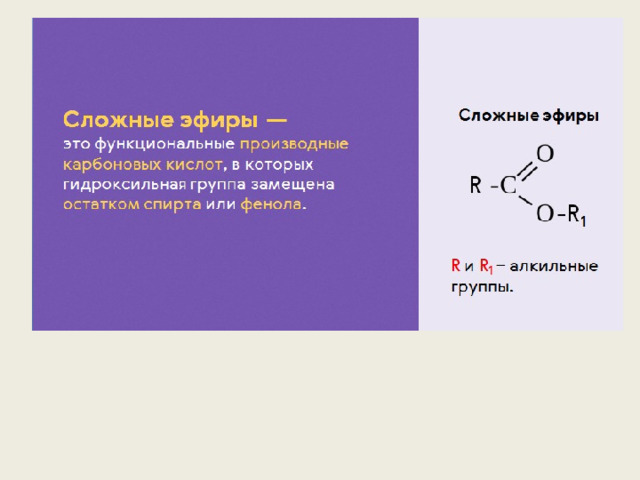
Химические свойства сложных эфиров карбоновых кислот
1. Гидролиз (омыление) сложных эфиров — основное химическое свойство. Гидролиз протекает с расщеплением сложных эфиров под действием воды. Эта обратная реакция для реакции этерификации. Реакция протекает как в кислой (катализаторы реакции – протоны Н+), так и в щелочной среде (катализаторы реакции – гидроксид-ионы ОН –).
В присутствии щелочи реакция необратима, т.к. происходит омыление – образование солей карбоновых кислот.
2. Реакция восстановления. При восстановлении водородом сложных эфиров образуется смесь двух спиртов:
3. Взаимодействие с аммиаком. При взаимодействии сложных эфиров с аммиаком образуется амид соответствующей кислоты и спирт:
Сложные эфиры карбоновых кислот в природе
Сложные эфиры входят в состав эфирных масел многих растений и фруктов, придавая им специфический приятный запах:
В значительных количествах сложные эфиры представлены в природе восками. Основа природных восков — эфиры высших одноосновных кислот и высших одноатомных спиртов. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
Основа природных восков — эфиры высших одноосновных кислот и высших одноатомных спиртов. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
Ch4(Ch3)14−C(O)−O−C31H63
Сложные эфиры на основе низших спиртов и кислот используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной промышленности.
Многие сложные эфиры используются в качестве растворителей, например этилацетат, который используется в качестве растворителя лаков и красок, в органическом синтезе, а также при изготовлении лекарственных средств.
Сложные эфиры непредельных спиртов используются для изготовления лаков и красок, так как вступают в реакции присоединения по двойной связи и образуют полимеры. Например, винилацетат — сложный эфир уксусной кислоты и винилового спирта Ch4−C(O)−O−CH=Ch3 при полимеризации образует поливинилацетат, который используется для изготовления кожезаменителя, его еще называют винилкожей или дермантином.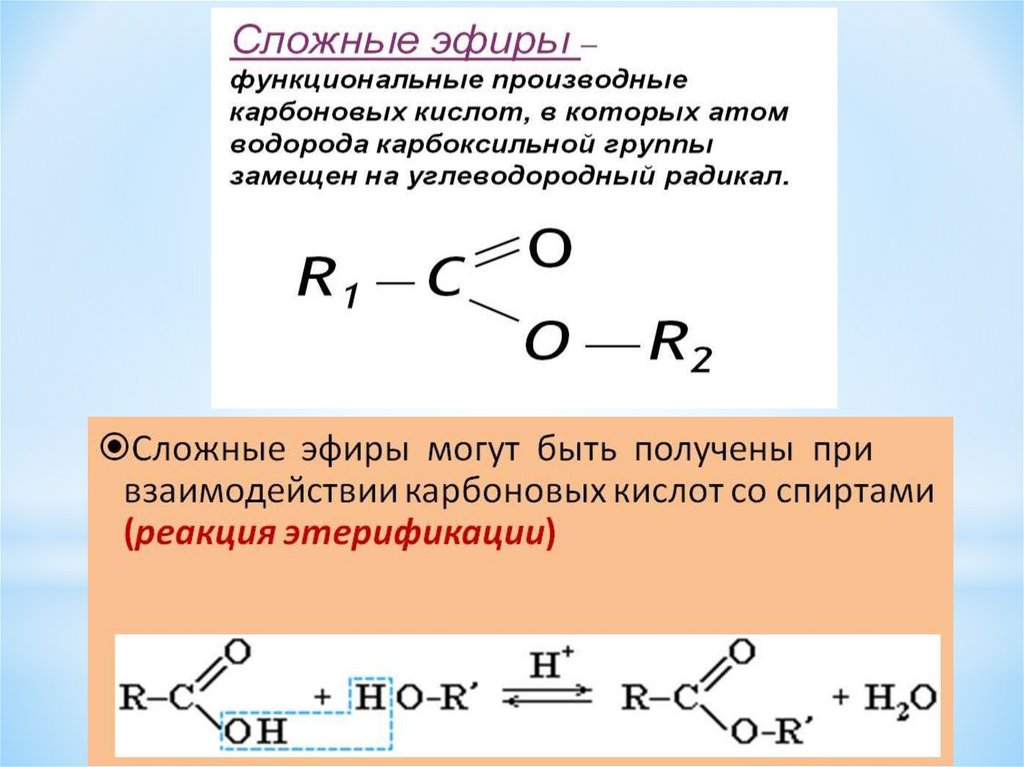
Методы получения сложных эфиров карбоновых кислот
1. Реакция этерификации см. Хим. свойства карбоновых кислот
2. Получение из солей кислот и галогенпроизводных
Сложные эфиры могут быть получены из солей кислот при действии на них галогенпроизводных. Например, из ацетата серебра и хлористого этила можно получить этилацетат:
Ch4C(O)OAg+Ch4−Ch3Cl⟶Ch4C(O)−O−Ch3Ch4+AgCl↓
Данная реакция необратима и эфир получается с хорошим выходом. В этом заключается преимущество метода перед методом этерификации.
3. Получение из хлорангидридов кислот и алкоголятов
Метод аналогичен предыдущему:
Ch4C(O)Cl+Ch4−Ch3−ONa⟶Ch4C(O)−O−Ch3Ch4+NaCl
4. Получение из ангидридов кислот
При действии спиртов на ангидриды кислот также достигаются хорошие выходы сложных эфиров:
(Ch4CO)2O+Ch4OH⟶Ch4C(O)O−Ch4+Ch4C(O)OH
Жиры и масла
Жиры (триглицериды) — природные органические соединения, представляющие собой полные сложные эфиры трехатомного спирта глицерина и одноосновных высших или средних жирных (предельных) кислот.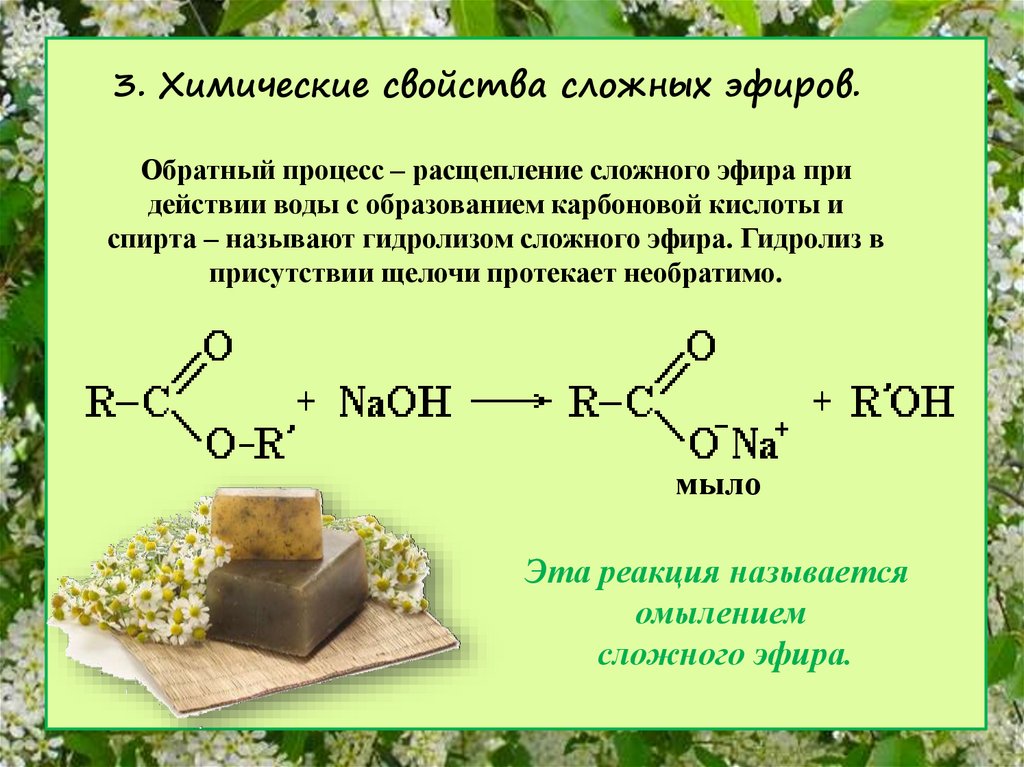
Жидкие жиры растительного происхождения называются маслами и представляют собой сложные эфиры глицерина и высших непредельных кислот .
Жиры являются главной составной частью животных жиров и растительных масел, присутствуют во всех животных и многих растительных тканях, особенно в семенах масличных культур (подсолнечника, оливы, всех орехов), входят в состав клеточных мембран и обеспечивают энергетический баланс в живых организмах. Для человека и многих животных являются одним из основных питательных компонентов.
Животные жиры при нормальных условиях — твердые вещества, имеющие невысокие температуры плавления. Животные жиры входят не только в состав жировой ткани, но также в больших количествах присутствуют в молоке и молочных продуктах (твороге, сметане, сыре, сливочном масле).
Строение жиров
Запомнить! Природные жиры содержат в своём составе три кислотных радикала (одинаковых или разных), имеющих неразветвлённую структуру и, как правило, чётное число атомов углерода.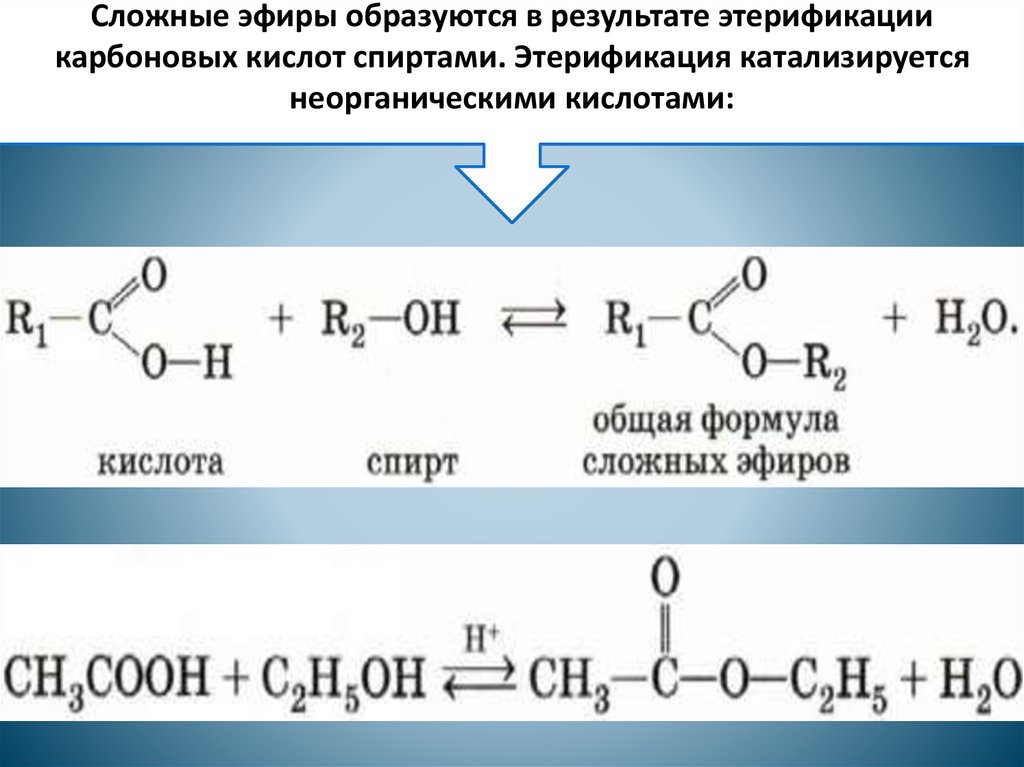
Природные жиры чаще всего содержат следующие жирные кислоты:
1. Предельные (насыщенные):
стеариновая (C17h45COOH)
маргариновая (C16h43COOH)
пальмитиновая (C15h41COOH)
капроновая (C5h21COOH)
масляная (C3H7COOH)
2. Непредельные (ненасыщенные) алкеновые:
пальмитолеиновая (C15h39COOH),
олеиновая (CC17h43COOH)
3. Непредельные алкадиеновые кислоты:
Растительные масла, характеризующиеся большим содержанием полиненасыщенных жирных кислот (льняное, конопляное, маковое, тунговое масло), известны под названием высыхающих масел, так как под действием кислорода воздуха они полимеризуются и затвердевают.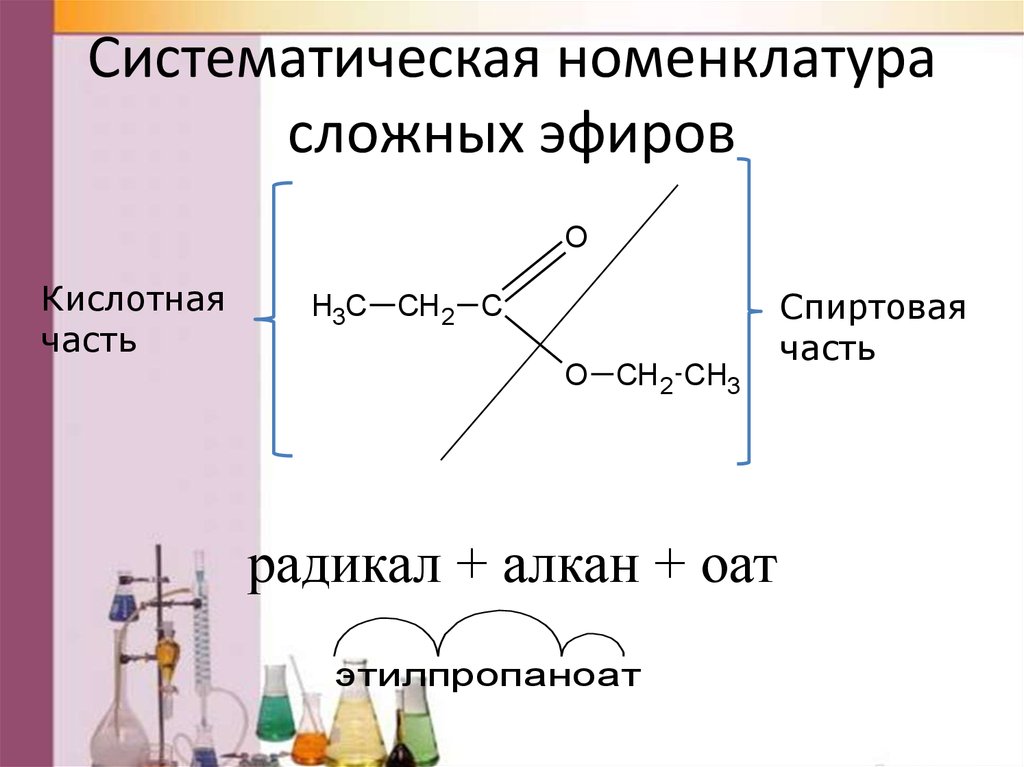
Физические свойства
Жиры и масла хорошо растворяются в органических растворителях — бензоле, хлороформе, эфире, сероуглероде, петролейном эфире, горячем спирте (в холодном — труднее), ацетоне и не растворяются в воде. При опадании в воду они образуют два несмешивающихся слоя, причем поскольку плотность масел меньше плотности воды, то масло всегда будет в верхнем слое.
Жиры и масла гидрофобны, то есть не смачиваются водой, но при попадании на водную поверхность с неограниченной площадью (например, в реку или озеро), образуют на поверхности тонкую пленку, что обусловлено наличием сил поверхностного натяжения. При добавлении к жирам, находящимся в воде, поверхностно-активных веществ (ПАВ) — детергентов они способны образовывать стойкие гетерогенные системы — жировые эмульсии. Это свойство используется для приготовления мазей и кремов. Масла при взбивании с водой также способны образовывать эмульсии, примером такой гетерогенной системы является майонез.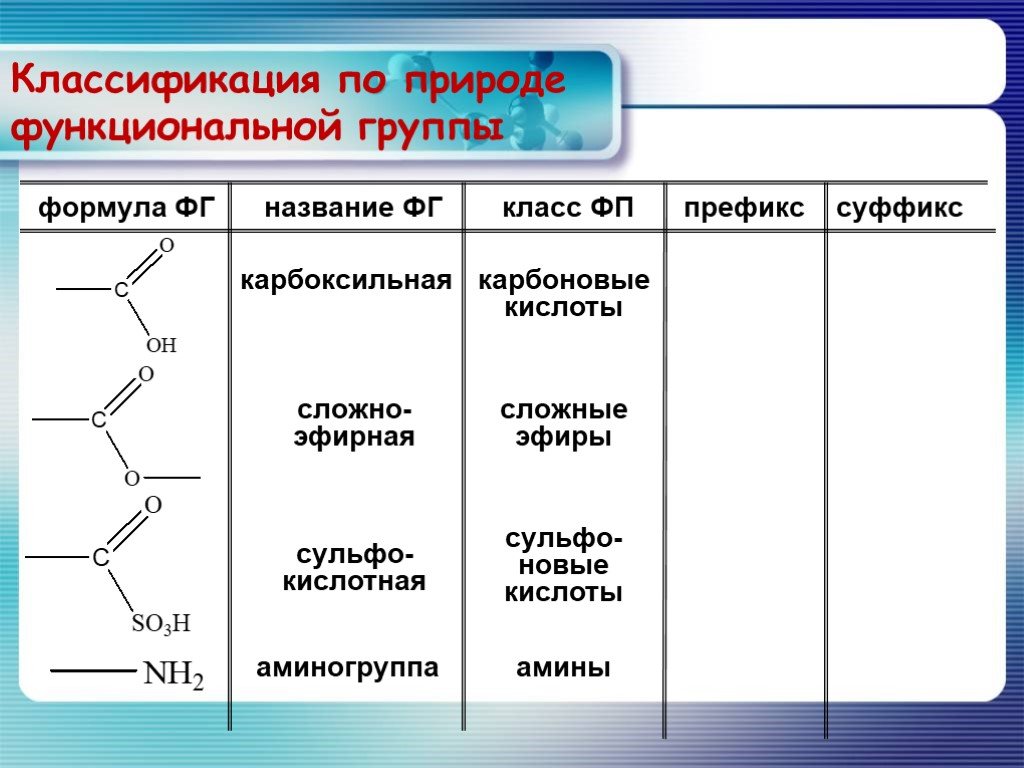
Химические свойства жиров
Нейтральные жиры вступают во все химические реакции, свойственные сложным эфирам (продуктам замещения атомов водорода в ОН-группах минеральных или карбоновых кислот).
1. Жиры вступают в реакцию омыления (гидролиза), в результате которой из триглицеридов образуются глицерин и жирные кислоты. Омыление жиров может происходить как при каталитическом гидролизе, так и при действии на жиры кислот или щелочей. При щелочном гидролизе образуются мыла (подробно см. тему «Мыла»)
2. Присоединение по двойным связям. Для получения из растительных масел жиров более твердой консистенции, использующихся в качестве жировой основы при производстве маргаринов, применяется гидрогенизация (гидрирование), т.е. насыщение молекул этих масел водородом.
3. При хранении, особенно на свету и при свободном доступе воздуха, жиры приобретают неприятный вкус — прогоркают. Установлено, что в прогоркании жиров главную роль играет химический процесс — окисление ненасыщенных жирных кислот кислородом воздуха. Получающиеся при этом перекиси разлагаются с образованием альдегидов.
При хранении, особенно на свету и при свободном доступе воздуха, жиры приобретают неприятный вкус — прогоркают. Установлено, что в прогоркании жиров главную роль играет химический процесс — окисление ненасыщенных жирных кислот кислородом воздуха. Получающиеся при этом перекиси разлагаются с образованием альдегидов.
Прогоркание может быть обусловлено и биохимическими процессами, протекающими под воздействием содержащихся в белках ферментов (липаз), при этом происходит гидролиз жиров и образование свободных жирных и ненасыщенных жирных кислот, которые окисляются затем до β-кетокислот (так называемое кетонное прогоркание жиров).
Задание для самостоятельного выполнения:
Назвать сложные эфиры:
-ster — Wiktionary
См. Также: STER , STêr , и STèr
Содержание
- 1 английский
- 1.1 Этимология
- 1.
 2 Суффикс
2 Суффикс- 1.2.1 Замечания по использованию
- 1.2.2 Синонимы
- 1.2.3 Производные термины
- 1.3 Анаграммы
- 2 голландский
- 2.1 Этимология
- 2.2 Суффикс
- 2.2.1 Производные термины
- 2.3 Каталожные номера
- 3 Среднеанглийский
- 3.1 Суффикс
Английский [править]
Этимология
*-astrijā спорного происхождения. Родственен средне-нижненемецкому -ester , голландскому -ster .
Суффикс[править]
-ster
- Кто-то, кто связан, или кто делает что-то конкретное.
- (юмористический, иногда оскорбительный) Уменьшительное, добавляемое к имени человека.
- 1992 , Рассел Бейкер, «Observer; Pretty Good Read» (обзор книги Ричарда Бена Крамера « What It Takes »), New York Times , 25 июля,
- Исследование Крамера сердец, умов и душ обезумевших от амбиций кандидатов в президенты Америки продвигается вперед с по-детски безумной скоростью.
 . . . И не только потому, что сенатора Роберта Доула постоянно называют «Бобом 9».0005 ster «.
. . . И не только потому, что сенатора Роберта Доула постоянно называют «Бобом 9».0005 ster «.
- Исследование Крамера сердец, умов и душ обезумевших от амбиций кандидатов в президенты Америки продвигается вперед с по-детски безумной скоростью.
- 1992 , Рассел Бейкер, «Observer; Pretty Good Read» (обзор книги Ричарда Бена Крамера « What It Takes »), New York Times , 25 июля,
Замечания по использованию , особенно в современном продуктивном использовании — сравните
хипстер , сцены , банкстер ; однако более старые термины, такие как барристер , не имеют этой небрежной коннотации.
Синонимы[править]
- -er
- -или
Производные термины
Анаграммы ]
Из среднеголландского -ster , из древнеголландского *-istra , из прото-западногерманского *-astrijā ; родственный средне-нижненемецкому -ester , древнеанглийскому -estre 9А. ван Лоэй, «Историческая грамматика Шенфельда в Нидерландах», Zutphen, 8. druk, 1970, → ISBN; § 177
ван Лоэй, «Историческая грамматика Шенфельда в Нидерландах», Zutphen, 8. druk, 1970, → ISBN; § 177 Среднеанглийский[править]
Суффикс[править]
-ster
- Альтернативная форма -эфир
R-5.7.4 Соли и сложные эфиры
R-5.7.4 Соли и сложные эфиры
Принесите силу именования IUPAC на свой рабочий стол!
ACD/Name (Chemist Version) предлагает стандартизированный набор функций для быстрого и простого создания имен IUPAC и структур из имен. Это упрощенная версия нашего популярного программного обеспечения ACD/Name.
Ознакомьтесь с полным описанием и ценами в нашем интернет-магазине.
Особые классы соединений
R-5.7.4 Соли и сложные эфиры
R-5.7.4.1 Соли
Нейтральные соли органических кислот называются с указанием катиона (катионов), за которым следует название аниона в качестве отдельного слова. Различные катионы цитируются в алфавитном порядке.
Различные катионы цитируются в алфавитном порядке.
Примеры к R-5.7.4.1
Кислые соли многоосновных органических кислот называются так же, как и нейтральные соли, при этом оставшийся атом(ы) водорода кислоты обозначается словом «водород» (или «диводород» и т. д., как
соответствующий) вставляется между названием(ями) катиона(ов) и названием аниона, от которого он отделен пробелами. Ионные заместители, такие как
, , и описываются именами префиксов, такими как «карбоксилато-», «сульфонато-» и «фосфонато-» соответственно.
Примеры к R-5.7.4.1
Гидроген натрия 3-[3-(карбоксилатометил)-2-нафтил]пропаноат
R-5.7.4.2 Сложные эфиры. Полностью этерифицированные кислоты обозначаются так же, как и нейтральные соли, за исключением названий алкильных или арильных и т.п. групп, приведенных в
в алфавитном порядке, если их несколько, замените названия катионов.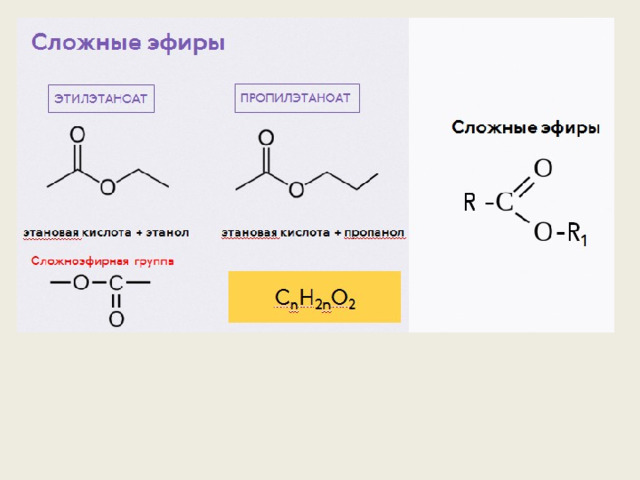
Примеры к R-5.7.4.2
Структурная специфичность сложных эфиров тио- или селенокарбоновых кислот обеспечивается соответствующим курсивным символом элемента, таким как S — или O -, перед названием алкила, арила,
д., группа по мере необходимости.
Примеры к R-5.7.4.2
Номенклатура функциональных классов часто используется для обозначения сложных эфиров натуральных продуктов и в индексной номенклатуре.
Примеры к R-5.7.4.2
Неполные (кислые) эфиры многоосновных кислот и их солей называют по методике для нейтральных эфиров и кислых солей; присутствующие компоненты указаны в порядке: катион, алкильная или арильная группа,
водород, анион. Числовые локанты и курсивные символы элементов добавляются по мере необходимости для обеспечения конкретики.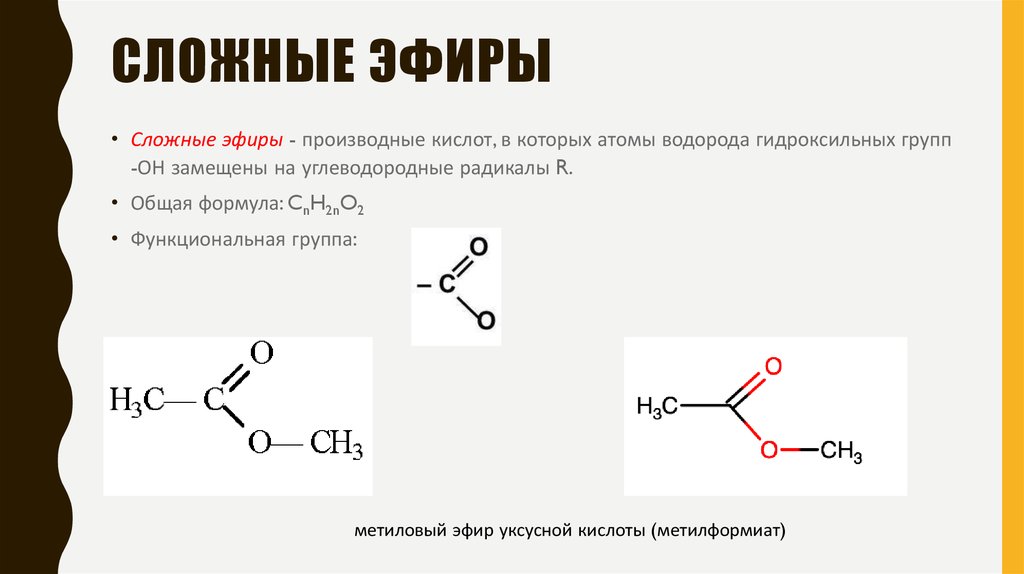
Примеры к R-5.7.4.2
(обратите внимание, что нумерация двухосновной кислоты сохранена)
Когда в сложном эфире с общей структурой присутствует другая группа, имеющая приоритет для цитирования в качестве суффикса (см. Таблицу 10, Т-4.1 и Таблицу 5,
R-3.2.1.1), или когда все сложноэфирные группы не могут быть описаны вышеуказанными методами, сложноэфирная группа обозначается префиксами, такими как «алкоксикарбонил-» или «арилоксикарбонил-» для группы.
, или «ацилокси-» для группы .
Примеры к R-5.7.4.2
Номенклатура функциональных классов также может использоваться, особенно в указателях, для описания сложного эфира в присутствии группы с приоритетом для цитирования в качестве группы основных характеристик.
Пример к R-5.7.4.2
- Следующий:
- R-5.


 2 Суффикс
2 Суффикс . . . И не только потому, что сенатора Роберта Доула постоянно называют «Бобом 9».0005 ster «.
. . . И не только потому, что сенатора Роберта Доула постоянно называют «Бобом 9».0005 ster «.