FST - Функционально-силовой тренинг. Стероиды это сложные эфиры
Стероиды эфиры - Справочник химика 21
По такому же принципу образовались и другие углеводороды С27—С35 —стерины и тритерпены. Предшественниками их являются стероиды, широко распространенные в живой природе как а свободном виде, так и в виде эфиров жирных кислот. [c.41]
Липиды, жиры, детергенты. Терпены и стероиды. Производные карбоновых кислот сложные эфиры, амиды, нитрилы, галогеноангидриды и ангидриды их химические свойства и способы получения. [c.247]Хлороформ, ацетон, диэтиловый эфир Селективное разделение веществ различных классов (ОР-1 — для разделения стероидов, холестерина,пестицидов, сахаров) [c.106]
Спирты от эфиров простых Стероиды [c.220]
Сульфаты и тозилаты (или их хлорангидриды) успешно использовались для получения эфиров сахаров [34, 35] и стероидов (36). Для получения эфиров сахаров лучше применять диметилсульфат с окисью бария или гидроокись бария в диметилформамиде или диметилсульфоксиде, а еще лучше—в смеси этих растворителей [371. Для эфиров стероидов подходящим алкилирующим агентом оказался свободный спирт. [c.331]
Поскольку эфиры енолов легко гидролизуются с образованием кетонов (разд. Г.З), этот метод синтеза является методом превращения в кетоны ароматических простых эфиров как с простой, так и со сложной циклической системой, например такой, как система в стероидах [15]. В этих случаях существенное значение имеют экспериментальные условия, например используемый металл, способ его добавления и применяемое количество этилового спирта. [c.117]
Силикат магния Кислый Кол., ТСХ Отчасти сходен по свойствам с кислой окисью алюминия, однако химически взаимодействует с многими соединениями. Используется для разделения стероидов, сложных эфиров, лактонов, глицеридов, алкалоидов, некоторых углеводов. См. также об-зор (3 [c.383]
Эфиры енолов обычно получают нагреванием кетонов с эфирами ортомуравьиной кислоты в присутствии небольшого количества кислоты [525]. В ряду стероидов эфиры енолов можно, по-видимому, получить только из соединений, содержащих кетогруппу в положении 3 и двойную связь в положении 4. Эфиры енолов устойчивы в щелочной среде, например при восстановлении металлическим натрием в спирте и жидком аммиаке [525], натрием в пропаноле [496, 526] и алюмогидридом лития [527, 528]. Кроме того, они не изменяются при длительном кипячении с раствором едкого кали в метаноле [529] и при действии реактивов Гриньяра [530]. Хотя обычно применяются этиловые эфиры енолов, иногда следует отдать предпочтение бензиловым [527] или изобутиловым [528] эфирам енолов. Все такие эфиры енолов очень легко гидролизуются минеральными кислотами. [c.261]
Реактив для получения трет-бутил-ВМЗ-эфиров углмодов, нуклеозидов, стероидов. Эфиры отличаются устойчивостью к гидролизу. [c.356]
Известны препараты иода, распределенного в поверх-ностно-активных веществах (иодофоры). Введение поверхностно-активных веществ позволяет получать препараты стероидов для парентерального и наружного использования. С этой целью используют неионные поверхностно-ак-тивные вещества. Широко известна солюбилизация витаминов и особенно масел. В частности, витамины А и Е были солюбилизированы эфирами сахарозы. В оксиэтилирован-ных эфирах сорбитана солюбилизируются барбитураты, аспирин и другие вещества. [c.172]Несмотря па сложность структур описанных соединений, их химическне свойства — это преимущественно свойства простых алифатических соединений. Так, холевые кислоты образуют сложные эфиры как по карбоксильной группе, так и по спиртовой гидроксильной группе, они подвергаются окислению, давая в качестве конечных продуктов трпкетоны (через стадии обра-зовання моно- и дикетонов). Эстрадиол обладает свойствами фенола II вторичного спирта, в го время как прогестерон дает реакции, ожидаемые для простого кетона и а,р-ненасыщенного кетона (гл. 16). Холестерин ведет себя как алкен и вторичный снирт. Биологический интерес к стероидам сосредоточен на установлении взаимосвязи между структурой и физиологической активностью, а также на выяснении возможных путей синтеза этих соединений в организме. С точки зрения химии стероиды также имеют большое значение и не только сами по себе, но и из-за очень важных стереохимических закономерностей их химических реакций, которые являются в основном следствием жесткости скелета молекулы, образованного конденсированными циклами. [c.361]
Неомыляемые липиды. — При омылении ткани мозга жиры, белки, фосфолипиды и сложные липиды в значительной степени превращаются в водорастворимые, но нерастворимые в эфире вещества. Экстракция эфиром щелочной смеси, образующейся в результате омыления, дает неомыляемую липидную фракцию, содержащую холестерин (строение и конформацию — см. том I 5.12) и небольшое количество сопутствующих стероидов. Холестерин образуется при омылении всех тканей тела, включая и кровь, в 100 которой обычно содержится около 200 м.г холестерина. Около 27% холестерина в крови находится в свободном состоянии, остальное количество этерифици-ровано жирными кислотами ie и ie. Общее количество холестерина, содержащегося в организме человека весом 65 кг, составляет около 250 г. Он образуется в организме в результате биосинтеза, а также (у плотоядных животных) постушает с пищей. [c.639]
Этот метод синтеза успешно применяют в химии стероидов для перехода от карбоновой кислоты к первичному спирту через хлор-ангидрид кислоты и сложный эфир тиокислоты. Хотя при этой реакции получаются также и альдегиды, оказалось, что активный катализатор Ренея W-4 [55] дает количественный выход спирта [121]. При восстановлении не затрагиваются определенные двойне связи и ацильные группы в положении 3 (кроме формильных) [122]. Выходы обычно бывают высокими. [c.240]
Сложные эфиры и лактоны ряда стероидов восстанавливают трех фтористым бором и гидридом металла наиболее подходящим восстановителем оказался боргидрид натрия в смеси диглим — тетрагидрофуран [111. В этих реакциях получались самые различные выходы, причем наифлее высокие выходы были получены для сложных эфиров с разветвленной алкильной группой. [c.369]
Алкилсульфонаты (обычно тозилаты) можно превратить в амины действием аммиака или другого амина. Для проведения реакции с низкокипящими реагентами, такими, как аммиак и простейшие амины, необходимо давление. При реакции с более высококипящими аминами, типа пиперидина, достаточно простого кипячения [44]. Этот метод с успехом применялся в ряду стероидов [45, 46] и сахаров [47, 48]. При взаимодействии аммиака и экваториальных сложных эфиров сульфокислот в стероидных, декалильных и циклогек- [c.509]
Этот синтез детально рассмотрен в литературе [6]. Хлорангидриды кислот можно превратить в эфиры тиоспиртов действием какого-либо меркаптана или алкилмеркаптида свинца. Обычно стандартный катализатор — никель Ренея W-1 или более активный — W-4 приводит к образованию спирта, но если катализатор частично дезактивирован нагреванием в ацетоне в течение 1—2 ч, то получается с удовлетворительным выходом альдегид. Этот синтез применялся в ряду углеводов [7] и стероидов [81. Необходимость использования для восстановления большого количества никеля Ренея (около [c.35]
Образование эфиров енолов с одновременным перемещением двойной связи весьма характерно в ряду стероидов, о чем свидетельствуют многочисленные данные в этой области [62, 33]. Получение еноловых эфиров стероидов проводят, уч-итывая специфику этого класса соединений. Однако эти методы по существу мало чем отличаются от описанных выше для более простых соединений. Обычно суспензию или раствор стероида в соответствующем растворителе (бензол, диоксан и др.) нагревают с ортоэфиром в спирте (или без него) в присутствии таких катализаторов, как Н2504, п-толуолсульфокислота, сульфосалициловая кислота, гидрохлорид анилина и др. (При наличии лабильных по отношению к О2 группировок процесс ведут в атмосфере N2. [c.70]
Элегантный мето 1 окисления ангулярной метильной группы в стероидах был разработан Бартоном и ходе изучения сннтеза альдостерона [2, 3] [схема 2.15 (20, К=Н)] из 21-ацетата кор-тнкостерона (18). Сложный эфир азотистой кислоты и спирга 18 [c.61]
Холестерин и его эфиры жирных кислот, попадая в клетки кишечника, соединяются с белками и образуют липопротеиды, которые переносятся кровью во все ткани организма, в частности в мозг. Кроме того, человеческий организм ежесуточно синтезирует из ацетат-иона примерно 1000 мг холестерина. С пищей же человек получает ежесуточно 500—1000 мг (куриные яйца — высокохолестериновый продукт, одно яйцо содержит около 250 мг этого вещества). Холестерин разрушается в организме в тех же количествах, в которых и поступает выводится он из организма с желчью в виде желчных кислот. Желчные кислоты имеют карбоксильную группу на конце боковой цепи так, холевая кислота С24Н4оОб отличается от холестерина тем, что при атоме С17 имеет боковую цепь —СН(СНз)СН2СН2СООН, а при атомах С7 и С13 —гидроксильные группы. Желчные кислоты — стероиды. Другую важную группу стероидов составляют гормоны (разд. 14.10). [c.408]
Липиды — вещества, имеющие различное химическое строение, но обладающие общим свойством высокой растворимостью в неполярных растворителях. Имеют гидрофобный характер. Различают нейтральные липиды (свободные жирные кислоты и их эфиры, моно-, ди-и триацилглицерины, стероиды, воски, углеводороды) и полярные липиды (глицерофосфолипиды, сфинго- и гликолипиды, цереброзиды). [c.67]
Перегруппировка дибромкетона СЛ под действием метилата натрия в лиэтиловом эфире протекает с 48%-ным [зыходом [66] при применении водного раствора едкого кали или углекислого калия пыход снижается соответственно до 20 и 1% [Ш1]- Однако принадлежащие к ряду стероидов 17,21-дибром-20-кетоны сравнительно мало чувствительны к таким изменениям в условиях реакции [64, 102]. [c.295]
Поразительные примеры- избирательного удаления серы Путем гидрогенолиза можно найти в области стероидов. Среди этих примеров следует указать на превращение бензилтиоеноль-ных эфиров холестенона (ЬХ) и прогестерона (ЬХ1) в холеста- [c.394]
Стероиды получение эфиров для - Справочник химика 21
Для получения эпоксидных соединений надмуравьиная кислота используется реже, чем надуксусная, так как присутствие муравьиной кислоты приводит к быстрому размыканию эпоксидного кольца с образованием формиатов гликолей. Небольших выходов эпоксидных соединений удалось, однако, достигнуть при действии надмуравьиной кислоты на диизобутилен аналогично были получены эпоксидные производные некоторых стероидов Ограничение количества надмуравьиной кислоты до 0,25—0,5 моль на 1 моль позволило провести эпоксидирование непредельных кислот и эфиров При этом использовалась 35—50%-ная перекись водорода, поддерживалась температура 25—35° С и добавлялось небольшое количество минеральной кислоты, например фосфорной, для поддержания pH в интервале О—1,5. Таким образом были получены эпоксидные производные эфиров линолевой кислоты , 3,4-дихлорбутена-1 и 1,4-дихлорбутена-2 Известны и другие варианты метода, предусматривающие использование растворителя (бензола, гексана и др.) и некоторое повышение температуры (60—65° С) [c.227]
Недавно была открыта исключительная важность этих сложных эфиров для синтеза стероидов и терпенов контролируемый -гетеролиз является важным общим способом образования С—С-связи в природе. Так, геранилпирофосфат может быть получен следующим путем [c.315]
В 20%-НОМ водном этаноле при 70° это соотношение равно 5,7 [120]. Аналогично соотношение скоростей ацетилирования транс-и г/ыс-4 трет-бутилциклогексанолов (рис. 2-9, X = ОН) уксусным ангидридом в пиридине [52] составляет 3,8. Соответствуюш,ее соотношение при получении эфира пропионовой кислоты равно 3,3, а при получении эфира изомасляной кислоты — 2,5 . Различие относительных скоростей ацилирования или омыления в зависимости от конформации гидроксильной или сложноэфирной группы в исходной молекуле изучено на большом числе примеров в ряду стероидов (см. [121]). [c.94]
Образование эфиров енолов с одновременным перемещением двойной связи весьма характерно в ряду стероидов, о чем свидетельствуют многочисленные данные в этой области [62, 33]. Получение еноловых эфиров стероидов проводят, уч-итывая специфику этого класса соединений. Однако эти методы по существу мало чем отличаются от описанных выше для более простых соединений. Обычно суспензию или раствор стероида в соответствующем растворителе (бензол, диоксан и др.) нагревают с ортоэфиром в спирте (или без него) в присутствии таких катализаторов, как Н2504, п-толуолсульфокислота, сульфосалициловая кислота, гидрохлорид анилина и др. (При наличии лабильных по отношению к О2 группировок процесс ведут в атмосфере N2. [c.70]
Иммобилизованные клетки микроорганизмов применяют для биотрансформации органических соединений, разделения рацемических смесей, гидролиза ряда сложных эфиров, инверсии сахарозы, восстановления и гидроксилирования стероидов. Иммобилизованные хроматофорь используют в лабораторных установках для синтеза АТФ, а пурпурные мембраны — для создания искусственных фотоэлектрических преобразователей — аналогов солнечных батарей. Разрабатывается реактор на основе иммобилизованных клеток дрожжей для получения этанола из мелассы, в котором дрожжи сохраняли бы способность к спиртовому брожению в течение 1800 ч. Из более чем 2000 известных в настоящее время ферментов иммобилизована и используется для целей инженерной энзимологии примерно десятая часть (преимущественно оксидоредуктазы, гидролазы и трансферазы). [c.93]
Один 113 полученных Ружичкой эфиров оказался идентичен соединению, синтезированному из природных желчных кислот. Поскольку природные стероиды имеют транс-сочлёненне колец С и D, то им отвечает лишь формула (LXXXIX) с р-положением карбоксильной группы. [c.292]
Применению бензиловых и трифенилметиловых простых эфиров в качестве защитных групп в сахарах [164, 165] и глицеридах [166, 167] посвящен ряд обзоров. Трифенилметиловые эфиры использовались и в химии стероидов [4]. Эти эфиры легко образуются при взаимодействии спиртов с хлористым бензилом или трифенилметилом в присутствии щелочи или пиридина. Образованиетрифенил-. метиловых эфиров характерно для первичных, а также для пространственно незатрудненных вторичных спиртов. Бензиловые и трифенилметиловые эфиры очень устойчивы к действию щелочных реагентов и многих окислителей, но легко расщепляются кислотами и восстановителями. В упомянутых обзорах приведено так много примеров получения и применения бензиловых и трифенилметиловых эфиров, что нет необходимости в более подробном изложении вопроса. [c.216]
В отличие от ацеталей сложные эфиры сравнительно очень устойчивы к действию кислот и часто применяются для защиты спиртовой группы в таких реакциях, как окисление, нитрование, получение хлорангидридов кислот, которые протекают в кислой среде. В ряду стероидов, содержащих две или несколько гидроксильных групп, большую роль играют избирательное образование и избирательное омыление сложноэфирных группировок [4]. Для этого часто прибегают к эфирам муравьиной кислоты, так как они могут быть легко получены [188] и гладко омылены, особенно в щелочной среде [189]. Трифторацетаты гидролизуются еще легче и могут раси1,епляться водой (вероятно, в результате аутокаталитической реакции) или абсолютным метанолом в мягких условиях [190]. Трифторацетаты были использованы главным образом в синтетических исследованиях в области сахаров [191] и стероидов [192]. [c.218]
Вторая часть книги содержит 9 глав, в которых дано описание способов получения меченных изотопами углерода карбонильных соединений (гл. V), простых эфиров (гл. VI), гетероциклических соединений (гл. VII), углеводородов и их замещенных (гл. VIII), оксисоединений (гл- IX), ониевых соединений (гл. X). Синтезу меченых сахаров, стероидов и витаминов посвящены главы XI—XIII. [c.5]
Успехи достигнуты при использовании реагентов типа 32-35 для фторирования стероидов. Варьируя условия, удается синтезировать фторированные стероиды с заданным положением атома фтора [130, 144, 146, 147]. Если кетостероиды не превращаются в О-силиловые эфиры, то фторированию они не подвергаются [146, 147]. В случае а,Р-ненасыщенных кето-стероидов также необходимо предварительно получать триметилсилило-вые эфиры енола. Выбор фторирующего агента дает возможность оптимизировать получение нужного изомера. Так, реагент 35 селективно фторирует 3-триметилсилиловый эфир андростадиена-3,5 в положение б, тогда как с реагентом 32 наблюдаются сравнимые выходы 6- и 4-фторпроизводных. [c.104]
Посторонние стероиды. Проводят определение, как описано в разделе Тонкослойная хроматография (т. 1, с. 92), используя в качестве адсорбента силикагель Р1, а в качестве подвижной фазы смесь 77 объемов дихлорметана Р, 15 объемов эфира Р, 8 объемов метанола Р и 1,2 объема воды. Наносят отдельно на пластинку по 1 мкл каждого из двух растворов в смеси 9 объемов хлороформа Р и 1 объема метанола Р, содержащих (А) 15 мг испытуемого вещества в 1 мл и (Б) 15 мг бетаметазона СО в 1 мл на пластинку также наносят 2 мкл третьего раствора (В), состоящего из смеси равных объемов растворов А и Б, I 1 мкл четвертого раствора (Г), содержащего 0,15 мг испытуемого вещества в 1 мл в той же смеси растворителей, которая использована для растворов А и Б. Вынимают пластинку из хроматографической камеры, дают ей высохнуть на воздухе до удаления растворителей и нагревают при 105 °С в течение 10 мин, дают остыть, опрыскивают раствором тетразолия синего в гидроокиси натрия ИР и оценивают хроматограмму в дневном свете. Любое пятно, полученное с раствором А, кроме основного пятна, не должно быть более интенсивным, чем пятно, полученное с раствором Г. [c.59]
С малононитрилом или циануксусным эфиром и серой в присутствии морфолина аналогично взаимодействует андростан-3,17-дион (6.35), причем реагирует только 3-кетогруппа стероида. Образующиеся продукты (6.37) идентичны соединениям, полученным из 3-илиденпроизводных (6.36) [838] [c.127]
Первый пример полного синтеза стероидов был описан в 1939 г. Бахманном, осуществившим вместе с сотрудниками линейную синтетическую цепочку, при которой последовательно проводилось построение одного за другим колец А, В, С и О. Примером подобного синтеза может служить и синтез холестерина по Вудворду [3.7.3]. В последнее время ( ыли разработаны конвергентные сходящиеся) синтетические цепочки при этом сначала получают два фрагмента целевой молекулы по раздельно осуществляемым схемам, а затем, по возможности на одной из последних стадий, соединяют эти фрагменты в более сложную структуру. Такой путь синтеза позволяет уменьшить потери промежуточно синтезируемых соединений, на получение которых ступень за ступенью затрачивается много времени и средств. Поэтому конвергентные пути синтеза со сходящимися цепочками особенно привлекательны для промышленного производства стероидов. Ниже приводится пример построения стероидного скелета с помощью линейного синтеза из метилового эфира 5-оксогептен-6-овой-1 кислоты и 2-метилциклопентандиона-1,3 [3.7.4] (см. схему на с. 696). [c.695]
Ключевой продукт 1 был далее стандартными трансформациями превращен в эфир 20, послуживщий общим исходным соединением для синтеза природных стероидов 2-7. Селективное гидрирование двух сопряженных двойных связей над палладием привело к продукту 21, в котором сохранив-щаяся изолированная двойная связь в цикле В обеспечивала в дальнейшем возможность введения кислородного заместителя в положение 11. Этот путь позволил осуществить успешный синтез кортикостероидов, в том числе кортизона (7). Для получения стероидов 2—6 потребовалось полное гидрирование всех трех двойных связей С=С над платиновым катализатором, приводящее к насыщенному эфиру 22. Кроме удаления лишних функциональных групп, эта реакция приводила к созданию требуемой конфигурации хиральных центров С-10 и С-17. Поскольку превращение эфира 22 в стероиды 2—5 уже было описано ранее, выполненный Вудвордом синтез этого соединения представлял собой одновременно и завершение полного синтеза стероидов 2-5. Наконец, с помощью ряда обьршых методов (присоединение алифатического заместителя в положение 17 и трансформации функциональных групп) из эфира 22 был синтезирован холестерин (6). [c.293]
Этот метод сходен с разработанным Фетизоном методом получения Д2-стероидов восстановленнем лнтием —аммиаком енольных диэтиловых эфиров фосфорной кислоты, получаемых из 2-бромке-тоноВ З (см. Триэтилфосфит в этом томе). [c.120]
Описан метод [3] определения положения атомов дейтерия, присоединенных к циклогексановым кольцам. Полученные данные показывают, что для дифференциации между аксиальными и экваториальными ориентациями дейтерия в производных циклогексана может быть использован метод инфракрасной спектроскопии. Соответствующие исследования проводили с указанными ниже стероидами, которые были помечены в определенных положениях с использованием реакций, характеризующихся заведомо известной стереонаправленностью. Холеста н-За-Н был получен восстановлением эфира холестанола-Зр и п-толуолсуль- [c.437]
Ряд интереснейших примеров можно привести из области стероидов и алкалоидов. Так, из уабагенина XXIV при действии ортомуравьиного эфира был получен ортоформиат XXXIV [121], что возможно только в том случае, если ангулярная окси-метильная группа и две гидроксильные группы при С-1 и С-5 имеют г мс-ориентацию [c.579]
Циклические ангидриды. Для решения вопросов стереохимии кроме методов получения лактонов и простых циклических эфиров используется также метод окисления природных соединений до дикарбоновых кислот, способных при соответствующей конфигурации к образованию ангидридов. Этот метод широко применялся в области стероидов, и полученные данные легли в основу многих выводов относительно стереохимии этих соединений. Типичный пример описан Виланд ом и Дэйном [144], изучившими стереохимию сочленения колец /D в 12-кетохолановой кислоте LXXXVII. [c.590]
Хотя эти реакции не очень привлекательны в синтетическом отношении, отдаленная функционализация более жестких субстратов, особенно стероидов, использовалась для получения продуктов, синтез которых до этого представлял значительные трудности [114]. После изучения молекулярных моделей было предсказано, что при облучении бензофенон-4-пропионовокислого эфира За-холестано-ла (84) функционализация должна происходить при С-12, С-14 и С-7. Облучение (84) в концентрации, достаточно низкой для предотвращения межмолекулярных реакций (Ю" М), привело к олефину (85) (35%) и двум лактонам (86) (45%) и(87) (19 /о). Олефин получался путем отщепления водорода, связанного с С-14, и последующего дополнительного отщепления под действием образовавшегося радикала, что приводило к появлению двойной связи. [c.807]
Применяют для получения TMS-эфиров стероидов, содержащих труднодоступные ОН-группы (например, кортикостероидов), а также спиртов, фенолов, гликолей, сахаров, оксиаминов, оксикислот, аминокислот, летучих жирных кислот, флавоноидов, нуклеотидов, барбитуратов. Реагирует только с гидроксильными группами. Для силилирования стероидов часто используют смесь TSIM, BSA (или BSTFA) и TM S в соотношений 3 3 2, без добавления растворителя. Реакция протекает 1—2 ч при 100—200 °С. [c.353]
Реактив для получения трет-бутил-ВМЗ-эфиров углмодов, нуклеозидов, стероидов. Эфиры отличаются устойчивостью к гидролизу. [c.356]
Метод обмена с донором цианистого водорода (нерегидроцианиро-вание) был с успехом использован в ряду стероидов (Эрколи, 1953). При получении гормона тестостерона образование циангидрина использовалось для защиты одной из кетогрупп Д -андростен-3,17-диона I, чтобы сделать возможным дальнейшее ее избирательное превращение. Дион I в количестве 20 г растворяли при слабом нагревании в ацетон-циангидрине II, полученном по приведенной выше схеме, и по охлаждении выделяли из раствора кристаллический 17-циангидрин III. Образование этого продукта с высоким выходом в присутствии большого избытка реагента показывает, что в данном случае кетогруппа в насыщенном кольце D является значительно более реакционноспособной, чем 3-кетогруппа, находящаяся в сопряжении с двойной связью. Циангидрин III был затем превращен в этиловый эфир енола IV действием при 65 °С ортомуравьиного эфира в среде сухого бензола и абсолютного этилового спирта, содержащего следы хлористого водорода. При этом твердое исходное вещество быстро растворялось и начинал кристаллизоваться продукт IV. В следующей стадии при восстановлении натрием в н-про пиловом спирте происходило элиминирование цианистого водорода под влиянием основного реагента и восстановление освобождающейся 17-карбонильной группы (атака сзади). Продукт V является этиловым эфиром енола тестостерона и при подкислении реакционной смеси он гидролизуется до тестостерона VI [c.489]
Фениловые эфиры получают прямым путем, как отмечалось выше. Синтез эфиров енолов из альдегидов и кетонов, существующих в основном в кето-форме, требует в некоторых случаях специальных методов. Енолацетаты обычно получают реакцией карбонильного соединения с ацетангидридом и хлорной кислотой или п-толуолсульфокислотой, как, например, в случае селективного получения ацетата стероида [78] (схема (100) . Этот метод представляет собой обилий путь синтеза енолацетатов из метилкетонов, однако, как правило, образование продукта определяется термодинамикой процесса, в то время как при использовании в качестве ацилирующего агента изопропенилацетата (39) выход продукта зависит от кинетики [79]. Енолацетаты из альдегидов можно получать катализируемым основаниями ацетилированием [80] (схемы (101) и (102) . Для синтеза ацетатов из кетонов, способных к енолизации можно также использовать [34] сульфоуксусную кислоту Me OOSOaOH [81]. [c.309]
chem21.info
Эфирные растворы стероидов | SportPharma
Одним из самых недопонимаемых веществ в мире стероидов является эфир, именно он на самом деле определяет, как работает тот или иной раствор тестостерона — ципионат, энантат, Сустанон… Если ты быстро пробежишься по Интернету фармакологическому, то найдешь немало статей, в которых одни формы тестостерона объявляются значительно более эффективными по сравнению с другими. Аргументация при этом всегда очень похожа и, как правило, беспочвенна. В этой статье мы попытаемся еще раз взглянуть на сложные эфиры и на то, как они действуют на стероиды.
Что такое эфир и как он работает
Можно быть уверенным, что, если ты интересуешься анаболиками, ты неоднократно отмечал сходство многих этикеток. Возьмем, например, тестостерон. Можно отыскать препараты типа тестостерона ципионата, энантата, пропионата, хептилата, капроата, изокапроата, деканоата, ацетата, этот список можно продолжать и продолжать. Во всех случаях общий элемент — гормон, тестостерон, модифицированный добавлением эфира (энантата, пропионата и т.д.) в его структуру. При явном наличии общего структурного элемента возникает вопрос: чем отличаются друг от друга все эти модификации тестостерона применительно к использованию их в бодибилдинге? Эфир представляет собой цепочку, состоящую преимущественно из атомов углерода и водорода. В большинстве случаев эта цепочка цепляется к стероидному гормону в позиции 17-го атома углерода (бета-ориентация), в некоторых случаях стероиды держат эфир на 3-ей позиции (в рамках темы данной статьи точное положение эфира не критично). Такое присоединение эфира (эфиризация) придает всем инъекционным анаболическим/андрогенным стероидам одно важное свойство — замедление выделения собственно стероида в организм из места инъекции.Это происходит потому, что эфир заметно снижает степень растворимости стероида в воде и заметно увеличивает его липидную (жировую) растворимость. Это приводит к образованию временного запаса препарата в мышечной ткани и дальнейшему выделению его в кровь в небольших количествах. В большинстве случаев, чем длиннее эфирная цепочка, тем меньше растворимость стероида в воде и тем медленнее препарат начинает участвовать в основном обмене. Замедление выделения препарата в кровь — большое преимущество для стероидных курсов, поскольку свободный тестостерон (и другие стероидные гормоны) в человеческом организме живет очень небольшое количество времени (до нескольких часов). Это делает необходимым неприятную процедуру инъекций препарата несколько раз в день по расписанию для поддрежания постоянного уровня гормона в крови. При добавлении в состав препарата эфиров, частота инъекций сильно сокращается. Без применения эфиров стероидная терапия была бы значительно более трудоемком и неприятным делом. Эфиризация временно деактивирует молекулу стероида, лишает ее рабочих свойств. Когда эфирная цепочка цепляется на 17-ю бета позицию, молекула не может удерживаться андрогенным рецептором (никакой активности, по крайней мере, он не проявляет). Для того, чтобы препарат стал активным, нужно удалить из его состава эфир. Это происходит автоматически когда препарат проникает в кровоток, где надлежащие энзимы быстро удаляют из его состава (путем гидролиза) эфирную цепочку. Это восстанавливает необходимую гидроксильную группу в 17-й позиции и делает препарат способным цепляться к нужному рецептору. Вот теперь и только теперь стероид готов оказывать какое-то влияние на скелетные мышцы. И теперь становится ясным, что споры о том, что эффективней работает — тестостерона ципионат или тестостерона энантат, не имеют реальной основательной почвы под ногами, ведь мышцам важно только наличие свободного тестостерона, им совершенно все равно, с каким эфиром стероид связан изначально
Действие различных эфиров
Существует большое разнообразие различных эфиров, используемых вместе с анаболическими/андрогенными стероидами, но, повторим опять, все они делают в основном одно и то же. Отличабтся они только в одном: в способности уменьшать растворимость стероида в воде. Например, такой эфир, как пропионат задерживает выделение стероида на несколько дней, в то время, как, например, деканоат увеличивает этот срок до нескольких недель. Эфиры не оказывают никакого действия ни на склонность базового стероида к конвертации в эстроген или в дигидротестостерон, ни на то, как препарат способствует наращиванию мышечной массы. Единственные различия могут быть отмечены бодибилдерами, которые пользовались различными эфирными растворами одного и того же базового стероида, они нося чисто временной характер. Тестостерона энантат вызывает проблемы с эстрогеном гораздо охотнее, чем Сустанон, это происходит просто потому, что с энантатом пиковый уровень тестостерона в крови достигается гораздо быстрее и проходит тоже быстрее (1-2 недели против 3-4). Подобные ему суспензии тестостерона являются наиболее опасными в плане гинекомастии и задержек воды по одной и той же причине — уровень гормона в крови подскакивает очень быстро. Вместо нескольких недель уровень гормона в крови достигает своей максимальной точки за пару дней.В остальном, при одном и том же рабочем уровне тестостерона в крови, между различными эфирами нет никакого различия в плане ароматизации или конвертации в ДГТ. Однако справедливости ради нужно отметить, что различные эфиры потенциально способны влиять на действие препаратов. Чем тяжелее эфирная цепочка, тем больше ее доля в общем весе препарата. Например, в тестостерона энантате на 250 мг препарата приходится всего 180 мг чистого тестостерона. 70 мг из каждой 250 миллиграммовой инъекции приходится на эфир и выводится из организма. Если уж совсем углубляться в детали, нужно сказать, что энантат немножко более сильнее ципионата (хотя это и расходится с общественным мнением), поскольку его эфирная цепочка содержит на один атом углерода меньше, а значит занимает меньше места в общем объеме препарата. Из трех рассматриваемых суспензий, первое место занимает, конечно, пропионат, поскольку конечный выход полезного продукта от него выше, чем от ципионата или энантата.
Краткие характеристики основных сложных эфиров
Сустанон: «король» тестостероновых смесей.
Эта смесь из четырех различных эфиров тестостерона весьма привлекательна для простого клинического пользователя, это без сомнений. Но для бодибилдера это все — чистой воды маркетинг («Слышь, пельмень, зачем тебе покупать один раствор, когда можно купить сразу целых четыре?!»). Да, в клинических условиях известно немало удачных его применений. Если ты проходишь курс стероидной терапии, Сустанон может быть гораздо комфортным выбором, чем энантат. К доктору на уколы нужно ходить реже, между инъекциями состав крови держится гораздо ровнее. Но бодибилдеру, которому нужно 4 ампулы сустанона в неделю, должно быть все равно — оптом колоть четыре разные суспензии или в розницу.
Фактически, Сустанон в силу его высокой стоимости по сравнению с простыми суспензиями тестостерона, должен быть гораздо менее выгодной покупкой, чем, например, ципионат или энантат. Не нужно западать на модные смеси, это, в-общем то, обычная 250 мг ампула, и стоит этот препарат обычно в два раза дороже, чем энантат, так что покупку сустанона вполне можно приравнять в выбрасыванию денег на ветер. Так что лучше не выдумываь и пользоваться тем же энантатом, а дорогими продуктами пусть пользуются ребята, которым больше некуда девать деньги.
Ацетат: химическая структура C2h5O2. Смотри также: Acetic Acid; Ethylic acid; Vinegar acid; vinegar; Methanecarboxylic acid. Ацетатные эфиры задерживают выделение стероида всего на пару дней. Вопреки многочисленным заявлениям, ацетатные эфиры не усиливают жиросжигающие эффекты, такого физиологического механима попросту нет. Этот эфир применяется в таблетках для орального применения — Примоболан (метенолона ацетат), капсулах для подкожного применения — Финапликс (тренболона ацетат) и иногда для суспензий тестостерона.
Пропионат: химическая структура C3H6O2. Смотри также: Carboxyethane; hydroacrylic acid; Methylacetic acid; Ethylformic acid; Ethanecarboxylic acid; metacetonic acid; pseudoacetic acid; Propionic Acid. Пропионатовые эфиры задерживают выделение стероида на несколько дней. Чтобы состав крови не скакал во время курса препарата, его обычно назначают два-три раза в неделю. Популярные наименования — тестостерона пропионат и метандриола дипропионат (два одинаковых эфира, прикрепленных к одному базовому стероиду — метандриолу).
Фенилпропионат: химическая структура C9h20O2. мотри также: Propionic Acid Phenyl Ester. Фенилпропионат работает на два дня дольше, чем пропионат. Инъекции назначают минимум два раза в неделю. С этим эфиром наиболее часто комбинируют дураболин (нандролона фенилпропионат), также он используется с тестостероном в Сустаноне и Омнадрене.
Изокапроат: химическая структура C6h22O2. Смотри также: Isocaproic Acid; isohexanoate; 4-methylvaleric acid. Изокапроат работает столько же, сколько и энантат. Приемлемый уровень гормона держится неделю. Этот эфир используется с тестостероном в сустаноне и Омнадрене.
Капроат: химическая структура C6h22O2. Смотри также: Hexanoic acid; hexanoate; n-Caproic Acid; n-Hexoic acid; butylacetic acid; pentiformic acid; pentylformic acid; n-hexylic acid; 1-pentanecarboxylic acid; hexoic acid; 1-hexanoic acid; Hexylic acid; Caproic acid. Этот эфир эквивалентен изокапроату по количеству атомов и весу, но имеет иную стуктуру. Время выделения практически такое же, как и у изокапроата, уровень держится около одной недели. Капроат — наиболее медленный из эфиров, это объясняет, почему преператы с его участием вызывают такую сильную задержку воды.
Энантат: химическая структура C7h24O2. Смотри также: heptanoic acid; enanthic acid; enanthylic acid; heptylic acid; heptoic acid; Oenanthylic acid; Oenanthic acid. Энантат — наиболее часто используемый из эфиров, комбинируется в основном с тестостероном, но используется также и в других препаратах, например в Примоболан Депо. Препараты с энантатом поддерживают уровень гормона в течение 10-14 дней. В медицине препараты энантата назначают раз в две недели или даже один раз в есяц, но атлеты применяют его гораздо чаще, минимум раз в неделю для поддержания постоянного уровня гормона в крови.
Ципионат: химическая структура C8h24O2. Смотри также: Cyclopentylpropionic acid, cyclopentylpropionate. Ципионат очень популярен в Штатах. Время выделения почти такое же, как у энантата (10-14 дней), в американской медицине оба они применяются как взаимозaменяемые. Атлеты твердо убеждены, что ципионат гораздо мощнее, чем энантат, хотя на самом деле разница между ними очень мала. Цепочка энантата немного меньше по размеру и поэтому препарат выделяет чуть больше стероида в кровь по сравнению с ципионатом.
Деканоат: химическая структура C10h30O2. Смотри также: decanoic acid; capric acid; caprinic acid; decylic acid, Nonanecarboxylic acid. Деканоат наиболее часто используется в препаратах нандролона (ретаболил, например) и встретить его можно практически во всех уголках мира. Тестостерона деканоат также является компонетом Сустанона с самым боьшим сроком действия, он значительно увеличивает срок работы этого препарата в организме. Время выделения препаратов на основе деканоата объявлялись какие-то нереальные, порядка одного месяца, практический опыт применения показал, что уровень гормона в крови значительно падает уже после двух недель. Для поддержания постоянного состава крови атлеты делают инъекции в среднем раз в неделю.
Ундесиленат (Undecylenate): химическая структура C11h30O2. Смотри также: Undecylenic acid; Hendecenoic acid; Undecenoic acid. Этот эфир очень похож на деканоат, но содержит на один атом углерода больше. Время выделения примерно такое же (2-3 недели), может быть на день или около того больше, чем у деканоата. Ундесиленат применяется исключительно в ветеринарной практике, например — Эквипоиз (болденона ундесиленат), но нет никаких видимых причин, почему бы ему не работать и в человеческом организме (Эквипоиз в спортивной практике зарекомендовал себя хорошо). Назначается еженедельно.
Ундеканоат: химическая структура C11h32O2. Смотри также: Undecanoic Acid; 1-Decanecarboxylic acid; Hendecanoic acid; Undecylic acid. Это не очень широко распространенный эфир, используется только в препарате нандролона (Динаболан) и в оральном тестостерона ундеканоате, Андриоле. Химически он очень похож на ундесиленат (на два атома водорода больше), поэтому время выделения почти такое же (примерно 2-3 недели). Хотя только это препарат используется в оральном Андриоле, нет никаких оснований верить тому, что он обладает какими-то уникальными свойствами по сравнению с другими эфирами. Фактически, по доставке тестостерона в организм Андриол работает очень плохо, лишний раз подтверждая тем самым, что эфирные препараты тестостерона не годятся для орального применения.
Лаурат: химическая структура C12h34O2. Смотри также: Dodecanoic acid, laurostearic acid, duodecyclic acid, 1-undecanecarboxylic acid, and dodecoic acid. Лаурат — наиболее долго выделяющий эфир, используемый в коммерческой фармакологии (хотя на самом деле, существуют и более «долгоиграющие» эфиры). Период выделения может достигать одного месяца, хотя уже после третьей недели уровень гормона в крови значительно падает. Лаурат применяется исключительно в ветеринарном препарате нандролона, Лаураболине. Атлеты используют это препарат по еженедельной схеме.
Заключение
Хотя вклад эфиров в стероидную медицину весьма велик и значителен, ясно видно, что никакого волшебства тут нет. Механизм действия эфиров хорошо изучен и вполне предсказуем, и не меняет в характере действия базового стероида ничего, кроме времени действия. Вокруг многих стероидных препаратов (типа Омнадрена, Сустанона, тестостерона ципионата и пр.) напущено немало тумана, дающего пищу для праздных измышлений, на самом деле это все малосущественно и на такие вещи атлету-химику внимания лучше не обращать. Тестостерон — он и в Африке тестостерон, и тому, кто морочит вам голову рассказами о превосходстве одного раствора над другим, лучше немного побольше поработать с литературой и поменьше болтать.
sportpharma.ru
Функционально-силовой тренинг: Строение стероидов их синтез и секреция.
Стероиды обладают необычайно большим разнообразием биологических возможностей, в их число входят: восстановительные процессы в органах и тканях, деление клеток, защитные процессы (некоторые иммунные возможности), обмен веществ (жиров и углеводов), развитие мышечных тканей и многое другое.
Обычно стероиды разделяют по типу их воздействия и по способу их синтезирования, по второму способу стероиды делятся на глюкокортикостероиды, гонадотропные, минералкортикостероиды (глюкокортикостероиды – синтезируются в коре надпочечников).
По первому типу стероиды разделяются на андрогенный, эстрогенные, анаболические и катаболические стероиды. Я думаю здесь не нужно объяснять, почему именно так.
По сути, стероиды не что иное, как жиросжигатели или гормоны способные бороться с жировыми отложениями. Структура стероида представляет собой соединение из четырех колец, три циклогесановых кольца и одно циклопентановое. Подробнее можно увидеть на рисунке.
На следующем рисунке можно увидеть положение углеводов в стероидах.
Сквален.
Синтез стероида начинается со сквалена. Сквален – это сложная линейная молекула ароматического типа. Сквален изображен на третьем рисунке.
Сквален – это важнейший промежуточный этап в метаболизме стероидов. Часто встречается в организме растений и животных. Сквален впервые был получен путем его выведения из печени акулы. Превращение сквалена на уровне ферментов в холестерин(любые стерины), начинается с первичного преобразования в ланостерит. Данное превращение возможно при окислении концевой связи сквалена.
Данный процесс, возможно, является наисложнейшей химической реакцией во всей биологической химии.
Холестерол.
Второй этап в синтезе стероида. Холестерол – непосредственный предшественник полового стероида. Лимитирующим этапом в данном случае является отслоение боковой цепи холестерола. Идентично происходит и процесс мутации холестерола в прегненолон как в яичниках и семенниках, так и в надпочечниках. Отличие лишь одно в некоторых случаях процесс происходит благодаря ЛГ, а не АКТГ.
Прегненолон.
Стероиды по своим функциям практически идентичны на молекулярном и клеточном уровнях. Как я уже говорил стероиды – жиросжигатели, по этой причине они без особых проблем проникают сквозь клеточную мембрану прямо в цитоплазму, после чего сливаясь с рецептором морфируют в рецептор-стероид. Далее в реацкции следует димеризация (образование двойной молекулы димера), после чего получаемый в процессе димер, соединяется с клеточным ДНК. Изображение данного процесса можно увидеть ниже.
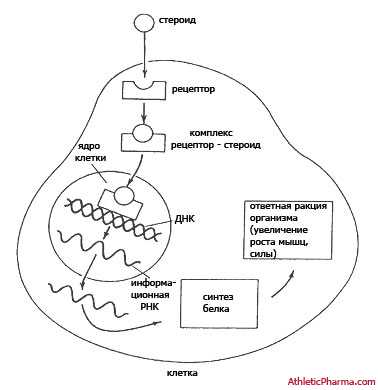
Процесс воздействия стероидов на гены и производство белка, крайне сложная к растолкованию вещь. В данном случае существует несколько “НО” – воздействие на ген зависит от множества факторов (тип клетки и т.д.), также синтезируемые белки зачастую морфируются с ДНК, отвечающим за работоспособность других генов. В общем, я не буду углубляться в дебри, а просто оставлю желание или нежелание изучать данный вопрос отдельно на ваше усмотрение.
Далее будет представлено описание структуры некоторых стероидов.
Тестостерон.
Тестостерон - первый стероид структуру и превращение, которого мы изучим подробно.
Есть два пути осуществления метаболических превращений тестостерона. Первый способ это окисление. А второй это создание связи между первичным кольцом и третьей кетогруппой.
Первый способ характерен для большинства тканей, в их число входит и печень, в его результате на выходе мы получаем 17-кетостероиды (данные кетостероиды отличаются более малой активностью или ее полным отсутствием, по сравнению с первичным соединением).
Второй способ – способ менее эффективный, ведущий к образованию активного метаболита ДТГ и эстродиола, а также агдростандиола.
Из всего этого можно делать вывод, тестостерон частично является прогормоном, для такого вывода есть 2 причины. Первое: тестостерон синтезируется в более активный дигидротестостерон; Второе: данное превращение преимущественно происходит в тканях.
Тестостерон, а особенно свободный тестостерон, в связи с альбумином, способен с легкостью проникать в целевые клетки. Внутри этих клеток и происходит метаморфоза тестостерона в эстрадиол и дигидротестостерон. Дигидротестостерон образуется в предстательной железе в количестве 300 мкг в сутки. В свою очередь эстрадиол образуется в яичках и за их пределами в количества 40 мкг. Высоко активный андроген – андростандиол, также получается из тестостерона.
Более сложные типы тестостерона.
Более сложные и комплексные эфиры тестостерона образованы путем соединения боковых цепей атомов (Углевод, водород, кислород) и малекулы тестостерона. Таким путем образуются: тестостерон энантат, ципионат и пропионат. Сложные тестостероны дольше попадают в кровь, они обладают сниженной растворимостью в воде и повышенными функциями жиросжигателя. Сложные эфиры в соединении с тестостероном, превращают его в неактивный тестостерон. Мешая, таким образом, его связи с рецепторами. Активация стероида происходит благодаря ферменту эстеразе, данный фермент способен отщеплять сложные эфиры и возобновлять реакцию воссоединению тестостерона и рецептора.
Тестостерон ципионат.
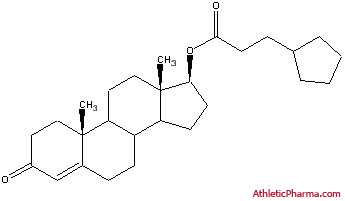
Тестостерон ципионат входит в число самых сложных эфиров тестостерона. Основное отличие тестостерон ципионата заключается в его формуле, в ней вместо водорода в группе С17, к нему прицеплено 8 атомов углерода, кольца циклопентана и одна кармоновая группа (=О) (боковая цепь). Сложные эфиры обладают способностью, соединятся не только с тестостероном, но и с другими стероидами. Морфирование тестостерона в дигидротестостерон, происходит в яичках и за их пределами, с помощью 5альфа-редуктазы.
ДГТ(дигидротестостерон).
С помощью 5альфа-редуктазы в ДТГ превращаются не все стероиды. Особенности ферментов, позволяются соединяться каждому из них только с определенным субстратом (по своему действию данная особенность схожа на систему замок/ключ).
Нандролон Деканоат.
Как можно заметить отличие нандролона от тестостерона заключается в отсутствии метиловой группы (СН3), на ее месте находится водород С10. Нандролон конвертируется также с помощью 5альфа-редукозе, возможно это благодаря его схожести с тестостероном (на выходе получается дигидронандролон, схожий с ДТГ).
Стероиды (не все) имеют предрасположенность к ароматизации (превращение андрогеновых веществ в эстрогеновые, при участии ароматазы – отсюда и название). Ниже представлен пример метаморфозы тестостерона в эстрадиол.
Проведя сравнение тестостерона и эстродиола можно сделать вывод о том, что отсутствует метиловая группа в С10, а на позиции С3 кислород конвертировался в гидроксильную группу. Процесс ароматизации вызвал потерю углерода и образование двоичных цепей (для свершения ароматизации в составе стероида должна находится метиловая группа С10, именно из-за отсутствия метила нандролон не превращается в андроген). Также нандролон не может конвертироваться в эстроген по причине видоизмененности своей формулы (в таких условиях ароматоза перестает выполнять свои функции).
Оксандролон.
Ярким примером невозможности конвертации в эстроген по причине измененной формулы является оксандролон. В нем присутствует метил на позиции С10, однако отсутствует углерод (С2), на его месте находится кислород. Как я уже говорил, в таких условиях ароматоза не справляется со своими функциями.
Станазолол.
Станозолол также следует отнести к числу неспособных к ароматизации стероидов. Станозолол обладает пятью кольцами в своей структуре, что и препятствует его ароматизации.
Еще одной конвертацией свойственной некоторым стероидам является 17 альфа-алькилирование, в данном случае на позицию С17 присоединяется метиловая группа СН3. Попадая в печень, данные стероиды фактически не видоизменяются, также они обладают большим временем распада. Примером такой мутации является описанный выше оксандролон. Еще одна их особенность заключается в том, что оральные стероиды такого типа более токсичны, чем их инъекционные собратья.
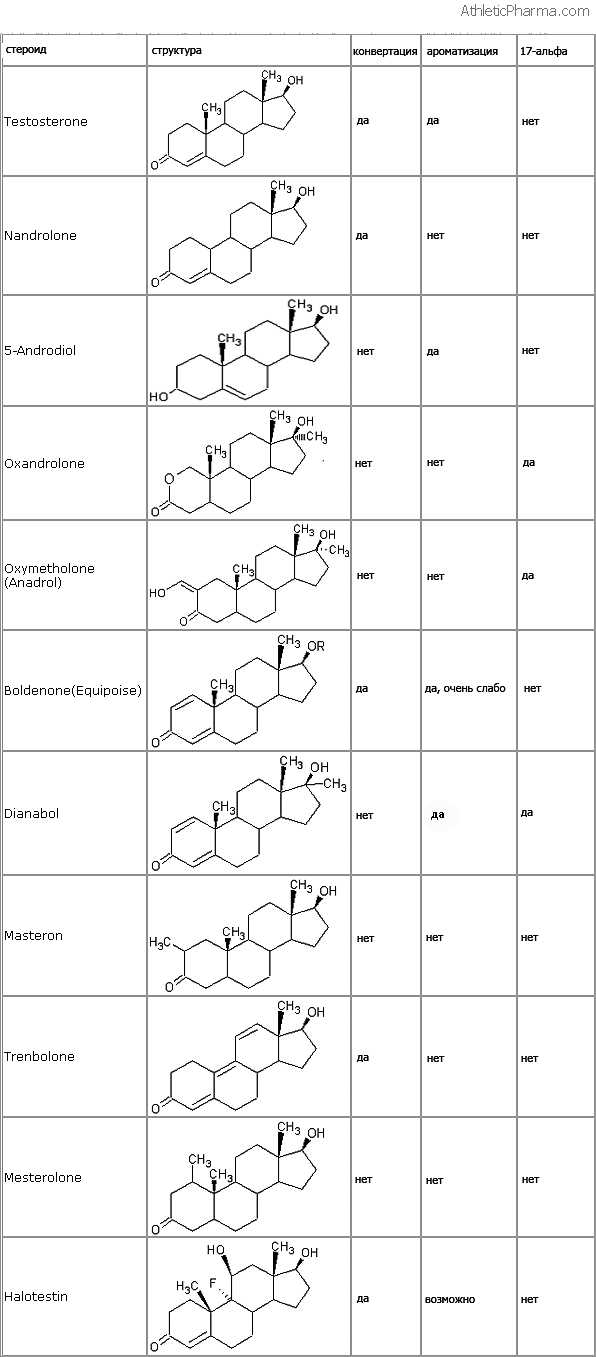
В ниже представленной таблице вы найдете свойства стероидов(возможных превращений) не описанных в этой статье.
Таблица возможных превращений стероидов:
functionalalexch.blogspot.com
СТЕРОИДНЫЕ ГОРМОНЫ, ИХ ПРОИЗВОДНЫЕ И ЭФИРЫ
 Стероиды - это широкий класс веществ, являющихся производными конденсированного карбоциклического углеводорода стерана (циклопентанпергидрофенантрена, состоящего из трех циклогесановых и одного циклопентанового колец).
Стероиды - это широкий класс веществ, являющихся производными конденсированного карбоциклического углеводорода стерана (циклопентанпергидрофенантрена, состоящего из трех циклогесановых и одного циклопентанового колец).В зависимости от химической структуры стероиды делятся на несколько подгрупп: Стеролы (Sterols), Брассиностероиды (Brassinosteroids), Буфадиенолиды (Bufadienolides), Карденолиды (Cardenolides), Кукурбитацины (Cucurbitacins), Экдистероиды (Ecdysteroids), Сапогенины (Sapogenins), Стероидные алкалоиды (Steroid alkaloids), Витастероиды (Withasteroids), Желчные кислоты (Bile acids), Гормональные стероиды (Hormonal steroids).
Стеран
Наиболее известный из стероидов - холестерин (холестерол), являющийся, кроме всего прочего, прекурсором для синтеза большинства стероидных гормонов. В организм человека холестерин поступает вместе с пищей, а так же синтезируется в печени и клетках.
Стероидные гормоныCтероидные гормоны - это жирорастворимые (липидные) гормоны, являющиеся по структуре стероидами, но способные проникать через клеточную мембрану и избирательно взаимодействуя со специфическими ядерными рецепторами вызывать изменения в генетическом аппарате клетки, то есть осуществляющие гормональную регуляцию в организме человека.
Выделяют четыре наиболее общие группы стероидных гормонов: минералкортикоиды, глюкокортикоиды, андрогены и эстрогены. Основными представителями этих каждой из этих групп являются альдостерон, кортизол, тестостерон и эстрадиол соответственно. Кроме того, выделяют группу прогестагенов, основным представителем которой является прогестерон. Дополнительно разделяют стероидные гормоны из этих пяти групп на две условные группы: половые гормоны (прогестагены, андрогены и эстрогены) и кортикостероиды (минералкортикоиды и глюкортикоиды).
Основные стероидные гормоны человека и пути их синтеза
Синтез различных стероидных гормонов из холестерина осуществляется последовательными ферментативными реакциями. Основной путь стероидогенеза, приводящий к образованию минералокортикоидов, глюкокортикоидов, андрогенов и эстрогенов, представлен на приведенном рисунке. Первая стадия на пути превращения холестерина в прегненолон является реакцией, которая происходит во всех стероид-продуцирующих тканях. Эта стадия, лимитирует скорость синтеза стероидных гормонов. Последующие ферментативные реакции стероидогенеза происходят только в определенных тканях.
В организме человека не существует никакого механизма, способствующего накоплению стероидных гормонов в клетках. Только гормональный предшественник в форме эфиров холестерина накапливается в стероид-продуцирующих клетках в значительных количествах. Синтезированные же в них стероидные гормоны быстро попадают через клеточную мембрану в кровяное русло, и, осуществляя свою гормональную регуляцию, постепенно выводятся из организма (в активной форме стероидные гормоны имеют относительно малый период полувывода).
Регуляция синтеза стероидных гормонов осуществляется с помощью пептидных гормонов вырабатываемых гипоталамусом и гипофизом. Кортикотропин, вырабатываемый гипофизом, стимулирует секрецию кортикостероидов (минералкортикоидов и глюкокортикоидов). Гонадотропины (фоллитропин и лютеотропин), вырабатываемые передней долей гипофиза, стимулируют синтез андрогенов и эстрогенов. В свою очередь, гонадолиберин, вырабатываемый гипотоламусом контролирует синтез и освобождение гипофизных гонадотропинов.
Выработка пептидных гормонов гипоталамусом и гипофизом зависит от концентрации контролируемых гормонов в крови и регулируется по принципу обратной связи. Попадание в организм экзогенных стероидных гормонов со скоростью, превышающей скорость синтеза соответствующих эндогенных стероидных гормонов, практически полностью подавляет выработку стимулирующих пептидных гормонов, что приводит к подавлению механизмов синтеза соответствующих эндогенных гормонов, и в результате нарушается общий гормональный баланс в организме.
Эфиры стероидовЭфир представляет собой цепочку из атомов углерода, водорода и кислорода, которая присоединяется к молекуле стероида (обычно на место атома водорода в 17-ой позиции), образуя эфир стероида. Эфиры стероидов имеют повышенную жирорастворимость и пониженную водорастворимость, в результате чего они надолго задерживаются в организме и медленней поступают в кровь из места инъекции.
Стероид с присоединенным к нему сложным эфиром является неактивным и не способен связываться с рецепторами. Активация стероида происходит при отщеплении эфира от стероида под действием фермента эстераза (с восстановлением водорода для формирования гидроксильной группы в 17-ой позиции, если эфир был присоединен к ней), после чего стероид способен взаимодействовать с рецепторами. Свойств самого стероида эфир не изменяет - после его отщепления стероид действует как обычно и выводится из организма со скоростью зависящей от собственного периода полувывода (полураспада) этого стероида из организма.
Как правило, чем длиннее эфирная цепочка, тем меньше водорастворимость эфира стероида, он медленнее начинает действовать, но имеет больший период полураспада. Кроме того, чем тяжелее цепочка, тем больше ее доля в общем весе эфира стероида, а значит, относительная концентрация самого стероида ниже.
Список основных эфиров стероидов:Название эфира и его период полураспада в организме, в сутках Существующие эфиры стероидов Препараты, в состав которых входит эфир стероидаАцетат(Acetate)Формула: C2h5O2Масса: 60.0524 г/мольТемп. плавления: 16.6 °C
3 Метенолона Ацетат(Methenolone Acetate) ПримоболанPrimobolan
Стенболона Ацетат(Stenbolone Acetate) Анотрофин, СтенболонAnatrofin, Stenbolone
Тестостерона Ацетат(Testosterone Acetate) Тренболона Ацетат(Trenbolone Acetate,Trembolone Acetate) Тренбол, Финаджект, Финаджет, ФинапликсFinaject, Finajet, Trenbol
Бензонат(Benzonate) 6 Эстрадиола Бензоат(Estradiol Benzonate) ЭстандронEstandron
Бутират(Butyrate) 6 Тестостерона Бутират(Testosterone Butyrate) Валерат(Valerate) 7.5 Эстрадиола Валерат(Estradiol Valerate) Гексагидробензилкарбонат(Hexahydrobenzylcarbonate)Масса: 130.1864 г/моль
12 Тренболона Гексагидробензилкарбонат(Trenbolone Hexahydrobenzylcarbonate,Trembolone Hexahydrobenzylcarbonate) ПараболанParabolan
Гексаноат(Hexanoate) 9 Тестостерона Гексаноат(Testosterone Hexanoate) ОмнадренOmnadren
Гексилоксифенилпропионат(Hexyloxyphenylpropionate) 12 Нандролона Гексилоксифенилпропионат(Nandrolone Hexyloxyphenylpropionate) АнадурГептаноат(Heptanoate) 10.5 Тестостерона Гептаноат(Testosterone Heptanoate) Гептилат(Heptylate) 10 Тестостерона Гептилат(Testosterone Heptylate) Тестостерон терамексTestosterone Teramex
Деканоат(Decanoate)Формула: C10h30O2Масса: 172.24 г/моль
15 Тестостерона Деканоат(Testosterone Decanoate) СустанонSustanon
Нандролона Деканоат(Nandrolone Decanoate) Анаболин, Дека-Дуболин, Дека-Дураболин, Дека-Дурабол, Еболан, Нурецан, Ретаболил, Стероболин, Туринабол Депо, Циремилон, Экстраболин, ЭлпихормоAnaboline, Jebolan, Deca-Durabolin, Deca-Durabol, Deca-Durabolin, Elpihormo, Extraboline, Nurezan, Retabolil, Sterobolin, Turinabol Depot, Ziremilon
Изогексаноат(Isohexanoate) 9 Тестостерона Изогексаноат(Testosterone Isohexanoate) ОмнадренOmnadren
Изокапроат(Isocaproate)Формула: C6h22O2Масса: 116,14 г/моль
9 Тестостерона Изокапроат(Testosterone Isocaproate) Сустанон, Омнадрен (новый), ЭстандронSustanon, Omnadren, Estandron
Капроат(Caproate)Формула: C6h22O2Масса: 116,14 г/моль
9 Тестостерона Капроат(Testosterone Caproate) Омнадрен (новый)Omnadren
Лаурат(Laurate)Формула: C12h34O2Масса: 200,29 г/моль
17 Нандролона Лаурат(Nandrolone Laurate) ЛаураболинНонаноат(Nonanoate) 13.5 Октаноат(Octanoate) 12 Пропионат(Propionate)Формула: C3H6O2Масса: 74.0792 г/моль
4.5 Андростенедиола Дипропионат(Androstenediol Di-Propionate) Дромастанолона Дипропионат(Dromastanolone Di-Propionate) Дростанолона Пропионат(Drostanolone Propionate) Дролбан, Мастабол, Мастерен, Мастерид, Мастизоль, Мастерил, Мастерон, Метолон, ПермастрилDrolban, Mastabol, Masterid, Masteril, Masteron, Masterone, Metholone, Permastril
Нандролона Пропионат(Nandrolone Propionate) Тестостерона Пропионат(Testosterone Propionate) Аговирин, Андролан, Андрофон-Рихт, Вирормон, Нео-Номбреол, Омнадрен, Примотестон Депо, Сустанон, Тестенон, Тестовирон Депо, Тестостерон пропионикум, Тестовирон, Тестопин, Тестэнат, ЭстандронМетиландростенедиола Дипропионат(Methylandrostenediol Di-Propionate) Аквеоус, МетандриолAcverous, Methandriol
Ундеканоат(Undeconoate)Формула: C11h32O2Масса: 186,26 г/моль
16.5 Тестостерона Ундеканоат(Testosterone Undeconoate) Андриол, Вириген, Пантестон, Равзини, Рестандол, УндесторНандролона Ундеканоат(Nandrolone Undeconoate) Динаболон, ПсихоболонУндесиленат(Undecylenate)Формула: C11h30O2Масса: 186.2936 г/моль
13 Болденона Ундесиленат(Boldenone Undecylenate) Болдебал, Болденон, Венобол, Ганабол, Пэйс, Сиболин, ЭквипойзBoldebal, Boldenon, Equipoise, Ganabol, Pace, Sybolin, Vebonol
Фенилпропионат(Phenylpropionate)Формула: C9h20O2Масса: 150.174 г/мольТемп. плавления: 20°C
4.5 Нандролона Фенилпропионат(Nandrolone Phenylpropionate) Активин, Анаболин, Андролон, Дубол, Дураболин, Нандроболин, Нероболин, Суперанаболин, Туринабол, Ферболико, Феноболин, Эквиболин, ЭстандронНоретандролона Фенилпропионат(Norethandrolone Phenylpropionate) Тестостерона Фенилпоропионат(Testosterone Phenylpropionate) Дурандрон, Омнадрен, СустанонDurandron, Omnadren, Sustanon
Эстрадиола Фенилпропионат(Estradiol Phenylpropionate) ЭстандронEstandron
Формиат(Formiate, Formate) 1.5 Тестостерона Формиат(Testosterone Formiate, Testosterone Formate) Ципионат(Cypionate)Формула: C8h24O2Масса: 132.1184 г/моль
12 Тестостерона Ципионат(Testosterone Cypionate) Андроцип, Андронад, Деп Андро, Д-Тест, Деп-Тест, Деп-Тестостерон, Депотест, Дуратест, Малоджек Сип, Теста-С, Тестацип, Тестекс Лео пролонгатум, Тестодиета-Депо, Тестоджект, Тестред Ципионат,Оксаболона Ципионат(Oxabolone Cypionate) Стеранабол Депо, СтеронSteranabol Depo, Steranabol Depot, Steranabol Ritardo, Steron
Эстрадиола Ципионат(Estradiol Cypionate) Энантат(Enanthate)Формула: C7h24O2Масса: 130.1864 г/моль
10.5 Метенолона Энантат(Methenolone Enanthate) Примоболан ДепоPrimobolan Depot
Тестостерона Энантат(Testosterone Enanthate) Андротардия, Депо-тестостерон, Дура-Тестостерон, Примотестон Депо, Тестостерон Депо, Тестен, Тестостерона Пролонгат, Тестостовирон Депо, Тесто-Энант, Эпармон-Депот, Тестостерон Энантат
Производные стероидных гормоновПроизводные стероидных гормонов получают путем структурных изменений в молекуле взятого за основу стероида. Таким образом, получают стероиды имеющие высокую степень сродства с взятым за основу стероидом, но с измененными в нужную сторону параметрами.
Алкилированием (алькилированием) называется введение в молекулы соединений алкила, например, метила Ch4 (метилирование) или этила C2H5 (этилирование). Большинство оральных стероидов алкилированы по 17-альфа: к 17-ой позиции молекулы присоединена метиловая группа (СН3), что предохраняет стероид от быстрого разрушения в печени (при этом оказывая токсичное действие на нее), увеличивая период полураспада стероида до нескольких часов.
В зависимости от характера биологической активности производные стероидных гормонов разделяют на три группы: кортикоидные (кортикостероиды), анаболические андрогенные (анаболические андрогенные стероиды, ААC, АС) и эстрогенные стероидные гормоны. Однако в организме, многие производные стероидных гормонов подвережены ферментативным реакциям в стероид-продуцирующих тканях, и могут превращаться в другие стероидные гормоны, являясь в этом случае одновременно и прогормонами (прекурсорами).
Различные производные стероидных гормонов могут применяться перорально (в виде таблеток или капсул), в виде внутримышечных инъекций, а также в виде мазей (кремов или гелей) и ингаляционно (в виде спреев).
Список основных производных стероидных гормоновНазвание и свойства стероида Существующие формы стероида и препараты, в состав которых они входят1-Тестостерон(1-Testosterone)Применение: инъекции эфировСоотношение андроген/анаболик: ? / ?Химическая формула: C19h38O2Молекулярная масса: 288.424 г/мольПериод полураспада зависит от свойств используемого эфираАндростенедиол(Androstenediol)Применение: инъекции эфировХимическая формула: C19h40O2Молекулярная масса: 290,44 г/мольПериод полураспада зависит от свойств используемого эфира
Андростенедиола Дипропионат(Androstenediol Di-Propionate)Андростенедион(Androstenedione)Применение: ?Химическая формула: C19h36O2Молекулярная масса: 286,41 г/мольПериод полураспада: 10-20 минут
Болденон(Boldenone)Применение: оральноСоотношение андроген/анаболик: 50 / 100Химическая формула: C19h36O2Молекулярная масса: 286.4132 г/мольПериод полураспада зависит от свойств используемого эфира
Болденона Ундесиленат(Boldenone Undecylenate)Болдебал, Болденон, Венобол, Ганабол, Пэйс, Сиболин, Эквипойз
Boldebal, Boldenon, Equipoise, Ganabol, Pace, Sybolin, VebonolБолдион(Boldione)Применение: оральноСоотношение андроген/анаболик: ? / ? Химическая формула: C19h34O2Молекулярная масса: 284,3974 г/мольПериод полураспада: ? часов
- капсулы -Болдион
BoldioneГидроскитестостерон / 4-Гидроскитестостерон(Hydroxytestosterone / 4-Hydroxytestosterone)Применение: инъекции эфировСоотношение андроген/анаболик: 25 / 65 Химическая формула: C19h37O3Молекулярная масса: 303,42 г/мольПериод полураспада зависит от свойств используемого эфира
Даназол(Danazol)Применение: оральноХимическая формула: C22h37NO2Молекулярная масса: 337.46 г/мольПериод полураспада: 2-4 часа
- капсулы -Дановал, Бонзол, Цикломен, Данокрин, Даногар, Данол, Ладогар, Додогал
Дегидрохлорметилтестостерон / Хлордегидрометилтестостерон(Dehydrochlormethyltestosterone / Chlorodehydromethyltestosterone)Применение: оральноСоотношение андроген/анаболик: 0 / 53Химическая формула: C20h37ClO2Молекулярная масса: 334.8854 г/мольПериод полураспада: 12 часов
- таблетированный -Орал Туринабол
Oral Turinabol
Дегидроэпиандростерон(Dehydroepiandrosterone)Применение: орально, ингаляционноХимическая формула: Молекулярная масса: г/мольПериод полураспада (орально): 10-20 минут
- капсулы -- кремы -
- спреи -
DHEA
Дромастанолон(Dromastanolone)Применение: инъекции эфировАлкилирование: метилирован во 2-ой позицииСоотношение андроген/анаболик: 25 / 62Химическая формула: C20h44O2Молекулярная масса: 306,4874 г/мольПериод полураспада зависит от свойств используемого эфира
Дромастанолона Дипропионат(Dromastanolone Di-Propionate)
Дростанолон(Drostanolone)Применение: инъекции эфировАлкилирование: метилирован во 2-ой позицииСоотношение андроген/анаболик: 25 / 62Химическая формула: C20h42O2Молекулярная масса: 304.4716 г/мольТемпература плавления: 128 °CПериод полураспада зависит от свойтв используемого эфира
Дростанолона Пропионат(Drostanolone Propionate)Дролбан, Мастабол, Мастерен, Мастерид, Мастизоль, Мастерил, Мастерон, Метолон, Пермастрил
Drolban, Mastabol, Masterid, Masteril, Masteron, Masterone, Metholone, Permastril
Квинболон(Quinbolone)Применение: оральноСоотношение андроген/анаболик: 50 / 100Химическая формула: C24h42O2Молекулярная масса: 352.5156 г/мольПериод полураспада: ? часов
Клостебол / Хлортестостерон(Clostebol / Chlortestosterone)Применение: орально, инъекции эфировХимическая формула: C19h37ClO2Молекулярная масса: 322,877 г/мольПериод полураспада зависит от свойств используемого эфира
Клостебола Ацетат(Clostebol Acetate)Местеролон / 1-Метиландростанолон(Mesterolone / 1-Methylandrostanolone)Применение: оральноАлкилирование: метилирован в 1-ой позицииСоотношение андроген/анаболик: 35 / 125Химическая формула: C20h42O2Молекулярная масса: 304.4716 г/мольПериод полураспада: 30-60 часов
- таблетированный -Вистимон, Месторанум, Плюривирон, Провирон
Mestoranum, Pluriviron, Proviron, Vistimon
Метандиенон / Метандростенолон(Methandienone / Methandrostenolone)Применение: оральноАлкилирование: метилирован в 17-ой позицииСоотношение андроген/анаболик: 50 / 90-210Химическая формула: C20h38O2Молекулярная масса: 300.441 г/мольПериод полураспада: 4-5 часов
- таблетированный -Анабол, Анаболекс, Анаболий, Анаболин, Анаборал, Андроредан, Бионабол, Ванабол, Данабол, Дегидрометилтестостерон, Диалон, Дианабол, Дистранорм, Ланаболин, Метанабол, Метандиенон, Метандростенолон, Метанокс, Метастенол, Наболин, Напосим, Неробол, Новабол, Перабол, Перболин, Пронабол, Стенолон, Пронабол, Стенолон, Тринерджик, Энсепан
Abirol, Anabol, Anabolikum, Anabolin, Anaboral, Andoredan, Bionabol, Dialone, Danаbol, Dianobol, Dehydromethyltestosterone, Encephan, Melic, Metanabol, Metandiabol, Metandienone, Metandrostenolon, Metandrostenolone, Metastenol, Methylandrostadienolone, Nabolin, Naposim, Nerobol, Pronabol, Trinergic, Stenolon, Vanabol, Vetanabol
Метандриол / Метиландростенедиол(Methandriol / Methylandrostenediol)Применение: инъекции эфировАлкилирование: метилирован в 17-ой позицииСоотношение андроген/анаболик: 40 / 40Химическая формула: C20h42O2Молекулярная масса: 304.4716 г/мольПериод полураспада зависит от свойств используемого эфира
Метиландростенедиола Дипроионат(Methylandrostenediol Di-Propionate)Аквеоус, Метандриол
Acverous, Methandriol
Метенолон(Methenolone)Применение: орально, инъекции эфировАлкилирование: метилирован в 1-ой позицииСоотношение андроген/анаболик: 50 / 88Химическая формула: C20h40O2Молекулярная масса: 302.4558 г/мольПериод полураспада (орально): 4-6 часовПериод полураспада (инъекционно): зависит от свойств используемого эфира
- таблетированный -Метенолона Ацетат(Methenolone Acetate)
Примоболан
Primobolan
Метенолона Энантат(Methenolone Enanthate)Примоболан Депо
Primobolan Depot
Метилтестостерон(Methyltestosterone)Применение: оральноАлкилирование: метилирован в 17-ой позицииСоотношение андроген/анаболик: 130 / 110Химическая формула: C20h40O2Молекулярная масса: 302.4558 г/мольТемпература плавления: 162-167 °CПериод полураспада: 3-7 часов
- таблетированный -Аговирин, Андроид, Андрорал, Аркостерон, Гормобин, Лонгивол, Местерон, Метандрен, Метандрен, Метилтестостерон, Тестормон, Тлингвалете, Тестовис, Тестред, Вирилон
Afro, Agovirin, Android, Androral, Hormobin, Longivol, Mediatric, Mesteron, Metandren, Metil Testosteron, Methyltestosterone, Oreton Methyl, Test Lingvalete, Teston, Testormon, Testosteron, Testovis, Testred, Virilon
Метилтриенолон(Methyltrienolone)Применение: оральноАлкилирование: метилирован в 17-ой позицииСоотношение андроген/анаболик: ? / ?Химическая формула: C19h34O2Молекулярная масса: 284,3974 г/мольПериод полураспада: ? часов
- таблетированный -
Нандролон(Nandrolone)Применение: инъекции эфировСоотношение андроген/анаболик: 37 / 125Химическая формула: C18h36O2Молекулярная масса: 274.4022 г/мольБиодоступность орально: 2,24%Биодоступность внутримышечно: 100%Период полураспада зависит от свойств используемого эфира
Нандролона Гексилоксифенилпропионат(Nandrolone Hexyloxyphenylpropionate)Анадур
Нандролона Деканоат(Nandrolone Decanoate)Анаболин, Дека-Дуболин, Дека-Дураболин, Дека-Дурабол, Еболан, Нурецан, Ретаболил, Стероболин, Туринабол Депо, Циремилон, Экстраболин, Элпихормо
Anaboline, Jebolan, Deca-Durabolin, Deca-Durabol, Deca-Durabolin, Elpihormo, Extraboline, Nurezan, Retabolil, Sterobolin, Turinabol Depot, Ziremilon
Нандролона Лаурат(Nandrolone Laurate)Лаураболин
Нандролона Ундеканоат(Nandrolone Undeconoate)Динаболон, Психоболон
Нандролона Фенилпропионат(Nandrolone Phenylpropionate)Активин, Анаболин, Андролон, Дубол, Дураболин, Нандроболин, Нероболин, Суперанаболин, Туринабол, Ферболико, Феноболин, Эквиболин, Эстандрон
Норетандролон(Norethandrolone)Применение: оральноАлкилирование: этилирован в 17-ой позицииСоотношение андроген/анаболик: 35 / 100-200Химическая формула: C20h40O2Молекулярная масса: 302.4558 г/мольПериод полураспада: 12 часов
- таблетированный -Анаплекс, Нилевар
Anaplex, Nilevar
Оксаболон(Oxabolone)Применение: инъекции эфировХимическая формула: C18h36O3Молекулярная масса: 290.4016 г/мольПериод полураспада зависит от свойств используемого эфира
Оксаболона Ципионат(Oxabolone Cypionate)Стеранабол Депо, Стерон
Steranabol Depo, Steranabol Depot, Steranabol Ritardo, Steron
Оксандролон(Oxandrolone)Применение: оральноАлкилирование: метилирован в 17-ой позицииСоотношение андроген/анаболик: 24 / 322-630Химическая формула: C19h40O3Молекулярная масса: 306.4442 г/мольТемпература плавления: 236.5 °CБиодоступность: 97%Период полураспада: 8-9 часов
- таблетированный -Анавар, Анатрофил, Липидекс, Лонавар, Оксадрин, Оксандролон, Оксадролонум, Противар, Вазором
Anavar, Anatrophill, Lipidex, Lonavar, Oxandrin, Oxandrolona, Oxandrolone, Oxandrolonum, Protivar, Vasorome
Оксиметолон(Oxymetholone)Применение: оральноАлкилирование: метилирован в 17-ой позицииСоотношение андроген/анаболик: 45 / 320Химическая формула: C21h42O3Молекулярная масса: 332.482 г/мольТемпература плавления: 236.5 °CБиодоступность: 95%Период полураспада: 8-9 часов
- таблетированный -Анадрол, Анаполон, Анастерон, Анадролик, Диастен, Гемоденин, Оксидрол, Оксиметонол, Оксимозона, Пленастрил, Ринастерон, Синастерон
Anadrol, Anapolon, Anasteron, Dynasten, Hemogenin, Oxitosona, Plenastril, Roboral, Synasteron
Станозолол(Stanozolol)Применение: орально, инъекции суспензииАлкилирование: метилирован в 17-ой позицииСоотношение андроген/анаболик: 30 / 320Химическая формула: C22h46N2OМолекулярная масса: 344.5392 г/мольПериод полураспада (орально): 8-9 часов Период полураспада (инъекции): 1 сутки
- таблетированный -Винстрол, Стромба
Stromba, Winstrol
Станозолола Суспензия(Stanozolol Suspension)Винстрол, Стромбаджект, Станобол, Станаболик, Станоболон, Станол, Стромба
Stanol, Stromba, Strombaject, Winstrol, Winstrol Depot
Стенболон(Stenbolone)Применение: инъекции эфировАлкилирование: метилирован во 2-ой позицииСоотношение андроген/анаболик: 55 / 88Химическая формула: C20h40O2Молекулярная масса: 302.4558 г/мольПериод полураспада зависит от свойств используемого эфира
Стенболона Ацетат(Stenbolone Acetate)Анотрофин, Стенболон
Anatrofin, Stenbolone
Тестостерон(Testosterone)Применение: инъекции суспензии или эфировСоотношение андроген/анаболик: 100 / 100Химическая формула: C19h38O2Молекулярная масса: 288.424 г/мольТемпература плавления: 155 °CСвязывание с глобулином: 40%Связывание с альбумином: 58%Период полураспада (орально): 10-20 минутПериод полураспада (инъекционно): зависит от свойств используемого эфира
Тестостерона Ацетат(Testosterone Acetate)Тестостерона Бутират(Testosterone Butyrate)Тестостерона Гексаноат(Testosterone Hexanoate)Омнадрен
Omnadren
Тестостерона Гептаноат(Testosterone Heptanoate)Тестостерона Гептилат(Testosterone Heptylate)Тестостерон терамекс
Testosterone Teramex
Тестостерона Деканоат(Testosterone Decanoate)Сустанон
Sustanon
Тестостерона Изогексаноат(Testosterone Isohexanoate)Омнадрен
Omnadren
Тестостерона Изокапроат(Testosterone Isocaproate)Сустанон, Омнадрен (новый), Эстандрон
Sustanon, Omnadren, Estandron
Тестостерона Капроат(Testosterone Caproate)Омнадрен (новый)
Omnadren
Тестостерона Пропионат(Testosterone Propionate)Аговирин, Андролан, Андрофон-Рихт, Вирормон, Нео-Номбреол, Омнадрен, Примотестон Депо, Сустанон, Тестенон, Тестовирон Депо, Тестостерон пропионикум, Тестовирон, Тестопин, Тестэнат, Эстандрон
Тестостерона Суспензия(Testosterone Suspension)Тестостерона Ундеканоат(Testosterone Undeconoate)Андриол, Вириген, Пантестон, Равзини, Рестандол, Ундестор
Тестостерона Фенилпоропионат(Testosterone Phenylpropionate)Дурандрон, Омнадрен, Сустанон
Durandron, Omnadren, Sustanon
Тестостерона Формиат(Testosterone Formiate, Testosterone Formate)
Тестостерона Ципионат(Testosterone Cypionate)Андроцип, Андронад, Деп Андро, Д-Тест, Деп-Тест, Деп-Тестостерон, Депотест, Дуратест, Малоджек Сип, Теста-С, Тестацип, Тестекс Лео пролонгатум, Тестодиета-Депо, Тестоджект, Тестред Ципионат,
Тестостерона Энантат(Testosterone Enanthate)Андротардия, Депо-тестостерон, Дура-Тестостерон, Примотестон Депо, Тестостерон Депо, Тестен, Тестостерона Пролонгат, Тестостовирон Депо, Тесто-Энант, Эпармон-Депот, Тестостерон Энантат
Тренболон(Trenbolone/Trembolone)Применение: инъекции эфировСоотношение андроген/анаболик: 500 / 500Химическая формула: C18h32O2Молекулярная масса: 270.3706 г/мольТемпература плавления: 183-186 °CБиодоступность: 100%Период полураспада зависит от свойств используемого эфира
Тренболона Ацетат(Trenbolone Acetate,Trembolone Acetate)Тренбол, Финаджект, Финаджет, Финапликс
Finaject, Finajet, Trenbol
Тренболона Гексагидробензилкарбонат(Trenbolone Hexahydrobenzylcarbonate,Trembolone Hexahydrobenzylcarbonate)Параболан
Parabolan
Флюоксиместерон(Fluoxymesterone)Применение: оральноАлкилирование: метилирован в 17-ой позицииСоотношение андроген/анаболик: 1900 / 850Химическая формула: C20h39FO3Молекулярная масса: 336.4457 г/мольТемпература плавления: 240-270 °CОральное всасывание: 44%Связывание с глобулином: 80%Связывание с альбумином: 19%Период полураспада: 6-10 часов
- таблетированный -Андроид, Ора-Тестрил, Халотестин, Хистерон, Хустерон, Ультандрен
Anadroid, Halotestin, Hysterone, Ora-Testryl, Ultandren
Эcтрадиол(Estradiol)Применение: орально, инъекции эфировХимическая формула: C18h34O2Молекулярная масса: 272.382 г/мольТемпература плавления: 173-179 °CВсасывание: 43%Биодоступность: 97-99%Связывание с белками крови: >95%Период полураспада (орально): 36 часовПериод полураспада (инъекционно): зависит от свойств используемого эфира
Эстрадиола Бензоат(Estradiol Benzonate)Эстандрон
Estandron
Эстрадиола Валерат(Estradiol Valerate)Эстрадиола Фенилпропионат(Estradiol Phenylpropionate)Эстандрон
Estandron
Эстрадиола Ципионат(Estradiol Cypionate)Этилэстренол(Ethylestrenol)Применение: оральноАлкилирование: этилирован в 17-ой позицииХимическая формула: C20h42OМолекулярная масса: 288.4722 г/мольПериод полураспада: ? часов
prosecrets.pro
33. изопреноиды II. стероиды
ИЗОПРЕНОИДЫ II
СТЕРОИДЫ
Стероиды - группа биологически важных природных соединений, в основе структуры которых лежит скелет циклопентанопергидрофенантрена (стерана). Стероиды входят в состав всех растительных и животных организмов.
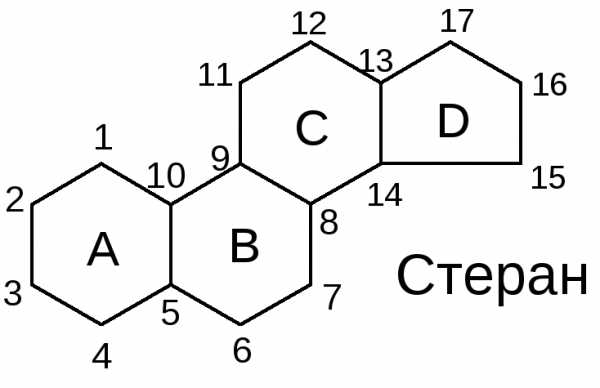
Стероиды – это важные группы низкомолекулярных биорегуляторов: желчные кислоты, кортикостероиды (гормоны коры надпочечников), половые гормоны и серию соединений с различными биологическими функциями.
Природные стероиды подразделяются на:
зоостерины, выделяемые из организмов высших животных,
микостерины, выделяемые из грибов и микроорганизмов,
фитостерины, выделяемые из растений.
В основе структуры природных стероидов лежит холестан:
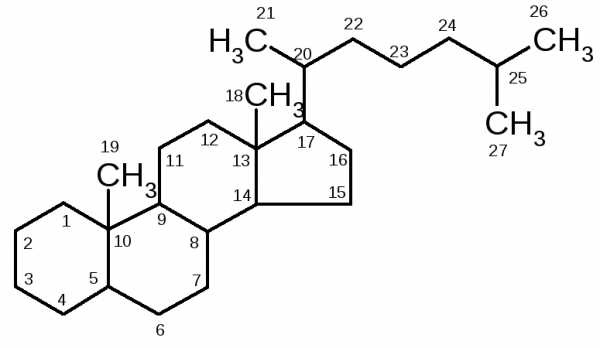
Важнейший представитель зоостеринов – холестерин – впервые выделенный из желчи:
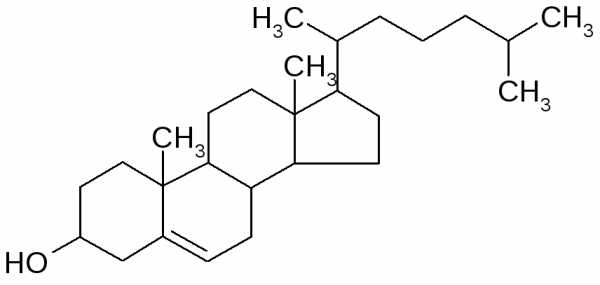
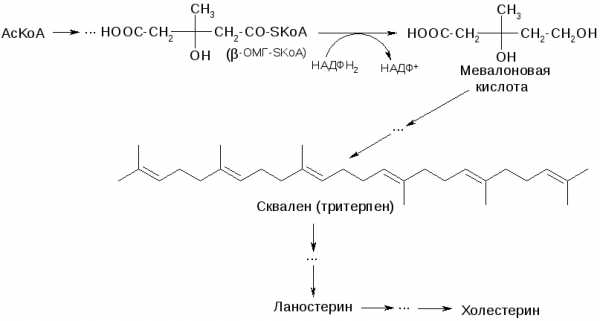
20% холестерина поступает в организм с пищей, а 80% образуется в организме из AcKoA по следующему пути:
В организме холестерин содержится в свободном виде (ХС) и виде сложных эфиров с карбоновыми кислотами (ХСЭ).Экзогенный и эндогенный холестерин, попадая в кровь, входит в состав липопротеинов и разносится в ткани. Излишек холестерина выводится из организма главным образом с желчью через кишечник. Нарушение обмена холестерина приводит к отложению его на стенках кровеносных сосудов и является причиной атеросклероза.
Холестерин содержится в клеточных мембранах, обеспечивая им необходимые физико-химические свойства и предохраняя их от окисления. Значительные количества холестерина содержатся в ткани головного мозга и нервной ткани.
Эргостерин – важнейший представитель микостеринов, получаемый экстракцией из дрожжей:
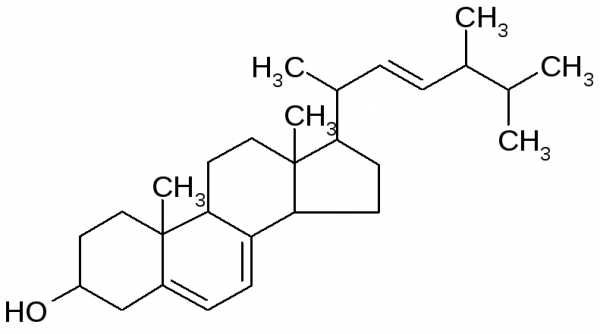
При фотохимической изомеризации эргостерина образуется эргокоальциферол – витамин D2:
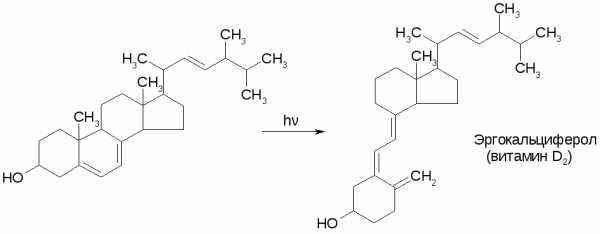
Аналогично из 7-дегидрохолестерина образуется холекальциферол –
витамин D3:
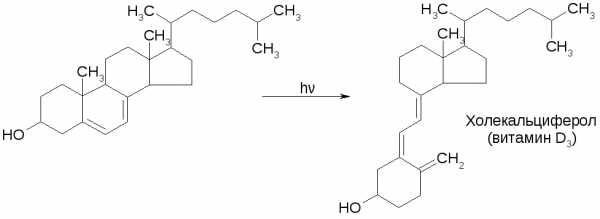
Витамины группы D регулируют фосфатно-кальциевый обмен в организме.
Они образуются в коже под действием ультрафиолетовых лучей, а также получаются промышленным путем из эргостерина и 7-дегидрохолестерина. Последний получают из холестерина двустадийным синтезом:
Холестерин является биохимическим предшественником всех остальных биогенных стероидов: желчных кислот, стероидных гормонов – кортикостероидов, половых гомонов. Основные пути их биосинтеза заключаются в том, что исходная молекула холестерина подвергается биологическому окислению, теряя атомы углерода и приобретая кислородсодержащие заместители: карбоксильные, карбонильные и гидроксильные группы.
Желчные кислоты
В желчи содержатся стероидные соединения – производные холана:
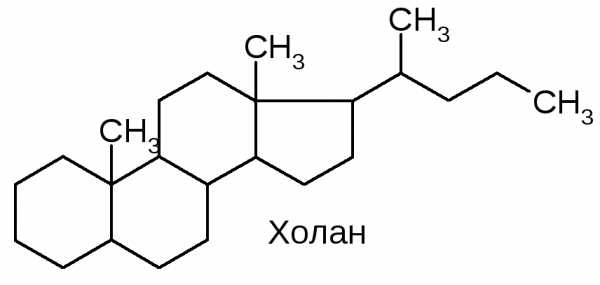
т.н. желчные кислоты, образующиеся в печени из холестерина:
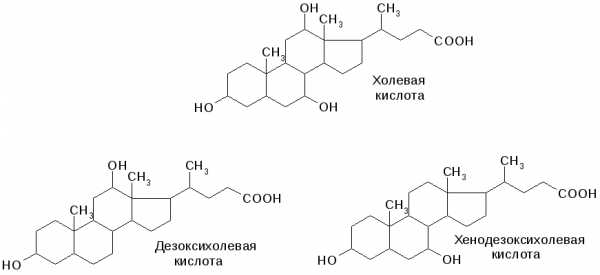
Желчные кислоты соединяются с глицином и таурином, образуя
парные желчные кислоты (гликохолевая, таурохолевая):
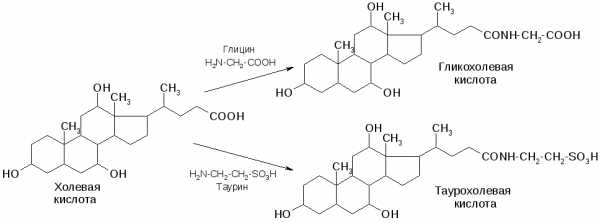
Соли парных желчных кислот обладают поверхносто-активными свойствами. Эмульгируя жиры пищи, они способствуют их перевариванию, а также активируют пищеварительный фермент липазу, гидролизующий жиры.
СТЕРОИДНЫЕ ГОРМОНЫ
Кортикостероиды
Кортикостероиды (или кортикоиды) – это гормоны коркового вещества надпочечников, где они образуются из холестерина. Из экстракта надпочечников выделено 46 кортикоидов. Кортикоиды делятся на две группы:
глюкокортикоиды, регулирующие углеводный обмен;
минералокортикоиды, регулирующие водно-солевой обмен.
Структурной основой кортикостероидов является прегнан:
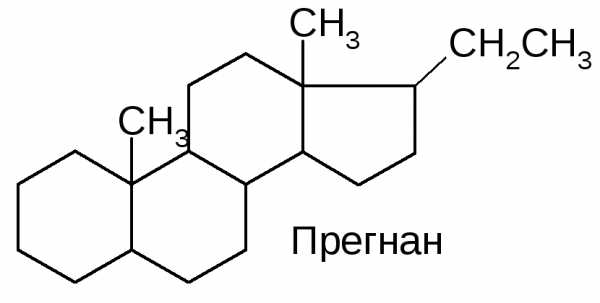
Глюкокортикоиды:
Глюкокортикоиды действуют как антагонисты инсулина, повышая содержание глюкозы в крови. Они стимулируют глюконеогенез и образование гликогена, способствуют расщеплению жиров и белков.
Синтетические аналоги глюкокортикоидов – преднизолон, гидрокортизон и др. – по своему действию превосходят природные соединения:
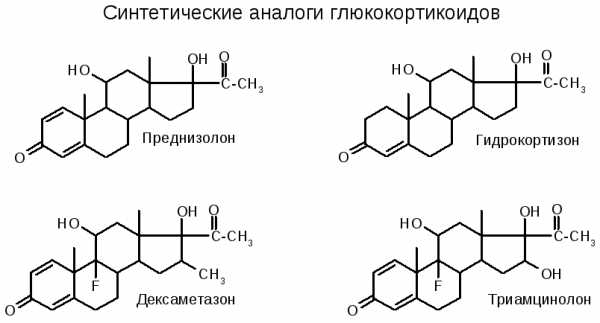
Глюкокортикоиды и их синтетические аналоги обладают мощным противовоспалительным, противошоковым, антиаллергическим действием. Они широко используются для лечения экзем, бронхиальной астмы, артритов.
Химические свойства глюкокортикоидов и их аналогов:
Введение фтора в положение 9:
Реакции окисления:
В реакциях с фенилгидразином глюкокортикоиды образуют окрашенные гидразоны (качественное определение):
Минералокортикоиды
Примером минералокортикоидов является альдостерон. Он регулирует водно-солевой обмен, увеличивая реабсорбцию ионов натрия в почечных канальцах, и тем самым повышает содержание Na+ в крови и других жидкостях организма.
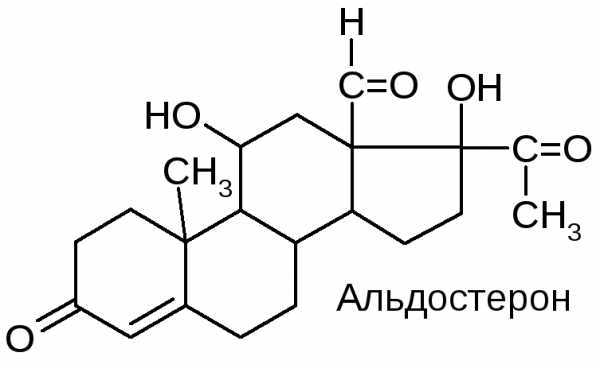
Половые гормоны
Эти гормоны вырабатываются половыми железами и регулируют половые функции. Они подразделяются на женские (гестагены и эстрогены) и мужские (андрогены) половые гормоны.
Женские половые гормоны
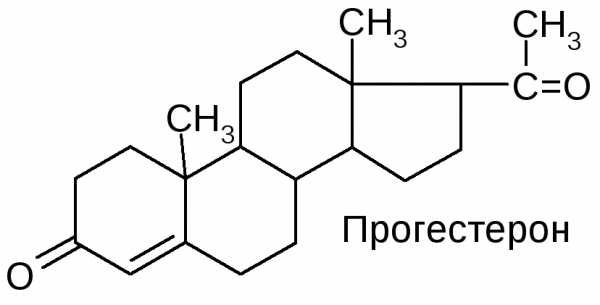
А. Гестагены
Гестагены – гомоны беременности – образуются в желтом теле яичников. Как и кортикостероиды, гестагены являются производными прегнана. Наибольшей активностью из них обладает прогестерон:
Б. Эстрогены
Эстрогены – производные эстрана. Отличительные признаки их структуры – ароматическое кольцо А, отсутствие метильной группы у С-10 и боковой углеродной цепи у С-17. Наиболее важные эстрогены – эстрадиол и эстрон.
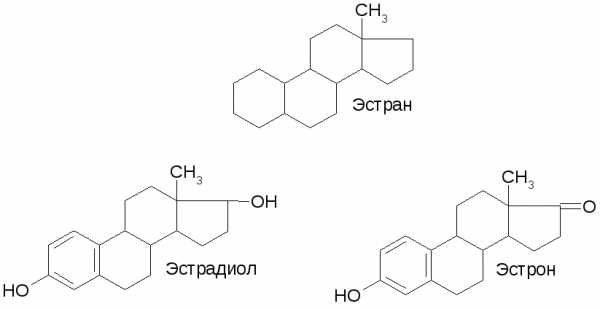
Эстрогены контролируют менструальный цикл у женщин, а также активируют синтетазу жирных кислот, способствуя образованию жиров из глюкозы. Используются как лекарственные препараты для лечения климактерических расстройств, гипертонии и других заболеваний. Эстрогены содержатся и в растениях – кокосовых орехах, цветках ивы и др. В настоящее время для медицинских целей эстрогены получаются путем промышленного синтеза.
Синтетические аналоги эстрагенов – дипропионат эстрадиола и этинилэстрадиол – при пероральном применении в несколько раз активнее своих природных предшественников – эстрадиола и эстрона:
В результате широкого синтетического поиска были получены этилстильбэстрол и продукт его гидрирования синэстрол – соединения нестероидной структуры, обладающие выраженной эстрогенной, а также противоопухолевой активностью:
Мужские половые гормоны (андрогены)
Андрогены вырабатываются мужскими половыми железами. Они стимулируют развитие вторичных мужских половых признаков, выработку спермы, а также обладают сильным анаболическим эффектом – усиливают синтез белков, способствуя развитию мышц.
По химической структуре андрогены – это производные андростана. Главные из них – андростерон и более активный тестостерон (первый был выделен из мочи, и, по-видимому, является продуктом метаболизма тестостерона):
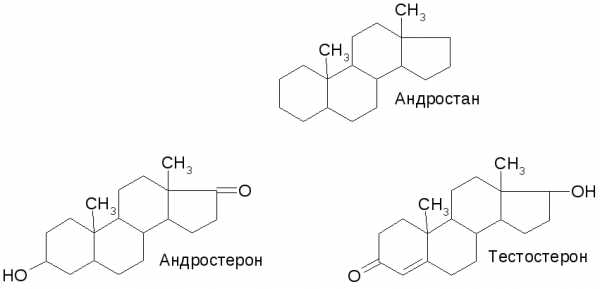
Анаболическое действие андрогенов стимулировало поиск их аналогов, обладающих минимальной гормональной и максимальной анаболической активностью. Химическая модификация природных андрогенов показала, что сложные эфиры тестостерона (в частности, пропионат), сохраняя гормональную активность, действуют более длительно. Другие производные – метилтестостерон, фенаболин – обладают слабым гормональным и выраженным анаболическим действием и применяются как анаболические препараты:
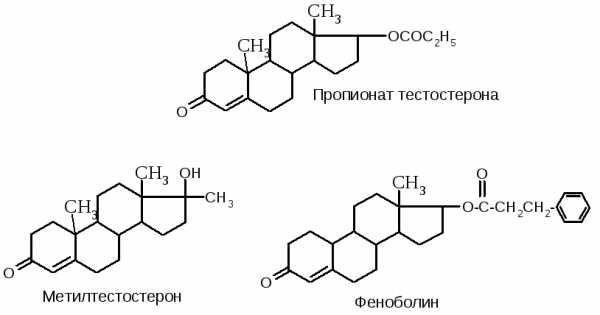
Сердечные гликозиды
Сердечные гликозиды – это стероидные гликозиды растительного происхождения. В них стероидная часть молекулы играет роль агликона (здесь он называется генином), связанного с олигосахаридом:
Особенностью этих веществ является то, что они избирательно накапливаются в тканях миокарда, где их концентрация более, чем в 200 раз, превышает концентрацию в других тканях. В небольших дозах они возбуждают сердечную деятельность и используются в кардиологии. В больших дозах они являются сердечными ядами. Выделяются эти соединения из наперстянки пурпурной (Digitalis purpurea), строфантина (Strophantus), ландыша.
К генинам сердечных гликозидов относятся дигитоксигенин (составная часть гликозида дигитоксина из Digitalis purpurea) и строфантидин (составная часть гликозида строфанта из Strophantus):
В южноамериканском растении Stevia содержится стевиозид – сложный гликозид с агликоном структурно близким к стероидам:

Стевиозид обладает интенсивным сладким вкусом (в 100-200 раз больше сахарозы) и широко применяется в качестве пищевой добавки.
ЛИТЕРАТУРА:
Основная:
1. Тюкавкина Н.А., Зурабян С.Э., Белобородов В.Л. и др. – Органическая химия (специальный курс), кн.2 – Дрофа, М., 2008 г., с. 242-250, 360-397.
2. Н.А.Тюкавкина, Ю.И.Бауков – Биоорганическая химия – ДРОФА, М., 2007 г., с. 469-483.
Дополнительная:
1. В.В.Племенков – Введение в химию природных соединений – Учебное пособие для химических, биологических и медицинских специальностей ВУЗов, Казань, 2001, с. 184-190.
2. Ю.А.Овчинников – Биоорганическая химия – М., Просвещение, 1987 г.,
с. 702-714.
26.04.10
11
studfiles.net
Стероидные кислоты их сложные эфиры
Используемый грибами круг источников углерода очень велик. Неполный список органических соединений, используемых грибами как единственный источник углерода, включает 155 соединений и состоит из 56 углеводов, сахарных кислот и спиртов производных сахаров, 43 аминокислот и других азотсодержащих соединений,. 40 органических кислот и их сложных эфиров и 16 стероидных соединений и алкалоидов. [c.54]
Устемен и др. [256] хроматографировали на слоях силикагеля ряд алкильных, арильных и стероидных эфиров серной кислоты. Сложные эфиры серной кислоты со слабополярными соединениями можно в основном разрешить элюированием смесью бензол—метилэтилкетон—этанол—вода (3 3 3 1), тогда как для разделения более полярных соединений требовался такой более полярный растворитель, как смесь бутанол-1—уксусная кислота—вода (3 1 1). В этой работе дана таблица значений Rf для группы характерных соединений. [c.473]
Этот диамин применяют для удаления избытка хлорангидрида кислоты в ИОВОМ методе сиитеза сложных эфиров нз третичных и вторичных стероидных спиртов П1. Раствор спирта в эфнре обрабатывают этил.магн1И1бромидом с образова1тием мапнтйбромалкого-лята, после чего проводят реакцию с хлораигидридом кислоты. Для [c.302]
ХОЛЕСТЕРИН. Вторичный циклический спирт. С жирными кислотами образует сложные эфиры — холестериды. Встречается только в животном организме, где служит источником образования очень важных в биологическом отношении веществ (стероидных гормонов, желчных кислот, витамина D). [c.350]
Влияние сопряжения. Томпсон и Торкингтон [2] заметили, что карбонильные частоты этилкарбоната и этил-бензоата несколько ниже частот соответствующих насы-щеиных соединений, что полностью подтвердилось более поздними исследованиями [3, 4, 6, 10]. Между тем интенсивность карбонильной полосы снижается вследствие наличия ненасыщенной связи в а, -положении в меньшей степени, чем в случае кетонов, а величина смещения полосы, как при замещении ароматическим радикалом, так и радикалом с простой двойной связью, одинакова. Поэтому если при исследовании кетонов можно отличить эти два типа радикалов, то при исследовании сложных эфиров это сделать невозможно. Метилметакрилат поглощает при 1718 см , пропилметакрилат [13] — при 1721 смг, а для И стероидных бензоатов [10] такая полоса поглощения найдена в интервале 1724—1719 см . Прямым подтверждением того, что уменьшение частоты обусловлено влиянием двойной связи, является тот факт, что эти же стероидные бензоаты после гидрогенизации до гексагидробензоатов поглощают при 1739—1735 сл " [10]. Таким образом, частота уменьшается примерно на 20 см-. Сопряжение другой двойной связи в у. -положении оказывает очень небольшое влияние этиловый эфир коричной кислоты [4], например, поглощает при 1717 см , а метилбензоат поглощает при 1724 см [6]. Метиловые эфиры нафталиновых и фенантреновых карбоновых кислот также поглощают при 1724 см [30]. Эти значения получены при изучении жидких веществ и растворов, а для веществ в газообразном состоянии частоты, по-видимому, на 20—30 см выше [3]. [c.218]
Воски — это большей частью сложные смеси эфиров высших одноосновных первичных алифатических спиртов (молекулы которых содержат четное число атомов углерода) с высшими (особенно насыщенными) жирными кислотами. Воски не растворяются в воде, их можно формовать под действием тепла. Они бывают как животного, так и растительного происхождения. Примерами животных ВОСКОВ служат пчелиный воск или ворвань спермацет), содержащийся в черепной полости каш алота и используемый в фармакологии и косметике для изготовления мазей. Сходное применение имеет ланолин — сложная смесь эфиров алифатических стероидных и тритерпеноидных спир- [c.198]
Для сужения кольца D ацетонид XIII был гидролизован в кислой среде до 1 Ис-гликоля и окислен йодной кислотой до диальдегида XIV последний в присутствии уксуснокислого пиперидина в качестве катализатора циклизовался в ненасыщенный альдегид XV, который окислением и этерификацией был превращен в соответствующий сложный кетоэфир. Разделение этого ( )-эфира на антиподы было выполнено методом, основанным на открытии Виндауса (1909), который установил, что Зр-оксистероиды, в отличие от За-эпимеров, обычно осаждаются из 90%-ного спирта стероидным сапонином дигитонином. При восстановлении ненасыщенного кетоэфира XV боргидридом натрия образовалась смесь За и Зр-оксиэфиров (XVI и XVII), из которой дигитонином была избирательно осаждена правовращающая форма Зр-спирта XVII, полученная после двух переосаждений в чистом виде [c.106]
Первый пример полного синтеза стероидов был описан в 1939 г. Бахманном, осуществившим вместе с сотрудниками линейную синтетическую цепочку, при которой последовательно проводилось построение одного за другим колец А, В, С и О. Примером подобного синтеза может служить и синтез холестерина по Вудворду [3.7.3]. В последнее время ( ыли разработаны конвергентные сходящиеся) синтетические цепочки при этом сначала получают два фрагмента целевой молекулы по раздельно осуществляемым схемам, а затем, по возможности на одной из последних стадий, соединяют эти фрагменты в более сложную структуру. Такой путь синтеза позволяет уменьшить потери промежуточно синтезируемых соединений, на получение которых ступень за ступенью затрачивается много времени и средств. Поэтому конвергентные пути синтеза со сходящимися цепочками особенно привлекательны для промышленного производства стероидов. Ниже приводится пример построения стероидного скелета с помощью линейного синтеза из метилового эфира 5-оксогептен-6-овой-1 кислоты и 2-метилциклопентандиона-1,3 [3.7.4] (см. схему на с. 696). [c.695]
Продукты аллильного бромирования благодаря большой реакционной способности находят широкое применение в тонком органическом синтезе. Так, например, действием на бромирован-ные стероидные диены уксуснокислого калия с последующим окислением можно вводить в их молекулу кетольную боковую цепь, что приводит к соединениям типа кортикальных гормонов —. Применение продуктов аллильного бромирования в реакции Реформатского дает возможность переходить от альдегидов и кетонов к более сложным соединениям этим путем получены, например, тропинон -, соединения, близкие к витамину и т. д. Используя реакцию ненасыщенных лактонов с Ы-бромсук-цинимидом, удалось синтезировать с хорошим выходом пеницил-ловую кислоту . В последнее время показано, что при аллильном бромировании энолацетатов альдегидов и кетонов и последующем взаимодействии полученных бромидов с натрийацетоуксусным и натриймалоновым эфирами образуются производные фурана и пирана 245,261 [c.289]
Липиды по строению можно подразделить на две большие группы. 1. Простые липиды, или нейтральные жиры, представленные у большинства организмов ацилглицеринами, т. е. глицериновыми эфирами жирных кислот (свободные жирные кислоты встречаются в клетках лишь как минорный компонент). 2. Сложные липиды, к которым относятся липиды, содержащие фосфорную кислоту в моно- или диэфирной связи, — это фосфолипиды, в число которых входят глицерофосфолипиды и сфинголипиды. к сложным липидам относятся соединения, связанные гликозид-ной связью с одним или несколькими остатками моносахаридов, или гликолипиды, а также соединения стероидной и изопреноид-ной природы, в том числе каротиноиды. [c.378]
chem21.info


















