4.2. Простые эфиры спиртов. Спирт простой эфир
4.2. Простые эфиры спиртов
Простыми эфирами называются органические соединения, в которых два углеводородных радикала связаны между собой атомом кислорода. Простые эфиры можно рассматривать как продукты замещения атома водорода в гидроксиле спирта радикалом:
R – O – H R – O – R/
Общая формула простых эфиров Сnh3n+2O.
Радикалы в молекуле простого эфира могут быть одинаковыми, например, в эфире СН3 – О – СН3, или же разными, например, в эфире СН3 – О – С3Н7. Эфир, имеющий различные радикалы, называется смешанным.
Номенклатура простых эфиров
Обычно эфиры называются по тем радикалам, которые входят в их состав (рациональная номенклатура).
По международной номенклатуре простые эфиры обозначают как производные углеводородов, в которых атом водорода замещен алкоксигруппой (RO –), например, метоксигруппой СН3О –, этоксигруппой С2Н5О – и т.д.
| Простой эфир | Рациональная номенклатура | Номенклатура ИЮПАК |
| СН3– О – СН3 | диметиловый эфир | метокисметан |
| С2Н5– О – С2Н5 | диэтиловый эфир | этоксиэтан |
| СН3– О – С2Н5 | метилэтиловый эфир | метоксиэтан |
| С2Н5– О – С3Н7 | этилпропиловый эфир | этоксипропан |
Изомерия простых эфиров
1. Изомерия простых эфиров определяется изомерией радикалов, связанных с кислородом.
С4Н10О
СН3– О – СН2– СН2– СН3 метилпропиловый эфир
С2Н5– О – С2Н5диэтиловый эфир
СН3- О – СН – СН3метилизопропиловый эфир
СН3
2. Межклассовыми изомерами простых эфиров являются одноатомные спирты.
СН3– СН2– СН2– СН2– ОН бутанол-1
Физические свойства простых эфиров
Диметиловый и метилэтиловый эфиры представляют собой при обычных условиях газообразные вещества.
Начиная с диэтилового эфира, вещества этого класса представляют собой бесцветные, легкоподвижные жидкости с характерным запахом.
Простые эфиры легче воды и почти не растворяются в ней. Из-за отсутствия водородных связей между молекулами, простые эфиры кипят при более низкой температуре, чем соответствующие спирты.
В органических растворителях простые эфиры растворяются легко и сами растворяют многие вещества.
Наиболее распространенным соединением этого класса является диэтиловый эфир С2Н5 – О – С2Н5. Получен диэтиловый эфир был еще в XVI веке Кордусом. Очень часто его называют “серный эфир”. Это название, полученное в XVIII веке, связано со способом получения эфира: взаимодействие этилового спирта с серной кислотой.
Диэтиловый эфир – бесцветная, очень подвижная жидкость с сильным характерным запахом. Это вещество чрезвычайно взрывопожароопасно.
Температура кипения диэтилового эфира 34,60С, температура замерзания 1170С. Эфир плохо растворим в воде (1 объем эфира растворяется в 10 объемах воды). Эфир легче воды (плотность 714 г/л).
Диэтиловый эфир склонен к электризации: разряды статического электричества могут возникнуть в момент переливания эфира и послужить причиной его воспламенения.
Пары диэтилового эфира в 2,5 раза тяжелее воздуха и образует с ним взрывоопасные смеси. Концентрационные пределы распространения пламени КПР 1,7 – 49 %.
Пары эфира могут распространяться на значительные расстояния, сохраняя при этом способность к горению. Основная мера предосторожности при работе с эфиром – это удаление от открытого огня и сильно нагретых приборов и поверхностей, включенных электрических плиток.
Температура вспышки эфира – 450С, температура самовоспламенения 1640С.
При горении эфир горит синеватым пламенем с выделением большого количества тепла. Пламя эфира быстро увеличивается, т.к. верхний слой его быстро нагревается до температуры кипения. При горении эфир нагревается в глубину. Скорость роста нагретого слоя составляет 45 см/час, а скорость выгорания его со свободной поверхности 30 см/час.
При контакте с сильными окислителями (KMnO4, CrO3, галогены) диэтиловый эфир самовозгорается.
Кроме этого, при контакте с кислородом воздуха диэтиловый эфир может образовывать перекисные соединения, которые являются чрезвычайно взрывоопасными веществами.
Способы получения простых эфиров
1. Межмолекулярная дегидратация спиртов
h3SO4конц.
С2Н5–ОН + НО – С2Н5С2Н5– О – С2Н5+ Н2О
этанол диэтиловый эфир
2. Взаимодействие галогеноводородов и алкоголятов
СН3–I+NaOС2Н5СН3– О – С2Н5+NaI
иодметан этилат метилэтиловый
натрия эфир
Химические свойства простых эфиров
1. Простые эфиры – довольно инертные вещества, не склонные к химическим реакциям. Однако при действии концентрированных кислот они разлагаются
С2Н5– О – С2Н5+ НI конц.С2Н5ОН + С2Н5I
диэтиловый этанол иодэтан
эфир
2. Реакции окисления
Полное окисление - горение:
С4Н10О + 6(О2+ 3,76N2)4СО2+ 5Н2О + 63,76N2
Неполное окисление
При стоянии, особенно на свету, эфир под влиянием кислорода окисляется и разлагается с образованием ядовитых и взрывоопасных продуктов– перекисных соединений и продуктов их дальнейшего разложения.
Н ОН
\ /
О – С – СН3
С2Н5– О – С2Н5+ 3[О]
О – С – СН3
/ \
НО Н гидроперекись оксиэтила
Применение простых эфиров
Диэтиловый эфир является хорошим органическим растворителем. Его применяют для извлечения различных полезных веществ из растений, для чистки тканей, при изготовлении порохов и искусственного волокна.
В медицине эфир применяется для общего наркоза. Впервые с этой целью при проведении хирургической операции эфир был использован американским врачом Джексоном в 1842 году. За введение этого метода горячо боролся русский хирург Н.И. Пирогов.
studfiles.net
литература для фармацевтов : Лекция 12. Спирты и простые эфиры
Спирты и эфиры
.Спирты представляют собой производные алифатических или алициклических углеводородов с общей формулой R-ОН. В зависимости от числа гидроксильных группировок различают спирты одноатомные, двух атомные (гликоли), трехатомные (глицерины) и полиатомные (манит – шестиатомный спирт).
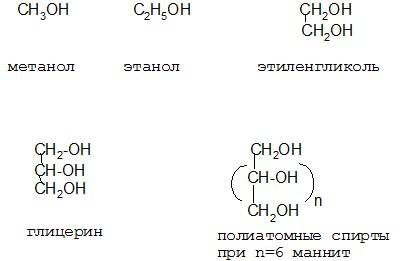
Между химическим строением и физическими свойствами существует определенная связь. Так, низкомолекулярные одноатомные спирты представляют легколетучие жидкости, смешивающиеся с водой. По мере удлинения цепи растворимость падает и уже бутанол мало растворим в воде. С увеличение длины цепи и количества гидроксилов в цепи увеличивается вязкость жидкостей от пропанола к пропандиолу и глицерину, причем самым вязким является глицерин. Четырехатомные и выше, а также разветвленные спирты (например пентаэритрит) являются твердыми веществами. Высшие спирты сами по себе малоприменимы в медицине, но используются в виде различных производных и вспомогательных веществ (сорбит, манит, эритрит). Зато они очень широко используются для получения порохов и ракетных топлив.
Введение гидроксила в молекулу углеводорода значительно повышает его физиологическую активность, в данном случае его наркотические свойства, увеличение числа гидроксильных групп ведет к уменьшению наркотической активности. Так, в отличие от этанола, глицерин и манит не имеют никаких наркотических свойств, хотя тот же одноатомный спирт пропанол или изопропанол обладают ярко выраженной наркотической активностью.
На физиологическую активность влияют также следующие факторы:
1. Длина углеродной цепи. Установлено, что физиологическое действие и токсичность нормальных первичных спиртов возрастает с удлиннением углеродной цепи до 6-8 атомов, а затем уменьшается. Спирты содержащие около 16 углеродных атомов совершенно инертны в физиологическом отношении. Несколько выпадает из этого ряда метанол, являющийся сильнейшим ядом.
2. Разветвление углеродной цепи. Физиологическая активность спиртов усиливается с разветвлением углеродной цепи. Так изопропиловый спирт более наркотически активен, чем пропиловый.
3. Введение галогенов в спирт усиливает их активность.
Способы получения спиртов. Спирт этиловый был известен уже в ХIII веке, как продукт образующийся при брожении виноградного сока. Источником получения спирта являются природные продукты, содержащие глюкозу или ее производные (ди- и полисахариды: сахарозу, крахмал, целлюлозу). Способы получения спирта из сырья, содержащего крахмал заключается в запаривании измельченного сырья, обработке полученного раствора (клейстера) солодовым ферментом АМИЛАЗОЙ, которая расщепляет крахмал до мальтозы, которая под действием фермента дрожжей Saccharomyces МАЛЬТАЗЫ расщепляется до глюкозы, преобразующейся в свою очередь по действием фермента ЗИМАЗЫ в спирт этиловый:
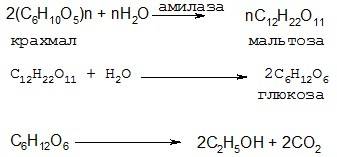
Спирт также получают из целлюлозы кислотным гидролизом последней до глюкозы и сбраживанием другой расой дрожжей Shysosaccharomyces до этилового спирта. В результате брожения получают бражку с содержанием от 10 до 14 % этилового спирта, при более высоком содержании спирта идет инактивация дрожжей. Для получения из бражки спирта ее подвергают многократной ректификации, включающей бражную колонну, альдегидную колонну, метанольную колонну и собственно спиртовую ректификационную колонну, на выходе из которой получают 96% по объему этиловый спирт. Использование кроме двух колонн альдегидной и метанольной позволяет отделяют сопутствующие примеси: эфиры, альдегиды, высшие спирты (сивушные масла), метанол.
Другой способ получения этилового спирта заключается в гидратации этилена ( или ацетилена):
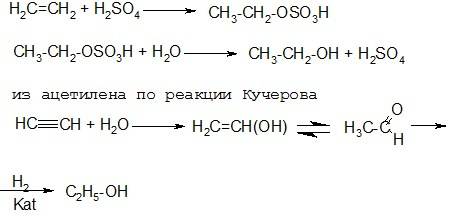
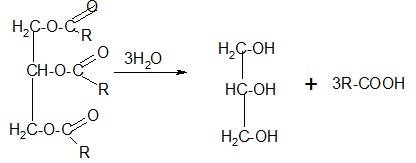
Глицерин получают двумя способами:
Первый – гидролиз жиров.
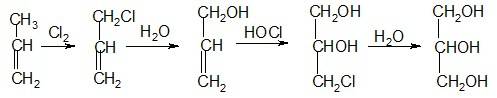
Второй, химический, заключается в хлорировании пропилена – продукта пиролиза нефтей с последующим окислительным хлорированием:
В качестве лекарственных препаратов используют спирт этиловый 95%, спирт этиловый 90, 70 и 40%, имеются фармакопейные статьи на жидкость антисептическую и спирт для наружного применения из непищевого сырья (гидролизный). Глицерин до сих пор нормируется статьей в ГФ1Х издания. Спирт, растворы спирта и глицерин жидкие прозрачные вещества.
Основные свойства препаратов сведены в таблицу.
| Препарат | Описание | Конц.объемн.% | Т. кип. °C | Плотность, г/см³ |
| Spiritus aethylicus 95%- спирт этиловый 95% | Прозрачная, бесцветная подвижная, летучая жидкость с характерным запахом и жгучим вкусом. Легко воспламеняется и горит синеватым бездымным пламенем | 95-96 | 78 | 0,812-0,808 |
| Spiritus aethylicus 90%- спирт этиловый 90% | Бесцветная прозрачная жидкость с характерным спиртовым запахом | 90-91 | – | 0,830-0,826 |
| Spiritus aethylicus 70%- спирт этиловый 70% | Бесцветная прозрачная жидкость с характерным спиртовым запахом | 70-71 | 0,886-0,883 | |
| Spiritus aethylicus 40%- спирт этиловый 40% | Бесцветная прозрачная жидкость с характерным спиртовым запахом | 40-41 | – | 0,949-0,947 |
| Glycerinum -глицерин | Прозрачная, бесцветная, сиропообразная жидкость без запах, сладкого вкуса, нейтральная реакция | 80-91 | 290разл. | 1,225-1,235 |
Для испытания на подлинность спирта этилового используют реакцию образования сложного эфира с уксусной кислотой:

образующийся этилацетат имеет своеобразный фруктовый запах. Идентифицировать спирт этиловый можно также по образованию йодоформа.
Подлинность глицерина устанавливают по образованию непредельного альдегида –акролеина под воздействием водоотнимающих средств (например, гидросульфата калия). Акролеин имеет неприятный раздражающий запах.
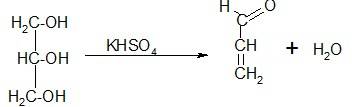
Спирт этиловый и глицерин могут содержать примеси различный веществ, образующихся в процессе производства и хранения. Основными сопутствующими веществами могут быть высшие спирты (сивушные масла), альдегиды, дубильные вещества, метанол, фурфурол (особенно гидролизный спирт).
Примесь метилового спирта определяют окислением метанола перманганатом натрия в присутствии фосфорной кислоты:
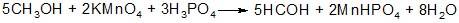
Образовавшийся формальдегид открывают с помощью хромотроповой кислоты в присутствии концентрированной серной кислоты по появлению фиолетового окрашивания:
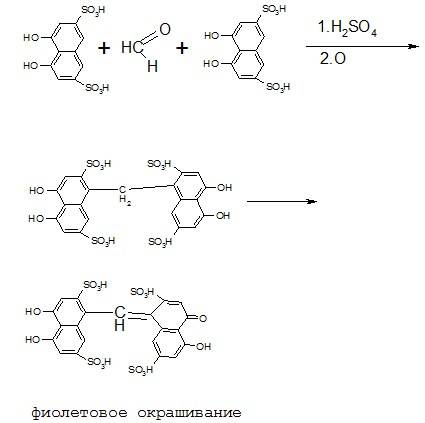
В самых последних фармакопейных статьях количественное определение метанола осуществляется методов газожидкостной хроматографии (ФС 42-3072-94 Спирт этиловый 95%).
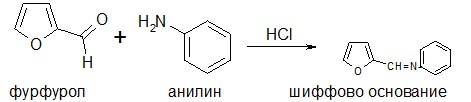
Фурфурол открывают по образованию Шиффова основания с анилином в присутствии соляной кислоты (розовое окрашивание).
Действующие фармакопейные статьи на спирт 95%, его растворы, антисептические растворы спирта не предусматривают количественное определение спирта. Спирт может быть загрязнен различными веществами: альдегидами, уксусной кислотой. В качестве примесей определяют альдегиды, хлориды, сульфаты, определяется кислотность. Главным показателем, характеризующим количественное содержание спирта в растворе является плотность раствора. Этот показатель обязательно вводится во все фармакопейные статьи.
Хранить спирт следует в хорошо закрытых сосудах. Отпускается спирт в аптеках по рецепту и находится на предметно-количественном учете. Используют его в медицинской практике как наружное средство для дезинфекции 90 и 70%, в качестве основы для приготовления лекарственных форм: настоек, растворов, экстрактов.
Глицерин также в обязательном порядке не требует количественного определения. Для количественного определения глицерина используют реакцию образования сложного эфира с уксусным ангидридом. Концентрацию рассчитывают либо по избытку уксусного ангидрида, либо по количеству израсходованной щелочи на гидролиз выделенного эфира глицерина с уксусной кислотой.
Используется глицерин в медицинской практике для сложных смесей для смягчения рук и в качестве растворителя для некоторых лекарственных средств. В последнее время его стали использовать как полупродукт и составная часть при получении основ для приготовления мягких лекарственных форм на основе эфиров ортотитановой кислоты : эфтидерм и тизоль. Получают эти препараты путем взаимодействия эфира ортотитановой кислоты с глицерином. Полученный препарат используется в качестве лечебного средства и для приготовления новых мазевых лекарственных композиций. Достоинством препарата является способность проникать через кожный покров и являться проводником лекарственных средств через кожу (трансдермальная проводимость).
Хлорбутанол гидрат.
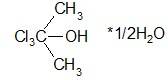
Препарат получают взаимодействием ацетона с хлороформом в присутствии амида натрия:
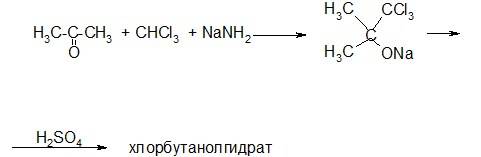
Препарат очищают перегонкой с водяным паром. В химическом отношении хлорбутанолгидрат нестойкое вещество. При обработке щелочью распадается на ацетон, формиат и хлориды.
Хлорбутанолгидрат дает йодоформную пробу
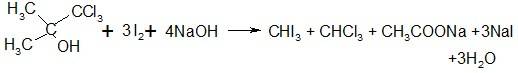
Раствор препарата в спирте должен иметь нейтральную реакцию, не допускается примесей хлоридов и тяжелых металлов. Количественное определение проводят аргетометричекси по хлориду калия, образующемуся после обработки хлорбутанолгидрата едким кали:
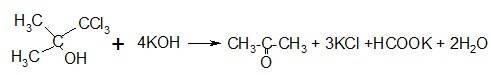
препарат обладает общеуспокаивающим, местноанестезирую-щим и легки наркотическим действием. Используют его как снотворное, наружно для лечения язв и воспалительных процессов, в составе аэрозольных препаратов как дезинфицирующее и местноанестезирующее средство (например, в составе каметона).
Хранят в прохладном месте в закупоренной таре.
Препараты простых эфиров.
Простые эфиры представляют собой кислородсодержащее органическое соединение общей формулы:
R-O-R’.
Известно много способов синтеза простых эфиров, но чаще всего их получают из спиртов в присутствии водоотнимающих средств (неорганических кислот – серной, соляной). Таким путем получают как правило симметричные эфиры:
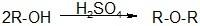
Для синтеза смешанных или несимметричных эфиров используют спирты и соответствующие хлорпроизводные:

Низшие алифатические эфиры легколетучие вещества, обладающие характерным запахом. Температура кипения и плотность их ниже, чем соответствующих спиртов, обусловлено это неспособностью образовывать сольваты и водородные связи, т.к. эфиры неполярные соединения. Простые эфиры на воздухе под воздействием кислорода образуют чрезвычайно взрывоопасные перекиси и гидроперекиси. Этот факт следует учитывать при работе с эфирами. В медицинской практике используют эфир медицинских и эфир для наркоза.
При хранении препаратов диэтилового эфира под влиянием солнечного света, кислорода воздуха идет образование целого комплекса побочных продуктов:
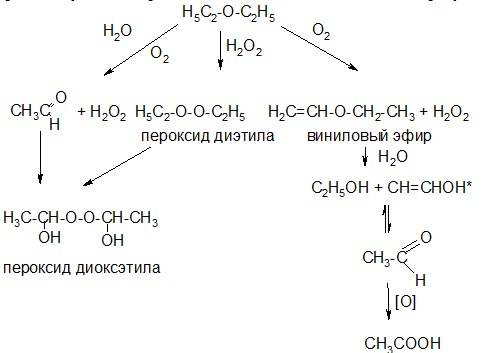
Кроме того эфир может содержать примеси воды и этилового спирта. Для очистки от кислот и других примесей эфир промывают водой, высушивают безводным хлоридом кальция и подвергают фракционной перегонке над кристаллическим гидроксидом калия, удаляя остатки воды и спирта. Самую большую опасность представляют образующиеся при хранении различные перекиси и гидроперекиси. Самая взрывоопасная пероксид этилидена. Для очистки от перекисей к эфиру добавляют сульфат железа (П), который восстанавливает перекись, окисляясь до железа (Ш). Дополнительную очистку эфира для наркоза проводят с помощью гидросульфита натрия и щелочного раствора перманганата калия, которые взаимодействуют с примесями непредельных соединений и альдегидов. Затем эфир вновь промывают, сушат и подвергают фракционной перегонке, отделяя фракцию перегоняющуюся при температуре 34-35°C.
При выполнении испытаний на препараты диэтилового эфира, при хранении и работе с ними необходимо соблюдать особые требования техники безопасности. Особенно важно требование отсутствия электронагревательных приборов при работе с эфиром. Обогрев можно осуществлять только нагретой водяной баней.
Прежде чем выполнять анализ проводят испытание на наличие перекисей. Если этим соединения обнаружены, то определение температуры кипения и нелетучего остатка проводить нельзя. Подлинность препарата подтверждается на основании его физических характеристик: температуры кипения и плотности.
При испытании доброкачественности в обоих препаратах устанавливают отсутствие или допустимые пределы примесей. Примесь кислот определяют нейтрализаций водного извлечения. Примесь посторонних пахучих веществ определяют выпаривая 10 мл эфира, который постепенно приливают на фильтровальную бумагу (не должно оставаться постороннего запаха). Нелетучие примеси определяют по массе остатка, полученного после выпаривания и высушивания (при 100-105°C) 50 мл препарата. Наличие пероксидов определяют в медицинских препаратов по реакции с йодидом калия:
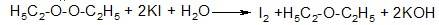
При визуальном наблюдении не должно быть пожелтения ни водного, ни эфирного слоев раствора.
Примесь альдегидов определяют по реакции с реактивов Несслера:
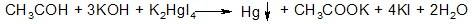
не допускается образования осадка; окраска раствора должны быть от желто-бурой до серовато-бурой.
Эфир для наркоза является более чистым соединением и требования к нему несколько жестче. Как по температуре кипения, так и по плотности. Кроме того в эфире для наркоза контролиру-ется содержание воды. Для этого добавляют пикриновую кислоту, которая растворяясь в воде, содержащейся в эфире окрашивает раствор в желтый цвет. По истечении каждых 6 месяцев эфир для наркоза подвергают контролю. Используют эфир очень мало. Для наркоза практически не используют.
Препараты сложных эфиров азотной кислоты.
Общая формула таких препаратов R-ONO2. В настоящее время используют следующие препараты эфиров азотной кислоты:1. Нитроглицерин2. Эринит (тетранитропентаэритрит)3. Нитросорбид4. Изосорбидмононитрат
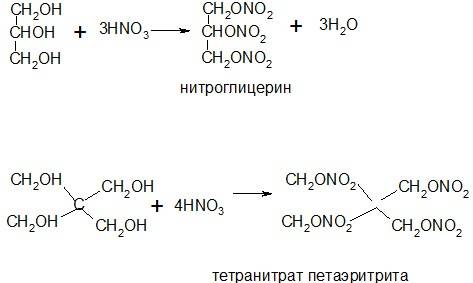
По физическим свойствам нитроглицерин – тяжелая маслянистая жидкость, эринит – твердое вещество. Оба препарата чрезвычайно взрывоопасны. Подлинность препаратов устанавливают по нитрат-ионам, которые образуются при гидролизе. В качестве реактива используют раствор дифениламина. Который нитратами окисляется до имониевой соли дифенил-бензидина, имеющего голубую окраску. Спиртовую часть молекулы идентифицируют только у нитроглицерина.
Количественное определение нитроглицерина проводят с помощью реакции омыления, которую выполняют в присутствии окислителя – перекиси водорода. Одна молекула нитроглицерина взаимодействует с пятью молекулами едкого натра. Три из них идут на омыление, а две расходуются на нейтрализацию образующихся муравьиной и уксусной кислот:
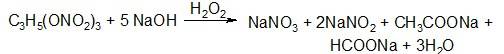
Препараты сложных эфиров хранят по списку Б в хорошо укупоренной таре, в прохладном, защищенном от света месте. При работе с растворами нитроглицерина необходимо соблюдать предосторожность. Сами растворы 4% в спирте невзрывоопасны. Однако при испарении спирта возможно образование опасной концентрации нитроглицерина. Поэтому при проливе раствора необходимо обработать все поверхности раствором щелочи.
Препарат используется в различных лекарственных формах:
1. Таблетки сублингвальные тритурационные2. Таблетки сублингвальные прессованные3. Мази4. Пластыри5. Спиртовые растворы.6. Растворы для инфузий.
Используют эринит только в виде таблеток. ПРЕПАРАТЫ ПРИМЕНЯЮТСЯ КАК СПАЗМОЛИТИЧЕСКИЕ СРЕДСТВА.
Недавно установлено, что нитроэфиры являются лишь пролекарствами, которые легко превращаются в организме в нитрат-анионы, восстанавливаемые затем гемоглобином крови и железосодержащими ферментами в монооксид азота:
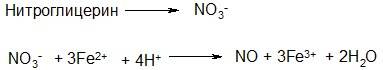
Последний и оказывает лечебное действие, расслабляя гладкую мускулатуру сосудов, снижая кровяное давление и снимая ишемические боли сердца. За последние 10 лет сложилось представление, что NO является эндогенной молекулой с функциями сигнала межклеточного взаимодействия.
Монооксид азота выполняет в организме роль нейромедиатора. Развивает иммунные реакции и участвует в системе долговремен-ной памяти.
Нитросорбид. Динитрат 1,4:3,6-диангидро-D-сорбита.
Нитросорбид получают из сорбита – шестиатомного спирта путем его дегидратации в присутствии катализаторов кислого характера и последующего нитрования концентрированной азотной кислотой:
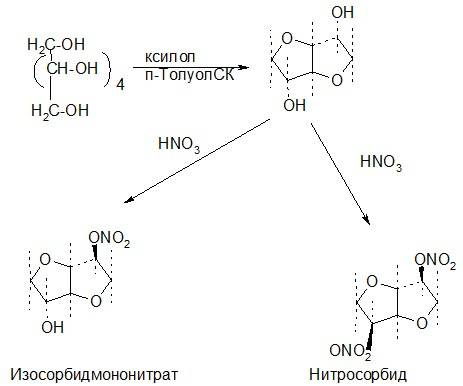
Подлинность препаратов контролируется ИК спектрами, органичексие примеси определяются ТСХ. Количественное определение осуществляют фотометрическим методом. Оба эти препарата используются в форме таблетмассы, т.к. сам динитроэфир взрывоопасен. Применяют в виде таблеток как спазмолитическое средство.
farmf.ru
Спирты и простые эфиры
Реферат на тему:
Спирты и простые эфиры
Подготовил
ученик 11 – Б класса
Орешко Иван
Формула винного, или этилового, спирта (этанола) , несомненно, знакома многим даже совершенно далёким от химии людям. Это соединение, которое образуется при ферментативном брожении крахмала, глюкозы и фруктозы, в быту называют просто спиртом.
Получение вина путём сбраживания виноградного сока было освоено людьми уже несколько тысячелетий назад. Однако чистый спирт, содержащий лишь незначительное количество воды, выделили при перегонке вина только в XIII в.. В Средние века стали известны многие свойства винного спирта, например горючесть (одно из его латинских названий – aqua ardens, что в переводе означает «огненная вода») и способность извлекать из листьев, плодов и кореньев содержащиеся в них биологически активные вещества и красители (полученные растворы в быту называют настойками). Алхимик Арнальдо из Вилановы упоминает спирт в числе медикаментов и противоядий.
Слово «спирт» происходит от древнего латинского названия этого вещества – spiritus vini («дух вина»). Этот термин до сих пор используется в медицине при записи рецептов. В XVI в. в западноевропейских языках, а в XVIII в. и в русском у винного спирта появилось новое название – алкоголь (араб. «ал-кугул»).
Безводный (абсолютный) этиловый спирт был впервые получен лишь в 1796 г. российским химиком Товием Егоровичем Ловинцем и немецким учёным Иеремией Вениамином Рихтером. Для этой цели они применяли вещества, связывающие воду, например оксид кальция (негашеную известь). Абсолютный спирт легко поглощает влагу воздуха, поэтому его хранят в плотно закрытых сосудах.
В химии спиртами называют органические вещества, содержащие одну или несколько гидроксильных групп. Соединения, в молекулах которых имеется одна такая группа, называют одноатомными спиртами. Простейший их представитель – метиловый спирт (метанол) образуется при сухой перегонке древесины (отсюда его старое название – древесный спирт). В отличие от этанола, метанол – сильнейший яд, и обращение с ним требует крайней осторожности.
Все спирты – жидкости или твёрдые вещества. Низшие спирты хорошо растворимы в воде, а первые члены ряда – метиловый, этиловый и пропиловый спирты – смешиваются с ней в любом соотношении.
Для спиртов, начиная с пропилового , характерна изомерия. Например, существуют пропиловый и изопропиловый спирт с общей формулой , четыре бутиловых .
Свойства этих соединений существенно различаются. Так, н-бутиловый и изобутиловый спирты при нагревании окисляются оксидом меди(II) до альдегидов (подобно метанолу и этанолу), а втор-бутиловый спирт – до кетона: ; . Трет-бутиловый спирт в этих условиях не изменяется.
При использовании сильных окислителей (например, раствора ) спирты окисляются до карбоновых кислот или даже до углекислого газа. При окислении этилового спирта хлором образуется хлораль (трихлоруксусный альдегид) – бесцветная жидкость с резким запахом: .
Это вещество используется в производстве ядохимикатов и лекарственных препаратов.
Подобно воде, спирты – очень слабые кислоты; они взаимодействуют только с активными металлами с выделением водорода и образованием алкоголятов (в чистом виде – твёрдых веществ белого цвета): .
Натрий реагирует с этиловым спиртом не так энергично, как с водой, поэтому спирт часто используют в лаборатории для уничтожения остатков натрия.
В присутствии концентрированной серной кислоты многие спирты подвергаются дегидратации – теряют воду. При температуре выше 160 °С в результате дегидратации этилового спирта образуется этилен, а при более низкой температуре (140 °С) – диэтиловый (серный) эфир: .
Образование легколетучей жидкости с характерным сладковатым запахом («истинного сладкого купоросного масла») при нагревании винного спирта с серной кислотой (отсюда – название «серный эфир») упоминается в трудах многих алхимиков. Парацельс называл эту реакцию «услащением кислот». Он же предложил использовать смесь диэтилового эфира со спиртом в медицине. В XVIII в. она получила название «Капли Гофмана».
Диэтиловый эфир принадлежит к классу простых эфиров. Это бесцветная жидкость, малорастворимая в воде, tкип=34,5 °С. В отличие от спиртов, простые эфиры плохо растворяются в воде и не реагируют с металлическим натрием, поскольку в них нет кислотного атома водорода.
Русский химик Александр Павлович Эльтеков (1846 – 1894) установил, что спирты, содержащие гидроскильную группу у атома углерода при двойной связи, неустойчивы и изомеризуются в карбонильные соединения (правило Эльтекова). Простейший из таких спиртов – виниловый . Он образуется в реакции гидратации ацетилена и из-за своей нестойкости очень быстро превращается в ацетальдегид. А вот простые эфиры винилового спирта вполне устойчивы. Винилэтиловый эфир, например, получают в результате реакции этанола с ацетиленом в присутствии катализатора – соли : .
Класс спиртов включает в себя также циклические соединения. Многие ароматические спирты действительно имеют приятный запах. Например, фенилэтиловый спирт (2-фенилэтанол), содержащийся в розовом масле, придаёт ему нежный аромат.
Многоатомные спирты по ряду свойств сходны с одноатомными. Спирты, содержащие две – группы, называются гликолями, три – глицеринами, а четыре – эритритами.
Родоначальник ряда трёхатомных спиртов – глицерин, входящий в виде эфиров в состав жиров. Это бесцветная соропообразная жидкость, сладковатая на вкус, растворимая в воде. В тканях живых организмов (дрожжах, клетках печени человека) содержится некоторое количество шестиатомного спирта миоинозитола.
Характерной особенностью многоатомных спиртов является их способность взаимодействовать с гидроксидом меди(II) с образованием тёмно-синего раствора комплексного соединения меди:
———
+
———
Гидроксильная группа часто входит в состав многих полифункциональных (относящихся одновременно к нескольким классам) соединений, таких, как нуклеотиды, многие гормоны, витамины. Все эти вещества проявляют некоторые свойства спиртов.
Использованная литература:
«Энциклопедия для детей» издательство Аванта+
Том 17. Химия.
mediku.com.ua
Получение простых эфиров
Общие методы получения простых эфиров
К общим методам получения простых эфиров относятся:
- реакция А. Вильямсона;
- межмолекулярная дегидратация спиртов;
- алкоксимеркурирование алкенов.
Синтез А. Вильямсона заключается в обработке алкогалятов калия или натрия галоидными соединениями, алкилсульфатами или алкилсульфонатами и имеет вид:
Рисунок 1.
Из двух радикалов один $R$ переходит в эфир из молекулы спирта, а второй $R'$ переходит из молекулы галогеналкана. Наилучший выход эфира можно получить, если $R'$ является первичным радикалом. В этом случае реакция идет по механизму бимолекулярного нуклеофильного замещения $S_N2$, например:
Рисунок 2.
Например, получение метилэтилового эфира из этилята натрия:
Рисунок 3.
Синтез А. Вильямсона пригоден только для первичных $RX$, так как трет-алкоголят-ионы очень объемистые.
Межмолекулярной дегидратацией первичных спиртов в присутствии кислых катализаторов можно получить симметричные простые эфиры, например, получение диметилового эфира из метанола:
Рисунок 4.
Для других спиртов с дегидратацией конкурирует образование алкенов. Но при определенных условиях можно получить простой эфир:
Рисунок 5.
Межмолекулярная дегидратация спиртов не применяется для получения эфиров фенолов, так как гидроксил в этих соединениях прочно связан. Спирты с реакционноспособным гидроксилом, например, бензгидрол $(C_6H_5)_2CHOH$ или бензиловый спирт $C_6H_5CH_2OH$, очень легко этерифицируются.
В зависимости от строения спирта, дегидратация протекает по $S_N1$- или $S_N2$-механизму замещения. Реакция межмолекулярной дегидратации является хорошим методом получения смешанных спиртов, если группа $R$-первичная, а $R'$- третичная.
Специфическим катализатором при получении простых эфиров из аллиловых спиртов является платинохлористоводородная кислота.
Рисунок 6.
Межмолекулярная дегидратация имеет практическое значение для получения эфиров низших спиртов, особенно этилового эфира.
Реакцию этерификации можно осуществить в условиях гетерогенного катализа, пропуская пары спирта над $Al_2O_3$, $ThO_2$, $TiO_2$, $W_2O_5$ или над квасцами при температуре 135-140$^\circ$С. В этой реакции применяют те же реактивы, что и для получения этилена. Однако будет иным соотношение исходных веществ и более низкая температура.
Алкоксимеркурирование алкенов начинается с атаки двойной связи олефина катионом $^+HgOCOCH_3$, в результате образуется интермедиат в виде меркуриониевого катиона, в последствии раскрывающегося в результате нуклеофильной атаки спирта по наиболее замещенному углеродному атому:
Рисунок 7.
При синтезе эфиров, имеющих вторичный или третичный алкил, применяют трифторацетат ртути (I), реакция протекает в спирте:
Рисунок 8.
Простые эфиры можно получить метилированием спиртов с помощью диазометана. Эта реакция дает особенно хорошие результаты в случае незатрудненных первичных и вторичных спиртов. Реакция протекает в присутствии кислого катализатора $HBF_4$ или $BF_3$ (кислоты с нуклеофильными анионами не применяют). Реакция протекает с образованием промежуточного иона метил-диазония ${CH_3N_3}^+$.
Рисунок 9.
Примеры использования метода А. Вильямсона
В основном синтез А. Вильямсона применяют для получения эфиров фенола.
Например: получение анизола (метилового эфира фенола) из фенолята натрия и йодистого метила:
Рисунок 10.
Подобным образом можно получить фенетол $C_6H_5OC_2H_5$ - этиловый эфир фенола.
Йодистые алкилы можно заменить соответствующими сульфатами, которые обладают подобной реакционной способностью.
Рисунок 11.
Методом А. Вильямсона можно получить ароматические эфиры, но реакция при этом будет протекать тяжелее в результате пониженной реакционной способности галоидного атома, связанного с ароматическим ядром.
Окись дифенила - дифениловый эфир можно получить при нагревании сухого фенолята натрия с бромбензолом до 210$^\circ$С в присутствии катализатора порошка меди
Рисунок 12.
Получение замещенных эфиров
Например, необходимо получить дивиниловый эфир $CH_2=CH-O-CH=CH_2$.
Для образования дивинилового эфира нужно получить двойную углерод-углеродную и эфирную связь. Лучшим методом получения ненасыщенного эфира является дегидрогалогенирование галогенэфира.
Пути получения эфира с двумя хлорэтильными группами ($ClCH_2CH_2-$):
Хлорирование эфира. Однако хлорирование диэтилового эфира не дает нужного продукта, а полихлорирование эфира ведет к накоплению атомов хлора в одной этильной группе.
Превращение хлорсоединения в эфир. Хлорэтиловый эфир можно синтезировать дегидратацией хлорэтилового спирта
Рисунок 13.
Несимметричный эфир можно получить по реакции Вильямсона, например, получение фенил-n-нитробензилового эфира
Рисунок 14.
Эфир получают в результате взаимодействия фенолята натрия с n-нитробензилхлоридом. Фенолят натрия образуется при действии раствора гидроксида натрия на фенол. n-Нитробензилхлорид получают свободнорадикальным хлорированием n-нитротолуола, который образуется при нитровании толуола.
Рисунок 15.
spravochnick.ru
Спирты и простые эфиры
Реферат на тему:
Спирты и простые эфиры
Подготовил
ученик 11 – Б класса
Орешко Иван
Формула винного, или этилового, спирта (этанола) , несомненно, знакома многим даже совершенно далёким от химии людям. Это соединение, которое образуется при ферментативном брожении крахмала, глюкозы и фруктозы, в быту называют просто спиртом.
Получение вина путём сбраживания виноградного сока было освоено людьми уже несколько тысячелетий назад. Однако чистый спирт, содержащий лишь незначительное количество воды, выделили при перегонке вина только в XIII в.. В Средние века стали известны многие свойства винного спирта, например горючесть (одно из его латинских названий – aqua ardens, что в переводе означает «огненная вода») и способность извлекать из листьев, плодов и кореньев содержащиеся в них биологически активные вещества и красители (полученные растворы в быту называют настойками). Алхимик Арнальдо из Вилановы упоминает спирт в числе медикаментов и противоядий.
Слово «спирт» происходит от древнего латинского названия этого вещества – spiritus vini («дух вина»). Этот термин до сих пор используется в медицине при записи рецептов. В XVI в. в западноевропейских языках, а в XVIII в. и в русском у винного спирта появилось новое название – алкоголь (араб. «ал-кугул»).
Безводный (абсолютный) этиловый спирт был впервые получен лишь в 1796 г. российским химиком Товием Егоровичем Ловинцем и немецким учёным Иеремией Вениамином Рихтером. Для этой цели они применяли вещества, связывающие воду, например оксид кальция (негашеную известь). Абсолютный спирт легко поглощает влагу воздуха, поэтому его хранят в плотно закрытых сосудах.
В химии спиртами называют органические вещества, содержащие одну или несколько гидроксильных групп. Соединения, в молекулах которых имеется одна такая группа, называют одноатомными спиртами. Простейший их представитель – метиловый спирт (метанол) образуется при сухой перегонке древесины (отсюда его старое название – древесный спирт). В отличие от этанола, метанол – сильнейший яд, и обращение с ним требует крайней осторожности.
Все спирты – жидкости или твёрдые вещества. Низшие спирты хорошо растворимы в воде, а первые члены ряда – метиловый, этиловый и пропиловый спирты – смешиваются с ней в любом соотношении.
Для спиртов, начиная с пропилового , характерна изомерия. Например, существуют пропиловый и изопропиловый спирт с общей формулой , четыре бутиловых .
Свойства этих соединений существенно различаются. Так, н-бутиловый и изобутиловый спирты при нагревании окисляются оксидом меди(II) до альдегидов (подобно метанолу и этанолу), а втор-бутиловый спирт – до кетона: ; . Трет-бутиловый спирт в этих условиях не изменяется.
При использовании сильных окислителей (например, раствора ) спирты окисляются до карбоновых кислот или даже до углекислого газа. При окислении этилового спирта хлором образуется хлораль (трихлоруксусный альдегид) – бесцветная жидкость с резким запахом: .
Это вещество используется в производстве ядохимикатов и лекарственных препаратов.
Подобно воде, спирты – очень слабые кислоты; они взаимодействуют только с активными металлами с выделением водорода и образованием алкоголятов (в чистом виде – твёрдых веществ белого цвета): .
Натрий реагирует с этиловым спиртом не так энергично, как с водой, поэтому спирт часто используют в лаборатории для уничтожения остатков натрия.
В присутствии концентрированной серной кислоты многие спирты подвергаются дегидратации – теряют воду. При температуре выше 160 °С в результате дегидратации этилового спирта образуется этилен, а при более низкой температуре (140 °С) – диэтиловый (серный) эфир: .
Образование легколетучей жидкости с характерным сладковатым запахом («истинного сладкого купоросного масла») при нагревании винного спирта с серной кислотой (отсюда – название «серный эфир») упоминается в трудах многих алхимиков. Парацельс называл эту реакцию «услащением кислот». Он же предложил использовать смесь диэтилового эфира со спиртом в медицине. В XVIII в. она получила название «Капли Гофмана».
Диэтиловый эфир принадлежит к классу простых эфиров. Это бесцветная жидкость, малорастворимая в воде, tкип=34,5 °С. В отличие от спиртов, простые эфиры плохо растворяются в воде и не реагируют с металлическим натрием, поскольку в них нет кислотного атома водорода.
Русский химик Александр Павлович Эльтеков (1846 – 1894) установил, что спирты, содержащие гидроскильную группу у атома углерода при двойной связи, неустойчивы и изомеризуются в карбонильные соединения (правило Эльтекова). Простейший из таких спиртов – виниловый . Он образуется в реакции гидратации ацетилена и из-за своей нестойкости очень быстро превращается в ацетальдегид. А вот простые эфиры винилового спирта вполне устойчивы. Винилэтиловый эфир, например, получают в результате реакции этанола с ацетиленом в присутствии катализатора – соли : .
Класс спиртов включает в себя также циклические соединения. Многие ароматические спирты действительно имеют приятный запах. Например, фенилэтиловый спирт (2-фенилэтанол), содержащийся в розовом масле, придаёт ему нежный аромат.
Многоатомные спирты по ряду свойств сходны с одноатомными. Спирты, содержащие две – группы, называются гликолями, три – глицеринами, а четыре – эритритами.
Родоначальник ряда трёхатомных спиртов – глицерин, входящий в виде эфиров в состав жиров. Это бесцветная соропообразная жидкость, сладковатая на вкус, растворимая в воде. В тканях живых организмов (дрожжах, клетках печени человека) содержится некоторое количество шестиатомного спирта миоинозитола.
Характерной особенностью многоатомных спиртов является их способность взаимодействовать с гидроксидом меди(II) с образованием тёмно-синего раствора комплексного соединения меди:
———
+
———
Гидроксильная группа часто входит в состав многих полифункциональных (относящихся одновременно к нескольким классам) соединений, таких, как нуклеотиды, многие гормоны, витамины. Все эти вещества проявляют некоторые свойства спиртов.
Использованная литература:
«Энциклопедия для детей» издательство Аванта+
Том 17. Химия.
uverenniy.ru
Спирты и простые эфиры
Реферат на тему:
Спирты и простые эфиры
Подготовил
ученик 11 – Б класса
Орешко Иван
Формула винного, или этилового, спирта (этанола) , несомненно, знакома многим даже совершенно далёким от химии людям. Это соединение, которое образуется при ферментативном брожении крахмала, глюкозы и фруктозы, в быту называют просто спиртом.
Получение вина путём сбраживания виноградного сока было освоено людьми уже несколько тысячелетий назад. Однако чистый спирт, содержащий лишь незначительное количество воды, выделили при перегонке вина только в XIII в.. В Средние века стали известны многие свойства винного спирта, например горючесть (одно из его латинских названий – aqua ardens, что в переводе означает «огненная вода») и способность извлекать из листьев, плодов и кореньев содержащиеся в них биологически активные вещества и красители (полученные растворы в быту называют настойками). Алхимик Арнальдо из Вилановы упоминает спирт в числе медикаментов и противоядий.
Слово «спирт» происходит от древнего латинского названия этого вещества – spiritus vini («дух вина»). Этот термин до сих пор используется в медицине при записи рецептов. В XVI в. в западноевропейских языках, а в XVIII в. и в русском у винного спирта появилось новое название – алкоголь (араб. «ал-кугул»).
Безводный (абсолютный) этиловый спирт был впервые получен лишь в 1796 г. российским химиком Товием Егоровичем Ловинцем и немецким учёным Иеремией Вениамином Рихтером. Для этой цели они применяли вещества, связывающие воду, например оксид кальция (негашеную известь). Абсолютный спирт легко поглощает влагу воздуха, поэтому его хранят в плотно закрытых сосудах.
В химии спиртами называют органические вещества, содержащие одну или несколько гидроксильных групп. Соединения, в молекулах которых имеется одна такая группа, называют одноатомными спиртами. Простейший их представитель – метиловый спирт (метанол) образуется при сухой перегонке древесины (отсюда его старое название – древесный спирт). В отличие от этанола, метанол – сильнейший яд, и обращение с ним требует крайней осторожности.
Все спирты – жидкости или твёрдые вещества. Низшие спирты хорошо растворимы в воде, а первые члены ряда – метиловый, этиловый и пропиловый спирты – смешиваются с ней в любом соотношении.
Для спиртов, начиная с пропилового , характерна изомерия. Например, существуют пропиловый и изопропиловый спирт с общей формулой , четыре бутиловых .
Свойства этих соединений существенно различаются. Так, н-бутиловый и изобутиловый спирты при нагревании окисляются оксидом меди(II) до альдегидов (подобно метанолу и этанолу), а втор-бутиловый спирт – до кетона: ; . Трет-бутиловый спирт в этих условиях не изменяется.
При использовании сильных окислителей (например, раствора ) спирты окисляются до карбоновых кислот или даже до углекислого газа. При окислении этилового спирта хлором образуется хлораль (трихлоруксусный альдегид) – бесцветная жидкость с резким запахом: .
Это вещество используется в производстве ядохимикатов и лекарственных препаратов.
Подобно воде, спирты – очень слабые кислоты; они взаимодействуют только с активными металлами с выделением водорода и образованием алкоголятов (в чистом виде – твёрдых веществ белого цвета): .
Натрий реагирует с этиловым спиртом не так энергично, как с водой, поэтому спирт часто используют в лаборатории для уничтожения остатков натрия.
В присутствии концентрированной серной кислоты многие спирты подвергаются дегидратации – теряют воду. При температуре выше 160 °С в результате дегидратации этилового спирта образуется этилен, а при более низкой температуре (140 °С) – диэтиловый (серный) эфир: .
Образование легколетучей жидкости с характерным сладковатым запахом («истинного сладкого купоросного масла») при нагревании винного спирта с серной кислотой (отсюда – название «серный эфир») упоминается в трудах многих алхимиков. Парацельс называл эту реакцию «услащением кислот». Он же предложил использовать смесь диэтилового эфира со спиртом в медицине. В XVIII в. она получила название «Капли Гофмана».
Диэтиловый эфир принадлежит к классу простых эфиров. Это бесцветная жидкость, малорастворимая в воде, tкип=34,5 °С. В отличие от спиртов, простые эфиры плохо растворяются в воде и не реагируют с металлическим натрием, поскольку в них нет кислотного атома водорода.
Русский химик Александр Павлович Эльтеков (1846 – 1894) установил, что спирты, содержащие гидроскильную группу у атома углерода при двойной связи, неустойчивы и изомеризуются в карбонильные соединения (правило Эльтекова). Простейший из таких спиртов – виниловый . Он образуется в реакции гидратации ацетилена и из-за своей нестойкости очень быстро превращается в ацетальдегид. А вот простые эфиры винилового спирта вполне устойчивы. Винилэтиловый эфир, например, получают в результате реакции этанола с ацетиленом в присутствии катализатора – соли : .
Класс спиртов включает в себя также циклические соединения. Многие ароматические спирты действительно имеют приятный запах. Например, фенилэтиловый спирт (2-фенилэтанол), содержащийся в розовом масле, придаёт ему нежный аромат.
Многоатомные спирты по ряду свойств сходны с одноатомными. Спирты, содержащие две – группы, называются гликолями, три – глицеринами, а четыре – эритритами.
Родоначальник ряда трёхатомных спиртов – глицерин, входящий в виде эфиров в состав жиров. Это бесцветная соропообразная жидкость, сладковатая на вкус, растворимая в воде. В тканях живых организмов (дрожжах, клетках печени человека) содержится некоторое количество шестиатомного спирта миоинозитола.
Характерной особенностью многоатомных спиртов является их способность взаимодействовать с гидроксидом меди(II) с образованием тёмно-синего раствора комплексного соединения меди:
———
+
———
Гидроксильная группа часто входит в состав многих полифункциональных (относящихся одновременно к нескольким классам) соединений, таких, как нуклеотиды, многие гормоны, витамины. Все эти вещества проявляют некоторые свойства спиртов.
Использованная литература:
«Энциклопедия для детей» издательство Аванта+
Том 17. Химия.
100-bal.ru
Эфиры простые расщепление из спиртов
Расщепление простых эфиров становится возможным после превращения алкокси-группы в хорощую уходящую группу (см. разд. 11.4). Это осуществляется переводом простых эфиров в оксониевые соединения. Примерами могут служить реакции расщепления простых эфиров галогеноводородами галогенид-анион играет роль нуклеофила, а в качестве уходящей группы выступает молекула спирта. В соответствии с нуклеофильной силой галогенид-анионов в протонных средах (см. разд. 2.1.1) расщепление простых эфиров легче всего будет происходить под действием иодоводородной кислоты [c.204] Простые эфиры можно расщепить нагреванием с концентрированными растворами иодоводородной или бромоводородной кислоты [813]. Использование НС1 редко бывает успешным. НВг взаимодействует медленнее, чем HI, но часто оказывается более удачным реагентом, так как дает меньше побочных реакций. Для этого превращения был использован и межфазный катализ [814]. В реакцию вступают как диалкиловые, так и алкилариловые эфиры. В последнем случае разрывается связь между алкильной группой и кислородом. Как и в реакции 10-68, уходящей группой в действительности является не 0R , а OHR. И хотя алкилариловые эфиры всегда расщепляются, давая алкилгалогенид и фенол, для диалкиловых эфиров такого общего правила не существует. Часто расщепление происходит по обе стороны от кислорода так, что получается смесь двух спиртов и двух алкилгалогенидов. Однако метиловые эфиры реагируют обычно таким образом, что продуктом оказывается ме-тилбромид или метилиодид. Избыток Н1 или НВг превращает получающийся спирт в алкилгалогенид, поэтому из диалкиловых [c.169]Расщепление простых эфиров происходит при действии некоторых кислот. Например, концентрированная (особенно дымящая) серная кислота поглощает пары простых эфиров, и при этом образуются сложный эфир серной кислоты (этилсерная кислота) и спирт. Например [c.128]
В отличие от редкого использования в лабораторной практике метола получения простых эфиров из спиртов в присутствии сильных кислот расщепление этих эфиров сильными кислотами нашло широкое примеиение, прежде всего в аналитических целях. [c.261]
О том, что в данном случае реакция протекает по механизму N2, а не с промежуточным образованием карбокатиона, свидетельствует то, что при расщеплении оптически активного простого эфира (56) образуется оптически активный спирт. Это означает, что связь атома кислорода с асимметрическим атомом углерода в процессе реакции не затрагивается. [c.156]
М-176, Р-Зг Эфиры простые расщепление Р-12в синтез ВЧ 2.4 ---из спиртов Г-2, П-5в [c.685]
Среди других методов, описанных в литературе для получения бромистых алкилов, можно упомянуть присоединение бромистого водорода к этиленовым углеводородам в присутствии абсорбента, состоящего из геля гидроокиси металла нагревание спирта или его сернокислого эфира с бромистоводородной кислотой в водном растворе при ИО—180° и под давлением для предотвращения образования паровой фазы обработку диалкилсульфата бромистым водородом в паровой фазе нагревание спирта, насыщенного бромистым водородом, вместе с бромистоводородной солью азотсодержащего гетероциклического соединения, например бромистоводородного пиридина расщепление алифатических простых эфиров бромистым водородом и водяным паром в Присутствии дегидратирующего катализатора . Алкилбромиды были получены также из высокомолекулярных спиртов насыщением спирта бромистым водородом при 100° . [c.122]
Важным свойством сахаров - простейших углеводов - является способность к брожению. Брожением называется процесс расщепления молекул сахаров с выделением СО2 под влиянием ферментов. Брожению подвергаются сахара с числом атомов углерода, кратным трем. Наиболее известно спиртовое брожение, происходящее под влиянием фермента дрожжей зимазы. Механизм спиртового брожения сложен, он включает более 10 отдельных стадий, в которых участвуют сложные эфиры глюкозы, фруктозы, глицерина с фосфорной кислотой, уксусный альдегид, пиро-виноградная кислота СН3—СО—СООН, а конечными продуктами являются этиловый (винный) спирт и СО2 [c.426]
Исследуя совершенно различные типы реакций. Сан Филиппо с сотр. [586, 1194] получили высокие выходы в реакции расщепления сложноэфирных связей избытком КОг в присутствии каталитических количеств ( /з моля) 18-крауна-б при энергичном перемешивании в бензоле от 8 ч и редко до 140 ч и последующей обработкой водой. Оказалось, что такое расщепление на спирт и кислоту проходит со многими сложными эфирами первичных, вторичных и третичных спиртов, а также фенолов и тиолов. Также расщепляются фосфаты. При использовании в качестве растворителя ДМСО время реакции сокращается. Возможность разрыва связи кислород—алкил в результате воздействия супернуклеофила рассматривалась, но была отвергнута, по крайней мере для вторичных спиртов, так как наблюдалось обращение конфигурации на 99% [586]. Простые амиды и нитрилы не реагируют. [c.395]
Из употребляемых для расщепления озонидов таких безводных растворителей, как спирт, эфир, безводные муравьиная и уксусная кислоты, лишь последняя оказалась особенно пригодной. В этой кислоте озонирование протекает очень равномерно, так как почти все озониды в ней растворимы и таким образом при ее употреблении eвoзмoжнo загрязнение образующегося озонида вследствие обволакивания им исходного материала. Однако для приготовления чистых озопидов ледяная уксусная кислота не особенно пригодна, так как требуется слишком высокая температура для ее полного удаления. Зто обстоятельство не имеет значения, когда озонид сразу расщепляется в самом растворе. Расщепление озонидов ледяной уксусной кислотой производится таким же образо.м, как и водой, т. е. простым нагреванием или продолжительным кипячением. При этом образуются перекпси в значительно большем количестве, чем при расщеплении водой, а при известных условиях имеют место даже все теоретически предусмотренные возможности. Так, озонид олеиновой кислоты распадается в ледяной уксусной кислоте следующим образом [c.86]
Образование простых эфиров из спиртов с участием кислот. Расщепление простых эфиров [c.260]
Реакция сложных эфиров неорганических кислот и галогенид-ионов 10-68. Реакция спиртов с галогеноаодородами или галогеиоаигидридами неорганических кислот 10-69. Расщепление простых эфиров действием НГ или НВг 10-71. Расщепление сложных эфиров действием ЬП [c.411]
Значительно легче, чем в случае простых эфиров, происходит расщепление литийорганическими соединениями циклических эфиров, например, тетрагидрофурана или диоксана. Еще легче протекает реакция расщепления литийорганическими соединениями органических окисей окиси этилена, окиси пропилена, окиси триметилена или окиси циклогексена (см. ниже). При этих реакциях в результате разрыва связи С — О образуются с хорошим выходом спирты, например [c.167]
По сравнению с прямой дегидратацией спиртов или с расщеплением простых и сложных эфиров в Ч.р. реже наблюдается изомеризация углеродного скелета существенно также, что разложение ксантогенатов протекает при умеренной т-ре в слабощелочной среде. [c.394]
Молекулярные ионы простых эфиров, как правило, не элиминируют молекулу спирта. Обычно важнее процесс простого расщепления связи С-О, который уже рассматртвался на примере тиолов необходимым условием для его осуществления является устойчивость образующегося карбониевого иона (рис. 5.10,0). В случае простых эфиров также предпочтительно образуется наиболее устойчивый из двух возможных карбониевых ионов [RЧ и Амины редко претерпевают [c.207]
Трехатомные спирты (глицерины). Простейший трехатомный спирт — глицерин СН2ОН — СНОН — СН2ОН, или СзН5(ОН)з. В природе он чрезвычайно распространен и входит в состав многочисленных глицеридов, т. е. сложных эфиров различных кислот. К числу таких глицеридов относятся жиры и масла. В технике глицерин получают преимущественно расщеплением жира в автоклавах при 180° С. [c.301]
Нуклеофильные реакции имеют важное значение в промышленности основного органического и нефтехимического синтеза. К их числу относятся процессы замещения и расщепления галогенпро-изводных, спиртов и эфиров сульфокислот (синтез спиртов, простых эфиров, меркаптанов, сульфидов, аминов, ненасыщенных веществ, а-окисей н других гетероциклических соединений), реакции присоединения (синтезы из а-окисей, альдольная конденсация, получение азотсодержащих производных альдегидов и кето-нов, некоторые реакции присоединения по двойным и тройным связям), процессы этерификации и другие превращения кислот и их производных. [c.28]
Спирты в присутствии кислот распадаются с образованием карбокатионов (в), которые реагируют с присутствующими ионами, образуя в зависимости от условий гало1щопроизводные, алкилсульфаты или простые эфиры г). Расщепление простых эфиров под действием протонных кислот подчиняется тому же принципу ([c.239]
Эфиры третичных спиртов могут быть омылены при нагревании со спиртами с образованием простых эфиров (алкоголиз). В этом случае расщепление происходит не по связи ацил—кислород, а по связи алкил—кислород (Коен, Шне11дер) [c.263]
В одной из предложенных схем [5, 6] для построения углеродного скелета со-оксикарбоновой кислоты была применена реакция конденсации а, со-дигалоидопроизводного с двумя молекулами ацетоуксусного эфира. Кислотное расщепление продукта конденсации приводило к а, -дикарбоновой кислоте, содержащей на четыре атома углерода больше, чем исходное дигалоидопроизводное. После того как был разработан удобный метод получения алкплацетоуксусных эфиров непосредственным алкилированием натрийацетоуксусного эфира, получаемого при сложноэфирной конденсации этилацетата под влиянием этилата натрия, который готовится из спирта и щелочи [7], эта стадия может быть осуществлена очень просто. [c.9]
Одним из простейших примеров гидролиза с распадом исходных молекул является расщепление простых эфиров, что можно осуществить в гомо- или гетерогенной фазе, Диэтиловый эфир под действием конц. h3SO4 при нагревании образует две молекулы спирта [c.528]
Гемопротеид пероксидаза катализирует окисление ряда фенолов и ароматических аминов. Эстеразы контролируют образование и, гидролиз сложных эфиров (из простых спиртов и кислот) липазы конт-)олируют образование и гидролиз глицеридов высших жирных кислот., (арбогидразы катализируют расщепление гликозидных связей в простых гликозидах и полисахаридах. [c.732]
Диазоалканы можно превратить в простые эфиры н результате термического или фотохимического расщепления в присутствии спирта. Это реакции карбенового и карбеноидного типа [498]. Аналогичные интермедиаты образуются и в реакции диазоалка-нов со спиртами в присутствии трет-BuO l, приводящей к аце-талям [499]. [c.122]
В том случае, когда эфир содержит первичную и вторичную алкильные группы, расщенленне отличается высокой региоселективиостью и, как правило, образуется только одни из двух возможных спиртов (вторичный) и только первичный алкилгалогеннд. Хлорид- и фторид-ионы в воде сильно сольватированы за счет водородных связей и обладают низкой нуклеофильностью, ноэтому соляная и особенно плавиковая кислоты не пригодны для кислотного расщепления простых эфиров ио 5 ,/2-механизму. [c.923]
При расщеплении алкоксиспиртов проявляются особенности, присущие как спиртам, так и простым эфирам. Например, 2-эток-сиэтанол разлагается по следующей схеме [c.37]
Четырехокись рутения, мен е летучая, менее токсичная, менее дорогая и более активная, чем четырехокись осмия, окисляет простые эфиры до сложных эфиров, но не действует на последние и на лактоны. В отличие от осмиевого ангидрида, она вызывает не гидроксилирова- ие, а расщепление двойных связей. Так, циклогекрен при действии RUO4 превращается в адипиновый диальдегид, а октен-1 образует геп-тиловый альдегид (и, вероятно, формальдегид). Бензиловый спирт окисляется ею до бензальдегида, но алифатические первичные спирты дают соответствующие кислоты. [c.75]
Как уже указывалось, химические свойства тетрагидрофурановых соединений определяются их структурой и во многом напоминают таковые у насыщенных алифатических веш.еств. в особенности простых эфиров. Для них характерны реакции расщепления цикла по эфирной связи и реакции замещения. Эти реакции, корошо изученные для случаев простейших соединений этого ряда — тетрагидрофурана, тетрагидрофурфурилового спирта и некоторых их гомологов, могут широко использоваться в органическом синтезе для получения многих ценных полупродуктов. [c.194]
Ацетали обладают структурой простых эфиров и, подобно простым эфирам, расщепляются кислотами и устойчивы по отношению к основаниям. Однако ацетали отличаются от простых эфиров по той необычайной легкости, с которой они подвергаются расщеплению кислотами уже при комнатной температуре при действии разбавленных минеральных кислот они быстро превращаются в смесь спирта и альдегида. Механизм гидролиза является обратным механизму образования ацеталей [c.613]
Восстановительное расщепленне аллиловых спиртов, нх простых эфиров нли ацетатов с помощью амальгамированного Ц. и [c.646]
При кипячении О-диметилцитромицинилхлорида (XIV, X = С1) с метиловым спиртом получается почти с количественным выходом триметиловый эфир. Аналогичным образом при действии этилового спирта образуется простой эфир карбинольного основания, что является хорошо известной характеристикой карбинольных оснований [2571. Расщепление О-диметилцитромицинола и карбинольного метилового эфира, изученное в самых различных условиях в общем дало одни и те же результаты. Гидролиз горячим разбав- [c.90]
Аналогично проходит процесс расщепления простой эфирной с1вязи галогеноводородными кислотами (уравнение 6.6). Уходящей группой здесь является молекула фенола (или спирта в случае диалкиловых эфиров). [c.169]
Обработка солей димеров фтор-, хлор- и бромацетонитрилов состава 2R N ЗHX первичными и вторичными спиртами при комнатной температуре. ведет к несимметричному расщеплению и образованию гидрохлоридов галогенацетамидинов, простых и сложных эфиров по следующему уравнению [c.51]
Безводный СгОз в уксусной кислоте был использован для превращения метиловых простых эфиров в соответствующие формиаты с выходами я 50% [124] [схема (8.56)]. Так как формиаты легко гидролизуются в соответствующие спирты, эту реакцию можно использовать для удаления метильной группы, введенной для защиты алифатической гидроксигруппы. При окислении вгор-алкиловых простых эфиров образуются продукты расщепления. Например, при окислении диизопропило-вого эфира с помощью хромовой кислоты в 45%-й серной кислоте с выходом 97% получается ацетон [125]. [c.352]
chem21.info