Содержание
Химические свойства одноосновных предельных кислот. — КиберПедия
Карбоновые кислоты — это производные уг-вод-ов, имеющие в своем составеодну или несколько карбоксильных групп. Общая формула карбоновых кислот — R-COOH. Карбоксильная группа в свою очередь состоит изкарбонильной (>С=О) и гидроксильной (-ОН) групп Н-СООН муравьиная (метановая)
2. СН3-СООН уксусная (этановая)
3. СН3-СН2-СООН пропионовая (пропановая)
4. СН3-СН2-СН2-СООН масляная (бутановая)
СН3-СН(СН3)-СООН изомасляная (изобутановая, 2-метилпропановая)
5. валериановая (пентановая)
6. С5Н11СООН капроновая (гексановая)
7. С15Н31СООН пальмитиновая(гексадекановая)
8. С17Н35СООН стеариновая (октадекановая)
ХИМ. Св-ва,
1. Диссоциация в водных растворах ,
СН3СООН →СН3СОО- + Н+(протон)
2.Замещение водорода на металл 2Na + 2Ch4COOH→2Ch4COONa + h3
3)Замещение гидроксила в карбоксильной группе R-COOH(галагеноангедрид-нестойкое)+PCl5=R-COCl+POCl3+HCl
4)Замещение гидроксила на остаток спирта R-COOH+HO-R=R-COOR(сложный эфир)+Н2О
5) Замещение гидроксила на остаток кислоты СН3-СООNa + Cl-CO-Ch3-Ch4=Ch4-CO-O-CO-Ch3-Ch4(уксуснопропио новый ангедрид) +NaCl. .
.
6) Замещение гидроксила на аминогруппу Ch4-COOH + Nh4 (аммиак) →Н2O+СН3-СОNh4(амид кислоты)
7)образование ангидрида 2R-COOH→-h3O→RCOOOCR
8)2RCOOH+MgO→R-CO-OMg-O-CO-R + h3O
9)RCOOH + KOH→R-COOK+h3O
Непред кислоты и их химические свойства.
Карбоновые кислоты — это производные уг-вод-ов, имеющие в своем составеодну или несколько карбоксильных групп. Общая формула карбоновых кислот — R-COOH. Карбоксильная группа в свою очередь состоит изкарбонильной (>С=О) и гидроксильной (-ОН) групп В зависимости от природы уг-вод-ного радикала различают: алифатические (насыщенные и ненасыщенные) кислоты и ароматические кислоты. Это производные непредельных уг-вод-ов у которых один атом водорода замещен на карбоксильную группу. Ненасыщенные одноосновные кислоты
1. СН2=СН-СООН акриловая
2. С17Н33СООН олеиновая
3) С17Н31СООН линолевая
4) С17Н29СООН линоленовая кислота
Хим. Св-ва.
1)все реакции на карбоксильную группу (образование солей, сложных эфиров, галагеноангедридов)
1. Диссоциация в водных растворах ,
Диссоциация в водных растворах ,
СН3СООН →СН3СОО- + Н+(протон)
2.Замещение водорода на металл 2Na + 2Ch4COOH→2Ch4COONa + h3
3)Замещение гидроксила в карбоксильной группе R-COOH(галагеноангедрид-нестойкое)+PCl5→R-COCl+POCl3+HCl 4)Замещение гидроксила на остаток спирта R-COOH+HO-R→R-COOR(сложный эфир)+Н2О
5) Замещение гидроксила на остаток кислоты СН3-СООNa + Cl-CO-Ch3-Ch4→Ch4-CO-O-CO-Ch3-Ch4(уксуснопропио новый ангедрид) +NaCl..
6) Замещение гидроксила на аминогруппу Ch4-COOH + Nh4 (аммиак)Н2O+СН3-СОNh4(амид кислоты)
7)образование ангидрида 2R-COOH→-h3O→RCOOOCR
8)2RCOOH+MgO→R-CO-OMg-O-CO-R + h3O
9)RCOOH + KOH→R-COOK+h3O
С2Н3СООН +НОС2Н5→ (-Н2О) →С2Н3СОО-С2 Н5(Этилакриловый эфир)
2)Р-ии присоединения Непред кислоты (например, олеиновая) могут присоединять по двойной
связи водород, галогены, галогеноводороды, воду (они, например, дают реакцию
обесцвечивания бромной воды). Они могут вступать в реакции полимеризации.
3)окислениеС3Н5СООН=({О},НОН,КМО4)СН3-СНОН-СНОН-СООН(дигидроксо кислоты)
С3Н5СООН=({О},t*)-=СН3-СООН(УКСУСНАЯ КИСЛОТА)+ НООС-СООН(щавелевая кислота)
4)полимеризация n Ch3=CH-COOH→[-Ch3-CH(COOH)-]n
Дикарбоновые кислоты.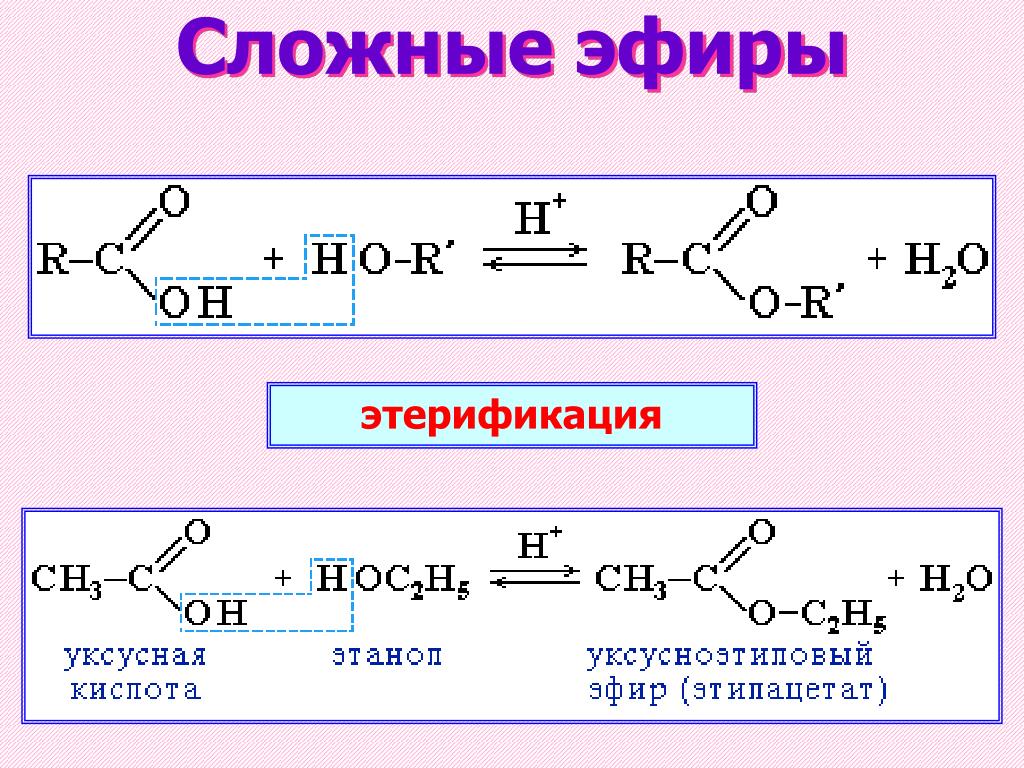
Карбоновые кислоты — это производные уг-вод-ов, имеющие в своем составеодну или несколько карбоксильных групп. Общая формула карбоновых кислот — R-COOH. Карбоксильная группа в свою очередь состоит изкарбонильной (>С=О) и гидроксильной (-ОН) групп В зависимости от количества карбоксильных групп карбоновые кислоты делят наодноосновные(монокарбоновые), двухосновные(дикарбоновые) и многоосновные кислоты. Это орг.соединения содержащие две карбоксильные групппы. Двухосновные кислоты
НООС-СООН щавелевая (этандиовая)
НООС-СН2-СООН малоновая пропандиовая
НООС-СН2-СН2-СООН янтарная (бутандиовая)
НООС-СН2-СН2-СН2-СООНпентандиовая, глутаровая
НООС-СН2-СН2-СООН янтарная=(-Н2О)=ангидрид янтарной кислоты
ПОЛУЧЕНИЕ:
1)окисление 2хатомных спиртов Ch3(OH)- Ch3(OH)→[O],-h3O→COH-COH→[O]→COOH-COOH
2)из дигалогенпроизводных Cl-Ch3-Ch3-Cl→(2KCl)→N≡C-Ch3-Ch3-C≡N→(+6h3O,-2Nh4)→HOOC-Ch3-Ch3-COOH+2h3O
ХИМИЧЕСКИЕ СВ-ВА
1)реакции замещения
COOH-COOH→(+NaOH,-h3O)→ COONa-COOH→(+NaOH,-h3O)→ COONa-COONa
2)выдеоение СО2 при t
COOH-COOH→CO2+HCOOH
COOH-Ch3-COOH→CO2+Ch4COOH
3)выделение Н2О при t
СООН-Ch3-Ch3-COOH→(t,-h3O)→ (-Ch3-COOOC-Ch3-)ЦИКЛ
4) COOH-COOH→[O]→CO2+CO+h3O
5) COOH-Ch3-COOH+2C2H5O→CO(O-C2H5)-Ch3-CO(O-C2H5)+h3O
6) СООН-Ch3-Ch3-COOH+2Nh5OH→ СООNh5-Ch3-Ch3-COONh5→(-h3O)→ СОNh3-Ch3-Ch3-CONh3→(-Nh4)→(-Ch3-C(O)-NH-C(O)-Ch3-)→(-CH=CH-NH-CH=CH-)
Сложные эфиры R-COOR’ — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
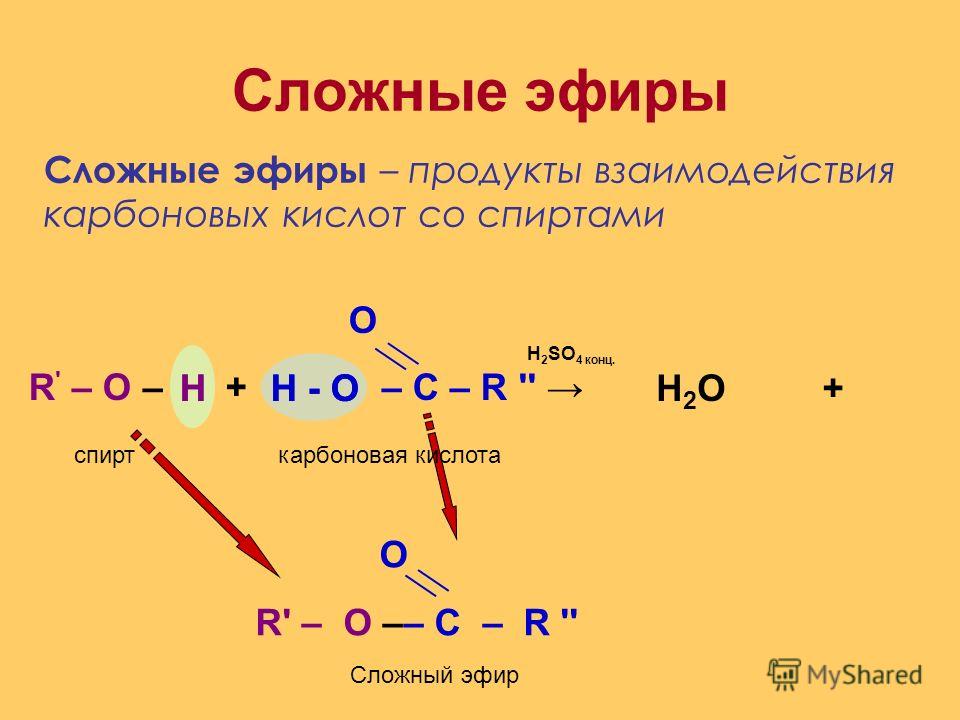
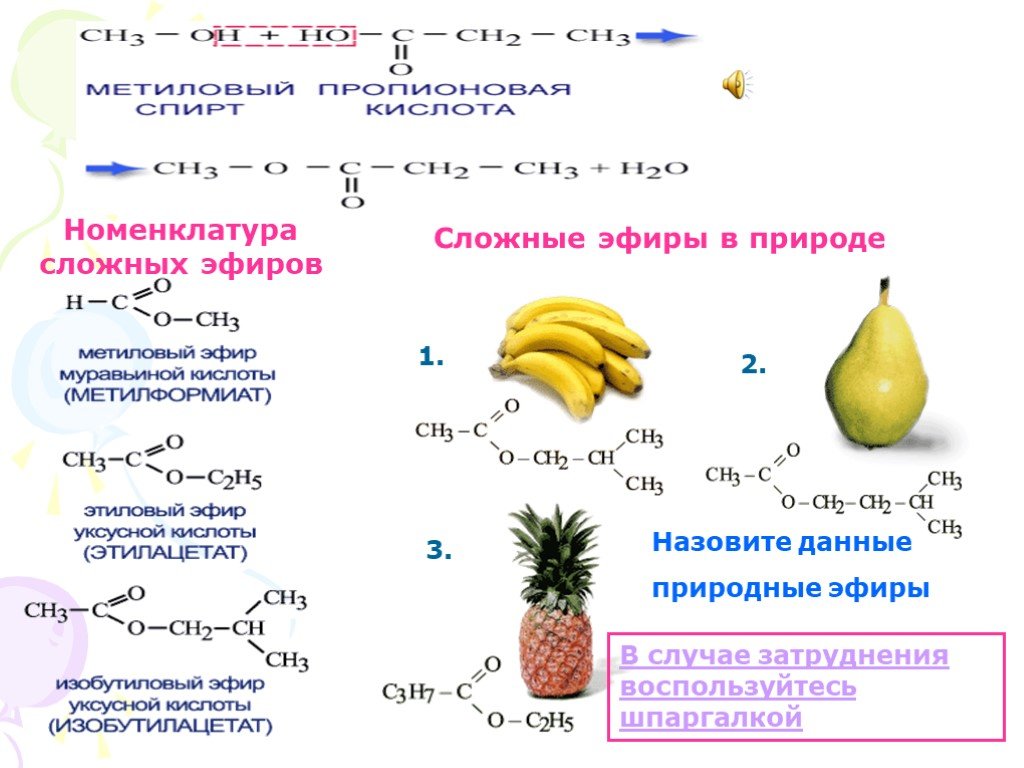
1. Сложные эфиры (R-COOR’)
Сложные эфиры низших карбоновых кислот
и простейших одноатомных спиртов — летучие бесцветные жидкости с
характерным, зачастую фруктовым запахом.
Сложные эфиры высших карбоновых кислот — бесцветные
твердые вещества.
Атом углерода карбонильной группы электрофилен, вследствие этого
для них характерны реакции замещения спиртового остатка с разрывом
связи ацил-кислород:
R-CO-OR’ + Nu− → RCONu + R’O−
Nu: НOH, ROН, Nh4, RNh3, R2Ch3 и т. п.
Характерные реакции SN .
Реакционная способность как у кислот.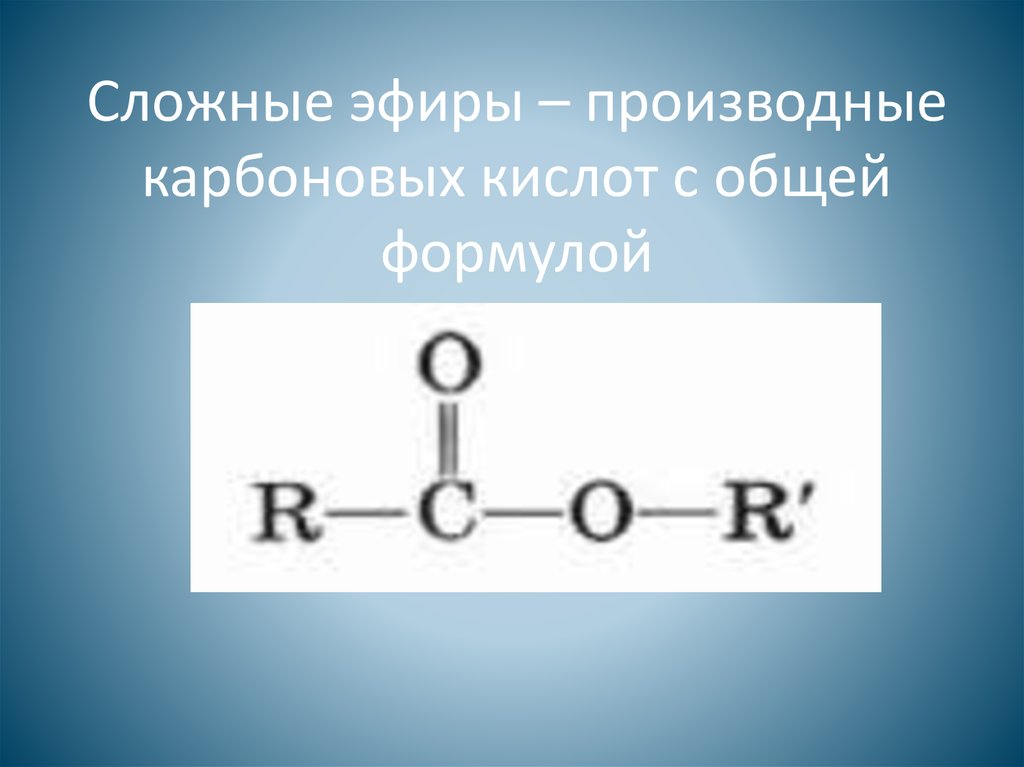
1
HCOOCh4 — метилформиат, tкип = 32 °C; растворитель жиров, минеральных и растительных
масел, целлюлозы, жирных кислот; ацилирующий агент; используют в производстве некоторых
уретанов, формамида.
HCOOC2H5 — этилформиат, tкип = 53 °C; растворитель нитрата и ацетата целлюлозы;
ацилирующий агент; отдушка для мыла, его добавляют к некоторым сортам рома, чтобы
придать ему характерный аромат; применяют в производстве витаминов B1,A,E.
HCOOCh3CH(Ch4)2 — изобутилформиат несколько напоминает запах ягод малины.
HCOOCh3C6H5 — бензилформиат, tкип = 202 °C; имеет запах жасмина; используется как
растворитель лаков и красителей.
Ch4COOC2H5 — этилацетат, tкип = 78 °C; подобно ацетону растворяет большинство полимеров.
По сравнению с ацетоном его преимущество в более высокой температуре кипения (меньшей
летучести).
Ch4COOCh3Ch3CH(Ch4)2 — изоамилацетат (изопентилацетат), используется как компонент
грушевой и банановой эссенций.
Ch4COOC8h27 — н-октилацетат имеет запах апельсинов.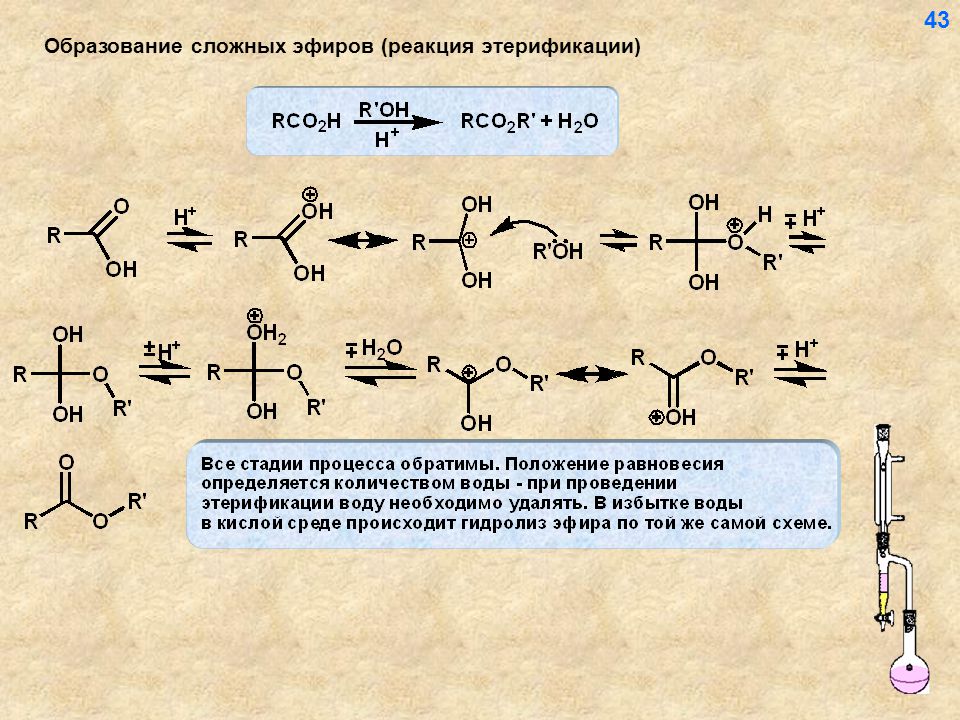
C3H7COOCh4 — метилбутират, tкип = 102,5 °C; по запаху напоминает ранет.
C3H7COOC2H5 — этилбутират, tкип = 121,5 °C; имеет характерный запах ананасов.
C3H7COOC5h21 —н-пентилбутират и C3H7COOCh3Ch3CH(Ch4)2 —изопентилбутират имеют запах
груш, а также служат растворителями в лаках для ногтей.
2
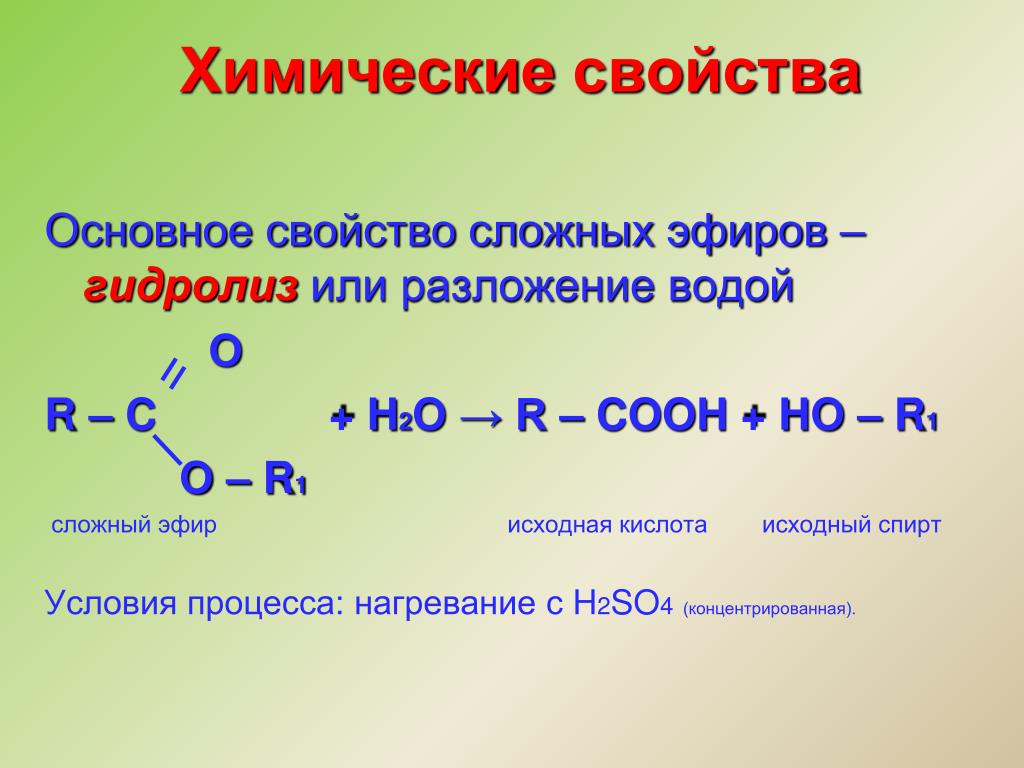
ХИМИЧЕСКИЕ СВОЙСТВА СЛОЖНЫХ ЭФИРОВ
№
Химические свойства
Реакция
Продукты реакции
Гидролиз
R-COOR’ + Н2О (в кислой среде) →
Кислота + спирт
Омыление
R-COOR’ + NaOH →
Соль + спирт
2 Аммонолиз
R-COOR’ + Nh4 →
Амид + спирт
3 Переэтерификация
R-COOR1 + R2OH → R-COOR2 + R1OH
1
R-COOR’ + R-МgHal →
Кетоны + RMgHal →
спирты третичные
R-COOR’ + Н2 →
Спирты
4 Взаимодействие с
реактивами Гриньяра
5 Восстановление
3
4. Ангидриды кислот R-CO-O-CO-R
Характерные реакции — SN
Высокая реакционная способность.
Ангидриды карбоновых кислот представляют собой бесцветные жидкости с едким
запахом.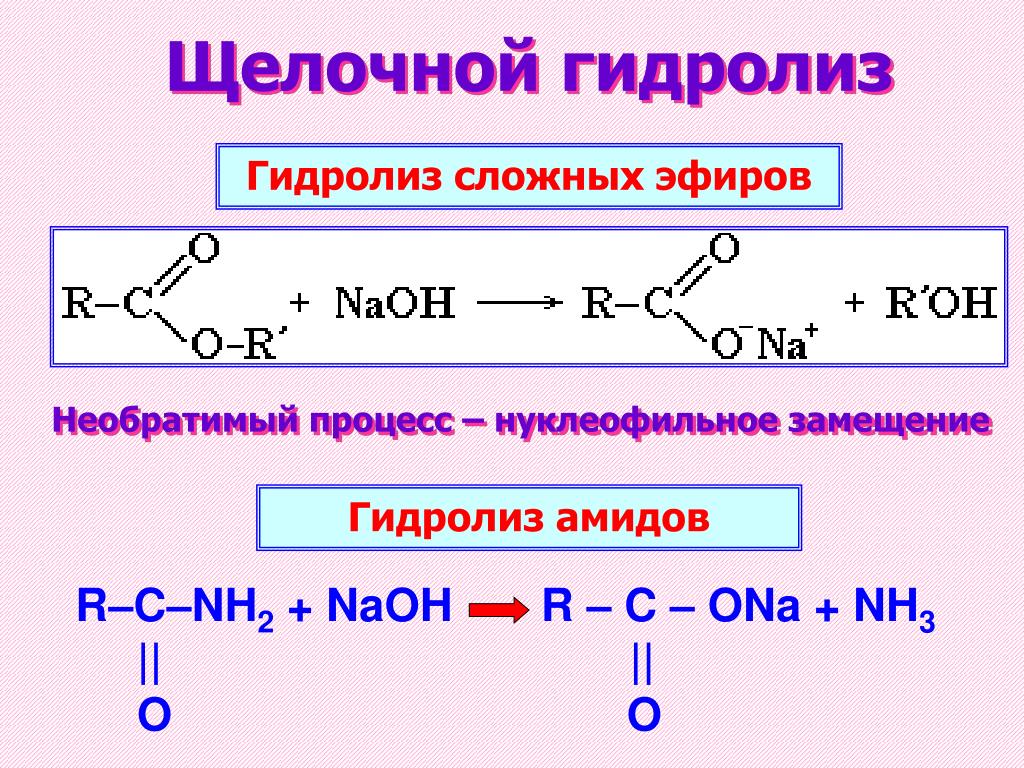
Ангидриды — ацилирующие агенты, применяются в производстве ацетил-целлюлозы,
винилацетата, красителей, лекарственных веществ, синтетических полимеров,
термостойких полиимидов, карбоксилатных каучуков, детергентов.
№ Химические свойства
Реакция
Продукты реакции
R-CO-O-CO-R →
Кислоты
2 Этерификация
R-CO-O-CO-R + ROH →
Сложный эфир +
кислота
3 Аммонолиз
R-CO-O-CO-R + Nh4 или
амины →
Амид + соль
аммония
1 Гидролиз
4
5. Галогенангидриды кислот R-CO-Hal
Характерные реакции SN
Высокая активность.
Не требуется катализ.
Галогенангидриды карбоновых кислот являются высокореакционноспособными
веществами и широко используются в органическом синтезе для введения ацильной
группы (реакция ацилирования).
Галогенангидриды — сильные электрофильные агенты. Их электрофильность
возрастает в ряду:
R-CO-F < R-CO-Cl < R-CO-Вr < R-CO-I
Практическое значение имеют хлорангидриды и в меньшей степенибромангидриды.
При взаимодействии галогенангидридов карбоновых кислот с нуклеофилами
образуются продукты ацилирования:
R-CO-Hal + НА → R-CO-A + HHal
Галогенангидриды карбоновых кислот легко вступают в реакции нуклеофильного
замещения, реакции идут без катализаторов.
Реакцией дигалогенангидридов дикарбоновых кислот с диаминами и
дигидроксисоединениями (гликолями, двухатомными фенолами) получают полиамиды
и сложные полиэфиры.
5
Химические свойства
галогенангидридов карбоновых кислот
№
Химические свойства
Реакция
Продукты реакции
1 Гидролиз
R-CO-Hal + h3O →
Кислоты
2 Этерификация
R-CO-Hal + ROH →
Сложные эфиры
3 Аммонолиз
R-CO-Hal + Nh4 или амины →
Амиды
4
Взаимодействие с
R-CO-Hal + R-МgHal →
реактивами Гриньяра
Альдегиды или
кетоны →
спирты
вторичные или
третичные 6
Производство полимерных материалов
n Ch4-O-CO-
-CO-O-Ch4 + n HO-Ch3-Ch3-OH → 2n Ch4-OH +
диметилтерефталат
этиленгликоль
+ -[-CO-
-CO-O-Ch3-Ch3-O-]nПЭ
полиэтилентерефталат (лавсан)
n Cl-CO-
-CO-Cl
+
n HO-Ch3-Ch3-OH → 2n HCl +
хлорангидрид терефталевой
этиленгликоль
кислоты
+ -[-CO-
-CO-O-Ch3-Ch3-O-]n-
полиэтилентерефталат (лавсан)
n Cl-CO-(Ch3)4-CO-Cl
хлорангидрид адипиновой
кислоты
ПЭ
+ n h3N-(Ch3)6-Nh3 → 2n HCl +
гексаметилендиамин
+ -[-CO-(Ch3)4-CO-NH-(Ch3)6-NH-]nполигексаметиленадипамид (найлон-6,6)
3n (СН3СО)2О
Целлюлоза
уксусный
ангидрид
ПА
3n СН3СООH
триацетилцеллюлоза
7
8.
 Амиды карбоновых кислот R-CO-Nh3, R-CO-NHR, R-CO-NR2
Амиды карбоновых кислот R-CO-Nh3, R-CO-NHR, R-CO-NR2
№
Характерные реакции SN
Химические свойства
Гидролиз в кислой
среде
1
Омыление
2 Восстановление
3 Дегидратация
Реакция
R-CO-Nh3+ НХ + h3O →
R-CO-Nh3 + NaOH →
R-CO-Nh3+ Н2 →
Продукты реакции
Кислота + Nh5X
RCOONa + Nh4
Амины + Н2О
Нитрилы
При действии горячей воды или водного пара амиды гидролизуются. Быстрее идёт гидролиз
сильными щелочами и водными растворами сильных кислот.
Амиды обладают очень слабо выраженными кислотными и основными свойствами. Реагируя со
щелочными металлами, они дают соли, легко разлагаемые водой.
8
Формамид — амид муравьиной кислоты Н-СО-Nh3.
Формамид используется в качестве сырья в производстве синильной кислоты
(дегидратация формамида) и муравьиной кислоты (гидролизом формамида).
N,N-Диметилформамид (ДМФА) Н-СО-N(Ch4)2
Применение: растворитель при производстве полиакрилонитрильного волокна
(нитрона), и других полимеров, для растворения масляных красок, красителей при
крашении кожи, бумаги, древесины, вискозы; для абсорбции HCl, SO2 и других
кислотных газов; для проведения спектроскопических исследований в ближней
инфракрасной области; в кислотно-основном титровании слабых кислот в неводных
средах (в качестве среды).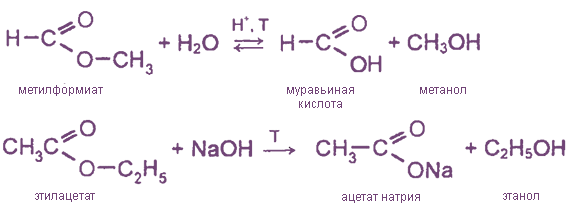
Мочевиина (карбамид) —диамид угольной кислоты Н2N-СО-NН2
Мочевина образует комплексы со многими соединениями, например с перекисью
водорода CO(Nh3)2-h3O2, используемое как удобная и безопасная форма «сухой»
перекиси водорода (гидроперит). Используется для депарафинизации нефти,
используется как азотное удобрение.
применяется для синтеза мочевино-формальдегидных смол, широко
использующихся в качестве
адгезивов в производстве
древесно-волокнистых
плит (ДВП) и мебельном
производстве.
9
10. Нитрилы карбоновых кислот R-C≡N
Нитрилы карбоновых
кислот R-C≡N
Характерные реакции — АN
0,1468 нм
0,116 нм
Нитрильная группа обладает отрицательными мезомерным и индукционным
эффектами. Нитрилы способны вступать в реакции как с электрофильными реагентами
по атому азота, так и с нуклеофильными реагентами по атому углерода.
Нитрилы являются жидкими или твёрдыми веществами, растворимыми в органических
растворителях.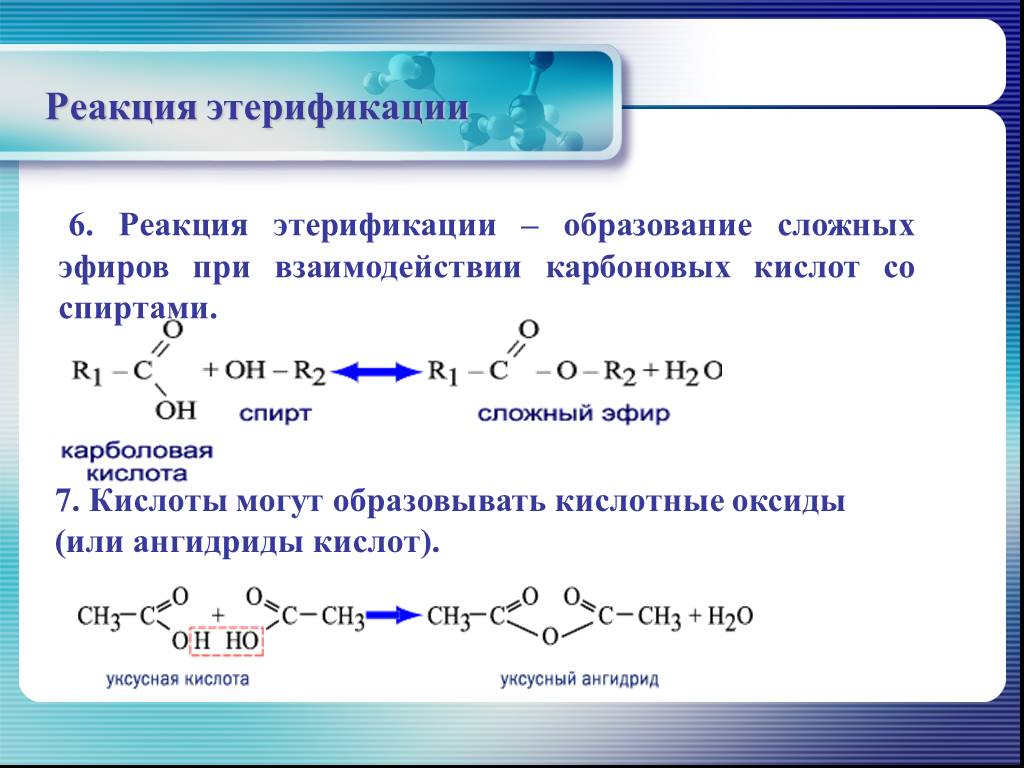 Низшие нитрилы хорошо растворяются в воде.
Низшие нитрилы хорошо растворяются в воде.
№ Химические свойства
Реакция
1 Щелочной гидролиз
R-C≡N + h3O →
Амид кислоты →
→ соль кислоты +Nh4
R-C≡N + Н2 →
Амины
R-C≡N+ R-МgHal →
Кетоны
2
Гидрирование:
Взаимодействие с
3 реактивами Гриньяра
Продукты реакции
10
Гидролиз нитрилов в кислой среде приводит сначала к амидам, потом — к
соответствующим карбоновым кислотам:
Неподелённая электронная пара на атоме азота способствует образованию
комплексов нитрилов с солями металлов, например, с CuCl, NiCl2, SbCl5.
Наличие нитрильной группы приводит к снижению энергии диссоциации связи C-H у
α-углеродного атома.
Связь C≡N способна присоединять другие атомы и группы.
Нитрилы используются в качестве растворителей, инициаторов радикальноцепной полимеризации, сырья для получения мономеров, лекарственных средств,
пестицидов, пластификаторов.
Наибольшее значение имеют:
-ацетонитрил Ch4-C≡N (растворитель, адсорбент при выделении бутадиена из смеси
с бутенами),
-акрилонитрил Ch3=CH-C≡N (мономер для получения волокна нитрон),
-адиподинитрил N≡C-(Ch3)4-C≡N (сырьё для синтеза адипиновой кислоты,
капролактама, гексаметилендиамина),
-бензонитрил C6H5-C≡N
(растворитель хлорированных каучуков, нитратов и ацетатов целлюлозы).
11
Сложные
эфиры
C2H5-CO-OCh4 + h3O →
(Ch4)2CH-CO-OCh4 + Nh3-C2H5 →
C2H5-CO-OCh4 + (Ch4)2CH-OH →
Ch4-CO-OC2H5 + C3H7MgBr →
(Ch4)2CH-CO-OCh4 + h3 →
Ангидриды
(Ch4CO)2O + h3O →
(Ch4CO)2O + C2H5OH →
(C2H5CO)2O + 2Nh4 →
Галогенангидриды
Ch4COCl + HOH →
Ch4-CH(Ch4)COBr + C2H5OH →
C3H7COBr + h3N-Ch4 →
Ch4-COCl + C2H5MgCl →
HCl
Амиды
Ch4CO-Nh3 + h3O →
Ch4CO-NH-Ch4 + NaOH →
C4H9CO-NH-C2H5 + 2h3 →
P2O5
C2H5CO-Nh3 →
NaOH
Нитрилы
(Ch4)2CH-CN + h3O → A
C2H5-CN + Ch4MgBr →
C2H5-CN + h3 →
→
12
English
Русский
Правила
Карбоксильные производные — восстановление (каталитическое восстановление)
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1222
- Уильям Ройш
- Университет штата Мичиган
Можно ожидать, что восстановление производных карбоновых кислот приведет либо к альдегидам, либо к спиртам, функциональные группы которых имеют более низкую степень окисления карбоксильного углерода. Действительно, сами карбоновые кислоты восстанавливаются до спиртов алюмогидридом лития. На этом этапе будет полезно рассмотреть три вида редукций:
Действительно, сами карбоновые кислоты восстанавливаются до спиртов алюмогидридом лития. На этом этапе будет полезно рассмотреть три вида редукций:
- каталитическое гидрирование
- комплексные металлогидридные восстановители
- диборановое восстановление.
Каталитическое гидрирование
Как правило, карбонильная группа не так легко присоединяет водород, как углерод-углеродные двойные и тройные связи. Таким образом, довольно легко восстановить алкеновую или алкиновую функцию, не затрагивая какие-либо карбонильные функции в той же молекуле. Используя платиновый катализатор и повышенную температуру и давление, можно восстановить альдегиды и кетоны до спиртов, но карбоновые кислоты, сложные эфиры и амиды сравнительно неактивны. С другой стороны, исключительная реакционная способность ацилгалогенидов облегчает их восстановление в мягких условиях с использованием отравленного палладиевого катализатора, аналогичного тому, который используется для частичного восстановления алкинов до алкенов.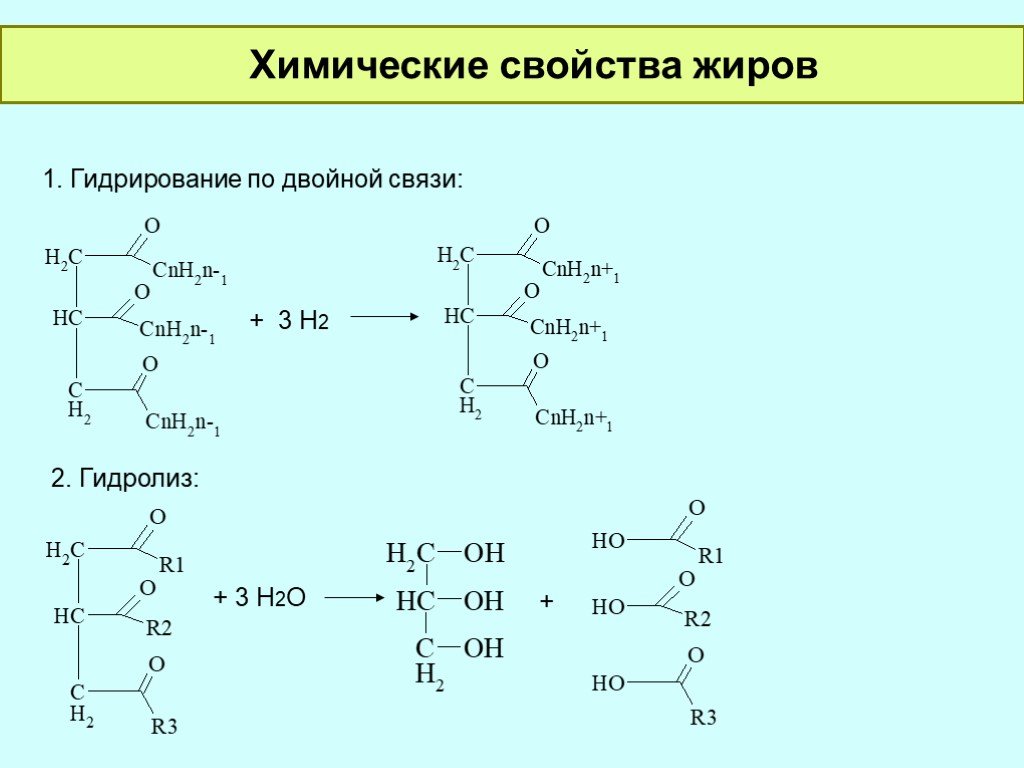 Это восстановление останавливается на стадии альдегида, что дает нам полезную двухстадийную процедуру превращения карбоновых кислот в альдегиды, как демонстрирует реакция № 1 ниже. Об эквивалентном восстановлении ангидридов не сообщалось, но можно предположить, что они восстанавливаются легче, чем сложные эфиры. Единственным другим широко используемым восстановлением производных карбоновых кислот является восстановление нитрилов до 1º-аминов. Примеры этих сокращений представлены на следующей диаграмме.
Это восстановление останавливается на стадии альдегида, что дает нам полезную двухстадийную процедуру превращения карбоновых кислот в альдегиды, как демонстрирует реакция № 1 ниже. Об эквивалентном восстановлении ангидридов не сообщалось, но можно предположить, что они восстанавливаются легче, чем сложные эфиры. Единственным другим широко используемым восстановлением производных карбоновых кислот является восстановление нитрилов до 1º-аминов. Примеры этих сокращений представлены на следующей диаграмме.
Второе и третье уравнения иллюстрируют крайнюю разницу в реакционной способности гидрирования сложных эфиров и нитрилов. Это дополнительно демонстрируется последней реакцией, в которой нитрил предпочтительно восстанавливается в присутствии карбонильной группы и двух бензольных колец. Образовавшийся 1º-амин немедленно вступает в реакцию с карбонильной группой с образованием циклического продукта енамина (окрашенного в голубой цвет).
В большинстве случаев восстановления нитрила аммиак добавляется для подавления образования побочного продукта 2º-амина. Это может происходить за счет промежуточного альдегидимина, полученного добавлением первого эквивалента водорода. Следующие уравнения показывают, как такие виды имина могут реагировать с продуктом 1º-амина с образованием замещенного имина (2-е уравнение), который затем добавляет водород с образованием 2º-амина. Избыток аммиака сдвигает иминное равновесие влево, как написано ниже.
Это может происходить за счет промежуточного альдегидимина, полученного добавлением первого эквивалента водорода. Следующие уравнения показывают, как такие виды имина могут реагировать с продуктом 1º-амина с образованием замещенного имина (2-е уравнение), который затем добавляет водород с образованием 2º-амина. Избыток аммиака сдвигает иминное равновесие влево, как написано ниже.
| (1) | R–C≡N + H 2 | катализатор | RCH=NH имин | Н 2 | RCH 2 NH 2 1º-амин |
|---|
| (2) | RCH=NH + RCH 2 NH 2 Имин 1º-амин | RCH=NCH 2 R + NH 3 замещенный имин | H 2 и катализатор | RCH 2 NHCH 2 R 2º-амин |
|---|
Авторы
Уильям Ройш, почетный профессор (штат Мичиган, Университет штата Мичиган), Виртуальный учебник органической химии
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Уильям Ройш
- Показать страницу TOC
- № на стр.

- Метки
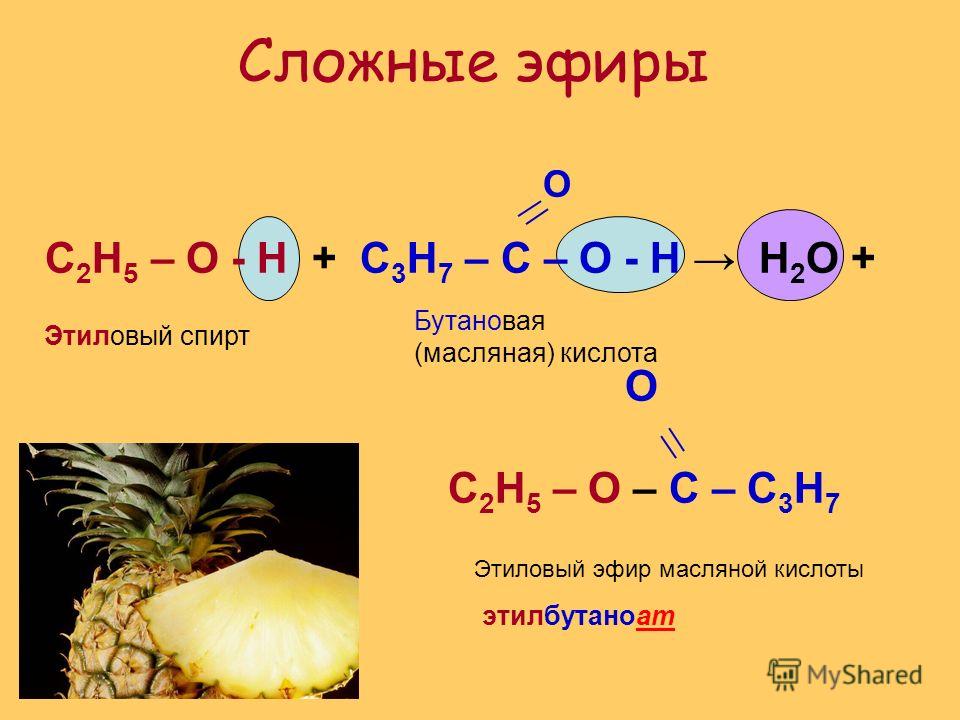
ЭТЕРИФИКАЦИЯ На этой странице рассматривается этерификация — в основном реакция между спиртами и карбоновыми кислотами с образованием сложных эфиров. В нем также кратко рассматривается получение сложных эфиров в результате реакций между ацилхлоридами (хлорангидридами) и спиртами, а также между ангидридами кислот и спиртами. Что такое сложные эфиры? Сложные эфиры получают из карбоновых кислот. Карбоновая кислота содержит группу -COOH, а в сложном эфире водород в этой группе заменен какой-либо углеводородной группой. Мы просто рассмотрим случаи, когда она заменена алкильной группой, но с тем же успехом это может быть и арильная группа (основанная на бензольном кольце). Сложный эфир этиловый Наиболее часто обсуждаемым сложным эфиром является этилэтанолат. В этом случае водород в группе -COOH заменен этильной группой. Формула этилового спирта: Обратите внимание, что название сложного эфира противоположно тому, как написана формула. Бит «этаноат» происходит от этановой кислоты. Бит «этил» происходит от этильной группы на конце. | |
Примечание: По моему опыту, студенты, начинающие изучать органическую химию, больше путаются при написании названий и формул для сложных эфиров, чем почти для всего остального, особенно когда речь идет о менее часто встречающихся сложных эфирах, таких как те, которые будут описаны ниже. Потратьте время и заботьтесь, чтобы убедиться, что вы понимаете! | |
Еще несколько сложных эфиров В каждом случае убедитесь, что вы видите, как имена и формулы соотносятся друг с другом. Обратите внимание, что название кислоты определяется путем подсчета общего числа атомов углерода в цепи — , включая атом в группе -COOH . Так, например, CH 3 CH 2 COOH — пропановая кислота, а CH 3 CH 2 COO — пропаноатная группа. | |
Примечание: Дополнительную информацию о присвоении названий кислотам и сложным эфирам можно получить, перейдя по этой ссылке в другую часть этого сайта. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |
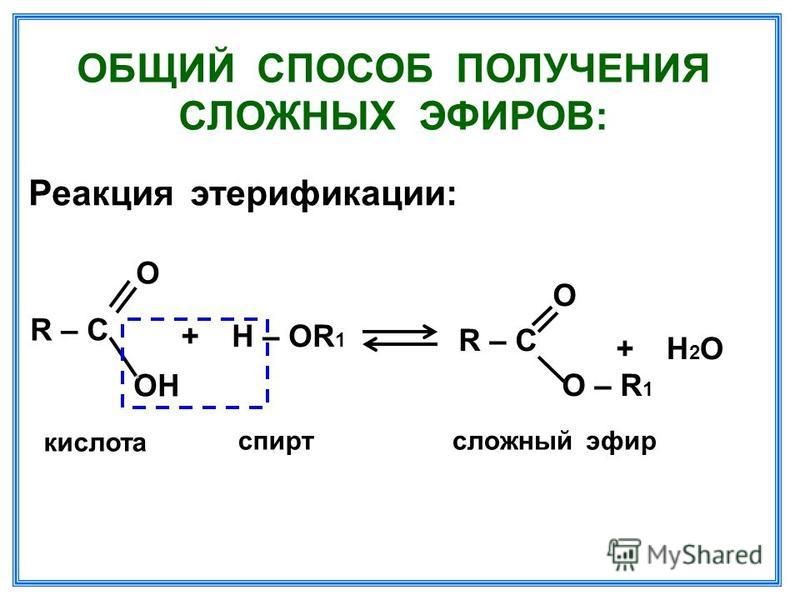
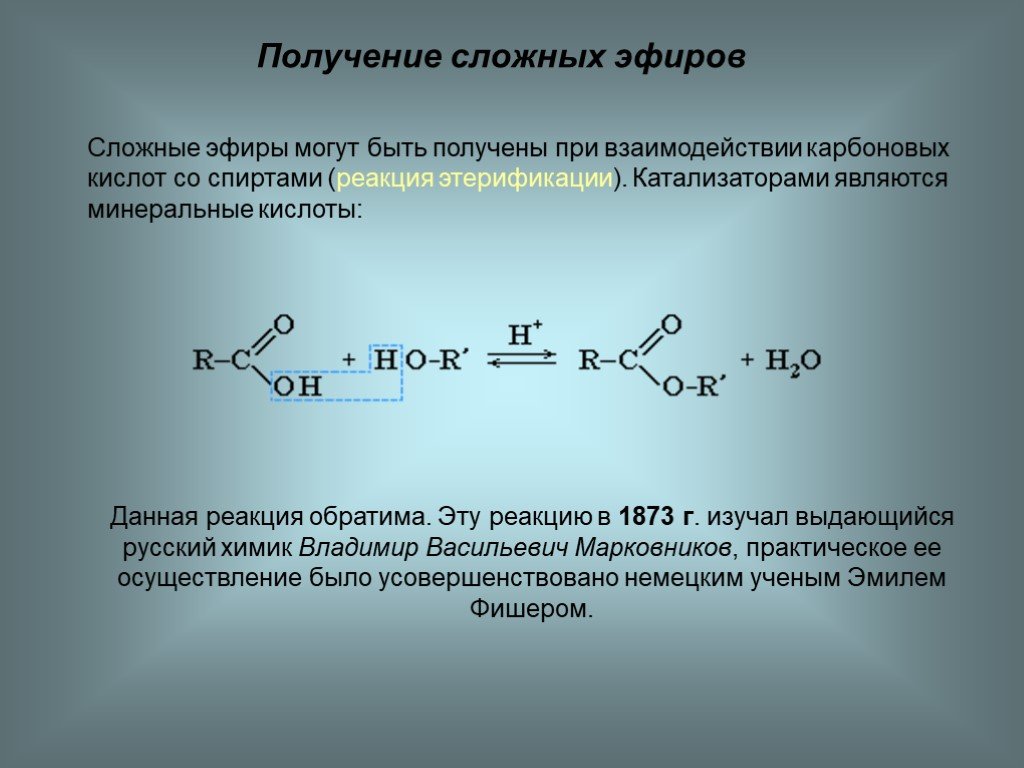
Получение сложных эфиров из карбоновых кислот и спиртов Химия реакции Сложные эфиры получают при нагревании карбоновых кислот со спиртами в присутствии кислотного катализатора. Катализатором обычно является концентрированная серная кислота. В некоторых случаях используется сухой газообразный хлористый водород, но они, как правило, включают ароматические сложные эфиры (содержащие бензольное кольцо). Реакция этерификации является одновременно медленной и обратимой. Уравнение реакции между кислотой RCOOH и спиртом R’OH (где R и R’ могут быть одинаковыми или разными): Так, например, если бы вы производили этилэтанолат из этановой кислоты и этанола, уравнение было бы таким: | |
Примечание: Механизм реакции этерификации описан в разделе о катализе на этом сайте. Это не требуется для какой-либо учебной программы по химии в Великобритании уровня A (или эквивалентной). Если вы перейдете по этой ссылке, используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |
Выполнение реакций На весах для пробирок Карбоновые кислоты и спирты часто нагревают вместе в присутствии нескольких капель концентрированной серной кислоты, чтобы наблюдать запах образующихся эфиров. Обычно вы используете небольшое количество всего, что нагрето в пробирке, выдержанной в ванне с горячей водой в течение нескольких минут. Поскольку реакции медленные и обратимые, за это время не образуется много эфира. Запах часто маскируется или искажается запахом карбоновой кислоты. Простой способ обнаружить запах эфира — вылить смесь в небольшое количество воды в небольшой химический стакан. Сложные эфиры, за исключением очень мелких, довольно нерастворимы в воде и имеют тенденцию образовывать тонкий слой на поверхности. Избыток кислоты и спирта растворяются и надежно прячутся под слоем сложного эфира. Небольшие сложные эфиры, такие как этилэтанолат, пахнут как типичные органические растворители (этилэтанолат является обычным растворителем, например, в клеях). По мере того, как сложные эфиры становятся крупнее, запахи становятся ближе к искусственным фруктовым ароматизаторам, например, к «грушевым леденцам». В более крупном масштабе Если вы хотите получить достаточно большой образец сложного эфира, используемый метод в некоторой степени зависит от размера сложного эфира. Чтобы получить небольшой эфир, такой как этилэтанолат, вы можете осторожно нагреть смесь этановой кислоты и этанола в присутствии концентрированной серной кислоты и отогнать эфир, как только он образуется. Это предотвращает возникновение обратной реакции. Это работает хорошо, потому что сложный эфир имеет самую низкую температуру кипения из всех присутствующих. Сложный эфир — единственное вещество в смеси, которое не образует водородных связей, поэтому у него самые слабые межмолекулярные силы. | |
Примечание: Перейдите по этой ссылке, если вы не уверены в водородных связях. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |
Большие сложные эфиры имеют тенденцию образовываться медленнее. В этих случаях может оказаться необходимым нагревание реакционной смеси с обратным холодильником в течение некоторого времени для получения равновесной смеси. | |
Примечание: Предоставление полной информации об органических препаратах (включая все шаги, необходимые для очистки продукта) выходит за рамки этого сайта. Если вам нужны такие детали, вам следует обратиться к органической практической книге. | |
Прочие способы получения сложных эфиров Сложные эфиры также могут быть получены в результате реакций между спиртами и либо ацилхлоридами, либо ангидридами кислот. Получение сложных эфиров из спиртов и ацилхлоридов (хлорангидридов) Если вы добавите ацилхлорид к спирту, вы получите бурную (даже бурную) реакцию при комнатной температуре с образованием сложного эфира и облаком парообразных кислых паров хлороводорода. Например, если вы добавите жидкий этанолилхлорид в этанол, вы получите взрыв хлороводорода, произведенного вместе с жидким эфиром этилэтаноата. | |
Примечание: Если вы хотите узнать больше об ацилхлоридах, изучите меню ацилхлоридов, перейдя по этой ссылке. Используйте кнопку НАЗАД (или меню GO, или файл HISTORY) в браузере, чтобы вернуться на эту страницу. | |
Получение сложных эфиров из спиртов и ангидридов кислот Реакции ангидридов кислот протекают медленнее, чем соответствующие реакции с ацилхлоридами, и обычно требуется подогрев смеси. Принятие реакции этанола с этановым ангидридом в качестве типичной реакции с участием спирта: Происходит медленная реакция при комнатной температуре (или быстрее при нагревании). В бесцветных жидкостях видимых изменений нет, но образуется смесь этилового спирта и этановой кислоты. | |
Примечание: Если вы хотите узнать больше об ангидридах кислот, изучите меню ангидридов кислот, перейдя по этой ссылке. Begin typing your search term above and press enter to search. Press ESC to cancel. Back To Top
| |


 Если вы студент уровня A в Великобритании, вам не придется об этом беспокоиться.
Если вы студент уровня A в Великобритании, вам не придется об этом беспокоиться.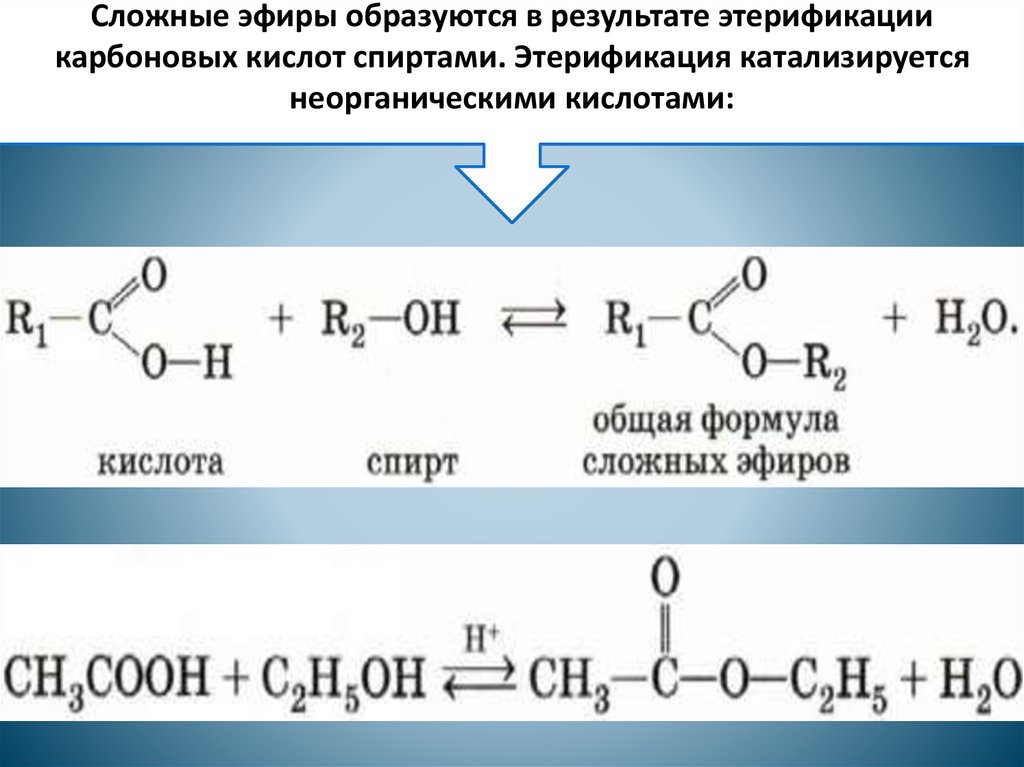
 Маленькие сложные эфиры образуются быстрее, чем большие.
Маленькие сложные эфиры образуются быстрее, чем большие.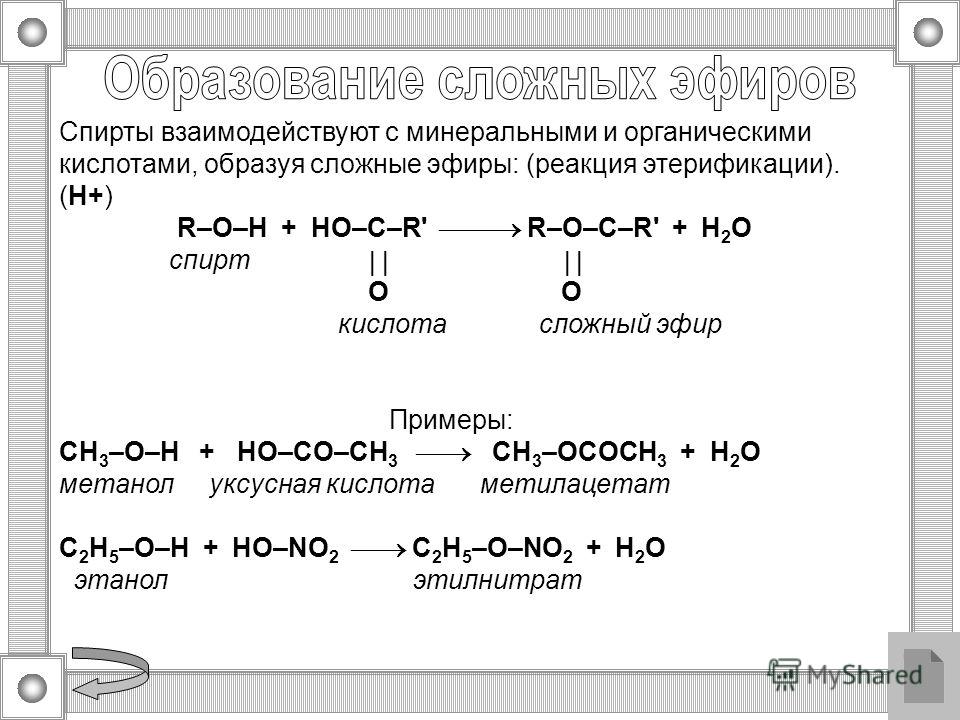 Сложный эфир можно отделить от карбоновой кислоты, спирта, воды и серной кислоты в смеси фракционной перегонкой.
Сложный эфир можно отделить от карбоновой кислоты, спирта, воды и серной кислоты в смеси фракционной перегонкой.