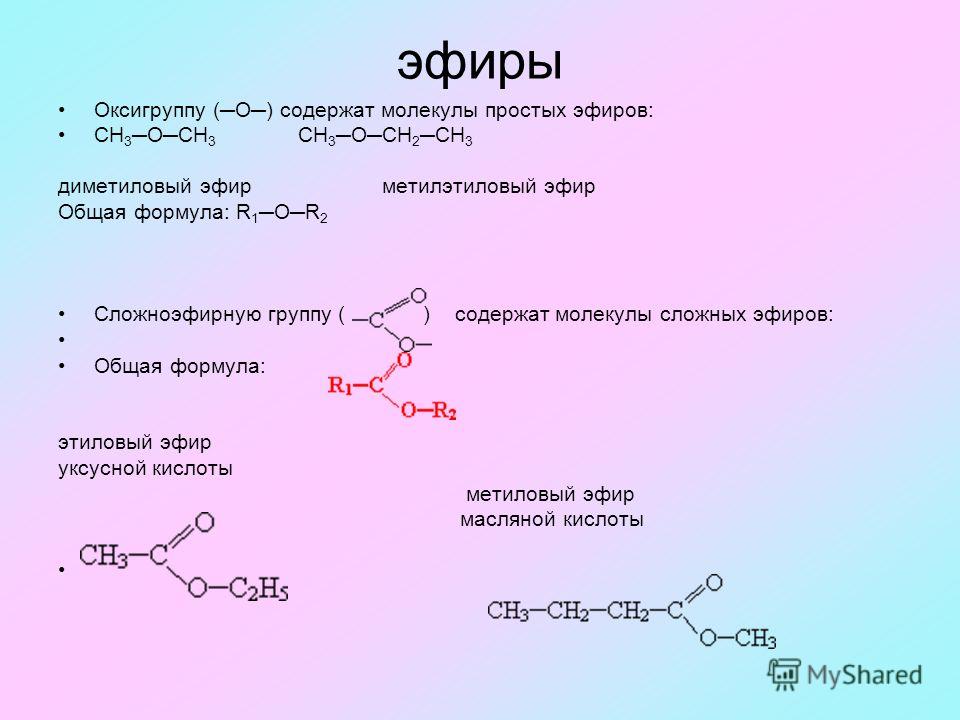
Содержание
Тема 11. Сложные эфиры
ПЛАН
11.1.
Номенклатура
и изомерия.
11.2. Физические
свойства сложных эфиров.
11.3.
Химические свойства сложных эфиров.
11.1. Номенклатура и изомерия
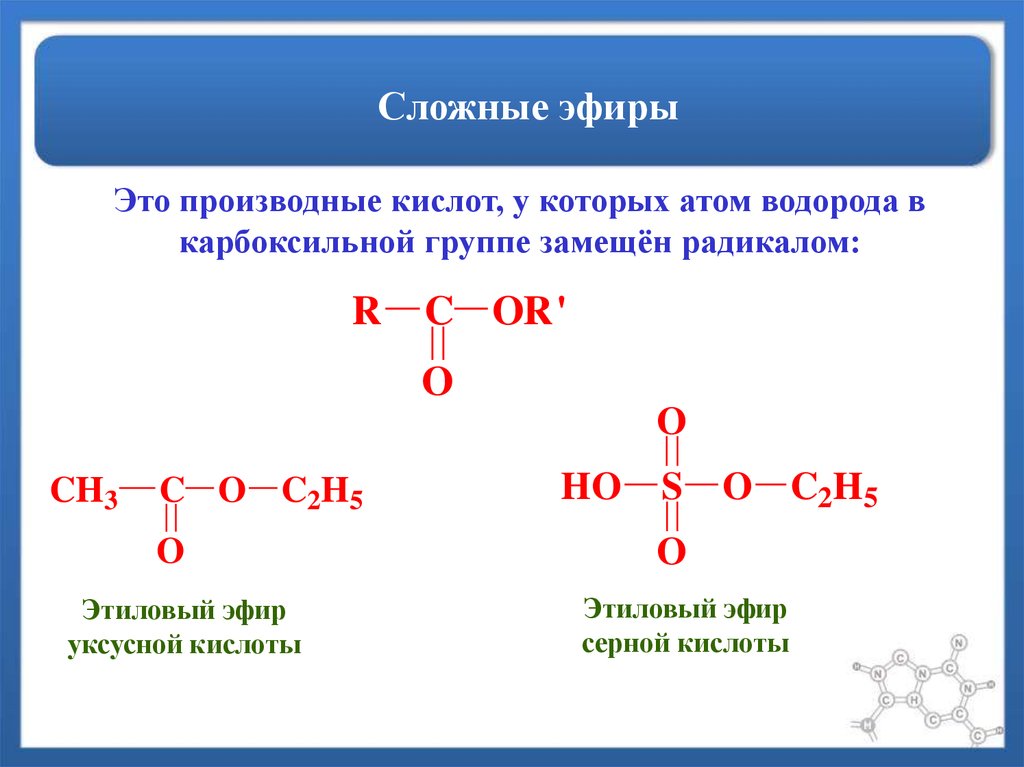
Среди
функциональных производных кислот
особое место занимают сложные
эфиры – производные кислот, у которых
атом водорода в карбоксильной группе
заменен углеводородным радикалом.
Общая формула
сложных эфиров:
где
R и R’– углеводородные радикалы (в сложных
эфиpax муравьиной кислоты R – атом
водорода).
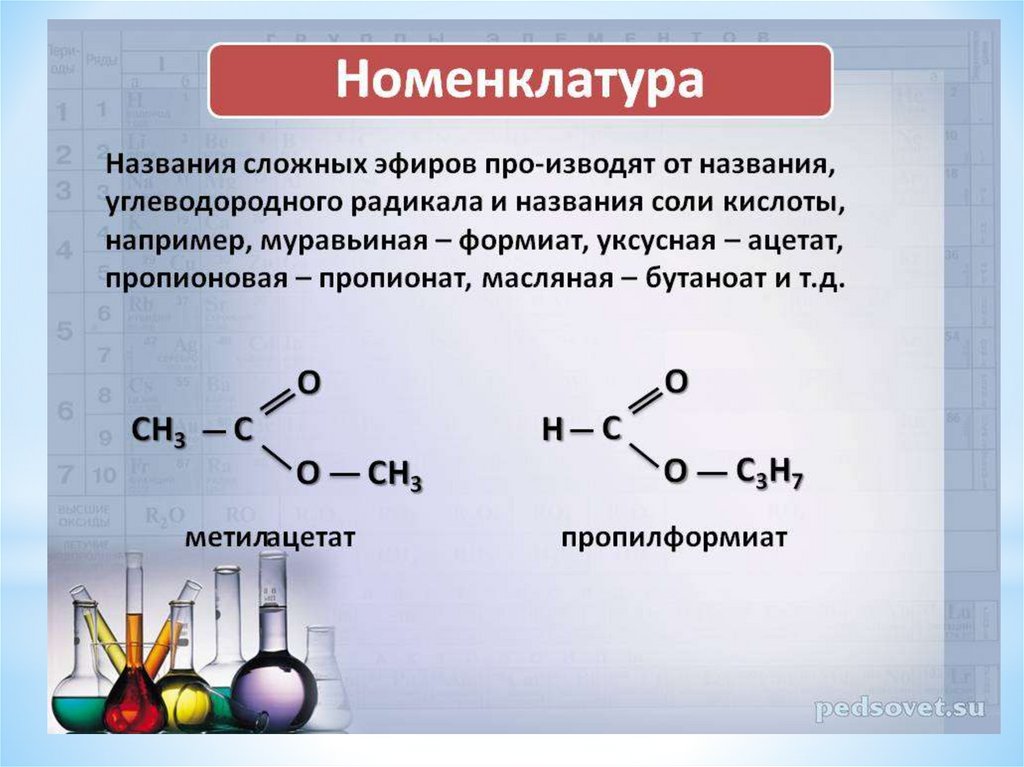
Названия
сложных эфиров производят от названия
углеводородного радикала и названия
кислоты, в котором вместо окончания
–овая используют суффикс –aт, например:
Для
сложных эфиров характерны три вида
изомерии:
1.
Изомерия углеродной цепи начинается
по кислотному остатку с бутановой
кислоты, по спиртовому остатку – с
пропилового спирта, например, этилбутирату
изомерны этилизобутират, пропилацетат
и изопропилацетат.
2.
Изомерия положения сложноэфирной
группировки –СО–О–. Этот вид изомерии
начинается со сложных эфиров, в молекулах
которых содержится не менее 4 атомов
углерода, например этилацетат и
метилпропионат.
3. Межклассовая
изомерия, например, метилацетату изомерна
пропановая кислота.
Для сложных эфиров,
содержащих непредельную кислоту или
непредельный спирт, возможны еще два
вида изомерии: изомерия положения
кратной связи и цис-, транс-изомерия.
11.2. Физические свойства сложных эфиров
Сложные
эфиры низших карбоновых кислот и спиртов
представляют собой летучие, нерастворимые
в воде жидкости. Многие из них имеют
приятный запах. Так, например, бутилбутират
имеет запах ананаса, изоамилацетат –
груши и т. д.
Сложные
эфиры высших жирных кислот и спиртов –
воскообразные вещества, не имеют запаха,
в воде не растворимы.
11.3. Химические свойства сложных эфиров
1.
Реакция гидролиза, или омыления. Так,
как реакция этерификации является
обратимой, поэтому в присутствии кислот
протекает обратная реакция гидролиза:
Реакция гидролиза
катализируется и щелочами; в этом случае
гидролиз необратим, так как получающаяся
кислота со щелочью образует соль:
2. Реакция
присоединения. Сложные эфиры, имеющие
в своем составе непредельную кислоту
или спирт, способны к реакциям
присоединения.
3.
Реакция восстановления. Восстановление
сложных эфиров водородом приводит к
образованию двух спиртов:
4. Реакция образования
амидов. Под действием аммиака сложные
эфиры превращаются в амиды кислот и
спирты:
Тема 12. Жиры
ПЛАН
12.1.
Номенклатура
и изомерия.
12.2. Физические
свойства.
12.3.
Химические свойства.
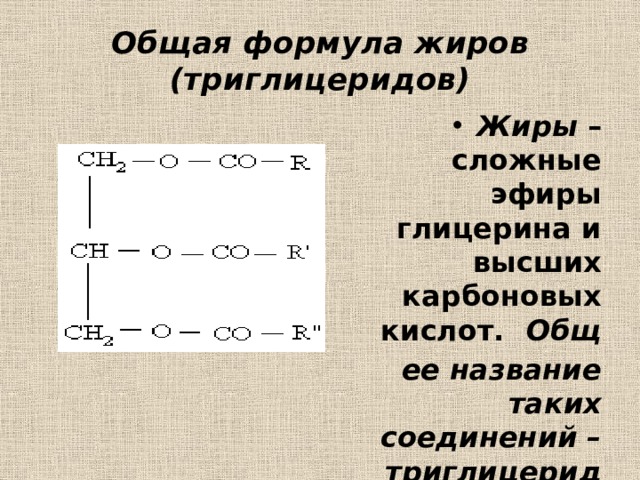
12.1. Номенклатура и изомерия
Жиры
– образованы трехатомным спиртом
глицерином и высшими жирными кислотами.
Жиры входят в
состав растительных и животных организмов
и служат одним из источников энергии
живых организмов, которая выделяется
при окислении жиров.
Общая формула
жиров:
где
R’, R», R»‘ – углеродные радикалы.
Жиры
бывают “простыми” и “смешанными”. В
состав простых жиров входят остатки
одинаковых кислот (т. е. R’ = R» = R'»),
в состав смешанных – различных.
В жирах наиболее
часто встречаются следующие жирные
кислоты:
Алкановые кислоты
1.
Масляная кислотата СН3
– (CH2)2
– СООН
2.
Капроновая кислотата СН3
– (CH2)4
– СООН
3.
Пальмитиновая кислотата СН3
– (CH2)14
– СООН
4.
Стеариновая кислотата СН3
– (CH2)16
– СООН
Алкеновые кислоты
5.
Олеиновая кислотата С17Н33СООН
СН3–
(СН2)7–СН
= СН– (СН2)7–СООН
Алкадиеновые
кислоты
6.
Линолевая кислотата С17Н31СООН
СН3–
(СН2)4–СН
= СН–СН2–СН
= СН–СООН
Алкатриеновые
кислоты
7.
Линоленовая кислотата С17Н29СООН
СН3–СН2–СН
= CH–CH2–CH
== CH-CH2–CH
= СН–(СН2)4–СООН
Презентация по химии на тему «Сложные эфиры» (10 класс)
Презентация по химии на тему «Сложные эфиры» (10 класс)
| Предмет: | Химия |
|---|---|
| Категория материала: | Презентации |
| Автор: | Кривоносова Ирина Павловна это Вы? |
Урок изучения нового материала (10 класс) с элементами исследования.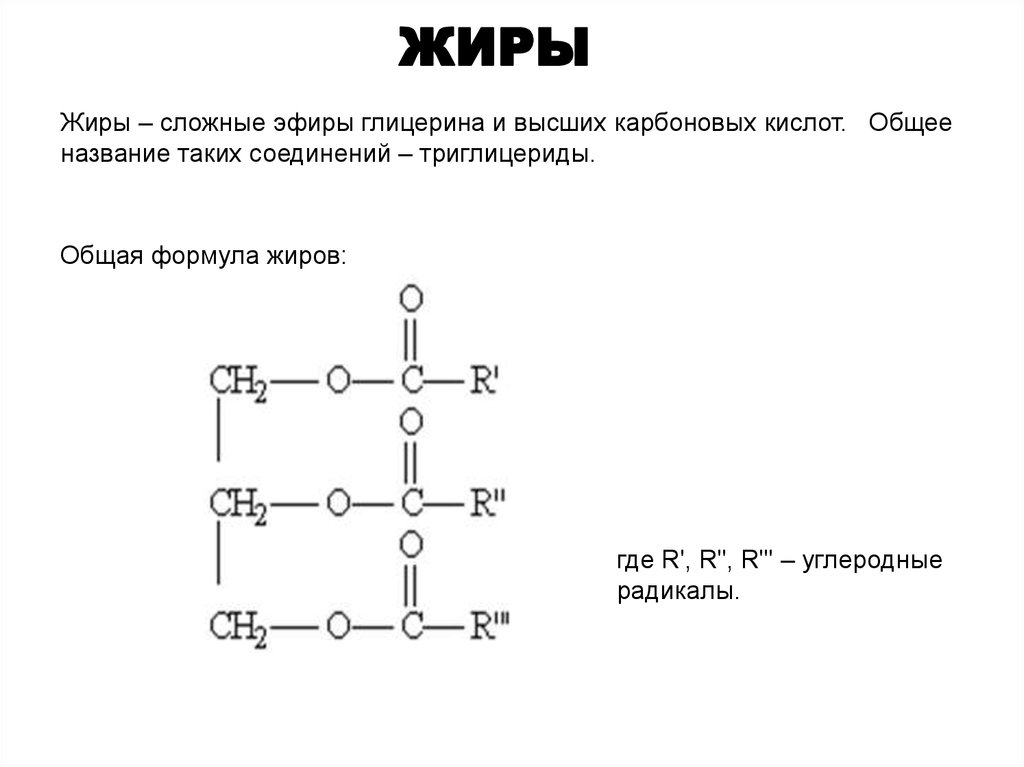 На нем использованы методы беседы, практического исследования, приемы сравнения и анализа. Урок сопровождается презентацией.
На нем использованы методы беседы, практического исследования, приемы сравнения и анализа. Урок сопровождается презентацией.
Цели урока: рассмотреть строение и виды изомерии сложных эфиров. Познакомить учащихся с номенклатурой этого класса соединений. Изучить особенности реакций этерификации и гидролиза сложных эфиров. Рассказать о распространённости сложных эфиров в природе. Развивать умения анализировать, исследовать, формировать аналитическое мышление, воспитывать внимательность, аккуратность.
Слайд 1Тема урока: Сложные эфиры Девиз урока: « Может тот, кто думает, что может ». Учитель химии МКОУ Кривоносовская СОШ Кривоносова Ирина Павловна
Слайд 2Органические вещества, которые образуются в реакциях карбоновых кислот со спиртами Общая формула O R – C – O – R 1 Сложные эфиры
Слайд 3- Назовите формулу сложного эфира, который был получен при взаимодействии уксусной кислоты и этилового спирта? Этиловый эфир уксусной кислоты — Откуда в смеси появилась уксусная кислота? При взаимодействии ацетата натрия и серной кислоты
Слайд 4Номенклатура Названия сложным эфирам д ают по названию кислот и спиртов, из которых они образованы.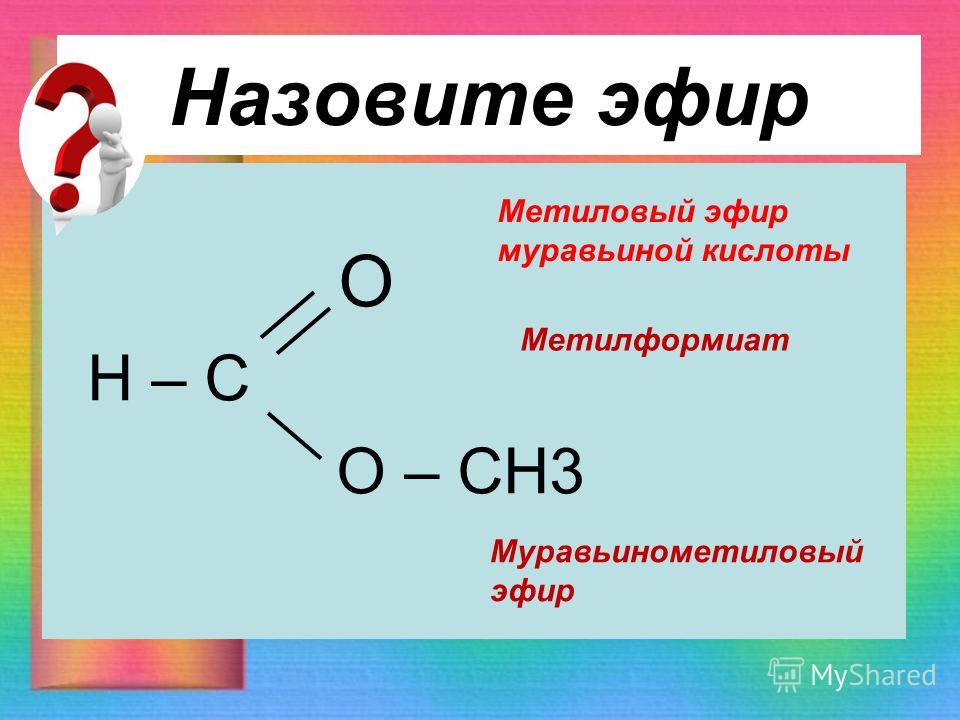 Часто названия соединений данного класса с оставляют из названий углеводородных радикалов, образующих спирт и названий кислотных остатков.
Часто названия соединений данного класса с оставляют из названий углеводородных радикалов, образующих спирт и названий кислотных остатков.
Слайд 5Изомерия сложных эфиров Общая формула сложных эфиров С n H 2n O 2 Такая же формула у предельных одноосновных карбоновых кислот, значит есть межклассовая изомерия Изомерия сложных эфиров связана с изомерией УВ радикалов кислот и спиртов, входящих в состав эфиров — изомерия углеродного скелета
Слайд 6Задание: Составьте структурные формулы изомерных соединений состава С 3 H 6 O 2, дайте названия изомерам, укажите вид изомерии
Слайд 7Реакции взаимодействия кислот и спиртов, при которых образуется сложный эфир и вода, называются реакцией этерификации ,от лат « этер »,что в переводе означает «эфир». CH 3 -C + HO-C 2 H 5 CH 3 -C + H 2 O O OH O O-C 2 H 5 у ксусная кислота этанол э тиловый эфир уксусной кислоты (этилацетат) Н + Особенности реакции этерификации: 1.Обратима 2.Протекает в присутствии ионов Н + 3.От кислоты отщепляется группа ОН —
Слайд 8Долгое время ученые предполагали, что при взаимодействии кислот со спиртами водород должен отщепляться от молекулы кислоты, а гидроксильная группа – от молекулы спирта. Однако при помощи изотопа кислорода с атомной массой 18 ученым удалось установить, что гидроксильная группа отщепляется от молекулы карбоновой кислоты.
Однако при помощи изотопа кислорода с атомной массой 18 ученым удалось установить, что гидроксильная группа отщепляется от молекулы карбоновой кислоты.
Слайд 9Гидролиз сложных эфиров Кислотный гидролиз O H + O R 1 -C + H 2 O R 1 — C + HO — R 2 R OH Щелочной гидролиз O Н 2 О O R 1 — C + NaOH R 1 — C + HO — R 2 О – R 2 ONa
Слайд 10Сложные эфиры широко распространены в природе. Они содержатся во фруктах, ягодах, цветах, обуславливая их запахи.
Слайд 11Сложные эфиры входят в состав эфирных масел растений, придавая им цветочный или фруктовый аромат. Важнейшими представителями сложных эфиров являются жиры. Сложные эфиры высших карболовых кислот и высших спиртов называют восками.
Слайд 12Свойства сложных эфиров Физические свойства : бесцветные жидкости, нерастворимые в воде и обладающие невысокими температурами кипения. Многие эфиры имеют приятный запах и являются хорошими растворителями органических веществ. В воде растворимы только сложные эфиры с небольшой относительной молекулярной массой.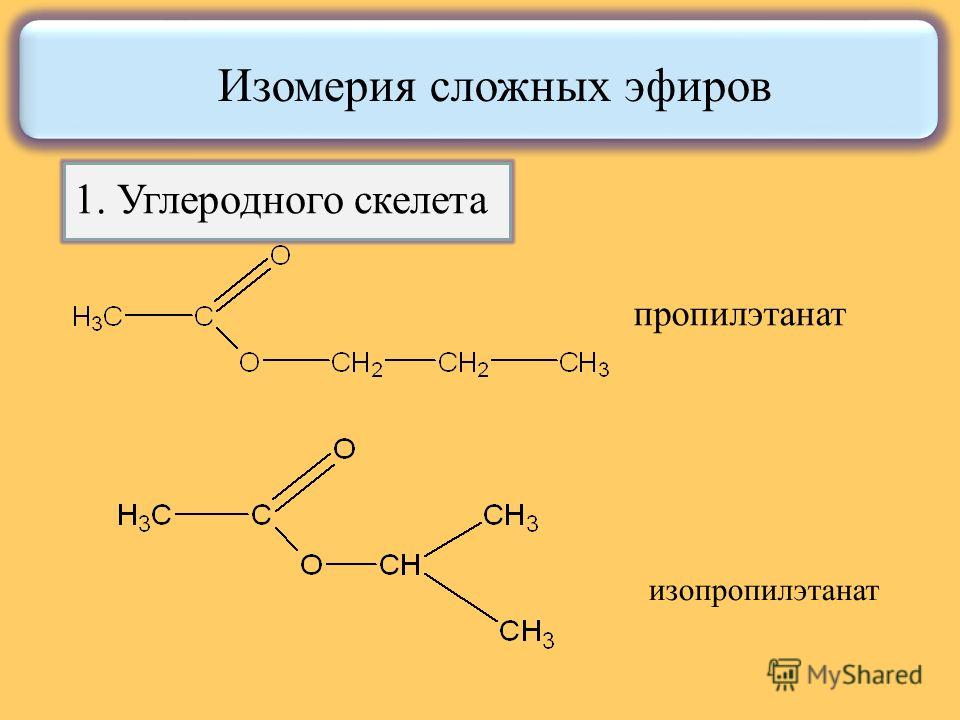 Химические свойства: гидролиз сложных эфиров.
Химические свойства: гидролиз сложных эфиров.
Слайд 13Применение В пищевой промышленности В парфюмерной промышленности В медицине В производстве моющих средств Используют как растворители Получают искусственные волокна В производство лакокрасочных материалов В производстве пластмасс, резины, искусственной кожи В производстве взрывчатых веществ
Слайд 14Назовите сложные эфиры: и зобутиловый эфир уксусной к-ты и зоамиловый эфир уксусной к-ты э тиловый эфир масляной к-ты СН 3 м етиловый эфир масляной к-ты
Слайд 15Вопросы Какие вещества называют сложными эфирами? Составьте 3 уравнения реакций их образования. Какой вид изомерии характерен для сложных эфиров? Напишите формулы 2-3 изомеров и их названия. Приведите уравнения реакций получения этилформиата, пентилацетата, метилакрилата .
Слайд 16Знаете ли вы, что …при взаимодействии изоамилового спирта и уксусной кислоты появляется запах груш, фенилэтилового спирта и муравьиной кислоты – хризантем, бензилового спирта и муравьиной кислоты – жасмина.
| Тип материала: | Презентация Power Point (pptx) |
|---|---|
| Размер: | 391.98 Kb |
| Количество скачиваний: | 32 |
Скачать
Просмотров: 84
Если Вы являетесь автором этой работы и хотите отредактировать, либо удалить ее с сайта — свяжитесь, пожалуйста, с нами.
- Вольф Мессинг… Кто он?
- Презентация на тему по химии » Қорытындылау, жүйелеу » (8 класс)
- Презентация на тему: «Проектная деятельность учащихся на уроках химии.»
- Презентация по химии на тему «Металлы для Победы» (10 класс)
- Презентация на тему: «Озеро-большое Яровое»
- Презентация по химии на тему: «Цифровая лаборатория «Архимед»»
- Презентация внеклассного мероприятия «Мой стиль»
- Презентация по химии — тестирование на тему «Основания» (8 класс)
- Презентация по химии: «Кислородные соединения углерода»
- Презентация по химии «Естественные красители»
Объяснение урока: Свойства сложных эфиров
В этом объяснении мы научимся определять и называть сложные эфиры и описывать их.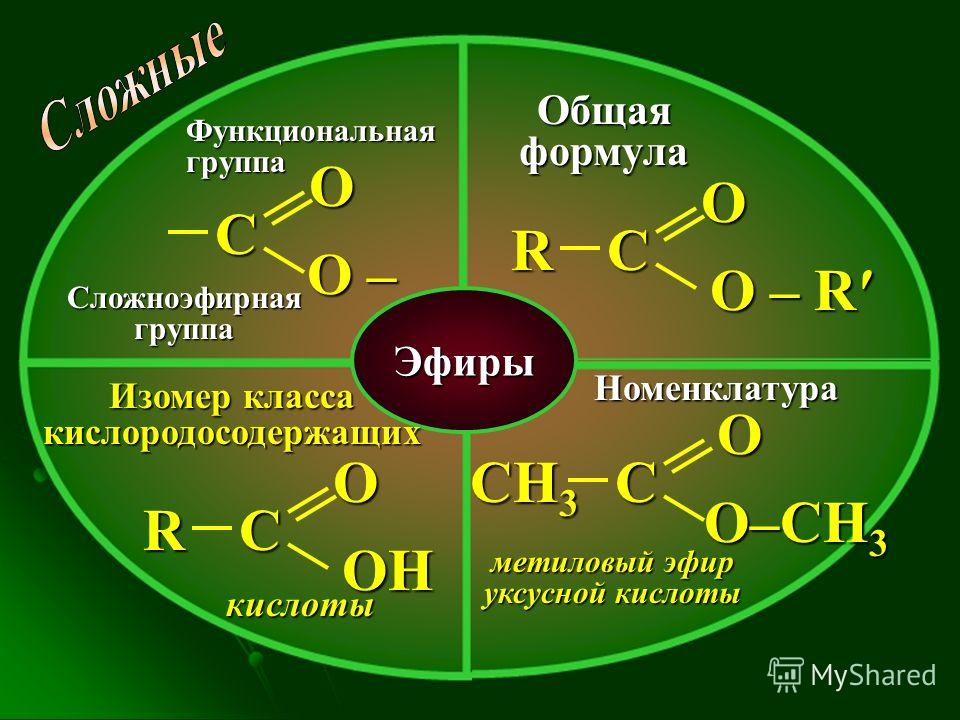
их физические свойства.
Сложные эфиры представляют собой органические соединения с общей химической формулой
RCOOR’ и общая отображаемая формула как
показано ниже. Примером сложного эфира может быть метилметаноат, который имеет
формула CHCOOCh43.
Функциональная группа (COO) может относиться к
как эфирная ссылка.
Определение: сложный эфир
Молекулы сложного эфира представляют собой органические соединения, представленные общей формулой
RCOOR’ и образуются по реакции
между спиртами и карбоновыми кислотами.
При нагревании спирта с карбоновой кислотой образуются сложный эфир и вода. Этот
называется реакцией этерификации, в ней участвует алкоксидная группа
спирт, замещающий гидроксильную группу карбоновой кислоты.
В приведенном ниже уравнении алкоксидная группа представлена
OR’ и гидроксильную группу в
карбоновая кислота представляет собой ОН. Эта реакция
вызывает образование связи СО в
сложный эфир, а также ОН
в воде:
Реакция образует равновесие, которое устанавливается медленно, если только сильное
кислотный катализатор, такой как концентрированная HSO24,
используется.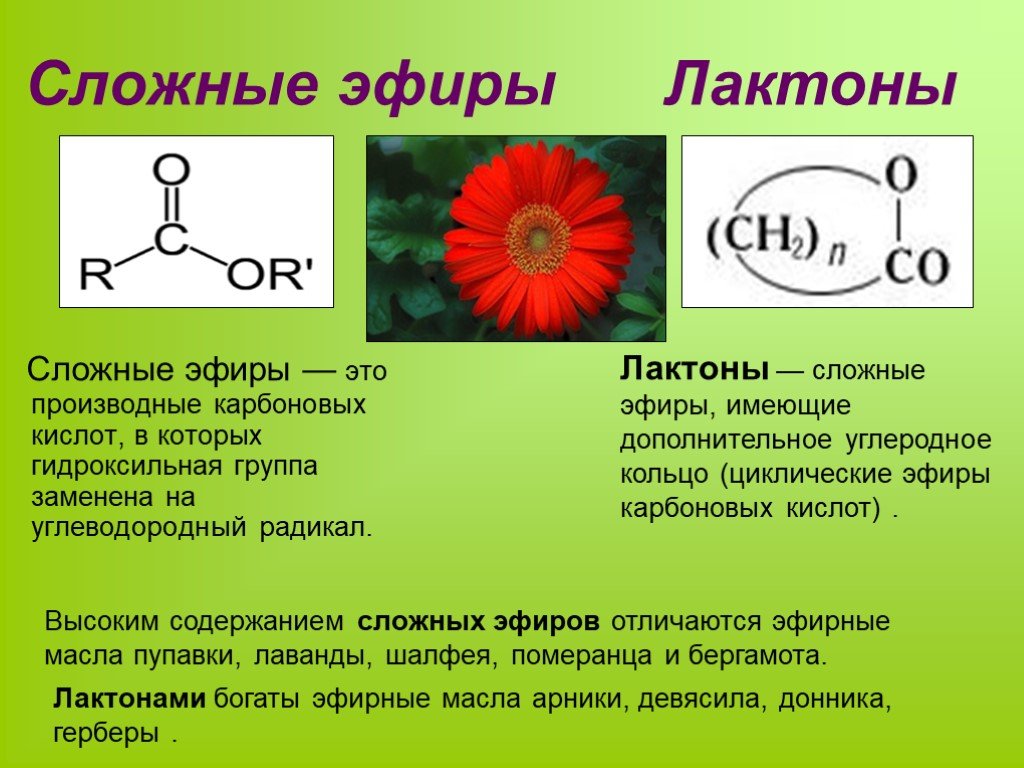 Это не единственная реакция, используемая для образования сложных эфиров, но наиболее
Это не единственная реакция, используемая для образования сложных эфиров, но наиболее
обычно используется. Это называется этерификацией Фишера, и пример этого
реакция показана ниже. Реакция показывает сочетание этановой кислоты и
этанол с кислотным катализатором для производства этилэтаноата и воды:
Этановая кислота также известна как уксусная кислота, а этилэтаноат также
обычно называют этилацетатом.
Поскольку вода получается из комбинации двух молекул, этерификация может
охарактеризовать как реакцию конденсации.
Определение: реакция конденсации (реакция дегидратации)
Конденсация или дегидратация – это реакция, которая объединяет молекулы в химическом
связи и приводит к образованию молекулы воды.
Следует отметить, что хотя функциональная группа спирта и карбоновой кислоты
группы обычно находятся на отдельных молекулах, реакция циклизации может протекать, если
функциональные группы находятся в одной молекуле. Это наиболее вероятно, когда углерод
Это наиболее вероятно, когда углерод
цепь между спиртовой и карбоновой группами состоит из четырех или пяти атомов углерода.
длинная. В результате реакции образуются циклический эфир, лактон и вода.
Пример 1: Прогнозирование результата внутримолекулярной этерификации
5-Гидроксипентановая кислота
Возможно для молекулы, содержащей спирт и карбоновую кислоту
группа вступает в реакцию сама с собой с образованием циклических сложных эфиров, известных как лактоны. Который
структура образуется в результате реакции 5-гидроксипентановой кислоты с
сам?
Ч3ОНЧ3Ч3Ч3СООН
А.
Ч3ЧЧ3ОЧ3Ч3СОНО
Б.
OCH3CH3CH3CHOH
C.
CH3CHCH3OHCH3CH3
D.
CH3CCH3OCH3CH3
E.
CCH3OOCH3CH4
ОТВЕТ
В этом вопросе, ASTERITICATICATICATICATICTITION; Однако,
спирт и карбоновая кислота, участвующие в реакции, происходят из одного и того же
молекула.
Алкоксидная группа спирта
(УКПЧ)a2 заменяет
гидроксильную группу (ОН) карбоновой кислоты. Таким образом, образуется связь между Ce и
О рядом с
CHa2 и сложноэфирная связь
(COO) был создан. Реакция
схема этой реакции такова:
Пятиуглеродная цепь 5-гидроксипентановой кислоты является линейной с
функциональные группы на обоих концах цепи. Таким образом, шестичленный
вырабатывается лактон — шесть «членов» включают пять
атомы углерода и атом кислорода из функциональной группы спирта.
Очевидно, что продукт D.
Концентрированная серная кислота используется в качестве катализатора реакции, но она
также используется в качестве дегидратирующего агента для удаления воды и повышения выхода сложного эфира. После образования сложного эфира его необходимо извлечь из реакции.
смесь, которая будет содержать непрореагировавший спирт, карбоновую кислоту и серную
кислота.
Названия сложных эфиров состоят из двух частей, которые соответствуют спирту и
карбоновая кислота или исходные молекулы, используемые для их изготовления. Чтобы узнать, какой
молекулы были использованы для образования эфира, его
Связь CO должна быть разделена. Фрагмент
содержащий CO является карбоновым
кислотная сторона.
Присоединение гидроксигруппы вместо алкоксигруппы даст
исходная карбоновая кислота. Алкоксильный фрагмент
(ИЛИ)’ — спиртовая сторона. Добавление
от Н до О
отдаст родителю алкоголь.
На приведенной ниже диаграмме показано, как найти исходную карбоновую кислоту и спирт для
общий эфир.
На приведенной ниже диаграмме показано, как найти исходную карбоновую кислоту и спирт для
например эфир.
Очевидно, что соединения, используемые для получения сложного эфира, представляли собой этановую кислоту, которая
также широко известен как уксусная кислота и метанол.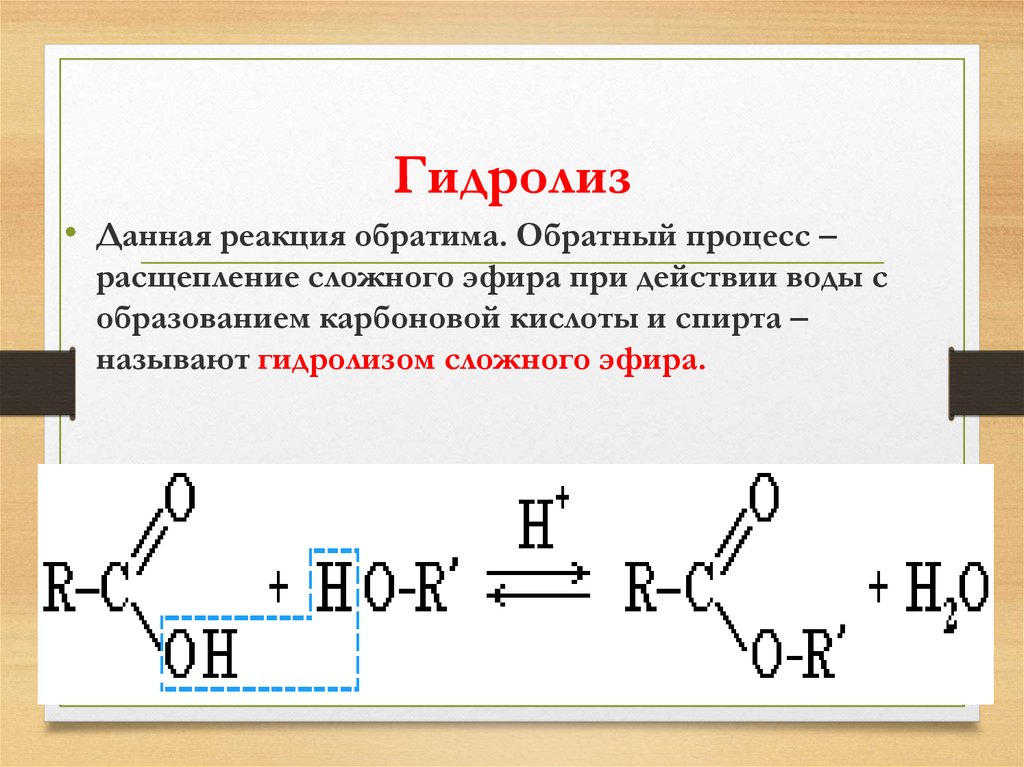 Имя родителя
Имя родителя
молекулы могут быть использованы для названия сложного эфира. Первая часть названия эфира идет
от названия алкоголя и включает изменение последней части названия на
-ил. Вторая часть происходит от названия карбоновой кислоты и включает
изменение последней части имени на -oate. Следуя показанному примеру
выше, «метанол» становится «метилом», и
«этановая кислота» становится «этаноатом». Следовательно,
эфир имеет название «метилэтаноат». Так как этановая кислота также
называемый уксусной кислотой, сложный эфир может также называться метилацетатом. Обратите внимание, что в этом случае добавляется суффикс -ate, а не -oate.
Та же схема именования используется для других спиртов при именовании сложных эфиров, например,
«этанол» станет «этилом», а
«пропанол» станет «пропилом». Если фенол используется для
сделать сложный эфир, тогда название сложного эфира будет включать «фенил».
Ситуация аналогична карбоновым кислотам, так же как и
«этановая кислота» становится «этаноатом» при названии сложных эфиров,
«метановая кислота», «пропановая кислота»,
а «бутановая кислота» станет «метаноатом»,
«пропаноат» и «бутаноат».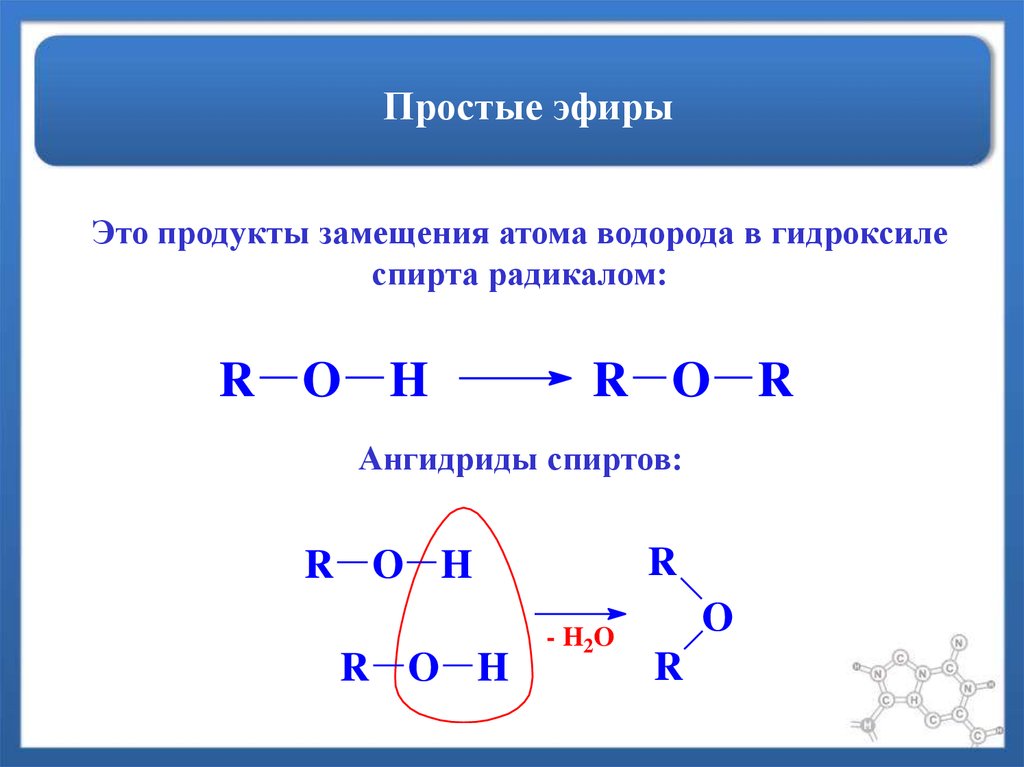 Следует также отметить
Следует также отметить
что так же, как «этановая кислота» также называется «уксусной
кислота» и, следовательно, «этаноат» также может быть
«ацетат», «метановая кислота» обычно
называется «муравьиная кислота»; таким образом, «метаноат» также может
называться «форматом». Например, метиловый эфир
метаноат может также называться метилформиатом.
Если бензойная кислота используется для получения эфира, то название эфира будет
включают «бензоат».
Пример 2: Название сложного эфира по его структурной формуле
Какое из следующих названий имеет показанный сложный эфир?
COCH3CH3CH4O
- этилбензоат
- фенилгензоат
- Пропилгензоат
- фенил пропаноат
- Бензилметаноат
Ответ
. Название эстейтов — это, которые соответствуют им. Двухни, которые соответствуют их частям, которые соответствуют их частям, которые соответствуют им названиям. И Наиботы, которые соответствуют их частям, которые соответствуют им названиям. И Наиботы.
И Наиботы.
спирт и карбоновая кислота, используемые для их изготовления. Молекула должна быть расщеплена
на связи CO, чтобы разделить молекулу
на карбоновую и спиртовую части. Фрагмент, содержащий
CO — сторона карбоновой кислоты. Присоединение гидроксильной группы к тому месту, где раньше была алкоксигруппа, даст
исходная карбоновая кислота. Фрагмент пропокси представляет собой спиртовую сторону. Добавление
от Н до О
отдаст родителю алкоголь.
Первая часть названия происходит от спирта и предполагает изменение
последняя часть имени на -ил. Спирт, используемый для получения эфира, — пропанол,
так как он содержит три атома углерода; таким образом, «пропил» является первым
часть названия эфира.
Вторая часть происходит от названия карбоновой кислоты и включает
изменение последней части имени на -oate. Карбоновая кислота, используемая для получения
эфир представлял собой бензойную кислоту; таким образом, «бензоат» является второй частью
имени эфира.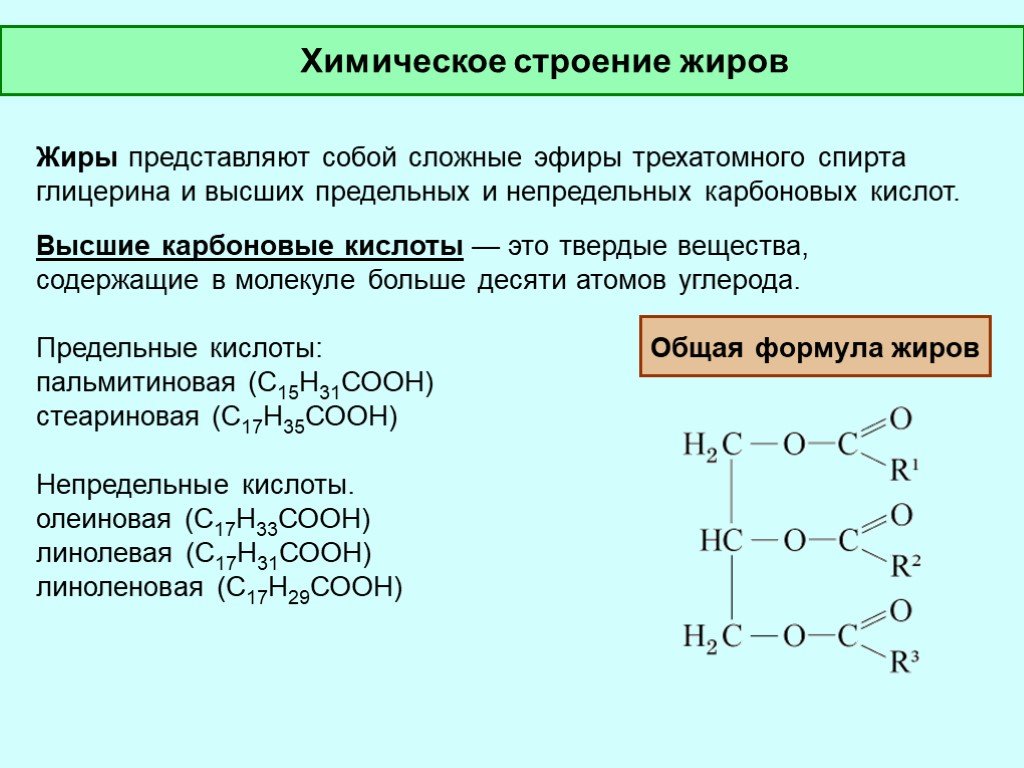
Таким образом, ответ на этот вопрос C, пропилбензоат.
Следует отметить, что имя пишется наоборот
написана сокращенная структурная формула. Общая формула сложного эфира
RCOOR’, где первая часть
(RCO) происходит от исходной карбоновой кислоты и
вторая часть (ИЛИ)’ исходит от родителя
алкоголь. Обратное верно при названии сложного эфира. Первая часть
название эфира происходит от родительского спирта, а вторая часть происходит от
исходная карбоновая кислота.
Пример 3: Название сложного эфира по его сокращенной формуле
Какое название по номенклатуре ИЮПАК носит сложный эфир
CHCHCOOCHCh4223 есть?
- Пропилэтаноат
- Этилэтанолат
- Этоксипропанокси
- Пропилпропаноат
- Этилпропаноат
карбоновая кислота, используемая для их изготовления.
Связь CO должна быть разделена, чтобы разделить
молекула на две части.
 Левая часть формулы
Левая часть формулы
(т. е. CHCHCO32) происходит от карбоксильной
кислота, а правый участок (ОССН)23
происходит от алкоголя.
Первая часть названия происходит от спирта и предполагает изменение
последняя часть имени на -ил. В спиртовой части два атома углерода.
(ОНН)СС23; таким образом, этанол был использован, чтобы сделать
эфир, а «этил» — первая часть
имя эфира.
Вторая часть происходит от названия карбоновой кислоты и включает
изменение последней части имени на -oate. Распространенная ошибка при наименовании
сложных эфиров из конденсированных формул забывает считать атом углерода в
сложноэфирная функциональная группа (CHCHO)32C. В карбоновой кислоте три атома углерода.
(ННО)ССС32; таким образом,
использовалась пропановая кислота
для получения эфира, а «пропаноат» — вторая часть
имя эфира.
Таким образом, очевидно, что ответ Е, этилпропаноат.
Вам нужно будет не только назвать сложный эфир по его сокращенной формуле,
но также вы должны быть в состоянии предсказать продукт этерификации
реакция.
Пример 4. Прогнозирование основного продукта реакции этанола и бутановой кислоты
Рассмотрим следующую реакцию:
Этанолбутановая кислотаHO++2
Какой сложный эфир получается в результате этой реакции?
- Этилбутаноат
- Этилпропаноат
- Пропилбутаноат
- Метилбутаноат
- Бутилэтаноат
Ответ
Названия сложных эфиров состоят из двух частей, соответствующих спирту и
карбоновая кислота, используемая для их изготовления.
Первая часть названия происходит от названия алкоголя и предполагает изменение
последняя часть имени на -ил. Нам говорят, что используемый спирт — это этанол;
таким образом, первая часть названия — «этил».
Вторая часть происходит от названия карбоновой кислоты и включает
изменение последней части имени на -oate. Нам говорят, что карбоновая
Нам говорят, что карбоновая
используемая кислота представляет собой бутановую кислоту; таким образом, вторая часть имени
«бутаноат».
Следовательно, ответ на этот вопрос: А, этилбутаноат.
Большинство эфиров с короткой цепью — это жидкости со сладким запахом, и они становятся менее ароматными
и более восковые, когда их
моляр
масса увеличена. Сложные эфиры, как правило, имеют более низкую температуру кипения, чем спирты.
карбоновые кислоты аналогичные
моляр
масса, так как водородные связи не могут образовываться между молекулами сложного эфира. Это потому что
спирты и карбоновые кислоты содержат гидроксильные группы, а сложные эфиры — нет.
В следующей таблице показаны два набора из трех видов с разной температурой кипения.
баллы, несмотря на то, что они имеют одинаковые
моляр
масса. Разница в их температурах кипения обусловлена их разным содержанием водорода.
связующие способности.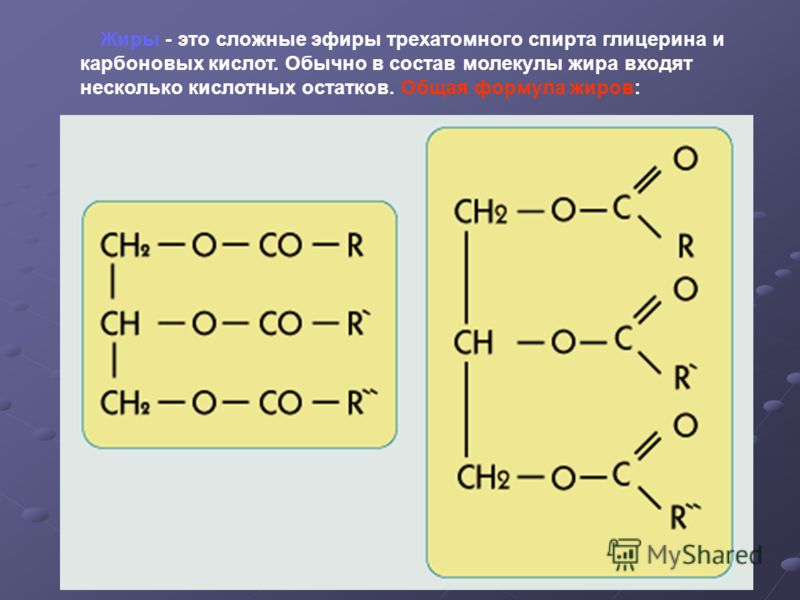 Водородные связи не могут образовываться между молекулами сложного эфира, но могут
Водородные связи не могут образовываться между молекулами сложного эфира, но могут
образуются между молекулами спирта и карбоновой кислоты. Вот почему метилметаноат
имеет более низкую температуру кипения, чем пропанол и этановая кислота, а также метилэтаноат
имеет более низкую температуру кипения, чем бутанол и пропановая кислота.
| Тип вещества | Название вещества | Краткая структурная формула | Молярная масса (г/моль) | Температура кипения (∘C) |
|---|---|---|---|---|
| Carboxylic acid | Ethanoic acid (acetic acid) | CHCOOh4 | 60 | 118 |
| Propanoic acid | CHCHCOOh42 | 74 | 141 | |
| Alcohol | Пропанол | CH(CH)Oh422 | 60 | 97 |
| Butanol | CH(CH)Oh423 | 74 | 118 | |
| Ester | Methyl methanoate (methyl formate) | HCOOCh4 | 60 | 32 |
| метилатаноат (метилацетат) | CHCOUCH43 | 74 | 57 |
9
9
9
.
ниже.
Отсутствие водородных связей в сложных эфирах также является причиной их высокой
волатильность.
Определение: Летучее вещество
Летучее вещество – это вещество, которое легко испаряется при нормальных температурах.
и давление.
Однако сложные эфиры могут образовывать водородные связи с молекулами воды, как показано ниже;
таким образом, мельчайшие сложные эфиры до некоторой степени растворимы в воде.
Однако растворимость уменьшается с увеличением длины цепи, и большинство
сложные эфиры считаются нерастворимыми. Углеродные цепи неполярны и
гидрофобный; таким образом, если молекула сложного эфира имеет длинную углеродную цепь, только небольшая
часть молекулы сможет образовать водородную связь с водой,
делая его нерастворимым.
Жиры и масла представляют собой сложные эфиры с длинной цепью, поэтому они нерастворимы в
вода.
Пример 5. Прогнозирование самой длинной цепи неизвестных сложных эфиров по их
Растворимость
В таблице ниже показана растворимость пяти неизвестных сложных эфиров.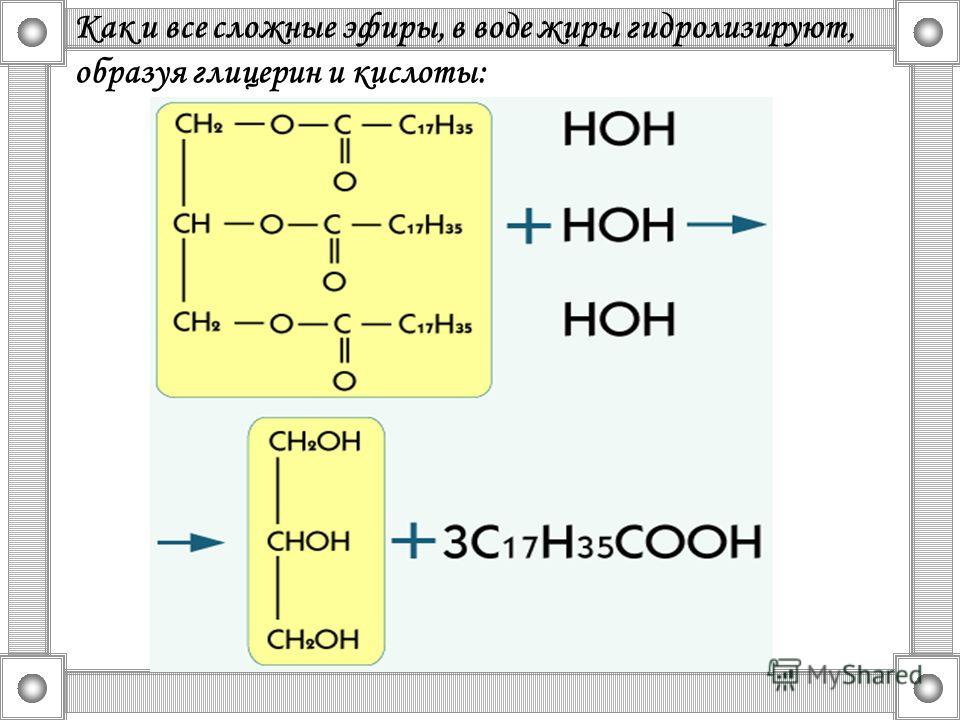 Какой из неизвестных сложных эфиров, вероятно, будет иметь самую длинную цепь
Какой из неизвестных сложных эфиров, вероятно, будет иметь самую длинную цепь
длина? Предположим, что цепи линейны и разветвлений нет.
| Эфир | А | B | C | D | E |
|---|---|---|---|---|---|
| Растворимость (г/100 мл) | 8.7 | 0.6 | 10.5 | 2.2 | 4.9 |
- A
- D
- C
- B
- E
Answer
The solubility of esters decreases with increasing chain length as в
углеродная цепь неполярна и гидрофобна, поэтому сложный эфир с самой длинной
длина цепи будет иметь наименьшую растворимость. 0,6 г/100 мл
самое низкое значение; таким образом, сложный эфир B, вероятно, будет иметь самую длинную цепь
длина.
Следовательно, ответ D, сложный эфир B.
Сложные эфиры с низкой
моляр
массы обычно сладко пахнут, но как их
моляр
масса увеличивается, они становятся без запаха. Они отвечают за запах
Они отвечают за запах
и вкус многих цветов и фруктов, а также можно найти в феромонах. Они есть
используются в качестве ароматизаторов для пищевых продуктов и напитков, а также в производстве парфюмерии. Они также широко используются в качестве промышленных растворителей. В таблице ниже показаны
различное использование для выбора сложных эфиров.
| Ester | Smell/Flavor | Application |
|---|---|---|
| Propyl ethanoate (propyl acetate) | Pear | Flavoring agent |
| Methyl butanoate (methyl butyrate) | Pineapple | Flavoring agent |
| Бутилэтаноат (бутилацетат) | Яблоко | Ароматизатор, растворитель лака для ногтей |
| Этилэтаноат (ethyl acetate) | Sweet | Solvent for the process of removing caffeine from coffee beans |
| Propyl methanoate (propyl formate) | Apple, plum | Flavoring agent |
| 2-Methylpropyl methanoate (изобутилформиат) | Вишня | Ароматизатор, отдушка |
| Бензилметаноат (бензилформиат) | Миндаль, абрикос | Flavoring agent, fragrance |
| Pentyl ethanoate (pentyl acetate) | Bananas, apples | Flavoring agent, paint solvent |
| Methyl ethanoate (methyl acetate) | Sweet, glue-like | Растворитель для клеев, красок, и жидкостей для снятия лака |
Кроме того, растительные и животные масла и жиры в основном состоят из
природные триэфиры, называемые триглицеридами. Триэфиры представляют собой молекулы, содержащие
Триэфиры представляют собой молекулы, содержащие
три сложноэфирные группы, а триглицериды представляют собой сложные эфиры жирных кислот и глицерина. Показана реакция этерификации, в результате которой образуются триглицериды (масла и жиры).
ниже:
Углеродная цепь жирных кислот обычно состоит из 4–24 атомов углерода.
атомов, часто является линейным с четным числом атомов углерода и может быть
насыщенный или ненасыщенный. Эти жиры и масла можно использовать для производства
биодизель.
Определение: жирная кислота
Жирная кислота представляет собой монокарбоновую кислоту с длинной алифатической цепью,
либо насыщенный, либо ненасыщенный.
Сложные полиэфиры используются в качестве пластмасс и волокон, например полиэстер
поли(этилентерефталат) используется для изготовления волокон одежды и пластиковых изделий.
например бутылки с водой. Он также находит применение в медицинской промышленности, где он
используется в швах, которые представляют собой нити, используемые в швах, и сосудистых трансплантатах,
которые используются для замены поврежденных кровеносных сосудов.
Его образование показано на следующей схеме реакции:
Поли(этилентерефталат) может обозначаться аббревиатурой PET или PETE. В швейной промышленности его называют полиэстером или дакроном.
можно определить на пластиковых изделиях по треугольному символу с
«1» посередине, как показано.
В древних цивилизациях люди жевали кору ивы для облегчения боли,
активным ингредиентом оказалась салициловая кислота. Несмотря на преимущества
салициловая кислота вызывает нежелательные побочные эффекты; таким образом, ученые отреагировали на это с
этановая кислота (уксусная кислота), образуя сложный эфир, называемый ацетилсалициловой кислотой.
что побочные эффекты более незначительны. Ацетилсалициловая кислота также известна как
аспирин и используется в основном как болеутоляющее. Его также можно использовать в качестве
жаропонижающее, которое является лекарством, используемым для предотвращения или снижения лихорадки. При ежедневном приеме
При ежедневном приеме
в низких дозах он может помочь предотвратить инсульты и сердечные приступы. К сожалению,
прием аспирина замедляет выработку защитной слизи в слизистой оболочке желудка, поэтому
желудок более восприимчив к повреждению желудочной кислотой, а язвы желудка могут
форма.
Это фенольная часть салициловой кислоты, которая реагирует с образованием
аспирин — он действует как спирт и реагирует с карбоновой кислотой с образованием
эфир аспирина. Хотя фенолы содержат
Группа ОН, поэтому они будут реагировать, алифатические
спирты реагируют лучше.
Однако, поскольку салициловая кислота также содержит функциональную группу карбоновой кислоты,
он также может реагировать со спиртами с образованием сложных эфиров. Примером этого может быть его
реакция с метанолом с образованием масла грушанки (метилсалицилата), которое
также может использоваться для облегчения боли и придания мятного вкуса жевательной резинке и
монетные дворы. Реакции салициловой кислоты с образованием двух разных эфиров с
Реакции салициловой кислоты с образованием двух разных эфиров с
различные варианты использования показаны ниже.
Подведем итог тому, что мы узнали о сложных эфирах и их свойствах.
Ключевые положения
- Молекулы сложных эфиров представляют собой органические соединения, представленные общей формулой
RCOOR’ и образуются путем замены
гидроксильную группу в кислоте с алкоксигруппой. - Наиболее распространенный метод образования сложных эфиров включает (конденсацию)
реакция спирта и карбоновой кислоты. - Названия сложных эфиров происходят от названий спиртов и карбоновых кислот
кислоты, используемые для их изготовления. Первая часть названия происходит от алкоголя,
но окончание названия спирта изменено на -ил, а вторая часть
название происходит от карбоновой кислоты, но окончание карбоновой
название кислоты изменено на -оат или -ат. - Сложные эфиры обычно имеют более низкую температуру кипения, чем спирты и карбоновые кислоты
поскольку водородные связи не могут образовываться между молекулами сложного эфира.
- Сложные эфиры летучи и практически нерастворимы.
- Сложные эфиры имеют сладкий запах; таким образом, они используются в качестве ароматизаторов и в
духи. Они также используются в качестве промышленных растворителей, используемых для приготовления овощей.
и животные масла и жиры, и могут быть полимеризованы для получения сложных полиэфиров. Они также используются в медицине, такие как аспирин и масло грушанки.
Эстер — Энциклопедия Нового Света
Из Энциклопедии Нового Света
Перейти к:навигация, поиск
Предыдущая (Генеральные штаты 1789 г.)
Следующая (Эстер, Книга)
Общая формула эфира карбоновой кислоты.
В химии сложные эфиры представляют собой органические соединения, в которых органическая группа (обозначаемая в этой статье как R’ ) заменяет атом водорода гидроксильной группы в оксокислоте. Молекула оксокислоты имеет -OH (OH) группа, от которой водород (H) может диссоциировать в виде иона H + .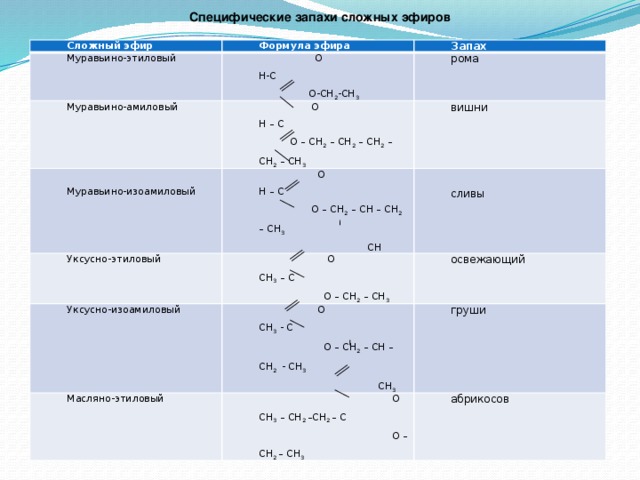 Многие сложные эфиры имеют отличительные запахи и вкусы, что приводит к их использованию в качестве искусственных ароматизаторов и ароматизаторов.
Многие сложные эфиры имеют отличительные запахи и вкусы, что приводит к их использованию в качестве искусственных ароматизаторов и ароматизаторов.
Наиболее распространенными сложными эфирами являются сложные эфиры карбоновых кислот , где рассматриваемой кислотой является карбоновая кислота. Например, если кислота представляет собой уксусную кислоту, сложный эфир называется ацетатом. Стабильные сложные эфиры, такие как карбаматы RO(CO)NHR’ и диалкилкарбонаты RO(CO)OR, могут быть образованы из нестабильной карбаминовой кислоты или угольной кислоты соответственно. Сложные эфиры также могут образовываться с неорганическими кислотами; например, диметилсульфат представляет собой сложный эфир, который иногда называют «диметиловым эфиром серной кислоты».
Сложные эфиры названы аналогично солям; хотя они не состоят из катионов и анионов, как соли, терминология, используемая для их обозначения, следует той же схеме: за более электроположительной частью следует более электроотрицательная часть.
Содержание
- 1 Номенклатура
- 2 Физические свойства
- 2.1 Запахи и привкусы
- 3 Синтез сложных эфиров
- 4 Реакции сложных эфиров
- 5 См. также
- 6 Примечания
- 7 Каталожные номера
- 8 Внешние ссылки
- 9 кредитов
Сложный эфир можно рассматривать как продукт реакции конденсации кислоты (обычно органической кислоты) и спирта (или соединения фенола), хотя существуют и другие способы образования сложных эфиров. Конденсация — это тип химической реакции, в которой две молекулы соединяются вместе и удаляют маленькую молекулу, в этом случае две группы -OH соединяются, удаляя молекулу воды. Реакция конденсации с образованием сложного эфира называется этерификацией. Этерификацию можно катализировать в присутствии H + ионов. Серная кислота часто используется в качестве катализатора этой реакции. Название сложного эфира происходит от немецкого Es sig-Ä ther , старого названия этилового эфира уксусной кислоты (этилацетата).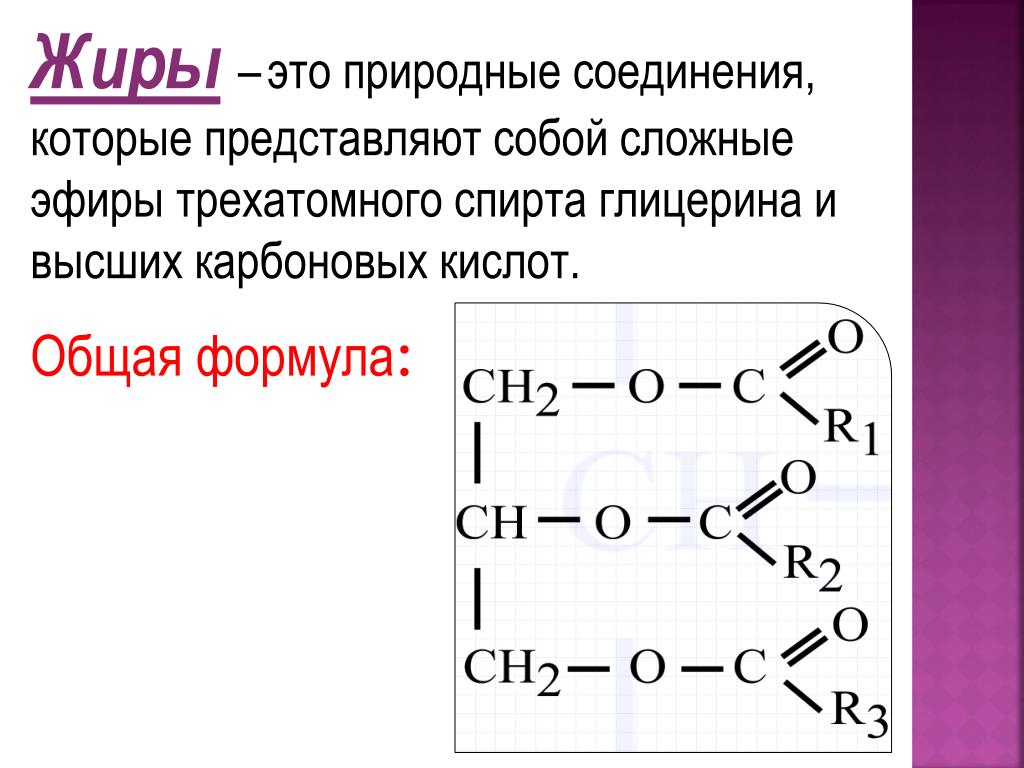
Номенклатура
Структура этилацетата
Сложные эфиры могут быть получены равновесной реакцией между спиртом и карбоновой кислотой. Сложный эфир назван в соответствии с группой алкил (часть спирта), а затем алканоатом 9.0535 (часть карбоновой кислоты), из которых он состоит. [1] Например, реакция между метанолом и масляной кислотой дает сложный эфир метилбутират C 3 H 7 -COO-CH 3 (а также воду). Самый простой эфир — метилформиат (H-COO-CH 3 , также называемый метилметаноатом).
Для сложных эфиров, полученных из простейших карбоновых кислот, традиционные названия рекомендованы Международным союзом теоретической и прикладной химии (IUPAC), [2] . Примеры названий (от низкомолекулярных кислот): формиат (от муравьиной кислоты), ацетат (уксусная кислота), пропионат (от пропионовой кислоты), бутират (масляная кислота) и т. д. Для сложных эфиров кислот с более высокой молекулярной массой обычно предпочтительнее название алкана с окончанием -оат , например, гексаноат из гексановой кислоты. Обычные сложные эфиры ароматических кислот включают бензоаты, такие как метилбензоат, и фталаты с допустимой заменой в названии.
Обычные сложные эфиры ароматических кислот включают бензоаты, такие как метилбензоат, и фталаты с допустимой заменой в названии.
Физические свойства
Сложные эфиры участвуют в водородных связях как акцепторы водородных связей, но не могут действовать как доноры водородных связей, в отличие от исходных спиртов. Эта способность участвовать в водородных связях делает их более растворимыми в воде, чем исходные углеводороды. Однако ограничения на их водородные связи также делают их более гидрофобными, чем их исходные спирты или исходные кислоты.
Отсутствие у них способности отдавать водородные связи означает, что молекулы сложных эфиров не могут образовывать водородные связи друг с другом, что делает сложные эфиры обычно более летучими, чем карбоновые кислоты аналогичной молекулярной массы. Это свойство делает их очень полезными в органической аналитической химии: неизвестные органические кислоты с низкой летучестью часто могут быть этерифицированы в летучий сложный эфир, который затем можно анализировать с помощью газовой хроматографии, газожидкостной хроматографии или масс-спектрометрии.
Запахи и вкусы
Ниже приведены примеры сложных эфиров с характерными запахами и вкусами.
| химическое название | молярная масса (г/моль) | ♦ | ♦ | ♦ | изображение | запах |
|---|---|---|---|---|---|---|
| аллилгексаноат | ананас | |||||
| бензилацетат | 150,18 | 1 | 1 | 0 | груша, клубника, жасмин | |
| борнилацетат | аромат сосны | |||||
| бутилбутират | 144,21 | 2 | 2 | 0 | ананас | |
| этилацетат | 88,12 | 1 | 3 | 0 | жидкость для снятия лака, краска для моделей, клей для моделей самолетов | |
| этилбутират | 116,16 | банан, ананас, клубника | ||||
| этилгексаноат | клубника | |||||
| этилциннамат | 176,21 | корица | ||||
| этилформиат | 74,08 | лимон, ром, клубника | ||||
| этилгептаноат | 158,27 | абрикос, вишня, виноград, малина | ||||
| этилизовалерат | яблоко | |||||
| этиллактат | 118,13 | 1 | 1 | 0 | масляный крем | |
| этилнонаноат | виноград | |||||
| этилвалерат | 130,18 | 1 | 3 | 0 | яблоко | |
| геранилацетат | 196,29 | 0 | 1 | 0 | герань | |
| геранилбутират | вишня | |||||
| геранилпентаноат | яблоко | |||||
| изобутилацетат | 116,16 | 1 | 3 | 0 | вишня, малина, клубника | |
| изобутилформиат | малина | |||||
| изоамилацетат | 130,19 | груша, банан (ароматизатор Pear Drops) | ||||
| изопропилацетат | 102,1 | 1 | 3 | 0 | фруктовый | |
| линалилацетат | лаванда, шалфей | |||||
| линалилбутират | персик | |||||
| линалилформиат | яблоко, персик | |||||
| метилацетат | 74,08 | 1 | 3 | 0 | мята перечная | |
| метилантранилат | 151,165 | виноград, жасмин | ||||
| метилбензоат | 136,15 | фруктовый, иланг-иланг, фейхоа | ||||
| метилбензилацетат | вишня | |||||
| метилбутират | 102.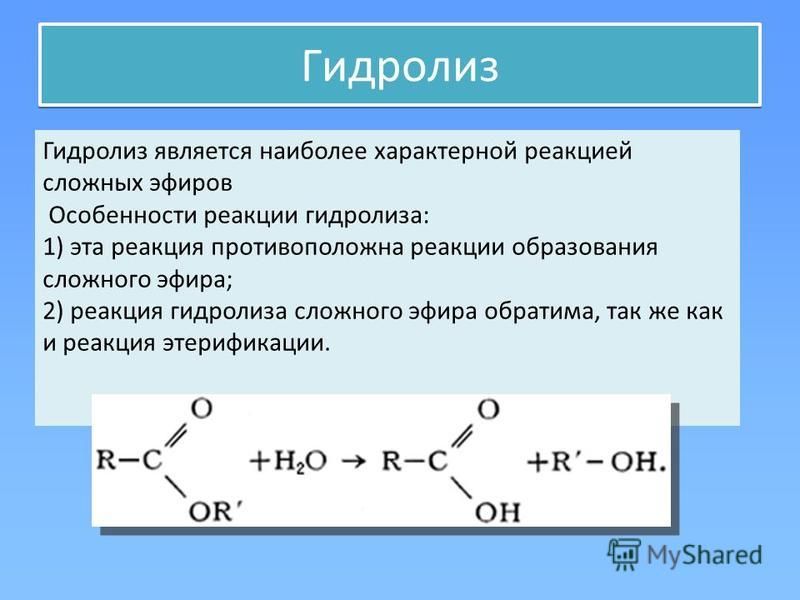 13 13 | ананас, яблоко | ||||
| метилциннамат | клубника | |||||
| метилпентаноат | 116,16 | цветочный | ||||
| метилфенилацетат | мед | |||||
| метилсалицилат (масло грушанки) | 152.1494 | рутбир, грушанка, мази Germolene™ и Ralgex™ (Великобритания) | ||||
| нонилкаприлат | оранжевый | |||||
| октилацетат | 172,27 | фруктово-апельсиновый | ||||
| октилбутират | пастернак | |||||
| амилацетат (пентилацетат) | 130,19 | яблоко, банан | ||||
| пентилбутират (амилбутират) | 158,24 | абрикос, груша, ананас | ||||
| пентилгексаноат (амилкапроат) | яблоко, ананас | |||||
| пентилпентаноат (амилвалерат) | 172,15 | яблоко | ||||
| пропилэтаноат | груша | |||||
| пропилизобутират | ром | |||||
| терпенилбутират | вишня |
Синтез сложных эфиров
Сложные эфиры можно получить в лаборатории несколькими способами:
- путем этерификации производных карбоновых кислот и спиртов
- путем переэтерификации между другими сложными эфирами
- путем конденсации Дикмана или Клайзена сложных эфиров, несущих кислотные α-протоны
- перегруппировкой Фаворского α-галогенкетонов в присутствии основания
- путем нуклеофильного замещения алкилгалогенидов солями карбоновых кислот
- окислением кетонов по Байеру-Виллигеру пероксидами
- по реакции Пиннера нитрилов со спиртом
Реакции сложных эфиров
Сложные эфиры реагируют несколькими способами:
- Сложные эфиры могут подвергаться гидролизу – разложению сложного эфира водой.
 Этот процесс может катализироваться как кислотами, так и основаниями. Процесс, катализируемый основанием, называется омылением. Гидролиз дает спирт и карбоновую кислоту или ее карбоксилатную соль.
Этот процесс может катализироваться как кислотами, так и основаниями. Процесс, катализируемый основанием, называется омылением. Гидролиз дает спирт и карбоновую кислоту или ее карбоксилатную соль. - Сложные эфиры также реагируют при нагревании с первичными или вторичными аминами с образованием амидов.
- Фениловые эфиры реагируют с гидроксиарилкетонами в перегруппировке Фриса.
- Диэфиры, такие как диэтилмалонат, реагируют в качестве нуклеофила с алкилгалогенидами при синтезе малонового эфира после депротонирования.
- Определенные сложные эфиры функционализированы α-гидроксильной группой в перегруппировке Чана
- Сложные эфиры превращаются в изоцианаты через промежуточные гидроксамовые кислоты в перегруппировке Лоссена.
См. также
- Карбоновая кислота
- Спирт
Примечания
- ↑ Особые классы соединений: соли и сложные эфиры. (Название сложных эфиров ИЮПАК.) Проверено 24 мая 2007 г.

- ↑ Карбоновые кислоты и родственные группы: незамещенные исходные структуры. (Родительские группы IUPAC используют традиционные названия.) Проверено 24 мая 2007 г.
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Макмерри, Джон. Органическая химия, 6-е изд. Бельмонт, Калифорния: Брукс/Коул, 2004. ISBN 0534420052.
- Моррисон, Роберт Т. и Роберт Н. Бойд. Органическая химия, 6-е изд. Englewood Cliffs, NJ: Prentice Hall, 1992. ISBN 0136436692.
- Соломоновы острова, Т.В. Грэм и Фрайле, Крейг Б. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: John Wiley, 2004. ISBN 0471417998.
Внешние ссылки
Все ссылки получены 15 августа 2017 г.
- Саймон Коттон Этилацетат. Аппингемская школа, Ратленд, Великобритания.
- Project shum Создание домашней страницы Ester.
- Сборник химической терминологии ИЮПАК — Золотая книга. Международный союз теоретической и прикладной химии .

| Функциональные группы |
|---|
| Химический класс : Спирт • Альдегид • Алкан • Алкен • Алкин • Амид • Амин • Азосоединение • Производное бензола • Карбоновая кислота • Цианат • Сложный эфир • Эфир • Галоалкан • Кетон • Изоцианат • Имин • Изоцианат Нитросоединение • Нитрозосоединение • Пероксид • Фосфорная кислота • Пиридиновое производное • Сульфон • Сульфоновая кислота • Сульфоксид • Тиоэфир • Тиол • Толуольное производное |
Авторы
Энциклопедия Нового Света авторов и редакторов переписали и дополнили статью Википедии
в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно осуществляться в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа.


 Этот процесс может катализироваться как кислотами, так и основаниями. Процесс, катализируемый основанием, называется омылением. Гидролиз дает спирт и карбоновую кислоту или ее карбоксилатную соль.
Этот процесс может катализироваться как кислотами, так и основаниями. Процесс, катализируемый основанием, называется омылением. Гидролиз дает спирт и карбоновую кислоту или ее карбоксилатную соль.