Большая Энциклопедия Нефти и Газа. Скорость омыления сложного эфира не зависит от
Скорость - омыление - Большая Энциклопедия Нефти и Газа, статья, страница 1
Скорость - омыление
Cтраница 1
Скорость омыления зависит от концентрации в растворе ио-ноз ОН -, а также от температуры, при которой протекает реакция. Чаще всего омыление проводят в кипящей водяной бане. В спиртовой среде омыляютс эфиры, плохо растворимые в воде, например жиры, пластификаторы. [1]
Скорость омыления решающим образом зависит от того, какой спирт применяется для приготовления раствора щелочи. Растворы щелочи в метиловом спирте омыляют сложные эфиры очень медленно, и даже для легко омыляемых жиров время реакции приходится иногда удлинять до-3 - 4 ч, а количественного омыления трудно омыляемых жиров или восков за практически приемлемый период времени вообще достичь не удается. Омыление в этиловом спирте во всех случаях заканчивается за 30 мин, а в пропиловом спирте - - уже за 15 мин. [2]
Скорость омыления зависит прежде всего от величины радикала, входящего в состав эфира. Так, триметилфосфит омыляется в 10 раз быстрее, чем триэтилфосфит; в 30 раз, чем трифенилфосфит; в 90 раз, чем три-н. [3]
Скорость омыления зависит также от температуры проведения реакции. Влияние температуры на скорость реакции омыления - обычное, как для большинства химических реакций. [4]
Скорость омыления зависит от положения реакционноспособных групп в молекуле. Если карбоксильная группа связана непосредственно с углеродом полимерной цепи, как, например, в метилакрилате, то омыление эфира затрудняется. Введение а-метильной группы, как в метилметакрилате, создает стерические препятствия, которые очень затрудняют омыление даже мономера. Вследствие стерических препятствий однажды образовавшиеся связи эфира смоляной кислоты очень устойчивы к кислотному или основному гидролизу. Легко омыляются эфиры, содержащие гидроксильные группы, связанные непосредственно с атомами углерода полимерной цепи, как, например, в ацетилцеллюлозе или поливинилацетате. Некристаллические и кристаллические формы полиметилметакрилата также проявляют различную химическую реакционную способность. Поэтому различная скорость омыления может быть использована для идентификации полимеров и для разделения физических смесей таких полимеров. Холл и Шефер [58] рассмотрели омыление легко и трудно омыляемых эфиров и предложили методику для определения чисел омыления. [5]
Скорость омыления растворами щелочи сложных эфиров уменьшается при добавке Н2О2, так как в растворе частично уничтожаются ионы ОН -, которые и вызывают омыление. [6]
Скорость омыления растворами щелочи сложных эфиров уменьшается при добавке ШСЬ, так как в растворе частично уничтожаются ионы ОН -, которые и вызывают омыление. [7]
Скорость омыления зависит от концентрации едкого натра в растворе; при ее повышении до 7 - 8 % гидролиз замедляется. Эта закономерность широко используется в производстве вискозного волокна. [8]
Скорость омыления сложных эфиров различна. [9]
Скорость омыления сложных эфиров увеличивается с повышением температуры. [10]
Скорость омыления растительных и животных жиров незначительна и моющее действие щелочных растворов обусловлено не столько омылением жиров, сколько снижением межфазного натяжения на границе водной и масляной фаз. [11]
На скорость омыления влияет содержание катализатора в смеси. В присутствии небольшого количества воды сернокислые эфиры целлюлозы не образуются; наоборот, в этих условиях имеет место частичное омыление лабильных сернокислых эфиров. [12]
На скорость омыления влияет количество катализатора в смеси. В присутствии небольшого количества воды сернокислые эфиры целлюлозы не образуются; наоборот, в этих условиях имеет место частичное омыление лабильных сернокислых эфиров. [13]
По скорости омыления ацетаты располагаются в ряд АБВ. [15]
Страницы: 1 2 3
www.ngpedia.ru
Скорость омыления эфиров - Справочник химика 21
Реакция омыления протекает в присутствии щелочи. Скорость омыления зависит от концентрации ионов 0Н в растворе и от температуры. Наиболее часто омыление проводят при температуре кипящей водяной бани. Кроме того, скорость омыления эфиров зависит от природы эфира. В одних случаях реакция омыления протекает быстро, даже при обычной температуре, в других продолжается несколько часов. Сложные эфиры, растворимые в воде, сравнительно легко омы-ляются даже водным раствором щелочи, плохо растворимые эфиры — в спиртовой среде. Для омыления пользуются преимущественно спиртовым раствором КОН. Спиртовые растворы щелочей при хранении меняют свой титр, поэтому поправочный коэффициент для них определяют в каждом отдельном случае при помощи контрольного титрования. [c.251] Величина р, называется константой реакции. При постоянных температуре и растворителе она представляет собой меру чувствительности (проводимости), например, реакционной серии 2 к влиянию заместителя. Для экспериментального определения этого параметра для реакционной серии / строят график зависимости g ki/ko) или Ig от Gi. Угол наклона получающейся при этом прямой представляет собой р/. Для серии 2 при 25°С в 607о-ном ацетоне р = 2,26, а для серии 3 при 30 °С в 48%-ном этаноле р=—2,18 [1.6.2]. Таким образом, скорость омыления эфиров замещенных бензойных кислот увеличивается в случае заместителей с положительными а, и уменьшается для заместителей с отрицательными а. Обратное влияние на скорость реакции наблюдается в случае гидролиза замещенных бензилхлоридов. Для первой реакционной серии величина р по определению принята равной 1. [c.172]См. предыдущую работу Определение константы скорости омыления эфира . [c.264]
Конкретным выражением принципа ЛСЭ является уравнение Гаммета, устанавливающее, например, линейную зависимость между константа.ми скоростей омыления эфиров м- п-замещенных кислот и константами ионизации последних. [c.24]
На основании данных о скоростях омыления эфиров в водных растЕорах [М.] сделайте вывод, омыление какого из эфиров при 323 К СН3СООС2Н5, СН3СООС3Н, или СН3СООС4Н9 происходит быстрее. В каком соотношении находятся константы скорости омыления этих эфиров [c.420]
До сих пор мы рассматривали лишь такие системы, геометрия которых строго фиксирована, а реакционный центр удален от заместителей на достаточно большое расстояние. Оба эти фактора обеспечивают либо постоянство, либо равенство нулю члена АЛС, в выражении (1И.1) и, следовательно, корреляционное уравнение Гаммета и его развития в применении к другим системам характеризуют линейные соотношения составляющих AAG, приходящихся на долю электронной структуры молекул. Попытка приложения подобных зависимостей к алифатическим системам оказывается неудачной. Характерный пример — отсутствие корреляции между скоростью омыления эфиров [c.307]
Уравнение Гаммета не ограничивается корреляцией скорости омыления эфиров замещенных бензойной кислоты с константой заместителя ст. С помощью уравнения Гаммета удовлетворительно описывается действие замещенного арильного остатка и на множество других реакций (рис. 28). [c.101]
Однако муравьиные и уксусные эфиры борнеола и изоборнеола практически нерастворимы в водном растворе едкого натра. Поэтому молекулы эфира и щелочи, находящиеся вне поверхности раздела фаз, е могут взаимодействовать друг с другом до тех пор, пока вследствие диффузии или других процессов (например, разрушения одних зерен эмульсии и образования новых) не перейдут на поверхность раздела фаз. Так как эти процессы протекают значительно медленнее, чем реакция, то именно они определяют скорость омыления эфиров водными 106 [c.106]
Нами была изучена (дилатометрическим методом) скорость омыления эфиров чистой водой при эквимолекулярных отношениях. [c.514]
Пиридин и ацетон реагируют с продуктом реакции, давая соответственно соль диалкилфосфористой кислоты с пиридином и эфиром а-оксиалкил-фосфиновой кислоты с ацетоном, поэтому скорость омыления эфиров в их среде соответственно уменьшается. Так, например, омыление триэтил- [c.515]
Скорости омыления эфиров вторичных и третичных алифатических спиртов [c.231]
Установлены некоторые новые закономерности в константах и в скоростях омыления эфиров цис- и транс-циклогексен-4-дикарбо-новых кислот и их ближайших гомологов. [c.859]
И пришел к выводу, что если переходное состояние менее полярно, нем основное, то при увеличении поляр- ности растворителя первое будет стабилизироваться в меньшей степени, чем последнее. Следствием этого должна быть более высокая энергия активации и более низкая скорость реакции, что и наблюдается в действительности. На основании этих аргументов можно было бы ожидать, что скорость омыления эфиров также должна уменьшаться с увеличением полярности растворителя. В действительности же это противоречит экспериментальным данным 36, 37]. [c.17]
Влияние спиртовой компоненты. В то время как относительно влияния кислотной компоненты при кислом гидролизе получается картина, не очень отличающаяся от щелочного гидролиза, влияние спиртовой компоненты проявляется здесь совершенно иначе. Эфиры нормальных первичных спиртов практически омыляются с одинаковой скоростью, метиловый спирт не составляет здесь исключения [79]. При переходе от первичных к вторичным спиртам скорость реакции падает, как и при щелочном омылении, однако при переходе к третичным она вновь возрастает, что находится в обращающем на себя внимание противоречии со щелочным омылением. Скорость омыления эфиров третичных спиртов даже заметно выше, чем эфиров первичных спиртов . [c.501]
Скорость омыления эфира изоборнеола LII в 250 тысяч раз ( ) превосходит скорость омыления соответствующего эфира борнеола LI. Важно подчеркнуть, что мы имеем здесь дело с огромным, повышением скорости гидролиза эфиров циклических спиртов, в качестве единицы здесь служит скорость гидролиза производного циклогексанола. Явление ускорения реакций под влиянием соседних групп называют син-артетическим или анхимерным) ускорением. Скорости рацемизации и обмена кислорода в кислой среде у изоборнеола и борнеола также различаются в 2,3-10 раз [112]. [c.387]
Обсуждение. Сложные эфиры сильно отличаются друг от друга по скорости омыления. Эфиры более простого строения, кипящие ниже 110°С, полностью омыляются за 0,5 ч при кипячении с 257о-ным раствором гидроксида натрия, как это описано в методе А. Эфиры, кипящие между ПО и 200°С, требуют для полного омыления более длительного времени (1—2 ч). [c.339]
Примеры приложения методов корреляционного анализа для обработки кинетики и равновесий реакции в этом ряду еще более малочисленны. В работах [87—89J был поднят вопрос о том, каким образом передается влияние заместителей в бензольном ядре индола на реакционный центр в положениях 2 и 3 пиррольного кольца. Отсуи и Джаффе [87] установили, что константы ионизации и скорости омыления эфиров 2-ицдолкарбоновых кислот подчиняются следующим соотношениям, вытекающим из (1V.3). [c.261]
Для предсказания индуктивного эффекта винильной группы используется, по общему признанию, достаточно умозрительный метод, основанный на использовании констант полярных заместителей а [140]. Эти константы, полученные на основании изучения скоростей омыления эфиров, рассматриваются как характеристика электроноотталкивающей способности различных заместителей. Было найдено, что влияние достаточно широкого ряда групп на скорость и равновесие некоторых различных типов реакций могут быть с известной степенью точности представлены величинами а. В частности, Браун и сотрудники при изучении газофазной диссоциации продуктов взаимодействия три-метилбора и некоторых первичных алифатических аминов [140] получили данные, позволившие проверить уравнение АН = = —7,262а + 24,54, где ЛЯ представляет собой энтальпию диссоциации, а 2о — сумму величин а заместителей, в данном случае двух атомов водорода и алкильной группы у атома азота. Если предполагать, что полярные эффекты сказываются на диссоциации типа [c.141]
Гемптин в 1894 г. [106] успешно рассчитал по уравнению (I—17) влияние температуры на скорость омыления эфиров органических кислот. В некоторых других работах конца XIX в. была показана применимость уравнения (I—23) для определения скоростей органических реакций при изменении температуры [133, 218—220], а Петерсен в 1895 г. выдвинул предположение о наличии связи температурной зависимости константы скорости реакции с изменением строения исходных молекул в растворе при различной температуре [107]. [c.60]
Для лаборатории наибольшее значение жмеет щелочное омыление. В зависимости от строения спиртовых, а также кислотных компонентов, скорость омыления эфиров карбоновых кислот изменяется в широчайших пределах. [c.217]
Другим примером, изученным более тщательно, является скорость омыления эфиров аминобензойных кислот При щелочном гидролизе эфира важную роль в активном комплексе играет, вероятно, структура с ионом гидроксила, связанным с карбонильным атомом углерода Поэтому, хотя нереагирующая молекула этил-п-диметиламинобензоата может резонировать со структурами типа ХУП1 (наряду с другими, более существенными), но подобный резонанс невозможен в активном комплексе, для которого можно написать только структуры класса В, вроде XIX (в дополнение к тем, которые имеют кольца обычных структур Кекуле). Поэтому резонанс со структурой XVIII повышает энергию активации и тем самым уменьшает скорость гидролиза. [c.399]
При щелочном омылении эфиров бензойной кислоты (значения р от +2,2 до +2,8) полярный эффект заместителей делается хорошо заметным то же можно получить для щелочного омыления эфира алифатической карбоновой кислоты. Вследствие этого разница в скорости омыления эфира замещенной уксусной кислоты в щелочной среде обусловлена как полярным эффектом заместителей, так и указанным ранее стерическим влиянием заместителей. Здесь Тафт постулировал, что стерическое влияние заместителей при катализируемом кислотой омылении сложных эфиров и при их омылении, катализируемом щелочью, должно быть практически равным, поскольку переходные состояния обеих реакций [(а) и (б) соответственно] различаются только отсутствием двух протонов, которые к тому же глубоко погружены Б злектроккую оболочку других атомов. [c.121]
Скорость омыления эфира пзоборнеола в 250 тысяч раз пре-восходг т скорость омыления соответствующего производного борнеола. Подробнее об этом см. s главе VII. [c.131]
Нами изучено влияние продукта реакции на скорость омыления эфиров на примере триэтилфосфита. В исходную смесь эквимолекулярных количеств фосфита и воды добавлялись перед началом опыта различные количества диэтилфосфористой кислоты. Все опыты проводились при температуре 25°. Состав исходной смеси (С2И50)зР+Н,0-1-а (С2Н50)2Р0Н. Результаты приведены в табл. 2. Как видно из табл. 2, предварительное добавление в исходную смесь диэтилфосфористой кислоты ускоряет течение реакции. [c.515]
Эффект влияния соседних карбоксильных групп меньше при гидролизе эфиров жирных спиртов. Тем не менее результаты опытов с метиловым эфиром гексагидрофталевой кислоты показывают [61], что наличие соседних карбоксильных групп значительно увеличивает скорость омыления эфира аналогично звенья метилметакрилата в частично нейтрализованных сополимерах его с метакриловой кислотой имеют реакционную способность, примерно в 100 раз более высокую, чем в сополимерах с винил-нирролидоном [62]. Странным и малопонятным при оценке результатов этих опытов является предположение о том, что максимальная скорость гидролиза должна соответствовать случаю, когда ионизировано 25% от общего числа карбоксильных групп. [c.32]
Подобное стерическое содействование вместо препятствования путем накопления заместителей вблизи реакционноспособной группы наблюдал еще В. Мейер [31, 32] при ацилировании ароматических углеводородов. Ван-Доин [33] нашел, что у сульфобензойных кислот сульфогруппа в виде натриевой соли в оршо-положении понижает скорость омыления эфиров этих кислот, в то время как группа 80зН в том же положении повышает скорость этерификации этих кислот. Эти и другие примеры показывают, насколько трудна проблема пространственных препятствий, хотя на первый взгляд кажется, что ее можно охватить простейшими модельными представлениями. [c.492]
Выполненное Паломаа сравнение температурных коэффициентов позволяет установить, что, несмотря на близкие по величине скорости омыления эфиров с третичными и первичными спиртами, между ними имеется коренное отличие, которое должно быть сведено к различному механизму реакции омыления. Температурный коэффициент для третичных спиртов равен 4 на 10°, тем самым он почти вдвое больше, чем для первичных спиртов. Соответственно, эиергия активации выше примерно на 10 ккал. Если, тем не менее, имеется одинаковая скорость омыления, то она осуществляется за счет исключительно высокой константы действия, которая примерно на 7 порядков больше, чем у первичпых спиртов, как гюказывает сводка на стр. 501, 502 [81]. Тольк о диметилметоксикарбинол приближается по значениям с/ и а к первичным спиртам. То же самое наблюдается и для вторичных спиртов, для которых, впрочем, видимо, плохо соблюдается уравнение Аррениуса. [c.501]
chem21.info
Скорость реакции омыления сложных эфиров
XIX.2. ОПРЕДЕЛЕНИЕ КОНСТАНТЫ СКОРОСТИ РЕАКЦИИ ОМЫЛЕНИЯ СЛОЖНОГО ЭФИРА [c.253]Цель работы. Определение среднего значения константы скорости реакции омыления сложного эфира (например, метил- или этилацетата) водой при двух температурах и энергии активации реакции [c.196]
Реакция омыления сложных эфиров в присутствии ионов гидроксила. Изучаемая реакция протекает практически до конца. Она двухмолекулярна скорость ее пропорциональна концентрации эфира и щелочи и определяется уравнением (5) и (6), т. е. [c.240]
Цель работы. Определение среднего значения константы скорости реакции омыления сложного эфира (например, метил-или этилацетата) водой [c.238]Цель работы — определить среднее значение константы скорости реакции омыления сложного эфира (например, метил- или этилацетата) водой [c.152]
Задание. Определить среднее значение константы скорости реакции омыления сложного эфира этилацетата водой. [c.68]
Как реакция этерификации карбоновой кислоты, так и реакция омыления сложного эфира протекает чрезвычайно медленно даже при нагревании. Скорости обеих реакций значительно возрастают в присутствии сильных кислот, действующих каталитически, Щелочи также ускоряют омыление сложных эфиров, [c.139]
Реакции омыления сложных эфиров едким натром в разбавленных растворах при эквимолекулярных соотношениях реагентов являются реакциями второго порядка. Скорость необратимой реакции описывается уравнением [c.243]
Определение методом электропроводности константы скорости и энергии активации реакции омыления сложного эфира щелочью [c.40]
Омыление сложных эфиров — важнейшее йх химическое свойство. В присутствии кислот и щелочей оно протекает довольно легко. С наибольшей скоростью реакция омыления протекает в щелочной среде. [c.393]
Реакциями нулевого порядка называют процессы, в которых скорость процесса сохраняется постоянной во времени. Это встречается в некоторых гетерогенных системах. Так, если в предыдущем примере — омыление сложного эфира водой в разбавленном водном растворе — применять эфир, малорастворимый в воде, и взять его в избытке, чтобы в системе присутствовал эфирный слой, то расход эфира будет постоянно восполняться из эфирного слоя. Таким образом, концентрация его в водном слое будет постоянной [c.462]
Скорость реакции омыления прямо пропорциональна концентрации каждого из реагирующих веществ. Именно поэтому целесообразно выбирать такой растворитель, в котором сложный эфир легко растворяется. В противном случае его концентрация во время реакции будет все время оставаться небольшой, особенно учитывая то, что переход сложного эфира в раствор взамен прореагировавшего также происходит медленно. [c.237]
Она протекает аналогично реакции омыления этилацетата или других сложных эфиров. Различие между реакцией полимеров и аналогичной реакцией низкомолекулярных соединений, в которых участвуют те же функциональные группы, может проявиться в скорости, температуре реакции и степени превращения, что связано с различием в физическом состоянии этих веществ. [c.46]
В каждый данный момент большое число молекул уксусной кислоты и этилового спирта взаимодействуют между собой и одновременно с этим также большое число молекул уксусноэтилового эфира разлагаются водой. Скорости этих процессов вначале различны, но потом наступает момент, когда становится равной ьч и система приходит в состояние равновесия, хотя и в этот момент продолжают идти реакции как образования сложного эфира, так и его омыления. [c.95]
Обратим ыереакциивторогопорядка А + В А + + В. Примером реакции подобного типа могут служить реакции омыления сложных эфиров и этерификация. Формула скорости реакции для данного случая будет иметь следующий вид [c.24]
Иногда катализатор образуется в ходе самого химического процесса. Такие реакции называются автокаталитическими, а само явление — автокатализом. При автокатализе скорость химической реакции вначале очень мала, с появлением продукта — катализатора она быстро возрастает и, достигнув максимума, снова снижается вследствие уменьшения кон- центрации реагирующих веществ. Примером автока-талитической реакции может служить омыление сложного эфира [c.104]
Наличие диффузионных процессов при реакциях в гетерогенных системах (в случаях, когда константа скорости диффузии значительно больше константы скорости химической реакции) может привести к тому, что скорость химического превращения не будет зависеть от концентрации. Если убыль вещества, исчезающего в процессе реакции, достаточно быстро восполняется диффузией, то концентрация реагирующего вещества в зоне реакции будет оставаться практически постоянной, и реакция пойдет по нулевому порядку. Это может происходить, например, в реакции омыления сложного эфира в насыщенном эфиром водном растворе, находящемся Э равновесии с насыщенным раствором воды в эфире. Если скорость диффузии эфира из эфирного елоя в водный достаточно велика, а толшлна водного слоя мала, то концентрация эфира, независимо от времени, будет равна концентрации насыщения с ас. [c.107]
Рассмотрение данных, приведенных в табл. 9.4, позволяет выявить некоторые общие особенности реакций между ионами и полярными молекулами в гидроксилсодержащих растворителях. За исключением реакций омыления сложных эфиров, постоянная Л примерно одинакова для всех реакций. Сопоставление первой строчки табл. 9.4 с данными табл. 8.9 показывает, что замещение атома водорода на карбоксильную группу приводит примерно к двукратному увеличению константы скорости реакции СНзС1+1 -> - СНз1-ЬС1 и снижению энергии активации на 0,25 ккал. Данные по омылению сложных эфиров подтверждают р нние результаты по гидролизу этилацетата [51, 66], согласно которым lgA2 = = 7,22 0,07, = а 205 5 кал. Для процессов этого типа, по-видимому, g Л 2 примерно на три единицы меньше, чем для других типов реакций. Было высказано предположение, что, по крайней мере частично, это различие определяется типом столкновений, обеспечивающих реакции рассматриваемых типов. Если растворитель действует как третий участник реакции, то, по-видимому, применимо уравнение (5.52). Данные, помещенные в четвертой строчке табл. 9.4, показывают, что замена этильной группы на трет-бутильную приводит к существенному снижению скорости реакции с ионами гидроксила, в противоположность влиянию такого замещения на реакции других типов, которые мы обсудим позже. Если сравнить данные табл. 9.4 с результатами, которые обсуждались в гл. 8, то мы увидим, что значения параметров уравнения Аррениуса для реакций замещения в алифатическом и ароматическом рядах, такнх, [c.246]
Константы скоростей и стерические факторы реакций омыления сложных эфиров щелочами h4 OOR + 0Н -> h4 OO + rh ROH [c.206]
Протолитическая теория была применена к истолкованию закономерностей реакций кислотно-основного катализа разложение нитра-мида, инверсия сахаров, омыление сложных эфиров и т. п. Скорость этих процессов зависит от природы и концентрации кислот и оснований, присутствующих в растворе, причем сами кислоты и основания в ходе реакции не расходуются, т.е. выступают в роли катализаторов. Реагирующее вещество можно рассматривать как слабую кислоту пли слабое основание, которые вступают в реакцию с катализатором основанием или кислотой с образованием некоторого промежуточного комплекса. Последний затем распадается на конечные продукты с регенерацией катализатора. Сила кислот и оснований (константы их ионизации) и их каталитическая активность связаны между собой. Я. Брёнстед установил, что если в качестве катализаторов использовать ряд однотипных слабых кислот, то между константой скорости катализируемого ими процесса и константой ионизации кислот Ка существует следующее соотношение [c.84]
Омыление щелочью наиболее часто применяется для количественного определения содержания большинства сложных эфиров, в том числе и жиров, а также продуктов этерификации фенолов. Наибольшее влияние на реакцию омыления оказывают следующие факторы достаточная концентрация ионов гидроксила в растворе, хорошая растворимость анализируемого вещества во взятом растворителе и высокая температура реакции омыления. Сравнительно легко растворимые в воде сложные эфиры (как, например, этил-формиат, метилформиат, этилацетат и др.) могут быть омылены водными растворами щелочей. Сложные эфиры, плохо растворимые в воде, омыляют в спиртовой среде. Для этого пользуются спиртовыми растворами едкого кали или едкого натра. Можно прямо растворить сложный эфир в этиловом спирте, а затем прилить определенное количество водного раствора титрованной щелочи и омылить эфир. Спиртовые растворы едкого кали более предпочтительны вследствие хорошей растворимости едкого кали в спирте, особенно при получении его концентрированных растворов. Скорость омыления сложных эфиров различна. Она зависит от природы входящих в состав сложного эфира кислоты и спирта. В одних случаях реакция омыления протекает быстро даже при обычной комнатной температуре, в других [c.249]
Чтобы установить причину действия нейтральной соли на скорость реакции при омылении сложного эфира, Акерлёф [9] комбинировал измерение скорости при постоянной кислотности с измерением активности водородного иона. Он вывел следующую формулу для соотношения между скоростью и активностью [c.222]
Гомогенный катализ в растворах наиболее часто вызывается действием водородных или гидроксильных ионов. Каталитическое действие кислот было открыто в 1811 г. К. Кирхгофом. Инверсия сахара, омыление сложных эфиров, гидролитическое разложение амидов, ацеталей и много других реакций в растворах ускоряется действием водородных ионов, причем с повышением их концентрации примерно пропорционально увеличивается и скорость. В гомогенных каталитических реакциях в растворах во многих случаях такн е с несомненностью установлено образование промежуточнвтх соединений с участием катализатора. Так, Н. И. Кобозевым было показано, что ионыСггО ", W0 , МоО " катализирующие разложение перекиси водорода, образуют с ней промежуточное соединение, которое распадается с выделением кислорода последним процессом определяется кинетика всей реакции. [c.487]
Еще в прошлом веке довольно широкое применение нашли кинетические методы определения концентрации ионов водорода и гидроксила в водных растворах. Скорость очень многих реакций зависит от pH раствора, однако наиболее широко использовались реакции инверсии тростникового сахара , омыления сложных эфиров , разложения диазоуксусного эфира , деполимеризации диацетонового спирта и триоксиметилена нейтрали-, зации нитрометана и взаимодействия между галогенидами и галогенатами . С помощью этих реакций можно определять константы диссоциации кислот и оснований, константы гидролиза и константы устойчивости разнообразных гидроксокомплексов. [c.94]
При щелочном омылении эфиров бензойной кислоты (значения р от +2,2 до +2,8) полярный эффект заместителей делается хорошо заметным то же можно получить для щелочного омыления эфира алифатической карбоновой кислоты. Вследствие этого разница в скорости омыления эфира замещенной уксусной кислоты в щелочной среде обусловлена как полярным эффектом заместителей, так и указанным ранее стерическим влиянием заместителей. Здесь Тафт постулировал, что стерическое влияние заместителей при катализируемом кислотой омылении сложных эфиров и при их омылении, катализируемом щелочью, должно быть практически равным, поскольку переходные состояния обеих реакций [(а) и (б) соответственно] различаются только отсутствием двух протонов, которые к тому же глубоко погружены Б злектроккую оболочку других атомов. [c.121]
Сложные эфиры спиртов дают с гидроксиламином гидроксамовые кислоты в сильно щелочных средах. Для количественного определения пригоден лишь метод, основанный на образовании окрашенного железного комплекса полученной гидроксамовой кислоты, измеряемого спектрофотометрически. Этот метод особенно удобен при определении малых количеств сложных эфиров и для анализа многокомпонентных систем. Все определение состоит из двух стадий реакции сложного эфира с гидроксиламином, протекающей в щелочной среде, и получения окрашенного комплекса с железом (III) в кислой среде Скорость реакции образования гидроксамовой кислоты увеличивается по мере повышения концентрации Н0 в реакционной среде, однако при этом появляется опасность побочной реакции омыления определяемого эфира без образования гидроксамовой кислоты [33. Как протекает реакция для различных сложных эфиров даже одной и той же кислоты, точно сказать 1 ельзя, так как выделение после реакции чистых гидроксамовых кислот представляет большие трудности и реакция образования гидроксамовых кислот мало изучена. Описываемый метод имеет до известной степени условный характер. Достаточно точные данные удается получить только при строгом соблюдении одинаковых условий на обеих стадиях определения как при построении калибровочной кривой, так и при анализе. [c.171]
Гомогенный катализ в растворах нмболее часто вызывается действием водородных или гидроксильных ионов. Каталитическое действие кислот было открыто впервые в России К. Кирхгофом в 1811 г. Инверсия сахара, омыление сложных эфиров и много других реакций ускоряются при наличии в растворе ионов водорода, причем повышение их концентрации вызывает примерно пропорциональное увеличение скорости. В гомогенных каталитических реакциях в растворах во многих случаях также с несомненностью установлено образование промежуточных соединений с участием катализатора. Так, Н. И. Кобозевым было показано, что ионы СггОг, 04, МоОг , катализируюш,ие разложение перекиси водорода, образуют с ней промежуточные соединения, которые распадаются с выделением кислорода скоростью этого последнего процесса определяется скорость всей реакции. [c.376]
Впервые количественные исследования влияния структурных факторов на скорость омыления сложных эфиров в щелочной среде (реакция второго/но-рядка) были проведены Райхером [И], который, начиная с 1885 г., изучал сложные жирные эфиры К СООК с неразветвленными и разветвленными алкильными группами К и К. Эти исследования были расширены результаты изучения жирных эфиров Олсоном [12], Шкрабалом [13] и Киндлером [14] [c.940]
Гомогенный катализ в растворах наиболее часто вызывается действием водородных или гидроксильных ионов. Каталитическое действие кислот было открыто в 1811 г. К. Кирхгофом. Инверсия сахара, омыление сложных эфиров, гидролитическое разложение амидов, ацеталей и много других реакций в растворах ускоряется действием водородных ионов, причем с повышением их концентрации примерно пропорционально увеличивается и скорость. В гомогенных каталитических реакциях в растворах во многих [c.483]
chem21.info
Лабораторная работа № 11
Омыление сложных эфиров в присутствии
кислой и щелочной среды
Омыление сложных эфиров в присутствии
кислой и щелочной среды
Приборы и материалы
Термостат
Часы или секундомер
0,1 н раствор HCl
1/60 н раствор NaOH
Дистиллированная вода
Охлаждающая смесь (лед)
Этилацетат и раствор этилацетата в воде (для щелочной среды)
Набор конических колб на 100 мл для титрования – 4 шт.
Набор мерных колб на 100 мл – 3 шт.
Индикаторы (фенолфталеин, метилоранж)
Кристаллизатор
Пипетки – 2, 5, 10 мл
КРАТКАЯ ТЕОРИЯ
Реакции первого порядка
Мономолекулярными реакциями называют такие реакции, в которых только один
Определение среднего значения константы скорости реакции омыления сложного эфира (например, метил- или этилацетата) водой: RCOOR' + Н3О ——>RCOO-+ Н+- +R'OH
Реакции омыления сложных эфиров в присутствии ионов водорода. В разбавленных эфирных растворах вследствие большого избытка воды омыление протекает практически полностью, но крайне медленно. Поскольку ионы Н+катализируют процесс, для проведения реакции в приемлемом для работы промежутке времени ее проводят в кислой среде. Так как в результате самой реакции образуется кислота, то омыление являетсяавтокаталитическимпроцессом, что усложняет течение реакции. Однако если начальная концентрация ионов Н+велика, то увеличение концентрации кислоты будет относительно небольшим. Поэтому реакцию проводят в присутствии значительного количества сильной кислоты (например, НС1).
При большом избытке воды скорость омыления будет зависеть только от концентрации эфира, т. е. реакция будет первого порядка. Поэтому скорость ее определяется по уравнению (1), т. е.
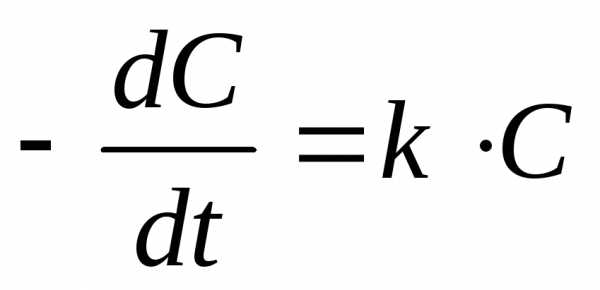 (1),
(1),
интегрируя которое получим:
(2) или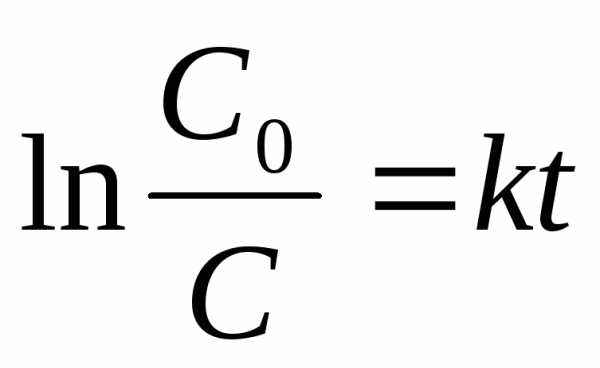 (3),
(3),
откуда: 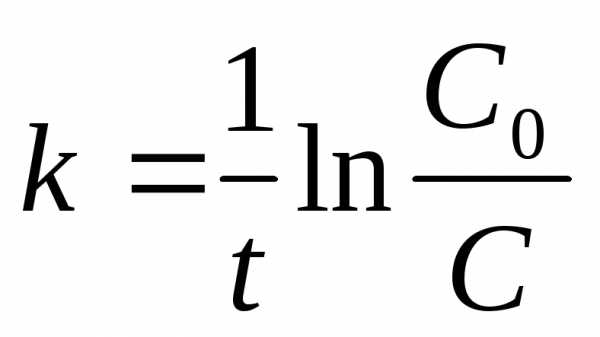 (4) – уравнение для константы скоростиI-го порядка,t-1.
(4) – уравнение для константы скоростиI-го порядка,t-1.
где С0- начальная концентрация эфира;
С - концентрация эфира в данный момент времениt.
В общем виде реакцию гидролиза эфира можно представить уравнением:
RA + h3O = ROH + HA,
где RA– сложный эфир;
ROH– образующийся спирт;
HA– образующаяся кислота.
Скорость гидролиза, протекающего как реакция первого порядка, выразится уравнением:
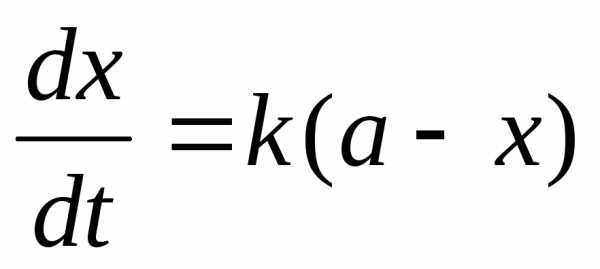 , (5)
, (5)
где х – количество разложившегося сложного эфира;
а – первоначальное количество сложного эфира.
Интегрируя последнее уравнение, получим выражение для константы скорости гидролиза сложного эфира:
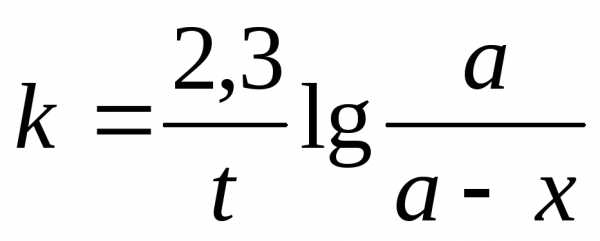 (6)
(6)
Реакции второго порядка
Бимолекулярными реакциями называются такие реакции, в которых принимают участие два различных вида молекул или две молекулы одного вида, т.е. реакции, в которых сумма показателей степеней в кинетическом уравнении равна двум.
К реакциям второго порядка могут быть отнесены химические процессы, в которых стехиометрический коэффициент исходных продуктов больше двух, но в виду того, что кинетика этих процессов описывается уравнениями бимолекулярных реакций, такие процессы относятся к реакциям второго порядка. Очень часто действительное протекание реакций не отражается схемой, соответствующей стехиометрическому уравнению.
Нередко обнаруживается, что реакции (в особенности более сложные) протекают в несколько стадий, из которых каждая описывается более простой схемой, чем суммарная реакция. Экспериментальному измерению поддается только наиболее медленная из всех реакций, и она является определяющей для общей скорости процесса и порядка реакции.
Для того чтобы произошла бимолекулярная реакция, необходимо столкновение двух разнородных или одинаковых молекул. Поэтому для скорости бимолекулярной реакции определяющим фактором является не только реакционная способность / в данном случае реакционной способностью надо понимать избыточную энергию, которой должны обладать молекулы, чтобы при их столкновении произошла реакция/, но общее число реагирующих молекул, т.е. скорость реакции, зависит от числа столкновений, а, следовательно, зависит от разведения.
Рассмотрим бимолекулярную реакцию типа:
А + В = С + Д
Обозначим С1и С2– концентрации веществ А и В, соответственно. Пустьvреакции, согласно постулату кинетики, для данной реакции при условии ее практической односторонности, выразится так:
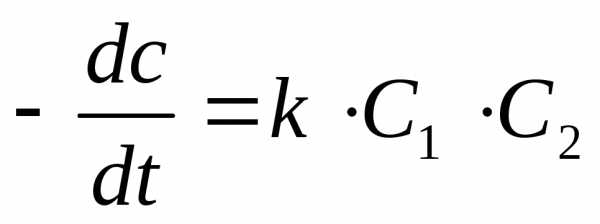 (7)
(7)
Пусть aиb, исходные количества молей веществ А и В,V-объем системы. Если к моменту времениtпрореагировалоxмолей веществ А и В, то концентрация веществ А и В, соответственно определяется
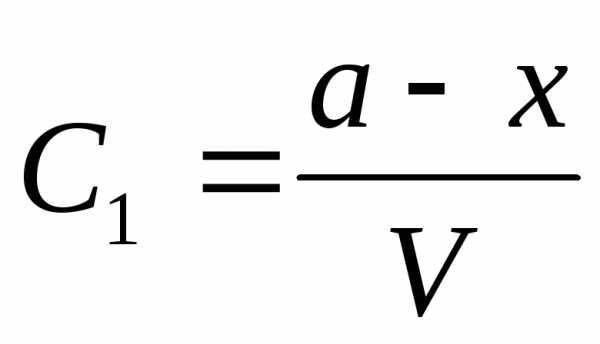 и
и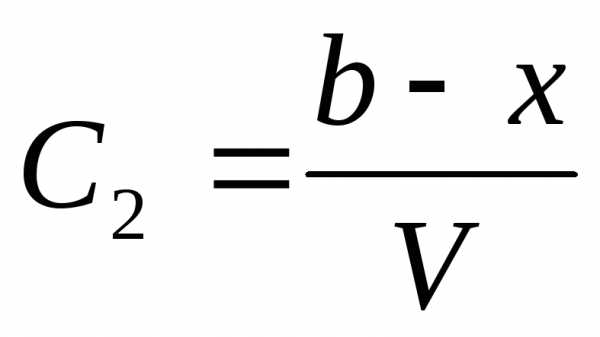 ,
,
а скорость реакции: 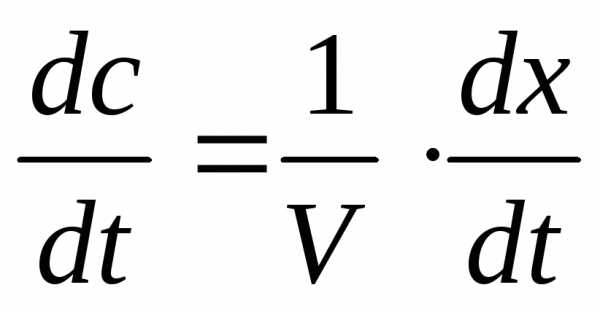
После подстановки этих выражений в уравнение (7) получим:
(8).
Из этого уравнения видим, что скорость бимолекулярной реакции зависит от разведения. Интегрируя уравнение (8) и находя значение постоянной интегрирования при условиях t=0,x=0 получаем окончательное выражение для константы скорости бимолекулярной реакции:
(9).
Константа скорости реакции второго порядка, в отличие от константы скорости первого порядка, имеет размерность /время-1/концентрация-1/, и величина константы, следовательно, зависит от выбранных для концентрации единиц.
Хорошо изученной бимолекулярной реакцией является реакция омыления сложного эфира щёлочью, которая описывается следующим уравнением:
RA + MOH = ROH + MA,
где RA– сложный эфир
MOH– раствор щёлочи
RON– алкоголь
MA– соль
Реакция омыления сложных эфиров щёлочью практически необратима и протекает с заметной скоростью.
Внимание!
Работу в кислой и щелочной средах проводить параллельно! Часть I. Изучение скорости омыления сложных эфиров в присутствии кислоты
В тщательно вымытую и пропаренную колбу емкостью 100 мл(желательно с притертой пробкой) наливают50 мл0,1н НСl. Колбочку закрывают пробкой и помещают в термостат на 10-15 минут пока раствор соляной кислоты в колбочке не примет температуру термостата. Затем, не вынимая из термостата колбочки, к раствору кислоты прибавить2 млсложного эфира (этилацетата). Тотчас же отбирают две пробы по3 млв ранее приготовленные колбочки с10 млводы, помещенные в лед. Титруют пробы щелочью (0,05нКОН), определяя содержание кислоты в начальный момент времени (t= 0). Пока титруется первая проба, колбочка со второй пробой остается во льду.
Охлаждение взятых проб необходимо, так как при комнатной температуре гидролиз сложного эфира будет происходить и после отбора пробы и до момента титрования, и нельзя будет точно определить концентрацию кислоты в начальный период.
После первого титрования через определенные промежутки времени (10, 30, 60, 120 мин) отбирается для каждого последующего титрования по одной пробе (3 мл) в колбочку с10 млдистиллированной воды, погруженную в охладительную смесь (лед).
Избыток щелочи по сравнению с первоначальным титрованием, который идет на каждое последующее титрование, соответствует количеству сложного эфира, разложившегося к определенному моменту времени t. Общее количество сложного эфира, подвергшегося гидролизу, определяется из заключительного титрования, когда предполагается, что реакция гидролиза практически закончилась (через неделю). Колбочка с реакционной смесью оставляется до следующего занятия на рабочем месте.
Заключительное титрование, соответствующее времени реакции t = ,проводится на очередном занятии.
Для отбора пробы необходимо создать прежние условия протекания реакции. Для этого колбочку с реакционной смесью снова погружают в термостат на 15-20 минут, чтобы реакционная смесь приняла температуру термостата (температура термостата должна быть такой же, как при предыдущих титрованиях). Для заключительного титрования отбирают две пробы реакционной смеси по 3 мл,которые титруют, как описано выше.
Так как по мере течения реакции количество кислоты непрерывно увеличивается, то о скорости процесса судят по увеличению количества раствора щелочи, идущего на титрование проб реагирующей смеси.
Обозначим через noмл количество щелочи, которое потребовалось при первоначальном титровании, т. е. для времениt = 0, а черезn1, n2, n3, n4, мл – количества щелочи, которые потребовались на титрование таких же по величине проб реакционной смеси при последующих опытах, т.е. для времени, равного соответственно:t1, t2, t3, t4.
Количество щелочи, которое пошло на титрование смеси в заключительном опыте (при t=), обозначимn. Разность между количеством щелочи, пошедшей на титрование в каждый момент времени (t1, t2, t3, t4) и количеством щелочи, пошедшей на титрование в момент времениt = 0, обозначим1 = n1 – n0; 2 = n2 – n0и т. д. Тогда количество сложного эфира, подвергшегося гидролизух1, х2, х3, x4 … хпо времениt1, t2, t3, t4, t,соответственно, будет пропорционально значениям1, 2, 3, 4 … ,в общемt.
Очевидно, что начальное количество сложного эфира будет пропорционально = n - nо, и отношение в последнем уравнении будет равно:
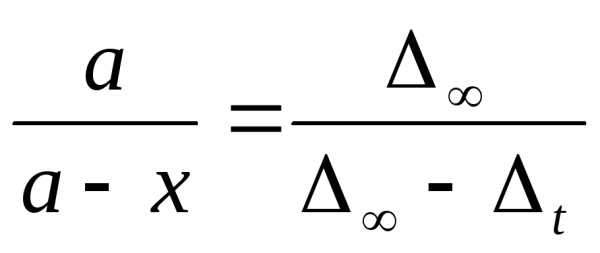 /10/.
/10/.
В этом случае константа скорости гидролиза сложного эфира выразится следующим образом:
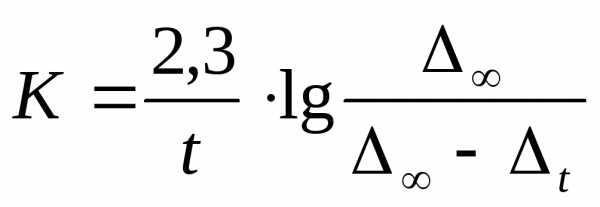 /11/.
/11/.
Как видно из уравнений (10) и (11) титр применяемой щелочи не нужен для расчета и может даже быть не известен, если для всех определений применять раствор щелочи постоянной концентрации.
Следует отметить, что при вычислении констант скоростей реакций первого порядка как начальная концентрация, так изменение концентрации исходного вещества во время реакции могут быть заменены пропорциональными величинами, например, при инверсии тростникового сахара изменению угла вращения реакционной смеси.
Расчет константы скорости гидролиза сложного эфира производится по уравнению (11).
Результат титрования и расчетов рекомендуется сводить в таблицу следующего вида:
Таблица1
| t, мин | nt | t = nt - no | - t = n - nt |
|
| 0 | ||||
| 10 | ||||
| 30 | ||||
| 60 | ||||
| 120 | ||||
| неделя |
Из полученных значений Кнаходят среднее значение. В тех случаях, когда трудно провести титрование в момент времениt0любой отсчет времени может быть принят за нулевой. Например, первое титрование можно проводить через 3-10 мин. от начала реакции, но тогда расчет константы скорости реакции гидролиза сложного эфира следует производить по уравнению:
где t1– время первого титрования.
ЩЁЛОЧИ
Для выполнения этой части работы, в две мерные колбочки на 100 мл, предварительно вымытые и высушенные, наливают по 50 млраствора: в первую0,01н раствор сложного эфира (метил или этилацетата), во вторую1/60 н раствор едкого натра. Эти колбочки закрывают пробкой и устанавливают в термостате с температурой 250С.
Через 10-15 мин. раствор эфира выливается в раствор щелочи, причем колбочку со щелочью не вынимают из термостата.
Через 10 минут отбирают пробу в количестве 10 млв коническую колбу, в которую заранее наливают10 млводы и помещают в кристаллизатор со льдом. Отобранная проба титруется кислотой с индикатором метиловым оранжевым.
Затем последовательно через промежутки времени 20, 40, 70,100 минут (от начала реакции) отбирают другие пробы по10 мли титруют кислотой одной и той же концентрации. Реакция омыления сложного эфира щёлочью практически заканчивается через 10-12 часов.
Пусть n0 мл – количество кислоты, которое пошло на титрование5 млисходной щелочи в15 млводы. Пусть по времениtна титрование пробы смеси потребуетсяntмл кислоты. Для времени, когда реакция практически полностью доходит до конца, количество кислоты затраченной на титрование, будетnмл.
Если нормальность кислоты, взятой для титрования N, то в начале реакции во взятом для титрования объёмеV(мл) содержит:n0 Nмиллиграмм-эквивалентов щёлочи (миллиграмм-эквивалент/мл = грамм-эквивалент). Ко времениtколичество щёлочи, нейтрализованное кислотой, определяется какnt Nмиллиграмм-эквивалентов щёлочи. Если щелочь в избытке, как в нашем случае, то количество сложного эфира, подвергающееся омылению, определится как разность между мг-эквивалент щелочи, нейтрализованной кислотой, а именно (n0 - n).
Следовательно, ко времени tмы получим следующие количества реагирующих веществ:
- для щелочи: (а – х) = nt N,
- для сложного эфира: (в – х) = (n0 – n) N – (n0 – nt) N = N (nt - n),
- для начального количества щелочи: а = n0 N,
- для начального количества сложного эфира: в = (n0 - n) N, (а – в) = n N
Если полученные выражения подставить в уравнение (11), то константа скорости реакции для случая, когда в исходной смеси имеется избыток щелочи, определится следующим выражением:
(12)
где V– объем взятой пробы,
N– нормальность кислоты взятой для титрования.
Вода, которая используется при титровании, не должна содержать растворенный углекислый газ, который уделяется кипячением воды в течение часа.
Полученные данные и результаты расчета рекомендуется записывать в виде таблицы:
| t мин | nt | nt - n |
|
| 0 | |||
| 10 | |||
| 20 | |||
| 40 | |||
| 70 | |||
| 100 |
Из полученных значений констант скоростей омыления эфира находят среднее значение.
studfiles.net
Скорость омыления сложных эфиров - Справочник химика 21
Скорость омыления сложных эфиров увеличивается с повышением температуры. [c.250]Работа 3. Изучение скорости омыления сложных эфиров в присутствии ионов водорода [c.238]
Определение константы скорости омыления сложного эфира [c.6]
Изучение скорости омыления сложных эфиров 153 [c.153]
ИЗУЧЕНИЕ СКОРОСТИ ОМЫЛЕНИЯ СЛОЖНЫХ ЭФИРОВ [c.145]
Скорость омыления сложных эфиров различна. Она зависиг от природы кислоты и спирта, образующих эфир. В одних случаях даже при комнатной температуре омыление протекает быстро, в других — продолжается несколько часов. [c.117]
Этот метод омыления сберегает большие количества спирта и приводит к более точному и четкому изменению окраски индикаторов и позволяет обнаруживать и определять этиловый спирт и этиловые сложные эфиры. Омыление водным раствором щелочи протекает тем быстрее, чем более растворимы в щелочи сложный эфир и продукты его разложения. Так как натриевые соли кислот, встречающихся наиболее часто в сложных эфирах, легко растворимы, но не действуют гидро-тропно а спирты всегда легче растворимы, чем их сложные эфиры, го скорость омыления сложного эфира при прочих равных условиях существенно зависит от растворимости выделяющегося спирта и от его гидро-тропного действия на эфир. Точно такое действие оказывают все частично или полностью растворимые в воде компоненты смеси на ее омыление. Высшие сложные и простые эфиры, углеводороды, а также спирты при слишком высоких концентрациях (например, в часто применяемом спиртовом растворе н елочи) замедляют омыление [c.981]Поэтому в учебном практикуме чаще всего изучают скорость омыления сложных эфиров либо инверсию тростникового all [c.117]
Впервые количественные исследования влияния структурных факторов на скорость омыления сложных эфиров в щелочной среде (реакция второго/но-рядка) были проведены Райхером [И], который, начиная с 1885 г., изучал сложные жирные эфиры К СООК с неразветвленными и разветвленными алкильными группами К и К. Эти исследования были расширены результаты изучения жирных эфиров Олсоном [12], Шкрабалом [13] и Киндлером [14] [c.940]
Омыление щелочью наиболее часто применяется для количественного определения содержания большинства сложных эфиров, в том числе и жиров, а также продуктов этерификации фенолов. Наибольшее влияние на реакцию омыления оказывают следующие факторы достаточная концентрация ионов гидроксила в растворе, хорошая растворимость анализируемого вещества во взятом растворителе и высокая температура реакции омыления. Сравнительно легко растворимые в воде сложные эфиры (как, например, этил-формиат, метилформиат, этилацетат и др.) могут быть омылены водными растворами щелочей. Сложные эфиры, плохо растворимые в воде, омыляют в спиртовой среде. Для этого пользуются спиртовыми растворами едкого кали или едкого натра. Можно прямо растворить сложный эфир в этиловом спирте, а затем прилить определенное количество водного раствора титрованной щелочи и омылить эфир. Спиртовые растворы едкого кали более предпочтительны вследствие хорошей растворимости едкого кали в спирте, особенно при получении его концентрированных растворов. Скорость омыления сложных эфиров различна. Она зависит от природы входящих в состав сложного эфира кислоты и спирта. В одних случаях реакция омыления протекает быстро даже при обычной комнатной температуре, в других [c.249]
Так как скорость омыления сложных эфиров приблизительно пропорциональна концентрации водородных или гидроксильных ионов, то, наоборот, измерением этой скорости пользуются для определенной концентрации ионов этот метод применяется, напр, для определения степени гидролиза у таких солей, как цианистый калий, углекислые щелочи и т. д., или же при определении количества водородных ионов кислых солей (напр., KHSOj). [c.115]
chem21.info
Скорость реакции омыления - Справочник химика 21
XIX.2. ОПРЕДЕЛЕНИЕ КОНСТАНТЫ СКОРОСТИ РЕАКЦИИ ОМЫЛЕНИЯ СЛОЖНОГО ЭФИРА [c.253]Константы скорости реакций омыления этилацетата различными [c.286]
Константа скорости реакции омыления этилацетата едким натром при 283 К равна 2,38, если концентрацию выражать в моль/л, а время — в минутах. Вычислите время, необходимое для омыления 50% этилацетата, если смешать при 289 К 1) 1 м 0,05 н. раствора этилового эфира уксусной кислоты с 1 м 0,05 н. NaOH 2) с 1 м 0,1 н. NaOH 3) с 1 м 0,04 и. NaOH. [c.334]
Константа скорости реакции омыления этилацетата едким натром при 9,4° С равна 2,37, а при 14,4° С составляет 3,204. Пользуясь уравнением (12), рассчитать константу скорости при 8° С. [c.345]Константа скорости реакции омыления этил-ацетата гидрооксидом бария [c.127]
Жиры омыляют водным раствором едкой щелочи. Практически жиры нерастворимы ни в воде, ни в водном растворе едкой Щелочи, поэтому реакция омыления сначала протекает на поверхности раздела с небольшой скоростью. Чтобы увеличить поверхность соприкосновения жира с раствором щелочи, нужны эмульгаторы. Таким эмульгатором служит само мыло, образующееся в начальный период омыления, специально добавленное или оставшееся в аппарате от предыдущей варки. Под действием острого пара или при энергичном перемешивании механической мешалкой образуется довольно стойкая эмульсия. С образованием эмульсии скорость реакции омыления значительно возрастает. Однако в сложном механизме омыления мыло является не только эмульгатором. Когда в реакционной массе накапливается примерно 10—15% (от веса жира) мыла, молекулы мыла начинают образовывать агрегаты (мицеллы). Мицеллы растворяют в себе жир и делают его растворимым в водном растворе щелочи. Процесс мицеллярного (коллоидного) растворения называется солюбилизацией. [c.130]
Таким образом, в этом случае ион гидроксила одновременно является и одним из исходных веществ, и катализатором. В табл. XII, 4 приведены константы скорости реакций омыления этилацетата в растворах гидроокисей некоторых металлов. Из таблицы видно, что константа скорости практически не зависит от начальной концентрации эфира и от химической природы >щелочи. [c.286]
Определить константу скорости реакции омыления при двух температурах. Вычислить энергию активации этой реакции [c.256]
Реакция проходит вдоль цепи по механизму замок молнии и обрывается при взаимодействии промежуточного продукта с водой. Авторы отрицают автокаталитический характер реакции омыления ПВА. Небольшую скорость реакции вначале процесса они объясняют медленной диффузией катализатора к эфирным группам, находящимся в полимерном клубке. Подобное предположение о влиянии конформации макромолекулы ПВА на скорость реакции омыления ранее высказывалось и в работах [80, 81]. [c.78]
Цель работы. Определение среднего значения константы скорости реакции омыления сложного эфира (например, метил-или этилацетата) водой [c.238]
Объясните, почему константа скорости реакции омыления этилацетата гидроксидом бария [c.132]
Цель работы. Определение среднего значения константы скорости реакции омыления метил- или этилацетата раствором едкой щелочи (МаОН или КОН) [c.240]
Омыление сложных эфиров — важнейшее йх химическое свойство. В присутствии кислот и щелочей оно протекает довольно легко. С наибольшей скоростью реакция омыления протекает в щелочной среде. [c.393]
Поверхность соприкосновения жиров, солюбилизированных в мицеллах мыла, получается значительно большей, чем в эмульсии, что соответственно приводит и к большей скорости реакции омыления. [c.131]
Результаты исследования кинетики щелочного алкоголиза ПВА в смесях различных растворителей также не позволили установить какие-либо корреляции межДу конформацией макромолекул полимера и скоростью реакции омыления [83]. Вместе с тем природа растворителей, добавляемых в реакционную смесь, оказывает значительное влияние на структуру частично гидролизованного ПВА. [c.79]
Введение в цепь сополимера звеньев этилена, не имеющих объемных заместителей и обладающих значительной свободой вращения вокруг связи С—С основной цепи, облегчает образование промежуточного комплекса [реакция (4.10)], чем и вызвано увеличение константы начальной скорости реакции. Об этом же свидетельствует и уменьшение энергии активации по мере роста содержания звеньев этилена в сополимере [90]. Однако суммарная скорость реакции омыления сополимеров ВА с этиленом значительно ниже скорости алкоголиза ПВА, что связано с уменьшением автокаталитического эффекта по мере сокращения последовательностей звеньев ВА в макроцепи. [c.90]
Скорость реакции омыления триглицеридов (нейтральных жиров) резко возрастает при наличии в массе 20% мыла и более. Это объясняется тем, что мыльный раствор такой концентрации довольно легко растворяет жиры. Благодаря этому увеличивается контакт между реагирующими веществами, что, как известно, ведет к ускорению реакции. Этот фактор имеет также существенное значение для организации непрерывного процесса варки мыла. [c.41]
Из рисунка видно, что в первый период (до образования начального количества мыла) процесс идет сравнительно медленно и кривая поднимается полого (участок 1). Этот этап соответствует эмульсионному периоду, когда скорость омыления зависит от образования устойчивой эмульсии. После омыления примерно 20% загруженных жиров, когда жиры растворяются в омыляемой массе, наступает второй этап — быстрое омыление, и кривая круто поднимается вверх (участок 2). К моменту, когда в реакцию вступает примерно 80—85 % всех жиров, скорость реакции омыления заметно уменьшается (участок 3). Это. происходит, во-первых, из-за снижения концентрации едкой щелочи и жира к этому мо- [c.41]
Уравнения (б) и (7) позволяют рассчитать скорость реакции омыления в вихревом слое и сравнить ее со скоростью превращения компонентов в известных реакторах. Так, по экспериментальным данным для приведенной выше реакции при 50°С и использовании никелевых частиц через 3 с после начала обработки в вихревом слое концентрация гидрата окиси лития составляет 5 от первоначального ее значения, т.е. С = 0,05 С , и согласно формуле (б) находим [c.52]
В ходе исследования было установлено, что начальная скорость реакции омыления растет с увеличением массовой доли едкого кали (рис. 1). Однако при использовании водного раствора КОН с массовой долей 40% уже через 30 мин от начала реакции [c.12]
Константа скорости реакции омыления уксусноэтилового эфира щелочью прн 283 К равна 2,38 мин- Х Xмоль- -л. Рассчитайте время половинног разложения эфира, еслн 1 л 0,05 н. раствора эфира смешать с I л 0,1 н. раствора щелочи. Реакция омыления эфира подчиняется кинетическому уравнению 2-го порядка. [c.69]
Скорость реакции омыления определяется концентрацией водородных ионов в реакционной среде и температурой. Очень важно, чтобы полимер получался в виде тонкодисперсного порошка, который может быть легко отделен и промыт. На степень дисперсности и характер агрегатного состояния осаждаемого полимера влияет величина модуля реакционной среды (отношение количества полимера к количеству растворителя) и интенсивность перемешивания. Чем больше модуль и чем интенсивнее перемешивание, тем выше дисперсность порошка. [c.297]
Скорость реакции омыления прямо пропорциональна концентрации каждого из реагирующих веществ. Именно поэтому целесообразно выбирать такой растворитель, в котором сложный эфир легко растворяется. В противном случае его концентрация во время реакции будет все время оставаться небольшой, особенно учитывая то, что переход сложного эфира в раствор взамен прореагировавшего также происходит медленно. [c.237]
На скорость реакции омыления влияют главным образом присутствие пространственно-трудных заместителей при углеро-дах, близких к карбоксильной и к карбонильной группам кислот и спиртов, образующих данный эфир. [c.160]
Константы скорости реакции омыления пропилового эфира уксусной кислоты щелочью при 283 и 293 К соответственно равны 2,15 и4ДЗ л-моль -с. Найдите энергию активации этой реакции. [c.130]
Аналогичным образом влияет на скорость реакции омыления и температура (рис. 4.7) изменяя ее, можно в достаточно широких пределах регулировать длительность процесса, что облегчает задачу получения частично омыленного ПВА заданного состава. [c.86]
Упраотение 2.2.38. Как изменится скорость реакции омыления по механизму Вас2 при переходе от метилового эфира уксусной кислоты к метиловым эфирам моно-хлоруксусной и дихлоруксусной кислот [c.413]
Скорость реакции омыления хлорангидридов будет возрастать прн ио-вын1ении температуры и увеличении растворимости хлорангидрида в воде. [c.112]
Таким образом, скорость реакции омыления в аппаратах вихревого слоя в сотни тысяч раз больше, чем в обычных варочных реакторах периодического действия, и в несколько десятков раз больше, чем в змвевиковых реакторах, используемых в непрерывных процессах. [c.53]
Скорость реакции омыления хлорангидридов будет возрастать при повышении температуры и увеличении растворимости хлорангидрида в воде. Поэтому эти факторы должны уменьшать молекулярный вес и выход полимеров в межфазной поликонденсации, что и наблюдается на самом деле, как это показали Фрунзе, Коршак, Курашев и Алиевский [83]. [c.26]
Катион основания не принимает участия в этом процессе. Чем больше концентрация гидроксил-ионов, т. е. чем сильнее основание, тем больше скорость реакции. Это было показано Райхером 3, который первый систематически изучал скорость реакций омыления. Он нашел следующие значения константы ско- [c.235]
СИ эфиров. Эти определения были выполнены по различиям в скоростях реакций омыления. Гаммет [41] приводит скорости реакций омыления некоторых эфиров в различных условиях [55, 56, 77, 90]. В табл. 33 даны константы скорости реакций омыления при 25° в водной среде для эфиров типа СНзСООК, КСООСНз, КСООСгНа и при 30° в 87,83% этиловом спирте для эфиров типа КСООСгНв. [c.202]chem21.info
Реакция - омыление - сложный эфир
Реакция - омыление - сложный эфир
Cтраница 2
Таким образом, порядок этой реакции в указанных условиях оказывается псевдопервым. По той же причине порядок реакции омыления сложных эфиров в избытке воды оказывается псевдопервым. Это свойство часто используют при исследовании кинетики химических процессов. [16]
К ним принадлежит большинство бимолекулярных реакций и некоторые тримолекулярные реакции. Примером реакции второго порядка может служить реакция омыления сложного эфира щелочью. [17]
Наряду с образованием нейтральных продуктов уплотнения и высокополимерных смол ( молекулярный вес 500), имеющих кислый характер, под действием щелочи идут реакции сложноэфирной конденсации и омыления, в результате которых образуются кислоты. При этом образование кислых веществ может быть только частично объяснено реакцией омыления сложных эфиров и нейтральных фенолов, содержавшихся в исходном сырье; основная же масса кислых веществ может быть получена лишь за счет сложноэфирной конденсации карбонильных соединений. [19]
Метод подстановки заключается в подстановке экспериментальных данных в уравнения кинетики реакции нулевого, первого, второго и третьего порядков и определении, которое из них приводит к постоянному значению константы скорости реакции. Если ни одно из них не дает такого результата, то реакция является сложной. В рассмотренном примере реакции омыления сложного эфира гидратом окиси натрия ( см. табл. 92) мы видели, как, применяя к экспериментальным данным уравнения кинетики реакций первого и второго порядков, можно было заключить, что данная реакция является реакций второго порядка. [20]
Наличие диффузионных процессов при реакциях в гетерогенных системах ( в случаях, когда константа скорости диффузии значительно больше константы скорости химической реакции) может привести к тому, что скорость химического превращения не будет зависеть от концентрации. Если убыль вещества, исчезающего в процессе реакции, достаточно быстро восполняется диффузией, то концентрация реагирующего вещества в зоне реакции будет оставаться практически постоянной, и реакция пойдет по нулевому порядку. Это может происходить, например, в реакции омыления сложного эфира в насыщенном эфиром водном растворе, находящемся §; равновесии с насыщенным раствором воды в эфире. Если скорость диффузии эфира из эфирного слоя в водный достаточно велика, а толщина водного слоя мала, то концентрация эфира, независимо от времени, будет равна концентрации насыщения снас. [21]
Страницы: 1 2
www.ngpedia.ru














