Содержание
Диэтиловый эфир, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
формула расчета, свойства и использование
В современной мире нужно постоянно развиваться, узнавать что-то новое, нельзя стоять на месте. Однако, по непонятным причинам, под развитием многие понимают только лишь погоню за моделями айфонов, освоение появляющихся и уже существующих социальных сетей, просмотр видеороликов (в большинстве случаев абсолютно бесполезных) или же изучение лишь определенной тематики. Едва ли многие не химики могут сказать, что такое серный эфир. Или рассказать о его свойствах. А кто знает, где применяется это вещество? Почему серный эфир называется именно так? К сожалению, ответить на все эти вопросы могут лишь единицы. Что же такое эфир в принципе? Какова формула, свойства и применение серного эфира?
Классы соединений под названием «Эфир»
Изначально все классы соединений, относящиеся к эфирам, так и назывались – эфиры, не было разделения на три группы, которые существуют на сегодняшний день:
- Простые эфиры — это класс соединений, в которых между двух углеводородных радикалов находится кислород, то есть, оба радикала имеют по связи с одним и тем же кислородом.
 Наиболее известным представителем этого класса является этиловый эфир.
Наиболее известным представителем этого класса является этиловый эфир. - Сложные эфиры — так называют производные карбоновых и минеральных кислот (так называемых оксикислот), у которых в молекуле вместо гидроксильной группы (-ОН) кислой функции находится спиртовой остаток. Безусловно, определение сложное и непонятное, общая формула таких соединений: R-C(=O)-R’. Представителями являются этилацетат, бутилбутират, бензилформиат.
- Полиэфиры — это класс высокомолекулярных соединений. Их получают в результате поликонденсации многоосновных кислот, то есть они содержат два атома и более водорода. Например, соляная кислота — HCl — одноосновная кислота, азотная — HNO3 — тоже. А вот серная — H2SO4 — и фосфорная — H3PO4 — многоосновные (серная — двухосновная, фосфорная — трех), как и их альдегиды с многоатомными спиртами (у этих спиртов две и более гидроксильных -ОН групп).
Что такое серный эфир?
Достоверно неизвестно где, когда, как и кем был впервые получен диэтиловый эфир.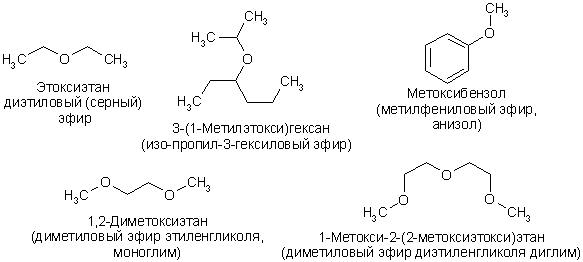 Причем здесь это вещество? Да просто у серного эфира несколько названий, в числе которых еще и этиловый. Этоксиэтан (еще одно название) — это простой эфир, молекула которого состоит из двух этильных групп (-С2Н5) и кислорода, с которым оба радикала (этильные группы) связаны. Доподлинно неизвестно, когда и кем был впервые получен – по этому вопросу имеется несколько точек зрения. Есть предположения, что в девятом веке Джабир ибн Хайян был первым, кто получил диэтиловый эфир. Но также возможно, что лишь в 1275 году каталанский миссионер Раймунд Луллий смог стать первопроходцем в области синтеза этоксиэтана. Относится вещество к алифатическим простым эфирам (то есть не имеет ароматических связей).
Причем здесь это вещество? Да просто у серного эфира несколько названий, в числе которых еще и этиловый. Этоксиэтан (еще одно название) — это простой эфир, молекула которого состоит из двух этильных групп (-С2Н5) и кислорода, с которым оба радикала (этильные группы) связаны. Доподлинно неизвестно, когда и кем был впервые получен – по этому вопросу имеется несколько точек зрения. Есть предположения, что в девятом веке Джабир ибн Хайян был первым, кто получил диэтиловый эфир. Но также возможно, что лишь в 1275 году каталанский миссионер Раймунд Луллий смог стать первопроходцем в области синтеза этоксиэтана. Относится вещество к алифатическим простым эфирам (то есть не имеет ароматических связей).
Способы получения
Название серного эфира тесно связан со способом получения, которым был освоен еще в средние века. Речь идет о перегонке этилового спирта и серной кислоты. Но название было дано этому веществу, точнее именно эфиром он назван, лишь в 1729 году.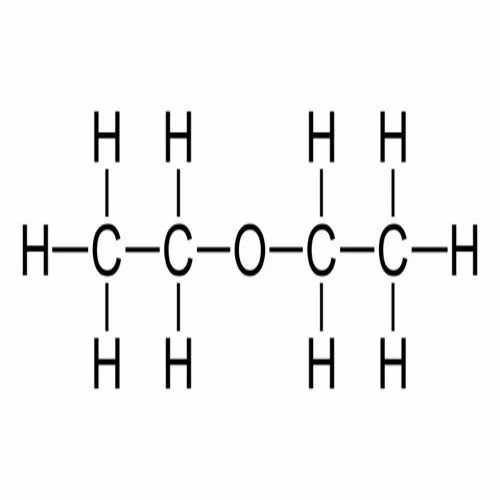 До этого момента можно встретить такое название как «сладкое купоросное масло» (раньше серную кислоту называли купоросным маслом).
До этого момента можно встретить такое название как «сладкое купоросное масло» (раньше серную кислоту называли купоросным маслом).
Однако это не единственный метод синтеза диэтилового эфира. Его можно получить в качестве побочного продукта в результате гидратации этилена в среде серной или фосфорной кислот. Основная часть диэтилового эфира образуется на стадии гидролиза сульфатов. Химическая формула серного эфира выглядит следующим образом: (С2Н5)2О. Систематическое название (по международной системе СИ) — 1,1-окси-бис-этан. Брутто-формула вещества — С4Н10О.
Физические свойства
Серный эфир является легколетучей жидкостью, которая очень подвижна. Он не имеет цвета, полностью прозрачен. У этой жидкости достаточно специфический запах и очень жгучий вкус. Диэтиловый эфир разлагается под воздействием света, влаги, воздуха. При нагревании он также разлагается, как и от вышеперечисленных факторов. В результате его разложения образуются достаточно токсичные вещества, которые оказывают раздражающее действие на дыхательные пути.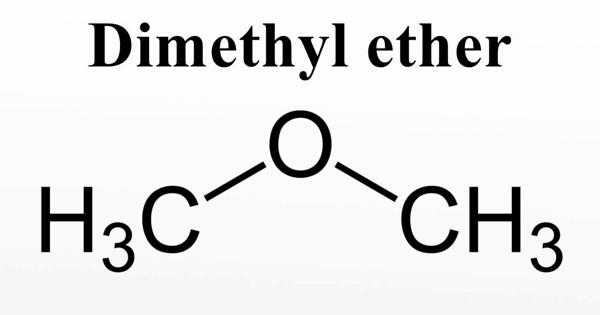
Этиловый эфир относится к легковоспламеняющимся жидкостям, его пары образуют с воздухом и кислородом взрывоопасные смеси. При взаимодействии с водой образует азеотропную смесь.
Серный эфир: свойства химические
Для диэтилового эфира, как представителя класса простых эфиров, характерны свойства этого класса соединений. В результате разложения образует альдегиды, пероксиды, кетоны. При взаимодействии с сильными кислотами образует оксониевые соли, которые являются весьма нестойкими соединениями. С кислотами Льюиса (химические соединения, которые являются акцепторами электронной пары), напротив, образует достаточно стабильные соединения. Смешивается с этиловым спиртом, бензолом в любых соотношениях.
Применение этоксиэтана
Существует две основные области применения этилового эфира: медицина (фармакология) и техника. С точки зрения действия на организм человека, диэтиловый эфир является общеанестезирующим веществом, то есть используется в качестве наркоза, обезболивающего. Во время проведения подготовительных операций для пломбирования (стоматологическая практика) используется местно «дырочек» в зубах от кариеса и корневого канала. Хирурги же применяют этоксиэтан в качестве ингаляционного наркоза: пациент вдыхает пары эфира, в результате воздействия которого центральная нервная система «обездвиживается». Такой эффект полностью проходит.
Во время проведения подготовительных операций для пломбирования (стоматологическая практика) используется местно «дырочек» в зубах от кариеса и корневого канала. Хирурги же применяют этоксиэтан в качестве ингаляционного наркоза: пациент вдыхает пары эфира, в результате воздействия которого центральная нервная система «обездвиживается». Такой эффект полностью проходит.
Нашел применение серный эфир и в качестве растворителя. Речь идет уже о технической области применения. Также может применяться в качестве теплоносителя, гораздо реже выступает в роли хладагента. В авиамодельных двигателях компрессионного типа используется как один из компонентов топлива.
Алкилсерные кислоты (сложные эфиры серной кислоты)
Алкилсерные кислоты являются одними из важнейших представителей сложных эфиров неорганических кислот (минеральных), которые имеют немаловажное значение в области синтеза органических соединений. Сложный эфир серной кислоты, формула общая этих соединений, представители наиболее значимые являются интересной темой для обсуждения.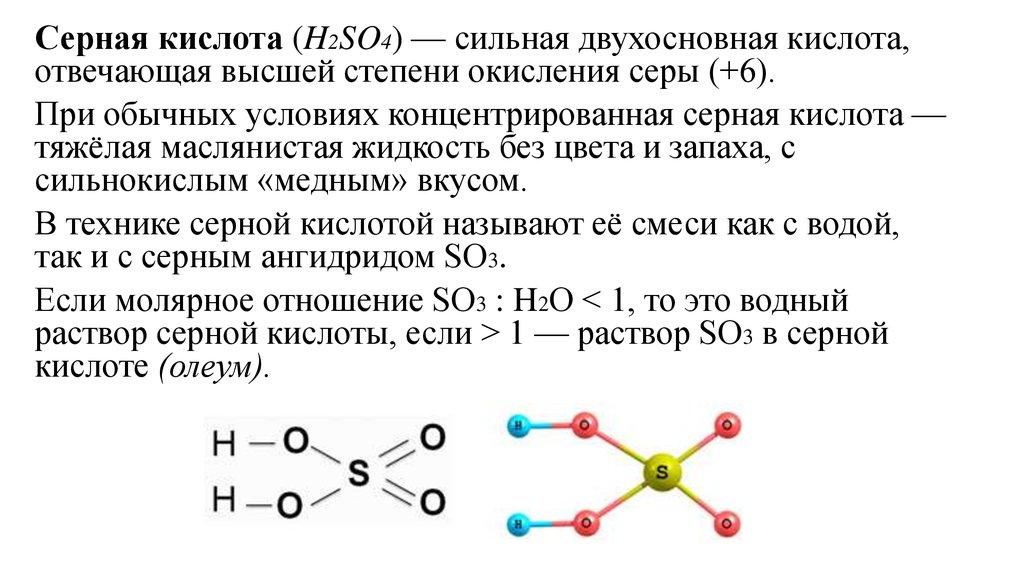 Итак, общая формула алкилсерных кислот выглядит следующим образом: R-CH2-O-SO2-OH. Эти вещества достаточно просто получить — они легко образуются при взаимодействии серной кислоты со спиртами. В ходе реакции также выделяется вода. Наиболее важными представителями этого класса соединений являются эфиры метилового (метилсерная кислота) и этилового (этилсерная кислота) спиртов.
Итак, общая формула алкилсерных кислот выглядит следующим образом: R-CH2-O-SO2-OH. Эти вещества достаточно просто получить — они легко образуются при взаимодействии серной кислоты со спиртами. В ходе реакции также выделяется вода. Наиболее важными представителями этого класса соединений являются эфиры метилового (метилсерная кислота) и этилового (этилсерная кислота) спиртов.
Выводы
Итак, серный эфир — это алифатический простой эфир, который представляет собой прозрачную, бесцветную жидкость со своеобразным запахом и жгучим вкусом. Получается из спирта этилового при воздействии на него кислот (в частности серной). Применяется в медицине и технике.
CDC — Карманный справочник NIOSH по химическим опасностям
Синонимы и торговые названия
Диэтиловый эфир, Диэтилоксид, Эфир, Этилоксид, Эфирный растворитель
Номер CAS
60-29-7
РТЭКС №
КИ5775000
DOT ID и руководство
1155 127
Формула
C₂H₅OC₂H₅
Преобразование
1 ч/млн = 3,03 мг/м 3
ИДЛХ
1900 частей на миллион [10% НПВ]
См. : 60297
: 60297
Пределы воздействия
NIOSH REL
См. Приложение D
OSHA PEL
TWA 400 частей на миллион (1200 мг/м 3 ) См. Приложение G
Методы измерения
НИОСХ 1610;
OSHA 7
См.: Методы NMAM или OSHA.
Физическое описание
Бесцветная жидкость с резким сладковатым запахом.
[Примечание: газ выше 94°F.]
Молекулярная масса
Точка кипячения
Точка замораживания
-177 ° F
Растворимость
Давление пара
440 мм рт. Ст.
Нижний предел взрываемости
Воспламеняющаяся жидкость класса IA: Fl.P. ниже 73°F и АД ниже 100°F.
Несовместимости и реакции
Сильные окислители, галогены, сера, соединения серы
[Примечание: имеет тенденцию образовывать взрывоопасные пероксиды под воздействием воздуха и света.]
Пути воздействия
вдыхание, проглатывание, контакт с кожей и/или глазами
Симптомы
раздражение глаз, кожи, верхних дыхательных путей; головокружение, сонливость, головная боль, возбуждение, наркоз; тошнота, рвота
Целевые органы
Глаза, кожа, дыхательная система, центральная нервная система
Средства индивидуальной защиты/санитарии
(См. коды защиты)
коды защиты)
Кожа: Предотвращать контакт с кожей
Глаза: Предотвращать попадание в глаза
Мытье кожи: Нет рекомендаций
Удалить: Во влажном состоянии (огнеопасно)
Изменение: Нет рекомендации
Первая помощь
(См. процедуры)
Глаза: Немедленно промыть
Кожа: Быстро смыть водой
Дыхание: Респираторная поддержка
Проглотить: Немедленная медицинская помощь
Рекомендации по использованию респираторов
OSHA
До 1900 частей на миллион :
(APF = 10) Любой респиратор с химическим картриджем и картриджем(ами) для защиты от органических паров*
(APF = 50) Любой воздухоочистительный полнолицевой респиратор (противогаз) с подбородочной канистрой, устанавливаемой спереди или сзади от органических паров
(APF = 25) Любой приводной респиратор для очистки воздуха с органическими парами картридж(и)*
(APF = 10) Любой респиратор с подачей воздуха*
(APF = 50) Любой автономный дыхательный аппарат с полнолицевой маской
Аварийный или плановый вход в неизвестные концентрации или условия IDLH:
( APF = 10 000) Любой автономный дыхательный аппарат с полной лицевой маской, работающий в режиме «давление-требование» или в другом режиме положительного давления
(APF = 10 000) Любой респиратор с подачей воздуха, который имеет полнолицевую маску и работает в режиме «давление-требование» или в другом режиме с положительным давлением в сочетании со вспомогательным автономным дыхательным аппаратом с положительным давлением
Побег:
(APF = 50) Любой очищающий воздух полнолицевой респиратор (противогаз) с установленным на подбородке баллончиком для органических паров спереди или сзади
Любой подходящий автономный дыхательный аппарат спасательного типа
Важная дополнительная информация о выборе респиратора
Смотрите также
ВВЕДЕНИЕ
КАРТА ICSC: 0355
МЕДИЦИНСКИЕ ИССЛЕДОВАНИЯ: 0095
Диэтиловый эфир | Подкаст | Chemistry World
Мира Сентилингам
На этой неделе мы идем на войну с Майклом Фримантлом, который зажигает искры
Майкл Фримантл
Когда я говорю людям, что пишу о химии Первой мировой войны, они часто предполагают, что меня интересует только химическое оружие. Я объясняю, что отравляющие газы были не единственными химическими веществами, использовавшимися на войне. Взрывчатые вещества также являются химическими веществами. Кроме того, что не менее важно, химия играла решающую роль в уходе за больными и ранеными.
Я объясняю, что отравляющие газы были не единственными химическими веществами, использовавшимися на войне. Взрывчатые вещества также являются химическими веществами. Кроме того, что не менее важно, химия играла решающую роль в уходе за больными и ранеными.
Я указываю, например, что морфин, встречающееся в природе химическое вещество, широко использовался в качестве болеутоляющего в пунктах оказания помощи раненым и в военных госпиталях. Войска дезинфицировали окопы и туалеты хлорной известью, химическим веществом, также известным как хлорная известь. Карболовая кислота, настойка йода и другие антисептики широко применялись для профилактики и лечения инфекций. И, наконец, хирурги применяли хлороформ, закись азота или диэтиловый эфир, все химические соединения, в качестве общих анестетиков при ампутации конечностей и проведении других операций.
Источник: © Shutterstock
Многие из этих соединений имеют долгую историю. Не более, чем диэтиловый эфир.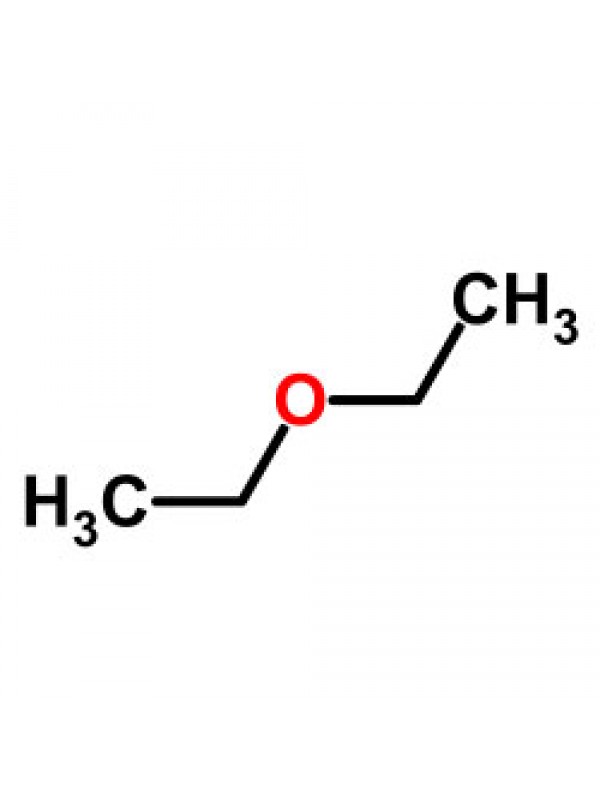 Эту летучую бесцветную жидкость со сладковатым запахом часто называют просто эфиром. Слово «эфир» восходит к 49025- векам до нашей эры, когда греческий философ Аристотель предложил добавить эфир в качестве пятого элемента к четырем классическим элементам: земле, воде, воздуху и огню. Он предположил, что эфир был небесным элементом, из которого состоят звезды и планеты.
Эту летучую бесцветную жидкость со сладковатым запахом часто называют просто эфиром. Слово «эфир» восходит к 49025- векам до нашей эры, когда греческий философ Аристотель предложил добавить эфир в качестве пятого элемента к четырем классическим элементам: земле, воде, воздуху и огню. Он предположил, что эфир был небесным элементом, из которого состоят звезды и планеты.
Давайте теперь перенесемся в 16 век нашей эры. В 1540 году немецкий ботаник и фармацевт Валериус Кордус осуществил первый синтез эфира. Он сделал это, добавив серную кислоту в этанол, метод, который до сих пор используется для приготовления жидкости.
Чуть более трех столетий спустя, в октябре 1846 года, два американца публично продемонстрировали использование диэтилового эфира в качестве хирургического ингаляционного анестетика. Это был дантист Уильям Мортон, который вводил анестезию, в то время как хирург Джон Коллинз Уоррен удалял опухоль из челюсти бессознательного пациента Эдварда Гилберта Эбботта. Они провели операцию в Массачусетской больнице общего профиля в Бостоне. После операции Эббот очнулся и заявил, что не чувствует боли.
Они провели операцию в Массачусетской больнице общего профиля в Бостоне. После операции Эббот очнулся и заявил, что не чувствует боли.
Во время Первой мировой войны диэтиловый эфир использовался в качестве анестетика либо сам по себе, либо в сочетании с другим анестетиком, таким как хлороформ. Он также использовался в качестве антисептика в начале 1900-х годов.
В феврале 1915 года лондонский хирург Герберт Уотерхаус сообщил в British Medical Journal , что он часто использовал эфир в качестве антисептика в течение более пяти лет. Он описал использование антисептика для лечения пациентов, поступивших в больницу с тяжелыми септическими огнестрельными ранениями и различными другими септическими повреждениями.
В одном случае молодой бык пронзил старого фермера и разорвал его от середины задней части бедра до уровня выше таза. Хирург увидел его через пять дней и заметил, что кто-то приложил к огромной ране припарку с патокой. Он заметил, что:
«Его рана была зеленоватого цвета и чрезвычайно зловонная».
У фермера была высокая температура, его пульс был слабым и прерывистым, и он бессвязно бормотал.
‘Повернув его лицом, я влил эфир в длинную, глубокую, бороздчатую рану и дал ему выкипеть, заполняя бороздку по мере испарения эфира в течение нескольких минут. Таким образом, было использовано около пинты эфира. Затем я неплотно забинтовал рану стерильной марлей, смоченной эфиром, и распорядился протирать рану эфиром два раза в день. В течение двадцати четырех часов состояние больного было всем, чего можно было желать, и рана быстро зажила». для широкого спектра веществ, включая жиры, масла, воски и, в частности, форму нитроцеллюлозы, известную как коллодий. Коллодий был ключевым компонентом Cordite RDB, одного из нескольких типов кордита, использовавшихся британцами в качестве топлива во время войны. Производственный процесс включал растворение коллодия и другого взрывчатого вещества, нитроглицерина, в смеси диэтилового эфира и этанола.
Источник: © Shutterstock
В настоящее время диэтиловый эфир широко используется для различных целей.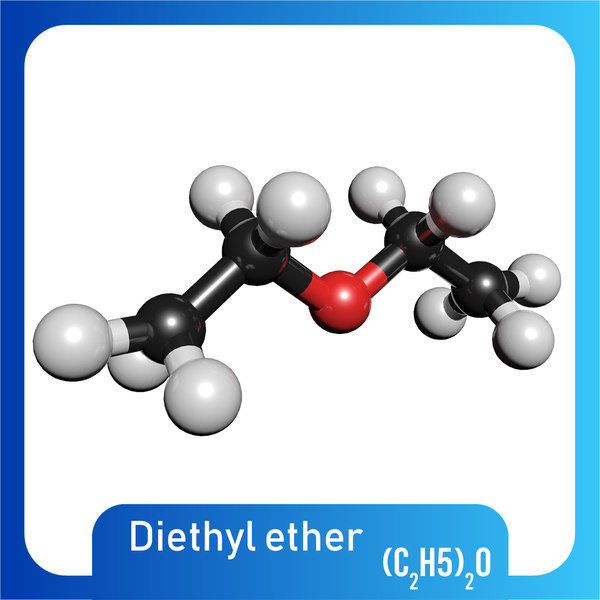

 Наиболее известным представителем этого класса является этиловый эфир.
Наиболее известным представителем этого класса является этиловый эфир.