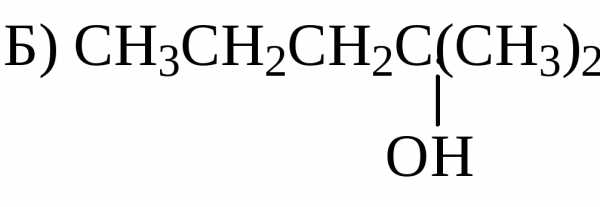Алкилирование и ацилирование по Фриделю-Крафтсу. Реакционная способность простых эфиров образование оксониевых солей
Оксониевые соли, образование - Справочник химика 21
Образование оксониевых солей. [c.136]Образование аммониевых и оксониевых солей может происходить также внутри-молекулярно (см., например, в аминокислотах — стр. 350). Этот процесс может быть выражен в электронных формулах аналогично тому, как это было сделано выше для случая простых аммониевых солен [c.160]
Из реакций подлинности наиболее характерной для димедрола является реакция образования окрашенных оксониевых солей с концентрированными кислотами. Так, при действии на димедрол концентрированной серной кислоты образуется оксо-ниевая соль от желтого до кирпично-красного цвета. [c.198]
С кислотами или их солями и даже с водой, оксониевые соли распадаются с образованием простого эфира и алкилированного аниона [c.128]Обратная реакция — дезалкилирование эфиров фенолов — достигается длительным их нагреванием с концентрированными галогеноводородными кислотами, безводными гидрохлоридами и гидробромидами пиридина или с хлоридом алюминия в присутствии хлороводорода. Дезалкилирование проходит через промежуточное образование оксониевых солей по схеме [c.262]
Простые эфиры являются в общем очень устойчивыми соединениями. Большинство алифатических эфиров растворяется в концентрированной соляной кислоте с образованием оксониевых солей. Соли распадаются при разбавлении водой эту особенность можно использовать для выделения простых эфиров из смесей. Арилалкильные эфиры дают оксониевые соли только с концентрированной серной кислотой, причем частично идет и сульфирование ароматического ядра. [c.317]
Оксониевые соли подобны аммониевым, но в отличие от последних менее устойчивы и легко разлагаются в присутствии воды. Образование оксониевых солей используется в фармацевтическом анализе, например, для идентификации димедрола так как некоторые оксониевые соли окрашены (см. реакции идентификации димедрола). [c.195]
Образование оксониевых солей. Простые эфиры растворяются в сильных кислотах, таких как серная, хлорная, соляная или иоди- [c.334]
Тенденция к образованию оксониевых солей падает в ряду от ди-алкиловых эфиров через алкилариловые эфиры к диариловым эфирам, так что последние уже не вступают в эту реакцию. [c.335]
Образование галогенопроизводного из оксониевой соли может проходить по механизму как 5 1, так и 5у2 [c.105]
Реакция синтетического изопренового каучука марки СКИ-3 с хлористым водородом в растворе при температурах от О до 70°С протекает по уравнению второго порядка относительно каучука и хлористого водорода (рис. 1.1), а энергия активации реакции гидрохлорирования составляет 52,5 кДж/моль [117]. Второй порядок реакции по хлористому водороду, по-видимому, обусловлен тем, что взаимодействие молекул НС1 с каучуком идет ступенчато — вначале присоединяется ион Н+, а потом ион С1 . Большая зависимость скорости реакции от концентрации хлористого водорода, чем от концентрации каучука, объясняется, по-видимому, определяющей ролью процесса образования нейтральной ионной пары [117]. Как одно из доказательств участия протона в первой медленной стадии реакции можно рассматривать сильное влияние на скорость гидрохлорирования электрофильных растворителей, связывающих протон с образованием оксониевых солей (рис. 1.2). Растворитель не только ионизирует молекулы хлористого водорода, он влияет также на конформацию молекулярной цепи исход- [c.19]
На схеме 5.3 приведен механизм реакций элиминирования, сопутствующих в кислой и щелочной средах гидролитической деструкции а-эфирной связи. В качестве модели рассматриваются превращения димерной единицы типа В, хотя те же закономерности аналогичны. для других димерных эфиров А, С, Л, а также структуры Е. В кислой среде реакция начинается протонированием кислорода а-эфирной группы с образованием нестойкой оксониевой соли IV- , которая, распадаясь, превращается в карбкатион 1У-2. Последний, захватывая молекулу воды, образует соответствующий бензиловый спирт, а выбрасывая р-протон, - виниловый эфир V- [c.222]
Независимо от того, содержит ли соединение свободный или алкилированный фенольный гидроксил, в кислой среде превращение начинается протонированием бензильной спиртовой или эфирной группировки с образованием оксониевой соли V- В результате последующего разрыва Са—0-связи получаются молеку- [c.138]
Получение антоцианов из растений основывается на образовании оксониевых солей, растворимых в спиртовых растворах и ледяной уксусной кислоте и осаждаемых избытком эфира. Этим свойством хлоридов антоцианов пользуются и для их синтеза. [c.245]
Халконы и ауроны цианидиновой реакции не дают, ио при бавлении концентрированной НС1 (без магния) образуют крась окрашивание за счет образования оксониевых солей. [c.86]
Существует большое количество продуктов присоединения диоксана [17] в этом отношении диоксан значительно отличается от алифатических эфиров, которые, как правило, образуют неустойчивые аддукты. Образование продуктов присоединения 1,4-диоксана может быть объяснено в большинстве случаев образованием оксониевых солей. Две эфирные связи, симметрично расположенные в шестичленном кольце, проявляют основные свойства, причиной чего является именно симметричное расположение этих связей. Поэтому основность атома кислорода в диэтиловом эфире очень слаба диэтиловый эфир образует продукты присоединения, которые, однако, очень неустойчивы. Тот факт, что 1,3-диоксан не проявляет солеобразующих свойств, может быть объяснен теми же причинами. [c.7]
Простые эфиры — слабые нейтральные п-основания (см. 4.4.1). )ни растворяются в концентрированных минеральных кислотах ш счет образования нестойких оксониевых солей, легко гидролизующихся избытком воды. [c.155]
По аналогии с сульфитированием модельных соединений I и II авторы полагают, что реакция протекает по механизму через катионы XIV- и Х1 -2 Последний при взаимодействии с бисуль-фит-ионом превращается в сульфокислоту XV Затем происходит поворот вокруг связи Ср—с замыканием цикла и образованием сульфокислоты XVI Альтернативным этому механизму может быть 2-замещение, при котором бисульфит-ион атакует Са-атом оксониевой соли Х1У-1, что также приводит к сульфокислоте XV [c.200]
Эти интереснейшие реакции использованы, конечно, в первую очередь для синтеза ранее неизвестных настояпщх третичных оксониевых солей. Образование алкоксиалкильных эфиров борной кислоты (КОСН20Н20)зВ имеет лишь подчиненный интерес. [c.68]
Согласно другим представлениям реакция начинается с присоединения одного протона серной кислоты к атому кислорода спирта (образование оксониевой соли) затем ион -ОЗОзИ отщепляет протон от второго углеродного атома спирта, после чего (с одновременным выделением воды) образуется олефин [c.60]
H I. В таком же порядке уменьшается сила кислоты и нуклеофильность соответствующего аниона. Взаимодействие спиртов с иодистоводородной и бромистоводородной кислотами протекает легко. В реакцию с H I легко вступают лишь третичные спирты и арилкарбинолы. Взаимодействию спиртов иного строения с НС1 способствует добавление безводного хлорида цинка, который повышает реакционную способность как спирта, так и H I. Получить фториды, действуя на спирты фтористоводородной кислотой, не удается реакция останавливается на стадии образования оксониевой соли. [c.105]
Алкилгалогениды можно алкилировать простыми эфирами или кетонами, что приводит к образованию оксониевых солей в том случае, если присутствуют очень слабый отрицательно заряженный нуклеофил, который может выступать противоионом, и кислота Льюиса, которая может связывать Х [588]. Типичная методика состоит в обработке алкилгалогенида эфиром или кетовом в присутствии AgBp4 или AgSbFa. Ион серебра служит для связывания Х , а ВР4- или SbPe становится противоионом. Согласно другому методу, алкилгалогенид обрабатывают комплексом, образующимся при взаимодействии кислородсодержащего соединения и кислоты Льюиса, например R2O—BFa-f RF- RaO+BF,-, однако наилучшие результаты этот метод дает, если в одной молекуле присутствуют атомы кислорода и галогена так, что образуется циклический оксониевый ион. Простые эфиры и оксониевые ионы также вступают в реакции обмена [c.136]
Спирты обладают чрезвычайно слабыми кислыми свойствами, слабее, чем у воды. Они не окрашивают лакмус в красный цвет практически не взаимодействуют с водными растворами щелочей, однако со щелочными металлами дают алкоголяты, легко разлагающиеся водой. Спирты можно рассматривать и как очень слабые основания, так как они могут протонизироваться за счет неподеленной электронной пары атома кислорода и таким образом могут образовывать оксониевые соли. Практически протонизацию с образованием непрочного оксоние-вого катиона приходится учитывать в качестве промежуточной стадии реакций спиртов в кислой среде. В первом приближении все же спирты можно считать нейтральными соединениями (особенно в отличие от фенолов, которым ОН-груцпа придает кислой характер). [c.38]
Так как скорость таких реакций лимитируется стадией распада оксониевой соли с образованием карбкатиона, она зависит от строения алкильной группы. Труднее всего дезалкилируются метиловые эфиры и гораздо легче — бензиловые. [c.262]
В синтезах кетонов требуется больше хлористого алюминия, чем в реакциях алкилирования, так как этот реагент образует с кислородсодержащими соединениями комплексы оксониевых солей. Так, если хлористый бензоил и хлористый алюминий смешать в эквивалентных количествах и нагревать или кипятить в растворе сероуглерода, то они соединяются, образуя кристаллическое комплексное соединение, которое, подобно хлористому алюминию, существует в растворе в димерной форме (Коулер, 1900). На схеме, изображающей предполагаемый механизм образования комплекса и последующего его взаимодействия, соли алюминия представлены в виде мономерных молекул, в действительности же они имеют удвоенный молекулярный вес. Хлористый [c.173]
Таким образом, для образовиния комплекса требуется один эквивалент хлористого алюминия. Если ацилирующим средством служит ангидрид кислоты, то хлористый алюминий необходимо брать в количестве, достаточном для образования оксониевой соли с обеими карбонильными группами. [c.174]
Электростатическое взаимодействие семиполярных связей соседних молекул, очевидпо, способствует ассоциации в жидкО М состоянии. Нитросоединения тяжелее воды и практически нерастворимы в ней, если не содержат групп, способствующих растворению. Благодаря образованию оксониевых солей они растворяются в холодной концентрированной серной кислоте обычно без изменения. Технический нитробензол, три-нитробензол и тринитротолуол всегда окрашены в желтый цвет, но хи-мическп чистые вещества бесцветны. [c.198]
При взаимодействии тре/и-бутилового спирта с серной кислотой не удается выделить ци-трет-бутиловый эфир. Это не означает, что данный эфир не образуется тем не менее выделить его не удается По-видимому, возникает протонированная оксониевая соль эфира, но она значительно менее устойчива, чем г/гретга-бутил-катион. Этот катион может превращаться в тре/ге-бутилсерную кислоту и полиизобутилен, чем и объясняется образование основного продукта реакции. (Полимеризация изобутилена обсуждалась в разд. 8.8.) [c.442]
Кроме того общеизвестно, что этиловый эфир легко растворяется с разогреванием в концентрированных соляной или серной кислотах,— явление, которое следует отнести за счет образования оксониевых солей. Твердые кристаллические галоидные соли этилового эфира описали Арчибальд и Мак Интош (там же). Гидробромид (С2Н5)20 -г НВг плавится при - 40" , гидроиодид — при —18 . [c.118]
Соли фенантрофеиазоксония Фенантренхинон конденсируется с о-аминофенолами с образованием псевдооснований, превращающихся при действии кислот в соответствующие оксониевые соли. [c.150]
Фейет отметил, что 2,б-диметил-7-пирон не дает фенилгидразона, а двой- ные связи его не восстанавливаются цинком в ледяной уксусной кислоте.. Эти факты в дальнейшем были подтверждены на многих производных у-пирст ов, Фейст отметил также, что водные растворы 2,6-диметил-7-пирона имеют нейтральную реакцию. Поэтому явилось неожиданным открытие и выделение хорошо образованных кристаллических продуктов присоединения большого числа неорганических и органических кислот к 2,6-диметил-7-пирону [79], В этих соединениях 1 моль пирона был связан с одним эквивалентом кислоты, и такие продукты присоединения, по аналогии с солями у-пиридона, рассматривались как оксониевые соли (V, К = Н) [80]. В то время представление о четырехвалентном кислороде было новым, однако в литературе можно было найти значительное число примеров таких соединений, например диметилового эфира с хлористым водородом [81] или цинеола с хлористым и бромистым водородом (VI) [82]. Строение этих соединений могло быть объяснено лишь в случае допущения существования четырехвалентного. кислорода [c.288]
При расчетах с помощью ПММО, несомненно, завышается доля структуры Vlr, но здесь важно было подчеркнуть, что у соединений со свободным фенольным гидроксилом карбоний-катион —это, по существу, хинонметид в протонированной форме, а тогда оче- V видно, что независимо от того, алкилирован или нет фенольный гидроксил, в кислой среде наряду с оксониевой солью V6 речь может идти об образовании только одной промежуточной частицы — карбоний-катиона VI Для образования истинного хинонметида VIII необходимые предпосылки создаются в щелочной среде благодаря ионизации фенольного гидроксила [c.139]
При повторной атаке протоном теперь уже кислорода метилольной группы стильбена XIV-2 образуется оксониевая соль XIV-3 и затем карбоний-катион XIV-4, в котором по механизму аллильной перегруппировки происходит замыкание цикла с образованием фенилкумарана XIV-5, и, наконец, атака протоном метиленовой группы последнего завершает цепь превращений XIV в XV Модельное соединение XlVa с алкилированным фенольным гидроксилом при ацидолизе ведет себя аналогично [c.164]
Вторая стадия процесса начинается атакой катализатора на кислород тетрагидрофуранового цикла, смежного с ароматическим кольцом А В результате сначала возникает оксониевая соль ХХП1-1 а затем происходит раскрытие цикла с образованием карбоний-катиона ХХП1-2 Последний атакует положение 6 ароматического кольца В и, таким образом, образуется новая углерод-углеродная связь, характерная для стабильной циклолигнановой структуры [c.171]
chem21.info
Алкилирование и ацилирование по Фриделю-Крафтсу
В фенольном ряду эти реакции имеют некоторые особенности, связанные с тем, что фенолы образуют комплексы с кислотами Льюиса и дальнейшая реакция алкилирования не происходит.
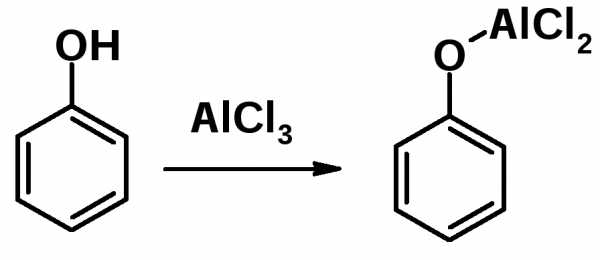
Поэтому сначала проводят О-алкилирование фенола, затем С-алкилирование или ацилирование по Фриделю-Крафтсу, после чего регенерируют ОН-группу.
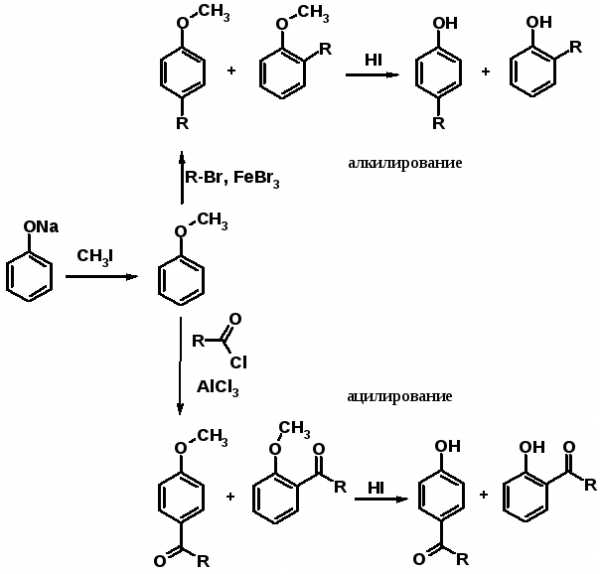
Известный индикатор – фенолфталеин – продукт ацилирования фенола фталевым ангидридом.
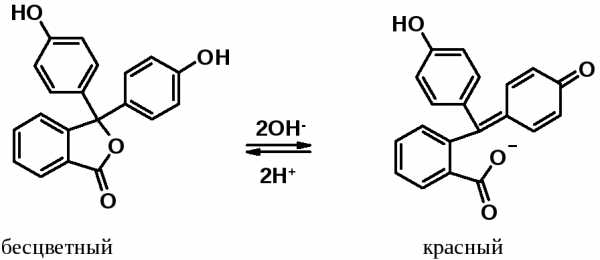
Активирующие свойства гидроксильной группы в фенолах столь велики, что позволяют осуществлять превращения, невозможные в бензольном ряду.
Карбоксилирование (реакция Кольбе-Шмитта)
Фенолят-анионы способны вступать в реакцию ароматического электрофильного замещения со столь слабым электрофилом как оксид углерода IV(углекислый газ).
Реакция Кольбе-Шмитта промышленный метод получения салициловой кислоты, предшественника широко распространенного лекарства – ацетилсалициловой кислоты (аспирина).
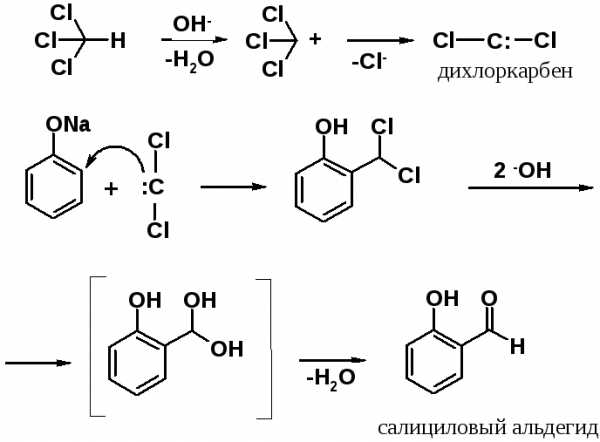
Формилирование (реакция Раймера-Тимана)
Нагревание фенола с хлороформом в присутствии щелочи приводит к введению в орто-положение бензольного кольца альдегидной группы. Электрофилом в этой реакции является дихлоркарбен (:ССl2), образующийся при взаимодействии хлороформа со щелочью. Далее проходит обычная реакцияSEAr. В условиях реакции дихлорбензильное производное гидролизуется, затем отщепляет молекулу воды, превращаясь в альдегид.
Лекция № 29 Простые эфиры.
Диалкиловые эфиры. Классификация, изомерия, номенклатура. Физические свойства. Химические свойства: образование оксониевых солей, расщепление кислотами, автоокисление. Получение межмолекулярной дегидратацией спиртов и действием алкилгалогенидов на алкоголяты. Получение и применение в синтезе краун-эфиров. Виниловые эфиры. Получение, гидролиз и причины легкости его протекания, полимеризация.
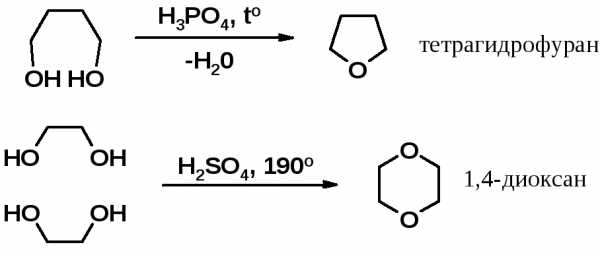
Простые циклические эфиры. Эпоксисоединения: получение, реакции с водой, спиртами, галогеноводородами, аммиаком и аминами, реактивами Гриньяра. Тетрагидрофуран, диоксан.
Токсикологические свойства и техника безопасности при работе с простыми эфирами.
Тиоаналоги спиртов, фенолов и эфиров.
Общая характеристика, номенклатура. Получение алкилтиолов реакцией алкилирования сероводорода и его солей. Получение арентиолов восстановлением аренсульфонилхлоридов. Физические свойства тиолов, полярность связи S-H. Кислотные свойства тиолов, реакции алкилирования и окисления. Диметилсульфоксид. Тиоэфиры (сульфиды), их получение, физические свойства. Реакции алкилирования и окисления тиоэфиров. Токсичность бис(2-хлорэтил)сульфида. Техника безопасности при работе с органическими соединениями серы. Антидоты.
Простые эфиры
Простыми эфирами называют соединения общей формулы R-O-R’, гдеRиR’ углеводородные радикалы. Простые эфиры бывают алифатическими, ароматическими, смешанными, симметричными и несимметричными, а также циклическими.
Получение
Некоторые способы получения эфиров: межмолекулярной дегидратацией спиртов, синтезом Вильямсона в спиртах и фенолах и присоединением спиртов к алкинам были рассмотрены ранее.
Часто используют методы, которые можно назвать «модифицированными синтезами Вильямсона», заключающиеся во взаимодействии алкоксид аниона с алкилирующими агентами. К наиболее распространенным алкилирующим агентам относятся диметилсульфат и эфиры пара-толуолсульфокислоты.
Эфиры могут быть получены также получены присоединением спиртов к алкенам в присутствии кислот Льюиса при нагревании и повышенном давлении.
Получение оксиранов см. раздел «Алкены». Пяти- и шестичленные циклы с эфирным кислородом получают внутримолекулярной дегидратацией 1,4- или 1,5-диолов, соответственно.
Свойства простых эфиров весьма ограничены. Их очень часто используют в качестве растворителей (например, при получении реактивов Гриньяра). Избыток электронной плотности на эфирном кислороде приводит к появлению нуклеофильных и основных свойств. Основность простых эфиров очень мала, оксониевые соли образуются исключительно в безводной среде и устойчивы только при пониженных температурах.
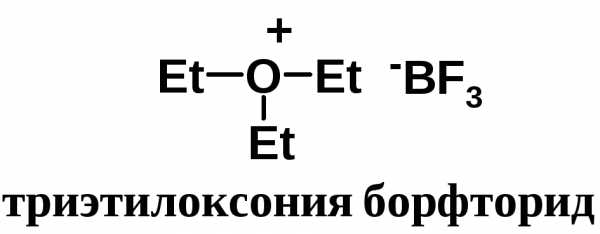
Алкиловые эфиры образуют устойчивые комплексы с кислотами Льюиса. Комплексы с трифторидом бора используют для получения борфторида триэтилоксония – очень мощного алкилирующего агента. С его помощью алкилируют соединения с самой низкой реакционной способностью.
Основность эфиров проявляется в способности избирательно образовывать комплексы с металлами. С этой целью используют макроциклические полиэфиры – краун-эфиры (англ. crown– корона).

Использование краун-эфиров позволяет растворять в неполярных органических растворителях высокополярные неорганические вещества и проводить невозможные в других условиях реакции.
studfiles.net
Оксониевые соли органических кислот и их эфиров
Качественное наблюдение, что простые эфиры ведут себя по отношению к льюисовским кислотам как основания, почти так же старо, как и сама органическая химия [277]. Были выделены оксониевые соли эфиров [252] и тщательно изучены их физические свойства. При этом оказалось, что протон координирован с эфирным атомом кислорода. Некоторые криоскопические исследования [134, 196] свидетельствуют о том, что алифатические простые эфиры, за исключением некоторых, имеющих электроотрицательные заместители, полностью протонируются концентрированной серной кислотой. Ароматические простые эфиры обычно слишком плохо растворимы, и поэтому их очень трудно исследовать криоскопически, а быстрое расщепление их серной кислотой делает практически невозможным точное измерение /-факторов в этой среде. [c.246] Оксониевые соединения. Многие окиси (и перекиси) способны образовывать с другими веществами продукты присоединения (соединения высшего порядка). Это свойство присуще в первую очередь воде оно выражается в образовании ею многочисленных гидратов. Но и многие другие кислородные соединения проявляют способность к присоединению Среди неорганических соединений это в первую очередь гидроокиси (и перекись водорода), среди органических — спирты, эфиры, альдегиды и кетоны. Эти кислородные соединения могут присоединяться как к солям металлов, так и к кислотам. Например [c.748]Из трех групп примеров первого типа экстракции, приведенных в табл. 22, в процессах переработки ядерного топлива важ ную роль играет только образование оксониевой соли. Этот вид экстракции имеет место в системах, где в качестве компонента участвуют сильные минеральные кислоты, но все же другие типы экстракции имеют более важное значение в процессах выделения металлов. Образование оксониевой соли происходит при наличии кислоты и органического растворителя, содержащего кислород. Хорошим примером является высокая растворимость сильной азотной или серной кислоты в диэтиловом эфире образующаяся соль может быть выражена формулой [c.108]
При исследовании превращений простых виниловых эфиров нами было установлено, что каталитическая роль многих кислых реагентов (кислот и их солей) сводится к образованию оксониевых комплексов с исходными виниловыми эфирами [35J. В дальнейшем, совместно с М. Г. Воронковым, было расширено получение оксониевых соединений винилового ряда и показана их каталитическая роль в реакциях присоединения галоидов, органических монокарбоновых кислот, спиртов, а также в реакциях нолимеризации [351. [c.765]
Органические кислоты реагируют с триэтилоксонийборфторидом таким образом, что вначале образуются нестабильные оксониевые соли этих кислот, которые затем нреврагдаются в сложные эфиры [82] [c.34]
Фейет отметил, что 2,б-диметил-7-пирон не дает фенилгидразона, а двой- ные связи его не восстанавливаются цинком в ледяной уксусной кислоте.. Эти факты в дальнейшем были подтверждены на многих производных у-пирст ов, Фейст отметил также, что водные растворы 2,6-диметил-7-пирона имеют нейтральную реакцию. Поэтому явилось неожиданным открытие и выделение хорошо образованных кристаллических продуктов присоединения большого числа неорганических и органических кислот к 2,6-диметил-7-пирону [79], В этих соединениях 1 моль пирона был связан с одним эквивалентом кислоты, и такие продукты присоединения, по аналогии с солями у-пиридона, рассматривались как оксониевые соли (V, К = Н) [80]. В то время представление о четырехвалентном кислороде было новым, однако в литературе можно было найти значительное число примеров таких соединений, например диметилового эфира с хлористым водородом [81] или цинеола с хлористым и бромистым водородом (VI) [82]. Строение этих соединений могло быть объяснено лишь в случае допущения существования четырехвалентного. кислорода [c.288]
Третьим важным фактором, определяющим гидратацию кислот в органической фазе, является характер и прочность связи Н — А. В результате образования водородной связи И...НА состояние связи Н — А будет меняться по-разному у разных кислот. У одних кислот связь Н — А может ионизироваться уже при слабых взаимодействиях, у других — при очень сильных. Предсказание такой ионизации пока невозможно. Вполне очевидно, что образование оксониевых катионов и в связи с этим ионных пар в органическом растворе будет способствовать гидратации оксониевой соли, причем, чем больше основность реагента, тем сильнее должна быть гидратация кислоты. Третий фактор действует противоположно второму. Путем полного анализа соответствующих фаз в системах 0,1 М раствор ТБФ в ССЬ— НС1 — НаО и 0,1 М раствор ДБЭБФ в I4 — H I — Н2О мы установили, что во второй системе содержание гидрата соляной кислоты в органической фазе в 3—5 раз превышает его содержание в первой системе. Это объясняется увеличенной основностью дибутилового эфира бутилфосфнновой кислоты. [c.54]
Оксониевые соединения широко используются в органическом синтезе с целью введения алкильных остатков (метильных, этиль-ных и др.) в органические соединения. Высокоэффективным алки-лирующим средством являются трифторбораты триалкилоксония, открытые Г. Мейервейном в 1937 г. По одному из методов они получаются взаимодействием галогеноалкилов с простыми эфирами в присутствии серебряной соли борфтороводородной кислоты. [c.135]
Вклад Байера в проблемы таутомерии и строения ароматических соединений действительно замечателен. В 1901 г. Байер совместно с Вил-лигером приступил к исследованиям соединений /келезо- и железистосинеродистой, кобальтосинеродистой, фосфорновольфрамовой и платинохлористоводородной кислот с органическими кислотами и их эфирами, спиртами, альдегидами, кетонами, простыми и смеи[апными эфирами и т. д. Байер пришел к выводу, что оксониевые соли (теорию которых в 1899 г. предложили Колли и Тиле) по своей природе подобны солям аммония и что кислород в них четырехвалентен. [c.289]
Образование оксониевых солей не ограничивается одним только диметилпироном. Байер и Виллигер показали, что все классы органических кислородсодержащих соединений, как спирты, альдегиды, сложные и простые эфиры и пр., обладают способностью давать соединения с такими комплексными кислотами, как желе-зистосинеродистоводородная кислота может быть и здесь также образуются оксониевые соли. [c.310]
chem21.info
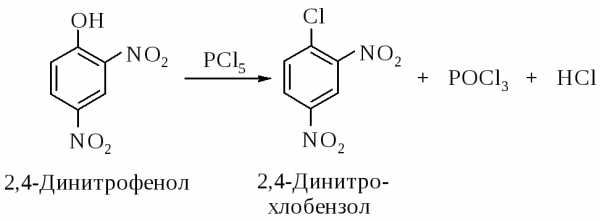
2.2.4. Замещение гидроксигруппы в нитрофенолах
Связь атома кислорода с атомом углерода ароматического кольца обладает высокой прочностью из-за сопряжения неподеленной электронной пары кислорода с -электронами кольца. Фенолы в отличие от спиртов не превращаются в арилгалогениды при нагревании с галогенводородными кислотами и при действии галогенидов фосфора. Только фенолы, содержащие нитрогруппы в орто- или пара-положениях к гидроксильной группе, взаимодействуют с РСl5.
2.2.5. Окисление
Фенолы чувствительны к действию окислителей. Под действием хромовой кислоты фенол и гидрохинон окисляются до п-бензохинона, а пирокатехин до о- бензохинона.
Резорцин (м-дигидроксифенол), а также фенолы сложного строения окисляются с образованием сложных смесей в результате димеризации и диспропорционирования.
Фенолы, содержащие разветвленные алкильные группы в орто-положении к группе ОН, применяют в качестве антиоксидантов, стабилизаторов полимерных материалов. Такие фенолы легко образуют очень устойчивые (малореакционноспособные) радикалы, вызывая тем самым обрыв радикально-цепных окислительных реакций.
2.2.6. Восстановление
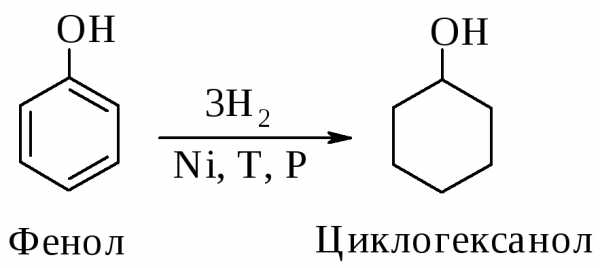
Фенолы гидрируются водородом над никелевым катализатором в соответствующие циклогексанолы. В значительных количествах в промышленности гидрированием фенола получают, в частности, циклогексанол, применяемый в производстве полимерных материалов, например полиамида «найлон-6,6» (см. п. 10.2).
2.3. Способы получения
2.3.1. Взаимодействие хлорбензола с водным раствором едкого натра при повышенной температуре и давлении
2.3.2. Разложение гидропероксида кумола водным раствором кислоты (реакция Сергеева-Удриса)
2.3.3. Щелочной плав сульфонатов
2.3.4. Гидролиз солей диазония
3. ПРОСТЫЕ ЭФИРЫ
Простыми эфирами называются соединения общей формулы R-О-R, R-О-Ar. Если оба радикала одинаковы, эфир называют симметричным; если радикалы разные – несимметричным.
Низшие простые эфиры называют по радикально-функциональной номенклатуре.
Простые эфиры сложного строения рассматривают как алканы или арены, в которых атом водорода замещен алкоксидной группой – алкоксиалканы или алкоксиарены:
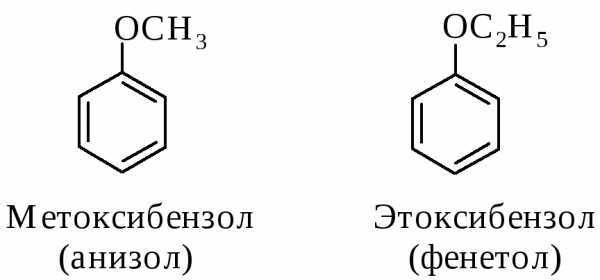
Для некоторых ароматических эфиров часто применяют и тривиальные названия (даны в скобках)
3.1. Физические свойства
Простые эфиры являются бесцветными жидкостями (кроме диметилового эфира, который в нормальных условиях является газообразным) и имеют своеобразный запах.
Простые эфиры имеют более низкие температуры кипения, чем спирты, так как в эфирах отсутствуют межмолекулярные водородные связи. По той же причине простые эфиры (кроме диметилового эфира) плохо растворимы в воде.
Простые эфиры менее полярны, чем спирты, их дипольный момент составляет (4,0-4,3)∙10-30 Кл∙м.
3.2. Химические свойства
Простые эфиры отличаются низкой реакционной способностью. Они устойчивы к действию сильных оснований, восстановителей и разбавленных кислот. В частности, эфиры не вступают в реакции с NaOH/Н2О, Ch4MgI, Na, LiAlh5. Химическая инертность простых эфиров обусловливает их широкое применение в качестве растворителей в химических реакциях.
Основность. Простые эфиры являются довольно слабыми основаниями и плохими нуклеофилами. Простые эфиры взаимодействуют с концентрированной серной кислотой, превращаясь при низкой температуре в кристаллические оксониевые соли.

Диэтиловый эфир используют в качестве растворителя в синтезах Гриньяра.
Расщепление галогеноводородными кислотами. Разрыв связи углерод-кислород происходит только в жестких условиях – при нагревании с концентрированными галогеноводородными кислотами НХ:
HI > НВг > НС1
реакционная способность уменьшается
Реакция представляет собой нуклеофильное замещение в протониро-ванном эфире, более реакционноспособном, чем нейтральная молекула эфира (сравните с реакцией замещения в спиртах).

Реакция протекает по механизму SN1 или SN2 в зависимости от строения алкильных групп. Реакции расщепления эфиров, содержащих первичные и вторичные алкильные группы, протекают по механизму SN2. Простые эфиры, содержащие третичную алкильную группу, расщепляются преимущественно по механизму SN1.
Расщепление эфира может протекать и одновременно по двум механизмам - SN1 и SN2, что приводит к смеси двух алкилгалогенидов и двух спиртов.
Расщепление арилалкиловых эфиров Ar-O-Alk всегда протекает только по связи ArO-Alk с образованием алкилгалогенида и фенола.
Примеры:
Реакции бимолекулярного нуклеофильного замещения
Реакции мономолекулярного нуклеофильного замещения
Окисление кислородом воздуха. Пероксиды. Простые эфиры на свету медленно окисляются кислородом воздуха с образованием гидропероксидов, которые со временем превращаются в полимерные пероксиды (автоокисление).
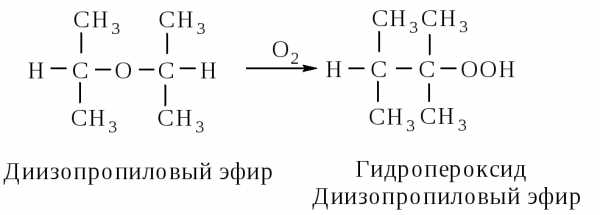
Гидропероксиды и пероксиды неустойчивы, легко взрываются. Поэтому перед применением эфиров в реакциях, в том числе, в качестве растворителей, их очищают от указанных примесей. В случае умеренного содержания пероксидов в эфире его энергично встряхивают с алюмогидри-дом лития или с водным раствором сульфата железа (II). При этом пероксиды разрушаются, а эфир становится пригодным для перегонки.
studfiles.net
Простые эфиры - PharmSpravka
Простые эфиры можно рассматривать как продукты замещения атома водорода в гидроксиле спирта радикалом (R).
Этот способ используется чаще в лабораторных условиях для получения смешанных эфиров (с разными радикалами).
Полученный любым способом эфир очищают от примесей, сушат путем настаивания с обезвоженными солями и перегоняют при определенной температуре.
Однако следует учитывать, что простые эфиры в отличие от сложных способны легко окисляться даже кислородом воздуха до перекисных соединений, которые представляют большую
опасность при перегонке эфиров и могут служить причиной: взрывов. Конечным продуктом окисления медицинского эфира является перекись этилидена, которая и вызывает взрыв.
Поэтому прежде чем перегонять эфир или определять его температуру кипения, следует провести испытание на перекис-ные соединения.
Характерным свойством простых эфиров является их способность образовывать оксониевые соли с концентрированными; кислотами. Это обусловлено тем, что у кислорода простого эфира имеются две пары свободных электронов, которые притягивают к себе протон кислоты.
Оксониевые соли подобны аммониевым, но в отличие от последних менее устойчивы и легко разлагаются в присутствии воды. Образование оксониевых солей используется в фармацевтическом анализе, например, для идентификации димедрола,. так как некоторые оксониевые соли окрашены (см. реакции идентификации димедрола).
Из простых эфиров фармакопейными препаратами являются эфир медицинский (диэтиловый эфир) и димедрол.
28.06.2015
www.pharmspravka.ru
Оксония соли - Справочник химика 21
Такие соединения имеют свойства солей, причем солеобразование происходит у атома кислорода поэтому их называют солями оксо-н и я . И действительно, между солями аммония и солями оксония существует большая аналогия, находящая свое выражение не только в способах образования этих соединений, но и во многих их свойствах. [c.151]Такой четырехковалентный азот реализуется, например, в солях аммония. Аналогичен ему трехковалентный кислород иона оксония, образование которого из нейтрального атома описывается схемой 0(2s 2p ) + ЗЫ ккал = 0- (25 2р ) + е. Энергия возбуждения валентного состояния в данном случае меньше, чем у азота, но все же очень велика. [c.229]
Какова структурная формула соединения iH,oO, если известно, что оно реагирует с металлическим натрием только при нагревании, образуя в качестве одного и) продуктов иодистый метил, не взаимодействует с уксусной кислотой, с H I образует не галогенпроизводное, а соль оксония С найденной структурой напишите все указанные реакции. [c.47]Простые эфиры. Соли оксония. Эфиры неорганических кислот [c.250]
В кислой среде спирты являются основаниями более сильными, чем вода, или такими же. В среде минеральных кислот они, так же как и другие кислородные соединения, образуют сравнительно устойчивые соли оксония. [c.230]
Алкилирование солями оксония [c.176]
Для серной кислоты известно несколько кристаллогидратов, состав которых показан на рис. У1П-19. Из них Н 30 -2И О 3 более бедный водой представляет со-гг п " бой соль оксония Нз0+Н80". Так как [c.338]
Спирт, как основание, способен принимать на одну из свободных электронных пар атома кислорода протон кислоты. Образуется так назьшаемый оксониевый ион, который с анионом хлора дает оксоние-вую соль (по аналогии с аммоншевой солью) [c.28]
В комплексных нонах аммония, оксония и сульфопня все координационные группы свя.чаны с центральным атомом одинаково (посредством электронной пары). Однако в то время как в молекулах a (миaкa и эфира один из двух электронов связывающей пары принадлежит центральному атому, а другой — связанному с ни,м заместителю, при образовании аммониевого или оксопневого комплекса центральный атом дает оба электрона, необходимых для связи с вступающим в соединение протоном. Координационный центр, следовательно, является донором электронов, и это находит отражение в формуле в виде стрелки, изображающей новую связь и указывающей направление смещения электронов при ее образовании необходимо, однако, помнить, что в уже получившейся соли все четыре связи ато.ма N равноценны. [c.160]
Тетрагидроксоцинкат(П) калия растворяют в воде и добавляют разбавленную серную кислоту (по каплям до избытка катионов оксония). Что Вы будете наблюдать в этом опыте Как называются проявляемые в протекающей реакции свойства соединений цинка(И) Почему при растворении исходной соли в воде может выпасть осадок Каков его состав [c.126]
В промышленности свободный водород получают элек1 1)олн-зом воды или водных растворов кислот, солей или щелочей. В лаборатории водород получают взаимодействием более нк тивных, чем он сам, восстановителей с катионами оксония или с водой (в щелочной среде) [c.197]
Атом кислорода амидов алкилируется солями оксония и образуются соли Ы-алкилиминоэфиров (алкоксиметиленими-ниевые соли) [608]. Затем такие ионы можно обработать различными нуклеофилами. Например, их можно восстановить до аминов с помощью боргидрида натрия или превратить в ами-дины действием вторичных аминов [609]. Эта реакция хорошо [c.140]
Спирты обладают чрезвычайно слабыми кислыми свойствами, слабее, чем у воды. Они не окрашивают лакмус в красный цвет практически не взаимодействуют с водными растворами щелочей, однако со щелочными металлами дают алкоголяты, легко разлагающиеся водой. Спирты можно рассматривать и как очень слабые основания, так как они могут протонизироваться за счет неподеленной электронной пары атома кислорода и таким образом могут образовывать оксониевые соли. Практически протонизацию с образованием непрочного оксоние-вого катиона приходится учитывать в качестве промежуточной стадии реакций спиртов в кислой среде. В первом приближении все же спирты можно считать нейтральными соединениями (особенно в отличие от фенолов, которым ОН-груцпа придает кислой характер). [c.38]
При растворении в воде сильно разогревается, образуя оксоние-вую соль [c.260]
Особый интерес представляют аналогичные катионам щелочных металлов комплексные ионы аммония (NHj"), оксония (0H ) и фторония (FH ). Устойчивость этих ионов по приведенному ряду быстро уменьшается в то время как соли аммония весьма многочисленны, солей оксония известно уже значительно меньше, а производные фторония в индивидуальном состоянии вообще не выделены и способны, по-видимому, существовать лишь в жидком фториде водо]зода. [c.478]
Наиболее своеобразной является способность т-пиронов об-разовывать с сильными кислотами соли по типу оксониевых (так называемые соли пироксония). В этом случае соли оксония получаются путем присоединения иона водорода к различным кислородным соединениям (за счет свободной пары электронов атома кислорода) реакция идет подобно образованию солей аммония. [c.607]
На снособиости простых эфиров давать соли оксония основаны способы расщепления простых эфиров иод действием бромистоводородной или йодистоводородной кислоты, а также трнгалогенидов бора. [c.922]
Процесс, определяющий скорость реакции, предшествует перегруппировке D том случае, когда ил солн китрония (XIX) [W] образуется соль оксония (XX). Соль XIX должна перегруппироваться в соединение XX, прежде чем произойдет бекманонская перегруппировка. [c.12]
ОКСбНИЕВЫЕ СОЕДИНЁНИЯ (оксониевые соли, соли оксония), содержат положительно заряженный атом кислорода, связанный ковалентно с орг. остатками и(или) водородом и ионной связью с анионом. [c.364]
chem21.info
3. Материалы для самоподготовки к усвоению данной темы.
Вопросы для самоподготовки
1. Номенклатура спиртов, фенолов, эфиров и их тиоаналогов.
2. Классификация спиртов и фенолов.
3. Химические свойства одно-, двух- и трехатомных спиртов: образование алкоголятов, сложных эфиров; внутри- и межмолекулярная дегидратации; замещение на галоген; окисление.
4. Химические свойства фенолов: реакции по гидроксильной группе; реакции по ароматическому кольцу фенолов.
5. Реакционная способность простых эфиров: образование оксониевых солей, расщепление эфирной связи.
6. Реакционная способность тиоаналогов спиртов и простых эфиров – тиоспиртов и тиоэфиров: образование тиолятов, сульфониевых солей, дисульфидов.
4. Вид занятия: практическое занятие.
5. Продолжительность занятия: 2 академических часа.
6. Оснащение рабочего места:
6.1 Посуда и приборы:
| Штатив с пробирками, пипетки, спиртовка, спички, держатель для пробирок. | на группу |
6.2. Объекты исследования:
| Глицерин, 1% раствор фенола, этанол. | на группу |
6.3. Реактивы:
| 3% Раствор CuSO4, 10% раствор NaOH, 3% раствор FeCl3, 10% раствор Н2SO4, 10% раствор K2Cr2O7. | на группу |
7. Содержание занятия
7.1. Образец билета входного контроля
1. Межмолекулярная дегидратация спиртов происходит при следующих условиях
1) h3SO4(конц), t = 170ºC;
2) h3SO4(конц), t = 140ºC;
3) Сu, t;
4) h4PO4, 300ºC.
2. Установите соответствие.
Алкен, образующийся в результате дегидратации спирта
| |
|
|
3. Простым эфиром, тиолом, спиртом являются соответственно
1) Ch4OC2H5, Ch4SC2H5, Ch4OH;
2) Ch4COOC2H5, C2H5SH, Ch4OH;
3) Ch4OC2H5, C2H5SH, Ch4OH;
4) Ch4COOC2H5, Ch4SC2H5, Ch4OH.
4. Простые эфиры образуются при
1) Межмолекулярной дегидратации спиртов;
2) Внутримолекулярной дегидратации спиртов;
3) Окислении тиолов;
4) Взаимодействии моногалогеналканов с щелочью.
5. В результате бромирования фенола преимущественно образуется
1) 2-бромфенол;
2) 4-бромфенол;
3) 2,6-дибромфенол;
4) 2,4,6-трибромфенол.
7.2 Узловые вопросы, необходимые для усвоения темы занятия
1. Химические свойства одно-, двух- и трехатомных спиртов: образование алкоголятов, сложных эфиров; внутри- и межмолекулярная дегидратации; замещение на галоген; окисление.
2. Химические свойства фенолов: реакции по гидроксильной группе; реакции по ароматическому кольцу фенолов.
3. Реакционная способность простых эфиров: образование оксониевых солей, расщепление эфирной связи.
4. Реакционная способность тиоаналогов спиртов и простых эфиров – тиоспиртов и тиоэфиров: образование тиолятов, сульфониевых солей, дисульфидов.
7.3 Лабораторная работа
Опыт 1. Реакция на многоатомные спирты
В пробирку поместите 4-5 капель 3% сульфата меди, а затем 1 мл 10% раствора NaOH. Добавьте 0,1 мл глицерина и встряхните. Осадок растворяется, и раствор приобретает ярко-синий цвет за счет образования хелатного соединения. Напишите схему реакций.
Опыт 2. Реакция на фенолы
В пробирку с 1-2 мл 1% раствора фенола добавьте 1-2 капли 3% раствора хлорида железа (III). Появляется характерное фиолетовое окрашивание фенолята железа. Напишите схему реакции.
Опыт 3. Окисление спирта хромовой смесью
Описанная ниже реакция окисления этанола используется для экспресс-анализа на содержание алкоголя в организме человека.
В пробирку поместите 0,5 мл этанола, 4-5 капель 10% раствора серной кислоты и 0,5 мл 10% раствора дихромата калия. Полученный раствор имеет оранжевую окраску. Реакционную смесь нагрейте над пламенем горелки. Через несколько секунд оранжевый цвет раствора начнет приобретать синевато-зеленную окраску (одновременно ощущается характерный запах антоновских яблок). Напишите уравнение реакции окисления спирта.
studfiles.net