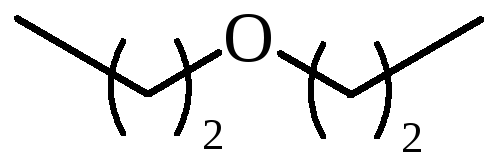
Чем отличаются простые эфиры от сложных. Простые эфиры
свойства, получение, применение :: SYL.ru
Органические соединения, образующиеся в результате реакции друг с другом двух молекул спирта, - это простые эфиры. Связь образуется через кислородный атом. В ходе реакции отщепляется молекула воды (h3O), при этом друг с другом взаимодействуют два гидроксила. По номенклатуре симметричные эфиры, то есть состоящие из одинаковых молекул, допускается называть тривиальными названиями. Например, вместо диэтилового - этиловый. Название соединений с разными радиклами строят по алфавиту. По этому правилу метилэтиловый эфир будет звучать верно, наоборот - нет.
Структура
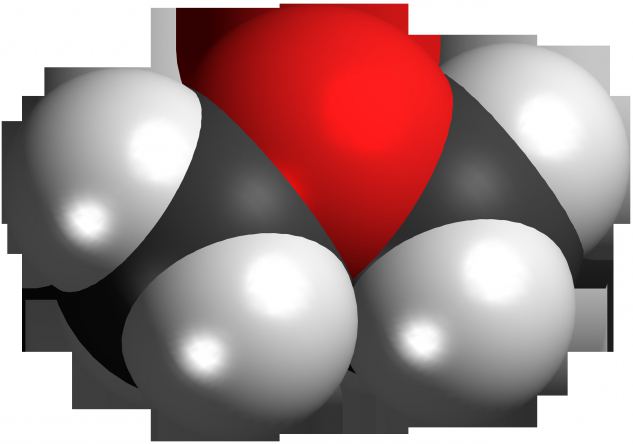
В связи с многообразием спиртов, вступающих в реакцию, при их взаимодействии могут образоваться существенно отличающиеся по своей структуре простые эфиры. Общая формула структуры данных соединений выглядит так: R-O-R´. Буквы «R» обозначают радикалы спиртов, то есть, проще говоря, всю остальную углеводородную часть молекулы, кроме гидроксила. Если у спирта таких групп больше одной, то он может образовывать несколько связей с разными соединениями. Молекулы спиртов могут также иметь в своей структуре циклические фрагменты и вообще представлять полимеры. Например, при взаимодействии целлюлозы с метанолом и/или этанолом образуются простые эфиры. Общая формула данных соединений при реакции одинаковых по структуре спиртов выглядит так же (см. выше), но убирается знак дефиса. Во всех остальных случаях он означает, что радикалы в молекуле простого эфира могут быть различными.
Циклические эфиры
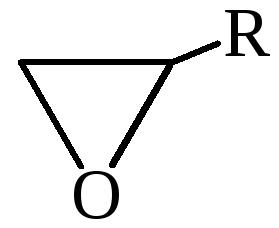
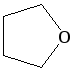
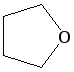
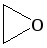
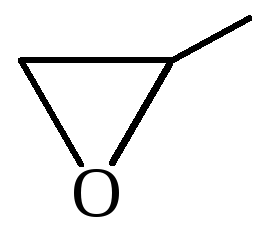
Особая разновидность простых эфиров – циклические. Наиболее известными среди них являются оксиэтан и тетрагидрофуран. Образование простых эфиров данной структуры происходит в результате взаимодействия двух гидроксилов одной молекулы многоатомного спирта. В результате формируется цикл. В отличие от линейных эфиров, циклические способны в большей степени образовать водородные связи, и поэтому они менее летучи и лучше растворимы в воде.
Свойства простых эфиров
В физическом плане простые эфиры представляют собой летучие жидкости, но есть достаточно много и кристаллических представителей.

Данные соединения плохо растворимы в воде, и многие из них обладают приятным запахом. Есть одно качество, благодаря которому в лабораториях в качестве органических растворителей активно используют простые эфиры. Химические свойства данных соединений достаточно инертны. Многие из них не подвергаются гидролизу – обратной реакции, происходящей с участием воды и приводящей к образованию двух молекул спирта.
Химические реакции простых эфиров в основном осуществимы только при высокой температуре. Например, при нагреве до температуры выше 100 оС метилфениловый эфир (C6H5-O-Ch4) взаимодействует с бромоводородной (HBr) или йодоводородной кислотой (HI) с образованием фенола и бромметила (СН3Br) или йодметила (СН3I), соответственно.

Таким же образом могут реагировать многие представители данной группы соединений, в частности метилэтиловый и диэтиловый эфир. Галоген, как правило, присоединяется к более короткому радикалу, например:
- С2Н5-O-СН3 + HBr → СН3Br + С2Н5OH.
Другой реакцией, в которую вступают простые эфиры, является взаимодействие с кислотами Льюиса. Таким термином называют молекулу или ион, который является акцептором и соединяется с донором, имеющим неподеленную пару электронов. Так, в качестве таких соединений могут выступать фторид бора (BF3), хлорид олова (SnCI4). Взаимодействуя с ними, эфиры образуют комплексы, называемые оксониевыми солями, к примеру:
- C2H5-O-Ch4 + BF3 → [C2H5-O(+)-Ch4]-B(-)F3.
Способы получения простых эфиров

Получение простых эфиров происходит разными путями. Один из способов заключается в дегидратации спиртов с использованием в качестве водоотнимающего средства концентрированной серной кислоты (h3SO4). Реакция протекает при 140 оС. Таким способом получают только соединения из одного спирта. Например:
- С2Н5ОН + h3SO4 → С2Н5SO4Н + Н2O;С2Н5SO4Н + НОС2Н5 → С2Н5–О–С2Н5 + h3SO4.
Как видно из уравнений, синтез диэтилового эфира протекает в 2 ступени.
Другой способ синтеза простых эфиров происходит по реакции Вильямсона. Суть ее заключается во взаимодействии алкоголята калия или натрия. Так называются продукты замещения протона гидроксильной группы спирта на металл. Например, этилат натрия, изопропилат калия и прочее. Вот пример данной реакции:
- СН3ONa + С2Н5Cl → СН3–О–С2Н5 + KCl.
Эфиры с двойными связями и циклические представители

Как в других группах органических соединений, среди простых эфиров обнаруживаются соединения с двойными связями. Среди способов получения данных веществ есть особые, не характерные для насыщенных структур. Заключаются они в использовании алкинов, по тройной связи которых происходит присоединение кислорода и образование виниловых эфиров.
Учеными описано получение простых эфиров циклической структуры (оксиранов) с использованием способа окисления алкенов надкислотами, содержащими вместо гидроксильной группы перекисный остаток. Данная реакция также проводится под действием кислорода в присутствии серебряного катализатора.
Применение простых эфиров

Применение простых эфиров в лабораториях заключается в активном использовании данных соединений в качестве химических растворителей. Популярным в этом плане является диэтиловый эфир. Как и все соединения данной группы, он инертен, не реагирует с растворяемыми в нем веществами. Температура его кипения составляет чуть более 35 оС, что удобно при необходимости быстрого упаривания.
В простых эфирах легко растворяются такие соединения, как смолы, лаки, красители, жиры. Производные фенола применяются в косметической промышленности в качестве консервантов и антиоксиданстов. Кроме того, эфиры добавляются в моющие средства. Среди данных соединений обнаружены представители, обладающие выраженным инсектицидным действием.
Циклические эфиры сложной структуры применяются при получении полимеров (гликолида, лактида, в частности), используемых в медицине. Они выполняют функцию биосорбируемого материала, который, например, используется для шунтирования сосудов.
Эфиры целлюлозы применяются во многих сферах человеческой деятельности, в том числе в процессе реставрации. Их функция заключается в проклеивании и укреплении изделия. Они применяются при восстановлении бумажных материалов, живописи, тканей. Существует особая методика, заключающаяся в опускании ветхой бумаги в слабый (2%) раствор метилцеллюлозы. Эфиры данного полимера являются устойчивыми к действию химических реагентов и экстремальных условий окружающей среды, негорючи, поэтому применяются для придания прочности каким-либо материалам.
Некоторые примеры использования конкретных представителей эфиров

Простые эфиры применяются во многих областях человеческой деятельности. Например, в качестве добавки к моторному маслу (диизопропиловый эфир), теплоносителя (дифенилоксид). Кроме того, данные соединения используются как промежуточные продукты для получения лекарств, красителей, ароматических добавок (метилфениловый и этилфениловый эфиры).
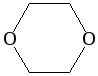
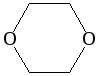
Интересным эфиром является диоксан, отличающийся хорошей растворимостью и в воде, и позволяющий смешивать данную жидкость с маслами. Особенность его получения заключается в том, что две молекулы этиленгликоля соединяются друг с другом по гидроксильным группам. В результате образуется шестичленный гетероцикл с двумя атомами кислорода. Он образуется под действием концентрированной серной кислоты при 140 оС.
Таким образом, простые эфиры, как и все классы органической химии, отличаются большим разнообразием. Их особенностью является химическая инертность. Связано это с тем, что, в отличие от спиртов, они не имеют атома водорода у кислорода, поэтому он не является столь активным. По этой же причине простые эфиры не образуют водородные связи. Именно вследствие таких свойств они способны смешиваться с различного рода гидрофобными компонентами.
В заключение хотелось бы отметить, что диэтиловый эфир применяется в экспериментах по генетике для усыпления мух дрозофил. Это лишь малая часть того, где используются данные соединения. Вполне возможно, что на основе простых эфиров в будущем изготовят ряд новых прочных полимеров с улучшенной структурой по сравнению с существующими.
www.syl.ru
Простые эфиры | Химия онлайн
Простыми эфирами называют органические вещества, в которых два углеводородных радикала связаны атомом кислорода: R'–O–R", где R' и R" — различные или одинаковые радикалы.
Простые эфиры могут быть предельными, непредельными, циклическими, ароматическими.
предельные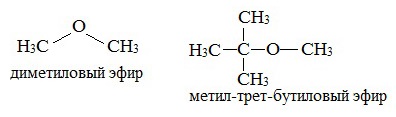
непредельные 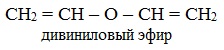
ароматические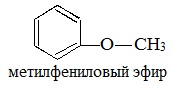
циклические 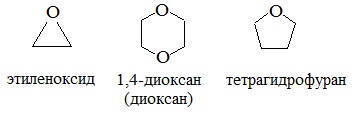
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений строятся из названий радикалов (в порядке возрастания молекулярной массы) и слова «эфир». Например, Ch4-O-Ch4 - диметиловый эфир; C2H5-O-Ch4 - метилэтиловый эфир.
Физические свойства
Два первых простейших представителя – диметиловый и метилэтиловый эфиры – при обычных условиях газы, все остальные – жидкости.
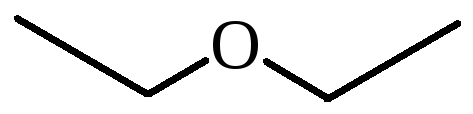
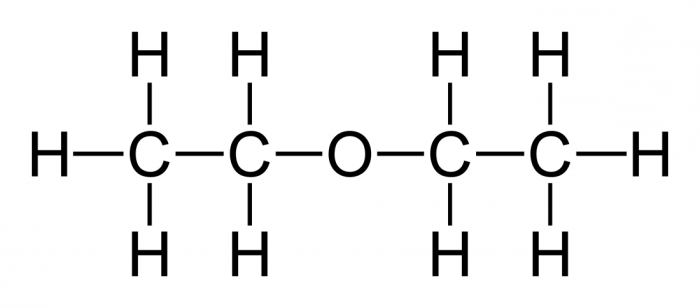
Диэтиловый эфир (C2H5-O-C2H5)– бесцветная легкокипящая прозрачная жидкость (t кип. 35,5 °С), малорастворимая в воде. С этиловым спиртом смешивается в любых отношениях. Температура воспламенения – 9,4°С, образует с воздухом взрывоопасную смесь. Вызывает набухание резин. Широко применяется в качестве растворителя, в медицине (ингаляционный наркоз), вызывает привыкание человека, ядовит.
Диоксан (т. кип. 101°С) — хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали «органической водой». Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана: диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О-Н.
Простые эфиры хорошо растворяют многие органические вещества и поэтому часто используются как растворители.
Эфиры имеют приятный запах.
Химические свойства
Простые эфиры — малоактивные соединения, они значительно менее реакционноспособны, чем спирты.
1.Расщепление простых эфиров HJ и HBr
Простые эфиры разлагаются под действием концентрированных иодоводородной или бромоводородной кислот:
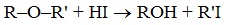
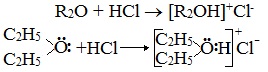
2. Образование комплексных соединений
Образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами:
3. Окисление эфиров, образование перекисей
Несмотря на относительную химическую инертность, эфиры легко образуют при хранении на воздухе перекиси: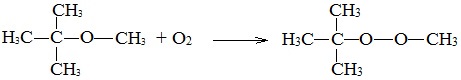
Перекиси являются причиной взрывов в конце перегонки эфиров, поэтому эфиры тщательно очищают от перекисей перед перегонкой и применением.
Получение
1. Межмолекулярная дегидратация спиртов
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов: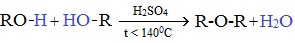
При этом в одной молекуле спирта разрывается связь О-Н, а в другой — связь С-О. Реакцию можно рассматривать как нуклеофильное замещение группы HО– (в одной молекуле спирта) на группу RO– (от другой молекулы):
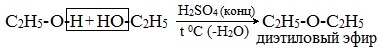
2. Взаимодействие галогенпроизводных с алкоголятами (реакция Вильямсона)
Эфиры несимметричного строения R–O–R' образуются при взаимодействии алкоголята и галогенуглеводорода. Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана: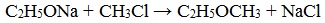
В этой реакции происходит нуклеофильное замещение галогена (Cl–) на алкоксигруппу (Ch4O–):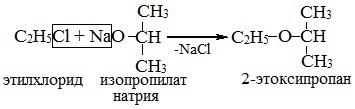
3. Дегидратация спиртов в присутствии ионов водорода как катализаторов 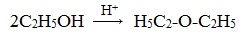
4. Получение гетероцикических кислородсодержащих соединений (циклические простые эфиры) этиленоксид (эпоксид)  диоксан
диоксан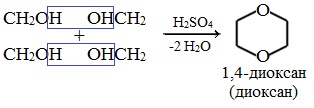
Применение
Вследствие относительной химической инертности, эфиры часто применяются в качестве органических растворителей (диэтиловый эфир, тетрагидрофуран, диоксан).
Эфиры с разветвленными алкильными радикалами (например, метил-трет-бутиловый эфир) используются в последнее время в качестве антидетонационных добавок в моторные топлива (бензины), заменяя чрезвычайно вредный тетраэтилсвинец (ТЭС) — Pb (Ch4Ch3)4.
Простые эфиры фенолов и нафтолов имеют своеобразные запахи и применяются в парфюмерии.
Химические свойства фенолов
himija-online.ru
3.4 Простые эфиры
Простые эфиры можно рассматривать как производные спиртов и фенолов, в которых атом водорода гидроксильной группы замещен углеводородным остатком. Общая формула простого эфира R–О–R1. В тех случаях, когда с атомом кислорода связаны различные углеводородные остатки, простой эфир называют смешанным, одинаковые остатки – симметричным. В зависимости от природы углеводородного радикада простые эфиры подразделяются на:
простые эфиры с открытой цепью;
циклические;
насыщенные;
ненасыщенные;
ароматические и т. д.
По названиям углеводородных остатков составляют название простого эфира. Примеры простых эфиров и их названий приведены в таблице 14.
Таблица 14 – Классификация и номенклатура простых эфиров
| Формула | Название | Класс |
| СН3–О–СН3 | диметиловый эфир метоксиметан | предельный симметричный |
| С2Н5–О–С2Н5 | диэтиловый эфир этоксиэтан | предельный симметричный |
| СН3–О–СН(СН3)2 | метилизопропиловый эфир 2-метоксипропан | предельный смешанный |
| СН3–О–С6Н5 | метилфениловыйэфир метоксибензол анилзол | жирно-ароматический смешанный |
| СН2=СН–О–С2Н5 | винилэтиловый эфир | непредельный смешанный |
|
| алкеноксид | циклический эпоксид оксиран |
|
| 1,4-диоксан | циклический |
|
| тетрагидрофуран | циклический |
Способы получения простых эфиров
Реакция галогенопроизводных углеводородов с алкоголятами – реакция Вильямсона. В качестве алкилирующих средств в этом синтезе могут быть использованы алкилгалогениды и диалкилсульфаты. Вследствие возможного протекания конкурирующей реакции элиминирования этот способ более пригоден для первичных субстратов и практически не используется для третичных:
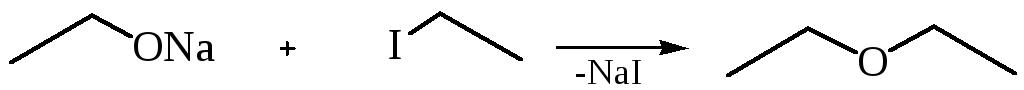
Дегидратация спиртов под влиянием кислот. Метод для получения симметричных простых эфиров из первичных спиртов или смешанных эфиров из первичного и третичного спиртов:
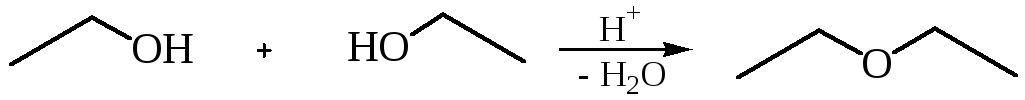
Присоединение спиртов к алкинам приводит к образованию виниловых эфиров:
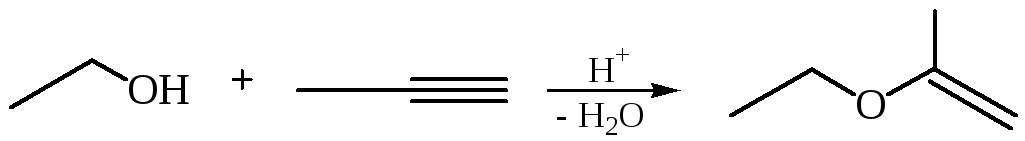
4. Окисление алкенов. Мягкое окисление алкенов надкислотами или кислородом в присутствии серебряного катализатора приводит к образованию трехчленных циклических простых эфиров – оксиранов (эпоксидов) (часть 1, глава 8.2).
Физические свойства простых эфиров. Неспособность молекул простых эфиров образовывать водородные связи делает эти соединения более легколетучими по сравнению со спиртами с близкой молекулярной массой. В смесях с оксисодержащими соединениями, в частности, с водой, простые эфиры образуют водородные связи за счет атома кислорода как донора пары электронов, поэтому низшие эфиры ограниченно растворимы в воде. Циклические простые эфиры, имея более доступный для сольватации атом кислорода, образуют более прочные водородные связи, поэтому они хорошо растворимы в воде (таблица 15).
Таблица 15 – Физические свойства простых эфиров
| Формула | Название | Мол. масса | Температура, °С | Растворимость в воде г/100 г | |
| плавления | кипения | ||||
|
| Диэтиловый эфир | 74 | –116 | 35 | 7,5 |
|
| Ди (н-пропиловый) эфир | 100 | –122 | 90 | 8 |
|
| Тетрагидрофуран | 72 | –108 | 66 | Растворим |
| Продолжение таблицы 15 | |||||
|
| Диоксан | 88 | 12 | 101 | Неограниченно |
|
| Эпоксиэтан, окись этилена | 44 | –112 | 11 | Неограниченно |
|
| Эпоксипропан, окись пропилена | 58 | –112 | 34 | Растворим |
Химические свойства простых эфиров. Простые эфиры – один из немногих классов органических соединений, обладающих невысокой реакционной способностью. В отличие от спиртов простые эфиры, не имея гидрофильного водорода, не проявляют кислотных свойств, однако остальные типы реакций, характерные для спиртов, присущи и простым эфирам:
Наличие в молекулах простых эфиров на атоме кислорода НЭП определяет их способность участвовать в реакциях в качестве оснований.
Вследствие большей электроотрицательности атома кислорода по сравнению с атомом углерода связь Сδ+–Оδ– в простых эфирах подобно связи С–О в спиртах полярна. На углеродном атоме имеется дефицит электронов, что делает возможной нуклеофильную атаку по этому атому с разрывом простой эфирной связи. Однако этот процесс расщепления простого эфира невыгоден по двум причинам:
вследствие электронодонорных свойств углеводородных заместителей, полярность связи С–О невелика;
алкокси-анион, так же как и гидрокси-анион, невыгодная уходящая группа (богата энергией), поскольку в ней нет условий для эффективной делокализации отрицательного заряда.
Следовательно, большинство простых эфиров – довольно инертные химические соединения. Они устойчивы к действию водных растворов кислот, щелочей. Простые эфиры могут расщепляться только некоторыми реагентами, например, при нагревании с концентрированной йодистоводородной кислотой или под действием металлического натрия при повышенной температуре.
1. Основные свойства. Обладая электронной парой на атоме кислорода, простые эфиры могут образовывать координационные комплексы с различными протонными или апротонными кислотами. Однако поскольку атом кислорода обладает довольно высокой электроотрицательностью и стерически мало доступен, он является слабым донором электронной пары. Вследствие этого простые эфиры – слабые основания. Они могут образовывать соли только с сильными кислотами (Н–кислоты и кислоты Льюиса) и в отсутствие воды.
1.1 Взаимодействие с концентрированной серной кислотой. Простые эфиры протонируются, давая растворы оксониевых солей:
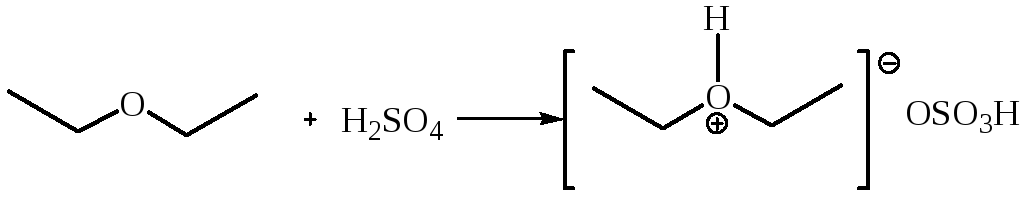
В водной среде оксониевые соли легко гидролизуются, регенерируя при этом исходные эфир и кислоту.
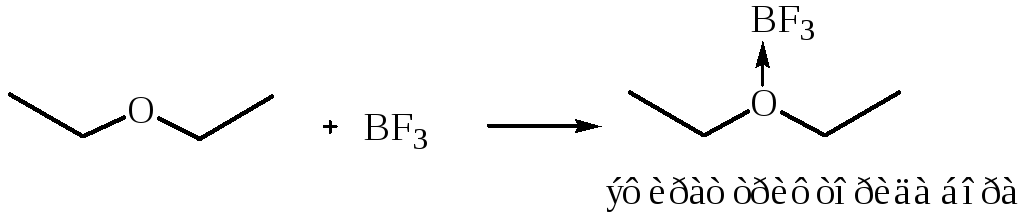
1.2 Взаимодействие с кислотами Льюиса. Эфиры посредством семиполярной связи образуют комплексы:
2. Реакции нуклеофильного замещения. Необходимыми условиями для расщепления простой эфирной связи является наличие сильного нуклеофила и перевод алкокси-аниона в выгодную уходящую группу. Последнее может быть достигнуто, если SN реакцию осуществлять с оксониевой солью эфира, т. е. в присутствии сильной кислоты.
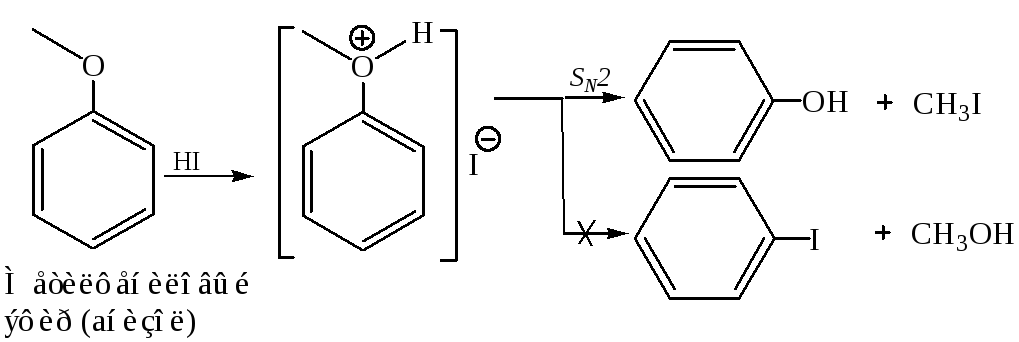
Реакция SN у простых эфиров идет еще труднее, чем у спиртов, т. к. группа RO – является плохой уходящей группой. Однако в кислой среде в результате протонирования по кислороду она превращается в несколько лучшую уходящую группу ROH и нуклеофильное замещение становится возможным.
Природа углеводородного радикала определяет в таких случаях, какой из механизмов – SN1 или SN2 – реализуется, причем закономерности здесь такие же, как в случае алкилгалогенидов. В качестве кислот, катализирующих реакции нуклеофильного замещения простых эфиров, обычно используют HI, h3SO4, НВr.
В данном случае образуется исключительно фенол, так как связь 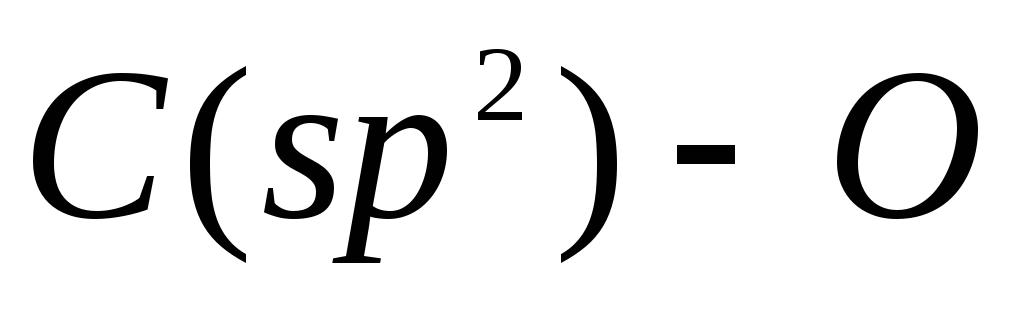 прочнее по сравнению
прочнее по сравнению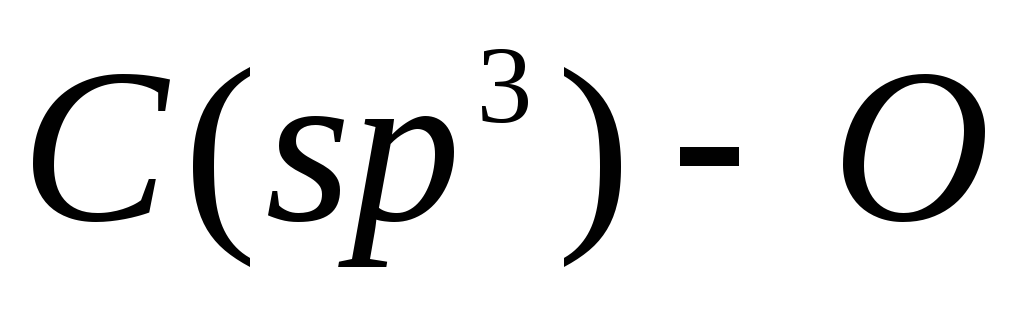 , и последняя разрывается легче.
, и последняя разрывается легче.
3. Отщепление (элиминирование) для простых эфиров, аналогично спиртам, можно осуществить действием сильных кислот, в частности, серной кислоты:
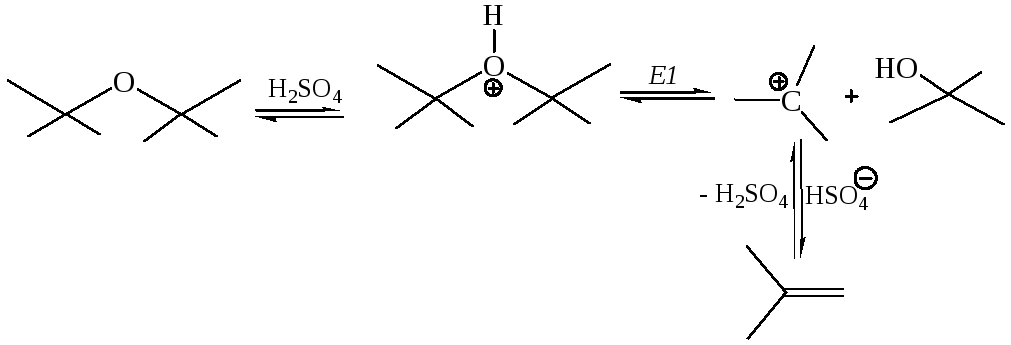
Реакции простых эфиров Е2 типа можно осуществить действием очень сильных оснований, в частности, алкилпроизводных щелочных металлов:
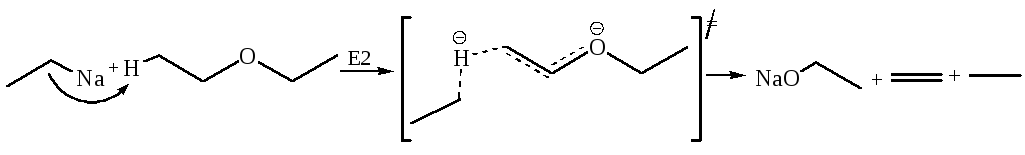
3.1 Расщепление простых эфиров при высоких темепратурах активными металлами (Шорыгин, 1910 г.):

4. Окисление простых эфиров идет легко по С–Н связи кислородом воздуха на свету, поэтому их хранят в темных (светонепроницаемых) емкостях. При длительном хранении в присутствии кислорода воздуха на свету у алифатических эфиров происходит свободнорадикальный процесс окисления, приводящий к образованию неустойчивых пероксидов.
Автоокисление эфиров протекает у α-углеродного атома, поскольку в качестве интермедиатов в этом случае выступают свободные радикалы, стабилизированные делокализацией неспаренного электрона с участием НЭП атома кислорода:
| | |
| Триплетный кислород | Синглетный кислород |
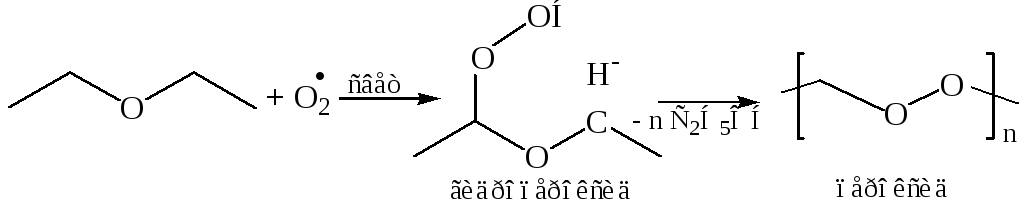
Работа с простыми эфирами, не освобожденными от перекисей, требует особой осторожности. Остаток после перегонки может содержать опасные в отношении взрыва концентрации перекисей. Эфиры, очищенные от перекисей, хранят, как правило, над металлическим натрием или гидридом кальция.
studfiles.net
ПРОСТЫЕ ЭФИРЫ | Энциклопедия Кругосвет
Содержание статьиПРОСТЫЕ ЭФИРЫ класс органических соединений (см. ХИМИЯ ОРГАНИЧЕСКАЯ), содержащих фрагмент ROR', в котором две органические группы соединены атомом кислорода. Прилагательное «простые» в названии эфиров помогает отличить их от другого класса соединений, именуемого сложными эфирами.
Номенклатура простых эфиров.
Если группы R и R' в простом эфире одинаковы, то его называют симметричным, если разные несимметричным. В название эфира включают названия органических групп, упоминая их в алфавитном порядке, и добавляют слово эфир, например, C2H5OC3H7 пропилэтиловый эфир. Для симметричных эфиров перед названием органической группы вводят приставку «ди», например, C2H5OC2H5 диэтиловый эфир. Для многих эфиров часто используют тривиальные (упрощенные) названия, сложившиеся исторически. К простым эфирам иногда относят соединения, которые содержат эфирный фрагмент СОС в составе циклической молекулы (рис. 1), одновременно их причисляют к другому классу соединений гетероциклическим соединениям. Есть также соединения (см. АЛЬДЕГИДЫ И КЕТОНЫ), в состав которых входит фрагмент СОС, но к классу эфиров их не относят, это полуацетали соединения, содержащие одновременно алкокси- и гидрокси-группу у одного атома углерода: >C(OH)OR, а также ацетали соединения, где у одного атома углерода находятся одновременно две RО-группы: >C(OR)2 (рис. 1). Наличие у одного атома углерода сразу двух химически связанных атомов О делает эти соединения непохожими по химическим свойствам на простые эфиры.
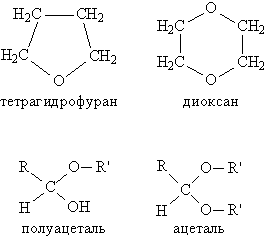
Рис. 1. ПРОСТЫЕ ЭФИРЫ, содержащие эфирный фрагмент в составе циклической молекулы (чаще такие соединения относят к гетероциклическим), а также полуацетали и ацетали, содержащие эфирный фрагмент, но не относящиеся к классу простых эфиров.
Химические свойства простых эфиров.
Простые эфиры представляют собой бесцветные жидкости с характерным (так называемым эфирным) запахом, практически не смешиваются с водой и неограниченно смешиваются с большинством органических растворителей. В сравнении со спиртами и альдегидами простые эфиры химически менее активны, например, они устойчивы к действию щелочей и щелочных металлов (металлический Na применяют даже для удаления следов воды из эфиров). В отличие от щелочей, кислоты расщепляют эфирный фрагмент, для этого чаще применяют галоидоводороды, особенно эффективен HI. При комнатной температуре образуется и спирт, и йодистый алкил (рис. 2А), а при нагревании йодистый алкил и вода (рис.2А), т.е. реакция протекает более глубоко. Простые эфиры, содержащие ароматические циклы, более устойчивы к расщеплению, для них возможна только стадия, аналогичная А, образуется фенол, а йод к ароматическому ядру не присоединяется (рис. 2В).
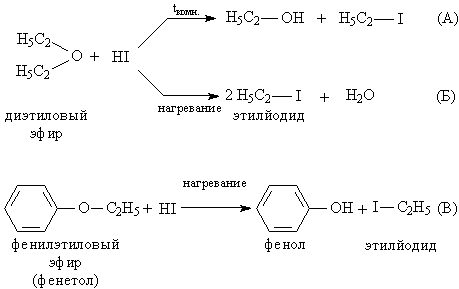
Рис. 2. РАСЩЕПЛЕНИЕ ЭФИРНОГО ФРАГМЕНТА при действии HI
Атом кислорода в эфирном фрагменте содержит свободную электронную пару СÖC, благодаря этому эфиры оказываются способными присоединять различные нейтральные молекулы, склонные к образованию донорно-акцепторных связей, атом кислорода дает для образования связи электронную пару (донор), роль акцептора, принимающего эту пару, играет присоединяющаяся молекула или ион (см. АМИНЫ). В результате возникают комплексные соединения (рис. 3).
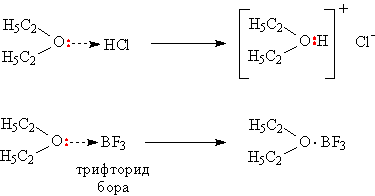
Рис. 3. ОБРАЗОВАНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ С УЧАСТИЕМ ПРОСТЫХ ЭФИРОВ
В присутствии кислорода воздуха на свету эфиры частично окисляются с образованием перекисных соединений ROOR', которые способны взрываться даже при слабом нагреве, поэтому, приступая к перегонке эфира, его предварительно обрабатывают восстановителями, разрушающими перекиси, часто вполне достаточно хранить эфир над металлическим Na.
Получение простых эфиров.
Наиболее удобный способ взаимодействие алкоголятов щелочных металлов R'ONa с алкилгалогенидами RHal, таким методом можно получать как симметричные (рис. 4А), так и несимметричные простые эфиры (рис. 4Б). В промышленности симметричные простые эфиры получают дегидратацией (отщеплением воды) спиртов с помощью серной кислоты (рис. 4В), этот метод позволяет получать эфиры, у которых в органической группе R не более 5 атомов С.
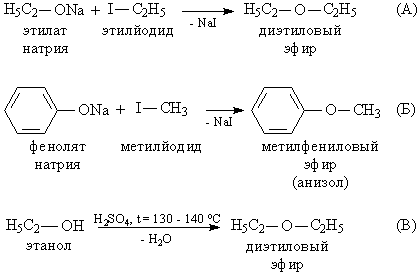
Рис. 4. ПОЛУЧЕНИЕ ПРОСТЫХ ЭФИРОВ
Применение простых эфиров
определяется, в основном, тем, что они очень хорошо растворяют многие жиры, смолы и лаки. Наиболее широко используют ДИЭТИЛОВЫЙ ЭФИР (С2Н5)2О, техническое название «серный эфир», поскольку его получают в присутствии серной кислоты (рис. 4В). Помимо применения в качестве растворителя, а также в роли реакционной среды при проведении различных органических синтезов его используют и для экстрагирования (извлечения) некоторых органических веществ, например, спиртов, из водных растворов, поскольку сам эфир очень мало растворим в воде. В медицине серный эфир применяют для наркоза.
Диизопропиловый эфир (СН3)2СНОСН(СН3)2 используют как растворитель и как добавку к моторному топливу для повышения октанового числа.
Анизол С6Н5ОСН3 (рис. 4) и ФЕНЕТОЛ С6Н5ОС2Н5 (рис. 3) используют в качестве промежуточных продуктов при получении красителей, лекарств и душистых веществ.
Дифениловый эфир (дифенилоксид) (С6Н5)2О из-за высокой температуры кипения (259,3° С) и химической устойчивости применяют как теплоноситель. Чтобы при остывании до комнатной температуры он не переходил в твердое состояние (его т. пл. 2829° С), в него добавляют дифенил (С6Н5)2. Такая смесь, называемая в технике даутермом, может работать как теплоноситель в широком диапазоне температур.
Диоксан, циклический эфир (СН2СН2О)2 (рис.), по химическим свойствам близок обычным простым эфирам, но в отличие от них неограниченно смешивается с водой и большинством органических растворителей. Растворяет жиры, воски, масла, эфиры, целлюлозы, его широко применяют и как реакционную среду при проведении различных органических синтезов.
Михаил Левицкий
www.krugosvet.ru
Формула простого эфира в химии
Определение и формула простого эфира
Химическая формула – 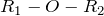 , где
, где 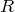 – это углеводородный радикал.
– это углеводородный радикал.
Низшие представители имеют следующие формулы:
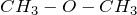
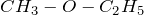
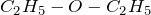
Молярная масса:
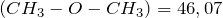 г/моль
г/моль
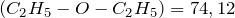 г/моль
г/моль
Физические свойства – 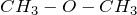 и
и 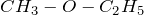 являются газами, остальные подвижные легкокипящие жидкости. Эфиры плохо растворимы в воде, легче воды, имеют приятный запах.
являются газами, остальные подвижные легкокипящие жидкости. Эфиры плохо растворимы в воде, легче воды, имеют приятный запах.
Химические свойства простого эфира
- Простые эфиры являются достаточно инертными соединениями, они не подвергаются гидролизу, не разлагаются водой, не взаимодействуют со щелочами и не расщепляются щелочными металлами на холоду. Простые эфиры имеют слабую основность, поэтому реагируют с разбавленными кислотами, некоторые концентрированные кислоты могут расщеплять простые эфиры, металлический натрий также расщепляет простые эфиры при нагревании:
![Rendered by QuickLaTeX.com \[ R_1-O-R_2 + HCl \rightarrow [R_1-OH-R_2]Cl \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-fe5f3a2eefe9ef70868cb7bdfb1a903b_l3.png)
![Rendered by QuickLaTeX.com \[ R_1-O-R_2 + H_2SO_4 \rightarrow R_1-O-SO_3H + R_2-OH \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-36d57988f0aa2cdfa62255cbd2b00cb2_l3.png)
![Rendered by QuickLaTeX.com \[ R_1-O-R_2 + HI \rightarrow R_1-I + R_2-OH \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-62b8e1db275d669f2eec9f8bb6154871_l3.png)
![Rendered by QuickLaTeX.com \[ R_1-O-R_2 + 2Na \rightarrow R_1-Na + R_2-ONa \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-1fe257ff262e1d49d974d658cdca6ded_l3.png)
Получение
Реакция галогенпроизводных углеводородов с алкоголятами (реакция Вильямсона):
![Rendered by QuickLaTeX.com \[ R_1-O-Na + I-R_2 \rightarrow R_1-O-R_2 + NaI \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-4d0369ae876e787660141cebd7870ada_l3.png)
Дегидратация спиртов под действием сильных минеральных кислот при нагревании до 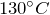 :
:
![Rendered by QuickLaTeX.com \[ 2R-OH \rightarrow R-O-R + H_2O \]](/800/600/http/ru.solverbook.com/wp-content/ql-cache/quicklatex.com-30818a1012b70bafc2ab633ba7213828_l3.png)
Применение
В основном простые эфиры применяются как растворители или в качестве реакционной среды для проведения химических реакций.
Примеры решения задач

| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Простые и сложные эфиры Простые эфиры
Простые эфиры (окиси алканов) можно представить как соединения, образованные замещением обоих атомов водорода молекулы воды двумя алкильными радикалами или замещением гидроксильного спирта алкильным радикалом.
Изомерия и номенклатура. Общая формула простых эфировROR(I) ((Cnh3n+1)2O) илиCnh3n+1OCkh3k+1, гдеnk(R1OR2) (II). Последние часто называют смешанными эфирами, хотя (I) частный случай (II).
Простые эфиры изомерны спиртам (изомерия функциональной группы). Приведем примеры таких соединений:
Н3СОСН3диметиловый эфир; С2Н5ОН этиловый спирт;
Н5С2ОС2Н5диэтиловый эфир; С4Н9ОН бутиловый спирт;
Н5С2ОС3Н7этилпропиловый эфир; С5Н11ОН амиловый спирт.
Кроме того, для простых эфиров распространена изомерия углеродного скелета (метилпропиловый эфир и метилизопропиловый эфир). Оптически активные эфиры немногочисленны.
Способы получения простых эфиров
1. Взаимодействие галогенпроизводных с алкоголятами (реакция Вильямсона).
С2Н5ОNa+IC2H5Н5С2ОС2Н5+NaI
2. Дегидратация спиртов в присутствии ионов водорода как катализаторов.
2С2Н5ОH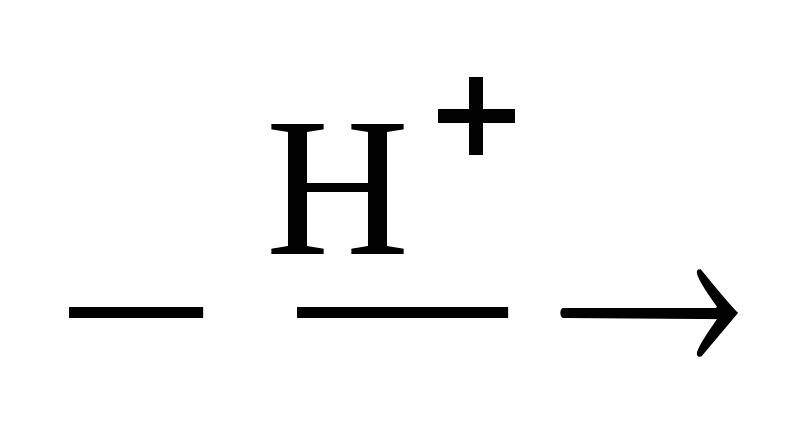 Н5С2ОС2Н5
Н5С2ОС2Н5
3. Частная реакция получения диэтилового эфира.
П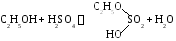 ервая стадия:
ервая стадия:
В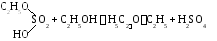 торая стадия:
торая стадия:
Физические свойства простых эфиров
Два первых простейших представителя – диметиловый и метилэтиловый эфиры – при обычных условиях газы, все остальные – жидкости. Их Ткипмного ниже, чем соответствующих спиртов. Так, температура кипения этанола – 78,3С, а Н3СОСН3– 24С, соответственно (С2Н5)2О – 35,6С. Дело в том, что простые эфиры не способны к образованию молекулярных водородных связей, а, следовательно, и к ассоциации молекул.
Химические свойства простых эфиров
1. Взаимодействие с кислотами.
(С2Н5)2О +HCl[(С2Н5)2ОH+]Cl.
Эфир играет роль основания.
2. Ацидолиз – взаимодействие с сильными кислотами.
Н5С2ОС2Н5+ 2h3SO42С2Н5OSO3H
этилсерная кислота
Н5С2ОС2Н5+HIС2Н5OH+ С2Н5I
3. Взаимодействие со щелочными металлами.
Н5С2ОС2Н5+ 2NaС2Н5ONa+ С2Н5Na
Отдельные представители
Этиловый эфир (диэтиловый эфир) – бецветная прозрачная жидкость, малорастворимая в воде. С этиловым спиртом смешивается в любых отношениях. Тпл=116,3С, давление насыщенного пара 2,66104Па (2,2С) и 5,32104Па (17,9С). Криоскопическая константа 1,79, эбулиоскопическая –1,84. Температура воспламенения – 9,4С, образует с воздухом взрывоопасную смесь при 1,71 об. % (нижний предел) – 48,0 об. % (верхний предел). Вызывает набухание резин. Широко применяется в качестве растворителя, в медицине (ингаляционный наркоз), вызывает привыкание человека, ядовит.
Сложные эфиры карбоновых кислот Получение сложных эфиров карбоновых кислот
1. Этерификация кислот спиртами.
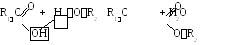
Гидроксил кислоты выделяется в составе воды, спирт же отдает лишь атом водорода. Реакция обратима, те же катионы катализируют и обратную реакцию.
2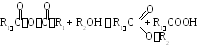 . Взаимодействие ангидридов кислот со спиртами.
. Взаимодействие ангидридов кислот со спиртами.
3. Взаимодействие галогенангидридов со спиртами.
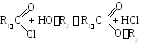
Некоторые физические свойства сложных эфиров приведены в табли- це 12.
Таблица 12
Некоторые физические свойства ряда сложных эфиров
| Формула | Строение радикала | Название | Тпл,С | Ткип,С | Плотность
|
| HCOOR | Ch4 | метилформиат | 99,0 | 31,5 | 0,975 |
| C2H5 | этилформиат | 80,5 | 54,3 | 0,917 | |
| СН3СООR | Ch4 | метилацетат | 98,1 | 57,1 | 0,924 |
| C2H5 | этилацетат | 83,6 | 77,1 | 0,901 | |
| н-C3H7 | н-пропилацетат | 92,5 | 101,6 | 0,887 | |
| н-C4H9 | н-бутилацетат | 76,8 | 126,5 | 0,882 |
Сложные эфиры низших карбоновых кислот и простейших спиртов – жидкости с освежающим фруктовым запахом. Употребляются как отдушки для приготовления напитков. Многие эфиры (уксусноэтиловый, уксуснобутиловый) широко применяются как растворители, особенно лаков.
studfiles.net
Чем отличаются простые эфиры от сложных
В органической химии существует два основных класса эфиров: простые и сложные. Это химические соединения, образующиеся при гидролизе (отщеплении молекулы воды). Простые эфиры (их еще называют этеры) получают при гидролизе соответствующих спиртов, а сложные эфиры (эстеры) – соответствующих спирта и кислоты.
Несмотря на похожее название, простые и сложные эфиры это два совершенно разных класса соединений. Их получают разными путями. Они имеют различные химические свойства. Различаются они и структурной формулой. Общими есть лишь некоторые физические свойства самых известных их представителей.
Физические свойства этеров и эстеров
Простые эфиры — малорастворимые в воде, легкокипящие жидкости, легко воспламеняются. При комнатной температуре, простые эфиры — приятно пахнущие бесцветные жидкости.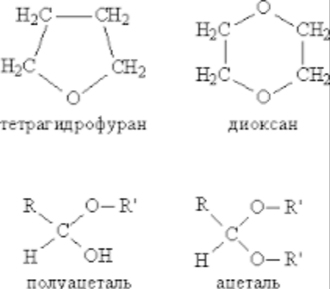 Сложные эфиры, имеющие малую молекулярную массу — легко испаряющиеся бесцветные жидкости, приятно пахнут, часто фруктами или цветами. С возрастанием карбоновой цепи ацилгруппы и спиртового остатков, их свойства становятся другими. Такие эфиры твердые вещества. Их точка плавления зависит от длинны углеродных радикалов и структуры молекулы.
Сложные эфиры, имеющие малую молекулярную массу — легко испаряющиеся бесцветные жидкости, приятно пахнут, часто фруктами или цветами. С возрастанием карбоновой цепи ацилгруппы и спиртового остатков, их свойства становятся другими. Такие эфиры твердые вещества. Их точка плавления зависит от длинны углеродных радикалов и структуры молекулы.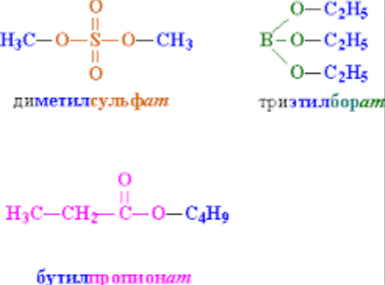
Структура простых и сложных эфиров
Оба соединения имеют простую эфирную связь (-О-), но в сложных эфирах она входит в состав более сложной функциональной группы (-COO), в которой первый атом кислорода связан с атомом карбона одинарной связью (-О-), а второй двойной (=О).
Схематически можно изобразить так:
- Простой эфир: R–O–R1
- Сложный эфир: R—COO—R1
В зависимости от радикалов в R и R1, простые эфиры делят на:
- Симметричные эфиры – такие у которых алкильные радикалы идентичны, например, дипропиловыйэфир, диэтиловый эфир, дибутиловый эфир и т.п.
- Асимметричные эфиры или смешанные – с разными радикалами, например, этилпропиловый эфир,метилфениловый эфир, бутилизопропиловый и т.д.
Сложные эфиры подразделяют на:
- Сложные эфиры спирта и минеральной кислоты: сульфатной (-SO3H), нитратной (-NO2) и др.
- Сложные эфиры спирта и карбоновой кислоты, например, С2Н5СО-, С5Н9СО-, СН3СО- и т. д.
Рассмотрим химические свойства эфиров. Простые эфиры имеют низкую реакционную способность, именно благодаря этому их часто применяют как растворители. Они реагируют только в экстремальных условиях, или с высокореакционными соединениями. В отличии от этеров, сложные эфиры более реакционноспособные. Они легко вступают в реакции гидролиза, омыления и др..
Простые эфиры
Реакция простых эфиров с галогеноводородами:
Большинство простых эфиров могут разлагаться под воздействием бромоводородной кислоти (HBr) с образованием алкилбромидов или при взаимодействии с иодоводородной кислотой (HI) с получениемалкилиодидов.
СН3—О—СН3 + НI = СН3—ОН + СН3I
СН3—ОН + НI = СН3I + Н2О
Образование оксониевых соединений:
Серная, иодная и др. сильные кислоты при взаимодействии с простыми эфирами, образуют оксониевые соединения – продукты соединения высшего порядка.
СН3—О—СН3 + HCl = (Ch4)2О ∙ HCl
Взаимодействие простых эфиров с металлическим натрием:
При нагревании с основными металлами, например, металлическим натрием, простые эфиры расщепляются на алкоголяты и алкилнатрий.
СН3—О—СН3 + 2Na = СН3—ОNa + СН3—Na
Автоокисление простых эфиров:
В присутствии кислорода, простые эфиры медленно автоокисляются с образованием гидроперекиси идиалкил пероксида. Автоокисление является спонтанным окислением соединения в воздухе.
С2Н5—О—С2Н5 + О2 = СН3—СН(ООН)—О—С2Н5
Сложные эфиры
Гидролиз сложных эфиров:
В кислой среде эстер гидролизует, образуя соответствующую кислоту и спирт.
СН3—СОО—С2Н5 = СН3—СООН + Н2О
Омыление сложных эфиров:
При повышенной температуре эстеры реагируют с водными растворами сильных оснований, таких как гидроксид натрия или калия, образуя соли карбоновых кислот. Соли жрных карбоновых кислот называют мылами. Побочным продуктом реакции омыления является спирт.
СН3—СОО—С2Н5 + NaОН = СН3—СООNa + С2Н5—ОН
Реакции переэстерефикации (обмена):
Сложные эфиры вступают в реакции обмена при действии спирта (алкоголиз), кислоты (ацидолиз), или при двойном обмене, при взаимодействии двух сложных эфиров.
СН3—СОО—С2Н5 + С3Н7—ОН = СН3—СОО—С3Н7 + С2Н5—ОН
СН3—СОО—С2Н5 + С3Н7—СООН = С3Н7—СОО—С2Н5 + СН3—СООН
СН3—СОО—С2Н5 + С3Н7—СОО—СН3 = СН3—СОО—СН3 + С3Н7—СОО—С2Н5
Реакции взаимодействия с аммиаком:
Сложные эфиры могут взаимодействовать с аммиаком (NН3) с образованием амида и спирта. По тому же принципу реагируют они и с аминами.
СН3—СОО—С2Н5 + NН3 = СН3—СО—NН2 + С2Н5—ОН
Реакции восстановления эстеров:
Эфиры могут быть восстановлены водородом (Н2) в присутствии хромита меди (Cu(CrO2)2).
СН3—СОО—С2Н5 + 2Н2 = СН3—СН2—ОН + С2Н5—ОН
vchemraznica.ru