Справочник химика 21. Простые эфиры функциональная группа
Функциональные производные эфиры простые - Справочник химика 21
Образование ацеталей и кеталей. Реакции образования важных функциональных производных альдегидов и кетонов — ацеталей и кеталей можно формально рассматривать как замещение атома кислорода оксосоединений на две алкоксильные группы, а сами продукты — как простые эфиры обычно не существующих 1,1-гликолей Rj С(0Н)2 [c.139]
Олигосахариды являются функциональными производными моносахаридов, имеющими характер простых эфиров они образуются в результате соединения двух илн нескольких молекул моносахаридов с отщеплением воды. Следовательно, в олигосахаридах связь между молекулами моносахаридов осуществляется через атомы кислорода. Олигосахариды подразделяются на дисахариды, трисахариды, тетрасахариды и т. д. в зависимости от числа составляющих их моносахаридов. [c.205]
Если исследуемый пептид содержит аминокислоты с третьей функциональной группой, то простых производных — метиловых эфиров Ы-ТФА-пептидов — оказывается недостаточно. [c.148]
Как и в других гетерофункциональных соединениях, обе функции в общих чертах сохраняют свои обычные свойства. Так, например, гидроксильная группа может подвергаться алкилированию (реакция 1, образование простых эфиров), ацилированию (реакция 2, образование сложных эфиров), замещаться на галоид (реакция 3, получение галоидзамещенных кислот), отщепляться в виде воды (реакция 4, образование непредельных кислот). Карбоксильная группа способна образовывать соли, сложные эфиры (реакция 5), ангидриды и галоидангидриды, амиды (реакция 6) и другие функциональные производные. Проиллюстрируем некоторые из. этих реакций схемой превращений молочной кислоты [c.343]
Реакции взаимодействия функциональных производных кремния с веществами, способными отдавать кислород. Источником кислорода могут служить вода, окиси металлов, простые эфиры, альдегиды, кетоны, спирты, смеси спиртов с кислотами и т. п. [c.397]
Аналогично углеводородам веду г себя по отношеныю к карбе-Н йй многие функциональные производные алкенов — простые п сложные эфиры, ацетали непредельных альдегидов п кетонов, органические производные кремния с ненасыщенными углеводородными заместителями, галогенопроизвоДные и другие соединения. Особенно энергично присоединяют карбены виниловые эфиры, имеющие открытую или замкнутую цепь атомов [c.20]
Некоторые функциональные производные кислот могут быть восстановлены в соответствующие альдегиды и первичные спирты. Наиболее простой путь восстановления кислоты в альдегид — это реакция-Розенмунда (см. стр. 127). Наиболее распространенный способ перехода от кислоты к спирту (реакция Буво)—восстановление сложного эфира карбоновой кислоты чистым (свободным от калия, В. В. Лонгинов) металлическим натрием в абсолютном этиловом спирте [c.158]
Женевской номенклатурой недостаточно разработаны правила наименования функциональных производных. Нельзя считать удачным правило 21, предлагающее для наименования простых эфиров называть входящие в них радикалы, ставя между ними соединительную частичку окси . При таком построении названия исчезает связь с исходной, спиртовой функцией. Для производных типа смешанных эфиров многоатомных спиртов или многоосновных кислот и оксикислот Женевская номенклатура вообще не дала четких правил. [c.22]
Другим примером являются простые эфиры, где при переходе к функциональным производным обозначение корня хотя и сохраняется, но меняется характер обозначения функции, например [c.32]
Дальнейшая возможность качественного определения представителей опреде.ченных классов веществ в смеси состоит в селективном превращении этих соединений в летучие производные перед газохроматографическим анализом. Превращенные компоненты можно узнавать по сдвигу пиков на хроматограмме предварительно обработанной пробы, которая отличается по своему качественному составу от исходной пробы. К таким методам селективного превращения можно отнести все виды гидрирования двойных связей и другие реакции с функциональными группами, как, папример, этерификация, омыление, образование простых эфиров и т. д. При практическом осуществлении этих методов анализа также можно использовать непрерывные и прерывные способы работы. Селективное превращение компонентов пробы особенно целесообразно в тех случаях, если нет в наличии чистых образцов тех соединений, которые присутствуют в анализируемой смеси соединений, или они менее доступны, чем продукты их превращения. [c.246]
К ним относится все, сказанное о систематике функциональных производных III рода. К этому классу, строго говоря, относятся только нитрилы и их аналоги типа —С=Э. Следовало бы, однако, сюда же отнести и такие соединения, как амидины, где все три валентности бывшей карбоксильной группы связаны с атомами одного элемента (азот), но с сохранением характера связей карбоксила (одна одинарная связь и одна двойная). Ортоэфиры карбоновых кислот систематика относит к простым эфирам трехатомных спиртов. Такие соединения, как тиоамиды, где кислород заменен серой, и их аналоги с другими гетероатомами, будут рассматриваться как усложненные производные II рода. [c.217]
Однако и этим не исчерпывается многообразие органических соединений. Если в перечисленных выше соединениях замещать атомы или группы атомов другими функциональными группами или углеводородными радикалами, получаются новые соединения. Такими производными являются, например, простые и сложные эфиры и др. Во все эти классы входят как предельные вещества, так и вещества, содержащие кратные связи (непредельные или ненасыщенные). [c.291]
Гетероциклические ароматические соединения представляют собой сложные циклические я-системы с непрерывным сопряжением к- или ия-электронов по всему замкнутому циклу. Обычно это производные сопряженных открытых (линейных) тс-систем — аминов, диаминов, полиаминов, простых эфиров, сульфидов, селенидов, теллуридов и многих других элементов, которые после замыкания цикла несут в ароматической я-системе один или несколько гетероатомов (М, О, Р, 8 и др.). Все гетероциклы являются би- или полифункциональными производными углеводородов. Так, например, пиррол имеет две функциональные группы, я-электронные (этиленовые) и вторичного амина [c.671]
Наиболее употребительные органические соединения сохраняют исторически сложившиеся тривиальные названия, указывающие ибо на происхождение данного вещества (молочная кислота, масляная кислота, мочевина и т. д.), либо на его свойства (эфир, антифебрин, скатол и т. д.). С развитием органического синтеза количество органических соединений стало возрастать с такой быстротой, что, пользуясь прежней системой обозначения, оказалось чрезвычайно трудным придумывать тысячи различных новых названий. Решение было найдено в заместительной, или так называемой рациональной, номенклатуре (PH). Эта номенклатура рассматривает химические соединения к к производные более простых и хорошо известных соединений — прототипов, в которых один или несколько атомов водорода замещены радикалами (остатками углеводородов), другими элементами или функциональными группами (—ОН, —Nh3, —ТМОг и т. д.). В качестве прототипов используются, например, метан, этилен, ацетилен, метиловый спирт, уксусная кислота и другие простейшие соединения. Рациональная номенклатура, очень удобная для обозначения сравнительно простых соединений, теряет свои преимущества при переходе к более сложным соединениям. В связи с этим возникла потребность в создании новой, универсальной международной номенклатуры (МН). [c.36]
Свойства смешанных простых эфиров целльэлозы, в том числе растворимость, зависят от вида и массовой доли введенных заместителей и могут обеспечить смешанному эфиру спеьифическое применение, t том числе использование подобных эфиров с низкой степенью замещения для модифицирования це-.люлозы. Перспективное направление - получение функциональных производных целлюлозы. Так, благодаря пористой структуре функциональных производных их можно использовать для получения ионообменных материалов, применяемых в колоночной хроматографии. Эти производные получают в волокнистой, порошковой или гранулированной формах введением алкильных заместителей, содержащих ами1югруппы (для анионообменников) и сульфо- [c.617]
О- и т. д.) или на электрон. При замещении алканов и щпслоалканов на неорганический остаток возникают функциональные производные с атомными функциями (галогенопроизводные КС1, карбоновые кислоты К-СООН, кетоны К-СО-К, амины ККН2, спирты К-ОН, простые эфиры К-О-К и т. д.). При замещении же на электрон возникают либо свободные радикалы СН3СН2, С Н ,, имеющие уединенный электрон, либо бирадикалы СНгСН , СвН о, имеющие два свободных электрона. [c.9]
Из схемы 9.1 очевидно, что фундаментом всей органической химии являются углеводороды. От алканов происходят все остальные классы углеводородов. Из углеводородов в результате химических реакций замещения Н-атома С-Н-связи и присоединения реагентов по л-связям возникают основные классы функциональных производных углеводородов — галогенопроизводные, сульфопроиз-водные, нитросоединения, спирты, простые и сложные эфиры, альдегиды, кегоны и карбоновые кислоты. Дальнейшее химическое преобразование (химический дизайн) этих производных за счет замещения или химического видоизменения функциональных групп создает все труднообозримое многообразие полифунк-ционапьных органических соединений, в том числе аминокислоты, пептиды, и белки, жиры и углеводы, гетероциклы различной сложности, витамины, гормоны, нуклеотиды и нуклеиновые кислоты, ферменты. [c.317]
При исследовании функциональных производных диацетиленов методом ЯМР обнаружено дальнее сцин-спиновое взаимодействие между ацетиленовым протоном и функциональной группой или с одной из двух тройных связей по цепи сопряжения [490, 491, 498, 599]. Это взаимодействие проявляется в молекулах монозамещенных гомологов диацетилена, моногалогендиацетиленов, первичных, вторичных и третичных диацетиленовых спиртов, аминов, ацеталей, простых эфиров, а также в молекуле гептадиин-4,6-овой кислоты и ее производных. На основании полученных значений химического сдвига и констант спин-спинового взаимодействия для молекул перечисленных соединений сделан вывод о передаче влияния гетероатома через сопряженные тройные связи. Величина этой передачи оценена по значению константы взаимодействия. Сопоставление значений химического сдвига, полученных в различных раствори- [c.175]
Например, после описания свойств фенола СеНзОН помещены его функциональные производные—анизол СбНбОСНз, фенетол С6Н5ОС2Н5, простые эфиры с более сложными радикалами, сложные эфиры и т. д. После [c.37]
Наконец, среди органических соединений есть множество структур, в которых углеродный скелет как бы разорван каким-либо гетероатомом простые и сложные эфиры, ацетали, вторичные и третичные амины. Все подобные структуры относят к функциональным производным соответствующих соединений. К ним причисляют также азотистые производные альдегидов и кетонов, карбоновых кислот (оксимы, гидразоны, замещенные гидразоны и т. п. амиды, гидраксамовые кислоты и т. п.). [c.9]
В этом разделе изучаются номенклатура, строение и свойства большой группы производных углевс1Доро-дов, содержащих кислородсодержащие функциональные группы. Простейшими представителями этой группы являются спирты, поэтому они открывают настс ящий раздел. Далее в нем последовательно рассматриваются фенолы, содержащие такую же функциональную группу, как и спирты, альдегиды, карбоновые кислоты, сложные эфиры, в частности, жиры-триглицериды, углеводы [c.526]
Нетрудно понять, к каким ошибкам может привести анализ результатов вычислений без исследования системы на обусловленность. Например, исследование обусловленности систем уравнений [3], полученных при определении постоянных в расчетных формулах для энтальпий образования алканов и их функциональных производных (спиртов, альдегидов, кетонов, кислот, простых и сложных эфиров, тиоспиртов, сульфидов, сульфонов, сульфоксидов, нитросоединений, нитратов и нитритов), приводит к следующим выводам [c.283]
Простые эфиры являются функциональными производными гид-роксилсодержащих соединений, формально получающимися из двух молекул спирта или фенола в результате отщепления молекулы воды. Названия эфиров образуются от названий радикалов, например этиловый эфир — (С2Нб)20 их можно также считать окислами соответствующих радикалов, например HjO Hg — окись метилэтила. [c.488]
Б другой схеме прививки полимеров к белкам также используются, хотя и не непосредственно, реакции изоцианатных функциональных групп. Производные алкилвиниловых простых эфиров, содержащие изоцианатные группы, вводят во взаимодействие с этиленимином, в результате чего образуются соответствующие К,Н -этиленуреидопроизводные [353], которыми затем обрабатывают шерсть или шелк, благодаря чему образуются прочные покрытия на волокне. [c.428]
Работа выполняется в двух вариантах в изотермическом режиме работы хроматографической колонки и в режиме программирования температуры. Общим для обоих вариантов является начальное хроматографирование в рекомендованных ниже условиях при использовании классической капиллярной колонки типа W OT со стандартной неполярной полидиметилсилоксановой неподвижной фазой опорных смесей н-алканов, например Сб-Сэ (в изотермическом режиме) или Се-Сц (в режиме программирования температуры). Далее в тех же условиях хроматографируют одну-две (по согласованию с преподавателем) искусственные смеси известного состава использованных ранее м-алканов и углеводородов других классов или их простейших функциональных производных (кетонов, спиртов, сложных эфиров). На заключительном этапе работы исследуют состав контрольных образцов, содержащих реперные н-алканы и одно-два или большее число неизвестных студентам соединений. [c.483]
Если взять любую рациональную классификацию органических соединений, например, по функциональным фуппам, и заполнить ее только структурами природных соединений, то мы увидим очень странную картину отдельные кластеры, густо усеянные разнообразными структурами, области, содержащие лишь отдельные точки, и, наконец, огромные пустые области. В такой системе, например, будут шедро представлены неразветвленные алифатические кислоты с четным числом атомов углерода, но будет маю разветвленных кислот или кислот с нечетным числом атомов углерода будет множество очень причудливо устроенных циклических и полициклических систем, но почти не встретится их простейших представителей. Редкими и случайными структурами будут представлены такие важнейшие классы, как алкилгалогениды, тиолы и сульфиды, нитро- и диазосоединения. Удивительно, но будут отсутствовать даже такие тривиальные соединения, как формальдегид, хлороформ, диэтиловый эфир или тетрагидрофуран. Мы уже не говорим о том, что многие важнейшие классы органических соединений, такие, как, например, различные типы металлоорганических соединений или борорганические производные, вообще никак не представлены в списке природных веществ. [c.52]
Вместе с тем, несомненно, что в реальной молекуле фуранового вещества все эти структурные элементы ядра находятся в известном взаимодействии, что должно сказываться на характере соответствующих реакций взаимное влияние должно иметь место и между ядром и замещающими группами. В действительности реакции фуранового ядра, как это будет показано ниже, обнаруживают в достаточно отчетливой степени указанную вьппе аналогию с диеновыми углеводородами и дивиниловым эфиром. В то же время химическое поведение фурановых веществ свидетельствует о том, что замыкание бутадиена в цикл через мостиковый кислород или, иначе говоря, соединение простой связью обоих Р-углеродных атомов дивинилового эфира, приводит к возникновению качественно новых свойств, присущих фурану как химической индивидуальности, которые в известной мере отличают фуран и все его производные от указанных выше структурно близких ненасыщенных соединений жирного и алицик-лического рядов. Эти специфические особенности фурановых веществ могут быть обнаружены при рассмотрении только тех химических реакций, Которые обусловлены самим фурановым ядром, а не замещающими функциональными группами. [c.7]
Впервые полученный в 1947 г., а юмогидрид лития в настоящее время является одним из самых универсальных реагентов. Он восстанавливает в мягких условиях различные по характеру ненасыщенные группировки и оставляет без изменения в большинстве случаев лишь кратные С-С-связи и связи С-0 простых эфиров. Обращает на себя внимание разнообразие способных к восстановлению алюмогидридом лития функциональных групп (табл. 2.1). Из карбонилсодержащих соединений альдегиды, кетоны, кислоты, их производные могут быть легко восстановлены до спиртов. Поддаются восстановлению оксимы, нитросоединения и галогеноуглево-дороды. [c.104]
Структура книги и рекомендации но ее использованию. После общих замечаний по планированию, подготовке и проведению органических реакций, по аппаратурному обеспечению эксперимента, ведению лабораторного журнала (гл. I) говорится о получении и превращениях соединений с простыми функциональными группами алкенов, алкинов, галогеналканов, спиртов, простых эфиров и оксиранов, органических соединений серы, аминов, альдегидов и кетонов, а также их производных, карбоновых кислот и их производных, ароматических соединений (гл. 2). Полученные соединения служат затем в качестве строительного материала для синтеза более сложных молекул. После описания важнейших методов образования связи С—С (разд. 3.1) следует раздел, посвященный образованию и превращению карбоциклов (разд. 3.2). гетероциклов (разд. 3.3) и красителей (гл. 4). Далее изложены. методы введения защитных групп и изотопных меток (гл. 5), а также приведены примеры регио- и стереоселективных реакций (гл. 6). Центральное место в книге занимают более сложные синтезы аминокислот, алкалоидов, пептидов, углеводов, терпенов, вита.минов, ферромонов, простаглан-динов, инсектицидов и фармацевтических препаратов, планирование и разработка которых обсуждаются с привлечением принципов ретро-синтетического расчленения (гл. 7). Почти все рассмотренные в этой [c.10]
Саундерс и Вильямс [84] описали применение трис-(дипива-лоилметаната)европия для получения спектров первого порядка и вообще простых спектров. В их работе описаны интересные эффекты, возникающие при анализе бензилового спирта и я-гексанола. Этим же методом можно анализировать и другие функциональные группы, такие, как кетоны, простые и сложные эфиры и амины. И хотя сам метод предназначен главным образом для структурных определений, его применимость для анализа функциональных групп очевидна. Производное европия связывается с функциональной группой, и его действие уменьшается по мере увеличения расстояния между протонами и функциональной группой. [c.69]
В целом свойства высших сахаров мало отличаются от свойств обычных моносахаридов и определяются теми функциональными группами, которые они содержат. Так, высшие альдозы проявляют все свойства, характерные для обычных альдоз высшие кетозы соответствуют обычным кетозам и т. д. Высшие сахара так же, как и обычные моносахариды, легко образуют простые и сложные эфиры, реагируют со спиртами и фенолами с образованием гликозидов, дают все известные для обычных сахаров производные по карбонильной группе, легко окисляются до альдоновых кислот и восстанавливаются до полиолов, легко подвергаются превраш,ениям под действием кислот и ш,елочей и т. д. Интересно отметить, что высшие сахара по некоторым физическим (оптическое вра-ш,ение) и химическим свойствам (образование нерастворимых фенилгидразонов, комплексов с солями ш,елочноземельных металлов и т. д.) очень близки к гексозам, если стереохимия первых четырех асимметрических углеродных атомов гексозы совпадает с таковой у высшего сахара. Такое совпадение свойств распространяется не только на циклические формы сахаров, их гликозидов и лактонов, но проявляется также и в свойствах амидов, феннлгидразидов, бензимидазолов и т. д. Наглядным примером является приведенное в табл. 14 сравнение величин оптического враш,е-ния производных )-гулозы и О-эритро-О-гуло-октозы [c.318]
chem21.info
Простые эфиры - Википедия
Материал из Википедии — свободной энциклопедии
Просты́е эфи́ры — органические вещества, имеющие формулу R-O-R', где R и R' — углеводородные радикалы. Следует, однако, учитывать, что такая группа может входить в состав других функциональных групп соединений, не являющихся простыми эфирами (см. ).
Способы получения[ | ]
По ВильямсонуВ лабораторных условиях эфиры получают по Вильямсону взаимодействием галогенопроизводных, способных вступать в реакцию Sn2 и алкоксид- и феноксид-ионами. Реакция протекает гладко с галогенметаном и первичными галогеналканами. В случае вторичных галогеналканов реакция может быть осложнена побочной реакцией элиминирования.
Физические свойства[ | ]
Простые эфиры — подвижные легкокипящие жидкости, малорастворимые в воде, очень легко воспламеняющиеся. Проявляют слабоосновные свойства (присоединяют протон по атому O).
Методы синтеза[ | ]
- Межмолекулярная дегидратация спиртов:
- Реакция алкоголятов с галогенуглеводородами:
- Реакция спиртов с галогенуглеводородами в присутствии ацетилацетоната никеля:
- Ароматические эфиры можно получить реакцией фенола с в присутствии щёлочей:
encyclopaedia.bid
Простые эфиры – это продукты замещения атома водорода гидроксильной группы спиртов или фенолов на углеводородный радикал.
Следовательно, они соответствуют общей формуле R–O–R1, в которой атом кислорода связан с двумя углеводородными остатками.
По заместительной номенклатуре к названию углеводорода, соответствующего наиболее длинной углеродной цепи, прибавляют в качестве префикса название алкоксигруппы (группа атомов R–O) или для эфиров фенолов – название арилоксигруппы (Ar–O):
По радикально-функциональной номенклатуре после перечисления названия радикалов в алфавитном поряжке называют слово эфир:
Для эфиров помимо изомерии, обусловленной строением цепи углеводородных остатков, встречается другая разновидность структурной изомерии – метамерия: метамеры – это соединения, отвечающие одной общей формуле, но отличающиеся между собой радикалами, связанными с одинаковым атомом или группой атомов. Например, два простых эфира – диэтиловый и метилпропиловый эфир являются метамерами, поскольку отвечают одной общей формуле – С4Н10О, но различаются радикалами, связанными с атомом кислорода:
К простым эфирам можно относить и циклические соединения, содержащие гетероатом (или гетероатомы) кислорода:

Способы получения
Кислотно-катализируемый метод.Эфиры с двумя одинаковыми радикалами – симметричные эфиры – удобно получать путём межмолекулярной дегидратации в присутствии серной кислоты как водоотнимающего средства. По этому методу спирт берут в избытке. Таким способом получают диэтиловый эфир:
Из алкоголятов и алкилгалогенидов (синтез Вильямсона) (см. разд. 13.3.2. и 12.3.2.).
Из алкоголятов (фенолятов) действием диалкилсульфатов:
Присоединением алкенов (или алкинов) к спиртам и фенолам (по правилу Марковникова):

Физические свойства
Диметиловый и метилэтиловый эфиры в обычных условиях – газы. Начиная с диэтилового эфира и далее по мере увеличения молекулярной массы вещества представляют собой легколетучие жидкости с характерным запахом.
Температуры кипения простых эфиров гораздо ниже, чем у соответствующих спиртов. Объясняется это отсутствием межмолекулярных водородных связей. Простые эфиры по-разному растворимы в воде: растворимость диэтилового эфира составляет 7,5 г на 100 г воды, а диметиловый эфир и тетрагидрофуран хорошо смешиваются с водой.
Химические свойства
Анализ значений валентных углов С–О–С в простых эфирах свидетельствует о том, что в диалкиловых эфирах он приближается к тетраэдрическому и равен 109-112о.
В алкилариловых и диариловых эфирах валентный угол близок к 120о. По этой причине дипольные моменты связей С–О–С не компенсируют друг друга (молекула не линейная). Алкильные радикалы проявляют +I-эффект, благодаря чему связь С–О полярна. Длина связи С–О несколько меньше, чем С–С в алканах. Простые эфиры обладают более сильными электронодонорными свойствами, чем спирты, что объясняется влиянием двух алкильных радикалов (+I-эффект).
Основные свойства
На атоме кислорода имеются неподелённые пары электронов, поэтому эфиры могут проявлять свойства жёстких оснований (согласно определению Льюиса). В то же время нуклеофильность этого реакционного центра повышена из-за влияния алкильных радикалов.
Все эти особенности строения свидетельствуют о том, что простые эфиры способны в присутствии сильных кислот (серная, хлороводородная и т.д.) протонироваться с образованием солей оксония:
Такие оксониевые соединения представляют собой соли слабого основания – эфира и сильной кислоты и поэтому гидролизуются при разбавлении водой с выделением эфира.
Кислоты Льюиса, например, BF3, SnCl4, ZnCl2, MgCl2 с простыми эфирами образуют так называемые эфираты, которые по сути представляют собой оксониевые соединения. Они отличаются значительной устойчивостью:
В эфиратах связь между атомом кислорода и кислотой Льюиса осуществляется за счёт неподелённой пары электронов кислорода, т.е. по донорно-акцепторному механизму.
Расщепление простых эфиров
Расщепление простой эфирной связи можно осуществить, если алкоксигруппу превратить в легко уходящую группу. Такое преобразование осуществляется путём перевода простых эфиров в оксониевые соединения под действием галогеноводорода. Галогенид-анион является нуклеофилом, атакующим α-углеродый атом. Уходящей группой является спирт.
Под действие галогеноводородных кислот эфирная связь легче всех разрывается под влиянием HI, поскольку нуклеофильность йодид аниона :I- наибольшая среди всех галогенид-анионов (I- > Br- > Cl- > F-).
Концентрированная йодистоводородная кислота разлагает простой эфир на холоду с образованием алкилйодида и спирта:
Расщепление простых эфиров под действием галогеноводородов может протекать как по SN2, так и по SN1 механизмам. По механизму реакции можно определить с участием какого алкильного радикала образуется галогеналкан, и какого – спирт (или фенол):
Концентрированная серная кислота разлагает простые эфиры либо до диалкилсульфата, либо до алкилсерной кислоты и спирта:
Металлический натрий при нагревании разлагает простые эфиры (реакция Шорыгина) с образованием алкоголята натрия и алкилнатрия:
14.3.3. Реакции по α-положению
В простых эфирах атом водорода в α-положении может замещаться по радикальному механизму. У образующегося свободного радикала орбиталь с неспаренным электроном взаимодействует с одной из двух несвязывающих р-орбиталей атома кислорода, заселённой парой электронов. Такая делокализация приводит к тому, что возникает выгодная электронная конфигурация, при которой три электрона распределены между двумя атомами – α-углеродным атомом и кислородом:
α-Положение простых эфиров легко окисляется по свободнорадикальному механизму замещения. Окисление легко происходит даже кислородом воздуха на свету. Продуктами реакции являются гидропероксиды, которые токсичны и взрывоопасны. Особенно легко гидропероксиды образует диизопропиловый эфир:

14.4. Оксираны (эпоксиды, α-оксиды)
Для трёхчленных циклических эфиров более целесообразно использовать название оксираны, поскольку это соответствует номенклатуре гетероциклических соединений.
Их ещё называют эпоксидами. Для простейших соединений сохраняются названия этиленоксид и пропиленоксид:

Получают оксираны из галогенгидринов действием оснований:
Оксиран является очень реакционоспособным соединением, взаимодействующим как с электрофильными, так и нуклеофильными реагентами:

Отдельные представители
Диэтиловый эфир Н5С2–О–С2Н5. Очень подвижная, летучая жидкость с сильным характерным запахом. Кипит при температуре 35о; температура воспламенения 160-165о. Пары эфира тяжелее воздуха в 2,5 раза. При работе с диэтиловым эфиром надо учитывать все его свойства: способность легко взрываться; при длительном контакте вызывать признаки сонливости; при хранении на свету окисляться с образованием токсических и взрывоопасных гидропероксидов. Перегонять эфир можно только на водяной бане. Используемый для медицинских целей «наркозный» эфир должен быть идеально очищенным от примесей и особенно от гидропероксидов.
Диглим Сh4OCh3Ch3O Ch3Ch3O Сh4 (диметиловый эфир диэтиленгликоля, 2,2’-диметоксидиэтиловый эфир). Является хорошим растворителем и характеризуется высокой сольватирующей способностью по отношению к ионам металлов, что объясняется донорным эффектом трех атомов кислорода одновременно. Находит широкое применение в аналитической химии.
Вопросы для самоподготовки
1. Напишите формулы: этиленоксида; анизола; 2-метоксипентана; орто-крезола; 1-этоксибутана; гексанола-2. Какие из этих веществ являются изомерами, а какие относятся к простым эфирам?
2. Какие исходные вещества следует взять, чтобы получить: 1-этоксибутанол; анизол; 1,4- диоксан. Назовите исходные вещества.
3. Используя в качестве исходных веществ ацетилен и фенол получите винилфениловый эфир, а из него фенилэтиловый эфир.
4. Приведите уравнения реакций, по которым из этиленхлоргидрина (2-хлорэтанола) можно получить этиленгликоль, акрилонитрил и коламин.
5. Охарактеризуйте отношение диэтилого, фенилэтилого и дифенилового эфиров к кислотному и щелочному гидролизу.
6. Заполните схему и назовите все вещества.
Глава 15. Тиолы и сульфиды
Из многочисленных групп сераорганических соединений, в молекулах которых атом углерода связан с атомом серы*, в данной главе будут рассмотрены тиолы и дисульфиды.
Тиолы (меркаптаны) – соединения, в которых углеводородный радикал связан с гидросульфидной группой –SH, называемой меркаптогруппой. Общая формула тиолов R–SH, где R – радикал алифатического или ароматического ряда. Алифатические тиолы иначе называются тиоспиртами, а ароматические – тиофенолами.
Сульфиды органические (тиоэфиры) – соединения общей формулы R–S–R1, которые можно рассматривать как производные сероводорода, в молекуле которого оба атома водорода замещены на углеводородные радикалы. Их следует считать серными аналогами простых эфиров.
Номенклатура тиолов аналогична номенклатуре гидроксипроизводных углеводородов, только вместо суффикса ол используют тиол, или вместо префикса гидрокси применяется префикс меркапто, но только в тех случаях, когда группа SH представляется в качестве заместителя:
Номенклатура ИЮПАК не рекомендует использование названий меркаптаны, тиоспирты, тиофенолы. По радикально-функциональной номенклатуре в названиях сульфидов вначале перечисляют радикалы, а затем добавляется слово сульфид, которое пишется слитно:
Название тиоэфир номенклатурой ИЮПАК также не рекомендуется.
Способы получения
В качестве препаративных методов используют взаимодействие сероводорода с алкенами, алкилбромидами и спиртами:
В реакциях с галогеналканами вместо сероводорода можно использовать гидросульфид натрия, что уменьшает протекание побочных реакций:
Ароматические тиолы можно получить восстановлением аренсульфонилхлоридов:
или взаимодействием галогенаренов с гидросульфидом натрия (калия). Замещение галогена на группу SH проходит значительно легче, если в ароматическом ядре содержатся электроноакцепторные заместители:
Традиционными методами получения сульфидов являются реакции алкилирования (или арилирования) с использованием сульфидов щелочных металлов. Из алкилгалогенидов образуются симметричные сульфиды:
Несимметричные сульфиды можно получить присоединением тиолов к алкенам (или алкинам):
Для получения диарилсульфидов используют реакцию галогенидов серы с аренами в присутствии кислот Льюиса:
Физические свойства
В обычных условиях метантиол – газ, а его гомологи представляют собой жидкости, кипящие при температурах выше 35оС. Все тиолы и сульфиды характеризуются неприятным запахом. Тиолы и сульфиды плохо растворимы в воде, но хорошо растворяются в органических растворителях.
Химические свойства
Сера как элемент подгруппы кислорода является его электронным аналогом. Валентный угол в воде составляет 104,5о, а валентный угол в сероводороде составляет 92,2о. В спиртах валентный угол С–О–Н равен примерно ~109о, а в тиолах валентный угол С–S–H составляет 100 – 104о. Энергия связей Н–О 460 кДж/моль, а С–ОН 344кДж/моль. Энергия связей S–H и C–SH соответственно равны 339 кДж/моль и 260 кДж/моль. Полярность связи S–H значительно ниже, чем связи O–H. По сравнению со спиртами тиолы являются более сильными электронодонорами; межмолекулярные водородные связи у тиолов слабее, поэтому у них температуры кипения ниже, чем у спиртов.
Кислотные свойства
Кислотные свойства тиолов обусловлены ионизацией связи S–H. По сравнению со спиртами тиолы являются значительно более сильными кислотами и это объясняется особенностью строения тиолят-аниона, в котором отрицательный заряд делокализован в большей степени, чем в алкоголят-анионе.
При взаимодействии с щелочами они образуют растворимые в воде тиоляты:
С катионами тяжелых металлов тиолы образуют нерастворимые тиоляты, которые, по сути, представляют собой соли ковалентного характера. С точки зрения принципа ЖМКО Пирсона тиолят-анион является «мягким» основанием, а катион ртути (II) – мягкой кислотой:
Нуклеофильные свойства
Тиолы и особенно тиолят-анионы являются более сильными нуклеофилами по сравнению с соответствующими алкоксид-анионами, что объясняется высокой поляризуемостью атома серы.
Тиолы и сульфиды как нуклеофилы проявляют высокую реакционную способность, вступая в реакции алкилирования (арилирования), ацилирования и присоединения:
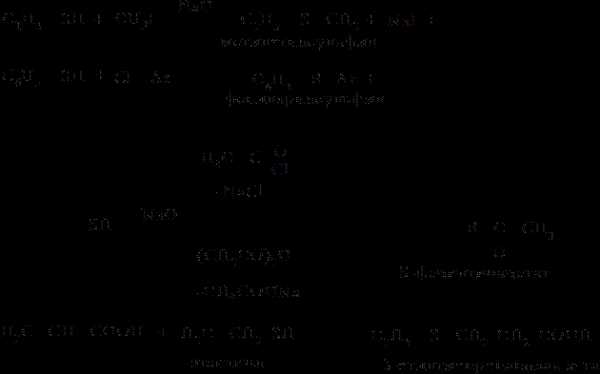
Сульфиды, будучи сильными нуклеофилами, способны взаимодействовать с алкилирующими реагентами с образованием устойчивых сульфониевых солей:

Окисление
Как тиолы, так и сульфиды способны окисляться и в зависимости от условий образуются разные продуты реакции:
в мягких условиях (кислород воздуха, гидроксиламин или йод) из тиолов образуются замещенные дисульфиды, содержащие дисульфидный мостик, являющийся аналогом пероксидного мостика.
В отличие от органических пероксидов дисульфидная связь более прочная:
под действием более сильных окислителей из тиолов образуются соответствующие сульфоновые кислоты, а из сульфидов – сульфоксиды:
Восстановление
Применение каталитического гидрирования позволяет восстановить тиолы до соответствующих углеводородов:
Из дисульфидов в этом случае образуются тиолы:
Вопросы для самоподготовки
1. Дайте определение следующим классам соединений: тиолы, сульфиды, дисульфиды. Приведите примеры соединенйи каждого ряда
2. Какие тиолы и спирты можно получить из углеводородов состава С4H8? Объясните, почему тиолы проявляют более выраженные кислотные свойства?
3. Запишите уравнениями реакций следующие превращения.
4. Объясните причину нуклеофильности тиолов? Сравните нуклеофильного свойства 2,4 –динитрофенола; n-(трет-бутил)-тиофенола, тиофенола.
5. Предложите реакции получения диэтилсульфида и охарактеризуйте его химические свойства.
cyberpedia.su
Эфиры простые классификация - Справочник химика 21
Классификация химических реакций целлюлозы как полимера рассмотрена выше в разделе, посвященном особенностям химических реакций полисахаридов древесины (см. П.3.1). У технической целлюлозы, выделенной из древесины, наибольшее значение из полимераналогичных превращений на практике имеют реакции функциональных групп. К этим реакциям относятся реакции получения сложных и простых эфиров, получения щелочной целлюлозы, а также окисление с превращением спиртовых групп в карбонильные и карбоксильные. Из макромолекулярных реакций наиболее важны реакции деструкции. Реакции сшивания цепей с получением разветвленных привитых сополимеров или сшитых полимеров пока имеют ограниченное применение, главным образом, для улучшения свойств хлопчатобумажных тканей. Реакции концевых групп используются в анализе технических целлюлоз для характеристики их степени деструкции по редуцирующей способности (см. 16.5), а также для предотвращения реакций деполимеризации в щелочной среде. Как и у всех полимеров, у целлюлозы одновременно могут протекать реакции нескольких типов. Так, реакции функциональных групп, как правило, сопровождаются побочными реакциями деструкции. [c.544]
В гл. 10 рассматривались некоторые преимущества классификации органических соединений в соответствии с их функциональными группами. Другим способом классификации различных типов соединений является рассмотрение их как замещенных на органические остатки производных воды, аммиака, сероводорода, азотной или азотистой кислоты и т. д. Во всех этих соединениях на органическую группу замещен один или большее число атомов водорода. Из табл. 11-1 видно, каким образом спирты, простые эфиры, карбоновые кислоты, ангидриды и сложные эфиры можно рассматривать в качестве производных воды меркаптаны и сульфиды — как производные сероводорода амины и амиды — как производные аммиака алкилнитраты — как производные азотной кислоты нитроалканы и алки-нитриты — как производные азотистой кислоты алкилсульфаты — как производные серной кислоты. В целях полноты описания включены также алкил-галогениды, которые выше классифицировали как замещенные алканы, но которые могут рассматриваться и как производные галогеноводородов. [c.254]В дальнейшем возникла теория типов (Жерар), согласно которой все органические вещества можно разделить на типы, соответствующие определенным неорганическим веществам. Например, спирты R—О—Н и простые эфиры R—О—R рассматривались как представители типа воды Н—О—Н, в которой один или два атома водорода замещены pai-дикалами. Теория типов создала довольно совершенную классификацию органических веществ некоторые принципы этой классификации применяются и в настоящее время. Однако в середине XIX столетия, по мере накопления все новых сведений о свойствах органических веществ. Теория типов все чаще оказывалась бессильной не только преД-. сказать, но и объяснить что-либо. [c.24]
Классификация углеводов 219 14. Простые углеводы (моносахариды, или монозы). Строение 220 15. Стереоизомерия моносахаридов 223 16. Получение моносахаридов 227 17. Химические свойства моносахаридов 227 18. Отдельные представители моносахаридов 230 19. Олигосахариды. Дисахариды (биозы) 231 20. Несахароподобные полисахариды (высокомолекулярные углеводы) 234 21. Простые и сложные эфиры целлюлозы 237 22. Древесина, бумага и сульфитно-дрожжевая бражка (СДБ) 239 [c.427]
Углеводы. Их распространение в природе и биологическая роль. Понятие о фотосинтезе. Классификация сахаров простые и сложные (олиго- и полисахариды) тетрозы, пентозы, гексозы, гептозы и т. д. альдозы и кетозы. Доказательство строения глюкозы как пятиатомного альдегидоспирта. Пространственная конфигурация моносахаридов D- и -ряды. Химические свойства моносахаридов. Окисление до альдоновых, уроновых и сахарных кислот, восстановление действие синильной кислоты, гидроксиламина и фенилгидразина (получение озазонов). Эпимеризация. Различие в действии кислот на пентозы и гексозы. Замещение атомов водорода в гидроксильных группах получение сахаратов, сложных эфиров моноз, их простых эфиров, гликозидов. Конденсация моноз с альдегидами и кетонами. [c.188]
Применяемые для технических целей растворители обычна подразделяются на группы по разным признакам. Если за основу классификации принять химическую природу растворителя, то будем иметь группы углеводородов и их галоидопроизводных спиртов, кетонов, сложных и простых эфиров. [c.12]
В последнее время в нашей лаборатории найден даже новый класс катализаторов для гидратации простых эфиров, принципиально отличающийся от окиси алюминия, дегидратирующей спирты до олефинов. В то же время в один класс с реакциями гидратации и дегидратации по новой классификации попадают такие реакции, которые совершенно не сопровождаются отщеплением или присоединением воды, например энолизация и альдолизация, но которые, несомненно, связаны с реакциями дегидратации. [c.192]
Классификация и применение. Эфиры целлюлозы подразделяются на простые и сложи ы е. [c.266]
Эти соединения содержат одну или более спиртовых гидроксильных групп и одну или более аминогрупп, связанных с атомами углерода. Эти соединения содержат как кислородные функциональные группы только спиртов, их простых или сложных эфиров, так и сочетания этих функциональных групп. Любая кислородная функция, находящаяся в не основном сегменте, присоединенном к исходному амино-спирту, при классификации не принимается во внимание. [c.199]
Авторы сохранили общий строй книги, но для облегчения пользования материалом отказались от разделения процессов на реакции, проходящие в присутствии и в отсутствие щелочи, воспользовавщись классификацией по типам реакций. Введены отдельные разделы по хиральным и полимерносвязанным катализаторам, которые отсутствовали в первом издании, а также новые разделы относительно нуклеофильного ароматического замещения и реакций металлоорганических соединений в условиях межфазного катализа. Основную часть книги занимает гл. 3, посвященная практическому использованию межфазного катализа, где достаточно подробно освещены вопросы техники проведения межфазных реакций, а затем последовательно обсуждено применение межфазного катализа в реакциях замещения (синтез галогенидов, включая фториды, синтезы нитрилов, сложных эфиров, тиолов и сульфидов, простых эфиров, Ы- и С-алкилирование, в том числе амбидентных ионов), изомеризации и дейтерообмена, присоединения к кратным С—С-связям, включая неактивированные, присоединения к С = 0-связям, р-элиминирования, гидролиза, генерирования и превращения фосфониевых и сульфониевых илидов, в нуклеофильном ароматическом замещении, в различных реакциях (ион-радикальных, радикальных, электрохимических и др.), в металлоорганической химии, при а-элиминировании (генерировании и присоединении дигалокарбенов и тригалометилид-ных анионов), окислении и восстановлении. В каждом разделе приведены конкретные методики проведения реакций в различных условиях межфазного катализа и таблицы примеров синтеза разнообразных классов соединений. В монографии использовано более 2000 литературных источников. [c.6]
У г л е в о д ы. Классификация. Моносахариды. Строение. Глюкоза и фруктоза. Стереойзомерия моносахаридов. Получение и химические свойства. Дисахариды сахароза, лактоза и мальтоза. Строение. Восстанавливающие и невосстанавливающие сахара. Несахароподобные полисахариды крахмал и целлюлоза. Строение и отличие в строении. Гидролиз к рахмала и целлюлозы. Простые и сложные эфиры целлюлозы. Бумага. Сульфитно-дрожжевая бражка (СДБ). Использование простых эфиров целлюлозы и СДБ в строительстве. [c.170]
П. К какому классу органических соединений относится триаце-тин с точки зрения классификации 1) биохимической, 2) химической а. Кетон б. Липид (жир) в. Простой эфир г. Сложный эфир [c.170]
Если взять любую рациональную классификацию органических соединений, например, по функциональным фуппам, и заполнить ее только структурами природных соединений, то мы увидим очень странную картину отдельные кластеры, густо усеянные разнообразными структурами, области, содержащие лишь отдельные точки, и, наконец, огромные пустые области. В такой системе, например, будут шедро представлены неразветвленные алифатические кислоты с четным числом атомов углерода, но будет маю разветвленных кислот или кислот с нечетным числом атомов углерода будет множество очень причудливо устроенных циклических и полициклических систем, но почти не встретится их простейших представителей. Редкими и случайными структурами будут представлены такие важнейшие классы, как алкилгалогениды, тиолы и сульфиды, нитро- и диазосоединения. Удивительно, но будут отсутствовать даже такие тривиальные соединения, как формальдегид, хлороформ, диэтиловый эфир или тетрагидрофуран. Мы уже не говорим о том, что многие важнейшие классы органических соединений, такие, как, например, различные типы металлоорганических соединений или борорганические производные, вообще никак не представлены в списке природных веществ. [c.52]
В этой монографии методы синтеза простых эфиров разделены на шесть типов в соответствии с механизмом протекающих при этом реакций. Иногда реакции, отнесенные к разным типам, протекают по одинаковым механизмам. В некоторых случаях подобная классификация может показаться поверхностной или произвольной с точки зрения понимания истинного механизма процесса. Однако она придает большую связггость обсуждению, сопровождающему каждый раздел. Наиболее полезным направлением развития методов синтеза этого типа является превращение карбонильных соединений в эпокиси под действием диметилсульфонийметилида [разд. В.4]. [c.325]
Подчеркивалось, что рассматриваемая классификация не является строгой. Существует ряд растворителей, которые нельзя однозначно отнести ни к одной из указанных трех групп, как, например, простые эфиры, сложные эфиры карбоновых кислот, первичные и вторичные амины, Ы-монозамещенные амиды, например Ы-метилацетамид [916]. Выбор в качестве граничной величины бг=15 произволен, но оправдан, так как в растворителях с меньшей диэлектрической проницаемостью ионы ассоциируют и свободные сольватированные ионы наблюдать уже не удается (ср. разд. 2.6). Такое деление растворителей на три группы имеет главным образом эвристическое значение. Полез-I ность этой системы классификации растворителей определяется тем, что в ней особо выделены полярные апротонные раствори-, тели, обладающие чрезвычайно специфической особенностью I сольватировать ионы [73, 92—96]. [c.115]
По химическому строению липиды можно разделить на слож ные эфиры высших жирных кислот и (обычно, но не всегда) глицерина (пропантриола-1,2,3), и амиды жирных кислот — производные длинноцепочечных аминов. По другой классификации различают простые, или нейтральные, липиды (триацилглицерины, некоторые липиды с простой эфирной связью, сложные эфиры холестерина, воска) и сложные, или полярные, липиды (фосфоглицериды, гликозилдиацилглицерины, сфинголипиды), в o hobhoai в соответствии с их хроматографическим поведением. [c.70]
СИЛЫ. Правильный выбор элюирующей силы подвижной фазы является необходимым, но не всегда достаточным условием успешного разделения. Для целенаправленного выбора или изменения состава подвижной фазы необходимо ввести рациональную классификацию растворителей по их селективности, подобно тому, как это было сделано в отношении элюирующей силы. Основой всех способов классификации селективности является различная способность растворителей вступать в межмолекулярные взаимодействия различных типов, представление интегрального параметра элюирующей силы в виде суммы парциальных величин, характеризующих донорные, акцепторные, диполь-дипольные и другие свойства. Отослав заинтересованного читателя к первоисточникам [81—84], остановимся лишь на изображении свойств растворителей в виде треугольника селективности [85]. Вершинам его (рис. 111.32) отвечают гипотетические растворители, способные к межмолекулярным взаимодействиям только одного типа. Окружности в его пределах изображают области, соответствующие реально существующим раствор1 телям группы Б, подразделенным на восемь подгрупп селективности I — алифатические простые эфиры, амины II — алифатические [c.298]
Существует несколько обзоров по получению простых эфиров, наиболее обширный из которых написан Меервейном [89]. В монографии, посвященной химии эфирной связи, имеется раздел [90], лосвященный получению простых эфиров полезную сводку литературы на эту тему дали Бюлер и Пирсон [91] другие примеры синтетических методов можно найти в книгах, посвященных синтезу [92]. В следующих разделах будут обсуждаться некоторые примеры синтеза простых эфиров. Реакции будут сгруппированы по категориям в зависимости от изменения степени окисления атома углерода, образующего новую связь С—О. В некоторых случаях такая классификация является довольно произвольной. Ясно, что синтез любого соединения можно рассматривать как реакцию другого соединения. Поскольку две связи С—О в простых эфирах обычно образуются на различных стадиях синтетической последовательности, большинство синтезов эфиров можно рассматривать как реакции спиртов или их производных (см. гл. 4.1). [c.317]
В начале занятия уточняется классификация изученных органических соединений. Преподаватель предлагает учащимся ответить на вопрос сколько классов органических соединений, содержащих кислородные функциональные группы, им известно. Изучено девять таких классов спирты, фенолы, альдегиды, кетоны, органические кислоты, простые эфиры, сложные эфиры, ангидриды, хлорангидриды кислот. Необходимо предупредить распространенную ошибку, допускаемую учащимися, относящими фенол к ароматическим спиртам. Нужно пояснить, что фенол — это особый тип гидроксильных соединений, проявляющий слабокислые свойства. Ароматический спирт — не фенол, а ароматическое соединение с гидроксилом в боковой цепи, например бензиловый спирт СбНз —СНгОН. [c.116]
В решении вопроса о природе растворов, естественно, могло помочь изучение жидкостей, образующих раствор. Гипотеза о полимерном строении жидкостей была проверена Рамзаем и Шильдсом в 1893 г., изучившими зависимость их поверхностного натяжения от температуры. Они пришли к выводу, что спирты и органические кислоты, подобно воде, — жидкости ассоциированные, а углеводороды, их галогенопроизводные, а также простые эфиры — жидкости неассоциированные. В 1899 г. Ван-Лаар указал, на то, что наблюдающееся при образовании водно-спиртовых смесей уменьшение объема, а также выделение при этом тепла объясняются переходом ассоциированных молекул в неассоциированные. Эти взгляды Ван-Лаара оказались применимы и к объяснению экспериментальных данных об изменении плотности паров неводных растворов. Классификацию жидкостей по степени их ассоциации от почти неассоциированных (нормальные пентан и его гомологи) до типично ассоциированных (вода и уксусная кислота) разработал Кистяковский [49]. [c.142]
Г. С. Петров, Б. Н. Рутовский и И. П. Лосев классифицируют пластмассы по методам их получения и по сырью. Согласно их классификации различают пластмассы на основе 1) продуктов поликонденсации 2) продуктов полимеризации 3) сложных и простых эфиров целлюлозы 4) белковых веществ 5) естественных и искусственных битумов 6) продуктов окисления глицеридов ненасыщенных жирных кислот. Классификация Петрова, РутоБского и Лосева в значительной степени отражает естественно сложившееся в технике и в литературе разделение пластмасс. [c.15]
Сложные эфиры рассматривалпсь как солеподобные производные этерпна и соответствующих кислот. Э. т. позволила впервые наметить нек-рые основы для классификации органич. веществ просто и наглядно показала, что органич. соединения могут быть описаны такими же уравнениями, какие известны в неорганич. химии. Э. т. на экспериментальной основе опроверг в 1834 Ю. Либих. Дюма признал критику Либиха правильной и в 1837 отказался от Э. т. [c.514]
Структурные гомологи, т. е. такие гомологи, которые образуются путем разрыва любого числа связей и включения любых алкиленовых радикалов. К этому ряду относятся все насыщенные одноатомные спирты и все насыщенные простые эфиры. Сеньор сам вынужден признать, что это не особенно полезная классификация . [c.51]
Роузер [16а] рассмотрел классификацию растворителей на основании их склонности к образованию водородных связей и наличия кислотных или основных групп и привел примеры действия растворителей разных типов. Он разделил растворители на шесть классов 1) не образующие водородных связей (углеводороды) 2) растворители, функционирующие при образовании водородных связей как в качестве доноров, так и в качестве акцепторов протонов (вода, спирты, амины, карбоновые кислоты, амиды и пр.) 3) растворители, играющие при образовании водородной связи роль только доноров протонов (хлороформ) 4) растворители, участвующие в водородной связи только как акцепторы протонов (альдегиды, кетоны, простые и сложные эфиры, нитросоединения и пр.) 5) кислоты (доноры — перенос- [c.125]
Химические превращения целлюлозы необходимо рассматривать в тесной взаимосвязи с особенностями химического поведения как низкомолекулярных гидроксилсодержащих соединений (спиртов, моносахаридов), так и всех соединений того класса, к которому относится целлюлоза, — класса полисахаридов. При этом в основу классификации химических превращений целлюлозы могут быть положены либо особенности химического строения образующихся производных (простые и сложные эфиры, продукты окисления, смешанные полисахариды, содержащие элементарные звенья различного строения, блок- и привитые сополимеры), либо механизм протекающих реакций (нуклеофильное или электрофильное замещение или присйединение, радикальная или ионная сополимеризация и др.). [c.15]
Среди реакционноспособных олигомеров широкое применение нашли ненасыщенные олигоэфиры-олигоэфирмалеинатфумараты [3-5]. олигоэфиракрилаты [1,6, 7], олигоэфиры других ненасыщенных кислот, а также акриловые, винильные, аллильные эфиры различных олигомерных соединений [8, 9] и др. Классификация непредельных олигоэфиров может быть проведена по трем основным признакам [2, с. 276-313] природе основной цепи (сложные или простые олиго- [c.7]
Здесь рассматриваются соединения фенола, в которых один или несколько атомов водорода замещены аминогруппой (МНз). Э соединения содержат в качестве кислородных функциональных групп только фенольные функциональные группы, их простые или сложные эфиры, или сочетагие этих функциональных групп. Любая кислородная функциональная группа в не основном сегменте, присоединенном к исходному амино-нафтолу или другому амино-фенолу, при классификации не принимается во внимание. [c.199]
Для классификации в данных субпозициях эфирные или сложноэфирные функциональные группы органической или неорганической кислоты рассматриваются либо как спиртовые, фенольные или кислотные функциональные группы в зависимости от положения кислородной функциональной группы по отношению к аминной группе. В этих случаях должны приниматься во внимание только те кислородные функциональные группы, которые представлены в той части молекулы, которая расположена между аминной функциональной группой и атомом кислорода любой рассматриваемой функциональной группы простого или сложного эфира. Если соединение содержит две или более функциональные группы простого или сложного эфира, то для целей классификации молекула разделяется на сегменты по атому кислорода каждой функциональной группы простого или сложного эфира, и учитываются только те кислородные функциональные группы, которые находятся в том же сегменте, что и аминная функциональная группа сегмент, содержащий аминную функцию рассматривается как "исходный" ("parent") сегмент. Например, в соединении 3-(2-аминоэтокси)пропионовая кислота исходным сегментом является аминоэтанол, а карбоксильная группа при классификации не принимается во внимание так простой эфир аминоспирта классифицируется в субпозиции 2922 19. [c.201]
В связи с простотой, быстротой, широтой применения и относительно малой опасностью внесения загрязнений [64—68, 229—231] экстракция является одним из главных методов разделения при определении следов элементов. Этот метод основан па распределении растворенного вещества между двумя несмешивающимися растворителями. Основным фактором в этом методе является коэффициент распределения, т. е. отношение общих концентраций растворенного вещества в двух жидких фазах после достижения равновесия. Чаще всего используют экстракцию различных металлов из водных растворов такими органическими растворителями, как эфир, хлороформ, четыреххлористый углерод и т. д. Образование нейтральных химических соединений существенно для экстракции элемента органическим растворителем [232 — 234]. В число этих соединений входят простые молекулы с ковалентными связями, гетерополикислоты, внутрикомплексные соединения, ионные ассо-циаты и комбинации некоторых перечисленных типов молекул. Классификация систем для экстракции металлов с этой точки зрения дана в работе Моррисона и Фрейзера [68]. Большинство элементов при определенных условиях образует экстрагируемые комплексы. Ра.зличпые органические [c.94]
Во-первых, классификацию можно провести на основании природы реагента Известно, что сложные эфиры могут гидролизоваться либо щелочами, либо кислотами. Многочисленные факты показывают, что к каждому из этих случаев применимы различные механизмы или даже группы механизмов. В нейтральных растворах протекает значительно менее известная форма гидролиза, которая не является просто промежуточной формой менаду взаимодействием в щелочной и кислой средах. Таким образом, может показаться, что существуют три основные группы механизмов однако мы будем рассматривать только две из этих групп, более близкие между собой и менее тесно связанные с третьей. Дело в том, что как при омылении щелочами, так и при гидролизе в нейтральной среде карбоксильная группа реагирует в виде нейтральной молекулы сложного эфира К СООК, а при гидролизе в кислой среде реагирует ионная сопряженная кислота К СООНК . Принципиально такая же градация применима и к реакциям этерификации. Устойчивость карбоксилат-иона препятствует этерификации в щелочной среде. Можно предполагать, что этерификация протекает и в нейтральной среде, Н0 это не установлено если бы удалось ее осуществить, то карбоксильная группа реагировала бы в форме И СООН. Катализируемая кислотами этерификация хорошо известна реагирует в данном случае К СООН . Гидролиз и этерификацию следует рассматривать совместно, поскольку они являются процессами, обратными один другому. Реакции кислородного обмена между кислотами и водой можно считать особыми случаями (группа Н заменена на Н гидролиза или этерификации. Переэтерификацию эфиров спиртами можно рассматривать как общий случай (Н заменен на К) гидролиза или этерификации. Механизмы всех этих реакций можно подразделить, основываясь на том, происходит или не происходит присоединение протона к карбоксильному соединению. [c.936]
chem21.info

















