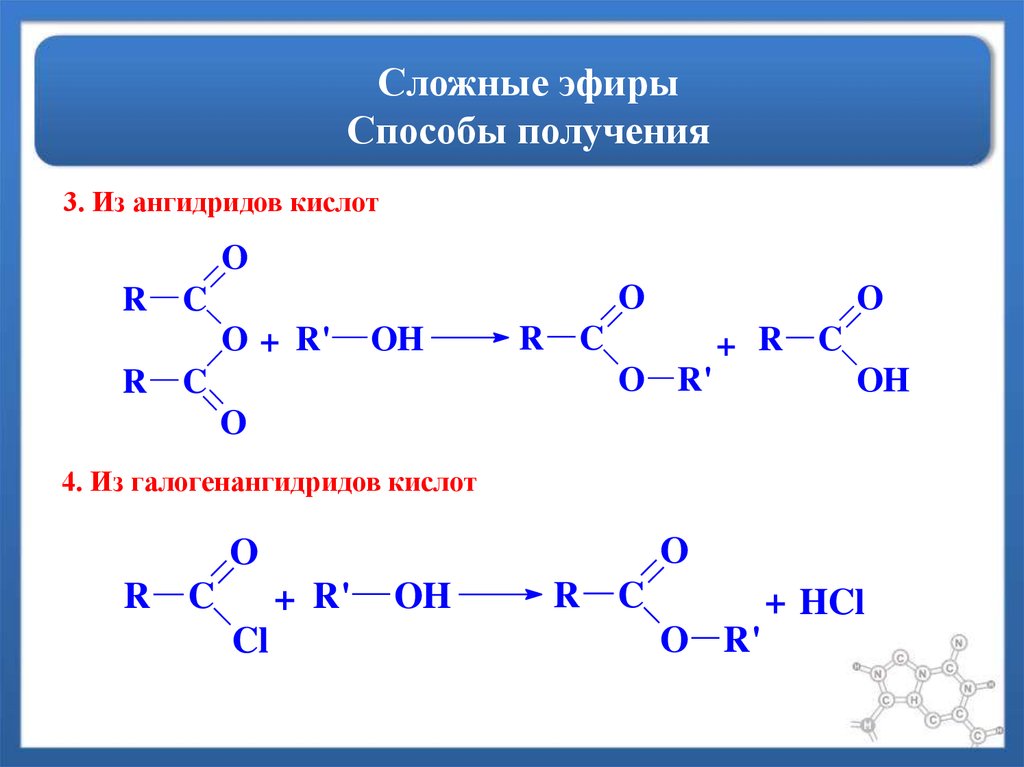
Содержание
14.4. Химические свойства простых эфиров
Простые
эфиры – нейтральные и малоактивные
соединения, в связи с чем их часто
используют в различных органических
реакциях в качестве растворителей.
Поскольку они в большинстве случаев не
реагируют с натрием, то этот металл
используют для сушки простых эфиров.
На них не действуют разбавленные
минеральные кислоты, щелочи. Эфиры не
расщепляются металлорганическими
соединениями, гидридами и амидами
щелочных металлов. Немногие химические
свойства этих соединений связаны с
наличием свободной электронной пары у
атома кислорода, что придает эфирам
основные свойства, а также с наличием
полярных связей С–О, разрыв одной из
которых приводит к расщеплению простых
эфиров.
(C2H5)2O
+ HCl → (C2H5)2OH+Cl
Образовавшаяся
оксониевая соль, как соль слабого
основания, роль которого играет молекула
эфира, легко гидролизуется при разбавлении
водой.
(С2Н5)2ОН+Сl
+ H2O
→ (C2H5)2O
+ HCl
Об
основном характере эфиров свидетельствует
их растворимость в концентрированной
серной кислоте и выделение при низкой
температуре кристаллической оксониевой
соли.
Эту
реакцию применяют для отделения простых
эфиров от алканов и галогеналканов.
Роль
галогенидов бора состоит в отщеплении
галогена от галогеналкана и связывании
его в прочный анион. Триалкилоксониевые
соединения с комплексными анионами –
твердые, вполне устойчивые солеобразные
соединения. При попытке заменить анион
в этих солях на анионы какой-либо обычной
кислоты, т.е. при взаимодействии их с
кислотами, солями и даже с водой,
оксониевые соли распадаются с образованием
простого эфира и алкилированного аниона.
Триалкилоксониевые соли являются самыми
сильными алкилирующими средствами
(сильнее галогеналканов и диалкилсульфатов).
Эфир
используют в качестве растворителя в
реакции
Гриньяра,
т.к. он обладает способностью сольватировать
и, таким образом, растворять реагент.
Он выступает как основание по отношению
к кислому атому магния.
Диэтиловый
эфир в этой реакции можно заменить на
тетрагидрофуран.
Реактивы
Гриньяра можно получить с хорошим
выходом в бензоле в присутствии
триэтиламина в качестве основания;
требуется один моль основания на один
моль галогеналкана.
Как
основания Льюиса простые эфиры образуют
комплексы,
в которых эфир играет роль донора
электронов, а галоген – акцептора. Так,
раствор иода в диэтиловом эфире окрашен
в коричневый цвет, в отличие от фиолетовой
окраски в инертных растворах. Такие
комплексы получили название комплексов
с переносом заряда (КПЗ).
Расщепление
простых
эфиров.
Простые
эфиры при нагревании до 140 ºС с
концентрированными кислотами (H2SO4,
HBr и, особенно, HI) способны подвергаться
расщеплению. Эта реакция была открыта
Эта реакция была открыта
А. Бутлеровым в 1861 г. на примере
2-этоксипропановой кислоты.
Под
воздействием иодоводородной кислоты
эфир первоначально превращается в иодид
диалкилгидроксония. Это приводит к
увеличению полярности связей С–О и
облегчению гетеролитического расщепления
одной из них с образованием хорошей
уходящей группы – молекулы спирта. Роль
нуклеофила выполняет иодид-ион:
При
расщеплении метил- и этилалкиловых
эфиров действие нуклеофила направлено
на более пространственно доступный
метильный или этильный радикал. На этой
особенности основан количественный
метод
Цейзеля
– определение метокси- и этоксигрупп
в органических соединениях.
Следует
отметить, что если один из алкилов
третичный, то расщепление идет особенно
легко.
Реакция
протонированного эфира с ионом галогена,
так же как соответствующая реакция
протонированного спирта, может протекать
как по SN1,
так и SN2-механизмам
в зависимости от строения эфира.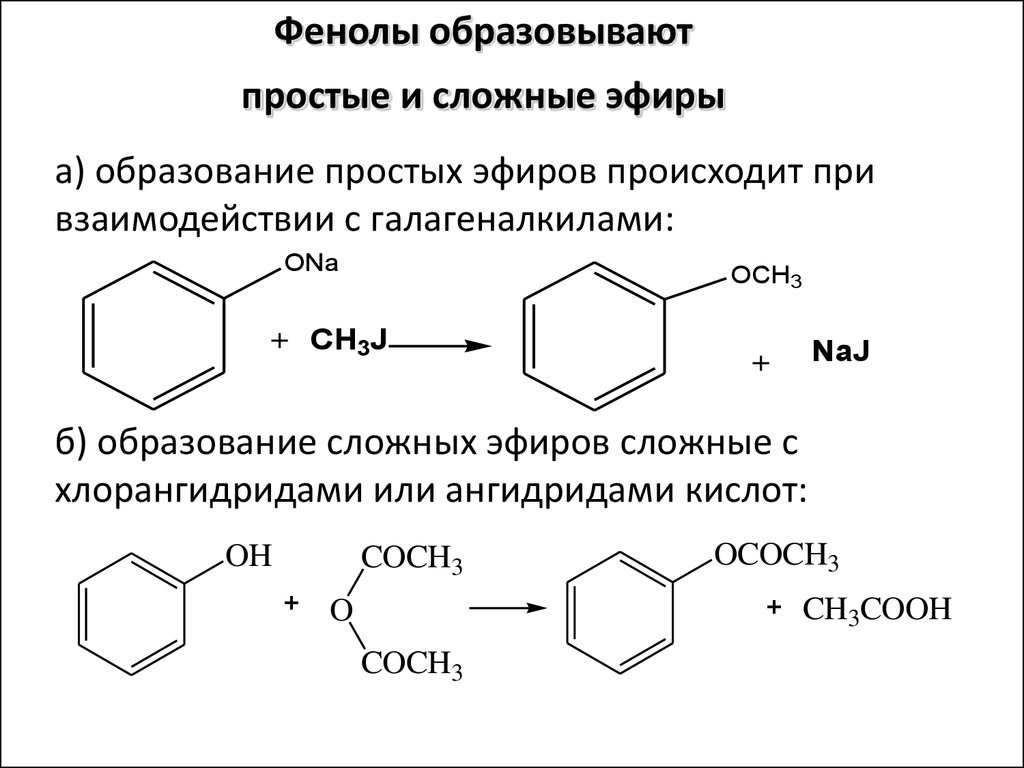 Как и
Как и
следовало ожидать, первичная алкильная
группа имеет тенденцию к SN2,
в то время как третичная – к SN1-замещению:
Реакции
по
-водородному
атому.
Наличие в эфирах атома кислорода
сказывается на поведении атомов
водородов, особенно находящихся в
α-положении. Такая региоселективность
объясняется стабильностью радикала
R-ĊH-Ö-R, где неспаренный электрон
2р-орбитали
углерода перекрывается с неподеленной
парой 2р-электронов
атома кислорода.
Наиболее
эффективно и избирательно протекают
свободнорадикальные реакции хлорирования.
Так, при обработке диэтилового эфира
рассчитанным количеством хлора на свету
образуется α-монохлорид.
Скорость
реакций α-хлорзамещенных эфиров на
много порядков выше по сравнению с
соответствующими галогеналканами. Они
чрезвычайно легко вступают в реакции
нуклеофильного замещения, особенно
протекающие через образование устойчивого
промежуточного карбокатиона, т. е. по
е. по
механизму SN1.
Эта устойчивость отражается резонансными
структурами:
.
Подобные
реакции широко используют в органическом
синтезе.
Примечательно,
что, меняя условия проведения реакции,
ее можно направить по пути
дегидрогалогенирования с получением
простых виниловых эфиров.
Особенно
легко подвергаются аутоокислению эфиры,
содержащие атом водорода у третичного
углерода. Спонтанно образующиеся при
стоянии гидропероксиды эфиров
исключительно взрывоопасны. Будучи
менее летучими, по сравнению с исходными
эфирами, они не отгоняются вместе с
эфирами, а накапливаются в колбе. По
этой причине эфиры нельзя отгонять
досуха, т. к. в противном случае может
произойти взрыв. Гидропероксиды должны
быть тщательно удалены из эфира с помощью
восстановителей – солей железа(II) или
олова(II).
Тестом
на наличие пероксидов является обработка
пробы эфира водным раствором иодида
калия. Появление характерного коричневого
окрашивания, а в присутствии крахмала
– синего цвета указывают на присутствие
гидропероксидов.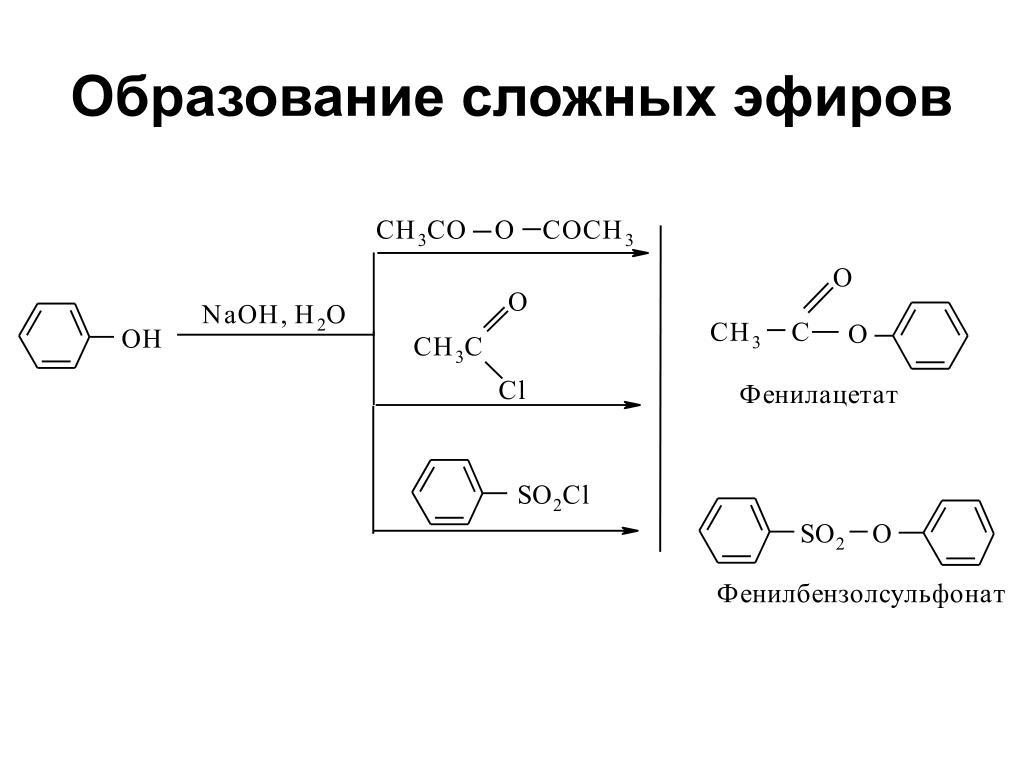
Получение — простой эфир — фенол
Cтраница 1
Получение простых эфиров фенолов с помощью диалкилсуль-фата, по Ульману, протекает в две стадии. Первая стадия: R — ОН S04 ( Gh4) 2 — R O-CHg S04HGh4, легко протекает уже при слабом нагревании. В том случае, когда перерабатываются небольшие количества и когда стоимость алкилсульфата ничтожна по сравнению со стоимостью алкилированного вещества, обычно этим и ограничиваются. Однако часто оказывается возможным использовать для алкилирования и вторую алкильную группу диалкилсульфата. В качестве примера можно указать получение анизола по Гирсу иХагеру, описанное в Синт.
[1]
Для получения простых эфиров фенолов также сначала получают раствор этилата натрия из 0 25 г-экв натрия и 300 мл абсолютного спирта. Благодаря более высокой нуклеофильной силе фенолят реагирует с алкилирующим агентом легче, чем спирт.
[2]
Для получения простых эфиров фенолов также сначала получают раствор этилата натрия из 0 25 молей натрия и 300 мл абсолютного спирта.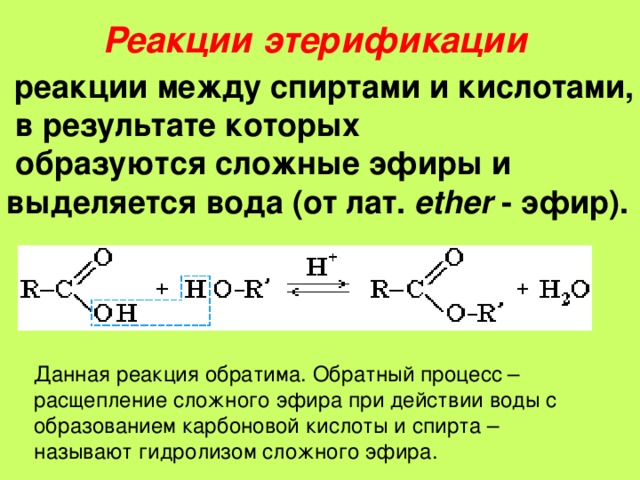 Затем к раствору добавляют 0 2 моля фенола в небольшом количестве абсолютного этилового спирта. После добавления алкилирующего средства процесс ведут так же, как описано выше. Поскольку фенолят имеет высокую нуклеофиль-ность, он реагирует с алкилирующим средством легче, чем спирт.
Затем к раствору добавляют 0 2 моля фенола в небольшом количестве абсолютного этилового спирта. После добавления алкилирующего средства процесс ведут так же, как описано выше. Поскольку фенолят имеет высокую нуклеофиль-ность, он реагирует с алкилирующим средством легче, чем спирт.
[3]
Медный порошок катализирует реакцию получения простых эфиров фенолов.
[4]
Растворитель сильно влияет на процесс получения простых эфиров фенолов. В частности, это наблюдается при работе с бромистым аллилом, циннамил бромидом и галоидными бензилами. Эти галоидные соединения реагируют с сухими фенолятами щелочных металлов в недиссоциирующих растворителях, например в бензоле или толуоле, с образованием фенолов, замещенных в ядре.
[5]
Растворитель сильно влияет на процесс получения простых эфиров фенолов. В частности, это наблюдается при работе с бромистым аллилом, циннамилбромидом и галоидными бензилами. Эти галоидные соединения реагируют с сухими фенолятами щелочных металлов в недиссоциирующих растворителях, например в бензоле или толуоле, с образованием фенолов, замещенных в ядре.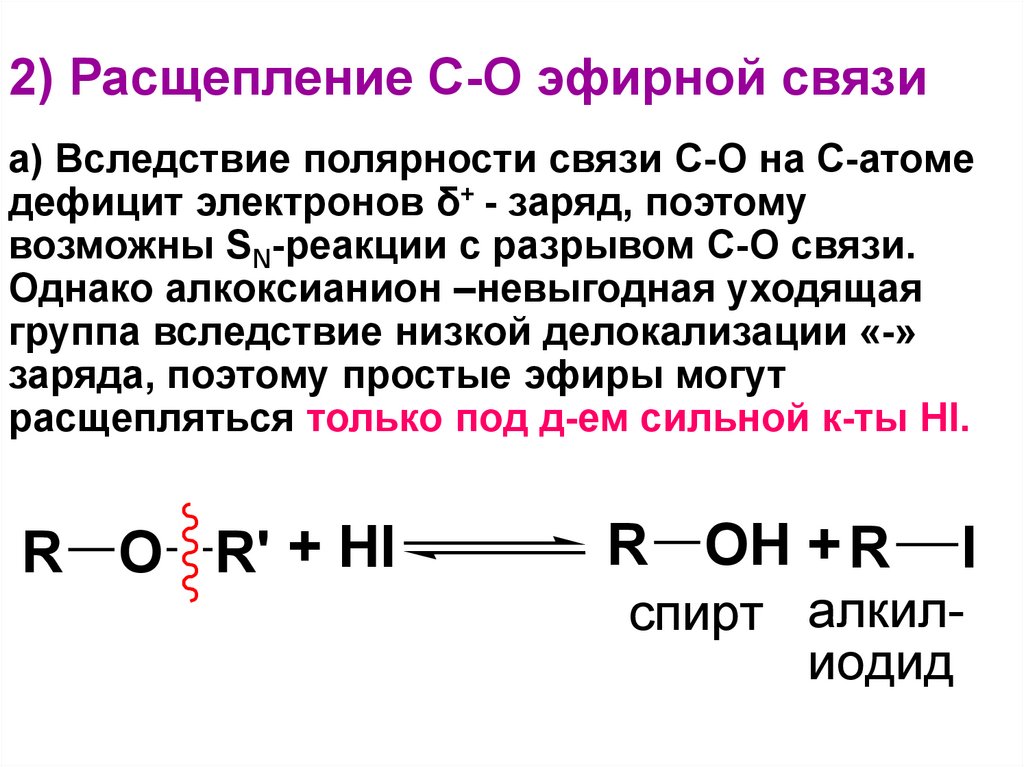
[6]
В общем же случае образуется смесь эфира фенола и углеводорода, поэтому и восстановительное дезаминирование и получение простых эфиров фенолов осуществляют другими методами.
[7]
С дигалогенпроизводными реакции могут протекать селективно [ О. Для получения простых эфиров фенолов используют хлоруксусную кислоту [ О.
[8]
С) представляют собой жидкости с ароматическим запахом, которые легко получаются алкилированием фенола диметил — или диэтил-сульфатом в слабощелочной водной среде. Это обычный путь получения простых эфиров фенолов, но в отдельных случаях алкилирование проводят при помощи диазометана или диазоэтана. Фенолы часто превращают в простые эфиры, чтобы предотвратить окисление и другие нежелательные побочные процессы при проведении реакций, не связанных с изменениями кислородсодержащей группы; защитная группа может быть в дальнейшем удалена и гидроксил регенерирован.
[9]
Их широко применяют в качестве алкилирующих агентов вместо дорогостоящих йодистых метила и этила, с которыми трудно работать вследствие их летучести. Характерной реакцией алкилирова-ния является получение простых эфиров фенолов.
Характерной реакцией алкилирова-ния является получение простых эфиров фенолов.
[10]
Страницы:
1
18.2: Подготовка эфиров — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 36366
Цели
После завершения этого раздела вы сможете
- напишите уравнение, иллюстрирующее промышленное получение простых симметричных эфиров.
- напишите уравнение, иллюстрирующее синтез простых эфиров по Вильямсону.
- идентифицируют эфир, полученный в результате реакции данного алкилгалогенида с данным ионом алкоксида.
- определяют реагенты, необходимые для получения данного эфира посредством синтеза Вильямсона.

- определите ограничения синтеза Вильямсона и сделайте правильный выбор, решая, как лучше всего синтезировать данный эфир.
- напишите уравнение, описывающее образование алкоксида из спирта.
- идентифицируют оксид серебра(I) как реагент, который можно использовать в синтезе Вильямсона.
- напишите уравнение, показывающее, как можно получить эфир алкоксимеркурированием-демеркурированием алкена.
- идентифицируют продукт, образованный алкоксимеркурированием-демеркурированием данного алкена.
- идентифицируют алкен, реагенты или и то, и другое, необходимые для получения данного эфира в процессе алкоксимеркурирования-демеркурирования.
- напишите подробный механизм реакции между алкеном, спиртом и трифторацетатом ртути(II).
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте ключевые термины ниже.
- алкоксимеркурация
- оксимеркурация
- Синтез эфира Вильямсона
Study Notes
Мы изучали оксимеркурирование как метод превращения алкена в спирт в разделе 8.5. «Алкоксимеркурирование» — очень похожий процесс, за исключением того, что теперь мы превращаем алкен в эфир. Два процесса сравниваются ниже.
| Описание | оксимеркурация | алкоксимеркурация |
|---|---|---|
| мы реагируем на | алкен | алкен |
| с | вода | спирт |
| в наличии | Hg(O 2 CCH 3 ) 2 | Hg(O 2 CCF 3 ) 2 |
| с последующей обработкой | NaBH 4 | NaBH 4 |
| для производства | спирт | эфир |
Рассмотрите механизм реакции оксимеркурирования в разделе 8.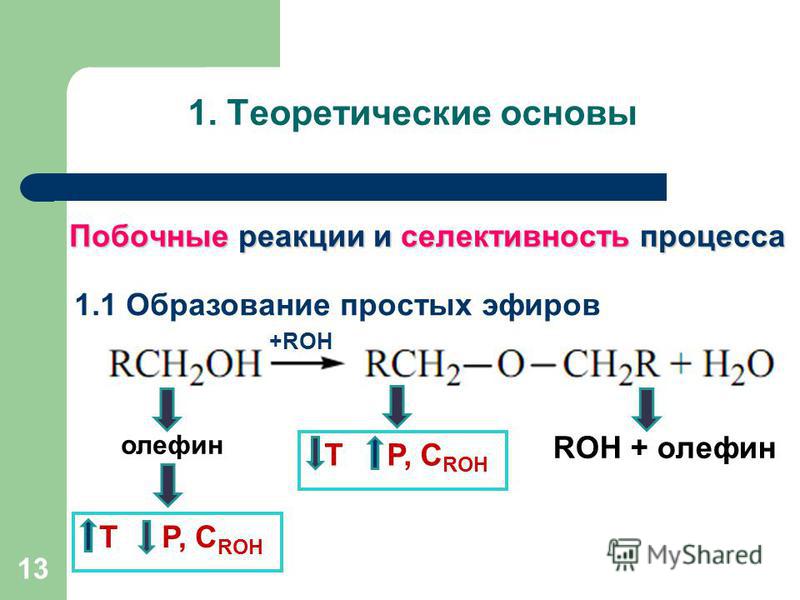 5, уделяя особое внимание региохимии и стереохимии реакции. Механизм идентичен алкоксимеркурированию.
5, уделяя особое внимание региохимии и стереохимии реакции. Механизм идентичен алкоксимеркурированию.
Получение эфира посредством дегидратации
Кислотно-катализируемая дегидратация малых 1º-спиртов представляет собой специализированный промышленный метод получения симметричных эфиров. Эта реакция не может быть использована для получения несимметричных эфиров, так как может быть получена смесь продуктов. Кроме того, спирты 2 o и 3 o нельзя использовать для этой реакции, поскольку они дегидратируются с образованием алкенов по механизму E1 ( Раздел 17-6 ).
9oC] CH_3CH_2\связь{-}O\связь{-}CH_2CH_3 + H_2O} \tag{18.2.1}\]
Механизм
На первом этапе механизма реакции один спирт протонируется, чтобы стать хорошим выходом группа. На втором этапе второй спирт вытесняет воду из протонированного спирта во время реакции S N 2 с образованием протонированного эфира. На последнем этапе это промежуточное соединение депротонируется с получением симметричного эфира.
Синтез эфира Вильямсона
Одна важная процедура, известная как Williamson Ether Synthesis , происходит в результате реакции S N 2 алкоксидного нуклеофила с первичным алкилгалогенидом или тозилатом. Как обсуждалось ранее в разделе 17-2 , алкоксиды обычно создаются путем депротонирования спирта сильным основанием, таким как гидрид натрия (NaH). Простые спирты можно использовать в качестве растворителя во время синтеза эфира Вильямсона и с их алкоксидом, созданным путем добавления металлического натрия (Na (s) ).
Планирование синтеза эфира Вильямсона
Синтез эфира Вильямсона имеет те же ограничения, что и другие реакции S N 2 , как описано в Раздел 11-3 . Так как анионы алкоксидов являются сильными основаниями, использование 2 90 146 o 90 147 или 3 90 146 o 90 147 уходящих галогенных групп может привести к образованию продукта отщепления Е2. При рассмотрении вопроса о синтезе несимметричного эфира возможны две различные комбинации реагентов, и каждая из них должна быть тщательно рассмотрена. Как правило, предпочтительным будет путь, в котором используется наименее стерически затрудненный галоген.
Как правило, предпочтительным будет путь, в котором используется наименее стерически затрудненный галоген.
При разрыве ключевой связи в молекуле-мишени участвует связь C-O. Поскольку несимметричные эфиры имеют две уникальные связи CO, каждую из них можно разорвать, чтобы получить уникальный набор реагентов. После расщепления фрагмент с кислородом станет алкоксидом. Другой фрагмент станет галогеном или тозилатом.
Рабочий пример \(\PageIndex{1}\)
Как бы вы получили следующую молекулу, используя синтез эфира Вильямсона?
- Ответить
Анализ: Эфир асимметричен, поэтому каждую из связей СО можно разорвать, чтобы создать другой набор возможных реагентов. После разрыва связи C-O путь 1 показывает галоген 3 o в качестве исходного материала. Эта реакция, скорее всего, будет неэффективной из-за того, что алкоксиды реагируют с 3 o галогенами с предпочтительным образованием алкенов путем отщепления Е2.
 Путь 2 показывает галоген 1 o в качестве исходного материала, который является благоприятным для S N 2 реакции.
Путь 2 показывает галоген 1 o в качестве исходного материала, который является благоприятным для S N 2 реакции.Путь 1
Решение 1
Путь 2
Решение 2
Синтез эфира с использованием оксида серебра
Вариант синтеза эфира по Вильямсону использует оксид серебра (Ag 2 O) вместо сильного основания. Условия этого варианта мягче, чем типичный синтез Уилламсона, потому что нет необходимости в сильном основании и образовании промежуточного алкоксида. Эта реакция особенно полезна при превращении групп -ОН на сахаре в простые эфиры.
Механизм
Во время этой реакции частично положительно заряженное серебро в Ag 2 O оттягивает электронную плотность от йода в CH 3 I. Это соответственно удаляет электронную плотность от соседнего углерода, увеличивая его частичный положительный заряд, который повышает его электрофильность. Это позволяет спирту действовать как нуклеофил в последующей реакции S N 2 .
Это позволяет спирту действовать как нуклеофил в последующей реакции S N 2 .
Синтез эфира с использованием алкоксимеркурации
Алкоксимеркурирование , построено по образцу реакции оксимеркурирования, описанной в Разделе 8-4 . Реакция алкена со спиртом в присутствии соли трифторацетата ртути (II) [(CF 3 CO 2 ) 2 Hg] дает продукт алкоксимеркурирования. Демеркурация с использованием боргидрида натрия (NaBH 4 ) дает эфирный продукт. В целом, эта реакция позволяет Марковникову присоединить спирт к алкену с образованием эфира. Обратите внимание, что спиртовой реагент используется в качестве растворителя, а соль трифторацетата ртути (II) используется вместо ацетата ртути (трифторацетат-анион является более слабым нуклеофилом, чем ацетат). Большинство 1 o , 2 o , 3 o спирты могут быть успешно использованы для этой реакции.
Механизм
Механизм алкоксимеркурирования подобен механизму оксимеркурирования с электрофильным присоединением соединений ртути к алкену.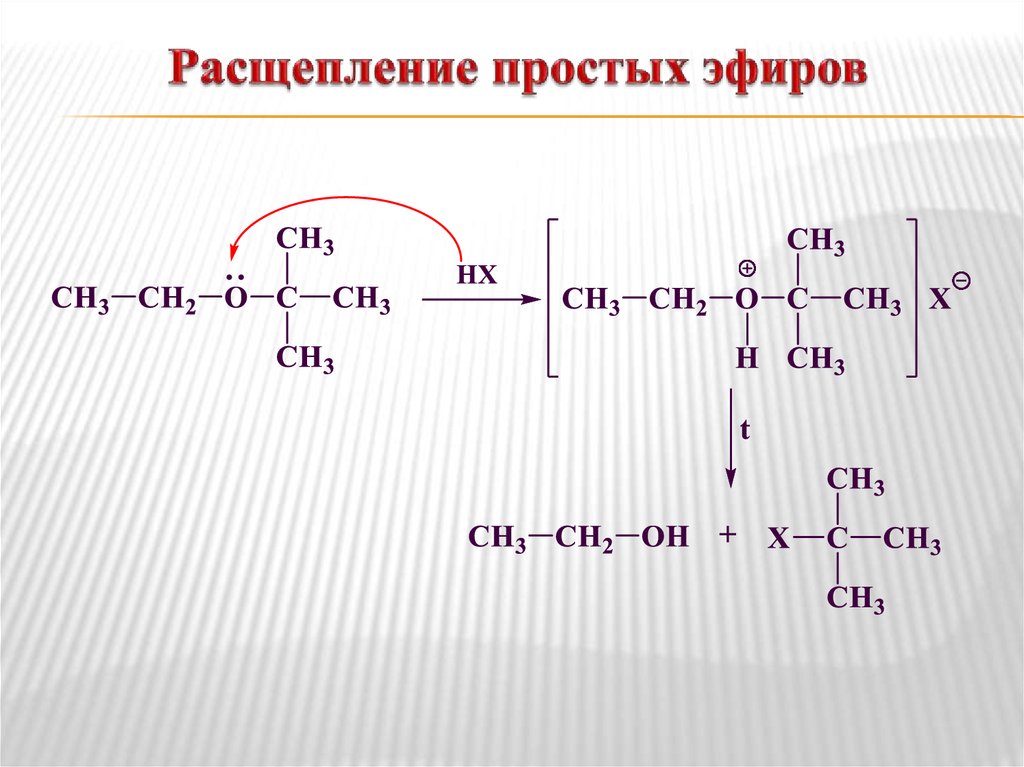 Спиртовой нуклеофил атакует более замещенный углерод трехчленного кольца по реакции S N 2 . Наконец, боргидрид натрия (NaBH 4 ) обеспечивает восстановительную демеркурацию с образованием эфирного продукта.
Спиртовой нуклеофил атакует более замещенный углерод трехчленного кольца по реакции S N 2 . Наконец, боргидрид натрия (NaBH 4 ) обеспечивает восстановительную демеркурацию с образованием эфирного продукта.
Планирование синтеза эфира с использованием алкоксимеркурации
Расщепление ключевой связи в молекуле-мишени включает связь C-O. Поскольку несимметричные эфиры имеют две уникальные связи CO, каждую из них можно разорвать, чтобы получить уникальный набор реагентов. После расщепления фрагмент с кислородом станет спиртом. Алкильный фрагмент будет терять водород от соседнего углерода с образованием алкена. Основным моментом, который следует учитывать при выборе возможных путей синтеза, является способность алкильного фрагмента образовывать алкен.
Рабочий пример \(\PageIndex{2}\)
Как бы вы получили следующую молекулу, используя алкоксимеркурирование?
- Ответить
Анализ: Эфир симметричен, поэтому каждую связь C-O эфира можно расщепить, чтобы получить набор исходных материалов для рассмотрения.
 Первый путь показывает набор исходных материалов, которые должны хорошо работать для этой реакции. Спирт, метанол, можно легко использовать в качестве растворителя. Хотя алкен не имеет определенной более и менее замещенной стороны, его симметрия предотвратит образование смеси продуктов. Фрагментация для пути 2 показывает исходный материал, который не подходит для этой реакции. Алкильный фрагмент имеет только один углерод, который нельзя использовать для образования исходного алкена. Это означает, что путь 2 не является жизнеспособным методом синтеза целевой молекулы.
Первый путь показывает набор исходных материалов, которые должны хорошо работать для этой реакции. Спирт, метанол, можно легко использовать в качестве растворителя. Хотя алкен не имеет определенной более и менее замещенной стороны, его симметрия предотвратит образование смеси продуктов. Фрагментация для пути 2 показывает исходный материал, который не подходит для этой реакции. Алкильный фрагмент имеет только один углерод, который нельзя использовать для образования исходного алкена. Это означает, что путь 2 не является жизнеспособным методом синтеза целевой молекулы.Путь 1
Решение 1
Путь 2
Упражнения
Упражнение \(\PageIndex{1}\)
При получении эфиров с использованием синтеза эфира Вильямсона какие факторы важны при выборе нуклеофила и электрофила?
- Ответить
В идеале нуклеофил должен быть очень основным, но не стерически затрудненным.
 Это сведет к минимуму возникновение любых реакций элиминации. Электрофил должен иметь характеристики хорошего S N 2 электрофил, предпочтительно первичный, чтобы свести к минимуму любые реакции отщепления.
Это сведет к минимуму возникновение любых реакций элиминации. Электрофил должен иметь характеристики хорошего S N 2 электрофил, предпочтительно первичный, чтобы свести к минимуму любые реакции отщепления.
Упражнение \(\PageIndex{2}\)
Как бы вы синтезировали следующие эфиры? Имейте в виду, что есть несколько способов. Синтез эфира Вильямсона, алкоксимеркурирование алкенов, а также замещение, катализируемое кислотой.
(а) (б) (в) (г) (д)
- Ответ
Синтез эфира Вильямсона требует добавления каталитического основания. Кроме того, большинство галогенидов можно заменить, например, на -Br или -Cl. Хотя, как правило, -I — лучшая уходящая группа.
(а)
(б)
(с)
(г)
Обратите внимание, что существует только один простой эфир (также называемый силиловым эфиром и часто используемый в качестве группы защиты спирта). Другая группа представляет собой сложный эфир.

(е)
Упражнение \(\PageIndex{3}\)
Изобразите механизм толкания электронной стрелки для образования диэтилового эфира в предыдущей задаче.
- Ответить
.
Упражнение \(\PageIndex{4}\)
трет-бутоксициклогексан можно получить двумя способами из алкена и спирта, нарисуйте обе возможные реакции.
- Ответить
Хотя оба варианта возможны, верхний путь, вероятно, проще, поскольку оба исходных материала являются жидкими.
Упражнение \(\PageIndex{5}\)
Эпоксиды часто образуются внутримолекулярно. Возьмем, к примеру, это большое кольцо в публикации 2016 года [ Дж. Орг. хим. , 2016 , 81 (20) , стр. 10029–10034]. Какой эпоксид образуется при воздействии основания? (Включить стереохимию)
- Ответ
Упражнение \(\PageIndex{6}\)
Какие реагенты вы бы использовали для выполнения следующих преобразований?
(а)
(б)
(в)
- Ответ
(а)
(b) Обратите внимание на добавление цис
(с)
Окисление до спирта путем гидроборирования и последующее замещение 2-бромпропаном также может работать, но этот путь обеспечивает наименьшую вероятность возникновения реакции отщепления.

Упражнение \(\PageIndex{7}\)
Предскажите произведение следующего.
- Ответить
Результатом является производство диоксана, распространенного растворителя.
Авторы и авторство
18.2: Preparing Ethers распространяется под лицензией CC BY-SA 4.0, автором, ремиксом и/или куратором выступили Стивен Фармер и Дитмар Кеннеполь.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- алкоксимеркурация
- автор@Дитмар Кеннеполь
- автор@Стивен Фармер
- оксимеркурация
- Синтез эфира Уильямсона
Приготовление эфиров — GeeksforGeeks
Спирты, фенол и эфиры имеют несколько применений в бизнесе и повседневной жизни. Спирты и фенолы относятся к гидроксильным органическим веществам. Полироль для дерева, которую мы используем для полировки нашей мебели, содержит спирт, который в основном представляет собой этанол. Ментол, полученный из масла перечной мяты, используется для ароматизации сигарет и пищевых продуктов. Кроме того, начиная со спиртов, можно синтезировать различные органические соединения, такие как алкилгалогениды, алкены, альдегиды, кетоны, карбоновые кислоты, простые эфиры и т. д. Органические гидроксильные соединения содержатся в тростниковом сахаре, хлопчатобумажной одежде и писчей бумаге.
д. Органические гидроксильные соединения содержатся в тростниковом сахаре, хлопчатобумажной одежде и писчей бумаге.
Поскольку эфиры химически инертны, их часто используют в качестве растворителей в самых разных химических процессах. Диэтиловый эфир, наиболее распространенный член семейства эфиров, использовался в качестве хирургического анестетика в течение многих лет, пока его не вытеснили более безопасные негорючие альтернативы. В парфюмерии используется анизол, ароматический эфир с приятным запахом.
Эфиры являются производными углеводородов, в которых алкокси (-OR) или арилокси (-OAr) 9Группа 0145 заменяет атом водорода. Эфиры также представляют собой вещества, созданные путем замены атома водорода гидроксильной группы спирта или фенола на алкильную или арильную группу.
- Эфиры представляют собой органические производные воды с двумя алкильными или арильными группами, связанными с атомом кислорода.
Простые эфиры также известны как алкилоксиды (R 2 O) или арилоксиды (AR 2 O).
- Общая формула алифатического эфира: C n H 2n+2 О.
- То же, что и у одноатомных спиртов. Следовательно, алифатические эфиры изомерны с одноатомными спиртами.
Классификация эфира
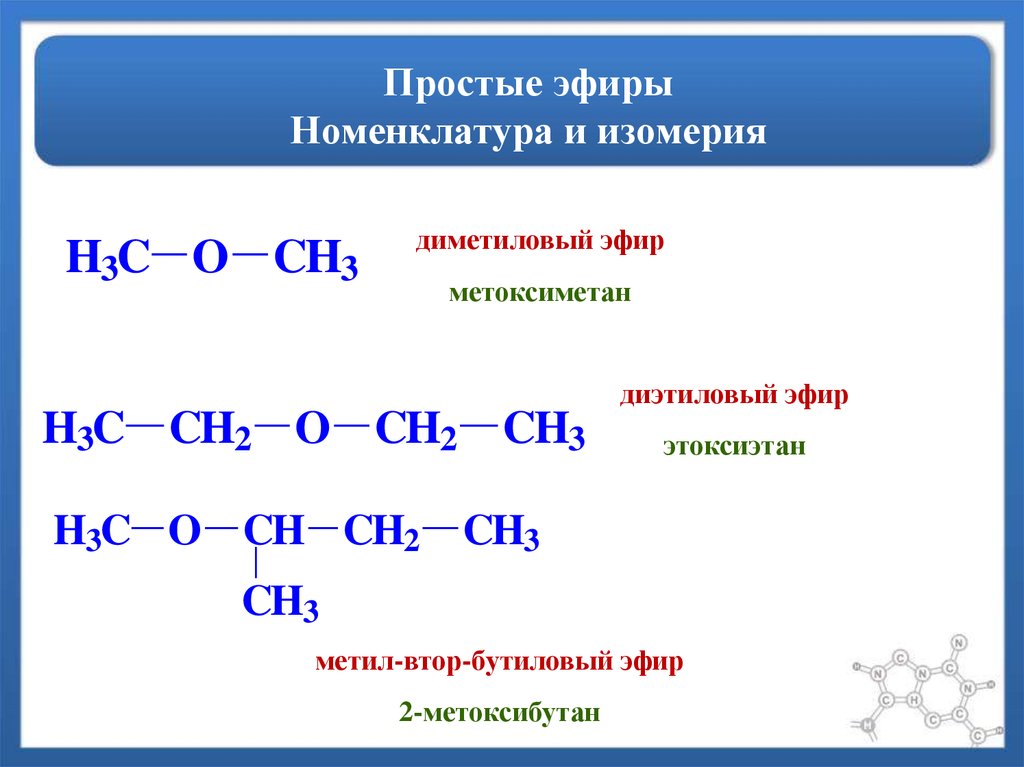
Эфиры в основном подразделяются на две группы: простые и смешанные эфиры.
- Простые или симметричные эфиры: Эфиры, в которых обе алкильные или арильные группы, присоединенные к атомам кислорода, одинаковы, называются простыми эфирами.
например: Диметиловый эфир (CH 3 – O – CH 3 ), дифениловый эфир (CH 6 – O – CH 6 ) и т. д.
- Смешанные или различные алкильные или арильные группы, присоединенные к атомам кислорода, называются смешанными эфирами.

например: Этилметиловый эфир (CH 3 – O – C 2 H 5 ). и т.д.
Структура эфира
Эфиры также имеют ту же тетраэдрическую геометрию, что и вода. Атом кислорода sp 3 гибрид. Из-за отталкивающего взаимодействия между двумя более объемными алкильными группами валентный угол C-O-C немного больше, чем тетраэдрический угол.
Структура диметилового эфира
- Метамерия: Простые эфиры с одинаковой химической формулой, но разными алкильными группами, присоединенными по обе стороны от атома кислорода, называются метамерами друг друга. Метамеры представляют собой либо изомеры цепи, либо изомеры положения, которые содержат одну и ту же функциональную группу, но разные алкильные группы, связанные с гетероатомом; в данном примере кислород.
e.g.: CH 3 – CH 2 – O – CH 2 – CH 3 (dimethyl ether) and CH 3 – O – CH 2 – CH 2 – CH 3 (метил-н-пропиловый эфир).
- Изомерия: Изомерия относится к наличию молекул, которые содержат одинаковое количество атомов одного типа и, следовательно, имеют одинаковую формулу, но различаются по химическим и физическим характеристикам. Эфиры в основном проявляют два типа изомерии:
- Изомерия цепи: Изомеры цепи представляют собой простые эфиры, которые имеют одинаковые алкильные группы по обе стороны от атома кислорода, но разные конфигурации углеродной цепи внутри алкильной группы.
- Функциональная изомерия : Функциональные изомеры представляют собой простые эфиры и одноатомные спирты с одинаковым числом атомов углерода.
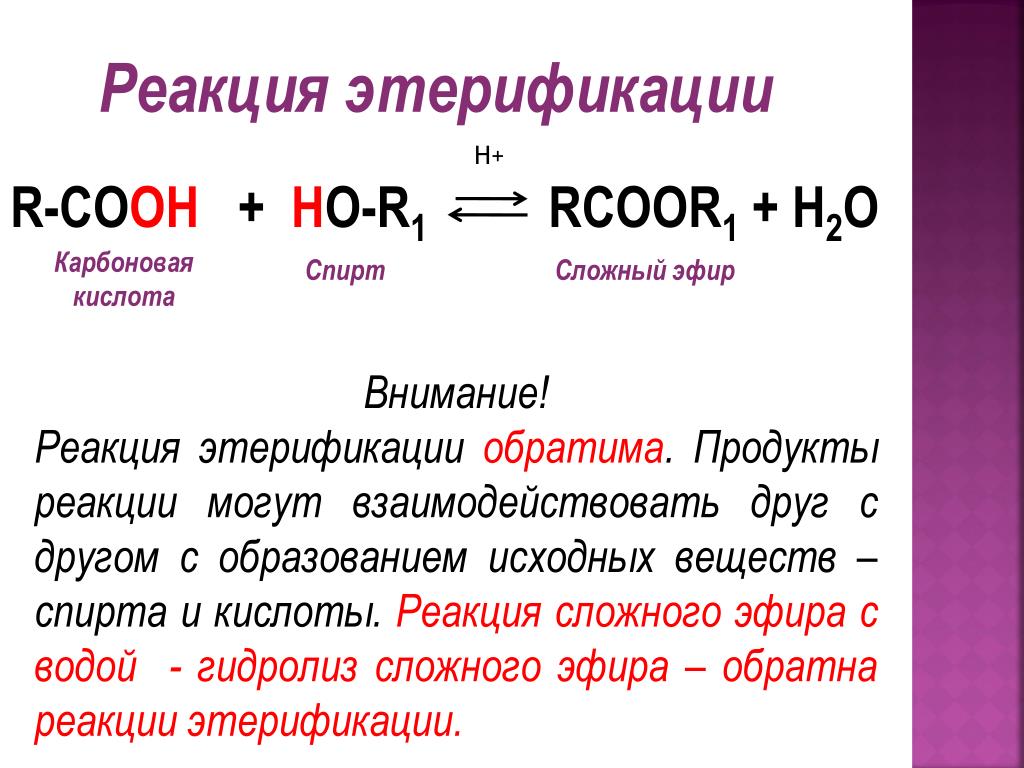
Получение простых эфиров
Межмолекулярной дегидратацией:
При перегонке избытка этилового спирта с концентрированной серной кислотой при 413 К получается диэтиловый эфир. т. е. из спиртов, также называемой межмолекулярной дегидратацией.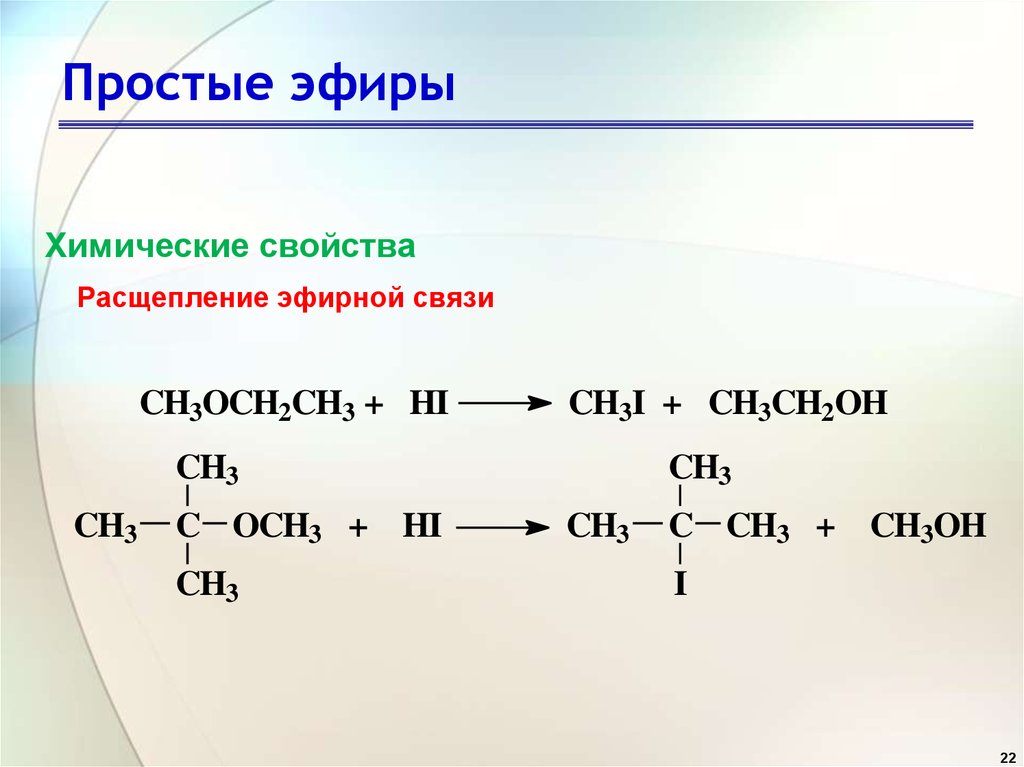
Если экспериментально видно, то
- Первые равные объемы этилового спирта и концентрированной серной кислоты помещают в перегонную колбу.
- Здесь этиловый спирт реагирует с концентрированной серной кислотой с образованием этилгидросульфата.
C 2 H 5 −OH + H−O−SO 3 H ⟶ C 2 H 5 −O−SO 3 H + H 2 O
- Теперь в перегонную колбу добавляется избыток этилового спирта.
- Здесь Этилгидросульфат реагирует с добавленным этиловым спиртом с образованием диэтилового эфира.
C 2 H 5 -O -SO 3 H+ H -O -C 2 H 5 ⟶ C 2 H 5 − -C 2 H 5 –O -C 2 H 5 –O -C 1 2 H 5 –O -C 2 H 5 –O -C 2 H 5 –O -C 2 H 5 5 + H 2 SO 4
- Полученный эфир перегоняется, а серная кислота, полученная во второй реакции, повторно используется на первой стадии
0144 непрерывный процесс этерификации , потому что небольшое количество серной кислоты превращает значительный объем этилового спирта в диэтиловый эфир, и процесс продолжается.
Reaction Mechanism:
- Step 1: Formation of protonated alcohol-
- Step 2 : Nucleophilic attack-
- Step 3 : Deprotonation
Ограничения вышеуказанной реакции:
- Этот процесс подходит исключительно для получения эфиров из первичных спиртов.
- Дегидратация вторичных и третичных спиртов, с другой стороны, дает алкены, а не простые эфиры, поскольку элиминация превосходит замещение.
- При кислотной дегидратации спиртов конкурируют два процесса. Одна реакция представляет собой отщепление, в результате которого образуются алкены, а другая представляет собой реакцию замещения, в результате которой образуются простые эфиры.
Теперь эти две конкурирующие реакции можно контролировать. По мере повышения температуры температура становится более благоприятной для элиминации (453 К и выше).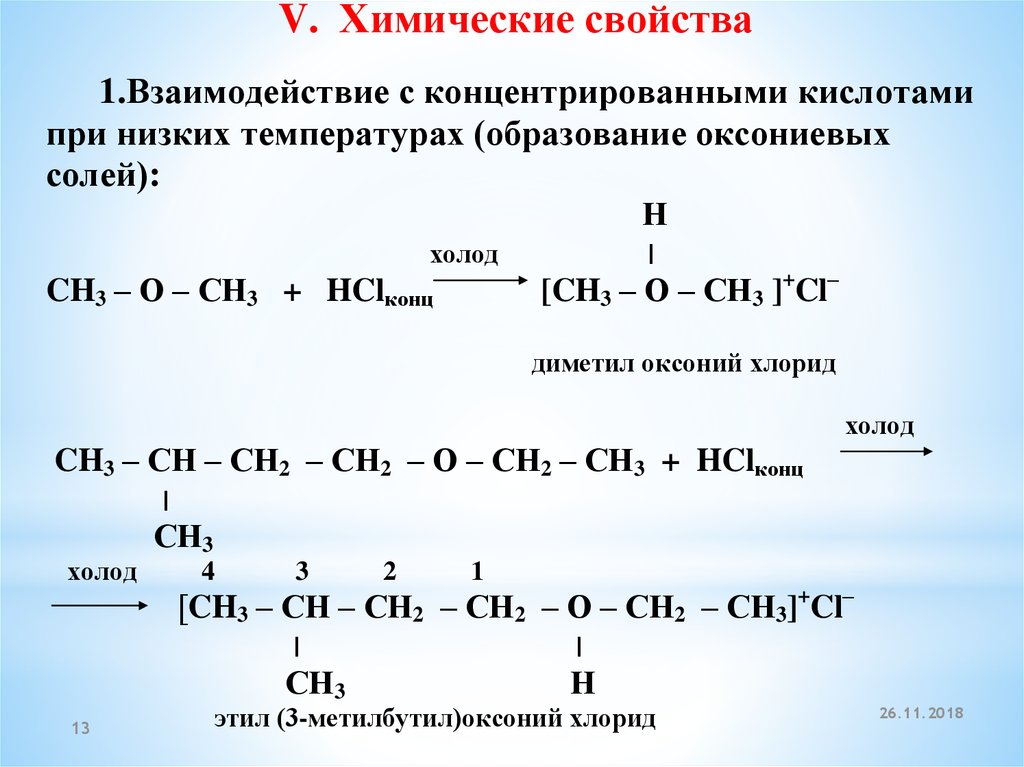 А вот при 413 К и ниже предпочтительнее замена.
А вот при 413 К и ниже предпочтительнее замена.
- Этот подход полезен для получения простых эфиров. Бимолекулярная дегидратация спиртов малоэффективна для синтеза смешанных эфиров. При соединении двух разных спиртов образуется смесь трех разных эфиров, которую трудно разделить.
Синтез Вильямсона
С помощью синтеза Вильямсона можно получить как простые, так и смешанные эфиры с использованием алкилгалогенида. При нагревании алкилгалогенида со спиртовым алкоксидом натрия или калия получается эфир.
Общая форма записывается как
Ниже приведены некоторые важные примеры синтеза Вильямсона:
- Получение трет-бутилметилового эфира следует проводить по следующей реакции.
- С помощью этого метода фенолы также превращаются в простые эфиры.
Хотя с помощью синтеза Вильямсона мы можем получать как простые, так и смешанные эфиры, но есть и ограничения,
Ограничения:
- Для синтеза несимметричных эфиров требуется правильный выбор реагентов.
 Поскольку первичные алкилгалогениды более чувствительны к реакции SN3, наибольший выход несимметричного эфира получается, когда алкилгалогенид является первичным, а алкоксид — третичным.
Поскольку первичные алкилгалогениды более чувствительны к реакции SN3, наибольший выход несимметричного эфира получается, когда алкилгалогенид является первичным, а алкоксид — третичным. - например: трет-бутилэтиловый эфир получают нагреванием этилбромида с трет-бутоксидом натрия.
- Однако, когда алкилгалогенид является вторичным или третичным, нуклеофильная атака на α-углеродный атом стерически проблематична (эффект краудинга). Кроме того, поскольку алкоксид является более сильным основанием и легче атакует β-водород, преобладает β-элиминирование.
Примеры вопросов
Вопрос 1: Приведите примеры простых и смешанных эфиров?
Answer:
- Simple ether: C 2 H 5 – O – C 2 H 5 Diethyl ether
- Mixed ether: CH 3 – O – C 2 H 5 Этилметиловый эфир
Вопрос 2: Назовите структуру следующего соединения:
- 1 -Метокситан
- 1 -Этан Этан
Ответ:
- 1–MHOXY
9
- 1–MHOXY
9
- 1 –MHOXY
669
9
- 1 –MHOXY
669
- 1 –MHOXY.

- 1 — Ethoxy Ethane
C 2 H 5 — O — C 2 H 5
ВОПРОС 3: Что представляет собой метаумразм?? Объясните применительно к эфирам.
Ответ:
Метамерия — это тип структурной изомерии, при котором два или более соединений имеют одинаковую химическую формулу, но имеют поливалентную функциональную группу, связанную с отдельными алкильными группами.
Различные соединения называются метамерами.
Например: Формула C 4 H 10 O представляет собой два разных простых эфира, которые являются метамерами.
- Диэтиловый эфир: CH 3 – CH 2 – O-CH 2 – CH 3
- Метил-н-пропиловый эфир: Ch4 – O – CH 2 – CH 2 – CH 3
5 .
Ответ:
При нагревании избытка низшего спирта с концентрированным Н 2 SO 4 при 413 К образуется промежуточное соединение, которое взаимодействует со второй молекулой спирта с образованием эфира.

 Эта реакция была открыта
Эта реакция была открыта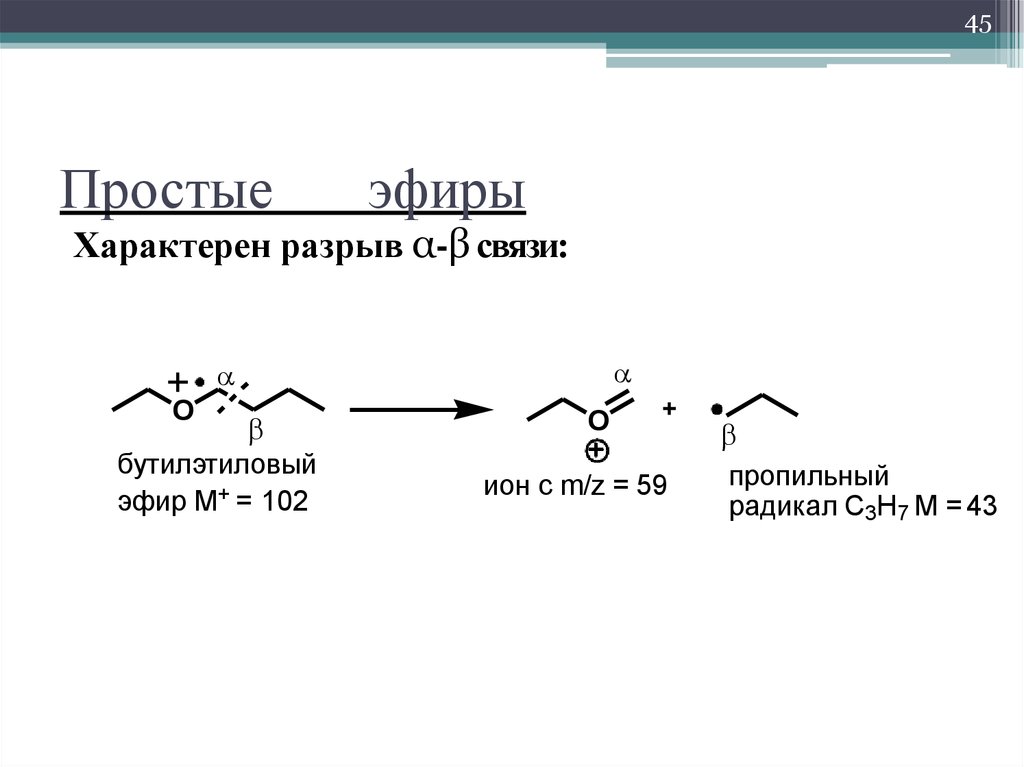
 Путь 2 показывает галоген 1 o в качестве исходного материала, который является благоприятным для S N 2 реакции.
Путь 2 показывает галоген 1 o в качестве исходного материала, который является благоприятным для S N 2 реакции. Первый путь показывает набор исходных материалов, которые должны хорошо работать для этой реакции. Спирт, метанол, можно легко использовать в качестве растворителя. Хотя алкен не имеет определенной более и менее замещенной стороны, его симметрия предотвратит образование смеси продуктов. Фрагментация для пути 2 показывает исходный материал, который не подходит для этой реакции. Алкильный фрагмент имеет только один углерод, который нельзя использовать для образования исходного алкена. Это означает, что путь 2 не является жизнеспособным методом синтеза целевой молекулы.
Первый путь показывает набор исходных материалов, которые должны хорошо работать для этой реакции. Спирт, метанол, можно легко использовать в качестве растворителя. Хотя алкен не имеет определенной более и менее замещенной стороны, его симметрия предотвратит образование смеси продуктов. Фрагментация для пути 2 показывает исходный материал, который не подходит для этой реакции. Алкильный фрагмент имеет только один углерод, который нельзя использовать для образования исходного алкена. Это означает, что путь 2 не является жизнеспособным методом синтеза целевой молекулы. Это сведет к минимуму возникновение любых реакций элиминации. Электрофил должен иметь характеристики хорошего S N 2 электрофил, предпочтительно первичный, чтобы свести к минимуму любые реакции отщепления.
Это сведет к минимуму возникновение любых реакций элиминации. Электрофил должен иметь характеристики хорошего S N 2 электрофил, предпочтительно первичный, чтобы свести к минимуму любые реакции отщепления.

 Простые эфиры также известны как алкилоксиды (R 2 O) или арилоксиды (AR 2 O).
Простые эфиры также известны как алкилоксиды (R 2 O) или арилоксиды (AR 2 O).
 Поскольку первичные алкилгалогениды более чувствительны к реакции SN3, наибольший выход несимметричного эфира получается, когда алкилгалогенид является первичным, а алкоксид — третичным.
Поскольку первичные алкилгалогениды более чувствительны к реакции SN3, наибольший выход несимметричного эфира получается, когда алкилгалогенид является первичным, а алкоксид — третичным.
