Zadaniya-dlya-samost.-raboty-studentov-po-obschei-himii-s-osnovami-analiticheskoi-Zootehniya. Определите тепловой эффект реакции синтеза диэтилового эфира
Вычислить энергию Гиббса тепловой денатурации трипсина при
Documents войти Загрузить ×- Естественные науки
- Химия
Related documents

Широкова И.Ю.

химический институт имени А.М. Бутлерова

Муниципальный этап Всероссийской олимпиады школьников по химии образования для детей

масса

Комитет по образованию Администрации Санкт-Петербурга Санкт-Петербургский Городской Дворец Творчества Юных

занятие 1. растворы. способы выражения концентрации

Решение Расчётных задач

(08)Казанцев

Занятие 8. Электродные и редокс
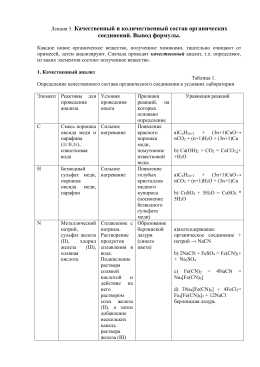
Качественный и количественный состав органических соединений. Вывод формулы.

Тест по физике к ВОУД Вариант 1

1.1 Производство хлебобулочных изделий (ИЗА №3)

Зворыгин И.А. О формате номенклатуры лабораторных

studydoc.ru
Часть 3.
Вычислите стандартную энтальпию хемосинтеза, протекающего в автотрофных бактериях Thiobacillus thioparus*:
5 Na2S2O3 ·5 h3O(т.) + 7O2(г.) = 5 Na2SO4(т.) + 3 h3SO4(ж.) + 2 S (т.) + 22 h3O (ж.)
К какому типу (экзо- или эндотермическому) относится эта реакция?
Справочные данные:
∆H0 (Na2S2O3*5h3O (т.)) = -2602 кДж/ моль
∆H0 (O2(г.)) = 0 кДж/ моль
∆H0 (Na2SO4(т.)) = -1384 кДж/ моль
∆H0 (h3SO4(ж.)) = -907 кДж/ моль
∆H0 (S (т.)) = 0 кДж/ моль
∆H0 (h3O (ж.)) = - 286 кДж/ моль
Вычислить значение ∆H0 298 для протекающих в организме реакций превращения глюкозы:
С6h22O6(к.) = 2 C2H5OH (ж.) + 2 CO2 (г.)
Справочные данные:
∆H0(С6h22O6(к.)) = -1275 кДж/ моль
∆H0(C2H5OH (ж.)) = -278 кДж/ моль
∆H0(CO2 (г.)) = -393,5 кДж/ моль
Вычислить значение ∆H0 298 для протекающих в организме реакций превращения глюкозы:
С6h22O6(к.) + 6 О2(г.) = 6 CO2(г.) + 6 h3O (ж.).
Справочные данные:
∆H0(С6h22O6(к.)) = -1275 кДж/ моль
∆H0 (O2(г.)) = 0 кДж/ моль
∆H0(CO2 (г.)) = -393,5 кДж/ моль
∆H0 (h3O (ж.)) = - 286 кДж/ моль
Определите значение энтальпии реакции гидролиза мочевины – одного из важнейших продуктов жизнедеятельности организма при 298 К, если известны стандартные энтальпии образования веществ, участвующих в реакции:
CO (Nh3)2(р-р) + h3O (ж) = CO2(водн.) + 2 Nh4(водн.)
Справочные данные:
∆H0 (CO (Nh3)2 р-р) = - 319,2 кДж/моль
∆H0 (h3O (ж.)) = - 286 кДж/ моль
∆H0(CO2 (ж.)) = -413,6 кДж/ моль
∆H0(Nh4 (ж.)) = - 79,9 кДж/ моль
Определите тепловой эффект реакции синтеза диэтилового эфира, применяемого в медицине для наркоза при 298 К:
С2H5OH (ж.) = С2H5OC2H5(ж.) + h3O (ж)
Справочные данные:
∆H0сгор. (С2H5OC2H5(ж.)) = - 2727 кДж/ моль
∆H0сгор. (С2H5OH(ж).) = -1371 кДж/моль
∆H0сгор. (h3O (ж)) = 0 кДж/моль
Вычислите тепловой эффект реакций (∆H0р-ции) при стандартных условий:
С6h22O6(р-р) = 2С2H5 OH (ж.) + 2 CO2(г.)
Справочные данные:
∆H0(С6h22O6(к.)) = -1275 кДж/ моль
∆H0(C2H5OH (ж.)) = -278 кДж/ моль
∆H0(CO2 (г.)) = -393,5 кДж/ моль
Вычислите тепловой эффект реакций (∆H0р-ции) при стандартных условиях:
4 Nh4(г)+ 5O2(г)= 4NO(г)+ 6h3O(ж)
Справочные данные:
∆H0(Nh4 (ж.)) = - 79,9 кДж/ моль
∆H0 (O2(г.)) = 0 кДж/ моль
∆H0 ( NO (г.)) = 90,4 кДж/моль
∆H0 (h3O (ж.)) = - 286 кДж/ моль
Вычислите тепловой эффект реакции при стандартных условиях.
С2h3(г.) + 2Н2(г) = С2H6 (г)
Справочные данные:
∆H0(С2h3(г.)) = 227 кДж/ моль
∆H0 (Н2(г)) = 0 кДж/ моль
∆H0 (С2H6 (г))= - 107 кДж/моль
Осмотическое давление водного раствора с концентрацией хлорида магния 0,1 моль/л равно при 298К 691кПа. Вычислите изотонический коэффициент хлорида магния в растворе.
Осмотическое давление крови 760 к Па. Какова молярная концентрация глюкозы в растворе, изотоничным крови при 37 0С?
Чему равно осмотическое давление 0,5М раствора глюкозы С6Н12О6при 250С?
Рассчитайте осмотическое давление 0,2 М раствора хлорида калия при температуре +7 °С, если известно, что изотонический коэффициент этого раствора составляет 1,8.
Осмотическое давление водного раствора сахара при температуре 20 0С равно 106 Па. Рассчитайте молярную концентрацию этого раствора.
studfiles.net
Zadaniya-dlya-samost.-raboty-studentov-po-obschei-himii-s-osnovami-analiticheskoi-Zootehniya
УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ «ВИТЕБСКАЯ ОРДЕНА «ЗНАК ПОЧЕТА» ГОСУДАРСТВЕННАЯ АКАДЕМИЯ ВЕТЕРИНАРНОЙ МЕДИЦИНЫ»
В.М. ХОЛОД, И.Ю. ПОСТРАШ
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ ПО ОБЩЕЙ ХИМИИ С ОСНОВАМИ АНАЛИТИЧЕСКОЙ
учебно-методическоепособие для студентов зооинженерного факультета
ВИТЕБСК
УО ВГАВМ
2007
УДК 546 ББК 24.1 Х 73
Рецензенты:
В.И. Соболевский, кандидат ветеринарных наук, доцент кафедры физики и основ высшей математики.
Н.Г. Толкач, кандидат ветеринарных наук, доцент, заведующий кафедрой фармакологии.
Холод, В.М.
Х 73 Задания для самостоятельной работы студентов по общей химии с основами аналитической: уч.-метод.пособие для студентов зооинжинерного факультета / В.М. Холод, И.Ю. Постраш. – Витебск: ВГАВМ, 2007.- 54 с.
ISBN 978-985-512-034-7
Учебно-методическоепособие составлено в соответствии с программой по общей химии с основами аналитической для студентов зооинженерного факультета. Пособие включает все темы, выносимые на лабораторнопрактические занятия. По каждой теме сформулированы основные теоретические вопросы для самостоятельного изучения, приведены примеры типовых задач с решением. Кроме того, в каждой теме содержится также домашнее задание, которое студент должен выполнить при подготовке к занятию, что позволит лучше усвоить теоретический материал и научиться его использовать практически.
Рассмотрено и рекомендовано к печати методической комиссией зооинженерного факультета УО «Витебская ордена «Знак Почета» государственная академия ветеринарной медицины» 11 января 2007 г. (протокол № 2).
Разрешено к печати редакционно-издательскимсоветом УО «Витебская ордена «Знак Почета» государственная академия ветеринарной медицины» «15» ноября 2007 г. (протокол № 4)
УДК 54(07)
ББК 24
© Холод В.М., Постраш И.Ю., 2007 © УО «Витебская ордена «Знак Почета» государственная академия ветеринарной медицины», 2007
СОДЕРЖАНИЕ
|
| Стр |
| Введение | 4 |
1. | Основные химические понятия и законы | 5 |
2. | Энергетика химических процессов | 7 |
3. | Кинетика химических реакций. Химическое равновесие | 9 |
4. | Растворы. Растворимость веществ. Способы выражения состава раство- | 12 |
| ров |
|
5. | Растворы неэлектролитов. Коллигативные свойства растворов | 15 |
6. | Свойства растворов электролитов | 16 |
7. | Ионное произведение воды. Водородный показатель | 19 |
8. | Гидролиз солей. Буферные растворы | 21 |
9. | Коллоидные растворы. Растворы высокомолекулярных соединений | 22 |
| (ВМС) |
|
10. | Строение атома. Химическая связь | 24 |
11. | Комплексные соединения | 26 |
12. | Окислительно-восстановительныереакции | 28 |
13. | Элементы I-AиII-Aгрупп | 30 |
14. | Элементы группы V-А | 32 |
15. | Элементы группы VI-А | 34 |
16. | Элементы группы VII-A | 36 |
17. | Химия d-элементов | 38 |
18. | Объемный анализ. Метод кислотно-основноготитрования | 39 |
19. | Метод комплексонометрического титрования | 41 |
20. | Физико-химическиеметоды анализа | 43 |
21. | Список литературы | 45 |
22. | Приложения | 46 |
Введение
Химия является одной из общетеоретических наук, которые предшествуют изучению профессионально-направленныхдисциплин и создают необходимую теоретическую базу для дальнейшего обучения и практической деятельности.
Большинство процессов, протекающих в окружающей среде, а также обмен веществ, являющийся основой жизнедеятельности организмов, представляет собой совокупность разнообразных химических реакций.
Знание закономерностей протекания химических реакций, свойств простых и сложных веществ, используемых в агропромышленном производстве, животноводстве, ветеринарии позволит студентам – будущим специалистам - грамотно решать как практические, так и научные проблемы.
Химические методы широко используются в производственных и биохимических лабораториях. Химический синтез позволяет получать различные лекарственные средства, биологически активные добавки, минеральные подкормки, минеральные удобрения, а также разнообразные пестициды и гербициды, используемые для борьбы с вредителями и сорняками.
Сведения о качественном и количественном анализе, а также о физико-хими-ческих методах анализа позволяют студентам получить представление о способах исследования как неорганических веществ, так и биологического материала животного или растительного происхождения.
Данное методическое пособие адресовано студентам зооинженерного факультета. Оно необходимо для самостоятельной подготовки к занятиям по дисциплине «Общая химия с основами аналитической».
Впособие включены все разделы химии согласно типовой программы по данной дисциплине и количеству часов, отведенных на ее изучение для студентов зооинженерного факультета.
Вкаждой теме данного пособия приведены теоретические вопросы, типовые расчеты, которыми должен владеть студент и домашнее задание, которое он должен выполнить с целью закрепления материала.
Подготовку домашнего задания следует начинать с изучения теоретических вопросов темы с использованием конспекта лекций и рекомендованной литературы. После освоения теоретического материала следует ознакомиться с решением типовых задач и наиболее трудные законспектировать в тетрадь для лабораторно-практическихзанятий. Далее следует перейти к разделу «Выполните задание», а именно, письменно ответить на все вопросы, а также решить задачи.
Тема 1. «Основные химические понятия и законы»
Основные вопросы темы
1.Основные классы неорганических соединений. Простые и сложные вещества. Оксиды, кислоты, гидроксиды, соли. Химическая номенклатура.
2.Атомно-молекулярноеучение. Химический элемент, атом, молекула. Относительная атомная масса элемента и относительная молекулярная масса вещества. Моль, молярная масса.
3.Закон Авогадро, следствия из закона Авогадро. Число Авогадро. Расчет абсолютных масс атомов и молекул.
4.Закон сохранения массы. Закон сохранения энергии.
5.Закон постоянства состава вещества. Соединения постоянного и переменного состава (дальтониды и бертоллиды).
6.Закон эквивалентов. Химический эквивалент. Молярная масса эквивалента (эквивалентная масса). Расчет эквивалентных масс простых и сложных веществ.
Примеры решения задач
Пример 1. Определите массу фторида натрия NaF, если его химическое количество равно 0,5 моль.
Решение: Массу вещества можно рассчитать по формуле: m = M ∙ n
где: М – молярная масса вещества; n – химическое количество вещества.
М (NaF) = 42 г/моль; n = 0,5 моль.
m (NaF) = 42 г/моль ∙ 0,5 моль = 21 г
Пример 2: Вычислите абсолютную массу одной молекулы йода I2.
Решение: Молярная масса йода М (I2) равна 254 г/моль. Один моль йода содержит
6,02∙ 1023 молекул, поэтому масса одной молекулы йода равна 254 г / 6,02 ∙ 1023 = 4,2 ∙10-22 г.
Пример 3: Вычислите молярную массу эквивалента марганца в соединениях MnO2
и Mn2O7.
Решение: Молярная масса эквивалента элемента вычисляется по формуле:
МЭ = М(А) n
где М(А) – молярная масса элемента;
n – валентность элемента в данном соединении.
Поэтому для MnO2 | MЭ (Mn) = 55/4 = 13,75 г/моль. |
для Mn2O7 | MЭ (Mn) = 55/7 = 7,86 г/моль. |
Пример 4: Определите молярную массу эквивалента Ca(OH)2, исходя из уравнений реакций:
Ca(OH)2 + 2 HCl = CaCl2 + 2 h3O
Ca(OH)2 + HCl = Ca(OH)Cl + h3O
Решение: Молярная масса эквивалента сложного вещества определяется той реакцией, в которой это вещество участвует. Она равна молярной массе вещества, деленной на суммарную валентность замещенных радикалов, которая определяется, исходя из уравнения реакции.
Поэтому для первой реакции:
МЭ (Ca(OH)2) = | 74г/моль | = 37 г/моль, | |
2 | |||
|
|
так как заместились 2 одновалентные группы ОН. Для второй реакции:
МЭ (Ca(OH)2) = | 74 г / моль | 74 г / моль , | |
1 | |||
|
|
так как в ходе реакции заместилась 1 группа ОН.
Выполните задание:
1.Запишите формулы веществ: сульфида аммония, карбоната лития, гидрофосфата натрия, гидроксонитрата хрома (III), дигидрофосфата кальция, дигидроксосульфата марганца (III), оксида хлора (VII), гидроксида алюминия, нитрита бария.
2.Назовите вещества: CaSO3, K2CrO4, K2Cr2O7, Са(ОН)2, Nh5OH, NaHSO4, Cu(NO2)2, (Al(OH)2)2SO4, Ca(HCO3)2, MgSO4, KMnO4.
3.Рассчитайте химическое количество вещества железа массой 5,6 г. Сколько атомов железа содержится в данном образце?
4.Определите массу карбоната калия, если его химическое количество равно 0,5 моль. Найдите общее число атомов всех элементов, содержащихся в данном образце.
5.Вычислите количество вещества и количество моль эквивалентов вещества в
данной массе вещества: а) 7,1 г Na2SO4; б) 5,8 г Mg(OH)2; в) 0,49 г h3SO4.
6.Какой объем займет при нормальных условиях смесь азота массой 2,8 г и водорода массой 10г? Сколько аммиака образуется при нагревании данной смеси? Какой газ останется после реакции?
7.При прокаливании медной проволоки на воздухе и последующем охлаждении ее масса увеличивается. Выполняется ли при этом закон сохранения массы? Дайте объяснение.
8.Мышьяк образует 2 оксида, в одном из них массовая доля мышьяка равна 65,2%, а в другом – 75,5%. Определите молярные массы эквивалентов мышьяка в оксидах, если молярная масса эквивалента кислорода равна 8 г/моль.
9.Определите молярную массу эквивалента серной кислоты, исходя из уравнений реакций:
h3SO4 + 2 NaOH = Na2SO4 + 2 h3O
h3SO4 + NaOH = NaHSO4 + h3O
10.Рассчитайте молярные массы эквивалентов азота в оксидах: N2O, NO, N2O3, NO2, N2O5.
11.Рассчитайте молярные массы эквивалентов следующих веществ: Са(ОН)2, NaOH, h3SO4, HNO3, Al2(SO4)3, Ca(HCO3)2, MgSO4.
Тема 2: «Энергетика химических процессов»
Основные вопросы темы
1.Понятие о системе и фазе. Системы гомогенные и гетерогенные, открытые, закрытые, изолированные. Полная и внутренняя энергия системы. Первое начало термодинамики.
2.Энтальпия. Стандартная энтальпия образования вещества. Стандартная энтальпия сгорания вещества.
3.Термохимия. Термохимические уравнения. Тепловой эффект реакции. Реакции экзотермические и эндотермические. Первый закон термохимии (закон ЛавуазьеЛапласа).
4.Закон Гесса и следствия из него. Расчет теплового эффекта реакции по стандартным энтальпиям образования и сгорания веществ.
5.Принцип Бертло.
6.Понятие об энтропии. Расчет изменения энтропии в ходе реакции.
7.Второе начало термодинамики. Изменение энергии Гиббса в ходе реакции – критерий направленности химических процессов.
8.Связь между энтропией, энтальпией и энергией Гиббса.
9.Приложение законов термодинамики к живым системам.
Примеры решения задач
Пример 1: Вычислите тепловой эффект реакции(∆Нор-ции):
2 Mg(к)+ CO2(г)→ 2 MgO(к)+ С(граф)
Решение: а) Находим по справочным таблицам значения стандартных энтальпий образования сложных веществ: ∆Нообр(MgO) =-602кДж/моль; ∆Нообр (СO2) =-394кДж/моль. Стандартные энтальпии образования простых веществ (Mg и С) равны 0.
б) Так как, согласно первому следствию из закона Гесса, тепловой эффект реакции (∆Нор-ции.)равен сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрических коэффициентов, то:
∆Н° р-ции = 2 ∆Нообр(MgO) - ∆Нообр(СO2) = 2 ∙(-602)–(-394)=-810кДж
Пример 2: При сгорании 80 г серы выделяется 747 кДж энергии. Определите энтальпию образования диоксида серы.
Решение: а) Энтальпия образования вещества – тепловой эффект реакции образования 1 моль вещества из простых веществ. Для образования 1 моль SO2 необходимо взять 1 моль серы.
S + O2 → SO2
б) Найдем химическое количество серы:
n(S) = | m(S) |
| 80 г |
| = 2,5 моль |
M(S) |
| 32 г / моль | |||
|
|
| |||
в) Составим пропорцию:
при сгорании 2,5 моль серы выделяется 747 кДж энергии;
» » » » 1 моль серы ────── х кДж.
х = 298,8 кДж; ∆Нообр.(SО2) =-298,8кДж/моль.
Пример 3: Возможно ли восстановление оксида титана (IV) до свободного титана углеродом в стандартных условиях?
Решение: а) Запишем уравнение реакции:
ТiО2(к) + 2 С(гр) = Тi(к) + 2 СО(г)
В справочных таблицах находим значения энергии Гиббса исходных веществ и продуктов реакции:
Вещества | СО(г) | Тi(к) | ТiО2(к) | С(гр) |
∆Gообр., кДж/моль | -137 | 0 | -887 | 0 |
б) Изменение энергии Гиббса в ходе реакции рассчитывается анало-
гично изменению теплового эффекта реакции (см. пример 1), поэтому: ∆Gореакц. = 2 ∆Gообр(СО) - ∆Gообр(ТiО2) = 2(-137)–(-887)= 613 кДж
Так как ∆Gореакц > 0, то восстановление диоксида титана графитом при стандартных условиях невозможно.
Пример 4: Возможно ли восстановление металлического железа из Fe2O3 действием водорода при 500оС по уравнению:
Fe2O3(к) + 3 h3(г) → 2 Fe(к) + 3 h3O(ж)?
Решение: а) В справочных таблицах находим необходимые данные:
| Fe2O3(к) | h3(г) | Fe(к) | h3O |
∆Н°(кДж/моль) | -822,0 | 0 | 0 | -285,8 |
S°обр. (Дж/моль К) | 87 | 130,5 | 2,27 | 70,1 |
б) Найдем ∆Нореак = 3 ∆Нообр (Н2О) - ∆Нообр (Fe2O3) = 3 ∙(-285,8)–(-822,0)=-35,4кДж.
в) Определим ∆Sор-ции = [3Sо(h3O) + 2Sо(Fe)] – [Sо(Fe2O3) + 3So(h3)] =
= [3 ∙ 70,1 + 2 ∙ 2,27] – [87 + 3 ∙ 130,5] = - 213,8 Дж/К = -0,2138кДж/К
г) Рассчитаем ∆G по формуле: ∆G = ∆Н - T∆S
∆G = -35,4+ 0,2138 ∙ (500+273)= 129,87 кДж
Т.к. ∆G > 0,то при t = 500оС (773 К) эта реакция не будет протекать.
Выполните задание:
1.Сформулируйте закон Гесса. Как с использованием стандартных энтальпий сгорания и стандартных энтальпий образования веществ рассчитать тепловой эффект реакции?
2.Определите калорийность 1 кг корма, содержащего 60% воды, 20% белков, 15% жиров и 5% углеводов, если калорийность белков и углеводов составляет 17,1 кДж/г, а калорийность жиров – 38 кДж/г.
3.Определите количество теплоты, выделившейся в результате взаимодействия 2 кг
оксида кальция с водой: СаО(к) + Н2О(ж) → Са(ОН)2(к), если известны стандартные энтальпии образования веществ:
| СaО (к) | Н2О(ж) | Са(ОН)2(к) |
∆Нообр., кДж/моль | -635 | -286 | -986 |
4.Дайте определение стандартной энтальпии образования вещества. При взаимодействии 2,1 г железа с серой выделилось 3,77 кДж теплоты. Рассчитайте энтальпию образования сульфида железа.
5.Энергетические затраты коровы на образование 1 л молока составляют 3000 кДж. Какое количество глюкозы будет затрачено на образование 10 л молока, если допустить, что процесс молокообразования энергетически обеспечивается только за счет окисления глюкозы по уравнению:
С6Н12О6(к)+ 6 О2(г)→ 6 СО2 (г)+ 6 Н2О(ж)
| СО2 (г) | Н2О(ж) | С6Н12О6(к) |
∆Нообр., кДж/моль | -394 | -236 | -1273 |
6.Определите тепловой эффект реакции синтеза диэтилового эфира, применяемого для наркоза:
2 С2Н5ОН(ж) → С2Н5ОС2Н5(ж) + Н2О, если ∆Носгор.(С2Н5ОС2Н5) = - 2727 кДж/моль; ∆Носгор.(Н2О) = 0; ∆Носгор.(С2Н5ОН) = - 414 кДж/моль.
7.Исходя из стандартных значений энтальпий сгорания веществ, рассчитайте стандартную энтальпию образования этилового спирта.
С2Н5ОН(ж) | С(г) | Н2(г) |
∆Носгор., кДж/моль-1368 | -394 | -286 |
8.Каков критерий самопроизвольного протекания процесса для изолированных систем? Рассчитайте изменение энергии Гиббса в ходе реакций и ответьте на вопрос, будут ли самопроизвольно протекать данные реакции в стандартных условиях?
а) С6Н12О6(к) + 6 О2(г) → 6 СО2 (г) + 6 Н2О(ж); |
| |||
б) С6Н12О6 → | 2 С2Н5ОН(ж) + 2 СО2 (г) , если |
| ||
| СО2 (г) | Н2О(ж) | С6Н12О6 (к) | С2Н5ОН(ж) |
∆Gообр., кДж/моль | -395 | -237 | -917 | -174 |
9.Возможно ли, что N2O, используемый в качестве наркотического средства при хирургических операциях, вызовет отравление в результате образования токсического NO при температуре 370 С в результате протекания следующей реакции:
2 N2O(г) + O2(г) = 4 NO(г),
если ∆Нообр (NO) = 90 кДж/моль; ∆Нообр. (N2О) = 81,6 кДж/моль; Sо(NO) = 210,6 Дж/моль∙К; Sо(N2O) = 191,5 Дж/моль∙К;
Sо(O2) = 205 Дж/моль∙К;
Тема 3. « Кинетика химических реакций. Химическое равновесие»
Основные вопросы темы
1.Понятие «скорость химических реакций».
2.Влияние природы реагирующих веществ на скорость реакций.
3.Влияние концентрации реагирующих веществ на скорость реакции. Реакции простые и сложные. Закон действующих масс. Константа скорости реакции. Порядок реакции.
4.Влияние температуры на скорость реакции. Правило Вант-Гоффа,температурный коэффициент. Энергия активации. Уравнение Аррениуса.
5.Катализаторы. Влияние катализатора на скорость реакции. Катализ гомогенный и гетерогенный. Ферменты.
6.Химическое равновесие. Константа равновесия. Связь константы равновесия со энергией Гиббса.
7.Смещение химического равновесия. Принцип Ле-Шателье.Влияние давления, концентрации, температуры на состояние равновесия.
Примеры решения задач
Пример 1: Как изменится скорость реакции 2 СО(г) + О2 (г) = 2 СО2 (г) при увеличении концентрации реагирующих веществ в 2 раза?
Решение: а) Скорость реакции (v1) при начальных концентрациях равна: v1 = k ∙ [СО]2 ∙ [О2]
б) При новых концентрациях СО и О2 скорость реакции (v2) будет рав-
на: v2 = k ∙ (2[СО]2) ∙ 2 [О2] = 8 k ∙ [СО]2 ∙ [О2] = 8 v1
Скорость реакции увеличится в 8 раз.
Пример 2: Во сколько раз увеличится скорость реакции при повышении температуры на 30оС, если температурный коэффициент скорости реакции равен
2?
|
|
|
|
|
|
|
|
| t2 | t1 |
|
|
|
|
|
|
| ||
Решение: По уравнениюВант-Гоффа:vt |
| = vt |
| ∙ |
| 10 |
|
|
|
|
|
|
|
|
| ||||
2 | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
| |||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
| 30 |
|
|
|
|
|
| |||
|
|
|
|
|
|
|
|
|
|
|
| ∙ 2 3 |
|
|
| ||||
Подставим данные в формулу: |
| vt | 2 | = vt | 1 | ∙ | 210 |
| = vt | 1 | = 8 ∙ vt | 1 | . | ||||||
Таким образом, скорость реакции возрастет в 8 раз.
Пример 3: Начальные концентрации веществ в системе:
СО(г)+ Н2О(г) СО2(г)+ Н2(г)
были равны (моль/л): С0 (СО) = 0,5; С0 (Н2О) = 0,6; С0 (СО2) = 0,4; С0 (Н2) = 0,2. Чему равны концентрации всех участвующих в реакции
веществ после того, как прореагирует 30% водяных паров? Решение: а) Рассчитаем, какое количество воды прореагировало:
n(h3O) = 0,6 ∙ 0,3 = 0,18 (моль)
б) Концентрация воды после реакции:
C1(h3O) = 0,6 – 0,18 = 0,42 (моль/л)
в) Согласно уравнению, 1 моль СО реагирует с 1 моль Н2О, при этом образуется 1 моль СО2 и 1 моль Н2. Значит, концентрация СО уменьшится на 0,18 моль, а концентрации СО2 и Н2 увеличатся на 0,18 моль и станут следующими:
C1(CO) = 0,5 – 0,18 = 0,32 (моль/л)
C1(CO2) = 0,4 + 0,18 = 0,58 (моль/л).
C1(h3) = 0,2 + 0,18 = 0,38 (моль/л).
Пример 4: Рассчитайте константу равновесия | реакции: |
СО + Н2О | СО2 + Н2, |
studfiles.net


















