Аминокислоты — номенклатура, получение, химические свойства. Белки. Определите строение сложного эфира альфа аминокислоты
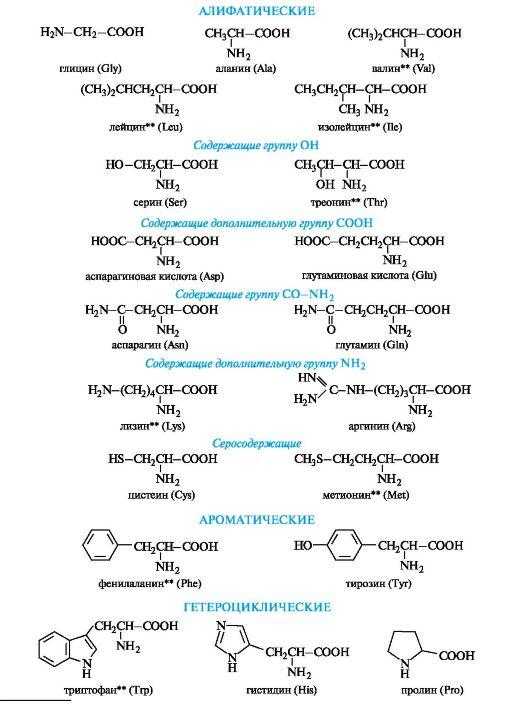
алифатические, ароматические, гетероциклические. Заменимые и незаменимые α-Аминокислоты. Привести примеры.
α-Аминокислоты - гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу у одного и того же атома углерода.
Многие α-аминокислоты синтезируются в организме. Некоторые аминокислоты, необходимые для синтеза белков, в организме не образуются и должны поступать извне. Такие аминокислоты называют незаменимыми
К незаменимым α-аминокислотам относятся:
валин изолейцин метионин триптофан
лейцин лизин треонин фенилаланин
Алифатические α-аминокислоты. Это наиболее многочисленная группа. Внутри нее аминокислоты подразделяют с привлечением дополнительных классификационных признаков.
В зависимости от числа карбоксильных групп и аминогрупп в молекуле выделяют:
• нейтральные аминокислоты - по одной группе Nh3 и СООН;
• основные аминокислоты - две группы Nh3 и одна группа
СООН;
• кислые аминокислоты - одна группа Nh3 и две группы СООН.
Можно отметить, что в группе алифатических нейтральных аминокислот число атомов углерода в цепи не бывает больше шести. При этом не существует аминокислоты с четырьмя атомами углерода в цепи, а аминокисоты с пятью и шестью атомами углерода имеют только разветвленное строение (валин, лейцин, изолейцин).
В алифатическом радикале могут содержаться «дополнительные» функциональные группы:
• гидроксильная - серин, треонин;
• карбоксильная - аспарагиновая и глутаминовая кислоты;
• тиольная - цистеин;
• амидная - аспарагин, глутамин.
Ароматические α-аминокислоты. К этой группе относятся фенилаланин и тирозин, построенные таким образом, что бензольные кольца в них отделены от общего α-аминокислотного фрагмента метиленовой группой -СН2-.
Гетероциклические α-аминокислоты. Относящиеся к этой группе гистидин и триптофан содержат гетероциклы - имидазол и индол соответственно. Строение и свойства этих гетероциклов рассмотрены ниже (см. 13.3.1; 13.3.2). Общий принцип построения гетероциклических аминокислот такой же, как и ароматических.
Гетероциклические и ароматические α-аминокислоты можно рассматривать как β-замещенные производные аланина.
К героциклическим относится также аминокислота пролин, в которой вторичная аминогруппа включена в состав пирролидинового
18. Свойства α-Аминокислот. Кислотно-основные свойства. Понятие об изоэлектрической точке (рI).
Пояснить на конкретном примере.
Амфотерность аминокислот обусловлена кислотными (СООН) и основными (Nh3) функциональными группами в их молекулах. Аминокислоты образуют соли как со щелочами, так и с кислотами.
В кристаллическом состоянии α-аминокислоты существуют как диполярные ионы h4N+ - CHR-COO- (обычно используемая запись
строения аминокислоты в неионизированной форме служит лишь для удобства).
В водном растворе аминокислоты существуют в виде равновесной смеси диполярного иона, катионной и анионной форм.
Положение равновесия зависит от рН среды. У всех аминокислот преобладают катионные формы в сильнокислых (рН 1-2) и анион- ные - в сильнощелочных (рН >11) средах.
Ионное строение обусловливает ряд специфических свойств аминокислот: высокую температуру плавления (выше 200 ?С), растворимость в воде и нерастворимость в неполярных органических растворителях. Способность большинства аминокислот хорошо растворяться в воде является важным фактором обеспечения их биологического функционирования, с нею связаны всасывание аминокислот, их транспорт в организме и т. п.
Положение равновесия, т. е. соотношение различных форм аминокислоты, в водном растворе при определенных значениях рН существенно зависит от строения радикала, главным образом от присутствия в нем ионогенных групп, играющих роль дополнительных кислотных и основных центров.
Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации катионных и анионных форм аминокислоты равны, называется изоэлектрической точкой (p/).
Нейтральные α-аминокислоты. Эти аминокислоты имеют значения рI несколько ниже 7 (5,5-6,3) вследствие большей способности к ионизации карбоксильной группы под влиянием -/-эффекта группы Nh3. Например, у аланина изоэлектрическая точка находится при рН 6,0.
Кислые α-аминокислоты. Эти аминокислоты имеют в радикале дополнительную карбоксильную группу и в сильнокислой среде находятся в полностью протонированной форме. Кислые аминокислоты являются трехосновными (по Брёндстеду) с тремя значениями рКа, как это видно на примере аспарагиновой кислоты (р/ 3,0).
У кислых аминокислот (аспарагиновой и глутаминовой) изоэлектрическая точка находится при рН много ниже 7 (см. табл. 12.1). В организме при физиологических значениях рН (например, рН крови 7,3-7,5) эти кислоты находятся в анионной форме, так как у них ионизированы обе карбоксильные группы.
Основные α-аминокислоты. В случае основных аминокислот изоэлектрические точки находятся в области рН выше 7. В сильно- кислой среде эти соединения также представляют собой трехосновные кислоты, этапы ионизации которых показаны на примере лизина (р/ 9,8).
В организме основные аминокислоты находятся в виде катионов, т. е. у них протонированы обе аминогруппы.
В целом ни одна α-аминокислота in vivo не находится в своей изоэлектрической точке и не попадает в состояние, отвечающее наименьшей растворимости в воде. Все аминокислоты в организме находятся в ионной форме.
19. Биологически важные реакции α-Аминокислот: а) трансаминирование; б) декарбоксилирование; в) дезаминирование: окислительное, восстановительное, внутримолекулярное, гидролитическое; г) образование пептидов.
В организме под действием различных ферментов осуществляется ряд важных химических превращений аминокислот. К таким пре- вращениям относятся трансаминирование, декарбоксилирование, элиминирование, альдольное расщепление, окислительное дезаминирование, окисление тиольных групп.
Трансаминирование является основным путем биосинтеза α-ами- нокислот из α-оксокислот. Донором аминогруппы служит аминокислота, имеющаяся в клетках в достаточном количестве или избытке, а ее акцептором - α-оксокислота. Аминокислота при этом превращается в оксокислоту, а оксокислота - в аминокислоту с соответствующим строением радикалов. В итоге трансаминирование представляет обратимый процесс взаимообмена амино- и оксо- групп. Пример такой реакции - получение l-глутаминовой кислоты из 2-оксоглутаровой кислоты. Донорной аминокислотой может служить, например, l-аспарагиновая кислота.
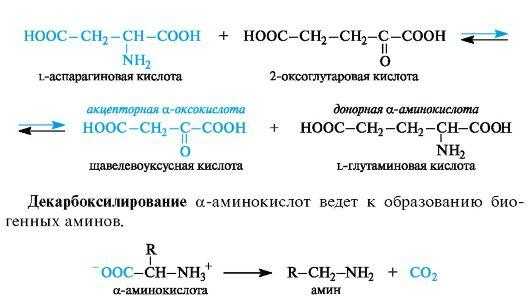
α-Аминокислоты содержат в α-положении к карбоксильной группе электроноакцепторную аминогруппу (точнее, протонированную аминогруппу Nh4+), в связи с чем способны к декарбоксилированию.
Окислительное дезаминирование может осуществляться с участием ферментов и кофермента НАД+ или НАДФ+. α-Аминокислоты могут превращаться в α-оксокислоты не только через трансаминирование, но и путем окислительного дезаминирования. Например, из l-глутаминовой кислоты образуется α-оксоглутаровая кислота. На первой стадии реакции осуществляется дегид- рирование (окисление) глутаминовой кислоты до α-иминоглутаровой
кислоты. На второй стадии происходит гидролиз, в результате которого получаются α-оксоглутаровая кислота и аммиак. Стадия гидролиза протекает без участия фермента.
В обратном направлении протекает реакция восстановительного аминирования α-оксокислот. Всегда содержащаяся в клетках α-оксоглутаровая кислота (как продукт метаболизма углеводов) превращается этим путем в L-глутаминовую кислоту.
Внутримолекулярное дезаминирование
Внутримолекулярное дезаминирование характерно для гистидина. Реакцию катализирует гистидаза (гистидин-аммиаклиаза). Эта реакция происходит только в печени и коже.
Гидролитиическое дезаминирование происходит при помощи фермента аденозин дезаминаза и выглядит следующим образом:
R-CH(Nh3)-COOH + h3O----> R-CH(OH)-COOH +Nh4
В результате образуются, как мы уже поняли, гидроксикислоты…
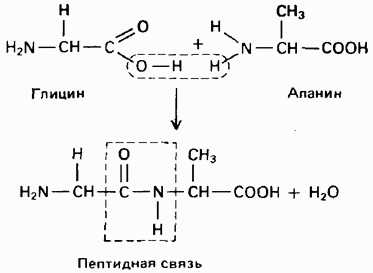
Пептидную и белковую молекулу формально можно представить как продукт поликонденсации α-аминокислот, протекающей с обра- зованием пептидной (амидной) связи между мономерными звеньями
20. Аминоспирты: коламин (2-аминоэтанол), холин. Бетаин как продукт окисления холина. Строение, биологическая роль. Аминофенолы. Катехоламины: дофамин, норадреналин, адреналин. Строение, биологическая роль.
Аминоспиртами называют соединения, содержащие в молекуле одновременно амино- и гидроксигруппы.
Эти две функциональные группы непрочно удерживаются у одного атома углерода, в результате чего происходит отщепление аммиака или воды. Простейшим представителем аминоспиртов является 2-аминоэтанол - соединение, в котором обе группы расположены у соседних атомов углерода. 2-Аминоэтанол (тривиальное название коламин) является структурным компонентом сложных липидов - фосфатидилэтаноламинов (см. 10.4.1).
С сильными кислотами 2-аминоэтанол образует устойчивые соли.
Четвертичное аммониевое основание - гидроксид (2-гидрокси- этил)триметиламмония [HOCh3Ch3N+(Ch4)3]OH- - имеет большое значение как витаминоподобное вещество, регулирующее жировой обмен. Его катион называют холином
В организме холин образуется с участием кофермента S-аде- нозилметионина (SAM), являющегося переносчиком метильных групп. В молекуле этого кофермента метильная группа «активирована» вследствие того, что находится в составе сульфониевой группировки.
При метилировании коламина в реакции участвует атом азота, более нуклеофильный, чем атом кислорода
В результате окисления холина in vivo образуется диполярный ион бетаин, который также может служить источником метильных групп, входящих в состав аммониевой группировки.
Сложноэфирные производные холина выполняют в организме различные биологические функции. Замещенные фосфаты холина являются структурной основой фосфолипидов - фосфатидилхолинов - важнейшего строительного материала клеточных мембран (см. 10.4.1). Сложный эфир холина и уксусной кислоты - ацетилхолин - наиболее распространенный посредник при передаче нервного возбуждения в нервных тканях (нейромедиатор). Он образуется в организме при ацетилировании холина с помощью ацетилкофермента А
Важная роль в организме принадлежит аминоспиртам, содержащим в качестве структурного фрагмента остаток пирокатехина. Они носят общее название катехоламинов. К этой группе относятся представители образующихся в организме биогенных аминов. К катехоламинам принадлежат дофамин, норадреналин и адреналин, выполняющие, как и ацетилхолин, роль нейромедиаторов. Адреналин участвует в регуляции сердечной деятельности, при физиологических стрессах он выделяется в кровь («гормон страха»).
В ароматическом ряду основу важных природных биологически активных соединений и синтетических лекарственных средств составляют и-аминофенол, и-аминобензойная, салициловая и сульфаниловая кислоты.
и-Аминофенол и его производные. Как гетерофункциональное соединение п-аминофенол может образовывать производные по каждой функциональной группе в отдельности и одновременно по двум функциональным группам. Сам п-аминофенол ядовит; интерес для медицины представляет его производное - парацетамол, оказывающий анальгетическое (обезболивающее) и жаропонижающее действие.
studfiles.net
Строение - сложный эфир - Большая Энциклопедия Нефти и Газа, статья, страница 1
Строение - сложный эфир
Cтраница 1
Строение сложного эфира оказывает влияние на вторую стадию процесса. [1]
Определите строение сложного эфира ос-аминокислоты, если известно, что он содержит 15 73 % азота по массе. [2]
Развивая свой первый вывод о строении сложных эфиров, Дюма опирается на идеи Гей-Люссака об эфире и спирте и переносил свойства основания сложных эфиров на этилен. Считая, как и Тенар, сложные эфиры солеподобными веществами, Дюма видел в этилене прототип аммиака. [3]
Метод гидролиза широко применяется для установления строения различных природных сложных эфиров, например восков. [4]
Если это будет усвоено, то формулы строения любых сложных эфиров могут быть выведены без особого затруднения. [5]
Показана зависимость относительной величины сигнала катарометра от молекулярного веса и строения сложных эфиров. [6]
Направление реакции зависит как от строения 2-алкилпиридина, так и от строения сложного эфира. При применении сложного эфира ароматической или гетероциклической кислоты и 2-этил - или 2-изобутилпиридина образуются только кетоны и реакция дальше не идет, а со сложными эфирами алифатических кислот получают кетоны или смесь кетона и третичного карбинола. [7]
Характер радикалов R и R онределяется строением кетона, а радикала R - строением галоидзамощенного сложного эфира. [8]
Изображая формулу так, как показано в примере I, можно, пользуясь общим уравнением реакции, без особого затруднения выводить формулы строения любых сложных эфиров. [9]
Это дает возможность получать эфиры, даже располагая очень малыми количествами кислот и спиртов, что имеет значение при исследовании тех и других. С другой стороны, этот синтез выясняет строение сложных эфиров, так как показывает, что алкил занимает то же место, что и - металл, то есть, что эти эфиры построены по типу солей. [10]
Вторичная сложноэфирная группировка замещается на хлор с инверсией, сопровождающейся более или менее значительной рацемизацией. Степень рацемизации зависит от выбора хлорирующего агента и строения сложного эфира. [11]
При этом появляется интересное различие в зависимости от строения сложных эфиров. [12]
Низкие т-ры ( 25 - 60 С) способствуют образованию па - / из-ацилфенолов, более высокие - орто-производных ( напр. Выходы конечных продуктов и соотношение образующихся изомеров колеблются в очень широких пределах и зависят как от строения сложного эфира, так и условий проведения р-ции. [13]
Среди многочисленных кислотных производных фосфора субфосфорная, пирофосфористая и пирофосфорная кислоты, их соли и органические производные уже давно привлекали к себе внимание исследователей. Однако несмотря на большое число работ, посвященных субфосфорной, пирофосфорной и в меньшей степени пирофосфористой кислотам, строение их далеко не может считаться установленным. Еще в меньшей мере изучены свойства и строение сложных эфиров названных кислот. [14]
Свободнорадикальной сополимеризацией АА, МАА и соответствующих N - замещенных амидов с другими мономерами получают линейные разветвленные и сшитые сополимеры, растворимые в воде или органических растворителях. Карбоцепные полиамидные гомо - и сополимеры превосходят соответствующие сложноэфирные аналоги по прочностным свойствам, имеют более высокие температуры стеклования, труднее гидролизуются. Показано [248] также, что исходные амидные мономеры Ch3CRCONR R отличаются от близких по строению сложных эфиров большей скоростью полимеризации. [15]
Страницы: 1 2
www.ngpedia.ru
Вопрос 104
Строение и классификация альфа-аминокислот
Природные аминокислоты отвечают общей формуле RCH(Nh3)COOH и отличаются строением радикала R. Формулы и тривиальные названия важнейших аминокислот приведены в таблице. Для биологического функционирования аминокислот в составе белков определяющим является полярность радикала R. По этому признаку аминокислоты разделяют на следующие основные группы (см. таблицу).
Таблица. Важнейшие a -аминокислоты RCH(Nh3)COOH
| Формула | Название | Обозначение | pI |
| Аминокислоты, содержащие неполярный радикал R | |||
|
| Глицин | Gly | 5,97 |
|
| Аланин | Ala | 6,0 |
|
| Валин | Val | 5,96 |
|
| Лейцин | Leu | 5,98 |
|
| Изолейцин | Ile | 6,02 |
|
| Фенилаланин | Phe | 5,48 |
|
| Триптофан | Trp | 5,89 |
| Пролин | Pro | 6,30 | |
|
| Метионин | Met | 5,74 |
|
| Цистин | (Cys)2 | 5,0 |
| Аминокислоты, содержащие полярный неионогенный радикал R
| |||
| Серин | Ser | 5,68 | |
|
| Треонин
|
Thr
| 5,60 |
|
| Гидроксипролин | Hyp | 5,8 |
|
| Аспаргин | Asn | 5,41 |
|
| Глутамин | Gln | 5,65 |
| Аминокислоты, содержащие полярный положительно заряженный радикал R | |||
|
| Лизин | Lys | 9,74 |
|
| 5-Гидроксилизин |
| 9,15 |
|
| Аргинин | Arg | 10,76 |
|
| Гистидин | His | 7,59 |
| Аминокислоты, содержащие полярный отрицательно заряженный радикал R | |||
|
| Аспаргиновая кислота | Asp | 2,77 |
|
| Глутаминовая кислота | Gly | 3,22
|
|
| Тирозин | Tyr | 5,66 |
|
| Цистеин | Cys | 5,07 |
Классификация
1.Аминокислоты, содержащие неполярный радикал R. Такие группы располагаются внутри молекулы белка и обуславливают гидрофобные взаимодействия.
2.Аминокислоты, содержащие полярный неионогенный радикал R. Аминокислоты этого типа имеют в составе бокового радикала полярные группы, не способные к ионизации в водной среде (спиртовый гидроксил, амидная группа). Такие группы могут располагаться как внутри, так и на поверхности молекулы белка. Они участвуют в образовании водородных связей с другими полярными группами.
3.Аминокислоты, содержащие радикал R, способный к ионизации в водной среде с образованием положительно или отрицательно заряженных групп. Такие аминокислоты содержат в боковом радикале дополнительный основный или кислотный центр, который в водном растворе может соответственно присоединять или отдавать протон.

В белках ионогенные группы этих аминокислот располагаются, как правило, на поверхности молекулы и обуславливают электростатические взаимодействия.
Классификация
По радикалу
Неполярные: аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан,
Полярные незаряженные (заряды скомпенсированы) при pH=7: [], серин, треонин, цистеин, аспарагин, глутамин, тирозин
Полярные заряженные отрицательно при pH=7: аспартат, глутамат
Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин
По функциональным группам
Алифатические
Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
Оксимоноаминокарбоновые: серин, треонин
Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
Амиды моноаминодикарбоновых: аспарагин, глутамин
Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
Серосодержащие: цистеин, метионин
Ароматические: фенилаланин, тирозин, триптофан, (гистидин)
Гетероциклические: триптофан, гистидин, пролин
Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз
Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
Семейство глутамата: глутамат, глутамин, аргинин, пролин.
Семейство пирувата: аланин, валин, лейцин.
Семейство серина: серин, цистеин, глицин.
Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников
Незаменимые
Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан
Заменимые
Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных
Биодеградация аминокислот может идти разными путями.
По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы:
Глюкогенные — при распаде дают метаболиты, не повышающие уровень кетоновых тел, способные относительно легко становиться субстратом для глюконеогенеза: пируват, α-кетоглутарат, сукцинил-KoA, фумарат, оксалоацетат
Кетогенные — распадаются до ацетил-KoA и ацетоацетил-KoA, повышающие уровень кетоновых тел в крови животных и человека и преобразующиеся в первую очередь в липиды
Глюко-кетогенные — при распаде образуются метаболиты обоих типов
Аминокислоты:
Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
Кетогенные: лейцин, лизин.
Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
Стереоизомеры (пространственные изомеры) — химические соединения, имеющие одинаковое строение, но отличающиеся пространственным расположением атомов. Стереоизомеры имеют одинаковую конституцию, но различные конфигурацию и/или конформацию.
studfiles.net
Лекция № 16. Аминокислоты. Пептиды
Лекция № 1765АМИНОКИСЛОТЫ. ПЕПТИДЫ
План
АМИНОКИСЛОТЫ. ПЕПТИДЫ
План
- Методы получения.
- Химические свойства.
- Аминокислоты, входящие в состав белков.
- Пептиды
Аминокислоты – гетерофункциональные соединения, содержащиекарбоксильную и аминогруппы. По взаимному расположению функциональных группразличают a -,b -, g — и т.д. аминокислоты.Аминокислоты, содержащие аминогруппу на конце цепи, называют w -аминокислотами.
1. Методы получения
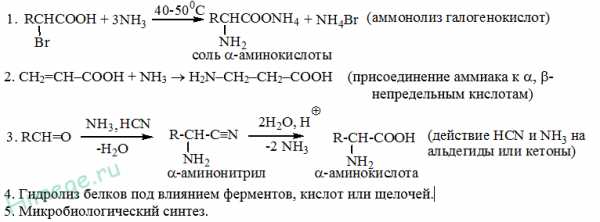
!) Аммонолиз галогензамещенных кислот.
Метод используется для синтеза a -аминокислот из доступных a -галогензамещенных кислот.
2) Метод Штеккера- Зелинского
Включает стадии образования аминонитрила привзаимодействии альдегида с HCN и Nh4 c последующим гидролизом его в аминокислоту. В качествереагента применяют смесь NaCN и Nh5Cl.
Метод применим для синтеза только a -аминокислот.
3) Восстановительное аминированиеоксокислот
4) Присоединение аммиака к a ,b -непредельным карбоновым кислотам.
Метод применим для синтеза b -аминокислот.
5) Из оксимов циклических кетоновперегруппировкой Бекмана.
Метод используется для синтеза w -аминокислот.
2. ХимическиесвойстваАминокислоты дают реакции, характерные для карбоксильнойи аминогрупп, и, кроме того, проявляют специфические свойства, которыеопределяются наличием двух функциональных групп и их взаимнымрасположением.2.1. Кислотно-основныесвойства
Аминокислоты содержат кислотный и основныйцентры и являются амфотерными соединениями. В кристаллическом состоянии онисуществуют в виде внутренних солей (биполярных ионов), которые образуются врезультате внутримолекулярного переноса протона от более слабого основногоцентра (СОО—) к более сильномуосновному центру (Nh3).
Ионное строение аминокислот подтверждается ихфизическими свойствами. Аминокислоты – нелетучие кристаллические вещества свысокими температурами плавления. Они нерастворимы в неполярных органическихрастворителях и растворимы в воде. Их молекулы обладают большими дипольнымимоментами.
Форма существования аминокислот в водныхрастворах зависит от рН. В кислых растворах аминокислоты присоединяют протон исуществуют преимущественно в виде катионов. В щелочной среде биполярный ионотдает протон и превращается в анион.
При некотором значении рН, строго определенномдля каждой аминокислоты, она существует преимущественно в виде биполярного иона.Это значение рН называют изоэлектрической точкой (рI). Визоэлектрической точке аминокислота не имеет заряда и обладает наименьшейрастворимостью в воде. Катионная форма аминокислоты содержит два кислотныхцентра (COOH и Nh4+) ихарактеризуется двумя константами диссоциации рКа1 и рКа2.Значение рI определяется по уравнению:
2.2. Реакции поаминогруппе
Дезаминирование
Аминокислоты содержат первичную аминогруппу и подобно первичным аминамвзаимодействуют с азотистой кислотой с выделением азота. При этом происходитзамещение аминогруппы на гидроксильную.
RCH(Nh3)COOH + HNO2® RCH(OH)COOH + N2 + h3O
Реакция используется для количественногоопределения аминокислот по объему выделившегося азота (метод Ван-Слайка).
Алкилирование иарилирование
При взаимодействии аминокислот с избыткомалкилгалогенида происходит исчерпывающее алкилирование аминогруппы и образуютсявнутренние соли.
Аминокислоты арилируются 2,4-динитрофторбензолом(ДНФБ) в щелочной среде. Реакция протекает как нуклеофильное замещение вактивированном ароматическом кольце.
Реакция используется для установленияаминокислотной последовательности в пептидах.
Ацилирование
Аминокислоты взаимодействуют с ангидридами ихлорангидридами с образованием N-ацильных производных.
Реакция используется для защиты аминогруппы всинтезе пептидов. Такая защита должна легко сниматься, а амиды, как известно,гидролизуются в жестких условиях. При разработке методов синтеза пептидов былинайдены защитные группы, которые легко удаляются путем гидролиза илигидрогенолиза.
Карбобензоксизащита:
трет-Бутоксикарбонильная защита(БОК-защита).
Легкость снятия защиты обусловлена устойчивостьюбензил- и трет-бутил-катионов, которые образуются в качествеинтермедиатов.
2.3. Реакции по карбоксильнойгруппе
Декарбоксилирование
При сухой перегонке в присутствии гидроксидабария аминокислоты декарбоксилируются с образованием аминов.
Этерификация
Аминокислоты взаимодействуют со спиртами в присутствии газообразного HCl каккатализатора с образованием сложных эфиров.
В отличие от самих аминокислот, их сложные эфиры– легко летучие соединения и могут быть разделены путем перегонки илигазожидкостной хроматографии, что используется для анализа и разделения смесейаминокислот, полученных при гидролизе белков.
Получение галогенангидридов иангидридов
При действии на защищенные по аминогруппеаминокислоты галогенидов фосфора или серы образуются хлорангидриды.
Реакция используется для активации карбоксильнойгруппы при нуклеофильном замещении. Чаще для этой цели получают смешанныеангидриды, которые являются более селективными ацилирующими реагентами.
Реакция используется для активации аминогруппы всинтезе пептидов.
2.4. Специфические реакцииаминокислот
Реакции с одновременным участием карбоксильной иаминогрупп идут, как правило, с образованием продуктов, содержащихтермодинамически устойчивые 5-ти- и 6-тичленные гетероциклы.
Комплексообразование
a -Аминокислотыобразуют прочные хелатные комплексы с ионами переходных металлов (Cu, Ni, Co, Crи др.).
Отношение аминокислот кнагреванию
Превращения аминокислот при нагревании зависят от взаимного расположениякарбоксильной и аминогруппы и определяются возможностью образованиятермодинамически стабильных 5-ти- 6-тичленных циклов
a -Аминокислотывступают в реакцию межмолекулярного самоацилирования. При этом образуютсяциклические амиды – дикетопиперазины.
b -Аминокислоты принагревании переходят a ,b -непредельные кислоты.
g — и d -Аминокислот претерпеваютвнутримолекулярное ацилирование с образованием циклических амидов – лактамов.
Нингидриновая реакция
При взаимодействии a -аминокислот с трикетоном – нингидрином происходит одновременное окислительноедезаминирование и декарбоксилирование с образованием альдегида и окрашенногопродукта конденсации.
Реакция используется для количественного анализааминокислот методом фотометрии.
- a -Аминокислоты,входящие в состав белков
Природные аминокислоты отвечают общей формуле RCH(Nh3)COOH и отличаются строением радикала R. Формулы итривиальные названия важнейших аминокислот приведены в таблице. Длябиологического функционирования аминокислот в составе белков определяющимявляется полярность радикала R. По этому признаку аминокислоты разделяют наследующие основные группы (см. таблицу).
Таблица. Важнейшие a -аминокислотыRCH(Nh3)COOH
| Формула | Название | Обозначение | pI |
| Аминокислоты, содержащиенеполярный радикал R | |||
| Глицин | Gly | 5,97 | |
| Аланин | Ala | 6,0 | |
| Валин | Val | 5,96 | |
| Лейцин | Leu | 5,98 | |
| Изолейцин | Ile | 6,02 | |
| Фенилаланин | Phe | 5,48 | |
| Триптофан | Trp | 5,89 | |
| Пролин | Pro | 6,30 | |
| Метионин | Met | 5,74 | |
| Цистин | (Cys)2 | 5,0 | |
| Аминокислоты, содержащие полярныйнеионогенный радикал R | |||
| Серин | Ser | 5,68 | |
| Треонин
| Thr | 5,60 | |
| Гидроксипролин | Hyp | 5,8 | |
| Аспаргин | Asn | 5,41 | |
| Глутамин | Gln | 5,65 | |
| Аминокислоты, содержащие полярныйположительно заряженный радикал R | |||
| Лизин | Lys | 9,74 | |
| 5-Гидроксилизин | 9,15 | ||
| Аргинин | Arg | 10,76 | |
| Гистидин | His | 7,59 | |
| Аминокислоты, содержащие полярныйотрицательно заряженный радикал R | |||
| Аспаргиноваякислота | Asp | 2,77 | |
| Глутаминоваякислота | Gly | 3,22 | |
| Тирозин | Tyr | 5,66 | |
| Цистеин | Cys | 5,07 | |
Аминокислоты, содержащие неполярный радикалR. Такие группы располагаются внутримолекулы белка и обуславливают гидрофобные взаимодействия.
Аминокислоты, содержащие полярныйнеионогенный радикал R. Аминокислоты этого типа имеют в составе бокового радикала полярные группы, неспособные к ионизации в водной среде (спиртовый гидроксил, амидная группа).Такие группы могут располагаться как внутри, так и на поверхности молекулыбелка. Они участвуют в образовании водородных связей с другими полярнымигруппами.
Аминокислоты, содержащие радикал R, способныйк ионизации в водной среде с образованием положительно или отрицательнозаряженных групп. Такие аминокислоты содержат в боковом радикаледополнительный основный или кислотный центр, который в водном растворе можетсоответственно присоединять или отдавать протон.

В белках ионогенные группы этих аминокислотрасполагаются, как правило, на поверхности молекулы и обуславливаютэлектростатические взаимодействия.
3.2.Стереоизомерия.
Все природные a-аминокислоты (кроме глицина)являются хиральными соединениями. По конфигурации хирального центра в положении2 аминокислоты относят D- или L-ряду.
Природные аминокислоты относятся кL-ряду.
Большинство аминокислот содержат один хиральныйцентр и имеют два стереоизомера. Аминокислоты изолейцин, треонин,гидроксипролин, 5-гидроксилизин и цистин содержат два хиральных центра и имеют(кроме цистина) 4 стереоизомера, из которых только один встречается в составебелков.
Так, из 4-х стереоизомеров треонина вприроде встречается только (2S,3R)-2-амино-3-гидроксибутановая кислота.
Использование для построения белков толькоодного вида стереоизомеров имеет важное значение для формирования ихпространственной структуры и обеспечения биологической активности.
a -Аминокислоты,полученные синтетическим путем, представляют рацемические смеси, которыенеобходимо разделять. Наиболее предпочтительным является ферментативный способразделения с помощью ферментов ацилаз, способных гидролизовать N-ацетильныепроизводные только L-a -аминокислот. Ферментативное расщепление проводят последующей схеме.
Сначала рацемическую аминокислоту ацилируютуксусным ангидридом:
Затем рацемическую смесь ацетильных производныхподвергают ферментативной обработке. При этом гидролизуется ацетильноепроизводное только L-аминокислоты:
Полученная после ферментативного смесь легкоразделяется, так как свободная L-аминокислота растворяется и в кислотах, и вщелочах, а ацилированная – только в щелочах.
3.3. Кислотно-основныесвойства.
По кислотно-основным свойствам аминокислотыразделяют на три группы.
Нейтральные аминокислоты не содержат врадикале R дополнительных кислотных или основных центров, способных к ионизациив водной среде. В кислой среде они существуют в виде однозарядного катиона иявляются двухосновными кислотами по Бренстеду. Как видно на примере аланина,изоэлектрическая точка у нейтральных аминокислот не равна 7, а лежит в интервале5,5 – 6,3.
pI=1/2(2,34+9,69)=6,01
Основные аминокислоты содержат врадикале R дополнительный основный центр. К ним относятся лизин, гистидин иаргинин. В кислой среде они существуют в виде дикатиона и являются трехосновнымикислотами. Изоэлектрическая точка основных аминокислот, как видно на примерелизина, лежит в области рН выше 7.
pI= 1/2(9,0+10,05)=9,74
Кислые аминокислоты содержат врадикале R дополнительный кислотный центр. К ним относятся аспаргиновая иглутаминовая кислоты. В кислой среде они существуют в виде катиона и являютсятрехосновными кислотами. Изоэлектрическая точка этих аминокислот лежит в областирН много ниже 7.
pI= 1/2(2,09+3,86)=2,77
Тирозин и цистеин содержат в боковых радикалахслабые кислотные центры, способные к ионизации при высоких значениях рН.
Важное значение имеет тот факт, что прифизиологическом значении рН (~7) ни одна аминокислота не находится визоэлектрической точке. В организме все аминокислоты ионизированы, чтообеспечивает им хорошую растворимость в воде.
Различие в кислотно-основных свойствахиспользуется для разделения аминокислот методом электрофореза и ионообменнойхроматографии. При данном значении рН разные аминокислоты могут иметь разный повеличине и знаку электрический заряд. Например, при рН6 лизин имеет заряд +1 идвижется к катоду, аспаргиновая кислота имеет заряд –1 и перемещается к аноду, ааланин находится в изоэлектрической точке и не перемещается в электрическом поле. Таким образом при рН6 они могут бытьразделены с помощью электрофореза.
Для разделения аминокислот методом ионообменнойхроматографии используют катионообменные смолы (сульфированный полистирол).Процесс ведут в кислой среде, когда аминокислоты находятся катионнойформе.
Скорость продвижения аминокислот похроматографической колонке зависит от силы их электростатических и гидрофобныхвзаимодействий со смолой. Наиболее прочно связываются со смолой основныеаминокислоты, имеющие наибольший положительный заряд, наименее прочно – кислыеаминокислоты. Наибольшим гидрофобным связыванием со смолой обладают аминокислотыс неполярными боковыми радикалами, особенно ароматическими. Таким образом,порядок элюирования аминокислот следующий. Легче других элюируются кислыеаминокислоты (Asp и Glu), следом за ними идут аминокислоты, содержащие полярныенеионогенные группы (Ser, Thr, Asn, Gln), затем из колонки вымываютсяаминокислоты с неполярными боковыми радикалами (Phe, Trp, Ile и др.) и впоследнюю очередь элюируются основные аминокислоты (His, Lys, Arg).
- 3.4. Реакции аминокислот invivo
Восстановительное аминирование – методсинтеза a -аминокислот из a -оксокислот при участии кофермента НАД Н в качествевосстанавливающего реагента.
Трасаминирование – основнойпуть биосинтеза аминокислот. При трансаминировании происходит взаимообмен двухфункциональных групп – аминной и карбонильной между аминокислотой и кетокилотой.При этом нужная для организма аминокислота 1 синтезируется из аминокислоты 2,имеющейся в клетках в избыточном коичестве. Реакция осуществляется при участииферментов трансаминаз и кофермента пиридоксальфосфата.
Содержащий альдегидную группу пиридоксальфосфатслужит переносчиком аминогруппы в виде основания Шиффа.
Декарбоксилирование
Аминокислоты декарбоксилируются под действиемферментов декарбоксилаз при участи кофермента пиридоксальфосфата. При этомобразуются биогенные амины.
Биогенные амины обладают ярко выраженнойбиологической активностью. Важнейшими из них являются — коламин (предшественникв синтезе холина и нейромедиатора ацетилхолина), гистамин (обеспечиваеталлергические реакции организма), g -аминомасляная кислота (нейромедиатор), адреналин(гормон надпочечников, нейромедиатор)
Дезаминирование
Неокислительное дезаминирование происходит путемотщепления аммиака под действием ферментов с образованием a ,b -непредельных кислот.
Окислительное дезаминирование происходитпри участии ферментов оксидаз и кофермента НАД+, который выступает в качестве окислителя. В результатевыделяется аммиак и образуется соответствующая кетокислота.
С помощью реакций дезаминирования снижаетсяизбыток аминокислот в организме.
4. Пептиды
Петиды – это полиамиды, построенные из a -аминокислот. По числу аминокислотных остатков вмолекуле пептида различают дипептиды, трипептиды, тетрапептиды и т.д.Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами, более 10 аминокислотных остатков – полипептидами.Природные полипептиды, включающие более 100 аминокислотных остатков, называют белками.
4.1. Строениепептидов
Формально пептиды можно рассматривать как продукты поликонденсацииаминокислот.
Аминокислотные остатки в пептиде связаныамидными (пептидными) связями. Один конец цепи, на котором находитсяаминокислота со свободной аминогруппой, называют N-концом. Другой конец,на котором находится аминокислота со свободной карбоксильной группой, называют С-концом. Пептиды принято записывать и называть, начиная сN-конца.
Название пептида строят на основе тривиальныхназваний, входящих в его состав аминокислотных остатков, которые перечисляют,начиная с N-конца. При этом в названиях всех аминокислот за исключениемС-концевой суффикс “ин” заменяют на суффикс “ил”. Для сокращенного обозначенияпептидов используют трехбуквенные обозначения входящих в его составаминокислот.
Пептид характеризуется аминокислотнымсоставом и аминокислотной последовательностью.
Аминокислотный состав пептида может бытьустановлен путем полного гидролиза пептида (расщепления до аминокислот) споследующим качественным и количественным анализом образовавшихся аминокислотметодом ионобменной хроматографии или ГЖХ-анализом сложных эфиров аминокислот.Полный гидролиз пептидов проводят в кислой среде при кипячении их с 6н.HCl.
Одному и тому же аминокислотному составуотвечает несколько пептидов. Так, из 2-х разных аминокислот может быть построено2 дипептида, из трех разных аминокислот – 6 трипептидов, из n разных аминокислотn! пептидов одинакового состава. Например, составу Gly:Ala:Val=1:1:1 отвечаютследующие 6 трипептидов.
Gly-Ala-Val Gly- Val-Ala Val-Gly-Ala Val-Ala-Gly Ala-Gly-ValAla-Val-Glu
Таким образом, для полной характеристики пептиданеобходимо знать его аминокислотный состав и аминокислотнуюпоследовательность.
4.2. Определение аминокислотнойпоследовательности
Для определения аминокислотнойпоследовательности используют комбинацию двух методов: определение концевыхаминокислот и частичный гидролиз.
Определение N-концевыхаминокислот.
Метод Сегнера. Пептид обрабатывают 2,4-динитрофтробензолом (ДНФБ), азатем полностью гидролизуют. Из гидролизата выделяют и идентифицируютДНФ-производное N-концевой аминокислоты.

Метод Эдмана состоит вовзаимодействии N-концевой аминокислоты с фенилизотиоцианатом в щелочной среде.При дальнейшей обработке слабой кислотой без нагревания происходит отщепление отцепи “меченой” концевой аминокислоты в виде фенилгидантоинового (ФТГ)производного.

Преимущество этого метода состоит в том, что приотщеплении N-концевой аминокислоты пептид не разрушается и операцию поотщеплению можно повторять. Метод Эдмана используют в автоматическом приборе –секвенаторе, с помощью которого можно осуществить 40 – 50 стадий отщепления,идентифицируя полученные на каждой стадии ФТГ-производные методом газожидкостнойхроматографии.
Частичный гидролиз полипептидов
При частичном гидролизе пептиды расщепляются собразованием более коротких цепей. Частичный гидролиз проводят с помощьюферментов, которые гидролизуют пептидные связи избирательно, например, только сN-конца (аминопептидазы) или только с С-конца (карбоксипептидазы).Существуют ферменты, расщепляющие пептидные связи только между определеннымиаминокислотами. Меняя условия гидролиза, можно разбить пептид на различныефрагменты, которые перекрываются по составляющим их аминокислотным остаткам.Анализ продуктов частичного гидролиза позволяет воссоздать структуру исходногопептида. Рассмотрим простейший пример установления структуры трипептида.Частичный гидролиз по двум разным направлениям трипептида неизвестного строениядает продукты представленные на схеме.
Единственный трипептид, структура которого непротиворечит продуктам частичного гидролиза – Gly-Ala-Phe.
Установление аминокислотной последовательностипептидов, содержащих несколько десятков аминокислотных остатков, – более сложнаязадача, которая требует комбинации различных методов.
4.3. Синтезпетидов
Синтез пептида с заданной аминокислотнойпоследовательностью – чрезвычайно сложная задача. В простейшем случае синтезадипептида из 2-х разных аминокислот возможно образование 4-х разныхпродуктов.
В настоящее время разработана стратегия синтезапептидов, основанная на использовании методов активации и защиты функциональных групп на соответствующих этапах синтеза. Процесс синтезадипептида включает следующие стадии:
- защита аминогруппы N-концевойаминокислоты;
- активация карбоксильной группы N-концевойаминокислоты;
- конденсация модифицированныхаминокислот
- снятие защитных групп

Таким образом, последовательно присоединяяаминокислоты, шаг за шагом наращивают цепь полипептида. Такой синтез оченьдлителен, трудоемок и дает низкий выход конечного продукта. Основные потерисвязаны с необходимостью выделения и очистки продуктов на каждой стадии.
Этих недостатков лишен используемый в настоящеевремя твердофазный синтез пептидов. На первой стадии защищенная поаминогруппе С-концевая аминокислота закрепляется на твердом полимерном носителе(полистироле, модифицированном введением групп –Ch3Cl). После снятия защиты проводят ацилированиеаминогруппы закрепленной на носителе аминокислоты другой аминокислотой, котораясодержит активированную карбоксильную и защищенную аминогруппу. После снятиязащиты проводят следующую стадию ацилирования. Отмывание продукта от примесейпроводят прямо на носителе и лишь после окончания синтеза полипептид снимают сносителя действием бромистоводородной кислоты. Твердофазный синтезавтоматизирован и проводится с помощью приборов – автоматическихсинтезаторов.
;
Методом твердофазного синтеза получено большоеколичество пептидов, содержащих 50 и более аминокислотных остатков, в том числеинсулин (51 аминокислотный остаток) и рибонуклеаза (124 аминокислотныхостатка).
studentik.net
Аминокислоты — номенклатура, получение, химические свойства. Белки » HimEge.ru

Строение аминокислот
Аминокислоты — гетерофункциональные соединения, которые обязательно содержат две функциональные группы: аминогруппу — Nh3 и карбоксильную группу —СООН, связанные с углеводородным радикалом.Общую формулу простейших аминокислот можно записать так:
Так как аминокислоты содержат две различные функциональные группы, которые оказывают влияние друг на друга, характерные реакции отличаются от характерных реакций карбоновых кислот и аминов.
Свойства аминокислот
Аминогруппа — Nh3 определяет основные свойства аминокислот, т. к. способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота.
Группа —СООН (карбоксильная группа) определяет кислотные свойства этих соединений. Следовательно, аминокислоты — это амфотерные органические соединения. Со щелочами они реагируют как кислоты:
С сильными кислотами- как основания-амины:
Кроме того, аминогруппа в аминокислоте вступает во взаимодействие с входящей в ее состав карбоксильной группой, образуя внутреннюю соль:
Ионизация молекул аминокислот зависит от кислотного или щелочного характера среды:
Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода.
Аминокислоты представляют собой бесцветные кристаллические вещества, плавящиеся с разложением при температуре выше 200 °С. Они растворимы в воде и нерастворимы в эфире. В зависимости от радикала R— они могут быть сладкими, горькими или безвкусными.
Аминокислоты подразделяют на природные (обнаруженные в живых организмах) и синтетические. Среди природных аминокислот (около 150) выделяют протеиногенные аминокислоты (около 20), которые входят в состав белков. Они представляют собой L-формы. Примерно половина из этих аминокислот относятся к незаменимым, т. к. они не синтезируются в организме человека. Незаменимыми являются такие кислоты, как валин, лейцин, изолейцин, фенилаланин, лизин, треонин, цистеин, метионин, гистидин, триптофан. В организм человека данные вещества поступают с пищей. Если их количество в пище будет недостаточным, нормальное развитие и функционирование организма человека нарушаются. При отдельных заболеваниях организм не в состоянии синтезировать и некоторые другие аминокислоты. Так, при фенилкетонурии не синтезируется тирозин. Важнейшим свойством аминокислот является способность вступать в молекулярную конденсацию с выделением воды и образованием амидной группировки —NH—СО—, например:
Получаемые в результате такой реакции высокомолекулярные соединения содержат большое число амидных фрагментов и поэтому получили название полимамидов.
К ним, кроме названного выше синтетического волокна капрона, относят, например, и энант, образующийся при поликонденсации аминоэнантовой кислоты. Для получения синтетических волокон пригодны аминокислоты с расположением амино- и карбоксильной групп на концах молекул.
Полиамиды альфа-аминокислот называются пептидами. В зависимости от числа остатков аминокислот различают дипептиды, трипептиды, полипептиды. В таких соединениях группы —NH—СО— называют пептидными.
Изомерия и номенклатура аминокислот
Изомерия аминокислот определяется различным строением углеродной цепи и положением аминогруппы, например:
Широко распространены также названия аминокислот, в которых положение аминогруппы обозначается буквами греческого алфавита: α, β, у и т. д. Так, 2-аминобутановую кислоту можно назвать также α-аминокислотой:
Способы получения аминокислот
В биосинтезе белка в живых организмах участвуют 20 аминокислот.
Более подробно про белки.
himege.ru
Лекция №
Лекция № 47
АМИНОКИСЛОТЫ. ПЕПТИДЫ
План
- Методы получения.
- Химические свойства.
- Аминокислоты, входящие в состав белков.
- Пептиды
Аминокислоты – гетерофункциональные соединения, содержащие карбоксильную и аминогруппы. По взаимному расположению функциональных групп различают a -,b -, g - и т.д. аминокислоты. Аминокислоты, содержащие аминогруппу на конце цепи, называют w -аминокислотами.
1. Методы получения
!) Аммонолиз галогензамещенных кислот.
Метод используется для синтеза a -аминокислот из доступных a -галогензамещенных кислот.
2) Метод Штеккера- Зелинского
Включает стадии образования аминонитрила при взаимодействии альдегида с HCN и Nh4 c последующим гидролизом его в аминокислоту. В качестве реагента применяют смесь NaCN и Nh5Cl.
Метод применим для синтеза только a -аминокислот.
3) Алкилирование N-фталимидмалонового эфира
4) Присоединение аммиака к a ,b -непредельным карбоновым кислотам.
Метод применим для синтеза b -аминокислот.
5) Из оксимов циклических кетонов перегруппировкой Бекмана.
Метод используется для синтеза w -аминокислот.
2. Химические свойства
Аминокислоты дают реакции, характерные для карбоксильной и аминогрупп, и, кроме того, проявляют специфические свойства, которые определяются наличием двух функциональных групп и их взаимным расположением.
2.1. Кислотно-основные свойства
Аминокислоты содержат кислотный и основный центры и являются амфотерными соединениями. В кристаллическом состоянии они существуют в виде внутренних солей (биполярных ионов), которые образуются в результате внутримолекулярного переноса протона от более слабого основного центра (СОО-) к более сильному основному центру (Nh3).
Ионное строение аминокислот подтверждается их физическими свойствами. Аминокислоты – нелетучие кристаллические вещества с высокими температурами плавления. Они нерастворимы в неполярных органических растворителях и растворимы в воде. Их молекулы обладают большими дипольными моментами.
Форма существования аминокислот в водных растворах зависит от рН. В кислых растворах аминокислоты присоединяют протон и существуют преимущественно в виде катионов. В щелочной среде биполярный ион отдает протон и превращается в анион.
При некотором значении рН, строго определенном для каждой аминокислоты, она существует преимущественно в виде биполярного иона. Это значение рН называют изоэлектрической точкой (рI). В изоэлектрической точке аминокислота не имеет заряда и обладает наименьшей растворимостью в воде. Катионная форма аминокислоты содержит два кислотных центра (COOH и Nh4+) и характеризуется двумя константами диссоциации рКа1 и рКа2. Значение рI определяется по уравнению:
2.2. Реакции по аминогруппе
Дезаминирование
Аминокислоты содержат первичную аминогруппу и подобно первичным аминам взаимодействуют с азотистой кислотой с выделением азота. При этом происходит замещение аминогруппы на гидроксильную.
RCH(Nh3)COOH + HNO2® RCH(OH)COOH + N2 + h3O
Реакция используется для количественного определения аминокислот по объему выделившегося азота (метод Ван-Слайка).
Алкилирование и арилирование
При взаимодействии аминокислот с избытком алкилгалогенида происходит исчерпывающее алкилирование аминогруппы и образуются внутренние соли.
Аминокислоты арилируются 2,4-динитрофторбензолом (ДНФБ) в щелочной среде. Реакция протекает как нуклеофильное замещение в активированном ароматическом кольце.
Реакция используется для установления аминокислотной последовательности в пептидах.
Ацилирование
Аминокислоты взаимодействуют с ангидридами и хлорангидридами с образованием N-ацильных производных.
Реакция используется для защиты аминогруппы в синтезе пептидов. Такая защита должна легко сниматься, а амиды, как известно, гидролизуются в жестких условиях. При разработке методов синтеза пептидов были найдены защитные группы, которые легко удаляются путем гидролиза или гидрогенолиза.
Карбобензоксизащита:
трет-Бутоксикарбонильная защита (БОК-защита).
Легкость снятия защиты обусловлена устойчивостью бензил- и трет-бутил-катионов, которые образуются в качестве интермедиатов.
2.3. Реакции по карбоксильной группе
Декарбоксилирование
При сухой перегонке в присутствии гидроксида бария аминокислоты декарбоксилируются с образованием аминов.
Этерификация
Аминокислоты взаимодействуют со спиртами в присутствии газообразного HCl как катализатора с образованием сложных эфиров.
В отличие от самих аминокислот, их сложные эфиры – легко летучие соединения и могут быть разделены путем перегонки или газожидкостной хроматографии, что используется для анализа и разделения смесей аминокислот, полученных при гидролизе белков.
Получение галогенангидридов и ангидридов
При действии на защищенные по аминогруппе аминокислоты галогенидов фосфора или серы образуются хлорангидриды.
Реакция используется для активации карбоксильной группы при нуклеофильном замещении. Чаще для этой цели получают смешанные ангидриды, которые являются более селективными ацилирующими реагентами.
Реакция используется для активации аминогруппы в синтезе пептидов.
2.4. Специфические реакции аминокислот
Реакции с одновременным участием карбоксильной и аминогрупп идут, как правило, с образованием продуктов, содержащих термодинамически устойчивые 5-ти- и 6-тичленные гетероциклы.
Комплексообразование
a -Аминокислоты образуют прочные хелатные комплексы с ионами переходных металлов (Cu, Ni, Co, Cr и др.).
Отношение аминокислот к нагреванию
Превращения аминокислот при нагревании зависят от взаимного расположения карбоксильной и аминогруппы и определяются возможностью образования термодинамически стабильных 5-ти- 6-тичленных циклов
a -Аминокислоты вступают в реакцию межмолекулярного самоацилирования. При этом образуются циклические амиды – дикетопиперазины.
b -Аминокислоты при нагревании переходят a ,b -непредельные кислоты.
g - и d -Аминокислот претерпевают внутримолекулярное ацилирование с образованием циклических амидов – лактамов.
Нингидриновая реакция
При взаимодействии a -аминокислот с трикетоном – нингидрином происходит одновременное окислительное дезаминирование и декарбоксилирование с образованием альдегида и окрашенного продукта конденсации.
Реакция используется для количественного анализа аминокислот методом фотометрии.
- a -Аминокислоты, входящие в состав белков
3.1. Строение и классификация
Природные аминокислоты отвечают общей формуле RCH(Nh3)COOH и отличаются строением радикала R. Формулы и тривиальные названия важнейших аминокислот приведены в таблице. Для биологического функционирования аминокислот в составе белков определяющим является полярность радикала R. По этому признаку аминокислоты разделяют на следующие основные группы (см. таблицу).
Таблица47.1. Важнейшие a -аминокислоты RCH(Nh3)COOH
|
Формула |
Название |
Обозначение |
pI |
|
Аминокислоты, содержащие неполярный радикал R |
|||
|
|
Глицин |
Gly |
5,97 |
|
|
Аланин |
Ala |
6,0 |
|
|
Валин |
Val |
5,96 |
|
|
Лейцин |
Leu |
5,98 |
|
|
Изолейцин |
Ile |
6,02 |
|
|
Фенилаланин |
Phe |
5,48 |
|
|
Триптофан |
Trp |
5,89 |
|
Пролин |
Pro |
6,30 |
|
|
|
Метионин |
Met |
5,74 |
|
|
Цистин |
(Cys)2 |
5,0 |
|
Аминокислоты, содержащие полярный неионогенный радикал R |
|||
|
Серин |
Ser |
5,68 |
|
|
|
Треонин
|
Thr |
5,60 |
|
|
Гидроксипролин |
Hyp |
5,8 |
|
|
Аспаргин |
Asn |
5,41 |
|
|
Глутамин |
Gln |
5,65 |
|
Аминокислоты, содержащие полярный положительно заряженный радикал R |
|||
|
|
Лизин |
Lys |
9,74 |
|
|
5-Гидроксилизин |
|
9,15 |
|
|
Аргинин |
Arg |
10,76 |
|
|
Гистидин |
His |
7,59 |
|
Аминокислоты, содержащие полярный отрицательно заряженный радикал R |
|||
|
|
Аспаргиновая кислота |
Asp |
2,77 |
|
|
Глутаминовая кислота |
Gly |
3,22
|
|
|
Тирозин |
Tyr |
5,66 |
|
|
Цистеин |
Cys |
5,07 |
Аминокислоты, содержащие неполярный радикал R. Такие группы располагаются внутри молекулы белка и обуславливают гидрофобные взаимодействия.
Аминокислоты, содержащие полярный неионогенный радикал R. Аминокислоты этого типа имеют в составе бокового радикала полярные группы, не способные к ионизации в водной среде (спиртовый гидроксил, амидная группа). Такие группы могут располагаться как внутри, так и на поверхности молекулы белка. Они участвуют в образовании водородных связей с другими полярными группами.
Аминокислоты, содержащие радикал R, способный к ионизации в водной среде с образованием положительно или отрицательно заряженных групп. Такие аминокислоты содержат в боковом радикале дополнительный основный или кислотный центр, который в водном растворе может соответственно присоединять или отдавать протон.
В белках ионогенные группы этих аминокислот располагаются, как правило, на поверхности молекулы и обуславливают электростатические взаимодействия.
3.2. Стереоизомерия.
Все природные a-аминокислоты (кроме глицина) являются хиральными соединениями. По конфигурации хирального центра в положении 2 аминокислоты относят D- или L-ряду.
Природные аминокислоты относятся к L-ряду.
Большинство аминокислот содержат один хиральный центр и имеют два стереоизомера. Аминокислоты изолейцин, треонин, гидроксипролин, 5-гидроксилизин и цистин содержат два хиральных центра и имеют (кроме цистина) 4 стереоизомера, из которых только один встречается в составе белков.
Так, из 4-х стереоизомеров треонина в природе встречается только (2S,3R)-2-амино-3-гидроксибутановая кислота.
Использование для построения белков только одного вида стереоизомеров имеет важное значение для формирования их пространственной структуры и обеспечения биологической активности.
a -Аминокислоты, полученные синтетическим путем, представляют рацемические смеси, которые необходимо разделять. Наиболее предпочтительным является ферментативный способ разделения с помощью ферментов ацилаз, способных гидролизовать N-ацетильные производные только L-a -аминокислот. Ферментативное расщепление проводят по следующей схеме.
Сначала рацемическую аминокислоту ацилируют уксусным ангидридом:
Затем рацемическую смесь ацетильных производных подвергают ферментативной обработке. При этом гидролизуется ацетильное производное только L-аминокислоты:
Полученная после ферментативного смесь легко разделяется, так как свободная L-аминокислота растворяется и в кислотах, и в щелочах, а ацилированная – только в щелочах.
3.3. Кислотно-основные свойства.
По кислотно-основным свойствам аминокислоты разделяют на три группы.
Нейтральные аминокислоты не содержат в радикале R дополнительных кислотных или основных центров, способных к ионизации в водной среде. В кислой среде они существуют в виде однозарядного катиона и являются двухосновными кислотами по Бренстеду. Как видно на примере аланина, изоэлектрическая точка у нейтральных аминокислот не равна 7, а лежит в интервале 5,5 – 6,3.
pI=1/2(2,34+9,69)=6,01
Основные аминокислоты содержат в радикале R дополнительный основный центр. К ним относятся лизин, гистидин и аргинин. В кислой среде они существуют в виде дикатиона и являются трехосновными кислотами. Изоэлектрическая точка основных аминокислот, как видно на примере лизина, лежит в области рН выше 7.
pI= 1/2(9,0+10,05)=9,74
Кислые аминокислоты содержат в радикале R дополнительный кислотный центр. К ним относятся аспаргиновая и глутаминовая кислоты. В кислой среде они существуют в виде катиона и являются трехосновными кислотами. Изоэлектрическая точка этих аминокислот лежит в области рН много ниже 7.
pI= 1/2(2,09+3,86)=2,77
Тирозин и цистеин содержат в боковых радикалах слабые кислотные центры, способные к ионизации при высоких значениях рН.
Важное значение имеет тот факт, что при физиологическом значении рН (~7) ни одна аминокислота не находится в изоэлектрической точке. В организме все аминокислоты ионизированы, что обеспечивает им хорошую растворимость в воде.
Различие в кислотно-основных свойствах используется для разделения аминокислот методом электрофореза и ионообменной хроматографии. При данном значении рН разные аминокислоты могут иметь разный по величине и знаку электрический заряд. Например, при рН6 лизин имеет заряд +1 и движется к катоду, аспаргиновая кислота имеет заряд –1 и перемещается к аноду, а аланин находится в изоэлектрической точке и не перемещается в электрическом поле. Таким образом при рН6 они могут быть разделены с помощью электрофореза.
Для разделения аминокислот методом ионообменной хроматографии используют катионообменные смолы (сульфированный полистирол). Процесс ведут в кислой среде, когда аминокислоты находятся катионной форме.
Скорость продвижения аминокислот по хроматографической колонке зависит от силы их электростатических и гидрофобных взаимодействий со смолой. Наиболее прочно связываются со смолой основные аминокислоты, имеющие наибольший положительный заряд, наименее прочно – кислые аминокислоты. Наибольшим гидрофобным связыванием со смолой обладают аминокислоты с неполярными боковыми радикалами, особенно ароматическими. Таким образом, порядок элюирования аминокислот следующий. Легче других элюируются кислые аминокислоты (Asp и Glu), следом за ними идут аминокислоты, содержащие полярные неионогенные группы (Ser, Thr, Asn, Gln), затем из колонки вымываются аминокислоты с неполярными боковыми радикалами (Phe, Trp, Ile и др.) и в последнюю очередь элюируются основные аминокислоты (His, Lys, Arg).
4. Пептиды
Петиды – это полиамиды, построенные из a -аминокислот. По числу аминокислотных остатков в молекуле пептида различают дипептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами, более 10 аминокислотных остатков – полипептидами. Природные полипептиды, включающие более 100 аминокислотных остатков, называют белками.
4.1. Строение пептидов
Формально пептиды можно рассматривать как продукты поликонденсации аминокислот.
Аминокислотные остатки в пептиде связаны амидными (пептидными) связями. Один конец цепи, на котором находится аминокислота со свободной аминогруппой, называют N-концом. Другой конец, на котором находится аминокислота со свободной карбоксильной группой, называют С-концом. Пептиды принято записывать и называть, начиная с N-конца.
Название пептида строят на основе тривиальных названий, входящих в его состав аминокислотных остатков, которые перечисляют, начиная с N-конца. При этом в названиях всех аминокислот за исключением С-концевой суффикс “ин” заменяют на суффикс “ил”. Для сокращенного обозначения пептидов используют трехбуквенные обозначения входящих в его состав аминокислот.
Пептид характеризуется аминокислотным составом и аминокислотной последовательностью.
Аминокислотный состав пептида может быть установлен путем полного гидролиза пептида (расщепления до аминокислот) с последующим качественным и количественным анализом образовавшихся аминокислот методом ионобменной хроматографии или ГЖХ-анализом сложных эфиров аминокислот. Полный гидролиз пептидов проводят в кислой среде при кипячении их с 6н. HCl.
Одному и тому же аминокислотному составу отвечает несколько пептидов. Так, из 2-х разных аминокислот может быть построено 2 дипептида, из трех разных аминокислот – 6 трипептидов, из n разных аминокислот n! пептидов одинакового состава. Например, составу Gly:Ala:Val=1:1:1 отвечают следующие 6 трипептидов.
Gly-Ala-Val Gly- Val-Ala Val-Gly-Ala Val-Ala-Gly Ala-Gly-Val Ala-Val-Glu
Таким образом, для полной характеристики пептида необходимо знать его аминокислотный состав и аминокислотную последовательность.
4.2. Определение аминокислотной последовательности
Для определения аминокислотной последовательности используют комбинацию двух методов: определение концевых аминокислот и частичный гидролиз.
Определение N-концевых аминокислот.
Метод Сегнера. Пептид обрабатывают 2,4-динитрофтробензолом (ДНФБ), а затем полностью гидролизуют. Из гидролизата выделяют и идентифицируют ДНФ-производное N-концевой аминокислоты.
Метод Эдмана состоит во взаимодействии N-концевой аминокислоты с фенилизотиоцианатом в щелочной среде. При дальнейшей обработке слабой кислотой без нагревания происходит отщепление от цепи “меченой” концевой аминокислоты в виде фенилгидантоинового (ФТГ) производного.
Преимущество этого метода состоит в том, что при отщеплении N-концевой аминокислоты пептид не разрушается и операцию по отщеплению можно повторять. Метод Эдмана используют в автоматическом приборе – секвенаторе, с помощью которого можно осуществить 40 – 50 стадий отщепления, идентифицируя полученные на каждой стадии ФТГ-производные методом газожидкостной хроматографии.
Частичный гидролиз полипептидов
При частичном гидролизе пептиды расщепляются с образованием более коротких цепей. Частичный гидролиз проводят с помощью ферментов, которые гидролизуют пептидные связи избирательно, например, только с N-конца (аминопептидазы) или только с С-конца (карбоксипептидазы). Существуют ферменты, расщепляющие пептидные связи только между определенными аминокислотами. Меняя условия гидролиза, можно разбить пептид на различные фрагменты, которые перекрываются по составляющим их аминокислотным остаткам. Анализ продуктов частичного гидролиза позволяет воссоздать структуру исходного пептида. Рассмотрим простейший пример установления структуры трипептида. Частичный гидролиз по двум разным направлениям трипептида неизвестного строения дает продукты представленные на схеме.
Единственный трипептид, структура которого не противоречит продуктам частичного гидролиза – Gly-Ala-Phe.
Установление аминокислотной последовательности пептидов, содержащих несколько десятков аминокислотных остатков, – более сложная задача, которая требует комбинации различных методов.
4.3. Синтез петидов
Синтез пептида с заданной аминокислотной последовательностью – чрезвычайно сложная задача. В простейшем случае синтеза дипептида из 2-х разных аминокислот возможно образование 4-х разных продуктов.
В настоящее время разработана стратегия синтеза пептидов, основанная на использовании методов активации и защиты функциональных групп на соответствующих этапах синтеза. Процесс синтеза дипептида включает следующие стадии:
- защита аминогруппы N-концевой аминокислоты;
- активация карбоксильной группы N-концевой аминокислоты;
- конденсация модифицированных аминокислот
- снятие защитных групп
Таким образом, последовательно присоединяя аминокислоты, шаг за шагом наращивают цепь полипептида. Такой синтез очень длителен, трудоемок и дает низкий выход конечного продукта. Основные потери связаны с необходимостью выделения и очистки продуктов на каждой стадии.
Этих недостатков лишен используемый в настоящее время твердофазный синтез пептидов. На первой стадии защищенная по аминогруппе С-концевая аминокислота закрепляется на твердом полимерном носителе (полистироле, модифицированном введением групп –Ch3Cl). После снятия защиты проводят ацилирование аминогруппы закрепленной на носителе аминокислоты другой аминокислотой, которая содержит активированную карбоксильную и защищенную аминогруппу. После снятия защиты проводят следующую стадию ацилирования. Отмывание продукта от примесей проводят прямо на носителе и лишь после окончания синтеза полипептид снимают с носителя действием бромистоводородной кислоты. Твердофазный синтез автоматизирован и проводится с помощью приборов – автоматических синтезаторов.
Методом твердофазного синтеза получено большое количество пептидов, содержащих 50 и более аминокислотных остатков, в том числе инсулин (51 аминокислотный остаток) и рибонуклеаза (124 аминокислотных остатка).
trotted.narod.ru
|
| Биоорганическая химияАминокислоты.Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно содержатся карбоксильные (-COOH) и аминные группы (-Nh3). Строение аминокислот можно выразить приведённой ниже общей формулой, (где R – углеводородный радикал, который может содержать и различные функциональные группы).
Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы (-Nh3). В качестве примера можно привести простейшие: аминоуксусную кислоту, или глицин, и аминопропионовую кислоту или аланин:
Химические свойства аминокислотАминокислоты – амфотерные соединения, т.е. в зависимости от условий они могут проявлять как основные, так и кислотные свойства. За счёт карбоксильной группы (-COOH) они образуют соли с основаниями. За счёт аминогруппы (-Nh3) образуют соли с кислотами. Ион водорода, отщепляющийся при диссоциации от карбоксила (-ОН) аминокислоты, может переходить к её аминогруппе с образованием аммониевой группировки (Nh4+).
Таким образом, аминокислоты существуют и вступают в реакции также в виде биполярных ионов (внутренних солей). Этим объясняется, что растворы аминокислот, содержащих одну карбоксильную и одну аминогруппу, имеют нейтральную реакцию. Альфа-аминокислотыИз молекул аминокислот строятся молекулы белковых веществ или белков, которые при полном гидролизе под влиянием минеральных кислот, щелочей или ферментов распадаются, образуя смеси аминокислот. Общее число встречающихся в природе аминокислот достигает 300, однако некоторые из них достаточно редки. Среди аминокислот выделяется группа из 20 наиболее важных. Они встречаются во всех белках и получили название альфа-аминокислот. Альфа-аминокислоты – кристаллические вещества, растворимые в воде. Многие из них обладают сладким вкусом. Это свойство нашло отражение в названии первого гомолога в ряду альфа-аминокислот – глицина, явившегося также первой альфа-аминокислотой, обнаруженной в природном материале. Ниже приведена таблица с перечнем альфа-аминокислот:
Незаменимые аминокислотыОсновным источником альфа-аминокислот для животного организма служат пищевые белки. Многие альфа-аминокислоты синтезируются в организме, некоторые же необходимые для синтеза белков альфа-аминокислоты в организме не синтезируются и должны поступать извне, с продуктами питания. Такие аминокислоты называют незаменимыми. Вот их список:
При некоторых, часто врождённых, заболеваниях перечень незаменимых кислот расширяется. Например, при фенилкетонурии человеческий организм не синтезирует ещё одну альфа-аминокислоту - тирозин, который в организме здоровых людей получается при гидроксилировании фенилаланина. Использование аминокислот в медицинской практикеАльфа-аминокислоты занимают ключевое положение в азотистом обмене. Многие из них используются в медицинской практике в качестве лекарственных средств, влияющих на тканевый обмен. Так, глутаминовая кислота применяется для лечения заболеваний центральной нервной системы, метионин и гистидин – лечения и предупреждения заболеваний печени, цистеин – глазных болезней. | ОглавлениеОрганическая химияКосметическая химияКоллоидная химияБиохимияБелки• Аминокислоты • Белки и пептиды • Нуклеиновые кислоты - Строение нуклеиновых кислот. Нуклеотиды и нуклеозиды. - Структура и простран- ственная организация нуклеиновых кислот Углеводы. Их роль и классификация.• Моносахариды (глюкоза и фруктоза). • Олигосахариды (сахароза). • Полисахариды (крахмал и целлюлоза). Липиды. Классификация.• Структурные компоненты липидов - Жирные кислоты и спирты, - Полиспирты, глицерин. • Простые омыляемые липиды: - Воски, - Жиры и масла. • Сложные омыляемые липиды. Классификация. - Фосфолипиды, лецитин, - Сфинголипиды, церамиды, - Гликолипиды. • Неомыляемые липиды: - Терпены, - Стероиды - стерины, холестерин, - желчные кислоты, - стероидные гормоны, - сердечные гликозиды. - Низкомолекулярные био- регуляторы липидной природы - Жирорастворимые витамины, - Простагландины. |
xn----7sbb4aandjwsmn3a8g6b.xn--p1ai



















