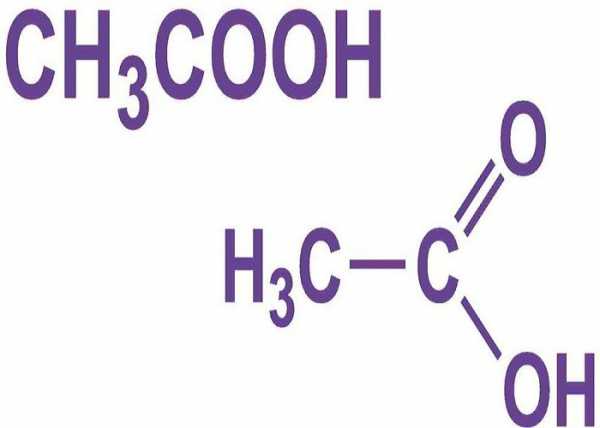
Металлическая и водородная химические связи. Диметиловый эфир число связей в молекуле
Тест ЕГЭ по химии. А3.Химическая связь.
Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая, водородная. Способы образования ковалентной связи. Характеристики ковалентной связи: длина и энергия связи. Образование ионной связи.
1. В аммиаке и хлориде бария химическая связь соответственно
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
1) F2, ССl4, КС1
2) NaBr,Na2O,KI
3) SO2.P4.CaF2
4) h3S,Br2,K2S
3. Соединение с ионной связью образуется при взаимодействии
1) СН4 и О2
2) SO3 и Н2О
3) С2Н6 и HNO3
4) Nh4 и HCI
4. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl,NaCl.Cl2
2) O2.h3O.CO2
3) h3O.Nh4.Ch5
4) NaBr.HBr.CO
5. В каком ряду записаны формулы веществ только с ковалентной полярнойсвязью?
1) С12, NO2, НС1
2) HBr,NO,Br2
3) h3S.h3O.Se
4) HI,h3O,Ph4
6. Ковалентная неполярная связь характерна для
1) С12 2) SO3 3) СО 4) SiO2
7. Веществом с ковалентной полярной связью является
1) С12 2) NaBr 3) h3S 4) MgCl2
8. Веществом с ковалентной связью является
1) СаС122) MgS 3) h3S 4) NaBr
9. Вещество с ковалентной неполярной связью имеет формулу
1) Nh42) Сu 3) h3S 4) I2
10. Веществами с неполярной ковалентной связью являются
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
12. Ковалентная полярная связь характерна для
1) KC1 2) НВг 3) Р4 4) СаСl2
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь
1)ковалентную полярную
2) ковалентную неполярную
3) ионную
4) металлическую
14. В молекуле какого вещества длина связи между атомами углерода наибольшая?
1} ацетилена 2) этана 3) этена 4) бензола
15. Тремя общими электронными парами образована ковалентная связь в молекуле
1) азота
2) сероводорода
3) метана
4) хлора
16. Водородные связи образуются между молекулами
1) диметилового эфира
2) метанола
3) этилена
4) этилацетата
17. Полярность связи наиболее выражена в молекуле
1) HI 2) НС1 3) HF 4) НВг
18. Веществами с неполярной ковалентной связью являются
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
19. Водородная связь не характерна для вещества
1) Н2О 2) СН4 3) Nh4 4) СНзОН
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
1) KI и Н2О
2) СО2 и К2О
3) h3S и Na2S
4) CS2 и РС15
21. Наименее прочная химическая связь в молекуле
1) фтора 2) хлора 3} брома 4} иода
22. В молекуле какого вещества длина химической связи наибольшая?
1) фтора 2) хлора 3) брома 4) иода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C4h20, NO2, NaCl
2} СО, CuO, Ch4Cl
3} BaS,C6H6,h3
4} C6H5NO2, F2, CC14
24. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) СаО,С3Н6, S8
2) Fe.NaNO3, CO
3) N2, CuCO3, K2S
4) C6H5N02, SО2, CHC13
25. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1} С3Н4, NO, Na2O
2) СО, СН3С1, PBr3
3) Р2Оз, NaHSO4, Сu
4) C6H5NO2, NaF, СС14
26. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C3Ha,NO2, NaF
2) КС1, Ch4Cl, C6h2206
3) P2O5, NaHSO4, Ba
4) C2H5Nh3, P4, Ch4OH
27. Полярность связи наиболее выражена в молекулах
1) сероводорода
2) хлора
3) фосфина
4) хлороводорода
28. В молекуле какого вещества химические связи наиболее прочные?
1)СF4
2)CCl4
3)CBr4
4)CI4
29. Среди веществ Nh5Cl, CsCl, NaNO3, Ph4, HNO3 - число соединений с ионной связью равно
30. Среди веществ (Nh5)2SO4, Na2SO4, CaI2, I2, CO2 - число соединений с ковалентной связью равно
Ответы: 1-2, 2-2, 3-4, 4-3, 5-4, 6-1, 7-3, 8-3, 9-4, 10-2, 11-3, 12-2, 13-3, 14-2, 15-1, 16-2, 17-3, 18-2, 19-2, 20-4, 21-4, 22-4, 23-4, 24-4, 25-2, 26-4, 27-4, 28-1, 29-3, 30-4
lib.repetitors.eu
03 Производные алканов - Стр 5
В промышленности пропан-2-олполучают каталитической гидратацией пропена в газовой фазе.
Изопропиловый спирт широко используется в качестве растворителя вместо метанола и этанола и как исходное вещество в органическом синтезе. Большие количества пропан-2-олаиспользуются для производства ацетона.
Гликоль (этиленгликоль, этан-1,2-диол)— бесцветная, умеренно вяз-
кая жидкость сладкого вкуса. С водой смешивается; безводный гликоль гигроскопичен.
Гликоль получают в промышленности в больших масштабах и используют главным образом для получения полимеров (лавсан). Большие количества гликоля используют для получения растворителей. Смеси гликоля с водой имеют низкую температуру замерзания, поэтому их применяют для охлаждения автомобильных и тракторных двигателей (антифризы).
Глицерин (пропан-1,2,3-триол) — бесцветная, очень вязкая жидкость сладкого вкуса. Безводный глицерин кристаллизуется очень трудно, образуя переохлаждѐнную жидкость. При температуре кипения (290 С) глицерин постепенно разлагается. Смешивается с водой. Безводный глицерин гигроскопичен.
Глицерин применяется для производства взрывчатых веществ (нитроглицерин, динамит) и синтетических высокомолекулярных соединений. В меньших количествах он применяется в текстильной и кожевенной промышленности и как составная часть косметических препаратов. В медицинской практике глицерин находит применение как основа для мазей и растворитель для некоторых лекарственных веществ.
3.4.ПРОСТЫЕ ЭФИРЫ
Вмолекулах простых эфиров два углеводородных радикала соединены через атом кислорода: R-O-R .Другими словами, их можно рассматривать как органические производные воды, в молекуле которой оба атома водорода замещены углеводородными радикалами. Если эти углеводородные радика-
лы неодинаковы (R R ), то такие эфиры называют смешанными.
3.4.1. НОМЕНКЛАТУРА И ИЗОМЕРИЯ
Для названия простых эфиров применяются обычно радикалофункциональная и заместительная номенклатуры ИЮПАК, но могут применяться и другие виды номенклатур (например, «а»-номенклатура— гл.
1.5.3).
studfiles.net
Металлическая и водородная химические связи. Видеоурок. Химия 11 Класс
Тема: Типы химической связи
Урок: Металлическая и водородная химические связи
Металлическая связьэто тип связи в металлах и их сплавах между атомами или ионами металлов и относительно свободными электронами (электронным газом) в кристаллической решетке.
Металлы – это химические элементы с низкой электроотрицательностью, поэтому они легко отдают свои валентные электроны. Если рядом с элементом металлом находится неметалл, то электроны от атома металла переходят к неметаллу. Такой тип связи называется ионный (рис. 1).
Рис. 1. Образование ионной связи
В случае простых веществ металлов или их сплавов, ситуация меняется.
При образовании молекул электронные орбитали металлов не остаются неизменными. Они взаимодействуют между собой, образуя новую молекулярную орбиталь. В зависимости от состава и строения соединения, молекулярные орбитали могут быть как близки к совокупности атомных орбиталей, так и значительно от них отличаться. При взаимодействии электронных орбиталей атомов металла образуются молекулярные орбитали. Такие, что валентные электроны атома металла, могут свободно перемещаться по этим молекулярным орбиталям. Не происходит полное разделение, заряда, т. е. металл – это не совокупность катионов и плавающих вокруг электронов. Но это и не совокупность атомов, которые иногда переходят в катионную форму и передают свой электрон другому катиону. Реальная ситуация – это совокупность двух этих крайних вариантов.
Рис. 2
Сущность образования металлической связи состоит в следующем: атомы металлов отдают наружные электроны, и некоторые из них превращаются в положительно заряженные ионы. Оторвавшиеся от атомов электроны относительно свободно перемещаются между возникшими положительными ионами металлов. Между этими частицами возникает металлическая связь, т. е. электроны как бы цементируют положительные ионы в металлической решетке (рис. 2).
Наличие металлической связи обуславливает физические свойства металлов:
· Высокая пластичность
· Тепло и электропроводность
· Металлический блеск
Пластичность – это способность материала легко деформироваться под действием механической нагрузки. Металлическая связь реализуется между всеми атомами металла одновременно, поэтому при механическом воздействии на металл не разрываются конкретные связи, а только меняется положение атома. Атомы металла, не связанные жесткими связями между собой, могут как бы скользить по слою электронного газа, как это происходит при скольжении одного стекла по другому с прослойкой воды между ними. Благодаря этому металлы можно легко деформировать или раскатывать в тонкую фольгу. Наиболее пластичные металлы – чистое золото, серебро и медь. Все эти металлы встречаются в природе в самородном виде в той или иной степени чистоты. Рис. 3.
Рис. 3. Металлы, встречающиеся в природе в самородном виде
Из них, особенно из золота, изготавливаются различные украшения. Благодаря своей удивительной пластичности, золото применяется при отделке дворцов. Из него можно раскатать фольгу толщиной всего 3.10-3 мм. Она называется сусальное золото, наносится на гипсовые, лепные украшения или другие предметы.
Тепло- и электропроводность. Лучше всего электрический ток проводят медь, серебро, золото и алюминий. Но так как золото и серебро – дорогие металлы, то для изготовления кабелей используются более дешевые медь и алюминий. Самыми плохими электрическими проводниками являются марганец, свинец, ртуть и вольфрам. У вольфрама электрическое сопротивление столь велико, что при прохождении электрического тока он начинает светиться. Это свойство используется при изготовлении ламп накаливания.
Температура тела – это мера энергии составляющих его атомов или молекул. Электронный газ металла может довольно быстро передавать избыточную энергию с одного иона или атома к другому. Температура металла быстро выравнивается по всему объёму, даже если нагревание идет с одной стороны. Это наблюдается, например, если опустить металлическую ложку в чай.
Металлический блеск. Блеск – это способность тела отражать световые лучи. Высокой световой отражательной способностью обладают серебро, алюминий и палладий. Поэтому именно эти металлы наносят тонким слоем на поверхность стекла при изготовлении фар, прожекторов и зеркал.
Водородная связь
Рассмотрим температуры кипения и плавления водородных соединений халькогенов: кислорода, серы, селена и теллура. Рис. 4.
Рис. 4
Если мысленно экстраполировать прямые температур кипения и плавления водородных соединений серы, селена и теллура, то мы увидим, что температура плавления воды должна примерно составлять -1000С, а кипения – примерно -800С. Происходит это потому, что между молекулами воды существует взаимодействие – водородная связь, которая объединяет молекулы воды в ассоциацию. Для разрушения этих ассоциатов требуется дополнительная энергия.
Водородная связь образуется между сильно поляризованным, обладающим значительной долей положительного заряда атомом водорода и другим атомом с очень высокой электроотрицательностью: фтором, кислородом или азотом. Примеры веществ, способных образовывать водородную связь, приведены на рис. 5.
Рис. 5
Рассмотрим образование водородных связей между молекулами воды. Водородная связь изображается тремя точками. Возникновение водородной связи обусловлено уникальной особенностью атома водорода. Т. к. атом водорода содержит только один электрон, то при оттягивании общей электронной пары другим атомом, оголяется ядро атома водорода, положительный заряд которого действует на электроотрицательные элементы в молекулах веществ.
Сравним свойства этилового спирта и диметилового эфира. Исходя из строения этих веществ, следует, что этиловый спирт может образовывать межмолекулярные водородные связи. Это обусловлено наличием гидроксогруппы. Диметиловый эфир межмолекулярных водородных связей образовывать не может.
Сопоставим их свойства в таблице 1.
|
Вещество |
Т кип. |
Т пл. |
Растворимость в воде |
|
Этиловый спирт |
+78,150С |
-114,150С |
В любых пропорциях |
|
Диметиловый эфир |
-29,90С |
-138,50С |
Ограничена |
Табл. 1
Т кип., Т пл, растворимость в воде выше у этилового спирта. Это общая закономерность для веществ, между молекулами которых образуется водородная связь. Эти вещества характеризуются более высокой Т кип.,Т пл, растворимостью в воде и более низкой летучестью.
Физические свойства соединений зависят также и от молекулярной массы вещества. Поэтому проводить сравнение физических свойств веществ с водородными связями, правомерно только для веществ с близкими молекулярными массами.
Энергия одной водородной связи примерно в 10 раз меньше энергии ковалентной связи. Если в органических молекулах сложного состава имеется несколько функциональных групп, способных к образованию водородной связи, то в них могут образовываться внутримолекулярные водородные связи (белки, ДНК, аминокислоты, ортонитрофенол и др.). За счет водородной связи образуется вторичная структура белков, двойная спираль ДНК.
Ван-дер-Ваальсовая связь.
Вспомним благородные газы. Соединения гелия до сих пор не получены. Он не способен образовывать обычные химические связи.
При сильно отрицательных температурах можно получить жидкий и даже твердый гелий. В жидком состоянии атомы гелия удерживаются при помощи сил электростатического притяжения. Существует три варианта этих сил:
· ориентационные силы. Это взаимодействие между двумя диполями (НСl)
· индукционное притяжение. Это притяжение диполя и неполярной молекулы.
· дисперсионное притяжение. Это взаимодействие между двумя неполярными молекулами (He). Возникает за счет неравномерности движения электронов вокруг ядра.
Подведение итога урока
На уроке рассмотрены три типа химической связи: металлическая, водородная и Ван-дер-Ваальсовая. Объяснялась зависимость физических и химических свойств от разных типов химических связей в веществе.
Список литературы
1. Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Попель П.П. Химия: 8 кл.: учебник для общеобразовательных учебных заведений / П.П. Попель, Л.С.Кривля. – К.: ИЦ «Академия», 2008. – 240 с.: ил.
3. Габриелян О.С. Химия. 11 класс. Базовый уровень. 2-е изд., стер. – М.: Дрофа, 2007. – 220 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Internerurok.ru (Источник).
2. Hemi.nsu.ru (Источник).
3. Chemport.ru (Источник).
4. Химик (Источник).
Домашнее задание
1. №№2, 4, 6 (с. 41) Рудзитис Г.Е. Химия. Основы общей химии. 11 класс: учебник для общеобразовательных учреждений: базовый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – 14-е изд. – М.: Просвещение, 2012.
2. Почему для изготовления волосков ламп накаливания используют вольфрам?
3. Чем объясняется отсутствие водородной связи в молекулах альдегидов?
interneturok.ru
Химическая связь
Дидактический материал
Тренировочные тесты ЕГЭ по химии
Ковалентная химическая связь, её разновидности и механизмы образования. Характеристика ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
1. В аммиаке и хлориде бария химическая связь соответственно
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
1) F2, ССl4, КС1
2) NaBr,Na2O,KI
3) SO2.P4.CaF2
4) h3S,Br2,K2S
3. Соединение с ионной связью образуется при взаимодействии
1) СН4 и О2
2) SO3 и Н2О
3) С2Н6 и HNO3
4) Nh4 и HCI
4. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl,NaCl.Cl2
2) O2.h3O.CO2
3) h3O.Nh4.Ch5
4) NaBr.HBr.CO
5. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
1) С12, NO2, НС1
2) HBr,NO,Br2
3) h3S.h3O.Se
4) HI,h3O,Ph4
6. Ковалентная неполярная связь характерна для
1) С12 2) SO3 3) СО 4) SiO2
7. Веществом с ковалентной полярной связью является
1) С12 2) NaBr 3) h3S 4) MgCl2
8. Веществом с ковалентной связью является
1) СаС12 2) MgS 3) h3S 4) NaBr
9. Вещество с ковалентной неполярной связью имеет формулу
1) Nh4 2) Сu 3) h3S 4) I2
10. Веществами с неполярной ковалентной связью являются
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
12. Ковалентная полярная связь характерна для
1) KC1 2) НВг 3) Р4 4) СаСl2
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь
1)ковалентную полярную
2) ковалентную неполярную
3) ионную
4) металлическую
14. В молекуле какого вещества длина связи между атомами углерода наибольшая?
1} ацетилена 2) этана 3) этена 4) бензола
15. Тремя общими электронными парами образована ковалентная связь в молекуле
1) азота
2) сероводорода
3) метана
4) хлора
16. Водородные связи образуются между молекулами
1) диметилового эфира
2) метанола
3) этилена
4) этилацетата
17. Полярность связи наиболее выражена в молекуле
1) HI 2) НС1 3) HF 4) НВг
18. Веществами с неполярной ковалентной связью являются
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
19. Водородная связь не характерна для вещества
1) Н2О 2) СН4 3) Nh4 4) СНзОН
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых
1) KI и Н2О
2) СО2 и К2О
3) h3S и Na2S
4) CS2 и РС15
21. Наименее прочная химическая связь в молекуле
1) фтора 2) хлора 3} брома 4} иода
22. В молекуле какого вещества длина химической связи наибольшая?
1) фтора 2) хлора 3) брома 4) иода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C4h20, NO2, NaCl
2) СО, CuO, Ch4Cl
3) BaS,C6H6,h3
4) C6H5NO2, F2, CC14
24. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) СаО,С3Н6, S8
2) Fe.NaNO3, CO
3) N2, CuCO3, K2S
4) C6H5NO2, SО2, CHC13
25. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) С3Н4, NO, Na2O
2) СО, СН3С1, PBr3
3) Р2Оз, NaHSO4, Сu
4) C6H5NO2, NaF, СС14
26. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C3Ha,NO2, NaF
2) КС1, Ch4Cl, C6h22О6
3) P2O5, NaHSO4, Ba
4) C2H5Nh3, P4, Ch4OH
27. Полярность связи наиболее выражена в молекулах
1) сероводорода
2) хлора
3) фосфина
4) хлороводорода
28. В молекуле какого вещества химические связи наиболее прочные?
1)СF4
2)CCl4
3)CBr4
4)CI4
29. Среди веществ Nh5Cl, CsCl, NaNO3, Ph4, HNO3 - число соединений с ионной связью равно
30. Среди веществ (Nh5)2SO4, Na2SO4, CaI2, I2, CO2 - число соединений с ковалентной связью равно
Ответы: 1-2, 2-2, 3-4, 4-3, 5-4, 6-1, 7-3, 8-3, 9-4, 10-2, 11-3, 12-2, 13-3, 14-2, 15-1, 16-2, 17-3, 18-2, 19-2, 20-4, 21-4, 22-4, 23-4, 24-4, 25-2, 26-4, 27-4, 28-1, 29-3, 30-4
maratakm.narod.ru
Тесты к 1 части ЕГЭ по химии
Глюкоза (моносахарид, альдегидоспирт, альдоза, гексоза)
Химические свойства глюкозы
I. Реакции по альдегидной группе
1. Окисление- «реакция серебряного зеркала», образование глюконовой кислоты
глюкоза + Ag2O (аммиачный раствор Ag(Nh4)2 OH )
2. Окисление гидроксидом меди (II) при нагревании, образование глюконовой кислоты
3. Окисление азотной кислотой - при этом окисляется альдегидная группа и шестой углеродный атом до карбоксила, образуется двухосновная кислота (сахарная).
4. Окисление бромной водой (Br2 +h3O), образование глюконовой кислоты
5. Восстановление альдегидной группы водородом - образуется шестиатомный спирт сорбит
II.Реакции по гидроксильным группам (свойства многоатомных спиртов)
1. Образование простых эфиров - реакция с иодистым метилом, при этом атом водорода во всех ОН-группах замещается на метильный радикал.
2. Образование глюкозидов с метанолом, при этом образуется простой эфир только за счет гликозидного гидроксила циклической формы.
3. Образование сложных эфиров – реакция этерификации, с уксусной кислотой
4. Образование алкоголятов – реакция с гидроксидом меди (II) без нагревания. (сахараты).
III. Специфические свойства глюкозы – брожение глюкозы.(Под действием микроорганизмов или ферментов молекулы глюкозы способны расщепляться с образованием молекул с меньшей молекулярной массой)
1. Спиртовое брожение
С6Н12О6 2С2Н5ОН + 2СО2
2. Молочнокислое брожение
С6Н12О6 молочная кислота (2-гидроксипропановая кислота)
Маслянокислое брожение
Сахароза (дисахарид) – многоатомный спирт,
(не альдегид!)
Молекула сахарозы состоит из соединенных друг с другом остатков глюкозы и фруктозы.
1) Для сахароза не характерна реакция « серебряного зеркала»
2) Для сахароза не характерна реакция с гидроксидом меди (II) при нагревании
3) Для сахароза характерна реакция
с гидроксидом меди (II) без нагревания
4) Основное свойство для сахарозы – гидролиз в присутствии сильной кислоты (Н+)
С12Н22О11 + Н2О = глюкоза + фруктоза
5) с О2 -горение
Крахмал (состоит из двух типов полимерных цепей: амилозы - растворимой фракции (80%) и амилопектина- нерастворимого в воде)
Свойства крахмала (полисахарид)
1) Гидролиз
2) С раствором йода (йод вызывает посинение крахмала -качественная реакция)
Свойства целлюлозы(полисахарид)
1) Гидролиз
2) С неорганическими кислотами
3) С органическими кислотами
4) с О2 горение
5) термическое разложение
С6Н12О6 масляная кислота (бутановая) + углекислый газ + водород
4. В живом организме происходит окисление глюкозы кислородом воздуха, в результате образуется углекислый газ и выделяется большое количество энергии, необходимой для функционирования клетки. Этот процесс обратный фотосинтезу.
multiurok.ru
А3- Химическая связь
А3 Химическая связь
1. В аммиаке и хлориде бария химическая связь соответственно:
1) ионная и ковалентная полярная 2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая 4) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
1) F2, ССl4, КС1 2) NaBr, Na2O, KI 3) SO2, P4, CaF2 4) h3S, Br2, K2S
3. Соединение с ионной связью образуется при взаимодействии:
1) СН4 и О2; 2) SO3 и Н2О; 3) С2Н6 и HNO3; 4) Nh4 и HCI.
4. В каком ряду все вещества имеют ковалентную полярную связь?
1) HCl, NaCl, Cl2; 2) O2, h3O, CO2; 3) h3O, Nh4, Ch5 ; 4) NaBr, HBr, CO.
5. В каком ряду записаны формулы веществ только с ковалентной полярной связью?
1) С12, NO2, НС1 2) HBr, NO, Br2 3) h3S, h3O, Se 4) HI, h3O, Ph4
6. Ковалентная неполярная связь характерна для:
1) С12 2) SO3 3) СО 4) SiO2
7. Веществом с ковалентной полярной связью является:
1) С12 2) NaBr 3) h3S 4) MgCl2
8. Веществом с ковалентной связью является:
1) СаС12 2) MgS 3) h3S 4) NaBr
9. Вещество с ковалентной неполярной связью имеет формулу:
1) Nh4 2) Сu 3) h3S 4) I2
10.Веществами с неполярной ковалентной связью являются:
1) вода и алмаз 2) водород и хлор 3) медь и азот 4) бром и метан
11. Между атомами с одинаковой относительной электроотрицательностью
образуется химическая связь:
1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
12. Ковалентная полярная связь характерна для:
1) KC1 2) НВг 3) Р4 4) СаСl2
13. Химический элемент, в атоме которого электроны по слоям распределены так:
2, 8, 8, 2 образует с водородом химическую связь:
1) ковалентную полярную 2) ковалентную неполярную
3) ионную 4) металлическую
14. В молекуле какого вещества длина связи между атомами углерода наибольшая?
1) ацетилена 2) этана 3) этена 4) бензола
15. Тремя общими электронными парами образована ковалентная связь в молекуле:
1) азота 2) сероводорода 3) метана 4) хлора
16. Водородные связи образуются между молекулами:
1) диметилового эфира 2) метанола 3) этилена 4) этилацетата
17. Полярность связи наиболее выражена в молекуле:
1) HI 2) НС1 3) HF 4) НВг
18. Веществами с неполярной ковалентной связью являются:
1) вода и алмаз 2) водород и хлор 3) медь и азот 4) бром и метан
19. Водородная связь не характерна для вещества:
1) Н2О 2) СН4 3) Nh4 4) СНзОН
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых:
1) KI и Н2О 2) СО2 и К2О 3) h3S и Na2S 4) CS2 и РС15
21. Наименее прочная химическая связь в молекуле:
1) фтора 2) хлора 3) брома 4) иода
22. В молекуле какого вещества длина химической связи наибольшая?
1) фтора 2) хлора 3) брома 4) иода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C4h20, NO2, NaCl 2) СО, CuO, Ch4Cl 3) BaS, C6H6, h3 4) C6H5NO2, F2, CC14
24. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) СаО, С3Н6, S8 2) Fe, NaNO3, CO 3) N2, CuCO3, K2S 4) C6H5N02, SО2, CHC13
25. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) С3Н4, NO, Na2O 2) СО, СН3С1, PBr3 3) Р2Оз, NaHSO4, Сu 4) C6H5NO2, NaF, СС14
26. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C3Ha, NO2, NaF 2) КС1, Ch4Cl, C6h2206 3) P2O5, NaHSO4, Ba 4) C2H5Nh3, P4, Ch4OH
27. Полярность связи наиболее выражена в молекулах:
1) сероводорода 2) хлора 3) фосфина 4) хлороводорода
28. В молекуле какого вещества химические связи наиболее прочные?
1) СF4 2) CCl4 3) CBr4 4) CI4
29. Среди веществ Nh5Cl, CsCl, NaNO3, Ph4, HNO3 - число соединений с ионной связью равно:
1) 1; 2) 2; 3) 3; 4) 4.
30. Среди веществ (Nh5)2SO4, Na2SO4, CaI2, I2, CO2 - число соединений с ковалентной связью равно:
1) 1; 2) 2; 3) 3; 4) 4.
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
26 |
27 |
28 |
29 |
30 |
|
2 |
2 |
4 |
3 |
4 |
1 |
3 |
3 |
4 |
2 |
3 |
2 |
3 |
2 |
1 |
2 |
3 |
2 |
2 |
4 |
4 |
4 |
4 |
4 |
2 |
4 |
4 |
1 |
3 |
4 |
jakovleva.teacher38.ru
Химические связи - ЕГЭ - ГОТОВИМСЯ К ЭКЗАМЕНАМ - Каталог файлов
ХИМИЧЕСКИЕ СВЯЗИ
1. В аммиаке и хлориде бария химическая связь соответственно:
1) ионная и ковалентная полярная
2) ковалентная полярная и ионная
3) ковалентная неполярная и металлическая
4) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
1) F2, ССl4, КС1
2) NaBr,Na2O,KI
3) SO2.P4.CaF2
4) h3S,Br2,K2S
3. Соединение с ионной связью образуется при взаимодействии:
1) СН4 и О2
2) SO3 и Н2О
3) С2Н6 и HNO3
4) Nh4 и HCI
4. Все вещества имеют ковалентную полярную связь в ряду:
1) HCl,NaCl.Cl2
2) O2.h3O.CO2
3) h3O.Nh4.Ch5
4) NaBr.HBr.CO
5. Вещества только с ковалентной полярной связью представлены в ряду:
1) С12, NO2, НС1
2) HBr,NO,Br2
3) h3S.h3O, Se
4) HI,h3O,Ph4
6. Ковалентная неполярная связь характерна для:
1) С12 2) SO3 3) СО 4) SiO2
7. Веществом с ковалентной полярной связью является:
1) С12 2) NaBr 3) h3S 4) MgCl2
8. Веществом с ковалентной связью является:
1) СаС12 2) MgS 3) h3S 4) NaBr
9. Вещество с ковалентной неполярной связью имеет формулу:
1) Nh4 2) Сu 3) h3S 4) I2
10. Веществами с неполярной ковалентной связью являются:
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
11. Между атомами с одинаковой относительной электроотрицательностью образуется химическая связь:
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
12. Ковалентная полярная связь характерна для:
1) KСl 2) НВr 3) Р4 4) СаСl2
13. Химический элемент, в атоме которого электроны по слоям распределены так: 2, 8, 8, 2 образует с водородом химическую связь:
1)ковалентную полярную
2) ковалентную неполярную
3) ионную
4) металлическую
14. Длина связи между атомами углерода наибольшая у:
1) ацетилена 2) этана 3) этена 4) бензола
15. Тремя общими электронными парами образована ковалентная связь в молекуле:
1) азота
2) сероводорода
3) метана
4) хлора
16. Водородные связи образуются между молекулами:
1) диметилового эфира
2) метанола
3) этилена
4) этилацетата
17. Полярность связи наиболее выражена в молекуле:
1) HI 2) НСl 3) HF 4) НВг
18. Веществами с неполярной ковалентной связью являются:
1) вода и алмаз
2) водород и хлор
3) медь и азот
4) бром и метан
19. Водородная связь не характерна для вещества:
1) Н2О 2) СН4 3) Nh4 4) СНзОН
20. Ковалентная полярная связь характерна для каждого из двух веществ, формулы которых:
1) KI и Н2О
2) СО2 и К2О
3) h3S и Na2S
4) CS2 и РС15
21. Наименее прочная химическая связь в молекуле:
1) фтора 2) хлора 3) брома 4) иода
22. Длина химической связи наибольшая в молекуле:
1) фтора 2) хлора 3) брома 4) иода
23. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C4h20, NO2, NaCl
2) СО, CuO, Ch4Cl
3) BaS, C6H6, h3
4) C6H5NO2, F2, CC14
24. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) СаО,С3Н6, S8
2) Fe.NaNO3, CO
3) N2, CuCO3, K2S
4) C6H5N02, SО2, CHC13
25. Ковалентную связь имеет каждое из веществ, указанных в ряду:
1) С3Н4, NO, Na2O
2) СО, СН3С1, PBr3
3) Р2Оз, NaHSO4, Сu
4) C6H5NO2, NaF, СС14
26. Ковалентные связи имеет каждое из веществ, указанных в ряду:
1) C3H6,NO2, NaF
2) КС1, Ch4Cl, C6h22О6
3) P2O5, NaHSO4, Ba
4) C2H5Nh3, P4, Ch4OH
27. Полярность связи наиболее выражена в молекулах:
1) сероводорода
2) хлора
3) фосфина
4) хлороводорода
28. Химические связи наиболее прочные в молекуле:
1)СF4
2)CCl4
3)CBr4
4)CI4
29. Среди веществ Nh5Cl, CsCl, NaNO3, Ph4, HNO3 - число соединений с ионной связью равно:
1) 1 2) 2 3) 3 4) 4
30. Среди веществ (Nh5)2SO4, Na2SO4, CaI2, I2, CO2 - число соединений только с ковалентной связью равно:
- 1 2) 2 3) 3 4) 4
31. В сероуглероде СS2 химическая связь:
1) ионная
2) металлическая
3) ковалентная полярная
4) ковалентная неполярная
32. Вещества только с ионной связью приведены в ряду:
1) F2, CCl4, KCl
2) КBr, СаO, KI
3) SO2, PCl5, CaF2
4) h3S, Br2, K2S
33. Ионный характер связи наиболее выражен в соединении:
1) CCl4 2) SiO2 3) CaBr2 4) Nh4
34. Соединениями с ковалентной полярной и ковалентной неполярной связью соответственно являются:
1) вода и сероводород
2) бромид калия и азот
3) аммиак и водород
4) кислород и метан
35. Ковалентная связь между атомами образуется по донорно-акцепторному механизму в соединении:
1) KCl 2) CCl4 3) Nh5Cl 4) HCl
36. Путем соединения одного и того же химического элемента образуется связь:
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) водородная
37. Все вещества имеют ковалентную полярную связь в ряду:
1) HCl, NaCl, Cl2
2) O2, h3O, CO2
3) h3O, Nh4, Ch5
4) NaBr, HBr, CO
38. Водородная связь образуется между молекулами:
1) C2H6 2) C2H5OH 3) Ch4OCh4 4) Ch4COCh4
39. Водородная связь реализуется:
1) в молекуле водорода
2) в молекуле воды
3) между молекулами водорода
4) между молекулами воды
40. Соединения с ионной связью расположены в ряду:
1) F2, KCl, Nh4 3) CaF2, CaSO4, h3O
2) LiBr, CaO, BaF2 4) NaNO3, HF, NF3
41. Веществом с ковалентной неполярной связью является:
1) аммиак 2) сероводород 3) оксид серы (IV) 4) белый фосфор
42. Одна из связей образована по донорно-акцепторному механизму в:
1) хлориде натрия 3) бромиде алюминия
2) бромиде аммония 4) хлориде железа (II)
43. Одна из связей образована по донорно-акцепторному механизму в:
1) молекуле водорода 3) ионе аммония
2) молекуле пероксида водорода 4) молекуле аммиака
44. Веществом с ковалентной полярной связью является:
1) водород 2) бром 3) кислород 4) вода
45. Водородная связь НЕ образуется между молекулами:
1) пропанола 2) ацетона 3) аммиака 4) воды
46. Только ковалентные неполярные связи присутствуют в молекулах:
1) водорода и воды 3) кислорода и аммиака
2) хлора и хлороводорода 4) водорода и кислорода
Ответы: 1-2, 2-2, 3-4, 4-3, 5-4, 6-1, 7-3, 8-3, 9-4, 10-2, 11-3, 12-2, 13-3, 14-2, 15-1, 16-2, 17-3, 18-2, 19-2, 20-4, 21-4, 22-4, 23-4, 24-4, 25-2, 26-4, 27-4, 28-1, 29-3, 30-4, 31-3, 32-2, 33-3, 34-3, 35-3, 36-3, 37-3, 38-2, 39-4, 40-2, 41-4, 42-2, 43-3, 44-4, 45-2, 46-4
idn.ucoz.com