Физические свойства уксусной кислоты, формула. Метиловый эфир уксусной кислоты физические свойства
Метанол
Метанол (другие названия: метиловый спирт, карбинол, древесный спирт) формула: CH 3 OH - простейший одноатомный спирт, бесцветная жидкость со слабым спиртовым запахом.
1. История получения
Впервые метанол был обнаружен еще в середине XVII века Робертом Бойлем при изучении продуктов перегонки дерева, однако в чистом виде метиловый спирт, или древесный (поскольку первым из известных методов его получения был метод сухой перегонки древесины), полученный этим способом, был выделен только через 200 лет: тогда впервые удалось очистить его от примесей сопутствующих веществ, прежде всего уксусной кислоты и ацетона. В 1857 году Марселен Бертло получил метанол омылением хлористого метила. Процесс сухой перегонки древесины долгое время оставался, пожалуй, единственным способом производства метанола. Сейчас он полностью вытеснен каталитическим синтезом из оксида углерода и водорода. Получение метанола из синтез-газа впервые было осуществлено в Германии в 1923 году фирмой BASF. Процесс проводился под давлением 100-300 атм на оксидных цинк-хромовых катализаторах (ZnO-Cr 2 O 3) в интервале температур 320-400 ? С, производительность первой промышленной установки доходила до 20 т / сут. Интересно, что в 1927 году в США был реализован промышленный синтез метанола, основанный не только на монооксида, но и на диоксид углерода.
Современный метод получения - каталитический синтез из оксида углерода (II) и водорода (температура 250 ? С, давление 7МПа, катализатор смесь оксида цинка и меди (II)):
2. Физические свойства
Метиловый спирт - подвижная жидкость (вязкость 0,5513 мПа ? с при 25 ? C) со слабым запахом похожим на запах обычного спирта. Плотность его 0,792 г / см 3. Температура кипения 64,5 ? С, замерзания -98 ? Температура самовоспламенения 464 ? C.
С водой смешивается в любых соотношениях. Хороший растворитель для многих органических веществ. Горит синеватым пламенем. Метиловый спирт ядовитое вещество, действующее на нервную и сосудистую системы человека. При попадании в организм человека 10 мл метанола может привести к тяжелому отравлению, до слепоты; попадания 25-30 мл метанола приводит к смертельному случаю.
3. Строение
Молекулярная формула его CH 4 O или CH 3-OH, а структурная:
4. Химические свойства
Метиловый спирт, как и другие спирты, при взаимодействии с щелочными металлами образует алкоголяты, например метилат калия CH 3-OK:
- 2CH 3-OH + 2К = 2CH 3-OK + H 2 ↑
При взаимодействии с водой алкоголяты, метилового спирта, как алкоголяты этилового спирта, легко гидролизуются, образуя спирт и едкая щелочь. Например:
- CH 3-OK + H 2 O = CH 3-OH + KOH
При взаимодействии с кислотами образует сложные эфиры. Например, с нитратной кислотой образует нитратнометиловий эфир, или метилнитрат:
5. Получение
Метиловый спирт теперь добывают синтетическим способом с монооксида углерода и водорода при температуре 300-400 ? С и давлении 300-500 атм в присутствии катализатора - смеси оксидов хрома, цинка и др.. Сырьем для синтеза метанола служит водяной газ (CO + H 2), обогащенный водородом:
Ранее метиловый спирт добывали исключительно из продуктов сухой перегонки древесины. Теперь этот способ имеет второстепенное значение.
6. Применение
Метиловый спирт применяется очень широко. Наибольшее его количество идет на производство формальдегида, который используется для изготовления карбамидных и фенолформальдегидных смол. Значительные количества CH 3 OH используют в лакокрасочной промышленности для изготовления растворителей при производстве лаков. Кроме того, его применяют как добавку к жидкому топливу для двигателей внутреннего сгорания.
В Украине метанол и сегодня используется для "денатурации" этанола. Добавление 5% примеси этого ядовитого спирта делает опасным употребление "спирта-денатурата". Метанол широко применяется в лабораторной практике как растворитель для проведения реакций с полярными органическими веществами, как растворитель для хроматоргафичного разделения и как реагент для получения метиловых эфиров кислот. Метанол широко используется как топливо для высокофорсированных двигателей внутреннего сгорания, которые принимают участие в соревнованиях на скорость и стартовый разгон (драг рейсинг), а также для авиамодельных двигателей часто в смеси с нитрометан (5-30%). Хотя метанол имеет в 1,9 раза меньшую теплотворность, чем бензин, зато в том же количестве воздуха можно сжечь в 2,3 раза большее количество метанола, чем бензина. Это дает 20% выигрыш в энергии заряда, так и в мощности двигателя. Учитывая высокое октановое число метанола можно увеличить степень сжатия в цилиндрах двигателя до 16-20, что добавит еще мощности двигателя и сделает его более экономичным.
Источники
- Деркач Ф. А. "Химия" Л. 1968.
- "20 открытых уроков по химии": Открытый урок: [Подборка статей] / / Все для учителя. - 2000. - 17-18. - С.3-30.
- Голобош Г. Интересные сведения о некоторых органические вещества: Материалы к уроку / / Химия. Биология. - 2004. - № 55. - С.6-8.
- Глоссарий терминов по химии / / Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им .. Л. М. Литвиненко НАН Украины, Донецкий национальный университет - М.: "Вебер", 2008. - 758 с. ISBN 978-966-335-206-0
См.. также
nado.znate.ru
Физические свойства уксусной кислоты, формула
Обычная бутылка пищевого уксуса, которую можно найти на кухне у любой домохозяйки, имеет в составе множество других кислот и витаминов. Добавление пары капель продукта в приготовленную пищу, салаты вызывает естественное усиление вкуса. Но мало кто из нас всерьез задумывался о свойствах и реальных масштабах применения основного компонента – уксусной кислоты.
Что это за вещество?
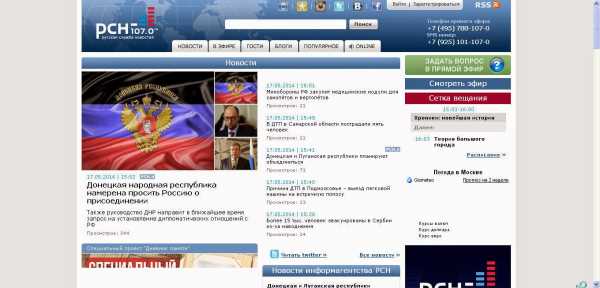
Формула уксусной кислоты СН3СООН, что относит ее к ряду жирных карбоновых кислот. Присутствие одной карбоксильной группы (СООН) относит ее к одноосновным кислотам. Вещество встречается на земном шаре в органическом виде и получается синтетическим путем в лабораториях. Кислота является самым простым, но не менее важным представителем своего ряда. Легко растворяется в воде, гигроскопична.
Физические свойства уксусной кислоты и плотность меняются в зависимости от температурного режима. При комнатной температуре в 20оС кислота находится в жидком состоянии, обладает плотностью 1,05 г/см3. Имеет специфический запах и кисловата на вкус. Раствор вещества без примесей твердеет и переходит в кристаллы на температуре ниже 17оС. Процесс кипения уксусной кислоты начинается при температуре свыше 117оС. Метиловая группа (СН3) формулы уксусной кислоты получается при взаимодействии спиртов с кислородом: брожение спиртовых веществ и углеводов, скисание вин.
Немного истории
Открытие уксуса было одним из первых в ряду кислот и совершалось поэтапно. Вначале уксусную кислоту стали добывать путем перегонки арабские ученые 8-го века. Однако еще в древнем Риме это вещество, полученное из скисшего вина, использовалось в качестве универсального соуса. Само название с древнегреческого переводится как "кислый". В 17 веке ученым Европы удалось добыть чистую субстанцию вещества. На тот момент они вывели формулу и обнаружили необычную способность – уксусная кислота в парообразном состоянии воспламенялась голубым огнем.
Вплоть до 19-го века ученые находили присутствие уксусной кислоты только в органическом виде - как часть соединений солей и эфиров. В составе растений и их плодов: яблок, винограда. В организме людей и животных: потовые выделения, желчь. В начале 20-го века русские ученые случайным образом добыли уксусный альдегид из реакции ацетилена с окисью ртути. На сегодня потребление уксусной кислоты на столько велико, что ее основная добыча происходит только синтетическим способом в огромных масштабах.
Способы добычи
Будет ли уксусная кислота чистого вида или с наличием примесей в растворе зависит от метода добычи. Пищевая уксусная кислота получается биохимическим методом в процессе брожения этанола. В промышленности выделяют несколько способов добычи кислоты. Как правило, реакции сопровождаются высокой температурой и наличием катализаторов:
- Метанол в реакции с углеродом (карбонилирование).
- Окислением фракции нефти кислородом.
- Пиролизом древесины.
- Окислением ацетальдегида кислородом.

Промышленный способ эффективнее и экономичнее биохимического. Благодаря промышленному способу, объем производства уксусной кислоты в 20-м и 21-м столетии вырос в сотни раз, по сравнению с 19-м веком. На сегодня синтез уксусной кислоты карбонилированием метанола дает боле 50% от всего производимого объема.
Физические свойства уксусной кислоты и влияние ее на индикатор
В жидком состоянии уксусная кислота бесцветна. Уровень кислотности pH 2,4 легко проверяется лакмусовой бумажкой. Уксусная кислота при попадании на индикатор окрашивает его в красный цвет. Физические свойства уксусной кислоты меняются визуально. Когда температура опускается ниже 16оС, вещество принимает твердую форму и напоминает мелкие кристаллы льда. Она легко растворяется в воде и взаимодействует с широким спектром растворителей, кроме сероводорода. Уксусная кислота снижает общий объем жидкости при разбавлении ее водой. Самостоятельно опишите физические свойства уксусной кислоты, ее цвет и консистенцию, которые вы наблюдаете на следующем изображении.

Вещество воспламеняется при температуре от 455оС с выделением теплоты в 876 кДж/моль. Молярная масса составляет 60,05 г/моль. Физические свойства уксусной кислоты как электролита в реакциях проявляются слабо. Диэлектрическая проницаемость равна 6,15 при комнатной температуре. Давление, как и плотность, – переменная величина физического свойства уксусной кислоты. При давлении 40 мм. рт. ст. и температуре 42оС начнется процесс кипения. Но уже при давлении в 100 мм. рт. ст. кипение произойдет только при 62оС.
Химические свойства
Вступая в реакцию с металлами и оксидами, вещество проявляет свои кислотные свойства. Прекрасно растворяя в себе более сложные соединения, кислота образует соли, которые называются ацетаты: магния, свинца, калия и др. Значение pK кислоты составляет 4,75.
При взаимодействии с газами уксус вступает в реакцию замещения с последующим вытеснением и образованием более сложных кислот: хлоруксусной, йодоуксусной. Растворяясь в воде, кислота диссоциирует с выделением ацетат-ионов и протонов водорода. Степень диссоциации равна 0,4 процента.
Физические и химические свойства молекул уксусной кислоты в кристаллическом виде создают диамеры на водородных связях. Также ее свойства необходимы при создании более сложных жирных кислот, стероидов и биосинтезе стеринов.
Лабораторные испытания
Обнаружить уксусную кислоту в растворе можно за счет выявления ее физических свойств, например запаха. Достаточно добавить в раствор более сильную кислоту, которая начнет вытеснять соли уксуса с выделением ее паров. Путем лабораторной перегонки Ch4COONa и h3SO4 возможно получить уксусную кислоту в сухом виде.
Проведем опыт из школьной программы по химии 8 класса. Физические свойства уксусной кислоты ярко демонстрирует химическая реакция расстворения. Достаточно добавить в раствор к веществу оксид меди и слегка нагреть его. Оксид полностью растворяется, делая раствор голубоватого цвета.
Производные вещества
Качественные реакции вещества со многими растворами образуют: эфиры, амиды и соли. Однако во время производства других веществ, требования к физическим свойствам уксусной кислоты остаются высокими. Она всегда должна иметь высокую степень растворения, а значит, не иметь сторонних примесей.
В зависимости от концентрации уксусной кислоты водного раствора выделяют ряд ее производных. Концентрация вещества более 96% имеет название - ледяная уксусная кислота. Уксусную кислоту в 70-80% можно приобрести в продуктовых магазинах, там она будет называться – уксусная эссенция. Столовый уксус имеет концентрацию 3-9 %.
Уксусная кислота и повседневная жизнь
Помимо пищевых особенностей, уксусная кислота обладает рядом физических свойств, которым человечество нашло свое применение в быту. Раствор вещества невысокой концентрации легко удаляет налет с металлических изделий, поверхности зеркал и окон. Способность впитывать влагу также играет на пользу. Уксус хорошо устраняет запахи в затхлых помещениях, удаляет пятна от овощей и фруктов на одежде.
Как выяснилось, физическое свойство уксусной кислоты – устранять жир с поверхности - может найти применение в народной медицине и косметологии. Слабым раствором пищевого уксуса обрабатывают волосы для придания им блеска. Вещество широко применяется для лечения простудных заболеваний, удаления бородавок и кожных грибков. Набирает темп использование уксуса в составе косметических обертываний для борьбы с целлюлитом.
Использование в производстве
В соединениях солей и других сложных веществ уксусная кислота выступает незаменимым элементом:
- Фармацевтическая отрасль. Для создания: аспирина, антисептических и антибактериальных мазей, фенацетина.
- Производство синтетических волокон. Негорючие пленки, ацетилцеллюлоза.
- Пищевая отрасль. Для успешной консервации, приготовления маринадов и соусов, в качестве пищевой добавки E260.
- Текстильная отрасль. Входит в состав красителей.
- Производство косметики и средств гигиены. Ароматические масла, крема для улучшения тонуса кожи.
- Изготовление протрав. Используется как инсектицид и протрава от сорняков.
- Производство лаков. Технические растворители, производство ацетона.

Ежегодно производство уксусной кислоты увеличивается. На сегодня его объем в мире составляет более 400 тысяч тонн в месяц. Транспортировка кислоты осуществляется в прочных цистернах из стали. Хранение в пластиковой таре на многих производствах в связи с высокой физической и химической активностью уксусной кислоты запрещено либо ограничено сроком до нескольких месяцев.
Безопасность
Уксусная кислота высокой концентрации имеет третью степень воспламенения и выделяет токсичные пары. Рекомендуется надевать специальные противогазы и другие средства индивидуальной защиты в процессе работы с кислотой. Смертельная доза для человеческого организма от 20 мл. В момент попадания вещества внутрь кислота в первую очередь обжигает слизистую оболочку, а затем поражает остальные органы. В таких случаях нужна немедленная госпитализация.
После попадания кислоты на открытые участки кожи рекомендуется сразу промыть их проточной водой. Поверхностный ожог кислотой может вызвать некроз тканей, что также требует госпитализации.
Интересные факты
Ученые физиологии выяснили, что человеку вовсе не обязателен прием уксусной кислоты - без пищевых добавок можно обойтись. Зато людям с непереносимостью кислоты, а также с проблемами желудка, вещество противопоказано.

Уксусная кислота используется в книгопечатании.
Вещество в небольшом количестве было найдено в меде, бананах и пшенице.
Охладив уксусную кислоту и резко взболтав с ней емкость, можно наблюдать ее резкое застывание.
Небольшая концентрация уксусной кислоты может снизить болевой симптом от укуса насекомых, а также мелких ожогов.
Прием в пищу продуктов с малым содержанием уксусной кислоты снижает уровень холестерина в организме. Вещество хорошо стабилизирует уровень сахара у диабетиков.
Употребление белковой и углеводной пищи вместе с небольшим количеством уксусной кислоты повышает их усвояемость организмом.
Если еда пересолена, достаточно добавить пару капель уксуса, чтобы сгладить солоноватость.
Напоследок
Тысячелетия использования уксусной кислоты привели к тому, что ее физические и химические свойства находят свое применение на каждом шагу. Сотни возможных реакций, тысячи полезных веществ, благодаря которым человечество идет дальше. Главное знать все особенности уксусной кислоты, ее положительные и отрицательные качества.
Не стоит забывать о пользе, но всегда надо помнить какой вред может причинить неосторожное обращение с уксусной кислотой высокой концентрации. По своей опасности она стоит рядом с соляной и серной кислотой. Всегда помните о технике безопасности при использовании кислоты. Правильно и осторожно разбавляйте эссенцию водой.
fb.ru
Органические кислоты | Учеба-Легко.РФ - крупнейший портал по учебе
Карбоновые кислоты. Карбоновыми кислотами называются соединения, содержащие карбоксильную группу
Классификация. По числу карбоксильных групп карбоновые кислоты делят на монокарбоновые, илиодноосновные (одна группа —СООН), дикарбоновые, или двухосновные (две группы —СООН), и т. д. В зависимости от строения углеводородного радикала, с которым связана карбоксильная группа, карбоновые кислоты бывают алифатическими (например, уксусная или акриловая), алициклическими (например, циклогексанкарбоновая) или ароматическими (бензойная, фталевая).
Если в углеводородном радикале карбоновых кислот атом (атомы) водорода замещен на другие функциональные группы, то такие кислоты называются гетерофункциональными. Среди них различаютгалогенкарбоновые (например, Ch3Cl—СООН), нитрокислоты (например, NО2—С6Н4СООН), аминокислоты (см. “Азотсодержащие соединения”), оксикислоты (например, СН3—СН(ОН)—СООН) и др.
Карбоновые кислоты с числом атомов углерода выше 6 называют высшими (жирными) кислотами.
Номенклатура. В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая. Карбоновые кислоты часто имеют тривиальные названия: муравьиная, уксусная и др. (см. табл.).
Карбоновые кислоты
| Формула | Систематическое название | Тривиальное название |
| Монокарбоновые кислоты | ||
| НСООН | Метановая | Муравьиная |
| СН 3СООН | Этановая | Уксусная |
| C2H5COOH | Пропановая | Пропионовая |
| C6H5COOH | Бензойная | ѕ |
| СН3(СН2)16СООН | Октадециловая | Стеариновая |
| Ch3==CH—СООН | Пропеновая | Акриловая |
| Дикарбоновые кислоты | ||
| НООС—СООН | Этандиовая | Щавелевая |
| НООС—Ch3—СООН | Пропандиовая | Малоновая |
| НООС—СН2—Ch3—СООН | Бутандиовая | Янтарная |
|
| Бензол-1,2-дикарбоновая | Фталевая |
|
| Бензол-1,4-дикарбоновая | Терефталевая |
Названия ароматических кислот производят от бензойной кислоты, например:
Изомерия. Возможны следующие виды изомерии:
1. Изомерия углеродной цепи. Она начинается с бутановой кислоты (С3Н7СООН), которая существует в виде двух изомеров: масляной и изомасляной (2-метилпропановой) кислот.
2. Изомерия положения кратной связи, например:
СН2==СН—СН2—СООН СН3—СН==СН—СООН
Бутен-3-овая кислота Бутен-2-овая кислота
(винилуксусная кислота) (кротоновая кислота)
3. Цис-, транс-изомерия, например:
4. Межклассовая изомерия: например, масляной кислоте (СН3—СН2—Ch3—СООН) изомерны метиловый эфир пропановой кислоты (СН3—СН2—СО—О—СНз) и этиловый эфир уксусной кислоты (СН3—СО—О —Ch3—СН3).
5. У гетерофункционалъных кислот возможна изомерия, связанная с положением функциональных групп, например, существуют три изомера хлормасляной кислоты: 2-хлорбутановая, 3-хлорбутановая и 4-хлорбутановая.
Для гетерофункциональных кислот возможна также оптическая изомерия.
Способы получения. 1. Окисление альдегидов и первичных спиртов — общий способ получения карбоновых кислот:
2. Другой общий способ — гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода:
3. Взаимодействие реактива Гриньяра с СО2:
4. Гидролиз сложных эфиров:
5. Гидролиз ангидридов кислот:
6. Для отдельных кислот существуют специфические способы получения:
Муравьиную кислоту получают нагреванием оксида углерода (II) с порошкообразным гидроксидом натрия под давлением и обработкой полученного формиата натрия сильной кислотой:
Уксусную кислоту получают в промышленных масштабах каталитическим окислением бутана кислородом воздуха:
Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия (см. “Ароматические углеводороды”):
Физические свойства. Насыщенные алифатические монокарбоновые кислоты образуют гомологический ряд, который характеризуется общей формулой СnН2n+1СООН. Низшие члены этого ряда (С1— С9) представляют собой жидкости, обладающие характерным острым запахом. Средние представители ряда—вязкие, “маслообразные” жидкости; начиная с С10 — твердые вещества.
Кислоты, содержащие 1—3 углеродных атома, неограниченно смешиваются с водой. С дальнейшим ростом углеводородного радикала растворимость монокарбоновых кислот уменьшается, твердые высшие жирные кислоты в воде не растворяются.
Ненасыщенные кислоты, как правило, жидкости.
Все дикарбоновые и ароматические кислоты при комнатной температуре — кристаллические вещества.
Строение. Карбоксильная группа СООН состоит из карбонильной группы С==O и гидроксильной группы ОН, которые оказывают взаимное влияние друг на друга. В группе СО атом углерода несет частичный положительный заряд и притягивает к себе неподеленную электронную пару атома кислорода в группе ОН. При этом электронная плотность на атоме кислорода уменьшается и связь O-Н ослабляется (увеличиваютсякислотные свойства):
В свою очередь, группа ОН “гасит” положительный заряд на группе СО, которая из-за этого теряет способность к реакциям присоединения, характерным для карбонильных соединений.
Химические свойства. 1. Диссоциация кислот. В водном растворе карбоновые кислоты диссоциируют:
Однако это равновесие диссоциации сильно сдвинуто влево, поэтому карбоновые кислоты, как правило, слабые кислоты.
Вследствие взаимного влияния атомов в молекулах дикарбоновых кислот они являются более сильными, чем одноосновные.
2. Образование солей. Карбоновые кислоты обладают всеми свойствами обычных кислот: реагируют с активными металлами, основными оксидами, основаниями:
Карбоновые кислоты — слабые, поэтому сильные минеральные кислоты вытесняют их из соответствующих солей.
3. Образование функциональных производных. При замещении группы ОН в карбоновых кислотах различными группами (X) образуются функциональные производные кислот, имеющие общую формулу R—СО—X; здесь R означает алкильную либо арильную группу.
Хлорангидриды получают действием хлорида фосфора (V) на кислоты:
Сложные эфиры образуются при нагревании кислоты со спиртом в присутствии серной кислоты (обратимая реакция этерификации):
Механизм реакции этерификации был установлен методом “меченых атомов”.
Сложные эфиры можно также получить при взаимодействии хлорангидридов кислот и алкоголятов щелочных металлов:
Реакции хлорангидридов карбоновых кислот с аммиаком приводят к образованию амидов:
Амидами карбоновых кислот называются производные этих кислот, в которых гидроксилъная группа замещена на аминогруппу.
Например:
Общая формула амидов RCONh3. Функциональная группа СONh3 называется амидогруппой.
Названия амидов производят от названий кислот, из которых они образовались, с добавлением слова амид.
Физические свойства амидов. Амид муравьиной кислоты — жидкость, амиды всех других кислот — белые кристаллические вещества. Низшие амиды хорошо растворимы в воде. Водные растворы амидов дают нейтральную реакцию на лакмус.
Важнейшее свойство амидов — способность их к гидролизу в присутствии кислот и щелочей. При этом образуются кислота и аммиак:
К амидам кислот относится мочевина. Это конечный продукт азотистого обмена в организме человека и животных. Образуется при распаде белков и выделяется вместе с мочой. Мочевину можно рассматривать как полный амид угольной кислоты:
Мочевина, или карбамид, — белое кристаллическое вещество, хорошо растворимое в воде. Впервые была получена немецким ученым Велером в 1828 г. из цианата аммония:
Это первое органическое соединение, полученное синтетическим путем. В промышленности мочевину получают из оксида углерода (IV) и аммиака при нагревании (150° С) и высоком давлении:
С сильными минеральными кислотами мочевина образует соли:
Мочевина — ценное высококонцентрированное азотное удобрение (46,6% азота), широко используется на всех почвах и под все культуры. Как источник азота, ее добавляют в корм скоту. Применяется также как исходное вещество для получения мочевиноформальдегидных смол и лекарственных веществ (люминала, веронала и др.).
4. Ряд свойств карбоновых кислот обусловлен наличием углеводородного радикала. Так, при действии галогенов на свету образуются a -галогензамещенные кислоты:
Непредельные карбоновые кислоты способны к реакциям присоединения.
5. Окислительно-восстановительные реакции карбоновых кислот.
Карбоновые кислоты при действии восстановителей способны превращаться в альдегиды или спирты:
Насыщенные карбоновые кислоты устойчивы к действию концентрированных серной и азотной кислот. Исключение составляет муравьиная кислота:
Муравьиная кислота НСООН отличается рядом особенностей, поскольку в ее составе есть альдегидная группа:
Муравьиная кислота — сильный восстановитель и легко окисляется до СО2. Она дает реакцию “серебряного зеркала”:
Кроме того, муравьиная кислота окисляется хлором:
Сложные эфиры. Среди функциональных производных кислот особое место занимают сложные эфиры — производные кислот, у которых атом водорода в карбоксильной группе заменен углеводородным радикалом. Общая формула сложных эфиров
где R и R' — углеводородные радикалы (в сложных эфиpax муравьиной кислоты R — атом водорода).
Номенклатура и изомерия. Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -овая используют суффикс -am, например:
Для сложных эфиров характерны три вида изомерии:
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат.
2. Изомерия положения сложноэфирной группировки —СО—О—. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат.
3. Межклассовая изомерия, например, метилацетату изомерна пропановая кислота.
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис-, транс-изомерия.
Физические свойства сложных эфиров. Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Так, например, бутилбутират имеет запах ананаса, изоамилацетат — груши и т. д.
Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы.
Химические свойства сложных эфиров. 1. Реакция гидролиза, или омыления. Так, как реакция этерификации является обратимой, поэтому в присутствии кислот протекает обратная реакция гидролиза:
Реакция гидролиза катализируется и щелочами; в этом случае гидролиз необратим, так как получающаяся кислота со щелочью образует соль:
2. Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения.
3. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
4. Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:
Жиры. Среди сложных эфиров особое место занимают природные эфиры — жиры и масла, которые образованы трехатомным спиртом глицерином и высшими жирными кислотами, содержащими четное число углеродных атомов. Жиры входят в состав растительных и животных организмов и служат одним из источников энергии живых организмов, которая выделяется при окислении жиров.
Общая формула жиров:
где R', R", R"' — углеродные радикалы.
Жиры бывают “простыми” и “смешанными”. В состав простых жиров входят остатки одинаковых кислот (т. е. R’ = R" = R'"), в состав смешанных — различных.
В жирах наиболее часто встречаются следующие жирные кислоты:
Алкановые кислоты
1. Масляная к-та СН3 — (Ch3)2 — СООН
2. Капроновая к-та СН3 — (Ch3)4 — СООН
3. Пальмитиновая к-та СН3 — (Ch3)14 — СООН
4. Стеариновая к-та СН3 — (Ch3)16 — СООН
Алкеновые кислоты
5. Олеиновая к-та С17Н33СООН
СН3—(СН2)7—СН === СН—(СН2)7—СООН
Алкадиеновые кислоты
6. Линолевая к-та С17Н31СООН
СН3—(СН2)4—СН = СН—СН2—СН = СН—СООН
Алкатриеновые кислоты
7. Линоленовая к-та С17Н29СООН
СН3СН2СН = CHCh3CH == CHCh3CH = СН(СН2)4СООН
Физические свойства. По агрегатному состоянию при комнатной температуре жиры делятся на жидкие и твердые. Твердые жиры, как правило, образованы предельными кислотами, жидкие жиры (их часто называют маслами) — непредельными.
Жиры растворимы в органических растворителях и нерастворимы в воде.
Химические свойства. 1. Гидролиз, или омыление, жиров происходит под действием воды (обратимо) или щелочей (необратимо). При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами.
2. Гидрогенизацией жиров называется процесс присоединения водорода к остаткам непредельных кислот, при этом жиры из жидких превращаются в твердые.
Мыла — это соли высших карбоновых кислот. Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла.
Мыла получаются при гидролизе жиров в присутствии щелочей:
Отсюда реакция, обратная этерификации, получила название реакции омыления. Омыление жиров может протекать и в присутствии серной кислоты (кислотное омыление). При этом получаются глицерин и высшие карбоновые кислоты. Последние действием щелочи или соды переводят в мыла. Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода. Растительные масла предварительно подвергаются гидрогенизации, т. е. их превращают в твердые жиры. Применяются также заменители жиров — синтетические карбоновые жирные кислоты с большей молекулярной массой. Производство мыла требует больших количеств сырья, поэтому поставлена задача получения мыла из непищевых продуктов. Необходимые для производства мыла карбоновые кислоты получают окислением парафина. Нейтрализацией кислот, содержащих от 10 до 16 углеродных атомов в молекуле, получают туалетное мыло, а из кислот, содержащих от 17 до 21атома углерода, — хозяйственное мыло и мыло для технических целей. Как синтетическое мыло, так и мыло, получаемое из жиров, плохо моет в жесткой воде. Поэтому наряду с мылом из синтетических кислот производят моющие средства из других видов сырья, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты. В общем виде образование таких солей можно изобразить уравнениями:
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Синтетические моющие средства высвобождают сотни тысяч тонн пищевого сырья — растительных масел и жиров.
uclg.ru
Применение уксусной кислоты на основе свойств.
Поиск Лекций
УКСУСНАЯ КИСЛОТА, Ch4COOH, бесцветная горючая жидкость с резким запахом, хорошо растворимая в воде. Имеет характерный кислый вкус, проводит электрический ток.
Уксусная кислота была единственной, которую знали древние греки. Отсюда и ее название: "оксос" - кислое, кислый вкус.
Уксусная кислота - это простейший вид органических кислот, которые являются неотъемлемой частью растительных и животных жиров. В небольших концентрациях она присутствует в продуктах питания и напитках и участвует в метаболических процессах при созревании фруктов. Уксусная кислота часто встречается в растениях, в выделениях животных. Соли и эфиры уксусной кислоты называются ацетатами.
Уксусная кислота - слабая (диссоциирует в водном растворе только частично). Тем не менее, поскольку кислотная среда подавляет жизнедеятельность микроорганизмов, уксусную кислоту используют при консервировании пищевых продуктов, например, в составе маринадов.
Получают уксусную кислоту окислением ацетальдегида и другими методами, пищевую уксусную кислоту уксуснокислым брожением этанола. Применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетата целлюлозы), в виде столового уксуса при изготовлении приправ, маринадов, консервов. Уксусная кислота участвует во многих процессах обмена веществ в живых организмах. Это одна из летучих кислот, присутствующая почти во всех продуктах питания, кислая на вкус и главная составляющая уксуса.
Как растворитель (например, в производстве ацетата целлюлозы), в виде столового уксуса при изготовлении приправ, маринадов, консервов.
Водный раствор уксусной кислоты используют в качестве вкусового и консервирующего средства (приправа к пище, маринование грибов, овощей).
В состав уксуса входят такие кислоты, как яблочная, молочная, аскорбиновая, уксусная.
Яблочный уксус ( 4% уксусной кислоты ):
Здоровым людям рекомендуется каждый день употреблять полезный и освежающий напиток: в стакане воды размешать ложку меда и добавить 1 ложку яблочного уксуса. Желающим похудеть, рекомендуем каждый раз во время еды выпивать стакан несладкой воды с двумя ложками яблочного уксуса.
В народной медицине уксус используется как неспецифическое жаропонижающее средство (путем протирания кожи раствором воды и уксуса в пропорции 3:1), а также при головных болях методом примочек. Распространено применение уксуса при укусах насекомых посредством компрессов.
Известно применение спиртового уксуса в косметологии. А именно для придания мягкости и блеска волосам после химической завивки и перманентной окраски. Для этого волосы рекомендуется ополаскивать теплой водой с добавлением спиртового уксуса (на 1 литр воды - 3-4 ложки уксуса)
Уксусная кислота применяется также для производства лекарственных средств.
Таблетки Аспирина (ЭС) содержат активный ингредиент ацетилсалициловую кислоту, которая представляет собой уксусный эфир салициловой кислоты.
Ацетилсалициловая кислота производится путём нагревания салициловой кислоты с безводной уксусной кислотой в присутствии небольшого количества серной кислоты (в качестве катализатора).
Уксусная кислота используется в и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров), в производстве негорючих пленок, парфюмерных продуктов, растворителей, при синтезе красителей, лекарственных веществ, например, аспирина. Соли уксусной кислоты используют для борьбы с вредителями растений.
Контроль знаний:
1.Какие свойства присущи карбоновым кислотам?2. Какой объем воздуха (объемное содержание кислорода 21 %) расходуется на полное сжигание 1 м3 метана и 1 кг гептана (н. у.).
3.Напишите структурную формулу 3-метилбутановой кислоты.
4.Составьте уравнения реакций, при которых можно получить карбоновую кислоту.
5.Как используют уксусную кислоту.
ДОМАШНЕЕ ЗАДАНИЕ:
Проработать: Л1.стр.120-130,пересказ конспекта лекции №12.
Лекция № 13.
Сложные эфиры и жиры. Получение сложных эфиров реакцией этерификации. Сложные эфиры в природе, их значение. Применение сложных эфиров на основе свойств. Жиры как сложные эфиры. Химические свойства жиров: гидролиз (омыление) жиров, гидрирование жидких жиров. Применение жиров на основе свойств.
Основные понятия и термины по теме:эфиры, жиры, гидролиз жиров.
План изучения темы:
(перечень вопросов, обязательных к изучению):
1.Понятие о сложных эфирах и жирах.Получение сложных эфиров реакцией этерификацией.
2.Химические и физические свойства эфиров и жиров.
3.Применение эфиров и жиров на основе свойств.
4.Химические свойства жиров: гидролиз (омыление) жиров, гидрирование жидких жиров.
Содержание лекции:
1.Понятие о сложных эфирах.Получение сложных эфиров реакцией этерификацией.
Сложными эфирами называют продукты взаимодействия одноатомных и многоатомных спиртов с сильными минеральными кислотами.
Реакция образования эфира из спирта и кислоты является обратимой: прямая реакция называется этерификациею, а обратная - омылением эфира.
Сложные эфиры обычно рассматривают как продукт реакции кислоты со спиртом, например, этилацетат можно воспринимать как результат взаимодействия уксусной кислоты и этанола. Довольно часто употребляют тривиальное название сложных эфиров. Этилацетат по ней можно назвать этиловым эфиром уксусной кислоты.
СН3-CO-OH + СН3-СН2-ОН = СН3COOC2H5 + h3O
2.Химические и физические свойства эфиров.
Основным химическим свойством сложных эфиров является их гидролиз. Гидролиз может катализироваться кислотой или основанием.
Химические свойства сложных эфиров:
1) взаимодействие их с водой. Например, при нагревании этилового эфира уксусной кислоты с водой в присутствии неорганической кислоты образуются уксусная кислота и этиловый спирт;
2) такая реакция называется гидролизом.
Особенности реакции гидролиза:
а) эта реакция противоположна реакции образования сложного эфира; б) реакция гидролиза сложного эфира обратима, так же, как и реакция этерификации.
Физические свойства сложных эфиров:
Много сложных эфиров карбоновых кислот имеют характерные фруктовые или цветочные запахи, за что их используют как искусственные ароматизаторы.
Например:Бутилацетат имеет грушевый ароматМетиловый эфир масляной кислоты - яблоневыйЭтиловый эфир масляной кислоты - ананасовый или «абрикосовый».Этиловый эфир изовалериановой кислоты - малиновый.Этиловый эфир валериановой кислоты - виноградный.Изоамиловый эфир изовалериановой кислоты - банановый.Октиловый эфир уксусной кислоты - апельсиновый.Етилсалицилат – мятный.Бензилацетат – жасминовый.Бензилбензоат – цветочный.
Рекомендуемые страницы:
poisk-ru.ru