Содержание
Презентация на тему: «Сложные эфиры. Жиры. Что такое сложные эфиры и жиры? ОпределениеОбщая формула Сложные эфиры
1
Сложные эфиры. Жиры
2
Что такое сложные эфиры и жиры? Определение Общая формула Сложные эфиры — это соединения, полученные в результате взаимодействия карбоновых кислот со спиртами. Жиры — природные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот R 1, R 2, R 3 -углеводородные радикалы (для сложных эфиров) и углеводородные радикалы карбоновых кислот (для жиров)
Жиры — природные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот R 1, R 2, R 3 -углеводородные радикалы (для сложных эфиров) и углеводородные радикалы карбоновых кислот (для жиров)
3
Номенклатура Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -новая используют суффикс -ат, например: CH 3 СOC 2 H 5 || О Этилацетат или этиловый эфир уксусной кислоты
4
Изомерия 1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат. СН 3 СН 2 СН 2 СН 2 СОС 2 Н 5 || О Этилбутират СН 3 СНСН 2 CОС 2 Н 5 | || CH 3 O Этилизобутират СН 3 СOСН 2 СН 2 СН 3 || О Пропилацетат СН 3 СOСНСН 3 || | O CH 3 Изопропилацетат
Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат. СН 3 СН 2 СН 2 СН 2 СОС 2 Н 5 || О Этилбутират СН 3 СНСН 2 CОС 2 Н 5 | || CH 3 O Этилизобутират СН 3 СOСН 2 СН 2 СН 3 || О Пропилацетат СН 3 СOСНСН 3 || | O CH 3 Изопропилацетат
5
2. Изомерия положения сложноэфирной группировки СОО Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат.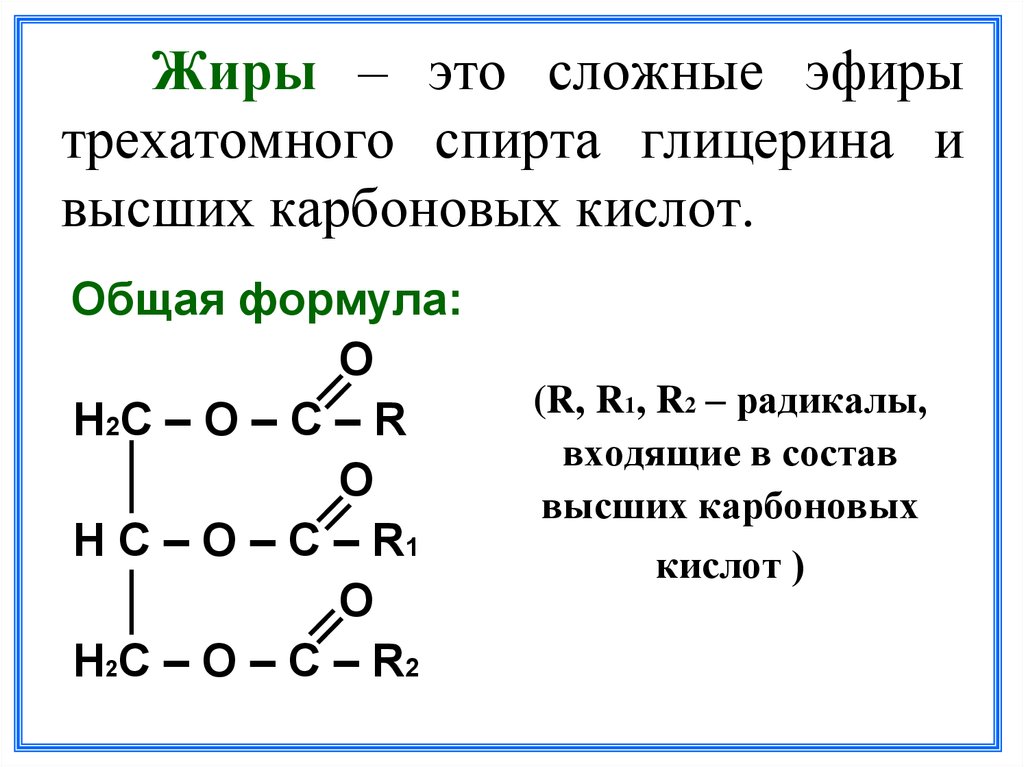 Изомерия СН 3 СООС 2 Н 5 этилацетат С 2 Н 5 СООСН 3 метилпропионат.
Изомерия СН 3 СООС 2 Н 5 этилацетат С 2 Н 5 СООСН 3 метилпропионат.
6
3. Межклассновая изомерия -например, метилацетату изомер на пропанновая кислота. СН 3 СООСН 3 метилацетат С 2 Н 5 СООН пропионновая кислота Изомерия
7
4.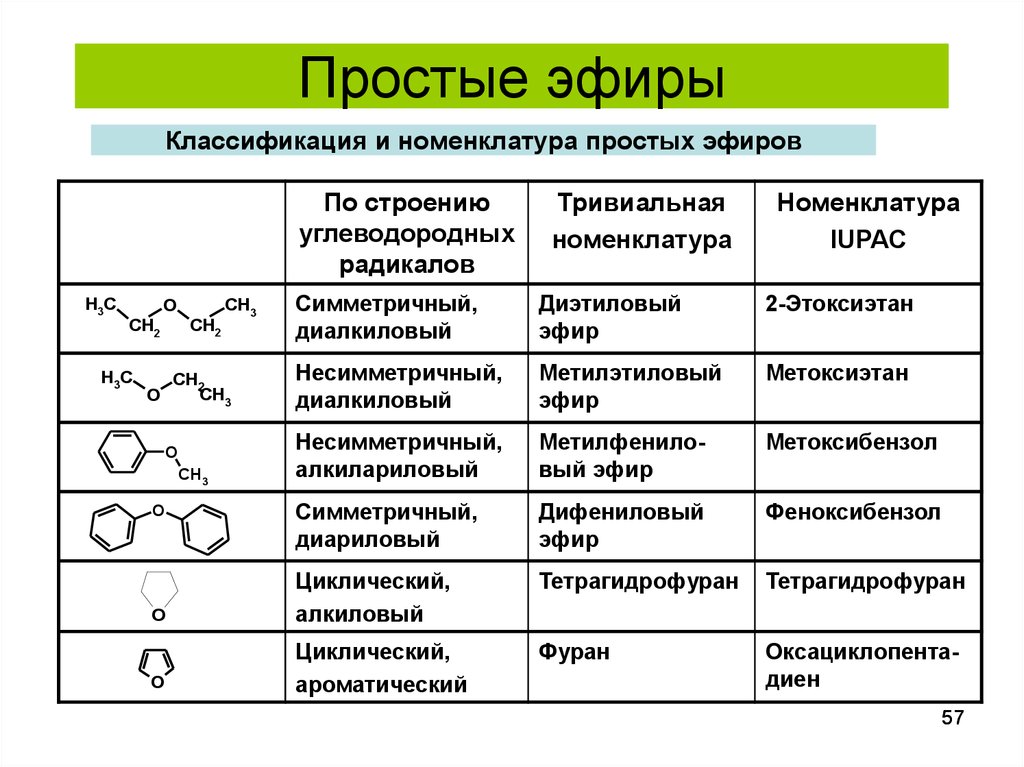 Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи цис транс изомерия Изомерия
Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи цис транс изомерия Изомерия
8
Физические свойства сложных эфиров Формула сложного эфира Название Аромат СН 3 СООС 4 Н 9 Бутилацетатгрушевый С 3 Н 7 СООСН 3 Метиловый эфир масляной кислоты яблочный С 3 Н 7 СООС 2 Н 5 Этиловый эфир масляной кислоты ананасовый С 4 Н 9 СООС 2 Н 5 Этиловый эфир изовалериановой кислоты малиновый С 4 Н 9 СООС 5 Н 11 Изоамиловый эфир изовалериановой кислоты банановый СН 3 СООСН 2 С 6 Н 5 Бензилацетатжасминовый С 6 Н 5 СООСН 2 С 6 Н 5 Бензилбензоатцветочный Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Сложные эфиры высших жирных кислот и спиртов воскообразные вещества, не имеют запаха, в воде не растворимы.
Многие из них имеют приятный запах. Сложные эфиры высших жирных кислот и спиртов воскообразные вещества, не имеют запаха, в воде не растворимы.
9
Физические свойства жиров Жиры широко распространены в природе. Наряду с углеводородами и белками они входят в состав всех растительных и животных организмов и составляют одну из основных частей нашей пищи. Агрегатное состояние жиров при комнатной температуре ЖИРЫ Твердые (жиры животного происхождения) Жидкие (масла) Жиры растворимы в органических растворителях и нерастворимы в воде.
10
Химические свойства сложных эфиров Процесс расщепления сложного эфира при действии воды с образованием карбоновой кислоты и спирта называют гидролизом сложного эфира: СН 3 СООС 2 Н 5 + H 2 O СН 3 СООН + С 2 Н 5 ОН Реакция этерификации (с помощью которой можно получить сложные эфиры) обратимый процесс. Прямая реакция образование сложного эфира, обратная его кислотный гидролиз. Для того чтобы сдвинуть равновесие вправо, необходимо удалять из реакционной смеси воду. Гидролиз в присутствии щелочи протекает необратимо (т. к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом спиртом). Эта реакция называется омылением сложного эфира.
к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом спиртом). Эта реакция называется омылением сложного эфира.
11
Химические свойства сложных эфиров Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения. Например, при каталитическом гидрировании они присоединяют водород. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов: R’COOR» + [H] R’Ch3OH + R»OH Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты R’COOR» + Nh4 R’CONh3 + R»OH
Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты R’COOR» + Nh4 R’CONh3 + R»OH
12
Одно из важнейших свойств жиров их способность расщепляться на составляющие: глицерин и карбоновые кислоты. Если такая реакция осуществляется под действием воды в присутствии кислот, она называется гидролизом (гидро вода, лиз разрушение): Химические свойства жиров Приведенная выше реакция является обратимой. Но как сместить равновесие вправо? Один из способов удаление одного из конечных продуктов, например, превратить его в другое вещество (см. след. слайд)
след. слайд)
13
Химические свойства жиров Если на выделяющуюся карбоновую кислоту действовать щелочью она превратится в соль: C 17 H 35 COOH + NaOH C 17 H 35 COONa + H 2 O Если объединить две реакции в одну, т. е. нагревать раствором щелочи, то разложение будет необратимым и пройдет до конца: СН 2 ОСОС 17 Н 35 CH 2 OH | СНОСOС 17 H NaOH CHOH + 3C 17 H 35 COONa | СН 2 ОСОС 17 Н 35 CH 2 OH Эта реакция называется омылением, поскольку образующиеся соли щелочных металлов и высших карбоновых кислот являются мылами.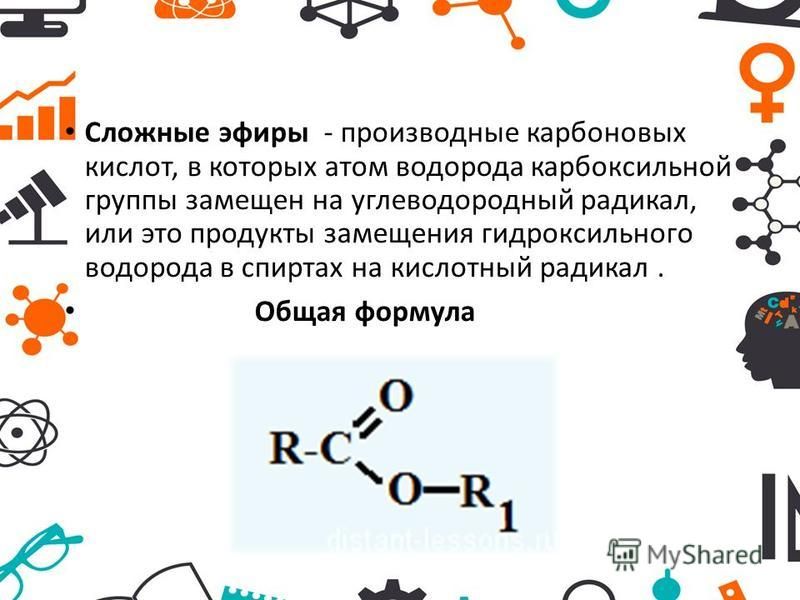
14
Химические свойства жиров Твердые животные жиры более ценны и дорогостоящи, чем растительные масла. Способ превращения непредельных жиров в предельные присоединение по двойной связи молекулы водорода. Такая реакция называется реакцией гидрирования. Например, реакция гидрирования триолеата глицерина до тристеарата: CH 2 OCOC 17 H 33 CH 2 OCOC 17 H 35 | CHOCOC 17 H H 2 CHOCOC 17 H 35 | CH 2 OCOC 17 H 33 Ch3OCOC 17 H 35
15
Получение сложных эфиров Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации).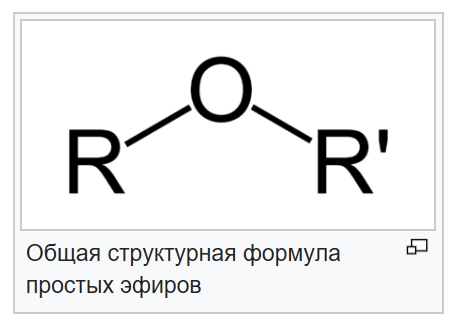 Катализаторами являются минеральные кислоты: Данная реакция обратима. Эту реакцию в 1873 г. изучал выдающийся русский химик Владимир Васильевич Марковников, практическое ее осуществление было усовершенствовано немецким ученым Эмилем Фишером.
Катализаторами являются минеральные кислоты: Данная реакция обратима. Эту реакцию в 1873 г. изучал выдающийся русский химик Владимир Васильевич Марковников, практическое ее осуществление было усовершенствовано немецким ученым Эмилем Фишером.
16
Получение жиров Получить Жиры можно реакцией этерификации, в которую вступают глицерин и соответствующая карбонновая кислота. Катализатором реакции этерификации является сильная кислота.
17
Применение сложных эфиров
18
Применение жиров
19
Интересное о жирах Жиры являются одной из трех главных составляющих пищи человека и животных, наряду с углеводами и белками.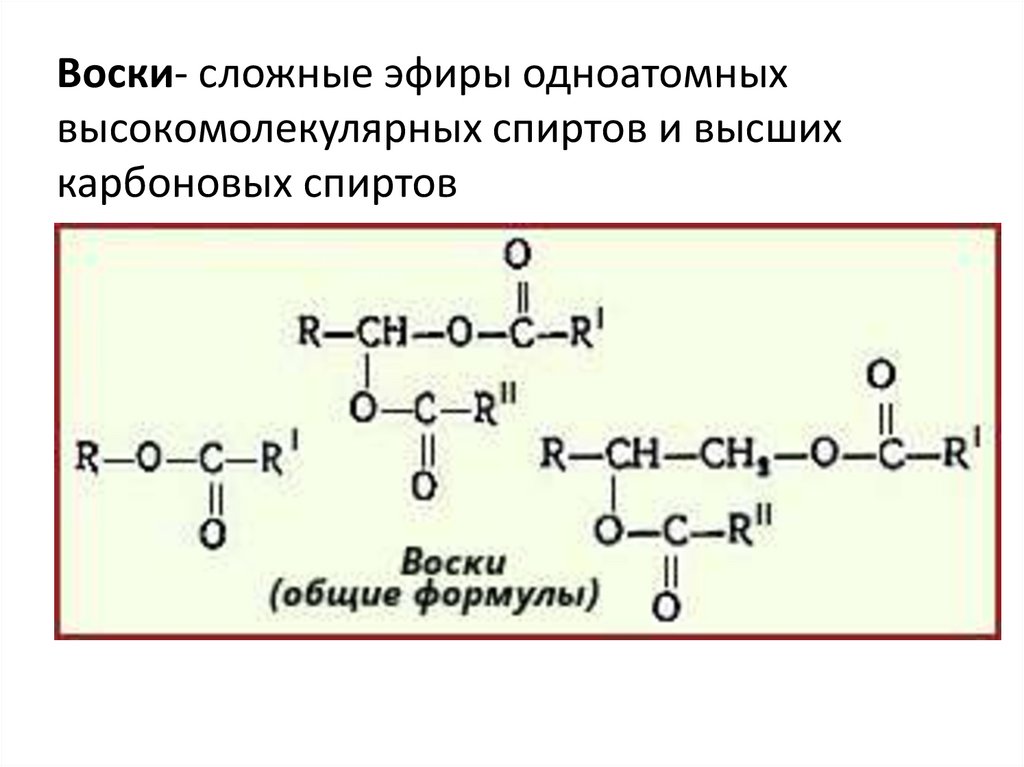 При их окислении в организме выделяется энергия, необходимая для поддержания постоянной температуры тела и протекания других физиологических процессов (калорийность чистого жира 3770 к Дж (900 ккал/100 г). Поступающие с пищей жиры в процессе пищеварения расщепляются на глицерин и жирные кислоты; эти вещества всасываются в кишечнике, затем из них вновь синтезируются жиры. Кроме того, жиры накапливаются в подкожных тканях и тканях, окружающих внутренние органы, и выполняют терморегулирующую и защитную функцию в организме. жиры
При их окислении в организме выделяется энергия, необходимая для поддержания постоянной температуры тела и протекания других физиологических процессов (калорийность чистого жира 3770 к Дж (900 ккал/100 г). Поступающие с пищей жиры в процессе пищеварения расщепляются на глицерин и жирные кислоты; эти вещества всасываются в кишечнике, затем из них вновь синтезируются жиры. Кроме того, жиры накапливаются в подкожных тканях и тканях, окружающих внутренние органы, и выполняют терморегулирующую и защитную функцию в организме. жиры
20
Литература 1. Несмеянов А. Н., Несмеянов Н. А., Начала органической химии, кн. 1-2, М., Г.П. Лучинский, Курс Химии, М., Цветков Л.А. Органическая химия: Учебник для классов общеобразовательных учебных заведений. — М.: Гуманит. изд. центр ВЛАДОС, 2001;
Несмеянов А. Н., Несмеянов Н. А., Начала органической химии, кн. 1-2, М., Г.П. Лучинский, Курс Химии, М., Цветков Л.А. Органическая химия: Учебник для классов общеобразовательных учебных заведений. — М.: Гуманит. изд. центр ВЛАДОС, 2001;
Классификация и состав сложных эфиров.
Среди
изученных и широко применяемых сложных
эфиров большинство представляют
соединения, полученные на основе
карбоновых кислот. Сложные эфиры на
основе минеральных (неорганических)
кислот не столь разнообразны, т.к. класс
минеральных кислот менее многочисленен,
чем карбоновых (многообразие соединений
– один из отличительных признаков органической
химии).
Когда
число атомов С в исходных карбоновой
кислоте и спирте не превышает 6–8,
соответствующие сложные эфиры представляют
собой бесцветные маслянистые жидкости,
чаще всего с фруктовым запахом. Они
составляют группу фруктовых эфиров.
Если в образовании сложного эфира
участвует ароматический спирт (содержащий
ароматическое ядро), то такие соединения
обладают, как правило, не фруктовым, а
цветочным запахом.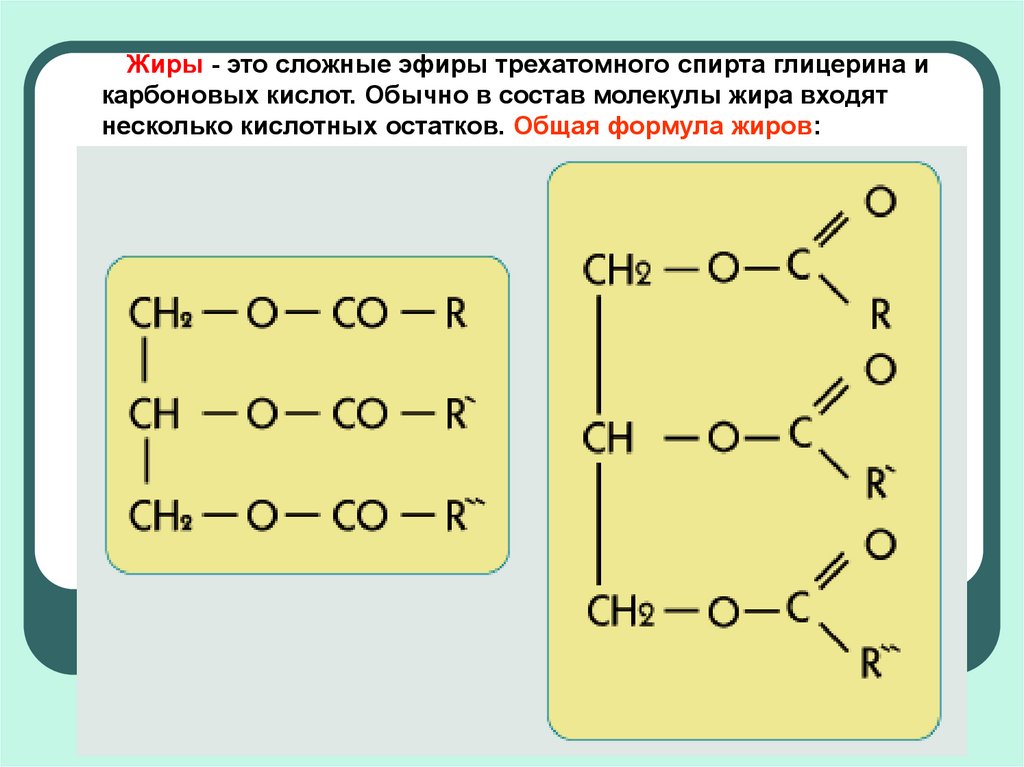 Все соединения этой
Все соединения этой
группы практически нерастворимы в воде,
но легко растворимы в большинстве
органических растворителей. Интересны
эти соединения широким спектром приятных
ароматов (табл. 1), некоторые из них
вначале были выделены из растений, а
позже синтезированы искусственно.
При
увеличении размеров органических групп,
входящих в состав сложных эфиров, до
С15–30 соединения
приобретают консистенцию пластичных,
легко размягчающихся веществ. Эту группу
называют восками, они, как правило, не
обладают запахом. Пчелиный воск содержит
смесь различных сложных эфиров, один
из компонентов воска, который удалось
выделить и определить его состав,
представляет собой мирициловый эфир
пальмитиновой кислоты С15Н31СООС31Н63.
Китайский воск (продукт выделения
кошенили – насекомых Восточной Азии)
содержит цериловый эфир церотиновой
кислоты С25Н51СООС26Н53.
Кроме того, воски содержат и свободные
карбоновые кислоты и спирты, включающие
большие органические группы.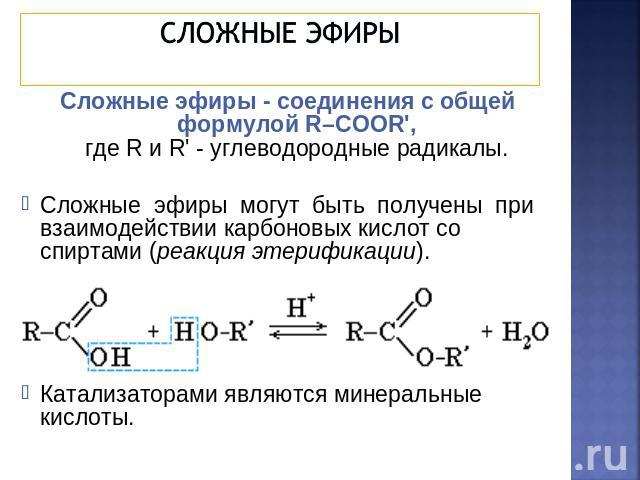 Воски не
Воски не
смачиваются водой, растворимы в бензине,
хлороформе, бензоле.
Среди функциональных
производных карбоновых кислот особое
место занимают сложные эфиры —
соединения, представляющие карбоновые
кислоты, у которых атом водорода в
карбоксильной группе заменен углеводородным
радикалом. Общая формула сложных эфиров
R — C — O — R’ |
|| |
O |
где R и R’
— углеводородные радикалы (в сложных
эфирах муравьиной кислоты R —
атом водорода).
Названия сложных
эфиров производят от названия,
углеводородного радикала и названия
кислоты, в котором вместо окончания
«-овая кислота» используют суффикс «ат»,
например:
|
| |||||||||||||||||||||||||
Часто сложные эфиры
называют по тем остаткам кислот и спиртов,
из которых они состоят. Так, рассмотренные
Так, рассмотренные
выше сложные эфиры могут быть названы:
этановоэтиловый эфир, кротоновометиловый
эфир.
Номенклатура
простых эфиров.
Если
группы R и R’ в простом эфире одинаковы,
то его называют симметричным, если
разные – несимметричным. В название
эфира включают названия органических
групп, упоминая их в алфавитном порядке,
и добавляют слово эфир, например,
C2H5OC3H7 –
пропилэтиловый эфир. Для симметричных
эфиров перед названием органической
группы вводят приставку «ди», например,
C2H5OC2H5 –
диэтиловый эфир. Для многих эфиров часто
используют тривиальные (упрощенные)
названия, сложившиеся исторически. К
простым эфирам иногда относят соединения,
которые содержат эфирный фрагмент С–О–С
в составе циклической молекулы (рис.
1), одновременно их причисляют к другому
классу соединений – гетероциклическим
соединениям.
Есть также соединения (см. АЛЬДЕГИДЫ
И КЕТОНЫ),
в состав которых входит фрагмент С–О–С,
но к классу эфиров их не относят, это
полуацетали – соединения, содержащие
одновременно алкокси- и гидрокси-группу
у одного атома углерода: >C(OH)OR, а также
ацетали – соединения, где у одного атома
углерода находятся одновременно две
RО-группы: >C(OR)2(рис.
1). Наличие у одного атома углерода сразу
двух химически связанных атомов О делает
эти соединения непохожими по химическим
свойствам на простые эфиры.
Сложные эфиры: описание, образование и использование, реакции
Что общего между мылом, биодизельным топливом, пластмассами и парфюмерией? Хотя эти вещества кажутся совершенно разными, все они сделаны из одного ключевого компонента: сложных эфиров .
- Эта статья о сложных эфирах в органической химии.
- Мы начнем с определения сложных эфиров, прежде чем рассматривать их номенклатуру.
- Затем мы рассмотрим некоторые из их свойств.
- Наконец, мы закончим кратким рассмотрением некоторых реакций, в которые они вовлечены.
Сложные эфиры представляют собой органические молекулы, полученные из карбоновых кислот и спиртов .
Как вы делаете сложные эфиры?
Сложные эфиры образуются из карбоновых кислот и спиртов .
Возможно, вы помните из Карбоновые кислоты , что карбоновые кислоты содержат функциональную группу, известную как карбоксильная группа , и имеют общую формулу. Для образования сложного эфира атом водорода карбоксильной группы карбоновой кислоты просто заменяется группой R спирта, что дает сложным эфирам общую формулу и функциональную группу.
Рис. 1 – Общая структура сложного эфира
Общая структура сложного эфира. Группы R могут быть одинаковыми или разными. Анна Брюэр, StudySmarter Originals
Чтобы получить сложные эфиры, мы взаимодействуем между карбоновой кислотой и спиртом в присутствии катализатора. Это известно как реакция этерификации . Он также производит воду.
\(RCOOH+R’OH\rightleftharpoons RCOOR’+H_2O\)
Подробнее об этом вы узнаете в Реакции сложных эфиров .
Вы можете легко получить сложные эфиры в лаборатории, нагревая карбоновую кислоту и спирт на водяной бане с несколькими каплями серной кислоты. Когда реакция завершится, перелейте смесь в химический стакан, наполненный водой. Сложный эфир будет находиться поверх воды, в то время как оставшиеся кислоты и спирт растворятся в растворе. Используйте руку, чтобы осторожно направить воздух через стакан к носу. Он должен пахнуть фруктами. Эфиры часто пахнут ароматно, поэтому они используются в туалетных принадлежностях, парфюмерии и бытовых чистящих средствах. На самом деле, они даже используются в обычных продуктах питания в качестве ароматизаторов. Возьми эфир этилэтанолат , например. Он пахнет грушами, поэтому мы используем его в сваренных вкрутую сладостях.
Когда реакция завершится, перелейте смесь в химический стакан, наполненный водой. Сложный эфир будет находиться поверх воды, в то время как оставшиеся кислоты и спирт растворятся в растворе. Используйте руку, чтобы осторожно направить воздух через стакан к носу. Он должен пахнуть фруктами. Эфиры часто пахнут ароматно, поэтому они используются в туалетных принадлежностях, парфюмерии и бытовых чистящих средствах. На самом деле, они даже используются в обычных продуктах питания в качестве ароматизаторов. Возьми эфир этилэтанолат , например. Он пахнет грушами, поэтому мы используем его в сваренных вкрутую сладостях.
Рис. 2 – Этилэтаноат. Эта молекула также известна как этилацетат
Из приведенной выше молекулы видно, что сложные эфиры содержат одну группу R с карбонильной функциональной группой и одну группу R, которая представляет собой просто углеводородную цепь. Группа R, содержащая связь, происходит от карбоновой кислоты, тогда как другая группа R происходит от спирта.
Рис. 3 – Получение сложных эфиров
Название сложных эфиров
Как мы выяснили выше, сложные эфиры состоят из двух разных молекул: карбоновой кислоты и спирта . Их имена состоят из двух частей и отражают эти две молекулы.
- Первая часть названия происходит от алкоголя. Вы называете это точно так же, как вы называете боковые цепи углеводородов в других органических молекулах. Он использует корневое название спирта, чтобы показать его длину, и заканчивается суффиксом -yl .
- Вторая часть названия происходит от карбоновой кислоты. Он снова использует корневое название карбоновой кислоты, чтобы показать ее длину и оканчивается суффиксом 9.0072 -оат .
Даже если вы не знаете, из какой карбоновой кислоты или спирта сделан сложный эфир, вы можете легко определить его название, посчитав количество атомов углерода в его цепях группы R. Давайте вместе рассмотрим несколько примеров.
Рис. 4. Можете ли вы назвать эту молекулу?
4. Можете ли вы назвать эту молекулу?
Посмотрите на молекулу выше. Группа R слева содержит карбонильную группу. Оно должно происходить от карбоновой кислоты, поэтому оканчивается на суффикс -оат . Если мы посчитаем атомы углерода в его цепочке, то увидим, что их два. Поэтому мы можем дать ему корневое имя -эт-. Если мы соединим корневое имя и суффикс, мы получим eth anoate .
Однако это только половина дела! Группа R справа должна быть от спирта. В его углеродной цепи всего один углерод, поэтому мы называем его метил . Объединение двух названий дает нам метилэтаноат .
Рис. 5 – Метилэтаноат. Метильная часть названия происходит от группы R, обведенной зеленым, а часть этаноата происходит от группы R, обведенной красным. Углероды пронумерованы, чтобы помочь вам
Не забудьте включить углерод, являющийся частью двойной связи C=O, при подсчете длины углеродной цепи.
Вот еще один пример.
Рис. 6. Можете ли вы назвать эту молекулу?
6. Можете ли вы назвать эту молекулу?
Группа R слева содержит карбонильную функциональную группу C=O и, следовательно, должна происходить от карбоновой кислоты. В его углеродной цепи три атома углерода, поэтому эта часть названия сложного эфира — пропаноат . Группа R справа происходит от спирта и имеет четыре атома углерода в своей цепи, что дает ему название 9.0072 бутил . Мы называем эту молекулу бутил проп аноат .
Рис. 7 — Бутилпропаноат
Обратите внимание, что когда мы рисуем сложные эфиры, мы обычно рисуем группу R, полученную из карбоновой кислоты, слева, а группу R, полученную из спирта, справа. Однако, называя их, мы сначала называем группу R, полученную из спирта.
Следующая молекула очень похожа на бутилпропаноат, но также содержит метильную группу и атом хлора:
Рис. 8
Чтобы выяснить, где именно они находятся в молекуле, нам нужно пронумеровать атомы углерода в основной цепи. Мы рассматриваем каждую половину молекулы отдельно.
Вы помните (см. Органические соединения ), что раньше мы могли нумеровать атомы углерода слева направо или справа налево — мы просто хотели, чтобы все дополнительные боковые группы располагались на самом низком возможном количестве атомов углерода. Это называется правилом наименьшего числа . Однако мы не можем сделать это с эфирами. Вместо этого мы всегда обозначаем атомы углерода, образующие связь, цифрой 1. К каким атомам углерода присоединены наши дополнительные группы? Здесь мы видим, что метильная группа присоединена к углероду 3 в правой группе R, а атом хлора присоединен к углероду 3 в левой группе R. Поэтому эта молекула называется 3-метилбутил-3-хлорпропаноат .
Рис. 9 – 3-метилбутил 3-хлорпропаноат. Атомы углерода пронумерованы, а группы R обведены кружком, чтобы помочь вам назвать молекулу. Например, метилэтаноат обычно называют метилацетатом.
Свойства сложных эфиров
Давайте вернемся к общей структуре сложного эфира.
Рис. 10 – Общая структура сложного эфира
Он содержит карбонильную группу, двойную связь. Эта группа полярная . Кислород гораздо более электроотрицательный, чем углерод, и поэтому притягивает к себе общие пары электронов в двойной связи, становясь частично отрицательно заряженным, а углерод оставляя частично положительно заряженным. Мы представляем это с помощью дельта-символа , δ . Это формирует постоянный диполь . Из-за этого сложные эфиры испытывают постоянные диполь-дипольные силы между молекулами.
Одинарная связь в сложном эфире также полярна. Эти полярные связи влияют на свойства молекулы. Его общая полярность показана ниже.
Рис. 11 – Диполи сложного эфира
Температура плавления и кипения
Сложные эфиры имеют более высокие температуры плавления, чем аналогичные алканы, но более низкие температуры плавления, чем аналогичные спирты и карбоновые кислоты. Алканы — неполярные молекулы, поэтому единственные межмолекулярные силы, которые они испытывают, слабы.0003 силы Ван-дер-Вааля . Напротив, сложные эфиры также имеют постоянных диполь-дипольных сил между молекулами. Они намного сильнее, чем силы Ван-дер-Ваальса, и для их преодоления требуется больше энергии. Однако спирты и карбоновые кислоты также содержат водородных связи между молекулами. Это самый сильный тип межмолекулярных сил, и они придают карбоновым кислотам и спиртам гораздо более высокие точки плавления и кипения, чем сложные эфиры.
Алканы — неполярные молекулы, поэтому единственные межмолекулярные силы, которые они испытывают, слабы.0003 силы Ван-дер-Вааля . Напротив, сложные эфиры также имеют постоянных диполь-дипольных сил между молекулами. Они намного сильнее, чем силы Ван-дер-Ваальса, и для их преодоления требуется больше энергии. Однако спирты и карбоновые кислоты также содержат водородных связи между молекулами. Это самый сильный тип межмолекулярных сил, и они придают карбоновым кислотам и спиртам гораздо более высокие точки плавления и кипения, чем сложные эфиры.
Как и все молекулы, сложные эфиры с более длинной цепью имеют более высокие температуры плавления и кипения, чем сложные эфиры с более короткой цепью. Это связано с тем, что более крупные молекулы содержат больше электронов и поэтому имеют более сильные временные диполи , создающие более сильные силы Ван-дер-Ваальса между молекулами. Разветвленные эфиры имеют более низкую температуру плавления, чем эфиры с прямой цепью, поскольку разветвления означают, что молекулы не могут упаковываться вместе так плотно. Это снижает притяжение между ними.
Это снижает притяжение между ними.
В следующей таблице приведены некоторые примеры сложных эфиров, их относительные массы и точки кипения.
| Наименование | Структура | Относительная масса | Температура кипения (℃) |
| Ethyl ethanoate | 88 | 77.1 | |
| Propyl ethanoate | 116 | 122.5 | |
| Butyl butanoate | 144 | 166.0 | |
| Метилпропилбутаноат | 144 | 156,9 |
Здесь бутилбутаноат имеет более высокую относительную молекулярную массу, чем пропилпропаноат и этилпропаноат. Это означает, что у него более высокая температура кипения. Метилпропилбутаноат имеет ту же относительную массу, что и бутилбутаноат. Но поскольку он разветвлен, молекулы не могут упаковываться вместе так плотно. Это обеспечивает более низкую температуру кипения.
Это обеспечивает более низкую температуру кипения.
Растворимость
Хотя сложные эфиры не могут образовывать водородные связи друг с другом, они могут образовывать водородные связи с молекулами воды. Это потому, что у них есть неподеленная пара электронов, которая может связываться с любым из двух частично положительных атомов водорода в воде. Из-за этого сложных эфиров с более короткой цепью растворимы в воде . Однако сложные эфиры с более длинной цепью не являются таковыми. Их неполярные углеводородные цепи разрывают водородные связи, мешая соединению. Вот почему мы выливаем раствор после создания эфира в стакан с водой — эфир не растворяется, а вместо этого образует слой на поверхности воды.
Рис. 12. Водородная связь между сложным эфиром и молекулой воды, показанная пунктирной линией
Для получения дополнительной информации о водородных связях и постоянных диполь-дипольных силах см. Межмолекулярные силы .
Реакции сложных эфиров
Мы уже упоминали несколько применений сложных эфиров: в качестве отдушек, пластмасс и ароматизаторов. Их также можно найти в биодизеле, и они часто используются в качестве пластификаторов и растворителей. Чтобы сделать мыло, мы гидролизуем растительные масла. Мы рассмотрим это подробнее в Реакции сложных эфиров , но сейчас вам просто нужно знать некоторые другие реакции, в которые вовлечены сложные эфиры.
Их также можно найти в биодизеле, и они часто используются в качестве пластификаторов и растворителей. Чтобы сделать мыло, мы гидролизуем растительные масла. Мы рассмотрим это подробнее в Реакции сложных эфиров , но сейчас вам просто нужно знать некоторые другие реакции, в которые вовлечены сложные эфиры.
- Кислотный гидролиз, с образованием карбоновой кислоты и спирта. Это пример реакции нуклеофильного замещения.
- Гидролиз основания , также известный как омыление , с образованием соли карбоновой кислоты и спирта.
- Реакция растительных масел с метанолом для получения биодизеля .
- Полимеризация спиртов и карбоновых кислот с образованием полиэфира .
Сложные эфиры – ключевые выводы
Сложные эфиры получают из спиртов и карбоновых кислот и имеют общую формулу.

При наименовании сложных эфиров мы сначала называем группу R, полученную от спирта, а затем название, полученное от карбоновой кислоты. Сложные эфиры имеют суффикс — и .
Сложные эфиры содержат полярную группу и поэтому между молекулами возникают постоянные диполь-дипольные силы. Это дает им более высокие температуры кипения, чем аналогичные алканы, но более низкие температуры кипения, чем аналогичные спирты и карбоновые кислоты.
Сложные эфиры с короткой цепью растворимы в воде, а сложные эфиры с длинной цепью — нет.
Как образуются сложные эфиры? — A Plus Topper
от Veerendra
Как образуются сложные эфиры?
Что такое сложный эфир в химии?
Сложные эфиры
- Сложные эфиры представляют собой неуглеводородные органические соединения, содержащие углерода, и 9 водорода.
 0003 кислород.
0003 кислород. - Самый маленький член семейства сложных эфиров показан на фотографии.
- Фактически, сложный эфир является продуктом реакции этерификации между карбоновой кислотой и спиртом. Молекула воды удаляется, когда карбоновая кислота соединяется со спиртом с образованием сложного эфира.
- Общая формула сложных эфиров: C n H 2n+1 COOC m H 2m+1 со значениями n = 0, 1, 2, 3,… и m = 1 , 2, 3,… Значения n и m указывают количество атомов углерода в молекуле сложного эфира.
- Общая формула содержит группу –COO. Это известно как карбоксилатная группа . Это функциональная группа сложных эфиров, структура которой показана ниже.
Как назвать сложный эфир?
Наименование сложных эфиров
- Структуру сложного эфира можно рассматривать как состоящую из двух частей, одна из которых является производной спирта, а другая — карбоновой кислоты.

- Таким образом, название эфира состоит из двух частей. Сначала дается название спиртовой части сложного эфира, а за ним следует отдельное слово, дающее название кислотной части сложного эфира.
- Название спиртовой части сложного эфира представляет собой название алкильной группы (–C m H 2m+1 ) в спирте.
- Название кислотной части сложного эфира – это название карбоксилатного аниона (C n H 2n+1 –), полученного из кислоты. -овая кислота в названии исходной кислоты заменена на -оат .
- Обычно названия сложных эфиров имеют вид «алкилкарбоксилат». В следующем примере показано, как назвать сложный эфир.
Пример названия сложного эфира: Назовите сложный эфир ниже.
CH 3 COOCH 2 CH 2 CH 3
Решение:
Этап 1: Определите и назовите спиртовую часть сложного эфира.
Этап 2: Определите и назовите кислотную часть сложного эфира.
Шаг 3: Объедините две части, чтобы получить название эфира.
Название сложного эфира: пропилэтаноат
Помните: сначала указывается спиртовая часть, а затем кислотная часть. Название эфира состоит из двух отдельных слов.
Люди также спрашивают
- Что такое соединения углерода?
- Химические свойства соединений углерода
- Как образуются алканы?
- Что такое алкен в химии?
- Что такое изомерия?
- Что такое алкоголь и как его производят?
- Как образуются карбоновые кислоты?
- Что такое жиры и масла?
- Как добывают пальмовое масло?
- Заказать в гомологичной серии
- Какой мономер натурального каучука?
- Какая кислота используется для коагуляции каучука из латекса?
- Классификация углеводородов
- Что такое гомологический ряд углеводородов?
- Свойства и применение этанола
- Свойства и применение этановой кислоты
Что такое реакция этерификации?
Образование сложных эфиров
- Сложные эфиры получают реакцией этерификации .
 Реакция этерификации включает молекулу карбоновой кислоты с молекулой спирта в присутствии сильнокислотного катализатора, такого как концентрированная серная кислота, с образованием сложного эфира и воды.
Реакция этерификации включает молекулу карбоновой кислоты с молекулой спирта в присутствии сильнокислотного катализатора, такого как концентрированная серная кислота, с образованием сложного эфира и воды. - Например, молекула метановой кислоты соединяется с молекулой метанола с образованием молекулы метилметаноата и а-молекулы воды.
- С другой стороны, вода также образуется в результате реакции нейтрализации. Однако эта вода образуется из ионов; реакция между ионом водорода и гидроксид-ионом.
- Например, раствор гидроксида натрия нейтрализуют соляной кислотой с образованием хлорида натрия (соли) и воды.
- В следующем примере показано, как прогнозировать сложные эфиры, образующиеся в результате этерификации между карбоновой кислотой и спиртом.
В таблице приведены названия и структуры некоторых сложных эфиров.
Пример образования сложного эфира: Предскажите эфир, полученный в результате реакции этерификации между бутановой кислотой и этанолом, и напишите уравнение для реакции этерификации.
Решение:
Как вы делаете этилэтанолат? Эксперимент
Цель: Подготовить образец этилового спирта в лаборатории.
Материалы: Абсолютный этанол, ледяная этановая кислота, концентрированная серная кислота, масло, вода.
Аппаратура: Мензурки, перегонная колба, воронка, коническая колба, мерный цилиндр, термометр, холодильник Либиха, горелка Бунзена, штатив, штатив и зажим для реторты, пробка с двумя отверстиями, деревянный брусок.
Процедура:
- Около 50 см 3 абсолютного этанола отмеряют в стакане. Добавляют около 50 см 3 ледяной этановой кислоты и хорошо перемешивают. Эту смесь переливают в перегонную колбу.
- Около 25 см 3 абсолютного этанола отмеряют в химический стакан. Около 25 см 3 концентрированной серной кислоты медленно добавляют при встряхивании к абсолютному этанолу.
 Смесь осторожно переливают в крановую воронку.
Смесь осторожно переливают в крановую воронку. - Устройство, как показано на рисунке, настроено.
- Масляную ванну нагревают примерно до 140°C и поддерживают эту температуру на протяжении всего процесса.
- Смесь из водопроводной воронки капают в перегонную колбу с той же скоростью, с которой дистиллят собирается в конической колбе.
- Осматривают дистиллят, собранный в конической колбе.
Наблюдения:
Получают бесцветную жидкость с фруктовым запахом.
Обсуждение:
- Этановая кислота реагирует с этанолом с образованием этилэтанолата и воды.
- Концентрированная серная кислота используется в качестве катализатора и для поглощения воды, чтобы подтолкнуть реакцию к получению большего количества сложного эфира.
Вывод:
Сложный эфир получают реакцией этерификации между карбоновой кислотой и спиртом.
Физические свойства сложных эфиров
- Наиболее заметной характеристикой сложных эфиров является их запах.
 Простые эфиры представляют собой нейтральные соединения со сладким приятным запахом (фруктовым запахом).
Простые эфиры представляют собой нейтральные соединения со сладким приятным запахом (фруктовым запахом). - Эти сложные эфиры, как правило, представляют собой бесцветные жидкости с температурой кипения намного ниже, чем у карбоновых кислот аналогичной молекулярной массы; что делает их группой летучих соединений.
- Они слабо растворимы в воде , но легко растворяются в органических растворителях.
Цель: Исследовать физические свойства этилового спирта.
Материалы: Этиловый спирт, дистиллированная вода, ацетон, денатурат.
Аппаратура: Пробирка, пипетка, стеклянная палочка, бутыли для образцов.
Процедура:
- Около 2 см 3 этилового спирта наливают в пробирку. Отмечается запах эфира.
- К эфиру добавляют около 5 см 3 дистиллированной воды и смесь хорошо встряхивают.
 Отмечается растворимость эфира в воде.
Отмечается растворимость эфира в воде. - Шаги 1-2 повторяются с использованием ацетона и денатурата последовательно вместо дистиллированной воды.
Наблюдения:
- Этилэтаноат имеет фруктовый запах.
- Растворимость:
| растворитель | Наблюдение |
| Вода | |
| Ацетон |
|
| Метиловый спирт |
|
Вывод:
Этиловый спирт представляет собой бесцветную жидкость с фруктовым запахом. Он растворим в органических растворителях, но не растворяется в воде.
Встречаются ли сложные эфиры в природе?
Природные источники сложных эфиров
- Большинство простых эфиров встречаются в плода и цветка.
 Эти летучие сложные эфиры отвечают за фруктовые запахи и приятные ароматы, присущие большинству фруктов и цветов.
Эти летучие сложные эфиры отвечают за фруктовые запахи и приятные ароматы, присущие большинству фруктов и цветов.
Пример:
Банан обязан своим запахом н-пентилэтанолату. Ананас получает свой вкус от этилбутаноата. - Высшие и более сложные эфиры имеют более высокие точки кипения и, следовательно, менее летучи. Они не производят знакомых приятных запахов простых эфиров.
- Животные жиры , такие как молочный жир, представляют собой твердые сложные эфиры. Растительные масла, например пальмовое масло, представляют собой жидкие сложные эфиры. И жиры, и масла представляют собой сложные эфиры глицерина и жирных кислот.
- Воски представляют собой твердые сложные эфиры, полученные из длинноцепочечных жирных кислот и длинноцепочечных спиртов. Пчелиный воск производится из сложного эфира с формулой C 15 H 31 COOC 30 H 61 .
Для чего используются сложные эфиры?
Применение сложных эфиров в быту
- Сложные эфиры широко используются как в жизни, так и в промышленности.

- Натуральные жиры представляют собой триэфиры глицерина, которые служат запас запаса энергии в живых существах.
- Сложные эфиры, называемые парабенами, используются в качестве пищевых и лекарственных консервантов , поскольку они могут предотвращать рост микроорганизмов, таких как плесень и дрожжи.
- Листья и стебли некоторых растений покрыты воском, что помогает предотвратить как обезвоживание , так и поражение микроорганизмами. Мех животных и перья птиц также покрыты воском, чтобы оставались сухими.
- Сложные эфиры с низкой молекулярной массой представляют собой летучие жидкости со сладким запахом. Их приятный аромат делает их пригодными для приготовления косметики и парфюмерии. Эти сложные эфиры используются в качестве пищевых добавок для улучшения вкуса и запаха обработанных пищевых продуктов. Они указаны как искусственные ароматизаторы на этикетках обработанных пищевых продуктов, закусок и кондитерских изделий.

