Содержание
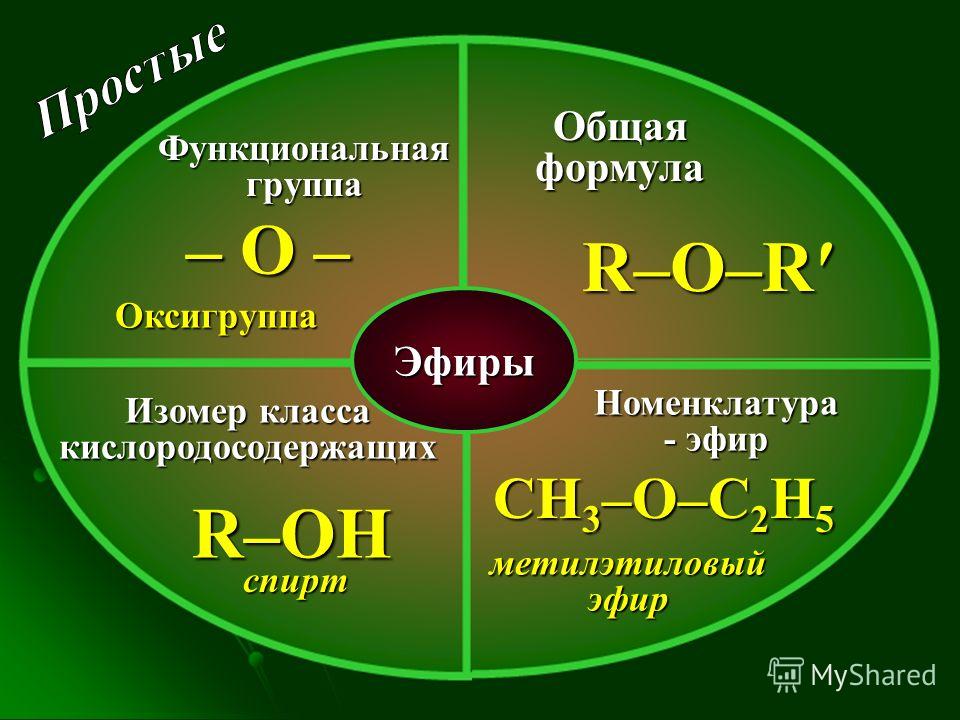
3.4 Простые эфиры
Простые
эфиры можно рассматривать как производные
спиртов и фенолов, в которых атом водорода
гидроксильной группы замещен
углеводородным остатком. Общая
формула простого эфира R–О–R1.
В тех случаях, когда с атомом кислорода
связаны различные углеводородные
остатки, простой эфир называют смешанным,
одинаковые остатки – симметричным. В
зависимости от природы углеводородного
радикада простые
эфиры подразделяются на:
По
названиям углеводородных остатков
составляют название простого эфира.
Примеры простых эфиров и их названий
приведены в таблице 14.
Таблица
14 – Классификация и номенклатура простых
эфиров
Формула | Название | Класс |
СН3–О–СН3 | диметиловый эфир метоксиметан | предельный |
С2Н5–О–С2Н5 | диэтиловый эфир этоксиэтан | предельный |
СН3–О–СН(СН3)2 | метилизопропиловый эфир 2-метоксипропан | предельный |
СН3–О–С6Н5 | метилфениловыйэфир метоксибензол анилзол | жирно-ароматический |
СН2=СН–О–С2Н5 | винилэтиловый | непредельный |
алкеноксид | циклический | |
1,4-диоксан | циклический | |
тетрагидрофуран | циклический |
Способы
получения простых эфиров
Реакция
галогенопроизводных углеводородов с
алкоголятами – реакция Вильямсона.
В
качестве алкилирующих средств в этом
синтезе могут быть использованы
алкилгалогениды и диалкилсульфаты.
Вследствие возможного протекания
конкурирующей реакции элиминирования
этот способ более пригоден для первичных
субстратов и практически не используется
для третичных:
Дегидратация
спиртов под влиянием кислот. Метод
для получения симметричных простых
эфиров из первичных спиртов или смешанных
эфиров из первичного и третичного
спиртов:
Присоединение
спиртов к алкинам
приводит к образованию виниловых
эфиров:
4.
Окисление алкенов.
Мягкое
окисление алкенов надкислотами или
кислородом в присутствии серебряного
катализатора приводит к образованию
трехчленных циклических простых эфиров
– оксиранов (эпоксидов) (часть 1, глава
8. 2).
2).
Физические
свойства простых эфиров. Неспособность
молекул простых эфиров образовывать
водородные связи делает эти соединения
более легколетучими по сравнению со
спиртами с близкой молекулярной массой.
В смесях с оксисодержащими соединениями,
в частности, с водой, простые эфиры
образуют водородные связи за счет атома
кислорода как донора пары электронов,
поэтому низшие эфиры ограниченно
растворимы в воде. Циклические простые
эфиры, имея более доступный для сольватации
атом кислорода, образуют более прочные
водородные связи, поэтому они хорошо
растворимы в воде (таблица 15).
Таблица
15 – Физические свойства простых эфиров
Формула | Название | Мол. | Температура, | Растворимость в воде г/100 г | |
плавления | кипения | ||||
Диэтиловый | 74 | –116 | 35 | 7,5 | |
Ди | 100 | –122 | 90 | 8 | |
Тетрагидрофуран | 72 | –108 | 66 | Растворим | |
Продолжение | |||||
Диоксан | 88 | 12 | 101 | Неограниченно | |
Эпоксиэтан, | 44 | –112 | 11 | Неограниченно | |
Эпоксипропан, | 58 | –112 | 34 | Растворим | |
Химические
свойства простых эфиров.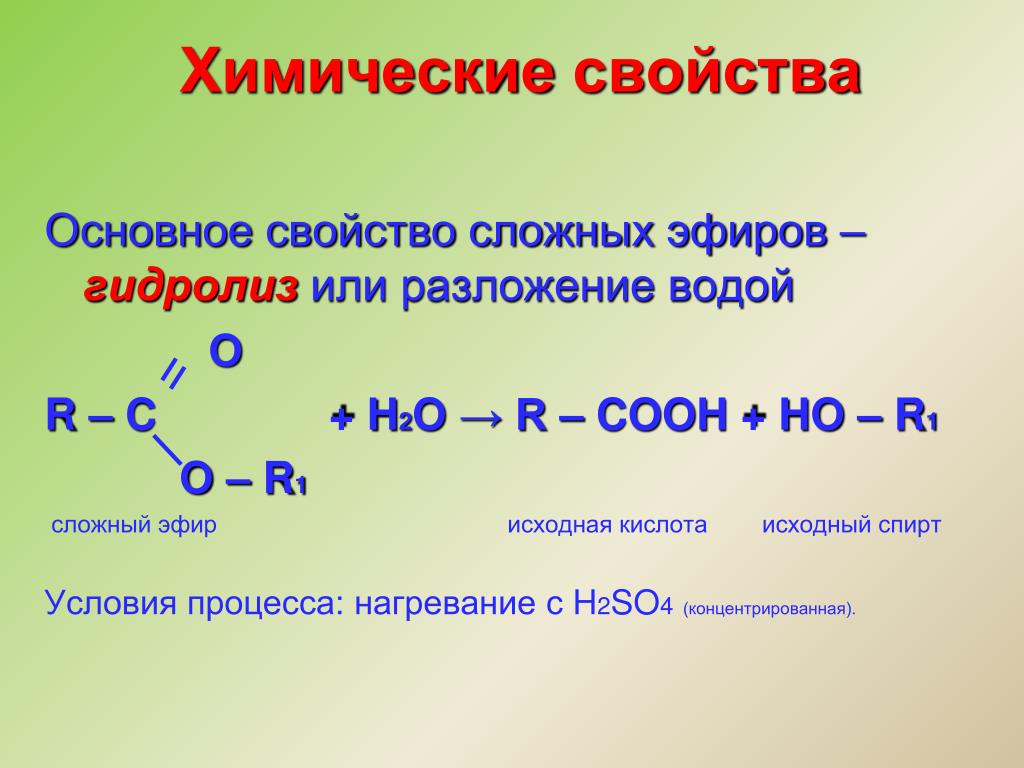 Простые
Простые
эфиры – один из немногих классов
органических соединений, обладающих
невысокой реакционной способностью. В
отличие
от спиртов простые эфиры, не имея
гидрофильного водорода, не проявляют
кислотных свойств, однако остальные
типы реакций, характерные для спиртов,
присущи и простым эфирам:
Наличие
в молекулах простых эфиров на атоме
кислорода НЭП
определяет их способность участвовать
в реакциях в качестве оснований.Вследствие
большей электроотрицательности атома
кислорода по сравнению с атомом углерода
связь Сδ+–Оδ–
в простых эфирах подобно связи С–О
в спиртах полярна. На углеродном атоме
имеется дефицит электронов, что делает
возможной нуклеофильную атаку по этому
атому с разрывом простой эфирной связи.
Однако этот процесс расщепления простого
эфира невыгоден по двум причинам:
вследствие
электронодонорных свойств углеводородных
заместителей, полярность связи С–О
невелика;алкокси-анион,
так же как и гидрокси-анион, невыгодная
уходящая группа (богата энергией),
поскольку в ней нет условий для
эффективной делокализации отрицательного
заряда.
Следовательно,
большинство простых эфиров – довольно
инертные химические соединения. Они
устойчивы к действию водных растворов
кислот, щелочей. Простые эфиры могут
расщепляться только некоторыми
реагентами, например, при нагревании с
концентрированной йодистоводородной
кислотой или под действием металлического
натрия при повышенной температуре.
1.
Основные свойства. Обладая
электронной парой на атоме кислорода,
простые эфиры могут образовывать
координационные комплексы с различными
протонными или апротонными кислотами.
Однако поскольку атом кислорода обладает
довольно высокой электроотрицательностью
и стерически мало доступен, он является
слабым донором электронной пары.
Вследствие этого простые эфиры – слабые
основания. Они могут образовывать соли
только с сильными кислотами (Н–кислоты
и кислоты Льюиса) и в отсутствие воды.
1.1
Взаимодействие с концентрированной
серной кислотой.
Простые эфиры протонируются, давая
растворы оксониевых солей:
В водной среде
оксониевые соли легко гидролизуются,
регенерируя при этом исходные эфир и
кислоту.
1.2
Взаимодействие с кислотами Льюиса.
Эфиры посредством семиполярной связи
образуют комплексы:
2.
Реакции нуклеофильного замещения.
Необходимыми условиями для расщепления
простой эфирной связи является наличие
сильного нуклеофила и перевод
алкокси-аниона в выгодную уходящую
группу. Последнее может быть достигнуто,
если SN
реакцию
осуществлять с оксониевой солью эфира,
т. е. в присутствии сильной кислоты.
Реакция
SN
у
простых эфиров идет еще труднее, чем у
спиртов, т. к. группа RO
–
является плохой уходящей группой. Однако
в кислой среде в результате протонирования
по кислороду она превращается в несколько
лучшую уходящую группу ROH
и нуклеофильное замещение становится
возможным.
Природа
углеводородного радикала определяет
в таких случаях, какой из механизмов –
SN1
или SN2
–
реализуется, причем закономерности
здесь такие же, как в случае алкилгалогенидов.
В качестве кислот, катализирующих
реакции нуклеофильного замещения
простых эфиров, обычно используют HI,
H2SO4,
НВr.
В
данном случае образуется исключительно
фенол, так как связь
прочнее по сравнению,
и последняя разрывается легче.
3.
Отщепление (элиминирование)
для
простых эфиров, аналогично спиртам,
можно осуществить действием сильных
кислот, в частности, серной кислоты:
Реакции
простых эфиров Е2
типа
можно осуществить действием очень
сильных оснований, в частности,
алкилпроизводных щелочных металлов:
3. 1
1
Расщепление простых эфиров при высоких
темепратурах активными металлами
(Шорыгин,
1910 г.):
4.
Окисление
простых
эфиров идет легко по С–Н
связи кислородом воздуха на
свету, поэтому
их хранят в темных (светонепроницаемых)
емкостях. При длительном хранении в
присутствии кислорода воздуха на свету
у алифатических эфиров происходит
свободнорадикальный процесс окисления,
приводящий к образованию неустойчивых
пероксидов.
Автоокисление
эфиров протекает у α-углеродного
атома, поскольку в качестве интермедиатов
в этом случае выступают свободные
радикалы, стабилизированные делокализацией
неспаренного электрона с участием НЭП
атома кислорода:
Триплетный кислород | Синглетный кислород |
Работа
с простыми эфирами, не освобожденными
от перекисей, требует особой осторожности.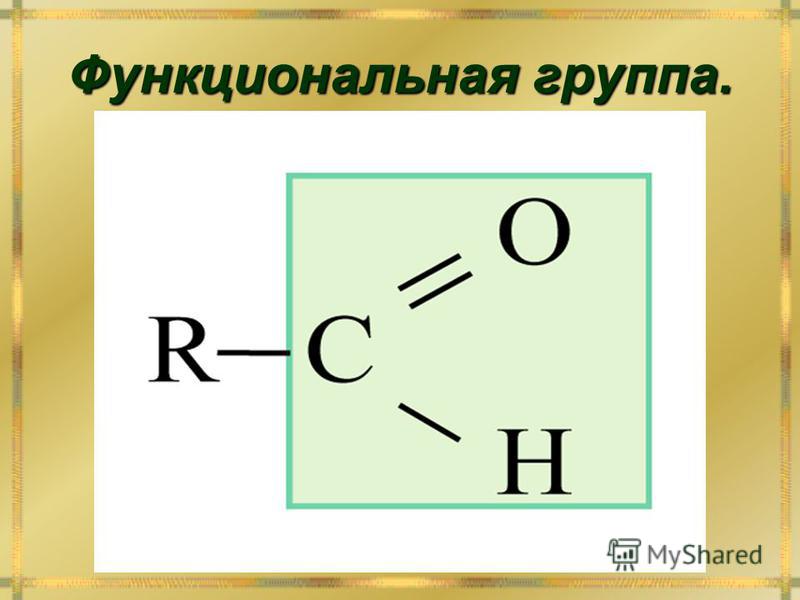
Остаток после перегонки может содержать
опасные в отношении взрыва концентрации
перекисей. Эфиры, очищенные от перекисей,
хранят, как правило, над металлическим
натрием или гидридом кальция.
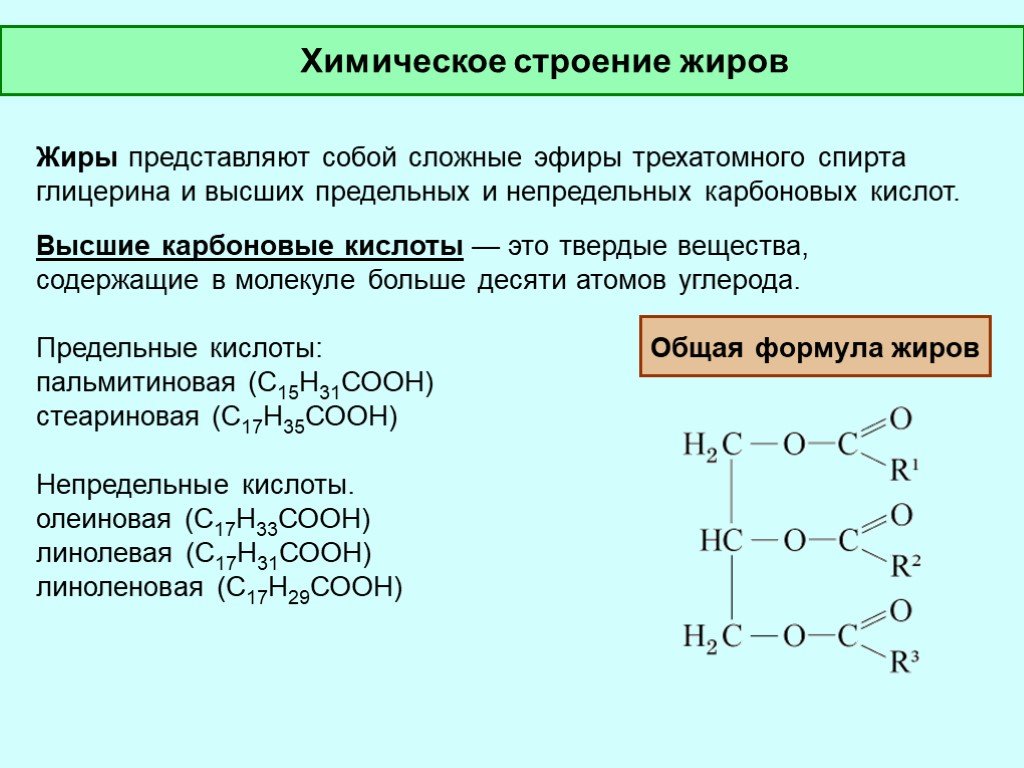
Контрольная работа по органической химии для 10 класса на тему «Сложные эфиры и жиры»
Органическая химия 10 класс
Контрольная работа по теме «Сложные эфиры и жиры».
Вариант 1.
Часть А
А1. Общая формула сложных эфиров:
а) RCHO; б)
RCOOH; в) RCH₂OH; г)
RCOOR.
А2. К сложным эфирам относится:
а) глицерин;
б) этилацетат; в) диэтиловый эфир; г) метилэтиловый эфир.
А3. Реакция между муравьиной кислотой и этанолом
называется реакцией:
а) гидролиза;
б) этерификации; в) омыления; г) поликонденсации.
А4. Укажите вещество, которое может реагировать с
гидроксид₃ом калия:
а) этан; б)
этиловый эфир уксусной кислоты; в) этанол; г) ацетон.
А5. Жиры – это сложные эфиры:
а) этанола и
минеральных кислот; б) глицерина и минеральных кислот; в) этанола и высших
карбоновых кислот; г) глицерина и высших карбоновых кислот.
А6. RCOOR – это общая формула:
а) карбоновых
кислот; б) простых эфиров; в) спиртов; г) сложных эфиров.
А7. К сложным эфирам не относится:
а)
метилацетат; б) этиловый эфир уксусной кислоты; в) этилформиат; г)
метилэтиловый эфир.
А8. Продуктами реакции этерификации являются;
а) альдегид и
вода; б) простой эфир и вода; в) сложный эфир и вода; г) карбоновая
кислота и спирт.
А9. В результате кислотного гидролиза сложного
эфира образуются:
а) карбоновая
кислота и спирт; б) карбоновая кислота и альдегид; в) соль карбоновой
кислоты и спирт; г) простой эфир и спирт.
А10. Для приготовления маргарина жидкие масла
подвергают:
а)
гидрированию; б) галогенированию; в) гидролизу; г) пиролизу.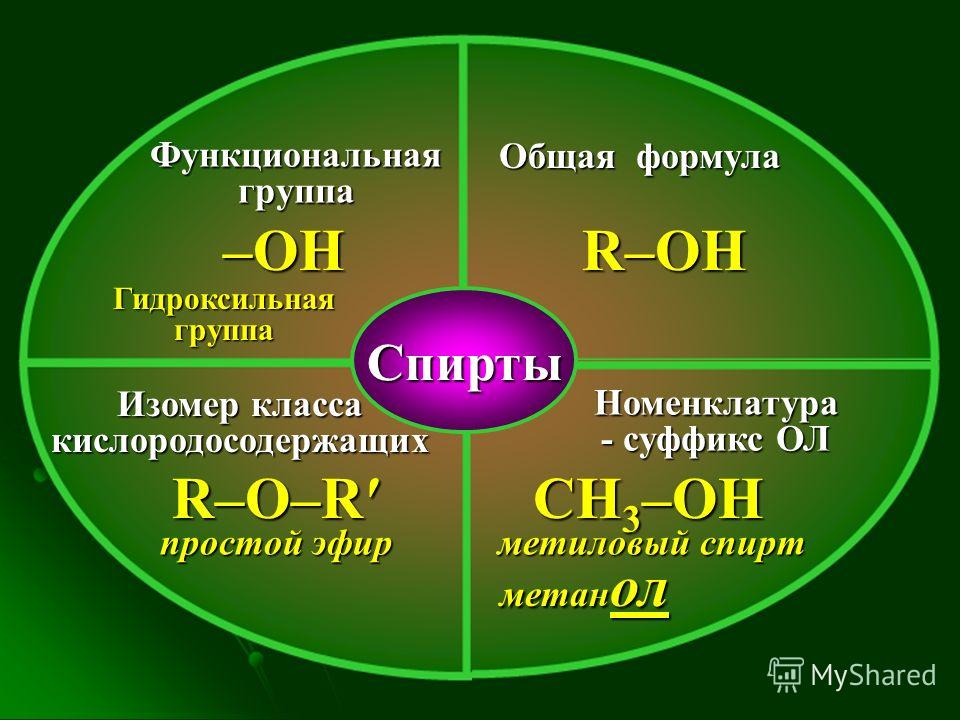
Часть В
В1.Верны ли следующие суждения?
А. Мыла – это
соли, обычно магниевые и кальциевые, высших карбоновых кислот.
Б. Одна из функций
жира в организме – энергетическая.
А. Верно только
А; б) верно только Б; в) верны оба суждения; г) оба суждения не верны.
В2. Верны ли следующие суждения?
А. Твёрдые мыла –
это натриевые, а жидкие мыла – это калиевые соли высших карбоновых кислот.
Б. Жиры, жидкие при
комнатной температуре, как правило, легче воды, в воде не растворимы,
растворимы в органических растворителях.
а) верно только А;
б) верно только Б; в) верны оба суждения; г) оба суждения неверны.
Часть С
С1. Определите количества веществ метилового
спирта и уксусной кислоты, необходимые для получения 148г метилового эфира
уксусной кислоты с выходом 80%.
С2. Определите массу мыла, которую можно получить
при действии избытка гидроксида натрия на 2,67
кг тристеарата глицерина , если выход реакции омыления составил 70%.
Органическая
химия 10 класс
Контрольная
работа по теме «Сложные эфиры и жиры».
Вариант 2.
Часть А
А1. Вещество, формула которого CH₃―CH₂―CH₂―COO―CH₃, относится к:
а) кетонам;
б) сложным эфирам; в) карбоновым кислотам; г) простым эфирам.
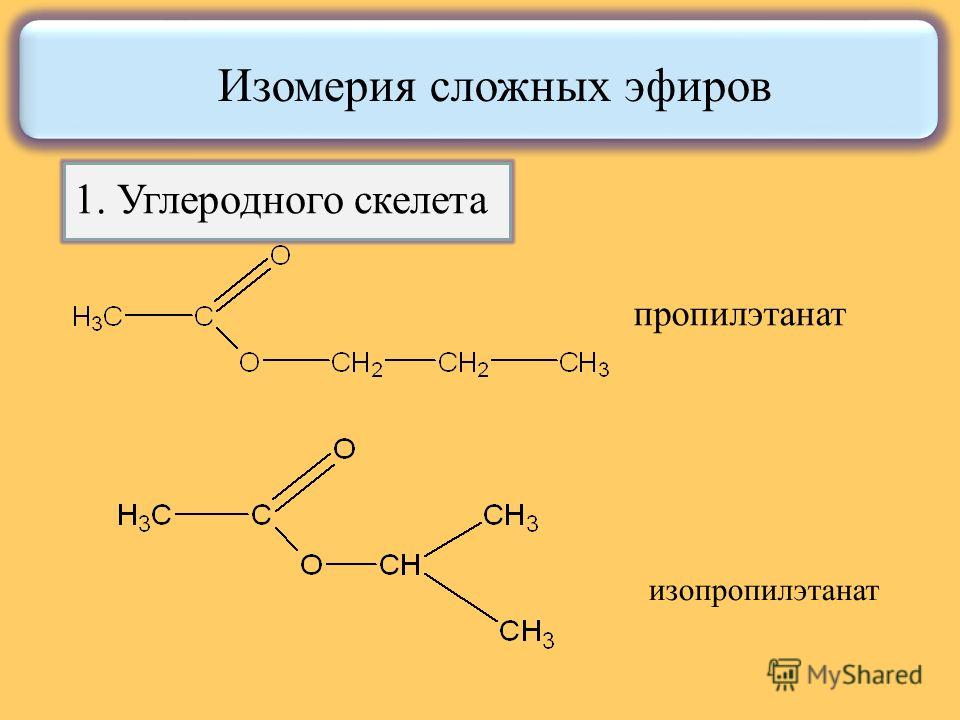
А2. Пропионовая кислота и метилацетат являются:
а) изомерами
углеродного скелета; б) гомологами; в) одним и тем же веществом;
г) межклассовыми
изомерами.
А3. При взаимодействии карбоновых кислот и
спиртов образуются:
а) сложные
эфиры; б) простые эфиры; в) углеводы; г) аминокислоты.
А4. Продуктами омыления сложного эфира в
нейтральной среде являются:
а) карбоновая
кислота и спирт; б) карбоновая кислота и альдегид; в) соль карбоновой
кислоты и альдегид; г) соль карбоновой кислоты и алкоголят.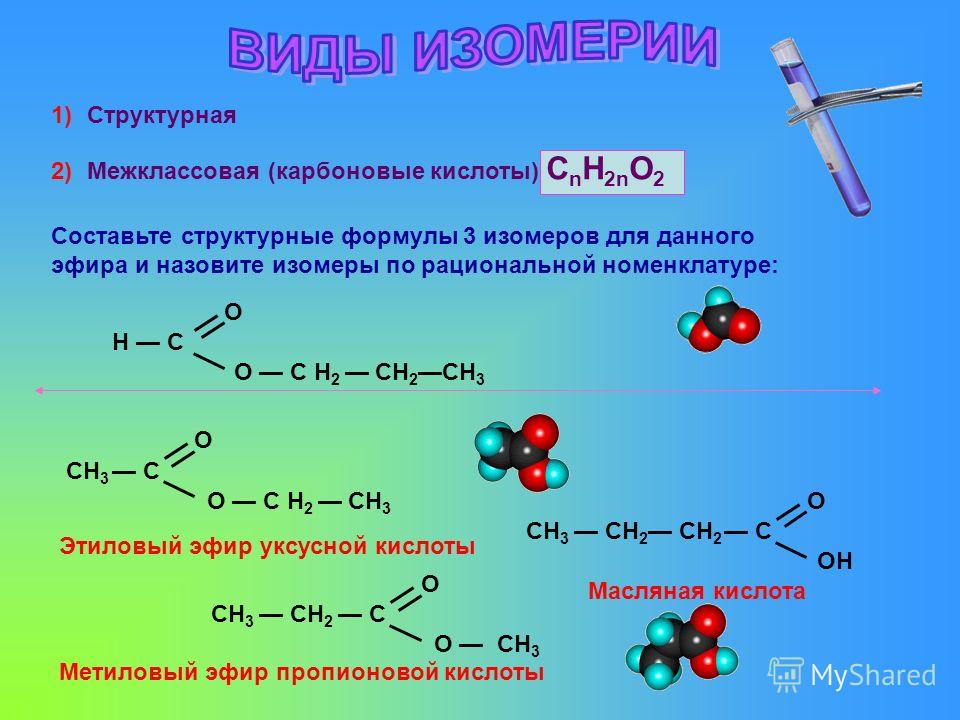
А5. Жидкие растительные жиры (масла) можно
превратить в твёрдые в результате:
а)
дегидрирования; б) окисления; в) гидрирования; г) гидратации.
А6. Вещество состава C₃H₆O₂ может быть отнесено к классу:
а) предельных
двухатомных спиртов; б) кетонов; в) сложных эфиров; г) простых эфиров.
А7. Сколько изомеров, принадлежащих к классу
карбоновых кислот, имеет метиловый эфир пропионовой кислоты?
а) два; б)
четыре; в) шесть; г) один.
А8. Сложный эфир можно получить взаимодействием:
а) этанола и
пропанола; б) метаналя и этанола; в) метановой кислоты и этанола; г)
глицерина и натрия.
А9. При щелочном гидролизе сложного эфира
образуются:
а) соль
карбоновой кислоты и спирт; б) карбоновая кислота и спирт; в) соль карбоновой
кислоты и алкоголят; г) карбоновая кислота и альдегид.
А10. В результате гидрирования жидких жиров
образуются:
а) твёрдые
жиры; б) твёрдые жиры и предельные кислоты; в) твёрдые жиры и
глицерин; г) твёрдые жиры и непредельные кислоты.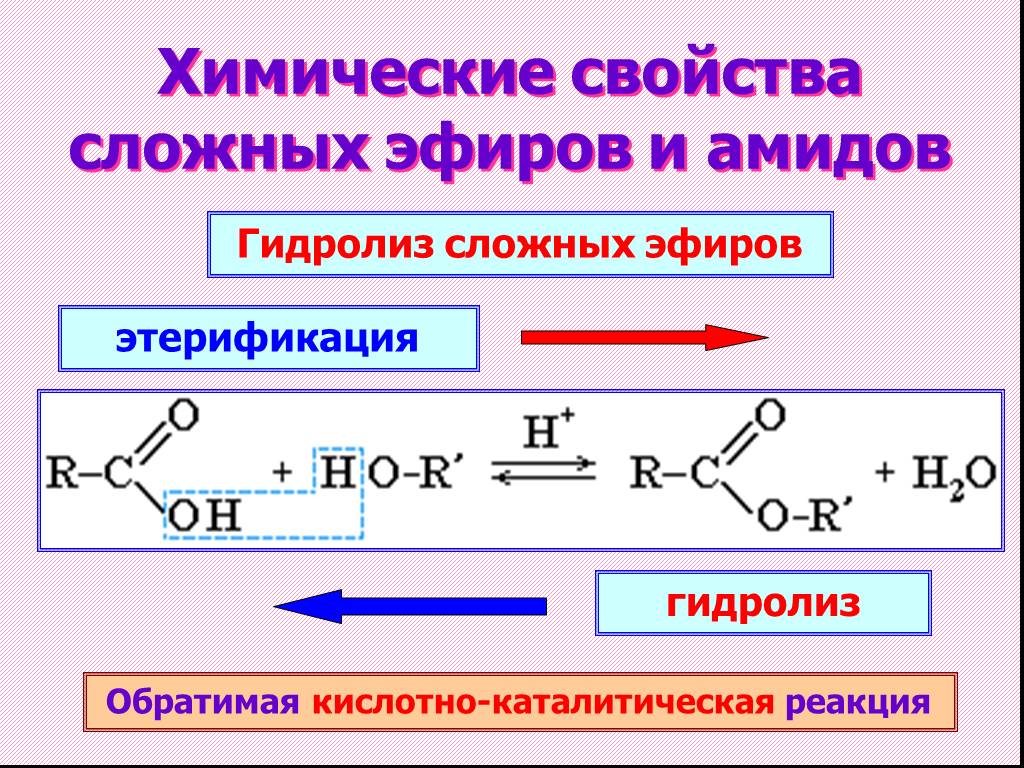
Часть В
В1. Верны ли следующие суждения?
А. Жиры являются
важной составной частью пищи человека и животных.
Б. Синтетические
моющие средства не сохраняют моющее действие в жёсткой воде и в кислых
растворах.
а) верно только
А; б) верно только Б; в) верны оба суждения; г) оба суждения неверны.
В2. Верны ли следующие суждения?
А. В жёсткой воде
часть мыла расходуется на взаимодействие с ионами кальция и магния.
Б. При щелочном
гидролизе жиров образуются глицерин и мыла.
а) верно только
А; б) верно только Б; в) верны оба суждения; г) оба суждения неверны.
Часть С
С1. Какую массу этилацетата можно получить при
взаимодействии этанола массой 1,61 г и уксусной кислоты массой1,80 г? Массовая
доля выхода эфира равна 75%.
С2. Определите объём водорода (н. у.), который
надо взять для получения 1,78 кг маргарина из триолетата глицерина, если для
полного проведения реакции следует брать тройное количество водорода.
Контрольная
работа по теме «Сложные эфиры и жиры».
Ответы на задания части А
Задание Вариант | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
1 | г | б | б | б | г | г | г | в | а | а |
2 | б | г | а | а | в | в | а | в | а | а |
Ответы на задания части В
Вариант | Номер | Задание | Ответ |
1. |
| В1. | б |
|
| В2. | в |
2. |
| В1. | а |
|
| В2. | в |
Ответы на
задания с развёрнутым ответом Часть С
Вариант 1.
С1. CH₃OH
+ CH₃COOH ↔ CH₃COOCH₃ + H₂O
ɳ(эфира)=mпракт./mтеорет.
·100%. mтеорет = mпракт. / ɳ ·100%.
/ ɳ ·100%.
mтеорет.(
CH₃COOCH₃)=148/0,8=185г.
n(CH₃COOCH₃)=185г/74г/моль=2,5моль.
n(CH₃OH) = n(CH₃COOH) = n(CH₃COOCH₃) = 2,5 моль.
С2. М(тристеарата) = 890г/моль,
М(C17H35COONa) =
306 г/моль.
n(тристеарата) = m/М
= 2670/890 = 3,0 моль.
CH₂―O―CO― C17H35
CH₂―O―H
|
|
CH―O―CO―
C17H35 + 3NaOH → CH₂―O―H + 3C17H35COONa
|
|
CH₂―O―CO― C17H35
CH₂―O―H
Из уравнения видно,
что
n(C17H35COONa) =
3n(тристеарата) = 9,0 моль.
mтеор.(C17H35COONa) =
n·М = 9·306 = 2754 г.
mпракт.(C17H35COONa) = η· mтеор.(C17H35COONa) = 0,7·2754 = 1928
г.
Вариант 2
С1. C₂H₅OH + CH₃COOH ↔ CH₃COOC₂H₅
+ H₂O
n(C₂H₅OH)
= 1,61г/46 г/моль = 0,035 моль.
n(CH₃COOH) = 1,80г/60г/моль = 0,03 моль.
n(C₂H₅OH)
: n(CH₃COOH)
1 моль : 1 моль
(по уравнению реакции)
0,035 моль : 0,03
моль (недостаток). Решаем по недостатку т. е. по уксусной кислоте.
n(CH₃COOC₂H₅)
= n(CH₃COOH) = 0,03 моль.
mтеорет.(CH₃COOC₂H₅)=
n(CH₃COOC₂H₅)
·М(CH₃COOC₂H₅)=0,03
моль · 88 г/моль =2,64г
ɳ(эфира)=mпракт./mтеорет.
·100%. mтеорет = mпракт./ ɳ ·100%.
mпракт.(CH₃COOC₂H₅)=
mтеорет. · 75% /100 =2,64 ·75%/100=1,98г.
С2. М(тристеарата) = 890г/моль,
n(тристеарата) = m/М
=1780/890 = 2,0 моль.
CH₂―O―CO― C17H33
CH₂―O―CO―C 17H 35
|
|
CH―O―CO―
C17H33 + 3H₂
→ CH₂―O―CO―C17H35
|
|
CH₂―O―CO― C17H33
CH₂―O― CO―C17H35
Из уравнения видно,
что
n(H₂) = 3n(тристеарата) = 6,0 моль.
С учётом того, что
следует брать тройное количество водорода:
n(H₂) = 18,0 моль и V(H₂) = n·VМ = 18·22,4 = 403
л.
Ответы на
задания с развёрнутым ответом Часть С
Вариант 1.
С2. М(тристеарата) = 890г/моль,
М(C17H35COONa) =
306 г/моль.
n(тристеарата) = m/М
= 2670/890 = 3,0 моль.
CH₂―O―CO― C17H35
CH₂―O―H
|
|
CH―O―CO―
C17H35 + 3NaOH → CH₂―O―H + 3C17H35COONa
|
|
CH₂―O―CO― C17H35
CH₂―O―H
Из уравнения видно,
что
n(C17H35COONa) =
3n(тристеарата) = 9,0 моль.
mтеор.(C17H35COONa) =
n·М = 9·306 = 2754 г.
mпракт. (C17H35COONa) = η· mтеор.(C17H35COONa) = 0,7·2754 = 1928
(C17H35COONa) = η· mтеор.(C17H35COONa) = 0,7·2754 = 1928
г.
Вариант 2.
С2. М(тристеарата) = 890г/моль,
n(тристеарата) = m/М
=1780/890 = 2,0 моль.
CH₂―O―CO― C17H33
CH₂―O―CO―C 17H
35
|
|
CH―O―CO―
C17H33 + 3H₂ → CH₂―O―CO―C17H35
|
|
CH₂―O―CO― C17H33
CH₂―O― CO―C17H35
Из уравнения видно,
что
n(H₂) = 3n(тристеарата) = 6,0 моль.
С учётом того, что
следует брать тройное количество водорода:
n(H₂) = 18,0 моль и V(H₂) = n·VМ = 18·22,4 = 403
л.
Разница между эфиром и кетоном
Ключевое различие между эфиром и кетоном заключается в том, что эфир содержит две алкильные группы, связанные с одним и тем же атомом кислорода, тогда как кетон содержит атом кислорода, связанный с атомом углерода двойной связью. .
Эфиры и кетоны являются органическими соединениями. Оба этих соединения имеют атомы C, H и O в своей молекулярной структуре. Однако, определив их функциональные группы, можно отличить простой эфир от кетона.
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2. Что такое эфир
3. Что такое кетон
4. Сравнение бок о бок – эфир и кетон в табличной форме
5. Резюме
Что такое эфир?
Эфир представляет собой органическое соединение, имеющее химическую формулу R-O-R. Здесь группы R могут быть либо алкильными, либо арильными группами. Если алкильные или арильные группы одинаковы по обе стороны от атомов кислорода, то это симметричный эфир. Если они разные, то это несимметричный эфир.
Здесь группы R могут быть либо алкильными, либо арильными группами. Если алкильные или арильные группы одинаковы по обе стороны от атомов кислорода, то это симметричный эфир. Если они разные, то это несимметричный эфир.
Рисунок 01: Общая структура эфира
Химическая связь C-O-C с валентным углом 110° определяет характеристики эфира. Следовательно, он действует как функциональная группа. Гибридизация каждого углерода этой функциональной группы представляет собой sp 3 .
Поскольку атом кислорода более электроотрицателен, чем атом углерода, альфа-водород эфира является более кислым по сравнению с углеводородом. Это означает, что атом водорода, связанный с атомом углерода и примыкающий к связи C-O-C, легко освобождается от протона. Однако он менее кислый, чем карбонильные соединения, такие как кетоны.
Эфиры не могут образовывать водородные связи друг с другом. Это приводит к более низким температурам кипения, поскольку между его молекулами нет сильных сил взаимодействия. Однако они могут образовывать водородные связи с молекулами воды, потому что у атома кислорода есть неподеленные электронные пары. А также простые эфиры слабополярны из-за валентного угла связи C-O-C.
Однако они могут образовывать водородные связи с молекулами воды, потому что у атома кислорода есть неподеленные электронные пары. А также простые эфиры слабополярны из-за валентного угла связи C-O-C.
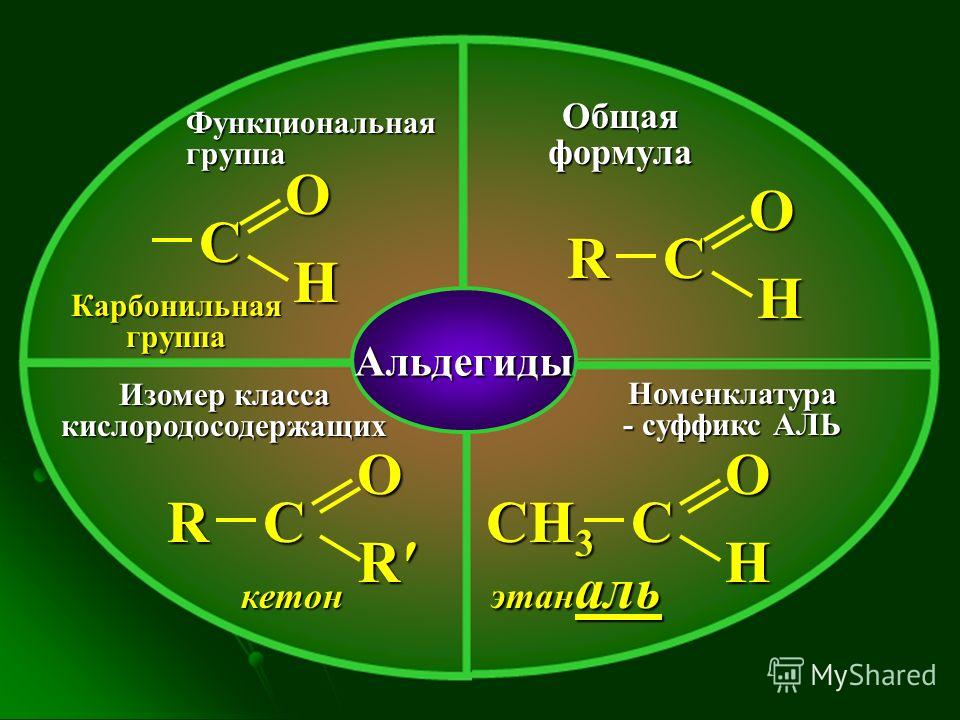
Что такое кетон?
Кетон представляет собой органическую молекулу, имеющую химическую формулу R-C-(=O)R. Здесь связь между атомом кислорода и атомом углерода представляет собой двойную связь. Группы R обозначают алкильные или арильные группы. Центральный атом углерода вместе с атомом кислорода с двойной связью образует карбонильную группу. Этот атом углерода имеет sp 2 гибридизированный.
Рисунок 02: Общая структура кетона
Кроме того, связь -C=O здесь сильно полярна. Следовательно, кетоны представляют собой полярные молекулы. Атом кислорода притягивает электроны связи между этой связью C и O из-за его высокой электроотрицательности. Тогда атом углерода получает частичный положительный заряд из-за недостатка электронов. А атом кислорода получает частичный отрицательный заряд.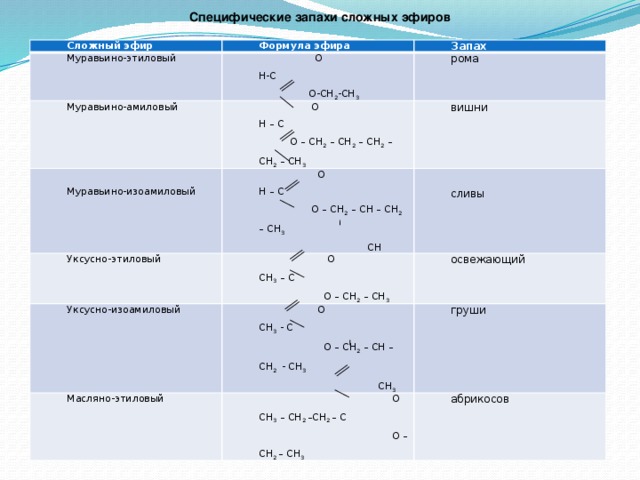 Следовательно, этот атом кислорода вызывает образование водородных связей между кетонами и молекулами воды. Таким образом, кетоны смешиваются с водой.
Следовательно, этот атом кислорода вызывает образование водородных связей между кетонами и молекулами воды. Таким образом, кетоны смешиваются с водой.
Кроме того, атом углерода карбонильной группы подвержен атаке со стороны нуклеофилов. Нуклеофил – это соединение, богатое электронами. Поскольку атом углерода карбонильной группы частично заряжен положительно, нуклеофил может взаимодействовать с атомом углерода. Следовательно, кетоны вступают в реакции нуклеофильного присоединения.
В чем разница между эфиром и кетоном?
Эфир против кетона | |
| Эфир представляет собой органическое соединение, содержащее две алкильные группы, связанные с одним и тем же атомом кислорода. | Кетон представляет собой органическое соединение, содержащее атом кислорода, связанный с атомом углерода двойной связью. |
| Химическая формула | |
| Р-О-Р | RC-(=O)R |
| Функциональная группа | |
К-О-К. | -С(=О)-. |
| Кислотность альфа-углеродов | |
| Менее кислый, чем кетон, но более кислый, чем углеводороды. | Более кислотный, чем эфиры. |
| Гибридизация углерода | |
| Гибридизация углерода в связи C-O-C: sp 3 . | Гибридизация углерода в карбонильной группе: sp 2 . |
Резюме – Эфир против кетона
Эфиры и кетоны являются органическими молекулами. Обе эти молекулы содержат атомы C, H и O. Разница между эфиром и кетоном заключается в том, что эфир содержит две алкильные группы, связанные с одним и тем же атомом кислорода, тогда как кетон содержит атом кислорода, связанный с атомом углерода двойной связью.
Ссылка:
1. «Эфир». Википедия, Фонд Викимедиа, 14 апреля 2018 г. Доступно здесь
2. «Кетон». Википедия, Фонд Викимедиа, 14 апреля 2018 г. Доступно здесь
Изображение предоставлено:
(Общественное достояние) через Commons Wikimedia
2. «Кетоновая группа-2D-скелет» (общественное достояние) через Commons Wikimedia
«Кетоновая группа-2D-скелет» (общественное достояние) через Commons Wikimedia
Структура эфиров: формула, свойства, примеры
- Автор
Сушмита Рут - Последнее изменение 19-07-2022
Структура эфиров: Знаете ли вы, что водители гоночных автомобилей используют метил-трет-бутиловый эфир (МТБЭ) для увеличения скорости своих автомобилей? МТБЭ помогает более эффективно сжигать бензин, увеличивая мощность двигателя автомобиля. Но65 его использование прекращается из-за опасений по поводу загрязнения питьевой воды из-за протекающих топливных баков, содержащих это соединение.
Эфир — это органическое соединение, в котором две углеводородные группы (алкильная или арильная) связаны с одним и тем же атомом кислорода. Эфир представлен общей формулой \(\rm{R−O−R}’\), как показано ниже.
\(\rm{R}’\) в формуле означает, что углеводородная группа может быть такой же, как \(\rm{R}\), или может быть другой.
Названия простых эфиров
Этапы присвоения названий простым эфирам перечислены ниже:
- В системе IUPAC простые эфиры называются алкоксизаместителями (\(—\rm{OR} =\) алкоксигруппа).
 -ильное окончание алкильных заместителей заменено на -окси. Например, -\(\rm{CH}_3\) метил в виде -\(\rm{O CH}_3\) метокси, -\(\rm{CH}_2 \rm{CH}_3\) этил в виде -\ (\rm{OCH}_2 \rm{CH}_3\) этокси.
-ильное окончание алкильных заместителей заменено на -окси. Например, -\(\rm{CH}_3\) метил в виде -\(\rm{O CH}_3\) метокси, -\(\rm{CH}_2 \rm{CH}_3\) этил в виде -\ (\rm{OCH}_2 \rm{CH}_3\) этокси. - Исходное соединение определяется словом эфир , которое появляется в конце названия.
- Названия каждой алкильной группы предшествуют слову эфир. Если две алкильные группы одинаковы, используется префикс – к . Если две алкильные группы различны, они перечислены в алфавитном порядке.
- Пробелы оставляются между названиями алкильных групп (если они различаются) и перед словом эфир .
Изучение концепций экзамена на Embibe
Ниже показаны два примера простых эфиров с их названиями IUPAC.
Диэтиловый эфир также может называться этоксиэтаном. Метилпропиловый эфир также называют \(1-\) метоксипропаном
Изучите физические свойства эфиров здесь
Структура эфиров
Эфиры получают, когда атом водорода гидроксильной группы в спиртах заменяется алкильная или арильная группа. Например-
Например-
Гибридизация
93\) гибридизация, ожидаемая форма эфиров должна быть тетраэдрической с валентным углом \(109,28\)’. В эфирах из-за отталкивания между двумя неподеленными парами (lp) на атоме кислорода эфиры имеют изогнутую форму.
Валентный угол: Наличие объемных групп на обоих концах атома кислорода создает стерические затруднения. Это приводит к отталкиванию между парами связей (bp), которое больше, чем отталкивание \(\rm{lp-lp}\). Это \(\rm{bp-bp}\) отталкивание приводит к \(\rm{C-O-C}\) валентному углу около \(111,7°\).
Длина связи: Расстояние связи \((\rm{C–O})\) в эфирах составляет около \(140\,\rm{pm}\). Барьер вращения вокруг связей \(\rm{C–O}\) низкий.
Полярность связи: Поскольку связь \(\rm{C-O-C}\) имеет изогнутую форму, диполи связи \(\rm{C–O}\) не компенсируются. Это делает эфиры полярными. Простые эфиры более полярны, чем алкены, но не так полярны, как спирты, сложные эфиры или амиды сопоставимой структуры.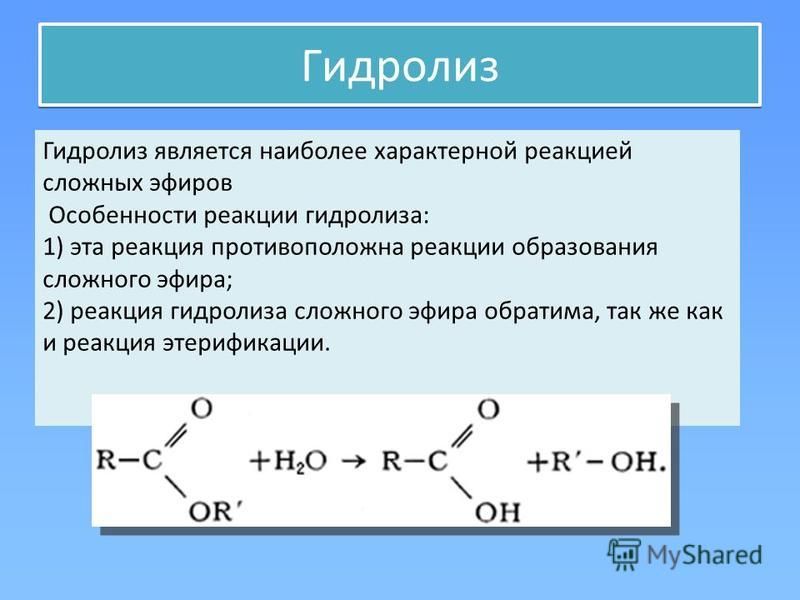 Наличие двух неподеленных пар электронов у атомов кислорода делает возможным образование водородных связей с молекулами воды. Циклические эфиры, такие как тетрагидрофуран и \(1,4-\)диоксан, смешиваются с водой из-за более открытого атома кислорода для водородной связи по сравнению с линейными алифатическими эфирами.
Наличие двух неподеленных пар электронов у атомов кислорода делает возможным образование водородных связей с молекулами воды. Циклические эфиры, такие как тетрагидрофуран и \(1,4-\)диоксан, смешиваются с водой из-за более открытого атома кислорода для водородной связи по сравнению с линейными алифатическими эфирами.
Кислотность: Связывание кислорода в эфирах, спиртах и воде аналогично. Кислород более электроотрицательный, чем углерод; таким образом, атомы водорода в альфа-положении к атому кислорода простых эфиров более кислые, чем в простых углеводородах. Они гораздо менее кислотны, чем атомы водорода в альфа-положении к карбонильным группам (например, в кетонах или альдегидах).
Классификация: В зависимости от групп при \(\rm{R}\) и \(\rm{R′}\) эфиры подразделяются на два типа:
1. Простые эфиры или симметричные эфиры: В этих эфирах атом кислорода связан с одними и теми же алкильными группами. Например:
2. Смешанные эфиры или асимметричные эфиры: В этих эфирах атом кислорода связан с двумя разными алкильными группами. Например-
Смешанные эфиры или асимметричные эфиры: В этих эфирах атом кислорода связан с двумя разными алкильными группами. Например-
Свойства эфиров
Растворимость : Эфиры также хорошо растворимы в воде. Это связано с тем, что неподеленная пара электронов на атоме кислорода эфира образует водородную связь с атомами водорода молекул воды. Растворимость выше для простых эфиров с меньшей длиной групп R. По мере того как углеродные цепи становятся длиннее, ван-дер-ваальсовы взаимодействия расширенной углеродной цепи преобладают над водородными связями.
Точка кипения : Точки кипения простых эфиров намного ниже, чем у аналогичных им спиртов. Из-за отсутствия слабых межмолекулярных водородных связей температуры кипения простых эфиров намного ближе к соответствующим им алканам.
Использование : Эфир использовался в качестве общего анестетика для пациентов, перенесших операции в течение многих лет.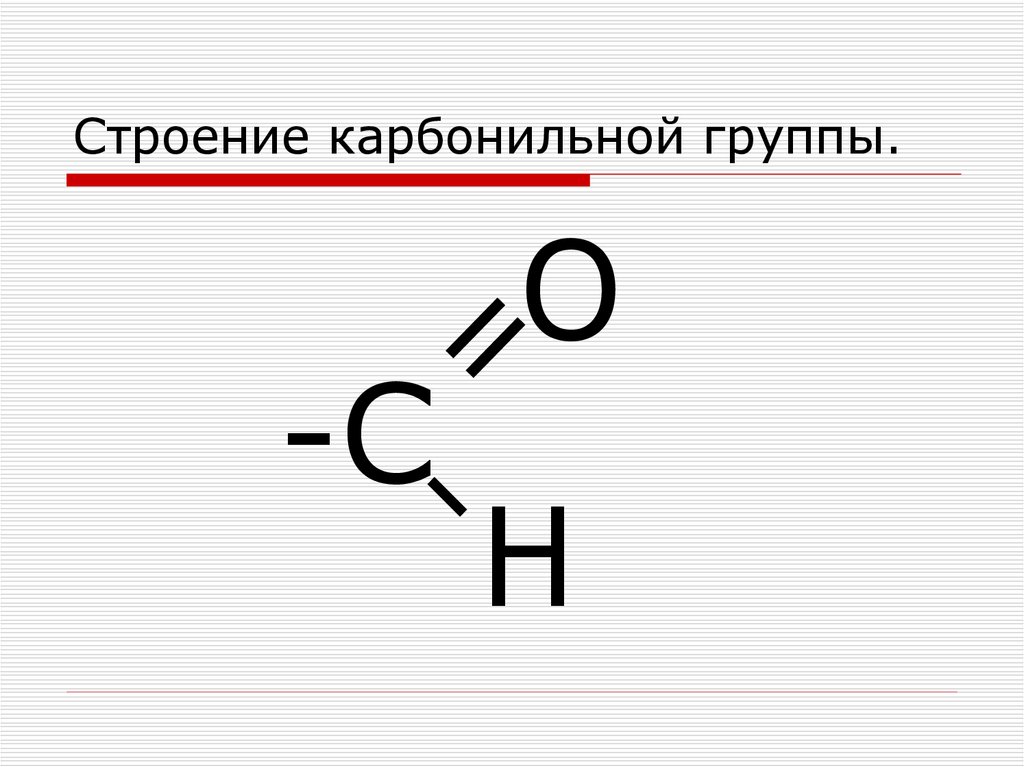 Однако эфиры очень легко воспламеняются и имеют нежелательные побочные эффекты, такие как тошнота и рвота. В настоящее время эфиры в основном используются в качестве растворителя для других органических соединений.
Однако эфиры очень легко воспламеняются и имеют нежелательные побочные эффекты, такие как тошнота и рвота. В настоящее время эфиры в основном используются в качестве растворителя для других органических соединений.
Вопросы для практического экзамена
Структура спиртов Фенолы и эфиры
Спирт, фенол и эфир представляют собой классы органических соединений, которые находят широкое применение в различных отраслях промышленности и в быту.
- Спирт образуется, когда насыщенный атом углерода связан с гидроксильной группой \((-\rm{OH}\)) группой.
- Фенол образуется при замещении атома водорода в молекуле бензола на гидроксильную группу \((-\rm{OH}\)) 9o\) немного больше тетраэдрического угла из-за отталкивающего взаимодействия между двумя объемными \((–\rm{R})\) группами. Длина связи \(\rm{C–O}\) \((141\,\rm{pm})\) почти такая же, как и в спиртах.
Резюме
Простые эфиры представляют собой соединения, в которых атом кислорода зажат между двумя одинаковыми или разными алкильными группами.
 В этой статье мы узнали структуру, номенклатуру и свойства эфира. Мы также узнали, чем эфир отличается от аналогичных ему спиртов и алканов.
В этой статье мы узнали структуру, номенклатуру и свойства эфира. Мы также узнали, чем эфир отличается от аналогичных ему спиртов и алканов.Попытка пробных тестов
Часто задаваемые вопросы о структуре эфиров
Q.1. Является ли эфир углеводородом?
Ответ: Эфир — это углеводород, представленный общей формулой \(\rm{R−O−R’}\). \(\rm{R’}\) в формуле означает, что углеводородная группа может быть такой же, как \(\rm{R}\), или может быть другой.Q.2. Каковы правила именования эфиров?
Ответ: Правила наименования эфира:- Исходное соединение эфира состоит из слова эфир , которое появляется в конце названия.
- Названия каждой алкильной группы стоят перед словом эфир. Если две алкильные группы одинаковы, используется префикс – к . Если две алкильные группы различны, они перечислены в алфавитном порядке.

- Пробелы оставляются между названиями алкильных групп (если они различаются) и перед словом эфир .
- В системе ИЮПАК простые эфиры называются алкоксизаместителями \((—\rm{OR} =\) алкоксигруппа). -ильное окончание алкильных заместителей заменено на -окси. Например, \(—\rm{CH}_3\) метил в виде \(—\rm{OCH}_3\) метокси, \(—\rm{CH}_2 \rm{CH}_3\) этил в виде \(— \rm{OCH}_2 \rm{CH}_3\) этокси. Например, диэтиловый эфир – этоксиэтан, этилфениловый эфир – этоксибензол
Q.3. Каковы характеристики эфира?
Ответ: 1. Эфиры хорошо растворимы в воде.
2. Температуры кипения простых эфиров намного ниже, чем температуры кипения их изомерных спиртов, и намного ближе к аналогичным им алканам.
3. Эфиры летучи и легко воспламеняются.Q.4. Как определить эфир?
Ответ: Тест Фейгла: Возьмите \(1 – 2\,\rm{мл}\) неизвестного соединения в кипящую пробирку и закройте горлышко пробирки фильтровальной бумагой, смоченной смесью раствора ацетата меди и бензидина гидрохлорида.



 -ильное окончание алкильных заместителей заменено на -окси. Например, -\(\rm{CH}_3\) метил в виде -\(\rm{O CH}_3\) метокси, -\(\rm{CH}_2 \rm{CH}_3\) этил в виде -\ (\rm{OCH}_2 \rm{CH}_3\) этокси.
-ильное окончание алкильных заместителей заменено на -окси. Например, -\(\rm{CH}_3\) метил в виде -\(\rm{O CH}_3\) метокси, -\(\rm{CH}_2 \rm{CH}_3\) этил в виде -\ (\rm{OCH}_2 \rm{CH}_3\) этокси. В этой статье мы узнали структуру, номенклатуру и свойства эфира. Мы также узнали, чем эфир отличается от аналогичных ему спиртов и алканов.
В этой статье мы узнали структуру, номенклатуру и свойства эфира. Мы также узнали, чем эфир отличается от аналогичных ему спиртов и алканов.