Содержание
404 Cтраница не найдена
Размер:
AAA
Изображения
Вкл.
Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
404 Cтраница не найдена
Размер:
AAA
Цвет:
C
C
C
Изображения
Вкл.
Выкл.
Обычная версия сайта
Контакты
Версия для слабовидящих
Версия для слабовидящих
+7 (81664) 40429
Областное государственное бюджетное профессиональное образовательное учреждение
«Боровичский автомобильно-дорожный колледж»
- Сведения об образовательной организации
- Основные сведения
- Структура и органы управления образовательной организацией
- Документы
- Образование
- Образовательные стандарты и требования
- Руководство. Педагогический состав
- Места осуществления образовательной деятельности
- Материально-техническое обеспечение и оснащённость образовательного процесса
- Платные образовательные услуги
- Стипендии и меры поддержки обучающихся
- Финансово-хозяйственная деятельность
- Вакантные места для приёма (перевода) обучающихся
- Доступная среда
- Международное сотрудничество
- Поступающим
- Образец заявления и согласия на обработку персональных данных
- Правила приема в образовательную организацию
- Информация для поступления лиц с инвалидностью и ОВЗ
- Условия приема на обучение по договорам об оказании платных образовательных услуг
- Перечень специальностей, требования к уровню образования
- Вступительные испытания
- Особенности проведения вступительных испытаний для инвалидов и лиц с ограниченными возможностями здоровья
- Информация о возможности приема заявлений и необходимых документов в электронной форме
- Медицинские осмотры
- Общее количество мест для приема по каждой специальности
- Правила подачи и рассмотрения апелляций по результатам вступительных испытаний
- Информация о наличии общежития и количество мест в общежитии
- Образец договора об оказании платных образовательных услуг
- Информация о начале учебного года
- Приказ о зачислении поступающих
- Списки абитуриентов, рекомендованных к зачислению в ОГБПОУ «БАДК»
- Режим работы приемной комиссии
- Стандарты ФГОС
- Презентация БАДК
- СМИ о нас
- Мероприятие для школьников в рамках деловой программы V Регионального чемпионата «Молодые профессионалы» (WorldSkills Russia)
- Дополнительное образование
- Сведения о ходе приема
- Рейтинг аттестатов
- Студентам
- Промежуточная аттестация
- Расписание экзаменов
- Расписание
- График учебного процесса
- Доверяем вместе!
- Дистанционное обучение
- График пересдачи задолженностей
- График дежурства учебных групп
- График приема отчетов (дневников) по практикам за 2020/2021 учебный год
- Ресурс «Персональныеданные.
 Дети»
Дети» - Список кураторов учебных групп
- Порядок постинтернатного сопровождения
- Персональные данные (видеоролик)
- График проведения родительских собраний в 1 семестре
- Содействие трудоустройству
- График посещения кураторами студентов, проживающих в общежитиях колледжа
- Доп. материалы
- Новости
- Противодействие коррупции
- Планирование на месяц
- Одаренная молодежь
- Независимая оценка
- Готов к труду и обороне
- Противодействие наркомании
- Объекты соц.
 инфраструктуры
инфраструктуры - Электронные образовательные ресурсы
- Обратная связь
- Родителям
- Поиск
- Методические материалы по признакам девиаций, действиям специалистов системы образования в ситуациях социальных рисков и профилактике девиантного поведения обучающихся
- Наставничество
- Доступная среда
- Пожарная безопасность
- Памятка безопасного поведения на дорогах
- Хотите быть в курсе новостей Новгородской области?
- Бесплатная юридическая помощь
- Безопасность на железной дороге
- Горячая линия в системе СПО
- Памятка по профилактике новой коронавирусной инфекции
- Контакты
- Галерея славы
- WorldSkills Russia
- Демонстрационный экзамен
- RuTube
- ВКонтакте
- Реализация основных профессиональных образовательных программ с помощью электронного обучения и дистанционных образовательных технологий
- Запущена «горячая линия»
- Мастерские 2019
- Работа в России
- В помощь выпускнику в 2022 году
- Воспитание
- Содействие трудоустройству
- Доступная среда
- Студенческий спортивный клуб
- Реализация своего потенциала на максимум
- Направления и результаты научной (научно-исследовательской) деятельности и научно-исследовательской базе для ее осуществления
- ОГБПОУ «БАДК» —
- ›
- Реализация основных профессиональных образовательных программ с помощью электронного обучения и дистанционных образовательных технологий
- ›
- Прищепова Ю.
 А.
А.
эфиров | Введение в химию |
Цель обучения
- Дать определение термину «эфир» применительно к органическим соединениям
Ключевые моменты
- Эфиры имеют относительно низкие температуры кипения из-за их неспособности образовывать водородные связи друг с другом.
- Из-за разницы в электроотрицательности атомов кислорода и углерода эфира молекула слегка полярна.
- Хотя в целом они имеют низкую реакционную способность, две неподеленные пары электронов на атоме кислорода действительно придают молекуле эфира некоторую реакционную способность; молекула эфира вступает в реакцию с сильными кислотами и служит основанием Льюиса.
Термины
- амид Любое производное оксокислоты, в котором гидроксильная группа заменена аминогруппой или замещенной аминогруппой; особенно такие производные карбоновой кислоты, как карбоксамиды.

- алкенНенасыщенный алифатический углеводород с одной или несколькими двойными углерод-углеродными связями.
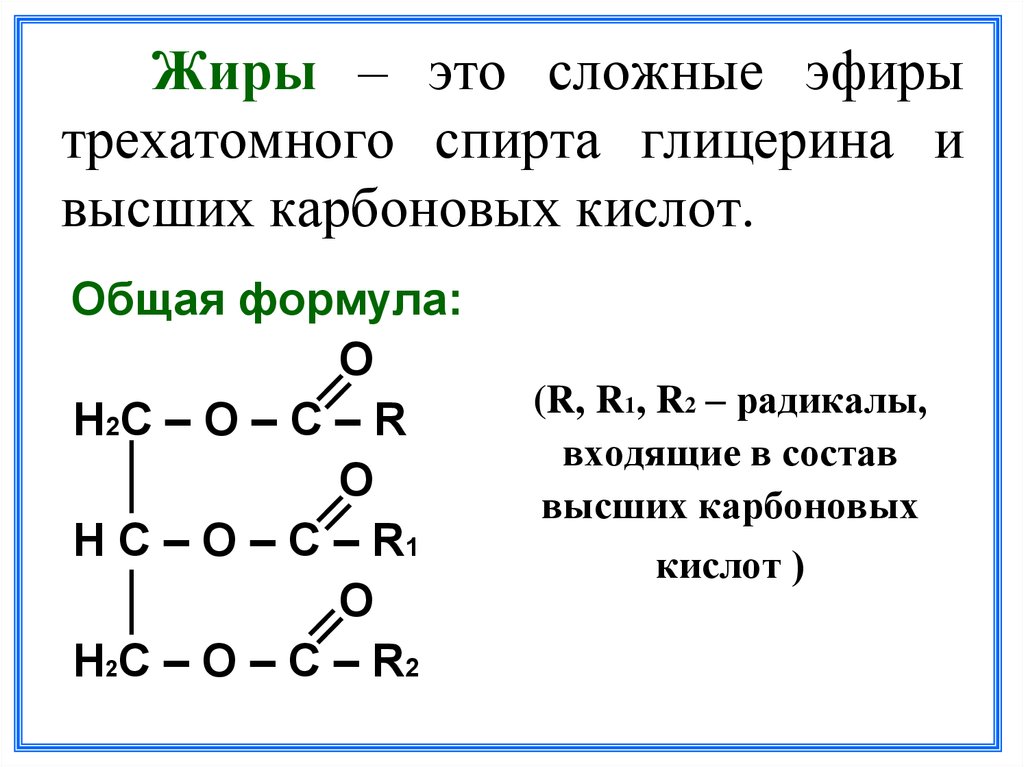
- сложный эфирСоединение, чаще всего образующееся при конденсации спирта и кислоты с удалением воды. Он содержит функциональную группу C=O, присоединенную через углерод к другому атому кислорода.
- эфирСоединение, содержащее атом кислорода, связанный с двумя углеводородными группами.
Структура эфиров
Эфиры — класс органических соединений, содержащих эфирную группу. Эфирная группа представляет собой атом кислорода, соединенный с двумя алкильными или арильными группами. Они следуют общей формуле R-O-R’. Связь С-О-С характеризуется валентными углами 104,5 градуса, а расстояние С-О составляет около 140 пм. Кислород эфира более электроотрицательный, чем углерод. Таким образом, альфа-водороды более кислые, чем в обычных углеводородных цепях.
Эфиры Общая структура эфира. Эфир характеризуется кислородом, связанным с двумя алкильными или арильными группами, представленными здесь R и R’. Заместители могут быть, но не обязательно, одинаковыми.
Заместители могут быть, но не обязательно, одинаковыми.
Номенклатура эфиров
Есть два способа назвать эфиры. Самый распространенный способ — идентифицировать алкильные группы по обе стороны от атома кислорода в алфавитном порядке, а затем написать «эфир». Например, этилметиловый эфир представляет собой эфир, который имеет этильную группу и метильную группу по обе стороны от атома кислорода. Если две алкильные группы идентичны, эфир называют ди[алкиловым] эфиром. Например, диэтиловый эфир представляет собой эфир с этильной группой по обе стороны от атома кислорода.
Другим способом обозначения эфиров является формальный метод ИЮПАК. Таким образом, форма имеет вид: [короткая алкильная цепь][окси][длинная алкильная цепь]. Например, название IUPAC для этилметилового эфира будет метоксиэтаном.
В циклических эфирах основа соединения известна как оксациклоалкан. «Окса» является индикатором замены углерода кислородом в кольце. Примером является оксациклопентан, пятичленное кольцо, в котором четыре атома углерода и один атом кислорода.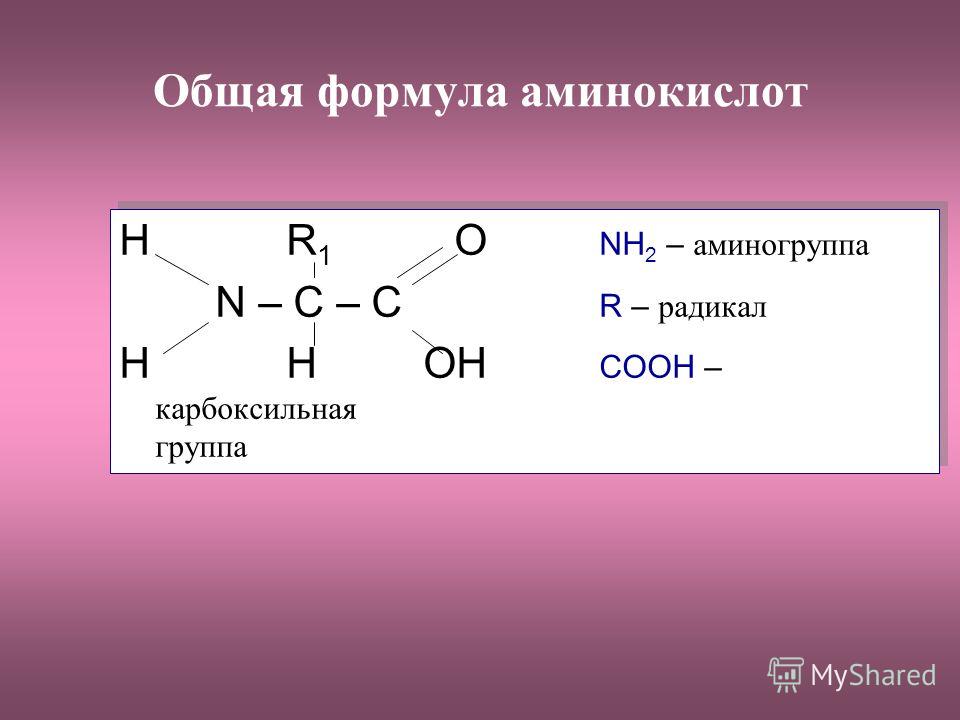
Тетрагидрофуран (ТГФ) Общее название циклического эфира «оксациклопентана» — тетрагидрофуран или ТГФ. Это обычный органический растворитель, который смешивается с водой.
Свойства эфиров
Эфиры довольно неполярны из-за наличия алкильной группы по обе стороны от центрального кислорода. Наличие примыкающих к нему объемных алкильных групп означает, что атом кислорода в значительной степени не способен участвовать в образовании водородных связей. Следовательно, эфиры имеют более низкую температуру кипения по сравнению со спиртами аналогичной молекулярной массы. Однако по мере того, как алкильная цепь простых эфиров становится длиннее, разница в температурах кипения становится меньше. Это связано с эффектом увеличения ван-дер-ваальсовых взаимодействий по мере увеличения числа атомов углерода и, следовательно, увеличения количества электронов. Две неподеленные пары электронов, присутствующие на атомах кислорода, позволяют эфирам образовывать водородные связи с водой.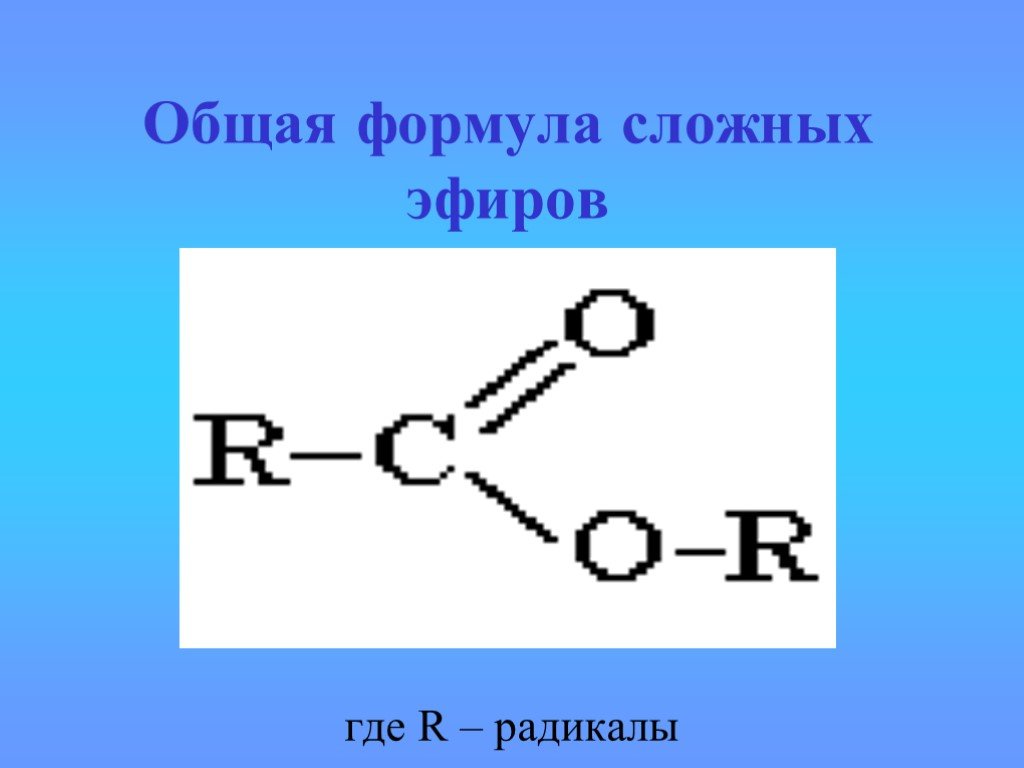 Простые эфиры более полярны, чем алкены, но не так полярны, как сложные эфиры, спирты или амиды сопоставимых структур.
Простые эфиры более полярны, чем алкены, но не так полярны, как сложные эфиры, спирты или амиды сопоставимых структур.
Реакции
Эфиры имеют относительно низкую химическую активность, но они все же более реакционноспособны, чем алканы. Хотя они устойчивы к гидролизу, они часто расщепляются кислотами, что приводит к образованию алкилгалогенида и спирта. Эфиры имеют тенденцию образовывать перекиси в присутствии кислорода или воздуха. Общая формула R-O-O-R’. Простые эфиры могут служить основаниями Льюиса и Бренстеда, служащими для отдачи электронов в реакциях или принятия протонов. Эфиры можно получить в лаборатории путем дегидратации спиртов (2R-OH → R-O-R + H 2 O при высокой температуре), нуклеофильное замещение алкилгалогенидов алкоксидами (R-ONa + R’-X → R-O-R’ + NaX) или электрофильное присоединение спиртов к алкенам (R 2 C=CR 2 + R-OH → R 2 CH-C(-O-R)-R 2 ) .
Show Sources
Безграничная проверка и отбор высококачественного контента с открытой лицензией со всего Интернета.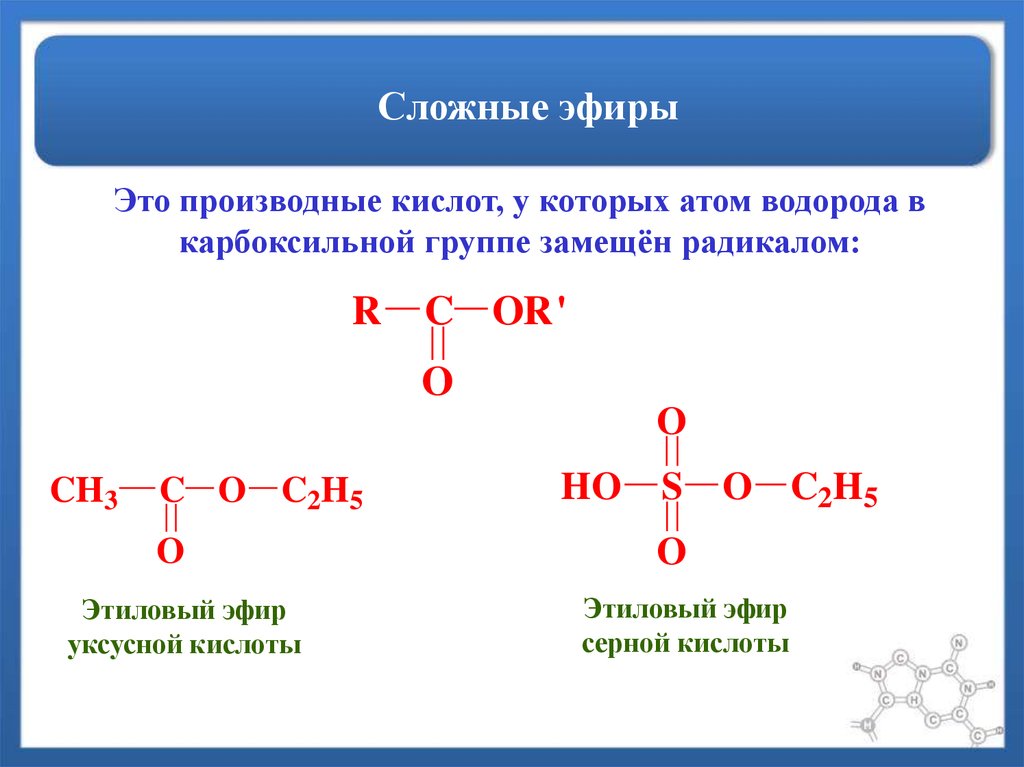 Данный конкретный ресурс использовал следующие источники:
Данный конкретный ресурс использовал следующие источники:
«Безграничный».
http://www.boundless.com/
Безграничное обучение
CC BY-SA 3.0.
«эфир».
http://en.wiktionary.org/wiki/ether
Викисловарь
CC BY-SA 3.0.
«амид».
http://en.wiktionary.org/wiki/amide
Викисловарь
CC BY-SA 3.0.
«эфир».
http://en.wiktionary.org/wiki/ester
Викисловарь
CC BY-SA 3.0.
«алкен».
http://en.wiktionary.org/wiki/alkene
Викисловарь
CC BY-SA 3.0.
«Эфиры».
http://en.wikipedia.org/wiki/Ethers
Wikipedia
CC BY-SA 3.0.
«тетрагидрофуран».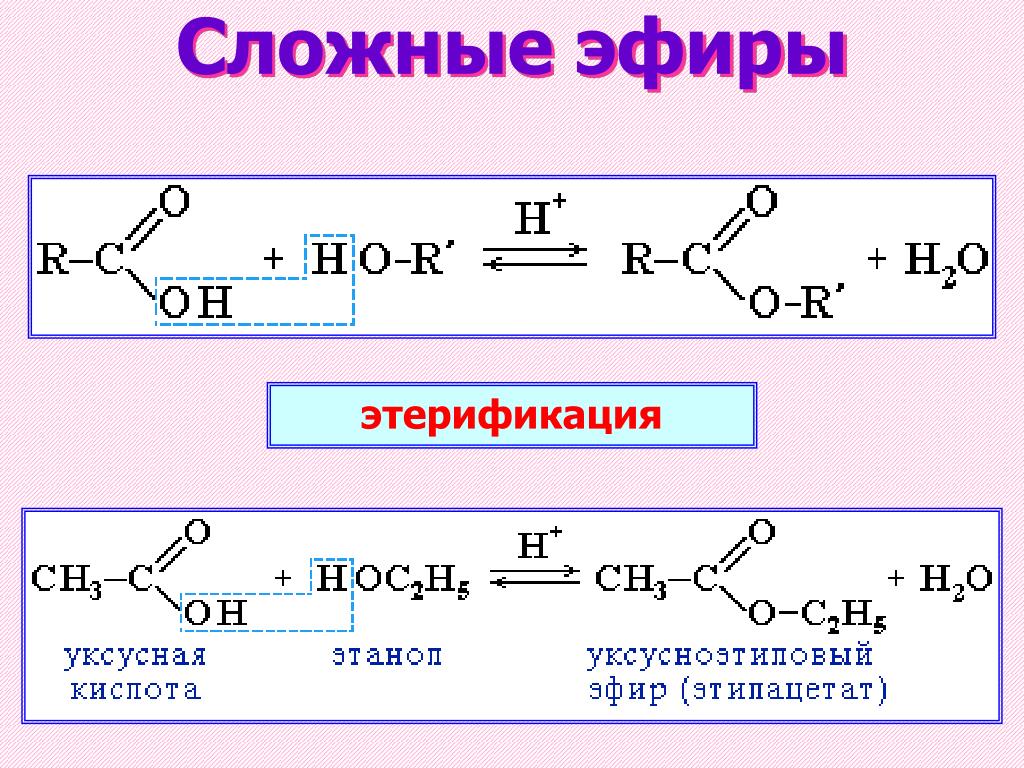
http://en.wikipedia.org/wiki/Тетрагидрофуран
википедия
CC BY-SA 3.0.
«Эфир-(общий)».
http://en.wikipedia.org/wiki/File:Ether-(general).png
Википедия
Общественное достояние.
Лицензии и атрибуции
Лицензионный контент CC, ранее опубликованный
- Boundless Chemistry. Предоставлено : Безграничное обучение. Лицензия : CC BY-SA: Attribution-ShareAlike
Разница между эфиром и кетоном
Основное отличие — эфир против кетона
Эфиры и кетоны — это две разные группы органических соединений. Они имеют разные химические и физические свойства. Но оба эти соединения в основном состоят из атомов C, H и O. Для идентификации этих соединений используют их функциональные группы. Другими словами, кетон можно отличить от эфира, идентифицируя их функциональные группы.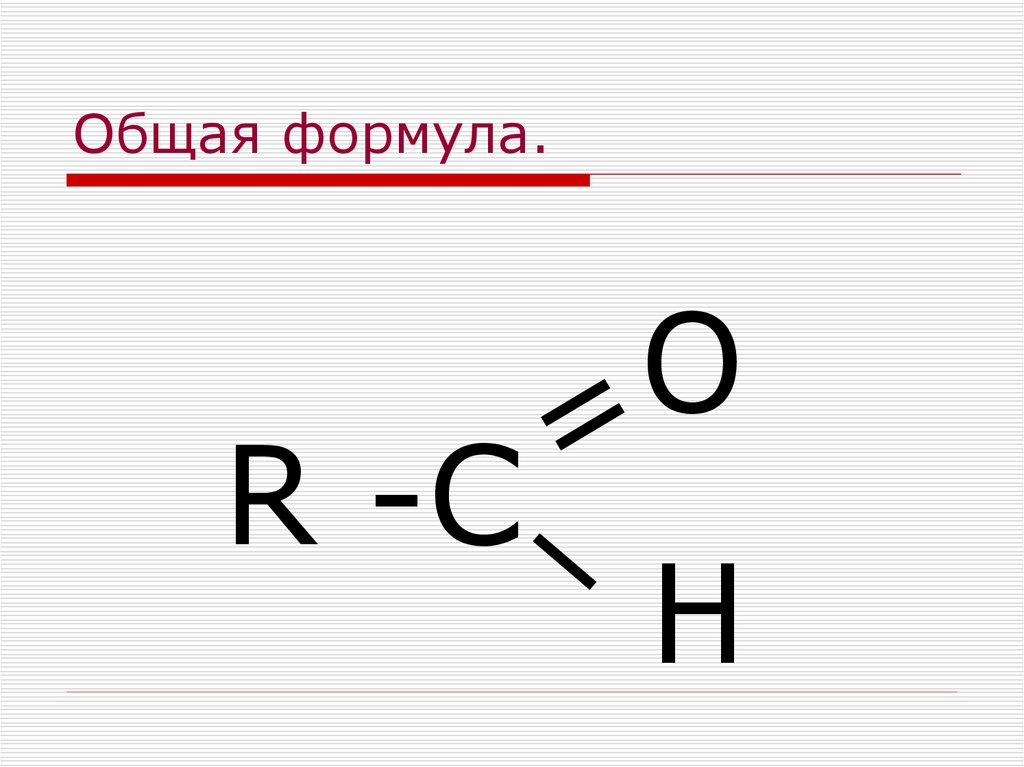 Функциональная группа — это группа атомов, которая определяет химические свойства молекулы. Мы можем определить разницу между эфиром и кетоном по их функциональным группам. Основное различие между эфиром и кетоном состоит в том, что функциональная группа простого эфира состоит из двух атомов углерода, связанных с одним и тем же атомом кислорода, тогда как функциональная группа кетона состоит из атома кислорода, связанного с атомом углерода двойной связью.
Функциональная группа — это группа атомов, которая определяет химические свойства молекулы. Мы можем определить разницу между эфиром и кетоном по их функциональным группам. Основное различие между эфиром и кетоном состоит в том, что функциональная группа простого эфира состоит из двух атомов углерода, связанных с одним и тем же атомом кислорода, тогда как функциональная группа кетона состоит из атома кислорода, связанного с атомом углерода двойной связью.
Ключевые области, охватываемые
1. Что является Ether
— Определение, свойства и общие реакции эфиров
2. Что является кетоном
— Определение, Propertes и Common Reactions of Ketnes
888888 — Определение, Properties и Common Reactions of KETONES 333388888 — Определение, Properties и Common Reactions of KETONE
— Определение, Propertes и Common Reactions of KETONE
— Определение.0084 3. В чем разница между эфиром и кетоном
В чем разница между эфиром и кетоном
– Сравнение основных различий
Ключевые термины: эфир, функциональная группа, кетон
Что такое эфир
Простые органические соединения Р’. Здесь атом кислорода связан с двумя алкильными или арильными группами. Это означает, что атом кислорода по существу связан с двумя атомами углерода. Наличие этой структуры C-O-C указывает на присутствие эфирной группы. Следовательно, он действует как функциональная группа эфира. Эта функциональная группа определяет химические свойства и реакции, которым подвергаются эфиры.
Рисунок 1: Диэтиловый эфир
При комнатной температуре эфиры представляют собой жидкости со сладким запахом. Молекулы эфира не могут образовывать водородные связи, потому что нет групп –ОН, поскольку атом кислорода связан с двумя другими атомами углерода. Это делает эфиры более низкими точками кипения, чем у соответствующих спиртов и других органических соединений. Поэтому эфиры очень летучи и легко воспламеняются. Эфиры также менее растворимы в воде по той же причине. Но атом кислорода молекулы эфира имеет неподеленные электронные пары, а атомы водорода молекул воды имеют частичный положительный заряд. Поэтому эфиры могут образовывать водородные связи с молекулами воды.
Поэтому эфиры очень летучи и легко воспламеняются. Эфиры также менее растворимы в воде по той же причине. Но атом кислорода молекулы эфира имеет неподеленные электронные пары, а атомы водорода молекул воды имеют частичный положительный заряд. Поэтому эфиры могут образовывать водородные связи с молекулами воды.
Хотя функциональная группа эфира инертна по отношению к большинству химических реакций, существуют некоторые общие реакции, в которые могут вступать эфиры. Эта инертность полезна при использовании их в качестве растворителей. Наиболее распространенным типом реакции, которую демонстрируют эфиры, является реакция расщепления. Здесь одна связь С-О расщепляется сильными кислотами. Кроме того, в присутствии воздуха и кислорода эфиры образуют взрывоопасные перекиси.
Что такое кетон
Кетон представляет собой органическое соединение, имеющее общую формулу R-C (=O)-R’. Здесь атом кислорода связан с атомом углерода двойной связью. Этот атом углерода снова связан с двумя другими алкильными или арильными группами. Эта структура действует как функциональная группа кетона. Этот атом углерода имеет sp 2 гибридизированный. Следовательно, вокруг него всего три сигма-связи. Геометрия вокруг этого атома углерода плоская.
Эта структура действует как функциональная группа кетона. Этот атом углерода имеет sp 2 гибридизированный. Следовательно, вокруг него всего три сигма-связи. Геометрия вокруг этого атома углерода плоская.
Рисунок 2: Общая структура кетонов
Кетоны являются полярными молекулами, поскольку двойная связь –C=O полярна. Электроотрицательность атома C выше, чем атома O. Тогда электроны связи сильнее притягиваются к атому кислорода, чем к атому углерода. Это приводит к частичному отрицательному заряду атома кислорода и частичному положительному заряду атома углерода, что делает молекулу кетона полярным соединением. Хотя молекулы кетонов не могут образовывать водородные связи друг с другом, эти молекулы образуют водородные связи с молекулами воды. Поскольку атом кислорода в молекуле кетона богат электронами, а атомы водорода молекул воды имеют частичный положительный заряд, атом кислорода может образовывать водородные связи с этими атомами водорода. Следовательно, кетоны растворимы в воде.
Следовательно, кетоны растворимы в воде.
Связь –C=O сильно полярна. Это делает атом углерода частично положительно заряженным. Затем этот атом углерода может быть атакован нуклеофилами. Протекающая здесь реакция называется реакцией нуклеофильного присоединения. Есть много других реакций, в которых кетоны используются в качестве реагентов. Например, реакция Гриньяра может происходить в присутствии кетона и реактива Гриньяра. Эта реакция превращает кетон в спирт.
Разница между эфиром и кетоном
Определение
Эфир: Эфиры представляют собой органические соединения, имеющие общую формулу R-O-R’.
Кетон: Кетоны представляют собой органические соединения, имеющие общую формулу R–C (=O)–R’.
Функциональная группа
Эфир: Функциональная группа простых эфиров имеет атом кислорода, связанный с двумя атомами углерода.
Кетон: Функциональная группа кетонов имеет атом кислорода, связанный с одним атомом углерода.
Связь между углеродом и кислородом
Эфир: Эфиры имеют одинарные связи -C-O.
Кетоны: Кетоны имеют двойные связи -C=O.
Гибридизация атомов углерода
Эфир: Простые эфиры могут иметь или не иметь sp 2 гибридизованных атомов углерода.
Кетоны: Кетоны в основном имеют sp 2 гибридизированных атомов углерода на молекулу.
Полярность
Эфир: Эфиры менее полярны.
Кетон: Кетоны очень полярны.
Заключение
Органические соединения в основном состоят из атомов углерода и водорода, а также некоторых других элементов. Эфиры и кетоны также являются органическими соединениями. Они состоят из атомов C, H и O. Эфир можно отличить от кетона по их функциональным группам. Следовательно, основное различие между эфиром и кетоном заключается в том, что эфир состоит из функциональной группы R-O-R’, тогда как кетон представляет собой соединение, состоящее из функциональной группы -R-C(=O)-R’.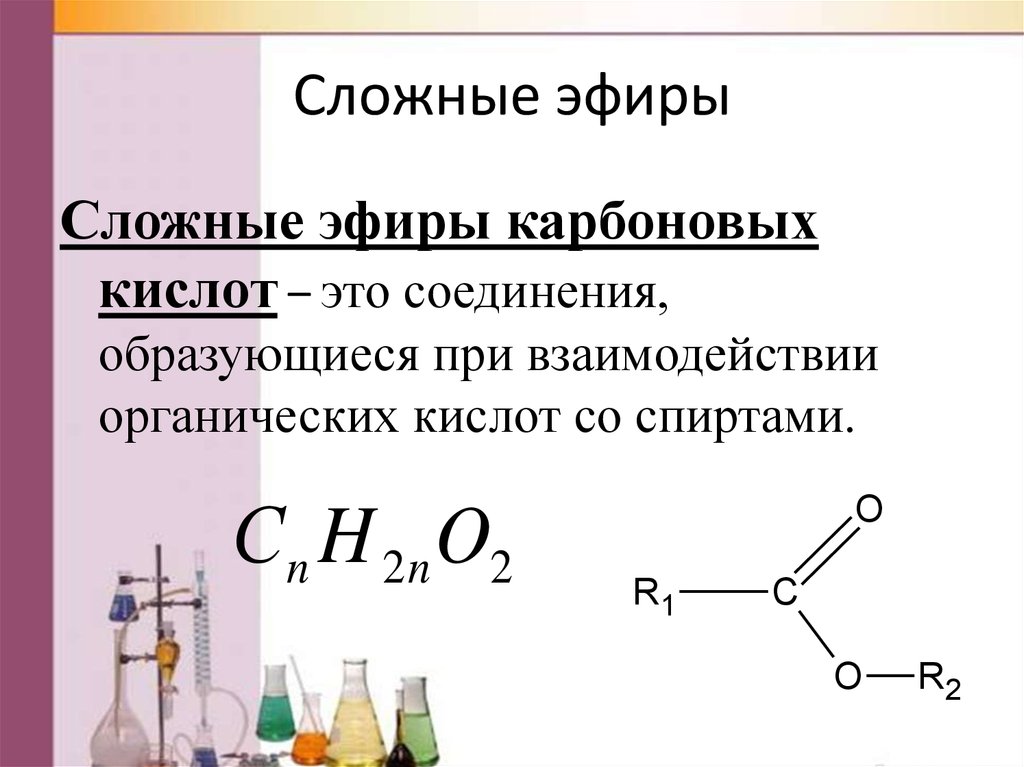

 Дети»
Дети»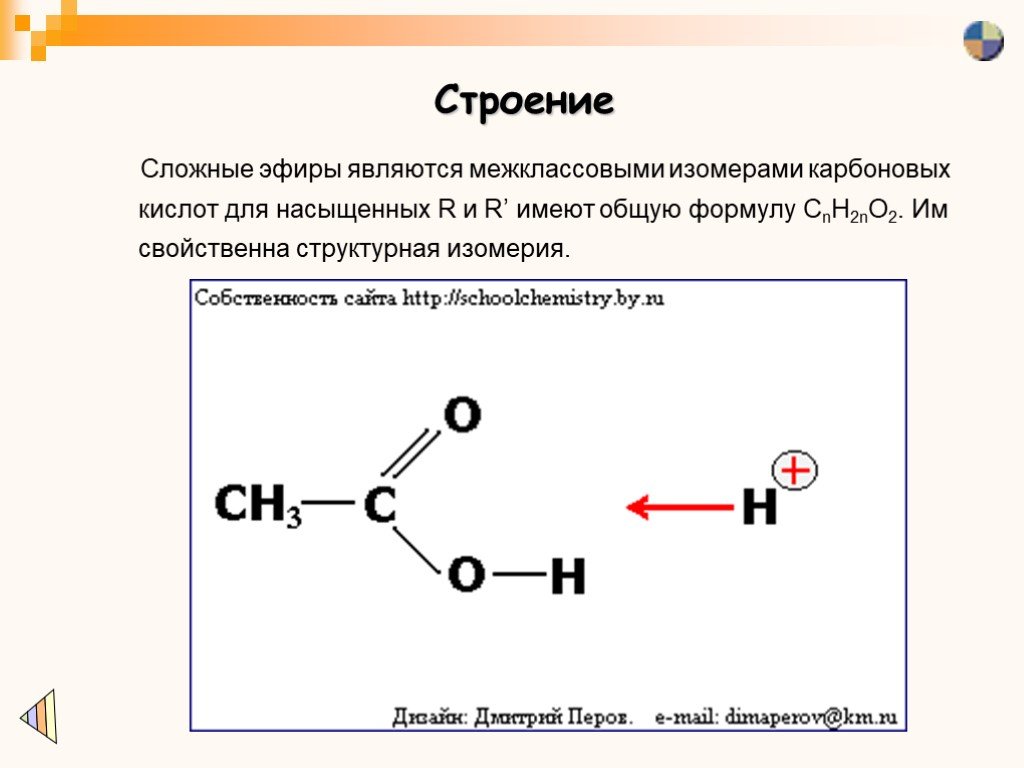 инфраструктуры
инфраструктуры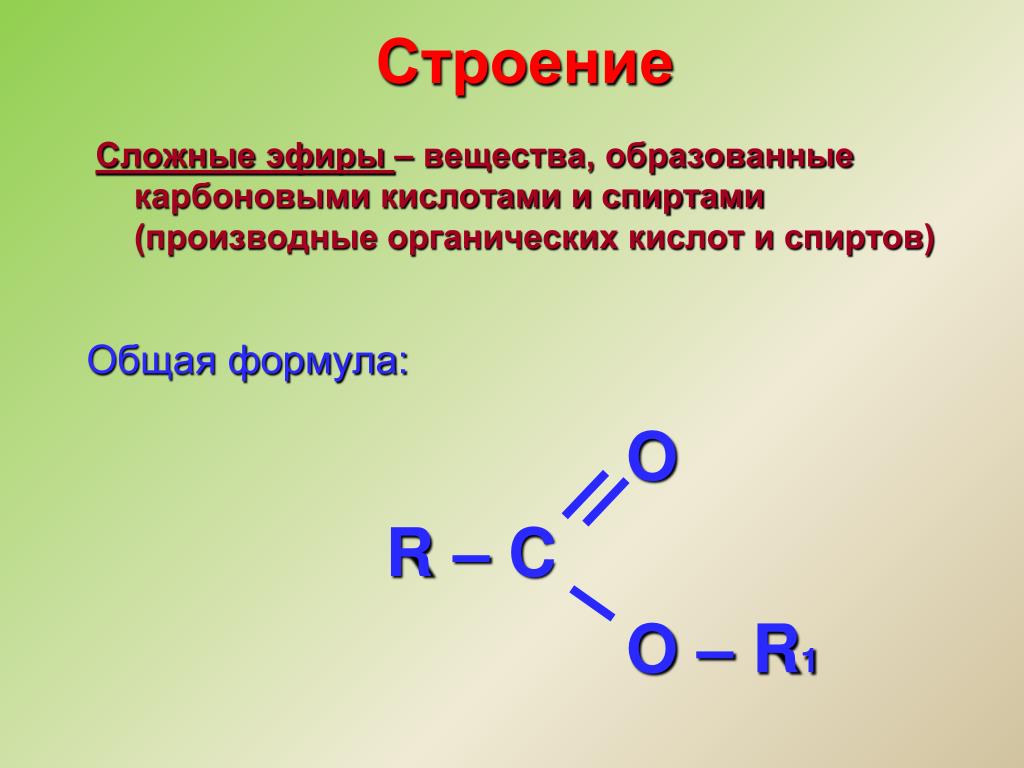 А.
А.