Содержание
Простые эфиры — Без Сменки
01 июля, 2022
1 мин
Хим 🧪
🔻 ОБЩИЕ СВЕДЕНИЯ
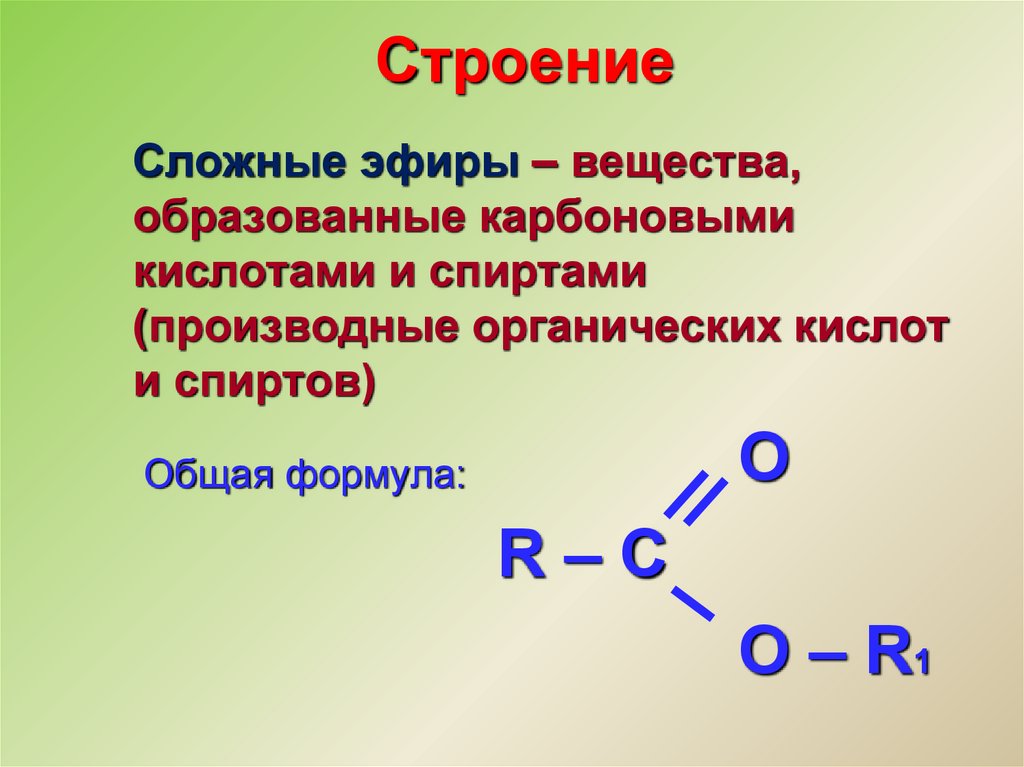
Простые эфиры изомерны спиртам. Атом кислорода в молекуле эфира соединён с двумя радикалами, общая формула зависит от строения радикала.
Строение молекул простых эфиров схоже со строением молекулы воды.
Кислород в простых эфирах находится в состоянии sp³-гибридизации.
🔻 НОМЕНКЛАТУРА
Назвать простой эфир очень просто! Нужно перечислить название радикалов в алфавитном порядке, добавить суффикс -овый и слово «эфир».
СH₃-O-СH₃ диметиловый эфир
СH₃-O-CH₂СH₃ метилэтиловый эфир
С₆H₅-O-СH₃ метилфениловый эфир или анизол
🔻 ФИЗИЧЕСКИЕ СВОЙСТВА
Простые эфиры — бесцветные легкокипящие жидкости с характерным запахом. Они не смешиваются с водой, но хорошо растворимы во многих органических растворителях.
🔻 СПОСОБЫ ПОЛУЧЕНИЯ
1️⃣ Межмолекулярная дегидратация спиртов
Условие: <140°C, H₂SO₄ (конц. )
)
2СH₃CH₂-OH → СH₃CH₂-O-CH₂СH₃ + H₂O (100°C, H₂SO₄)
2️⃣ Взаимодействие алкилгалогенидов и алкоголятов ЩМ
Условие: t°C
СH₃Br + СH₃CH₂-ONa → СH₃-O-CH₂СH₃ + NaBr ( t°C)
🔻 ПРИМЕНЕНИЕ ЭФИРОВ
Эфиры используются в органическом синтезе в качестве растворителей.
Некоторые эфиры, благодаря своему приятному запаху, нашли применение в косметической и парфюмерной промышленности 🌸
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter. Мы обязательно поправим!
Редакция Без Сменки
Честно. Понятно. С душой.
40
подписчиков
+ Подписаться
Редакция Без Сменки
07 июня, 2022
1 мин
Англ 🇬🇧
Притяжательный падеж в английском
В большинстве случаев притяжательный падеж (possessive case) относится к одушевлённым. ..
..
Редакция Без Сменки
10 июня, 2022
1 мин
Био 🦠
Аналогичные органы
Включаем фанатазию 💡! Люди постепенно переселяются в воду. Приходится много плавать 🏊♂️. А для…
Редакция Без Сменки
01 июля, 2022
1 мин
Лит 📚
Лирика
Хочешь узнать, что такое лирика? Вся самая важная информация собрана на картинке, сохраняй и…
Редакция Без Сменки
10 июня, 2022
1 мин
Био 🦠
Рефлекторная дуга
Рефлекторная дуга спасёт тебя от утюга!
Нервная система нужна для:
🔹 Регуляции внутренних. ..
..
Редакция Без Сменки
01 июля, 2022
1 мин
Решение задач ✏️
Хим 🧪
ИЗБЫТОК И НЕДОСТАТОК
Уравнение реакции — рецепт, который сообщает нам, в каких пропорциях стоит брать реагенты. А что…
Спирты и простые эфиры — презентация онлайн
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1.
 ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА СПИРТОВ И ПРОСТЫХ ЭФИРОВ
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА СПИРТОВ И ПРОСТЫХ ЭФИРОВ
1
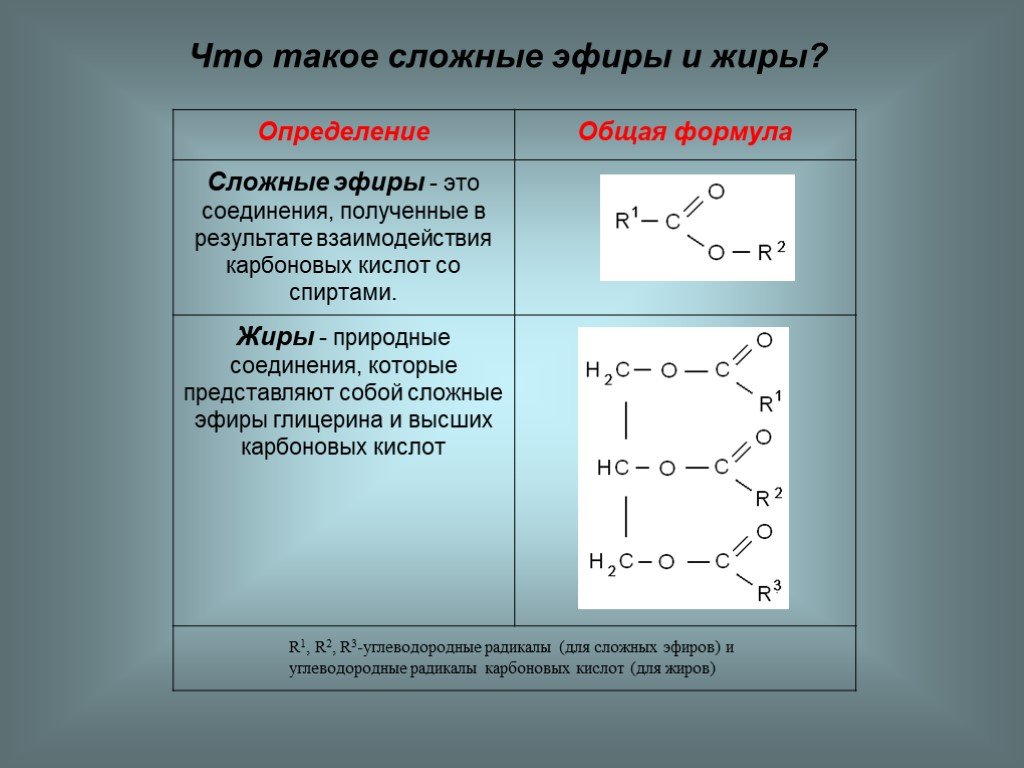
2. Спирты
Соединения, в молекулу которых
входит одна или несколько
гидроксильных групп, называются
спиртами.
Общая формула
R−OH
карбинолы
2
3. Спирты
По
числу
гидроксильных
групп
спирты
подразделяются на:
— одноатомные
Ch4OH, C2H5OH
— двухатомные
Ch3OH
Ch3OH
— многоатомные
Ch3OH
CHOH
Ch3OH
3
В зависимости от того, с каким углеводородным остатком связан
гидроксил, спирты бывают
—
—
предельные спирты
этанол
Ch4-Ch3-OH
пропанол-1
Ch4-Ch3-Ch3-OH
непредельные спирты
аллиловый спирт
Ch3=CH-Ch3-OH
4
5. Спирты
Предельный одноатомные спирты
Изомерия и номенклатура
Наиболее часто встречающиеся спирты
Ch4OH
Ch4Ch3OH
Ch4Ch3Ch3OH
Ch4CH(OH)Ch4
Ch4Ch3Ch3Ch3OH
Ch4Ch3CH(OH)Ch4
Ch4CHCh3OH
карбинол, метиловый спирт, метанол
этиловый спирт, этанол
пропиловый спирт, 1-пропанол
изопропиловый спирт, 2-пропанол
перв-бутиловый спирт, 1-бутанол
втор-бутиловый спирт, 2-бутанол
изобутиловый спирт, 2-метил-1-пропанол
Ch4
OH
Ch4CCh4
трет-бутиловый спирт, 2-метил-2-пропанол
Ch4
5
6.
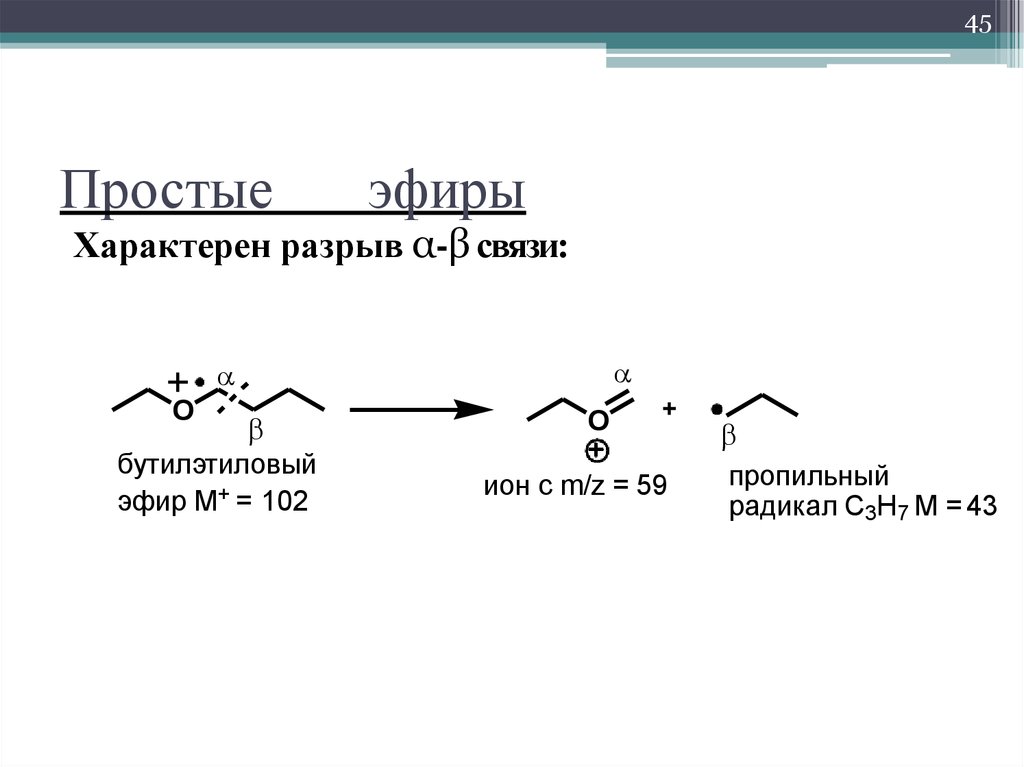 Спирты
Спирты
Предельный одноатомные спирты
Изомерия и номенклатура
Ch4CHCh3Ch3OH
3-метил-1-бутанол
Ch4
Ch4
Ch4 C Ch3OH
2,2-диметил-1-пропанол
Ch4
OH
Ch4CCh4
2-метил-2-пропанол
Ch4
6
7. Спирты
Методы получения
Гидрирование альдегидов и кетонов
RCh3CHO
h3
Pd/C
RCh3Ch3OH
R C R’
h3
R CH R’
O
Pd/C
OH
При гидрировании альдегиды превращаются в первичные, а
кетоны – во вторичные спирты
7
8. Спирты
Методы получения
Восстановление карбоновых кислот и сложных эфиров
Восстановление алюмогидридом лития
RCOOH
Ch4COOH
LiAlh5
LiAlh5
RCh3OH
Ch4Ch3OH
8
9. Спирты
Методы получения
Восстановление карбоновых кислот и сложных эфиров
Гидрирование
C11h33COOCh4
h3
Pd/C
C11h33Ch3OH + Ch4OH
Восстановление по Буво и Блану
C11h33COOCh4
C2H5OH, Na
C11h33Ch3OH + Ch4OH
9
10. Спирты
Методы получения
Другие способы
Получение метанола гидрированием оксида углерода (II)
0
400 C,
200-300 атм
CO + 2h3
Ch4OH
Получение этанола брожением глюкозы
C6h22O6
2Ch4Ch3OH + 2CO2
10
11.
 Спирты
Спирты
Химические свойства
Дегидратация (идет по правилу Зайцева)
Внутримолекулярная дегидратация – идет образование
алкенов
Ch4CHCh3Ch4
h3SO4
Ch4CH CHCh4 + h3O
OH
Правило Зайцева: при дегидратации вторичных и третичных
спиртов
в
присутствие
сильных
кислот
и
при
дегидрогалогенировании
вторичных
и
третичных
алкилгалогенидов
под
действием
оснований
протон
отщепляется
преимущественно
от
наименее
гидрогенизированного атома С
11
12. Спирты
Химические свойства
Дегидратация
Межмолекулярная дегидратация – идет образование
простых эфиров
o
Ch4Ch3OH + Ch4Ch3OH
o
140 C — 170 C
Ch4Ch3OCh3Ch4
12
13. Спирты
Химические свойства
Кислотно-основные свойства
ROH + Na
RO Na + 1/2 h3
алкоголят Na
RO Na + h3O
более
сильная
кислота
HC
C Na + ROH
более
сильная
кислота
NaOH + ROH
более
слабая
кислота
RO Na + HC
CH
более
слабая
кислота
13
14.
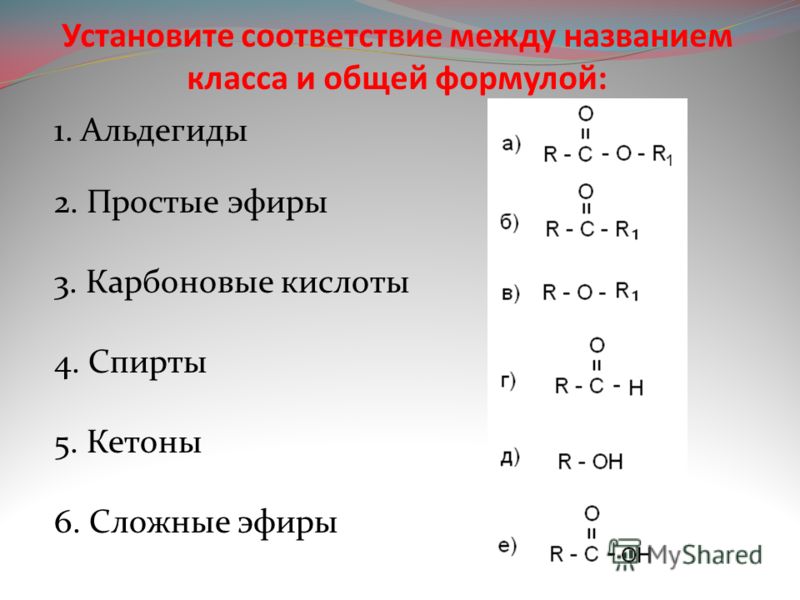 Спирты
Спирты
Химические свойства
Кислотно-основные свойства
В ряду спиртов кислотность изменяется в следующем порядке:
Ch4OH > первичный > вторичный> третичный
14
15. Спирты
Химические свойства
Замещение OH-группы на галоген
Ch4
Ch4 C OH + HCl
Ch4
Ch4
Ch4 C Cl + h3O
Ch4
15
16. Спирты
Химические свойства
Замещение OH-группы на галоген
Галогенирование спиртов хлористым тионилом
O
ROH + SOCl2
-HCl
ROSCl
RCl + SO2
16
17. Спирты
Химические свойства
Образование сложных эфиров (этерификация)
RCOOH + R’OH
h3SO4
O
R C OR’ + h3O
17
18. Спирты
Химические свойства
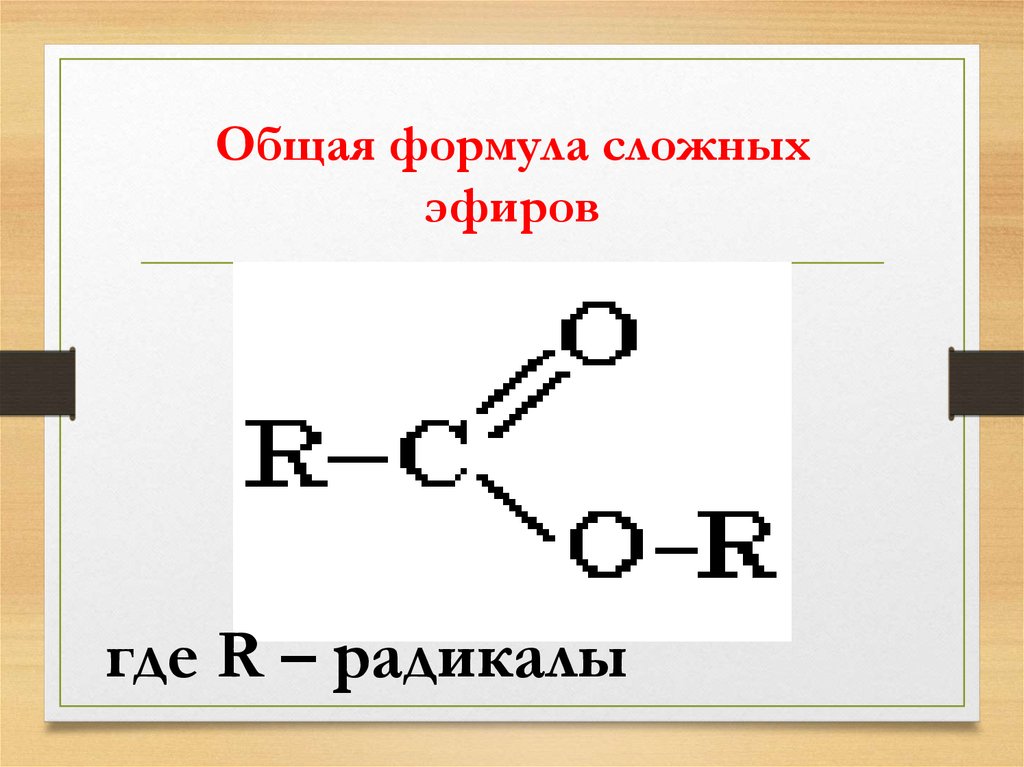
Окисление спиртов
Первичные спирты легко окисляются и образуют альдегиды
RCh3OH
K2Cr2O7
R C
O
H
Вторичные спирты при окислении образуют кетоны
OH
Ch4Ch3CHCh4
KMnO4
O
Ch4Ch3CCh4
Третичные спирты окисляются с большим трудом и только
с разрывом связей между углеродными атомами
18
19.
 Спирты
Спирты
Химические свойства
Дегидрирование спиртов
0C
Ch4Ch3OH
Cu, 200-300
Ch4
C
O
H
+ h3
19
20. Простые эфиры
— это соединения, в молекуле которых кислород связан с
двумя одинаковыми или различными углеводородными
остатками. Общая формула R-O-R или R-O-R`
Представители
Ch4OCh4
диметиловый эфир, метоксиметан
Ch4OCh3Ch4
метилэтиловый эфир, метоксиэтан
Ch4Ch3OCh3Ch4
Ch4
Ch4
C O Ch4
Ch4
диэтиловый эфир, этоксиэтан
метил-трет-бутиловый эфир
2-метил-2-метоксипропан
20
21. Простые эфиры
Химические свойства
Расщепление эфирной связи
2h3SO4
C2H5OC2H5
конц. h3SO4
2C2H5OSO3H
C2H5OSO2OC2H5 + h3O
21
22. Простые эфиры
Химические свойства
Расщепление эфирной связи
Ch4OCh3Ch4 + HI
Ch4I + Ch4Ch3OH
Ch4
Ch4
C OCh4 + HI
Ch4
Ch4
Ch4
C Ch4 + Ch4OH
I
22
23. Простые эфиры
Химические свойства
Оксониевые соли эфиров
C2H5OC2H5 + h3SO4
C2H5OC2H5 HSO4
H
кислый сульфат
диэтилоксония
23
24.
 Простые эфиры
Простые эфиры
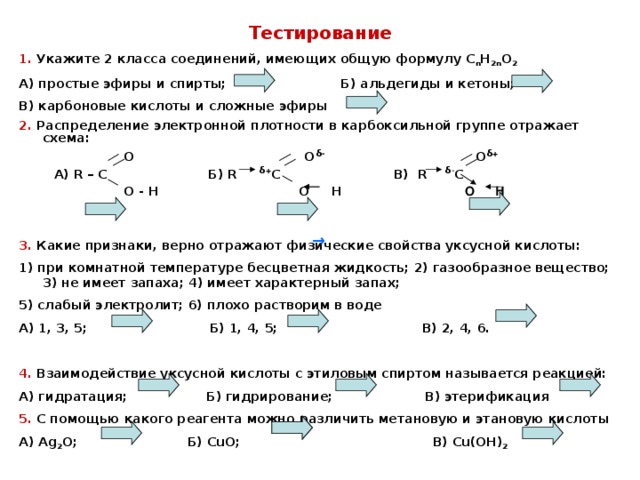
Химические свойства
Образование гидроперекисей
Ch4Ch3OCh3Ch4
O2
Ch4CHOCh3Ch4 пероксид
диэтилового эфира
OOH
24
English
Русский
Правила
18.2 Спирты и эфиры – Общая химия 1 и 2
Цели обучения
К концу этого раздела вы сможете:
- Описывать структуру и свойства спиртов
- Описать строение и свойства эфиров
- Назовите и нарисуйте структуры для спиртов и эфиров
В этом разделе мы узнаем о спиртах и эфирах.
Включение атома кислорода в углерод- и водородсодержащие молекулы приводит к новым функциональным группам и новым семействам соединений. Когда атом кислорода присоединен одинарными связями, молекула представляет собой либо спирт, либо эфир.
Спирты являются производными углеводородов, в которых атом водорода заменен группой –ОН. Хотя все спирты имеют одну или несколько гидроксильных (-OH) функциональных групп, они не ведут себя как основания, такие как NaOH и KOH. NaOH и KOH являются ионными соединениями, которые содержат ионы OH – . Спирты представляют собой ковалентные молекулы; группа –ОН в молекуле спирта связана с атомом углерода ковалентной связью.
NaOH и KOH являются ионными соединениями, которые содержат ионы OH – . Спирты представляют собой ковалентные молекулы; группа –ОН в молекуле спирта связана с атомом углерода ковалентной связью.
Этанол, CH 3 CH 2 OH, также называемый этиловым спиртом, является особенно важным спиртом для человека. Этанол — это спирт, вырабатываемый некоторыми видами дрожжей, который содержится в вине, пиве и дистиллированных напитках. Его долгое время готовили люди, используя метаболические усилия дрожжей для ферментации различных сахаров:
Большие количества этанола синтезируются реакцией присоединения воды к этилену с использованием кислоты в качестве катализатора:
Могут быть получены спирты, содержащие две или более гидроксильных групп. Примеры включают 1,2-этандиол (этиленгликоль, используемый в антифризах) и 1,2,3-пропантриол (глицерин, используемый в качестве растворителя для косметики и лекарств):
Наименование спиртов
Название спирта происходит от углеводорода, из которого он был получен. Финал -е в названии углеводорода заменяется на -ол , а атом углерода, с которым связана группа –ОН, обозначается цифрой, стоящей перед названием. [1]
Финал -е в названии углеводорода заменяется на -ол , а атом углерода, с которым связана группа –ОН, обозначается цифрой, стоящей перед названием. [1]
Пример 1
Наименование спиртов
Рассмотрим следующий пример. Как это должно называться?
Раствор
Углеродная цепь состоит из пяти атомов углерода. Если бы гидроксильной группы не было, мы бы назвали эту молекулу пентаном. Чтобы учесть тот факт, что гидроксильная группа присутствует, мы меняем окончание имени на 9.0040 -ол . В этом случае, поскольку –ОН присоединен к углероду 2 в цепи, мы бы назвали эту молекулу 2-пентанол.
Проверьте свои знания
Назовите следующую молекулу:
Ответ:
2-метил-2-пентанол
Эфиры представляют собой соединения, содержащие функциональную группу –O–. У простых эфиров нет обозначенного суффикса, как у других типов молекул, которые мы назвали до сих пор. В системе IUPAC атом кислорода и меньшая углеродная ветвь называются алкокси-заместителем, а остальная часть молекулы — основной цепью, как в алканах. Как показано в следующем соединении, красные символы представляют меньшую алкильную группу и атом кислорода, который можно назвать «метокси». Более крупная углеродная ветвь будет этаном, что сделает молекулу метоксиэтаном. Многие эфиры называются общими именами вместо системных имен IUPAC. Для общих названий две ветви, связанные с атомом кислорода, называются отдельно, а за ними следует «эфир». Общее название соединения, показанного в примере 2, — этилметиловый эфир:
В системе IUPAC атом кислорода и меньшая углеродная ветвь называются алкокси-заместителем, а остальная часть молекулы — основной цепью, как в алканах. Как показано в следующем соединении, красные символы представляют меньшую алкильную группу и атом кислорода, который можно назвать «метокси». Более крупная углеродная ветвь будет этаном, что сделает молекулу метоксиэтаном. Многие эфиры называются общими именами вместо системных имен IUPAC. Для общих названий две ветви, связанные с атомом кислорода, называются отдельно, а за ними следует «эфир». Общее название соединения, показанного в примере 2, — этилметиловый эфир:
Пример 2
Названия простых эфиров
Укажите IUPAC и общепринятое название эфира, показанного здесь:
Раствор
IUPAC: Молекула состоит из этоксигруппы, присоединенной к этановой цепи, поэтому название IUPAC будет этоксиэтан.
Общее: обе группы, присоединенные к атому кислорода, представляют собой этильные группы, поэтому обычное название — диэтиловый эфир.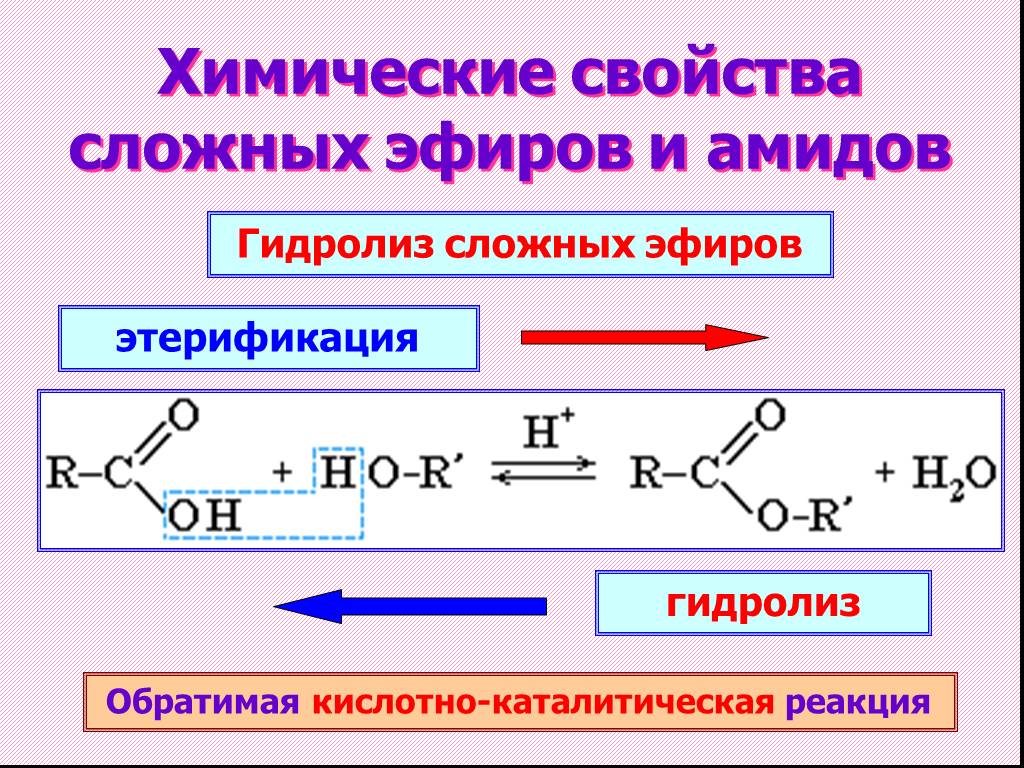
Проверьте свои знания
Укажите IUPAC и общее название показанного эфира:
Ответ:
ИЮПАК: 2-метоксипропан; общий: изопропилметиловый эфир
Эфиры можно получить из спиртов отщеплением молекулы воды от двух молекул спирта. Например, при обработке этанола ограниченным количеством серной кислоты и нагревании до 140°С образуются диэтиловый эфир и вода:
В общей формуле простых эфиров R— O —R углеводородные группы (R) могут быть одинаковыми или разными. Диэтиловый эфир, наиболее широко используемое соединение этого класса, представляет собой бесцветную летучую жидкость, которая легко воспламеняется. Впервые он был использован в 1846 году в качестве анестетика, но в настоящее время его место в значительной степени заняли более совершенные анестетики. Диэтиловый эфир и другие простые эфиры в настоящее время используются главным образом в качестве растворителей камедей, жиров, восков и смол. Третичный -бутилметиловый эфир, C 4 H 9 OCH 3 (сокращенно МТБЭ — части названий, выделенные курсивом, не учитываются при ранжировании групп в алфавитном порядке — поэтому бутил стоит перед метилом в общем названии), используется в качестве присадки к бензину. МТБЭ принадлежит к группе химических веществ, известных как оксигенаты, из-за их способности повышать содержание кислорода в бензине.
МТБЭ принадлежит к группе химических веществ, известных как оксигенаты, из-за их способности повышать содержание кислорода в бензине.
Хотите попрактиковаться в именовании эфиров? Этот краткий видеообзор подытоживает номенклатуру эфиров.
Углеводы и диабет
Углеводы представляют собой большие биомолекулы, состоящие из углерода, водорода и кислорода. Пищевые формы углеводов — это продукты, богатые этими типами молекул, такие как макароны, хлеб и конфеты. Название «углевод» происходит от формулы молекул, которые можно описать общей формулой C m (H 2 O) n , что показывает, что они в некотором смысле являются «углеродом и водой» или «гидраты углерода». Во многих случаях m и n имеют одинаковое значение, но могут быть разными. Меньшие углеводы обычно называют «сахарами», биохимический термин для этой группы молекул — «сахарид» от греческого слова «сахар» (рис. 1). В зависимости от количества сахарных единиц, соединенных вместе, их можно классифицировать как моносахариды (одна сахарная единица), дисахариды (две сахарные единицы), олигосахариды (несколько сахаров) или полисахариды (полимерная версия сахаров — полимеры были описаны в раздел о вторичной переработке пластика ранее в этой главе).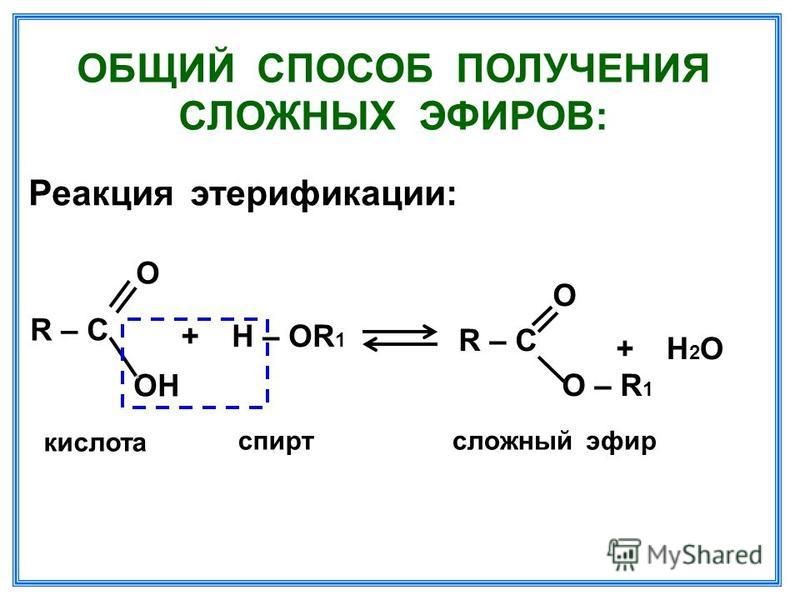 Научные названия сахаров можно узнать по суффиксу 9.0040 -ose в конце названия (например, фруктовый сахар представляет собой моносахарид, называемый «фруктозой», а молочный сахар — это дисахарид, называемый лактозой, состоящий из двух моносахаридов, глюкозы и галактозы, соединенных вместе). Сахара содержат некоторые функциональные группы, которые мы обсуждали: обратите внимание на спиртовые группы, присутствующие в структурах, и на то, как моносахаридные звенья связаны с образованием дисахарида путем образования эфира.
Научные названия сахаров можно узнать по суффиксу 9.0040 -ose в конце названия (например, фруктовый сахар представляет собой моносахарид, называемый «фруктозой», а молочный сахар — это дисахарид, называемый лактозой, состоящий из двух моносахаридов, глюкозы и галактозы, соединенных вместе). Сахара содержат некоторые функциональные группы, которые мы обсуждали: обратите внимание на спиртовые группы, присутствующие в структурах, и на то, как моносахаридные звенья связаны с образованием дисахарида путем образования эфира.
Рисунок 1. На рисунках показаны молекулярные структуры фруктозы, пятиуглеродного моносахарида, и лактозы, дисахарида, состоящего из двух изомерных шестиуглеродных сахаров.
Организмы используют углеводы для различных функций. Углеводы могут накапливать энергию, например полисахариды гликоген у животных или крахмал у растений. Они также обеспечивают структурную поддержку, такую как полисахаридная целлюлоза в растениях и модифицированный полисахаридный хитин в грибах и животных. Сахара рибоза и дезоксирибоза являются компонентами остова РНК и ДНК соответственно. Другие сахара играют ключевую роль в функционировании иммунной системы, в межклеточном распознавании и во многих других биологических функциях.
Сахара рибоза и дезоксирибоза являются компонентами остова РНК и ДНК соответственно. Другие сахара играют ключевую роль в функционировании иммунной системы, в межклеточном распознавании и во многих других биологических функциях.
Сахарный диабет — это группа метаболических заболеваний, при которых у человека наблюдается повышенная концентрация сахара в крови (рис. 2). Диабет может быть вызван недостаточной выработкой инсулина поджелудочной железой или клетками организма, которые не реагируют должным образом на вырабатываемый инсулин. У здорового человека инсулин вырабатывается, когда он необходим, и функционирует для транспортировки глюкозы из крови в клетки, где она может использоваться для получения энергии. Долгосрочные осложнения диабета могут включать потерю зрения, болезни сердца и почечную недостаточность.
В 2013 г. было подсчитано, что приблизительно 3,3% населения мира (~380 миллионов человек) страдали диабетом, что ежегодно приводило к более чем миллиону смертей.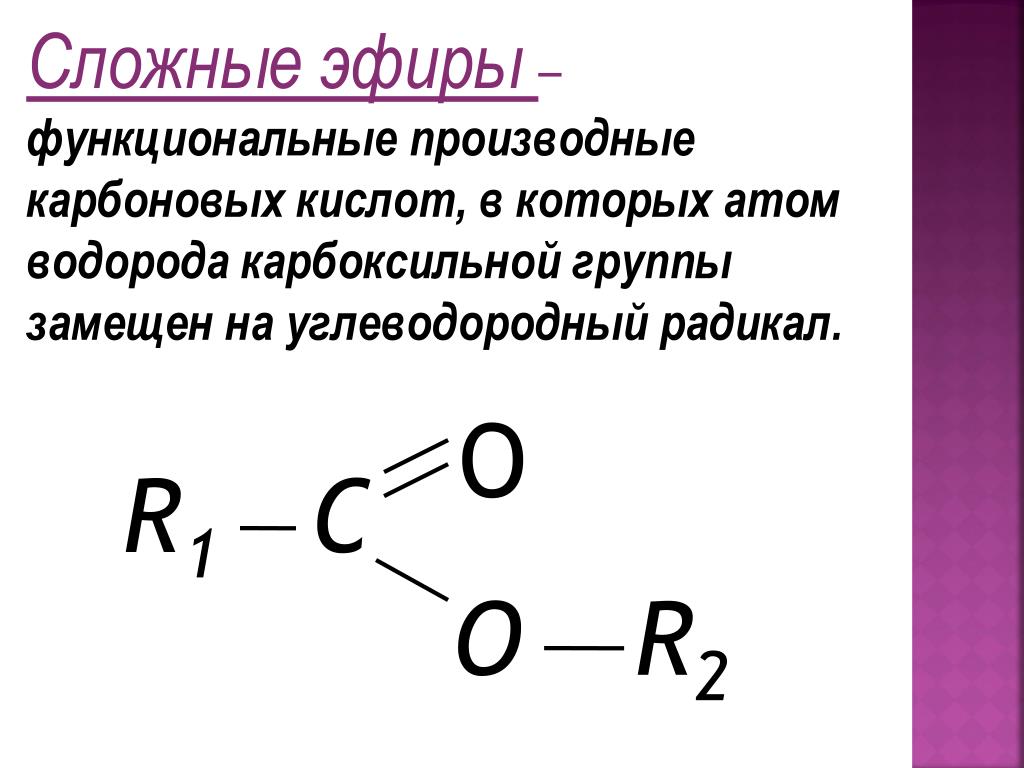 Профилактика включает в себя здоровое питание, много физических упражнений и поддержание нормальной массы тела. Лечение включает в себя все эти методы образа жизни и может потребовать инъекций инсулина.
Профилактика включает в себя здоровое питание, много физических упражнений и поддержание нормальной массы тела. Лечение включает в себя все эти методы образа жизни и может потребовать инъекций инсулина.
Рисунок 2. Сахарный диабет – это заболевание, характеризующееся высокой концентрацией глюкозы в крови. Лечение диабета включает в себя изменение образа жизни, контроль уровня сахара в крови, а иногда и инъекции инсулина. (кредит: «Blausen Medical Communications»/Wikimedia Commons)
Многие органические соединения, не являющиеся углеводородами, можно рассматривать как производные углеводородов. Углеводородное производное может быть образовано путем замены одного или нескольких атомов водорода углеводорода функциональной группой, которая содержит по меньшей мере один атом элемента, отличного от углерода или водорода. Свойства производных углеводородов во многом определяются функциональной группой. Группа –ОН является функциональной группой спирта. Группа –R–O–R– является функциональной группой эфира.
Глоссарий
- алкоголь
- органическое соединение с гидроксильной группой (–ОН), связанной с атомом углерода
- эфир
- органическое соединение с атомом кислорода, связанным с двумя атомами углерода
- В 2013 году IUPAC принял новые правила номенклатуры, которые требуют, чтобы этот номер помещался как «инфикс», а не как префикс. Например, новое название 2-пропанола будет пропан-2-ол. Широкое внедрение этой новой номенклатуры займет некоторое время, и учащимся рекомендуется ознакомиться как со старым, так и с новым протоколом именования. ↵
Эфиры — Энциклопедия
| ГЕОГРАФИЧЕСКИЕ НАЗВАНИЯ |
ЭФИРЫ, в органической химии соединения общей формулы ROR’, где R, R’ = алкильные или арильные группы. Их можно рассматривать как ангидриды спиртов, образующиеся при отщеплении одной молекулы воды от двух молекул спиртов; те, в которых два углеводородных радикала сходны, известны как простых эфиров , а те, в которых они не похожи, как смешанные эфиры . Их можно получить действием концентрированной серной кислоты на спирты, причем сначала образуются алкилсерные кислоты, которые при нагревании со спиртами дают простые эфиры. Процесс можно сделать непрерывным, непрерывно пропуская тонкую струю спирта в нагретую реакционную смесь спирта и серной кислоты. Вместо серной кислоты использовали бензолсульфокислоту (F. Krafft, 9).0189 Бер., 1893, 26, с. 2829). A. W. Williamson ( Ann., 18 5 1, 77, стр. 38; 1852, 81, стр. 77 ) получил эфир действием этилата натрия на этилиодид и показал, что все эфиры должны иметь структурную формулу приведено выше (см. также Brit. Assoc. Reports, 1850, стр. 65). Их также можно получить нагреванием алкилгалогенидов с оксидом серебра.
Их можно рассматривать как ангидриды спиртов, образующиеся при отщеплении одной молекулы воды от двух молекул спиртов; те, в которых два углеводородных радикала сходны, известны как простых эфиров , а те, в которых они не похожи, как смешанные эфиры . Их можно получить действием концентрированной серной кислоты на спирты, причем сначала образуются алкилсерные кислоты, которые при нагревании со спиртами дают простые эфиры. Процесс можно сделать непрерывным, непрерывно пропуская тонкую струю спирта в нагретую реакционную смесь спирта и серной кислоты. Вместо серной кислоты использовали бензолсульфокислоту (F. Krafft, 9).0189 Бер., 1893, 26, с. 2829). A. W. Williamson ( Ann., 18 5 1, 77, стр. 38; 1852, 81, стр. 77 ) получил эфир действием этилата натрия на этилиодид и показал, что все эфиры должны иметь структурную формулу приведено выше (см. также Brit. Assoc. Reports, 1850, стр. 65). Их также можно получить нагреванием алкилгалогенидов с оксидом серебра.
Эфиры представляют собой нейтральные летучие жидкости (первый член, метиловый эфир, представляет собой газ при обычной температуре). Пентахлорид фосфора превращает их в алкилхлориды, аналогичное разложение происходит при нагревании их с галоидными кислотами. Азотная и хромовая кислоты окисляют их таким образом, что они дают те же продукты, что и спирты, из которых они получены. С хлором они дают продукты замещения.
Метиловый эфир, (CH 3) 2 0, был впервые получен J. B. Dumas и E. Peligot ( Ann. chim. phys., 1835, [2] 58, p. 19) путем нагревания метилового спирта с серная кислота. Лучше всего его приготовить путем нагревания метилового спирта и серной кислоты до 140°С и превращения выделяющегося газа в серную кислоту. Затем раствор серной кислоты медленно капают в равный объем воды, при этом высвобождается метиловый эфир (E. Erlenmeyer and A. Kriechbaumer, Ber., 9).0190 18 74, 7, с. 6 99). Это приятно пахнущий газ, который горит при воспламенении и может сконденсироваться в жидкость, кипящую при 23,6°С.