Спирты — номенклатура, получение, химические свойства. Образование простых эфиров из спиртов
Эфиры простые образование из спиртов
Оксикислотами называются органические соединения, в молекулах которых присутствуют две функции гидроксил и карбоксил. Как и в других гетерофункциональных соединениях, обе функции в общих чертах сохраняют свои обычные свойства. Так, например, гидроксильная группа может подвергаться алкилированию (образование простых эфиров), ацилированию (образование сложных эфиров), может заменяться на галоген (получение галогенозамещенных кислот), отщепляться в виде воды (образование непредельных кислот). Карбоксильная группа также сохраняет в оксикислотах свои обычные свойства. Она способна образовывать соли, сложные эфиры со спиртами, ангидриды и галогенангидриды, амиды и дру- гие функциональные производные. [c.261]
Реакция дегидратации одноатомных спиртов под действием серной кислоты или ее солей является классическим методом получения простых эфиров. В образовании молекулы эфира участвуют две молекулы спирта. Реакция дегидратации гликолей в аналогичных условиях протекает в двух направлениях с образованием линейных полигликолей или с внутримолекулярной циклизацией (если возможно образование ненапряженных пяти- или шестичленных циклов). Этиленгликоль под действием серной кислоты образует полигликоли или шестичленный циклический эфир 1,4-диоксан [c.213]
Простыми эфирами называют производные спиртов, образованные в результате замещения водорода гидроксильной группы спирта на углеводородный радикал. Эти соединения можно рассматривать и как производные воды, в молекуле которой углеводородными радикалами замещены оба атома водорода, [c.127]
Теоретические основы экстракции.- Экстракцией называется извлечение вещества из одной жидкой фазы в другую жидкую фазу. С водой не смешиваются малополярные органические жидкости (с низкой диэлектрической постоянной). Подавляющее большинство неорганических соединений, имея ионную природу, растворяется в них плохо. В водном растворе эти соединения диссоциируют на ионы, которые гидратируются молекулами воды. Переход соединения в органическую фазу становится возможным, если все или часть молекул воды, координированных ионом, будут удалены, и получен нейтральный комплекс. Образование нейтральных соединений и уменьшение степени гидратации наблюдается прн образовании солей с органическими кислотами, аминами (если металл входит в состав аниона), сольватов с нейтральными экстрагентами (спиртами, кетонами, простыми и сложными эфирами). При образовании сольватов молекулы экстрагента замещают молекулы воды в гидратной оболочке катиона либо присоединяются к воде гидратной оболочки. Такого рода взаимодействие возможно, если органические вещества содержат атомы кислорода, азота и других элементов, способных быть донорами электронов, а металлы — акцепторами. [c.332]
В патентной литературе описан гидролиз простых эфиров с образованием спиртов под действием разбавленной серной кислоты при высоких температуре и давлении [22] процесс был проведен при 272° С и 130 атм в течение 25 мин. и была применена 10-процентная кислота. Конверсия эфира в этиловый спирт превышала 90%. Этот метод используют лишь в том случае, когда необходимо утилизировать избыток этилового эфира. [c.139]
Кроме того, образование спирта и простого эфира обусловлено обратимыми реакциями гидролиза и алкоголиза моно- и особенно диалкилсульфата, обладающего сильными алкилирующими свойст- вами [c.320]
Об образовании алкилсерной кислоты в качестве интермедиата при получении простых эфиров из первичных спиртов свидетельствует тот факт, что простые эфиры можно получать и действием на спирты заранее приготовленной алкилсерной кислотой [c.146]
Аутоокислению подвержены алканы. алкены, спирты, альдегиды и простые эфиры. Механизм образования гидропероксидов представлен ниже [c.151]
Образование простых и сложных эфиров. Простые эфиры образуются из молекул спиртов (одинаковых или разных) в присутствии водоотнимающих веществ — реакция этерификации [c.457]
Модифицирование карбамидоформальдегидных олигомеров спиртами заключается в алкилировании гидроксиметильных групп олигомера с образованием простых эфиров. Простейший метод получения модифицированных карбамидных олигомеров - двухступенчатая (в щелочной и кислой среде) конденсация смеси карбамида, формалина и бутанола. Такой процесс осуществляют либо предварительной конденсацией карбамида с формальдегидом, а затем с бутанолом, либо конденсацией формальдегида и бутанола с образованием формаля, который взаимодействует с карбамидом [c.75]
Основные побочные процессы прн Г. р.-образование спиртов, а также простых эфиров, эпоксидов, производных ТГФ и циклопропана. [c.602]
Преобладание при дегидратации одной из этих реакций зависит от свойств взятого спирта, от характера дегидратирующего средства и от общих условий опыта. Обычно третичные спирты легче образуют олефины, причем отщепление воды происходит в довольно мягких условиях сравнительно с условиями дегидратации первичных и вторичных спиртов. Некоторые спирты благодаря строению не могут образовывать олефины, поэтому дегидратация их ведет к образованию простых эфиров. Для других спиртов обычно удается подыскать такие условия реакции, при которых в качестве главного продукта реакции образуются либо олефины, либо простые эфиры. [c.127]
Поскольку ониевые ионы, образующиеся при распаде простых эфиров и диалкилсульфидов, по составу идентичны ионам, которые образуются из алифатических спиртов и тиолов, то по масс-спектрам иногда трудно отличить спирты от эфиров, а тиолы от диалкилсульфидов. На рис. 7.10 приведены масс-спектры изомерных этилбутиловых эфиров. Рассмотренные закономерности фрагментации под ЭУ простых эфиров объясняют образование основных пиков в масс-спектрах этих изомеров. [c.139]
В большинстве случаев для осуществления количественного анализа в качестве производных гидроксилсодержащих соединений используют простые и сложные эфиры. В образовании производных значительную роль играют пространственные факторы так, например, для количественного образования производных третичных спиртов пе всегда подходят методы, дающие удовлетворительные результаты при образовании производных первичных и вторичных спиртов. [c.43]
Посредством некоторых энергично действующих реагентов простые эфиры могут быть расщеплены с образованием спиртов (см. следующую главу Алкоксильные группы ). Однако этим методом для получения гидроксилсодержащих соединений не пользуются. [c.130]
Реакции карбонилирования. Оксид углерода (И) в присутствии специальных катализаторов при повышенной температуре и лучше под давлением реагирует со спиртами, галогенуглеводорода-ми, простыми и сложными эфирами с образованием карбоновых кислот [c.541]
Как уже упоминалось выше, для той же цели можно переводить спирты в эфиры серной кислоты. Именно таким путем раньше получали в промышленности диэтиловый эфир. При обработке спирта концентрированной серной кислотой и последующем нагревании выделяется вода и образуется алкилсерная кислота. Реакция обратима. Осторожная отгонка воды при 130°С сдвигает равновесие в сторону образования алкилсерной кислоты. К последней затем добавляют спирт (можно не изначальный, тогда получают несимметричный простой эфир) и продолжают нагревание при 140°С. Образуется оксониевая форма простого эфира, последний выделяют разбавлением раствора водой [c.181]
Много работ, устанавливающих первичный характер образования перекисей, выполнено на жирах, ио главным образом на родственных им веществах, в частности эфирах простых ннзкомолекулярных спиртов с высокомолекулярными жирными кислотами (преимущественно олеиновой, линолевой и линоленовой), пр1 че>л рядом исследователей убедительно показано, что на начальных стадиях окисления жиров и родственных и.м веществ перекиси являются практически единственными продуктами окпслени.я [39, 46, 87—90]. [c.28]
Например, продуктами гидроформилирования пропена, кроме С -альдегидов и спиртов (н- и зо-бутилового), являются С5-СОЛИ или эфиры муравьиной кислоты, Св-сложные эфиры, альдегиды или спирты, Св-простые эфиры, Сд- эфироальдегиды и эфироспирты и, возможно, (З з-ацетали, образованные путем следующих реакций [c.195]
В случае гидролиза водой побочным продуктом последовательных превращений является простой эфир. Его образование объяс- 1яется тем, что пер вичный продукт реакции — спирт — в результате быстрого кислотно-основного обмена со щелочью дает алкоголят, пакже способный взаимодействовать с хлорпроизводным [c.174]
Замещение атомов водорода в молекуле воды на алкильную или арильную группу приводит к образованию спирта, фенола или простых эфиров. Аналогично водородные соединения серы h3S и h3S2 являются родоначальными веществами трех типов простых алифатических серусодержащих соединений [c.90]
Тенденция к аналогичному разрыву связи алкил — кислород имеет место также в случае эфиров таких вторичных спиртов, как РЬгСНОН, образующих наиболее устойчивые карбониевые ионы. Попытки осуществить переэтерификацию сложных эфиров, образованных такими спиртами, привели не к ожидаемому новому сложному эфиру, а к смеси кислота простой эфир [c.228]
Побочными продуктами при получении альдегидов этим методом являются спирты, углеводороды, сложные и иногда простые эфиры. Высокая температура благоприятна для образования спиртов. Значение полного гидрогенолиза хлорокарбонильной группы (с разрывом связей С-С и С-С1), как правило, невелико. Лишь в отдельных случаях, например при восстановлении трифенилаце-тилхлорида, оно может возрастать настолько, что основная реакция подавляется и углеводород, содержащий на один углеродный атом меньше, чем исходное соединение, становится практически единственным органическим продуктом гидрирования [c.71]
Повышение температуры благоприятствует и образованию эфи-. ра, II элиминированию. Избыток спирта способствует образованию эфира, избыток кислоты — этерификации. Степень эфирообразова- йия зависит, кроме того, от структуры спирта тенденция к образованию симметричного простого эфира у третичных спиртов ничтожна из-за пространственных затруднений. [c.253]
В целом свойства высших сахаров мало отличаются от свойств обычных моносахаридов и определяются теми функциональными группами, которые они содержат. Так, высшие альдозы проявляют все свойства, характерные для обычных альдоз высшие кетозы соответствуют обычным кетозам и т. д. Высшие сахара так же, как и обычные моносахариды, легко образуют простые и сложные эфиры, реагируют со спиртами и фенолами с образованием гликозидов, дают все известные для обычных сахаров производные по карбонильной группе, легко окисляются до альдоновых кислот и восстанавливаются до полиолов, легко подвергаются превраш,ениям под действием кислот и ш,елочей и т. д. Интересно отметить, что высшие сахара по некоторым физическим (оптическое вра-ш,ение) и химическим свойствам (образование нерастворимых фенилгидразонов, комплексов с солями ш,елочноземельных металлов и т. д.) очень близки к гексозам, если стереохимия первых четырех асимметрических углеродных атомов гексозы совпадает с таковой у высшего сахара. Такое совпадение свойств распространяется не только на циклические формы сахаров, их гликозидов и лактонов, но проявляется также и в свойствах амидов, феннлгидразидов, бензимидазолов и т. д. Наглядным примером является приведенное в табл. 14 сравнение величин оптического враш,е-ния производных )-гулозы и О-эритро-О-гуло-октозы [c.318]
Простые /и е/и-бутиловые эфиры получают реакцией спирта или фенола с И. в присутствии кислого катализатора защитная трет-бутильная группа удаляется иод действием трифторуксусной кислоты. Примером может служить синтез бензоата тестостерона из андростенолона (61. Изучено несколько кислотных катализаторов образования простых эфиров, причем наиболее удовлетворительным считается комплекс ВР Н.РО4 (1 1). Его получают пропусканием газообразного трехфторнстого бора в безводную фосфорную кислоту. Последнюю получают из 80%-ной фосфорной кислоты добавлением рассчитанного количества фосфорного ангидрида. [c.21]
Общая часть. Кольцо окиси этилена может быть разомкнуто действием самых различных реагентов. Таким образом можно простым путем прийти ко многим классам соединений. Вода легко раскрывает окисное кольцо с образованием гликоля, превращая, например, окись циклогексена в 1,2-циклогександиол I [113]. Подобным же образом раскрывает окисное кольцо и спирт окись этилена при этом образует технически важные моноалкилиро-ванные эфиры этиленгликоля. Вместо спирта для раскрытия окисного кольца может быть применен фенол. [c.20]
При взаимодействии простых эфиров с концентрированной серной кислотой происходит их расщепление с образованием спирта и ал-килгидросульфата. Эта реакция характерна только для низших алифатических простых эфиров. Она протекает в более жестких условиях — при пропускании паров эфира в концентрированную серную кислоту. [c.196]
Гидрокрекинг цикланов и фенолов можно осуществлять также в присутствии сульфида никеля на носителях [2346—2348]. В отличие от гидрогенолиза с разрывом С—С-связи деструктивное гидрирование по С— 0-связям катализируется скелетным никелем без носителей и довольно легко протекает в эпоксисоединениях [1197, 1825—1832], эфирах простых и сложных [750, 1319, 1659, 1687, 1823, 1824, 1849—1861], лактонах [1844—1848]. Гидродеструкция производных фурана (с образованием алифатических кетонов, спиртов) идет в несколько более жестких условиях, при этом, по-видимому, необходимо присутствие в Ni-Ренея заметных количеств невыщелоченных АЬОз или ZnO [1381, 1423, 1560, 1561, 1567, 1570, 1825, 1833—1836]. [c.729]
Химия углеводородов за последние десятилетия претерпела значительную эволюцию. Два основных результата этой эволюции должны быть отмечены в первую очередь установление прямых путей перехода от углеводородов разных классов к соединениям иного химического характера и отыскание новых реакций, непосредственно связываюпщх различные группы углеводородов друг с другом. Превращения первого рода касаются главным образом непредельных и лишь отчасти предельных углеводородов к ним следует отнести такие реакции, как гидратация олефинов с образованием спиртов, получение ацет-альдегида и уксусной кислоты из ацетилена, получение хлористого аллила и глицерина из пропилена, окиси этилена из этилена, нитропарафинов прямым нитрованием парафиновых углеводородов, синтез многочисленных галоидопроизводных, простых и сложных эфиров, альдегидов, кетонов, аминов и других органических соединений на основе непредельных углеводородов. Многие из этих реакций получили в настоящее время промышленное оформление и составляют новую отрасль химической промышленности — промышленность соединений алифатического ряда. [c.3]
Brown и Odell описали гидратацию олефиновых углеводородов в спирты и простые эфиры проведением их с паром под давлением ад катализаторами например окисями алюминия, тория, титана, вольфрама и хро-ма) при температурах от 100 до 600°. Относительные количества образующихся спиртов и простых эфиров регулируют изменением температуры и количественного отношения пара к этилену в реагирующих газах. Вообще высокие температуры и избыток пара, способствуют образованию спирта. Гидратация гомологов этилена производится при более низких температурах, нежели гидратация самого этилена. [c.338]
chem21.info
Одноатомные спирты (алканолы)
Номенклатура и классификация
Методы получения
1. Гидратация алкенов (см. тему «Алкены»)
2. Из альдегидов и кетонов восстановлением или действием реактивов Гриньяра (см. тему «Альдегиды и кетоны»).
3. Гидролиз в щелочных условиях моногалогенопроизводных.
Строение
Атомы углерода и кислорода в алифатических спиртах находятся в sp3-гибридизации.
(длины связей С-О и О-Н)
Спирты образуют ассоциаты с помощью водородных связей. Энергия водородных связей составляет 20 кДж/моль, с этим связаны высокие температуры кипения спиртов (т. кип. метанола – 64оС, т. кип. этанола – 78оС).
Реакционная способность
Основные реакционные центры одноатόмных спиртов указаны на схеме:
I. Спирты – ОН –кислоты (кислотные свойства спиртов).
Спирты являются очень слабыми ОН – кислотами, слабее воды.
Значения рКа некоторых спиртов
СН3ОН 15,5 ССl3 – Ch3OH 12
Ch4Ch3OH 15,9 (CF3)3C – OH 6,5
(Ch4)3C – OH 18,0
Для сравнения: рКа Н2О 15,7
Спирты реагируют со щелочными и щелочно-земельными металлами, а так же с солями более слабых кислот, при этом образуются алкоголяты (солеобразные соединения). Алкоголяты легко гидролизуются до спиртов, так как НОН более сильная кислота, чем спирты.
Примеры реакций:
Реакции со щелочами обратимы.
II. Спирты – основания и нуклеофилы
1. Проявление оснόвных свойств
Спирты являются основаниями Льюиса за счет двух НПЭ атомов кислорода, и способны реагировать с протонными кислотами и кислотами Льюиса с образованием солеобразных соединений.
2. Проявление нуклеофильных свойств
Нуклеофильность спиртов как и их основность связана с наличием двух НПЭ. Спирты относятся к слабым нуклеофилам.
а) реакция этерификации – образование сложных эфиров из спиртов и кислот (органических и минеральных). В этом разделе рассматривается образование сложных эфиров карбоновых кислот.
Механизм SN (нуклеофильное замещение ОН-группы в карбоновой кислоте на алкоксигруппу из спирта).
б) Алкоголиз третичных галоидных алкилов; синтез простых эфиров, содержащих углеводородный радикал третичного типа (для первичных и вторичных галогенидов не реализуется).
Механизм SN1
III. Реакции замещения он-группы
Образование сложных эфиров минеральных кислот
2. Реакции замещения он группы на галоген.
а) реакция с HHal (кроме HF – слишком слабая кислота)
Общая схема реакции:
Сила галогеноводородных кислот уменьшается в ряду:
В случае HI реакция идет до образования алкана
Поскольку реакция равновесна и присутствие воды сдвигает равновесие влево, HCl и HBr используют в виде газов или концентрированных кислот, связывание воды и смещают равновесие реакции вправо.
Замещение ОН-группы в спиртах относится к реакциям нуклеофильного замещения. В качестве нуклеофилов выступают бромид- и хлорид-анионы, причём Br- более сильный нуклеофил, чем Cl- (электроотрицательность брома меньше электроотрицательности хлора, размер атома брома больше размера атома хлора).
Для первичных спиртов реакция с HCl идет только в присутствии безводного ZnCl2, причиной является высокая прочность связи С-О в первичных спиртах (для ее разрыва необходима помощь кислоты Льюиса).
Механизм SN2 (для RпОН)
1-й этап: связывание ОН-группы и катализатора (образование оксониевого иона) для превращения ОН-группы в хорошую уходящую группу.
2-й этап: нуклеофильная атака хлор-аниона, образование переходного состояния.
Вторичные и третичные спирты реагируют без катализатора по механизму SN1.
Механизм SN1 (для RтОН)
1-й этап: превращение ОН-группы в хорошую уходящую группу (*) за счет протонирования кислорода.
2-й этап: диссоциация с образованием карбкатиона.
Реакции с HBr идут легче, т.к. нуклеофильность бром-аниона больше нуклеофильности хлор-аниона.
б) Реакции с SOCl2, PCl5
Использование хлористого тионила и пятихлористого фосфора, является наиболее удобным способом получения хлоридов всех типов. Реакции с SOCl2 и PCl5 идут через образование промежуточного соединения, в котором ОН-группа превращается в хорошую уходящую (сложноэфирную) группу на первомэтапе взаимодействия с реагентом. Далее эта группа удаляется при внутримолекулярной нуклефильной атаке галогена.
Реакция с SOCl2
Реакция с PCl5
3.Образование простых эфиров (только для первичных спиртов)
Реакцию можно рассматривать также как межмолекулярную дегидратацию. Кроме концентрированной серной кислоты в качестве водоотнимающего агента используют Al2O3 при 300С. В этих условиях вторичные и третичные спирты не могут давать простые эфиры, они превращаются в алкены, т.е. происходит внутримолекулярная дегидратация.
studfiles.net
Спирты — номенклатура, получение, химические свойства » HimEge.ru

Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп —ОН), соединенных с углеводородным радикалом.
Классификация спиртов
По числу гидроксильных групп (атомности) спирты делятся на:
Одноатомные, например:
Двухатомные (гликоли), например:
Трехатомные, например:
По характеру углеводородного радикала выделяют следующие спирты:
Предельные, содержащие в молекуле лишь предельные углеводородные радикалы, например:
Непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода, например:
Ароматические, т. е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода, например:
Органические вещества,содержащие в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений-фенолы.
Например:
Существуют и полиатомные (многоатомные спирты),содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит)
Номенклатура и изомерия спиртов
При образовании названий спиртов к названию углеводорода,соответствующего спирту,добавляют (родовой) суффикс-ол.
Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-,тетра- и т.д.-их число:
В нумерации атомов углерода в главной цепи положение гидроксильной группы приоритетно перед положением кратных связей:
Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерия углеродного скелета (бутанол-1, 2-метилпропанол-1). Для них характерна и межклассовая изомерия- спирты изомерны простым эфирам:
Давайте дадим название спирту, формула которого указана ниже:
Порядок построения названия:
1. Углеродная цепь нумеруется с конца к которому ближе находится группа –ОН.2. Основная цепь содержит 7 атомов С, значит соответствующий углеводород — гептан.3. Число групп –ОН равно 2, префикс – «ди».4. Гидроксильные группы находятся при 2 и 3 атомах углерода, n = 2 и 4.
Название спирта: гептандиол-2,4
Физические свойства спиртов
Спирты могут образовывать водородные связи как между молекулами спирта, так и между молекулами спирта и воды. Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы.Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения.Так, пропан с относительной молекулярной массой 44 при обычных условиях является газом, а простейший из спиртов-метанол,имея относительную молекулярную массу 32, в обычных условиях-жидкость.
Низшие и средние члены ряда предельных одноатомных спиртов,содержащих от 1 до 11 атомов углерода-жидкости.Высшие спирты(начиная с C12h35OH) при комнатной температуре-твердые вещества. Низшие спирты имеют алкогольный запах и жгучий вкус,они хорошо растворимы в воде.По мере увеличения углеродного радикала растворимость спиртов в воде понижается, а октанол уже не смешивается с водой.
Химические свойства спиртов
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные группы, поэтому химические свойства спиртов определяются взаимодействием друг на друга этих групп.
Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
- Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал,с одной стороны, и вещества,содержащего гидроксильную группу и не содержащего углеводородный радикал,-с другой. Такими веществами могут быть,например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами(замещаться на них)
- Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например: Данная реакция обратима.
- Межмолекулярная дегидратация спиртов- отщепление молекулы воды от двух молекул спиртов при нагревании в присутствии водоотнимающих средств: В результате межмолекулярной дегидратации спиртов образуются простые эфиры.Так, при нагревании этилового спирта с серной кислотой до температуры от 100 до 140°С образуется диэтиловый (серный) эфир.
- Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров( реакция этерификации)Реакция этерификации катализируется сильными неорганическими кислотами. Например, при взаимодействии этилового спирта и уксусной кислоты образуется-этилацетат:
- Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры,чем температура межмолекулярной дегидратации. В результате образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше 140°С в присутствии концентрированной серной кислоты:
- Окисление спиртов обычно проводят сильными окислителями, например, дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты: При окислении вторичных спиртов образуются кетоны:Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе.
- Дегидрирование спиртов. При пропускании паров спирта при 200-300 °С над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:
- Качественная реакция на многоатомные спирты.Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II). Для этиленгликоля можно записать:Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.

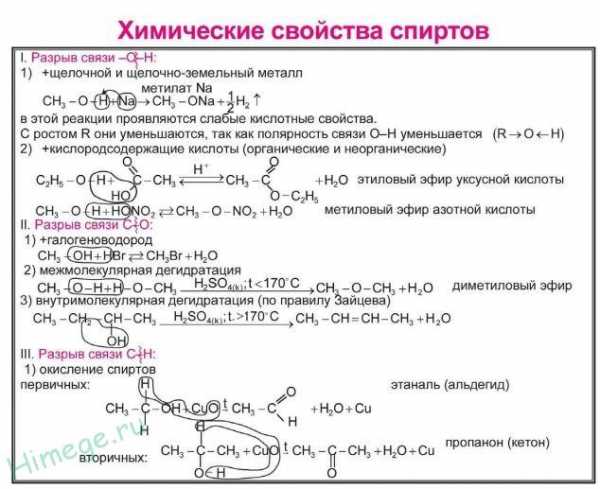
Получение спиртов:
Применение спиртов
Метанол (метиловый спирт СН3ОН) — бесцветная жидкость с характерным запахом и температурой кипения 64,7 °С. Горит чуть голубоватым пламенем. Историческое название метанола — древесный спирт объясняется одним из путей его получения способом перегонки твердых пород дерева (греч. methy — вино, опьянеть; hule — вещество, древесина).
Метанол требует осторожного обращения при работе с ним. Под действием фермента алкогольдегидрогеназы он превращается в организме в формальдегид и муравьиную кислоту, которые повреждают сетчатку глаза, вызывают гибель зрительного нерва и полную потерю зрения. Попадание в организм более 50 мл метанола вызывает смерть.
Этанол (этиловый спирт С2Н5ОН) — бесцветная жидкость с характерным запахом и температурой кипения 78,3 °С. Горюч. Смешивается с водой в любых соотношениях. Концентрацию (крепость) спирта обычно выражают в объемных процентах. «Чистым» (медицинским) спиртом называют продукт, полученный из пищевого сырья и содержащий 96 % (по объему) этанола и 4 % (по объему) воды. Для получения безводного этанола — «абсолютного спирта» этот продукт обрабатывают веществами, химически связывающими воду (оксид кальция, безводный сульфат меди (II) и др.).
Для того чтобы сделать спирт, используемый в технических целях, непригодным для питья, в него добавляют небольшие количества трудноотделимых ядовитых, плохо пахнущих и имеющих отвратительный вкус веществ и подкрашивают. Содержащий такие добавки спирт называют денатурированным, или денатуратом.
Этанол широко используется в промышленности для производства синтетического каучука, лекарственных препаратов, применяется как растворитель, входит в состав лаков и красок, парфюмерных средств. В медицине этиловый спирт — важнейшее дезинфицирующее средство. Используется для приготовления алкогольных напитков.
Небольшие количества этилового спирта при попадании в организм человека снижают болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеобразование, в результате чего происходит обезвоживание организма.
Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты.
В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме — ацетальдегид — крайне ядовит и вызывает тяжелое отравление.
Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью — циррозу печени.
Этандиол-1,2 (этиленгликоль) — бесцветная вязкая жидкость. Ядовит. Неограниченно растворим в воде. Водные растворы не кристаллизуются при температурах значительно ниже О °С, что позволяет применять его как компонент незамерзающих охлаждающих жидкостей — антифризов для двигателей внутреннего сгорания.
Пролактриол-1,2,3 (глицерин) — вязкая сиропообразная жидкость, сладкая на вкус. Неограниченно растворим в воде. Нелетуч. В качестве составной части сложных эфиров входит в состав жиров и масел.
Широко используется в косметике, фармацевтической и пищевой промышленностях. В косметических средствах глицерин играет роль смягчающего и успокаивающего средства. Его добавляют к зубной пасте, чтобы предотвратить ее высыхание.
К кондитерским изделиям глицерин добавляют для предотвращения их кристаллизации. Им опрыскивают табак, в этом случае он действует как увлажнитель, предотвращающий высыхание табачных листьев и их раскрошивание до переработки. Его добавляют к клеям, чтобы предохранить их от слишком быстрого высыхания, и к пластикам, особенно к целлофану. В последнем случае глицерин выполняет функции пластификатора, действуя наподобие смазки между полимерными молекулами и, таким образом, придавая пластмассам необходимую гибкость и эластичность.
himege.ru
3. Химические свойства спиртов
Спирты не обладают ярко выраженными кислотными или основными свойствами. Как сами спирты, так и их водные растворы не проводят электрический ток в заметной степени. Так как алкильная группа является донором электронов, то электронная плотность на атоме кислорода повышена и диссоциация связи О—Н проходит еще в меньшей степени, чем в молекуле воды:
Благодаря доступности и способности вступать в многочисленные химические реакции спирты играют громадную роль в различных, в том числе в промышленных, синтезах.
Реакции, в которые вступают спирты, можно разбить на следующие группы.
1. Реакции, идущие с участием атома водорода гидроксильной группы.
2. Реакции, происходящие с замещением или отщеплением всей гидроксильной группы.
3. Реакции окисления, в которых одновременно принимают участие гидроксильная группа, α-водородные атомы или даже соседние связи углерод — углерод.
1. Реакции, идущие с участием атома водорода гидроксильной группы
Атом водорода гидроксила обладает определенной подвижностью и способен к легкому замещению.
А) Замещение атома водорода в гидроксиле металлом.
Вещества, получающиеся в результате такого замещения называются алкоголятами:
Алкоголяты, образуемые метиловым спиртом, называют метилатами, образуемые этиловым спиртом — этилатами и т. д.
Алкоголяты — твердые вещества, легко растворимые в спирте. Алкоголяты натрия — нестойкие соединения, быстро темнеют (осмоляются) на воздухе, особенно при нагревании. Наиболее устойчив метилат натрия. В присутствии следов влаги алкоголяты натрия разлагаются, и вновь образуется спирт:
Реакция образования алкоголята иллюстрирует сходство спиртов с водой. Низшие спирты (СН3ОН, С2Н5ОН) реагируют с натрием бурно, средние — слабо, а высшие реагируют лишь при нагревании. Алкоголяты образуются при действии на спирты и других активных металлов, например магния, алюминия. В реакции образования алкоголята спирт проявляет свойства слабой кислоты.
Б) Замещение атома водорода в гидроксиле ацильной группой с образованием сложных эфиров.
При взаимодействии спиртов с органическими кислотами (лучше в присутствии следов сильных кислот) получаются сложные эфиры:
Реакция образования сложных эфиров называется реакцией этерификации. Реакция этерификации обратима: вода в присутствии кислот или щелочей разлагает сложные эфиры с образованием исходных веществ — кислоты и спирта. Такое гидролитическое разложение сложных эфиров называется реакцией гидролиза. Реакция этерификации, а также образующиеся в результате ее эфиры имеют очень важное промышленное значение.
2. Реакции, идущие с замещением или отщеплением всей гидроксильной группы
Гидроксильная группа спирта в некоторых реакциях обладает известной подвижностью и может замещаться или отщепляться.
А) Замещение гидроксила на галоген с образованием гадогенопроизводных углеводородов.
Обычно реакция осуществляется при действии на спирты галогенидов фосфора или серы, а также галогеноводородов:
Реакция взаимодействия спирта с галогенопроизводными кислотами обратима. Чтобы добиться большего выхода, т. е. сдвинуть равновесие вправо, необходимо удалять из реакционной смеси воду. Поэтому реакцию ведут в присутствии водоотнимающих веществ, например концентрированной серной кислоты, или же в безводный спирт пропускают газообразный галогеноводород. Чтобы уменьшить количество присутствующей воды, удобнее брать не галогеноводородную кислоту, а ее соль и выделять из нее сухой галогеноводород действием концентрированной серной кислоты.
Б) Образование олефинов путем отщепления воды
При нагревании спирта с большим количеством крепкой серной кислоты или хлоридом цинка, а так же при пропускании паров спирта при 350—500 °С через трубку с оксидом алюминия происходит реакция дегидратации (отнятие воды) и образуются этиленовые углеводороды. Так, например, из этилового спирта получается этилен:
Образование молекулы воды происходит за счет гидроксила и атома водорода у соседнего атома углерода (реакция β-элиминирования).
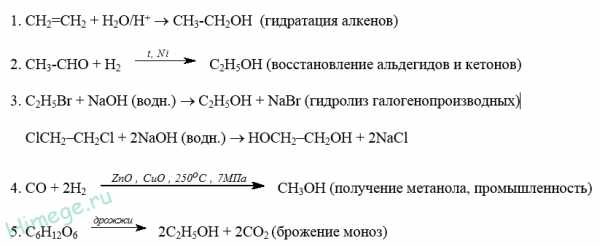
Легче всего дегидратируются третичные, потом вторичные и затем уже первичные спирты. В спиртах сложного строения преимущественно отщепляется третичный (3-водородный атом, гораздо в меньшей степени — вторичный, и практически не отщепляется первичный (правило Зайцева):
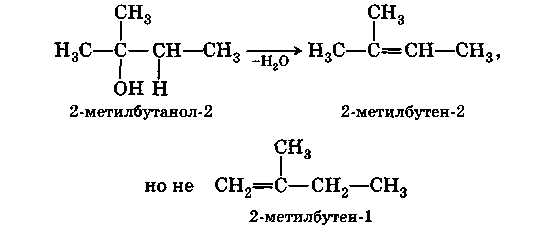
В) Межмолекулярная дегидратация.
При нагревании избытка спирта с серной кислотой или при пропускании паров спирта через порошкообразный безводный сульфат алюминия при 200°С наряду с этиленовыми углеводородами получаются и простые эфиры:
Г) Замена гидроксида на аминогруппу. В жестких условиях (300 °С, оксид алюминия) гидроксильная группа спиртов может быть заменена на аминогруппу с образованием первичных аминов:
Реакция осложняется образованием вторичных (R2NН) и третичных (R3N) аминов в результате взаимодействия спирта с уже образовавшимися аминами.
Реакции окисления, в которых одновременно принимают участие гидроксильная группа, α-водородные атомы или даже соседние связи углерод — углерод
А) Отщепление водорода (дегидрогенизация, дегидрирование).
При пропускании паров спирта при 200—300°С над мелко раздробленной медью или серебром первичные спирты превращаются в альдегиды, а вторичные — в кетоны. Реакция идет с выделением водорода:
Б) Окисление спиртов.
Окисление обычно проводят сильными окислителями, например К2Сг207 + Н2SО4 или КМп04 + + Н2SО4. При окислении спиртов действие окислителя направляется на тот углеродный атом, который уже связан с гидроксильной группой. Следовательно, в зависимости от того, какой спирт окисляется — первичный, вторичный или третичный, получаются различные продукты окисления.
При окислении вторичных спиртов образуются кетоны:
Окисление первичных спиртов происходит аналогично, но так как в первичных спиртах у углеродного атома, связанного с гидроксилом, на один атом водорода больше, чем во вторичных, то продуктами окисления в этом случае являются альдегиды:
Эту реакцию трудно осуществить с высоким выходом из-за легкой окисляемости образовавшегося альдегида до соответствующей карбоновой кислоты.
studfiles.net
Температуры кипения некоторых спиртов и изомерных им простых эфиров
| Спирт | Формула | Т кип., оС |
| Метанол | СН3ОН | 64,5 |
| Этанол | СН3СН2ОН | 78 |
| Диметиловый эфир (метоксиметан) | Ch4OCh4 | -24.9 |
| Пропанол-1 | СН3СН2СН2ОН | 97 |
| Метилэтиловый эфир (метоксиэтан) | СН3СН2ОCh4 | 7.9 |
| Бутанол-1 | Ch4(Ch3)3OH | 117 |
| Диэтиловый эфир (этоксиэтан) | СН3СН2ОCh3Ch4 | 34.6 |
Кислотно-основные свойства спиртов
в водном растворе кислотность спиртов изменяется следующим образом:
h3O > СН3ОН > СН3СН2ОН > (СН3)2СНОН > (СН3)3СОН
Формально, такой последовательности изменения кислотности спиртов можно было бы ожидать на основании увеличения индукционного эффекта радикалов в этом ряду, что, в свою очередь, должно приводить к увеличению электронной плотности на атоме кислорода спирта. Вследстсвие этого долж-но наблюдаться уменьшение кислотности спиртов. Однако более вероятным представляется образование менее прочной водородной связи в этом направ-лении, вследствие увеличения пространственных препятствий по мере увеличения объёма углеводородного радикала в ряду:
Ch4 < C2H5 < (Ch4)2CH < (Ch4)3C
Образование водородной связи всегда предшествует переносу протона в гидроксилсодержащих растворителях. В Таблице 2 приведены данные о кислотности простейших спиртов, которые подтверждают это положение.
Таблица 2
Кислотность спиртов
| RОН | рKa. |
| (СН3)3СОН | 18,0 |
| (СН3)2СНОН | 17,1 |
| СН3СН2ОН | 15,9 |
| СН3ОН | 15,5 |
| НОН | 15,7 |
Из этих данных следует, что равновесие в системе спирт – щелочь всегда смещено в сторону спирта, а не алкоголята:
Для количественного превращения спирта в алкоголят требуется использова-ние гораздо более сильных оснований, таких как гидриды или амиды щелоч-ных или щелочноземельных металлов или реактивов Гриньяра.
По отношению к сильным минеральным кислотам спирты проявляют свойства оснований и образуют соли алкоксония:
основание кислота кислота' основание'
Эта реакция является первой стадией в реакциях спиртов, протекащих в кислой среде, т.е., при замещении гидроксильной группы на галоген, дегидратации спиртов и образовании простых эфиров.
Замещение гидроксильной группы на галоген. Получение алкилгалогенидов
Известно много способов замены гидроксильной группы спирта на галоген. Эти методы замещения гидроксила на галоген основаны на реакции спиртов с галогеноводородами, а также с галогенидами фосфора и оксогалогенидами фосфора и серы.
Получение алкилгалогенидов из спирта и галогеноводородных кислот
ROH + HHal → RHal + Н2O
Реакционная способность галогеноводородов уменьшается в ряду HI > HBr > HC1 >> HF. Скорость реакции замещения возрастает в ряду первич-ный > вторичный > третичный спирт. Для получения третичных алкилгало-генидов обычно достаточно обработать третичный спирт концентрирован-ным водным раствором соляной, бромистоводородной или йодистоводород-ной кислоты при комнатной температуре. Для получения первичных и вторичных алкилбромидов и алкилйодидов обычно требуется нагревание смеси спирта с концентрированной бромистоводородной или йодисто-водородной кислотой. Вместо концентрированных водных растворов НВr и HI можно использовать бромиды и йодиды натрия или калия и концентрированную серную или фосфорную кислоту. Выходы алкилгалогенидов по этому методу обычно составляют 75—90%. Отдельные примеры приведены ниже.
Первой стадией реакции является образование из спирта иона алкоксония
Следующей стадией для первичных спиртов и некоторых вторичных является SN2 реакция замещения воды в катионе алкоксония на галоген:
для получения алкилхлоридов при взаимодействии первичных спиртов с соляной кислотой используют электрофильный катализатор - безводный хлорид цинка. Смесь соляной кислоты и хлорида цинка носит название реактива Лукаса. В отсутствии катализатора реакция протекает с гораздо меньшей скоростью.
Третичные спирты и некоторые вторичные взаимодействуют с гало-геноводородом по механизму SNl с образованием в качестве интермедиата карбокатиона, который далее с анионом галогена образут конечный продукт.
studfiles.net
Конденсация спиртов с образованием простых эфиров
Спирты-это производные углеводородов, содержащие одну или несколько групп ОН. Простые эфиры-родственные спиртам соединения, которые образуются в реакции конденсации из двух молекул спиртов в результате отщепления от них одной молекулы воды. Окисление первичных спиртов приводит к образованию альдегидов при дальнейшем окислении альдегидов получаются карбоновые кислоты. Окисление вторичных спиртов приводит к образованию кетонов. [c.435]
Конденсация спиртов с простыми эфирами фенолов в присутствии хлористого алюминия проходит подобно аналогичной реакции с ароматическими углеводородами, т. е. с образованием алкилированных фенолов и эфиров фенола. [c.626]
Гидрирование более сложных фурановых веществ, например, продуктов конденсации фурфурола с различными кетонами и альдегидами приводит к образованию более высокомолекулярных производных тетрагидрофурана и алифатических соединений, в том числе многоатомных спиртов (20, 89). Уже указывалось, что многие из тетрагидрофурановых спиртов, полученных этим путем, а также их сложных и простых эфиров могут быть рекомендованы как пластификаторы высокополимеров (17, 18, 19). [c.233]
Эфиризация представляет собой реакцию конденсации спиртов, гликолей, фено лов и окисей олефинов с образованием соответственно простых эфиров (диэтилового диизопропилового), ди- и триэтиленгликоля, моноэтилового и других моноэфиров гли [c.318]
Поскольку применяемые растворители являются простыми эфирами, а смешанные магнийорганические соединения при повышенной температуре реагируют с эфирами, целесообразно осуществлять контроль за температурой реакции. После того как реакция началась, галогенид в соответствующем растворителе следует вводить с такой скоростью, чтобы температура реакционной смеси находилась в пределах 40—50° и не достигала температуры кипения растворителя. При этих условиях можно избежать таких нежелательных реакций, как диспропорциониро-вание и конденсация продуктов реакции. Далее, магнийорганические соединения даже сложного характера не реагируют в заметной степени с ТГФ при обычной температуре [77]. Только при повышенной температуре (.190—200°) ТГФ, представляющий собой 1,4-эпоксисоединение, реагирует с магнийорганическими соединениями с образованием первичных спиртов, содержащих четыре дополнительных атома углерода [63]. [c.8]
Для ПВС характерны все реакции многоатомных спиртов. Гидроксильные группы могут вступать в реакции этерификации с образованием простых и сложных эфиров, в реакции конденсации с альдегидами и кетонами, с металлическим натрием и т. п. [c.243]
Полимеризация олефиновых углеводородов и алкилирование циклических соединений олефинами тот же катализатор может быть применен при конденсации простых эфиров или спиртов с ароматикой, фенолами и альдегидами катализатор пригоден также для галоидирования ненасыщенных соединений и реакций изомеризации этот катализатор можно использовать для образования сложных эфиров из карбоновых кислот и олефиновых углеводородов [c.469]
Судить о механизме превращения кетонов над алюмосили-катными катализаторами по образующимся продуктам реакции очень трудно. Основным продуктом реакции по схеме (1) должен быть сложный эфир третичного спирта — соединение, легко гидролизующееся водой даже на холоде [20]. Поэтому при повышенных температурах более вероятным является присутствие не самих сложных эфиров, а продуктов их гидролиза — спиртов и кислот. В свою очередь, образующиеся спирты, в зависимости от их строения, отщепляют воду, давая непредельные углеводороды или простые эфиры. Третичные спирты легко дегидратируются с образованием только непредельных углеводородов под влиянием даже таких мягких реагентов как щавелевая кислота. Наличие непредельных углеводородов и кислот, как продуктов конденсации альдегидов и кетонов жирного ряда, может быть объяснено реакцией (1). Наряду с этой реакцией протекает и параллельная ей реакция уплотнения по типу кротонового альдегида, но при более мягких условиях. [c.40]
Для поливинилового спирта характерны все реакции полиатомных спиртов. Гидроксильные группы могут быть этерифицированы с образованием простых и сложных эфиров, они реагируют с металлическим натрием, вступают в реакцию конденсации с альдегидами, кетонами и т. п. [c.176]
Превращения этих гидроперекисей в ходе окислительного процесса приводят, как указывалось выше, к образованию устойчивых продуктов окисления — органических кислот, карбонильных соединений, спиртов, фенолов, а также продуктов конденсации — простых и сложных эфиров и смолистых веществ. [c.167]
Простейшими реакциями этого типа являются реакции образования эфира из кислоты и спирта или амида из кислоты к амина. Если в процессе конденсации участвуют би- или полифункциональ-ные соединения, то реакция может повторяться, так как на каждой ее стадии (если не имеют места побочные реакции) вновь образуются соединения, обладающие той же функциональностью, что и исход- [c.27]
О к и с ь м е 3 и т и л а — жищкость с сильным запахом и темп. кип. 129,5°, нерастворима в воде. Является прекрасным растворителем ацетил- и нитроцеллюлозы и вероятно нашла бы широкое применение в лаковой про1МЫшленности, если бы не обладала довольно- неприятным запахом. Окись мезитила может вступать в конденсацию с жирными спиртам и с образованием простых эфиров диацетонового алкоголя. [c.446]
Вопрос об образовании простых эфиров метилолмеламинов при взаимодействии последних со спиртами подробно разбирается Коломбе [105] и Гольдштейном [106]. Эти эфиры в присутствии кислых катализаторов подвергаются конденсации с частичным отщеплением спиртовых групп. Образование таких полимеров описано и в патентах[115—119]. Алкилирование проводят н. бутанолом, н. гексанолом, бензиловым спиртом [120— 122], этиленхлоргидрином, пропиловым и октиловым спиртами, 2-этилгексанолом [ 123]. [c.104]
Наиболее близка к реакции образования простых эфиров по своей природе реакция образования ацеталей и кеталей. Это продукты конденсации спиртов с альдегидами и кетонами. [c.141]
Карбоний ионный механизм. Под влиянием серной кислоты олефины подвергаются различным реакциям гидратации, образованию сложных эфиров, нолиморизации и конденсации с ароматическими углеводородами. Наиболее просто механизм различных реакций можно понять с точки зрения нродстаплений об образовании в качестве промежуточного продукта карбопнй-иопа [1381. Так, нанример, в разбавленных растворах кислот третичные олофины подвергаются гидратации в третичные спирты [78, 196, 204, 205 . С бо. гое концентрированными кислотами образуется сложный эфир сорной кислоты [170]. В разбавленных водных растворах кислот вода является главным нуклеофильным агентом, в то время как в 67%-ной серной кислоте концентрация свободной воды ничтожно мала и бисульфат-ион присутствует в очень большой концентрации (ЬХХУП) [c.435]
Реакция дикетена со спиртами представляет собой лучший промышленный способ получения не только простейших эфиров ацетоуксусной кислоты, но и таких эфиров ацетоуксусной кислоты, которые нельзя получить сложноэфирной конденсацией по Кляйзену или путем переэтерификации. Подобные сложные эфиры в некоторых случаях представляют интерес как промежуточные продукты для дальнейших превращений. Например, такие ацилоины, как ацетоин, пропионоин, бензоин и другие, легко реагируют с дикетеном с образованием эфиров ацетоуксусной кислоты, которые при нагревании в присутствии триэтиламина циклизуются в ненасыщенные лактоны (XXX) [159]. Эти лактоны можно превращать в замещенные фураны. При обработке сильной кислотой, например соляной кислотой в уксусной кислоте, лактоны XXX (К=К = алкил или арил, Н" = Н), легко перегруппиро вываются в замещенные р-фуранкар-боновые кислоты с хорошими выходами [160], [c.232]
Следовательно, здесь в результате взаимодействия серной кислоты со спиртом при сильном нагревании (170 °С и выше) в конечном счете от молекулы спирта отщепляется молекула воды, т. е. серная кислота яйляется дегидратирующим агентом, как и при получении простого эфира. Одновременно имеет место и окисляющее действие серной кислоты на органические соединения, сопровождающееся образованием сернистого газа. Поэтому образующийся в опыте 42 Б диизоамиловый эфир ( BHii)gO содержит также полимеры амилена (см. опыт 21) и бурые продукты окисления и конденсации. / [c.108]
В конденсации Михаэля эфиров поликарбоновых кислот выявляются две тенденции. Во-первых, высокозамеЩенные продукты реакции склонны к диссоциации на более простые вещества путем отщепления некоторых небольших молекул, например этилового спирта или малонового эфира, с образованием двойной связи [325, 328—341]. Во-вторых, такие аддукты, содержащие енолизующийся водородный атом и подходящую структуру акцептора, претерпевают внутримолекулярную конденсацию Михаэля с образованием шестичленного цикла. По имеющимся [c.234]
I По данным Г. С. Петрова, в случае конденсации формальдегида с бутиловым спиртом образование ацеталей идет через простые эфиры бутил ]-цеталь с мочевиной не дает смол. [c.99]
На основании изложенного можно утверждать, что при каталитическом алкилировании бензола ацеталями в паровой фазе основными алкилирующими агентами являются соответствующие простые эфиры — продукты первой стадии распада ацеталей. Наряду с этим алкилирование бензола идет также и за счет непредельных углеводородов, возникающих вследствие разложения простого эфира на спирт и алкен или спирта на алкен и воду. В качестве побочных продуктов при этом образуются толуол и ксилол за счет взаимодействия бензола с метиленными радикалами, которые возникают путем сложных превращений формальдегида, всегда образующегося при распаде незамещенных ацеталей. В условиях контакта с алюмосиликатным катализатором образование толуола и ксилолов может совершаться также путем непосредственного метилирования бензола метилформиатом — продуктом конденсации формальдегида по реакции В. Е. Тищенко. [c.1010]
Другое уникальное свойство архебактерий касается состава их мембранных липидов. У них не найдены обычные для эубактерий эфиры глицерина и жирных кислот (см. рис. 14), но присутствуют эфиры, образованные путем конденсации глицерина с терпено-идными спиртами диэфир состоит из глицерина, связанного простыми эфирными связями с двумя молекулами Сзо-спирта фита-нола тетраэфир образован двумя остатками глицерина, соединенными двумя одинаковыми парами С4о-бифитанильных цепей (рис. 102, /, 2). Молекула тетраэфира, таким образом, структурно эквивалентна двум молекулам диэфира. Бифитанильные цепи тетраэфиров могут быть ациклическими или содержать от 1 до 4 пятичленных колец (рис. 102, 3). [c.410]
В СССР в 1953—1954 гг. проводились большие исследования по выбору присадок, предотвращающих образование кристаллов льда в авиационных топливах. В США эти работы стали проводиться только в 1957—1960 гг., когда стало ясно, что другие методы борьбы с образованием кристаллов льда и, в частности, применение подогревателей являются недостаточно эффективными. Исследовалось более 100 индивидуальных химических соединений. По своей природе и механизму действия эти присадки можно разделить на растворимые и поверхностно-активные, или нерастворимые в воде. К первой группе относятся одно- и двуатомные спирты, аминоспирты, кетоспирты, диамины, простые и сложные эфиры, кетоны и некоторые другие соединения [122]. Ко второй группе относятся нафтенаты аммония, натриевые и аммонийные соли алкил-арилсульфонатов, продукты конденсации окиси этилена или три-этаноламина со спиртами и жирными кислотами, полиоксилены, моноолеатглицерин и др. [123]. [c.113]
Образующийся таким образом активный ацетат соединяется с оксалилуксусной кислотой с помощью процесса, напоминающего синтез ацетоуксусного эфира из этилацетата конденсацией Клайзена, и дает связанную с ферментом лимонную кислоту. Последняя затем дегидратируется и изомеризуется до цйс-аконитовой кислоты и присоединяет воду в обратном порядке с образованием изолимонной кислоты, которая является легко окисляемой а-оксикислотой. Ферментативное окисление веществ этого типа, проходящее по механизму гидридного перехода к пиридиновому циклу, обсуждалось на стр. 86 и имеет простые химические аналогии среди процессов окисления спиртов. [c.124]
Трехфтористый бор. Сообщено о том, что применение трехфтористого Гюра в качестве катализатора при алкилировании фенолов и простых фенольных эфиров пропиленом [38] и при алкилировании салициловой кислоты пропиленом [39] дало хорошие результаты. Содер канием очень многих патентов является применение галоидных соединений бора вместо хлористого алюминия для реакций Фриделя—Крафтса, д.гя крекинга и для реакций присоединения га.лоидного водорода к олефинам [40]. Комплексы фтористого бора со спиртами и с анг-идридами кислот оказались эффективными катализаторами для реакций конденсации Фриделя — Крафтса [41]. Трехфтористый бор главным образом применяется в качестве катализатора для полпмеризацни в его присутствии о[сазалось возможным образование твердого полимерного соединения нз олефинов (см. стр. 799). Трехфтористый бор—бо.пее глубоко действующий каталх затор для реакций Фриделя — Крафтса, чем хлористый алюминий, и по этой причине он имеет очень ограниченное применение в рассматриваемой области. [c.892]
chem21.info
Химические свойства спиртов — Мегаобучалка
Спирты являются очень слабыми кислотами .Их pKa = 16-18. Однако они гораздо более сильные кислоты, чем ацетилен (рКа= 22) и аммиак (рКа=35). Поэтому легко, при комнатной температуре низшие спирты реагируют с ацетиленидами щелочных металлов и с амидом натрия:
Со щелочами спирты реагируют обратимо. Равновесие сильно смещено в сторону исходных веществ, так как вода значительно более сильная кислота, чем спирты:
В связи с этим при реакциях галогенпроизводных бензола со щелочами, проводимых в спирте, получается больше продукта I, чем II, так как
скорость реакции с метилат –ионом намного выше, чем с гидроксид-ионом, хотя последнего в равновесии больше.
Спирты могут взаимодействовать с очень многими реагентами. Ниже приведены наиболее важные из этих реакций:
Спиртыреагируют с активными металлами:
Реакции, приведённые ниже, используются для абсолютирования спиртов, то есть для удаления из них воды путём её химического связывания. К магниевым стружкам приливают
спирт, содержащий около 4% воды, и кипятят, добавляя йод для активации первой реакции:
Полученный этилат магния самопроизвольно реагирует с водой – обычный гидролиз соли слабого основания и слабой кислоты:
С менее активными металлами, такими как Al, Zn, Fe спирты не реагируют.
Спирты могут реагировать с концентрированными галогеноводородными кислотами в присутствии ZnCl2 (р. Лукаса):
Эти реакции – хороший пример для иллюстрации положения теории А.М.Бутлерова о влиянии строения на химические свойства. Как видно скорость реакции с одним и тем же реагентом в случае третичных спиртов намного выше, чем для вторичных, а те в свою очередь реагируют быстрее первичных.
С кислородсодержащими кислотами спирты реагируют с образованием сложных эфиров этих кислот:
Спирты реагируют с аммиаком. Реакция обратима. Равновесие в ней смещают вправо избытком аммиака в соответствии с принципом Ле-Шателье:
Спирты реагируют с аминами.
Примежмолекулярной дегидратации спиртов образуются простые эфиры:
При дегидратировании в газовой фазе на гетерогенном катализаторе – оксиде алюминия равновесие смещают вправо, понижая давление, так как в реакции из одного моля газа получается два (в соответствии с принципом Ле-Шателье)
При внутримолекулярной дегидратации получаются алкены. В соответствии с правилом Зайцева водород преимущественно отщепляется от менее гидрогенизированного атома углерода из двух соседних с тем атомом углерода, который связан с гидроксилом
Спирты взаимодействуют с непредельными углеводородами:
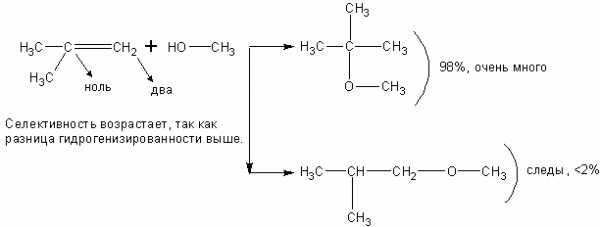
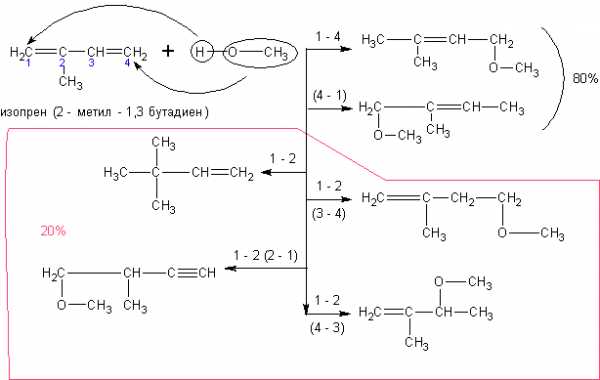
При реакции спиртов с ацетиленом получаются очень важные для синтеза полимеров виниловые эфиры:
Алкадиены со спиртами так же дают непредельные простые эфиры:
С аренами спирты не реагируют. Они не реагируют также с галогенпроизводными алканов. Однако соли спиртов – алкоголяты реагируют с ними очень легко. В результате реакции получаются простые эфиры (лучший способ получения несимметричных простых эфиров):
Реакция спиртов с альдегидами (получение полуацеталей).
При реакции спиртов с полуацеталями получаются ацетали:
Полуацетали и ацетали, как правило, обладают хорошим запахом, выделяются из растений и часто служат компонентами парфюмерных композиций.
Реакция спиртов с кетонами аналогична их взаимодействию с полуацеталями, но проходит в более жестких условиях.
Спиртывзаимодействуют с альдегидами и кетонами по реакции Меервейна – Понндорфа – Верлея, о которой было подробно рассказано в пункте 9 способов получения спиртов. Здесь приведём другой пример этой реакции:
Спирты взаимодействуют также и с карбоновыми кислотами. При этом обратимо получаются сложные эфиры и вода. Процесс называется реакцией этерификации.
Спирты могут взаимодействовать также со сложными эфирами. Получается новый спирт и новый сложный эфир. Реакция носит характер обратимой , катализируется кислотами и называется реакцией переэтерификации спиртом. Она очень широко применяется в синтезах душистых веществ для парфюмерных композиций.
Спирты могут окислятьсяв различных условиях до различных продуктов:
а) При горении:
б) При окислении паров первичных и вторичных спиртов оксидом медиполучаютсясоответственноальдегиды и кетоны,например:
в) При дегидрировании спиртов на катализаторах платиновой группы первичные спирты окисляются до альдегидов, а вторичные - до кетонов:
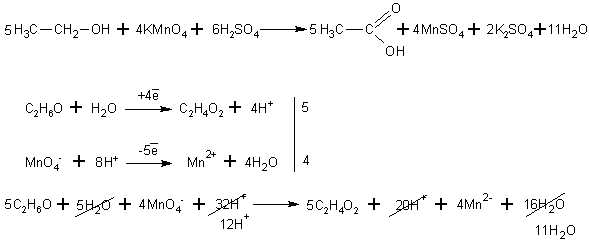
При окислении спиртов в жидкой фазе в кислой среде сильными окислителями, такими как перманганат калия, дихромат калия или висмутат натрия первичные спирты окисляются до карбоновых кислот. Вторичные - до кетонов. Например, этанол до уксусной кислоты:
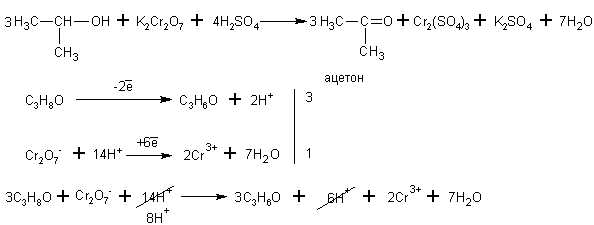
Изопропиловый спирт окисляется до кетона (до пропанона )
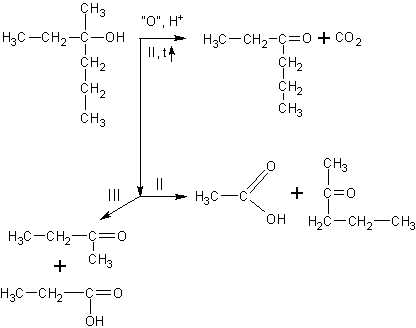 Окисление третичных спиртов идет
Окисление третичных спиртов идет
только при нагревании с разрывом C-C связи. Получается сложная смесь карбоновых кислот, кетонов и углекислый газ:
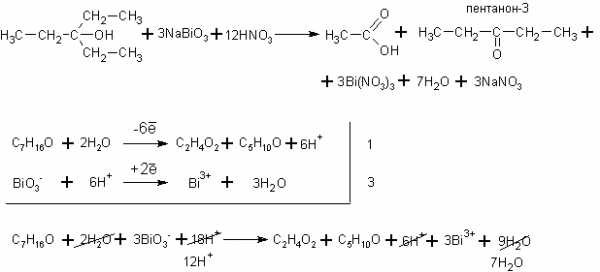
Если все алкильные радикалы одинаковы, то реакция может быть уравнена. Ниже приведена реакция окисления третичного спирта – триэтилкарбинола висмутатом натрия в среде разбавленной азотной кислоты:
megaobuchalka.ru
















