Меню сайта | ГДЗ к § 08. Вещества молекулярного и немолекулярного строения
| Новые файлы Статистика Онлайн всего: 1 Гостей: 1 Пользователей: 0 | |||||||||||||||
ГДЗ Боровских Т.
 А. Рабочая тетрадь по химии Урок 6 РЕШЕБНИК ОТВЕТЫ » Крутые решение для вас от GDZ.cool
А. Рабочая тетрадь по химии Урок 6 РЕШЕБНИК ОТВЕТЫ » Крутые решение для вас от GDZ.cool
ГДЗ Боровских Т.А. Рабочая тетрадь по химии Урок 6 РЕШЕБНИК ОТВЕТЫ
Другие задания смотри здесь…
Красным цветом даются ответы, а фиолетовым ― объяснения. |
Задание 1
При обычных условиях ― газы, жидкости или легкоплавкие твердые вещества, имеют низкие температуры плавления и кипения, часто летучи и имеют запах.
Примеры: кислород, водород, азот, вода, метан, спирт, эфир, кристаллическая сера, белый фосфор.
Задание 2
Вещества немолекулярного строения, в отличие от веществ молекулярного строения, твердые, имеют высокие температуры плавления и кипения, нелетучи, не имеют запаха.
Задание 3
Кристаллический иод имеет молекулярные кристаллические решётки, а алмаз ― атомные кристаллические решётки.
Задание 4
Вода ― вещество молекулярного строения, а хлорид натрия ― немолекулярного (ионного) строения.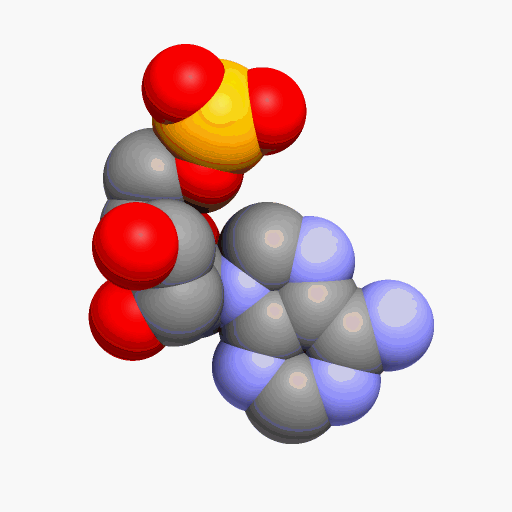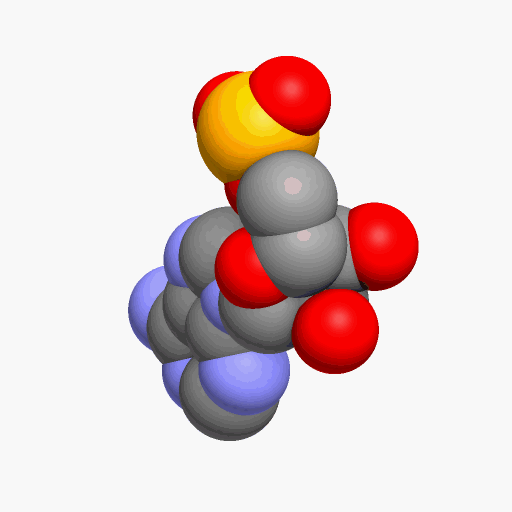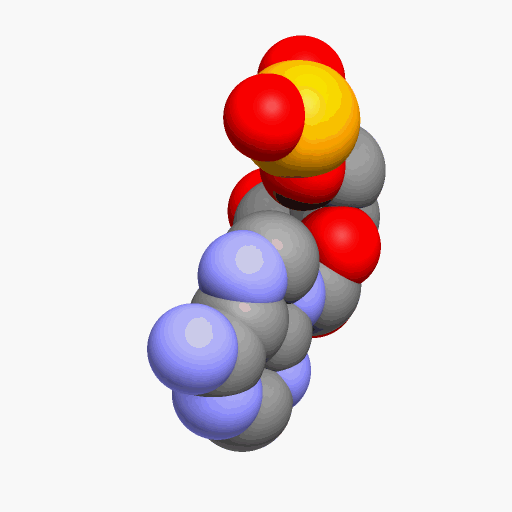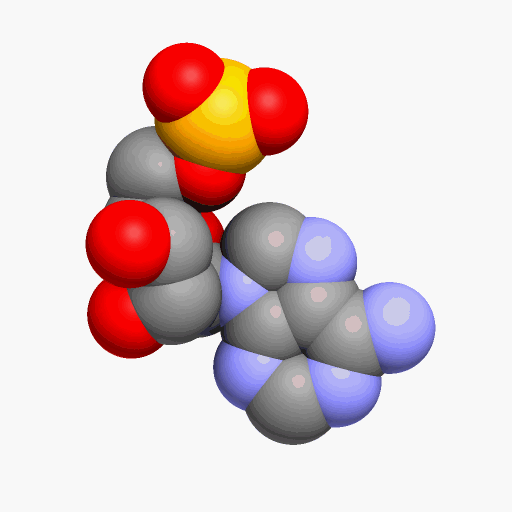
Задание 5 Тестовые задания.
ТЕСТ 1
Верные суждения о молекулах:
А. Молекулы являются химически делимыми частицами.
Б. Молекулы состоят из атомов.
3) верны оба суждения
ТЕСТ 2
Соответствие обозначено одинаковым цветом.
| Название элементарной частицы | Заряд |
| 1) протон 2) нейтрон 3) электрон | А. -1 Б. +1 В. 0 |
ТЕСТ 3
Кристаллическая решётка углекислого газа:
1) молекулярная
ТЕСТ 4
Соответствие обозначено одинаковым цветом.
| Кристаллическая решётка вещества | Свойства |
| 1) молекулярная 2) ионная 3) атомная | А. твёрдое, тугоплавкое, не растворяется в воде Б. хрупкое, легкоплавкое, не проводит электрический ток В. твёрдое, тугоплавкое, хорошо растворяется в воде |
Задание 6
Простые вещества: кислород, водород, сера, алюминий, железо.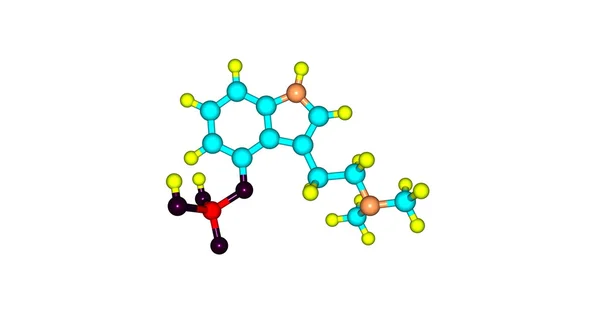
Сложные вещества: вода, сульфид железа, поваренная соль.
Задание 7
Как экспериментально доказать, что сахар — это вещество сложное? При нагревании сахар обуглится, что докажет наличие в его составе углерода, а появление каплей воды на стенках пробирки — водорода и кислорода.
Задание 8
Как можно доказать, что воздух — это смесь веществ, а не химическое соединение? С жидкого воздуха перегонкой (физическим методом разделения смесей) получают простые вещества: азот, кислород, аргон и др.
Задание 9. Тестовые задания.
ТЕСТ 1
Простое вещество изображено на рисунке: 4)
Простые вещества состоят из атомов одного химического элемента.
ТЕСТ 2
Сложное вещество изображено на рисунке: 2)
Сложные вещества образованы атомами двух и более химических элементов.
ТЕСТ 3
Смеси показаны на рисунках: 3) и 4)
Смеси состоят из молекул разного вида.
Другие задания смотри здесь…
9.4: Эфиры — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 15423
Цели обучения
- Описать структурные различия между спиртом и эфиром, которые влияют на физические характеристики и реакционную способность каждого из них.

- Назовите простые эфиры.
- Опишите структуру и применение некоторых эфиров.
С общей формулой ROR’ простой эфир можно рассматривать как производное воды, в котором оба атома водорода заменены алкильными или арильными группами. Его также можно считать производным спирта (ROH), в котором атом водорода группы OH заменен второй алкильной или арильной группой:
\[\mathrm{HOH\underset{H\:atomic}{ \xrightarrow{replace\: Both}}ROR’\underset{of\: OH\: group}{\xleftarrow{replace\: H\: atom}}ROH} \nonumber \]
Простые эфиры имеют простые общие названия, образованные из названий групп, присоединенных к атому кислорода, за которыми следует общее название эфир . Например, CH 3 –O–CH 2 CH 2 CH 3 представляет собой метилпропиловый эфир. Если обе группы совпадают, перед названием группы должен стоять префикс di -, как в случае диметилового эфира (CH 3 –O–CH 3 ) и диэтилового эфира CH 3 CH 2 – O–CH 2 CH 3 .
Молекулы эфира не имеют атома водорода при атоме кислорода (то есть группы ОН). Следовательно, межмолекулярная водородная связь между молекулами эфира отсутствует, и поэтому эфиры имеют довольно низкие температуры кипения для данной молярной массы. Действительно, температуры кипения простых эфиров примерно такие же, как у алканов сравнимой молекулярной массы, и значительно ниже, чем у соответствующих спиртов (таблица \(\PageIndex{1}\)).
| Краткая структурная формула | Имя | Молярная масса | Температура кипения (°С) | Межмолекулярная водородная связь в чистой жидкости? |
|---|---|---|---|---|
| CH 3 CH 2 CH 3 | пропан | 44 | –42 | нет |
| СН 3 ОСН 3 | диметиловый эфир | 46 | – 25 | нет |
| СН 3 СН 2 ОН | спирт этиловый | 46 | 78 | да |
| CH 3 CH 2 CH 2 CH 2 CH 3 | пентан | 72 | 36 | нет |
| CH 3 CH 2 OCH 2 CH 3 | диэтиловый эфир | 74 | 35 | нет |
| CH 3 CH 2 CH 2 CH 2 OH | бутиловый спирт | 74 | 117 | да |
Однако молекулы эфира содержат атом кислорода и образуют водородные связи с молекулами воды. Следовательно, эфир имеет примерно такую же растворимость в воде, как изомерный ему спирт. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) мало растворимы в воде (8 г/100 мл воды).
Следовательно, эфир имеет примерно такую же растворимость в воде, как изомерный ему спирт. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) мало растворимы в воде (8 г/100 мл воды).
Пример \(\PageIndex{1}\)
Каково общее название каждого эфира?
- CH 3 CH 2 CH 2 OCH 2 CH 2 CH 3
Solution
- Углеродные группы по обе стороны от атома кислорода представляют собой пропильные группы (CH 3 CH 2 CH 2 ), поэтому соединение представляет собой дипропиловый эфир.
- Трехуглеродная группа присоединена к среднему атому углерода, поэтому это изопропильная группа. Одноуглеродная группа представляет собой метильную группу.
 Соединение представляет собой изопропилметиловый эфир.
Соединение представляет собой изопропилметиловый эфир.
Упражнение \(\PageIndex{1}\)
Каково общее название каждого эфира?
- СН 3 СН 2 СН 2 СН 2 ОСН 2 СН 2 СН 2 9040 СН 3 9 СН 3
Для вашего здоровья: эфиры в качестве общих анестетиков
Общий анестетик воздействует на мозг, вызывая потерю сознания и общую нечувствительность к ощущениям или боли. Диэтиловый эфир (CH 3 CH 2 OCH 2 CH 3 ) был первым общим анестетиком, который использовался.
Диэтиловый эфир относительно безопасен, поскольку существует довольно большой разрыв между дозой, вызывающей эффективный уровень анестезии, и летальной дозой. Однако, поскольку он легко воспламеняется и имеет дополнительный недостаток, вызывающий тошноту, его заменили более новыми ингаляционными анестетиками, включая фторсодержащие соединения галотан, энфлуран и изофлуран.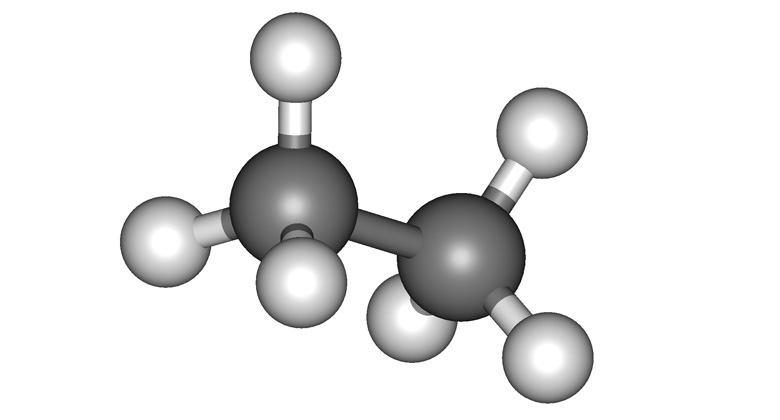 К сожалению, безопасность этих соединений для персонала операционной ставится под сомнение. Например, женщины, работающие в операционных, подвергшиеся воздействию галотана, чаще страдают от выкидышей, чем женщины в общей популяции.
К сожалению, безопасность этих соединений для персонала операционной ставится под сомнение. Например, женщины, работающие в операционных, подвергшиеся воздействию галотана, чаще страдают от выкидышей, чем женщины в общей популяции.
Чтобы дать эфирам общие названия, просто назовите группы, присоединенные к атому кислорода, а затем общее название эфир . Если обе группы одинаковы, перед названием группы должен стоять префикс di -. Молекулы эфира не имеют группы ОН и, следовательно, не имеют межмолекулярных водородных связей. Следовательно, эфиры имеют довольно низкие температуры кипения для данной молярной массы. Молекулы эфира имеют атом кислорода и могут образовывать водородные связи с молекулами воды. Молекула эфира имеет примерно такую же растворимость в воде, как изомерный ей спирт.
9.4: Ethers распространяется под лицензией CC BY-NC-SA и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Программа OER или Publisher
- Издатель, имя которого нельзя называть
- Показать страницу TOC
- № на стр.

- Включено
- да
- Теги
Что такое безводный диэтиловый эфир?
Обновлено 26 марта 2020 г.
Автор: Lan Luo
Эфиры представляют собой класс органических соединений, содержащих функциональную группу простого эфира. Эфир имеет общую формулу R-O-R’, где R и R’ представляют любую алкильную или арильную группу, присоединенную к атому кислорода. Диэтиловый эфир или этиловый эфир является одним из примеров эфира.
Однако из-за его распространенности в органической химии и биохимии диэтиловый эфир часто используется взаимозаменяемо с «эфиром». Путем удаления воды из диэтилового эфира образуется безводный (сухой) диэтиловый эфир, который обычно используется в качестве растворителя в лабораториях органической химии.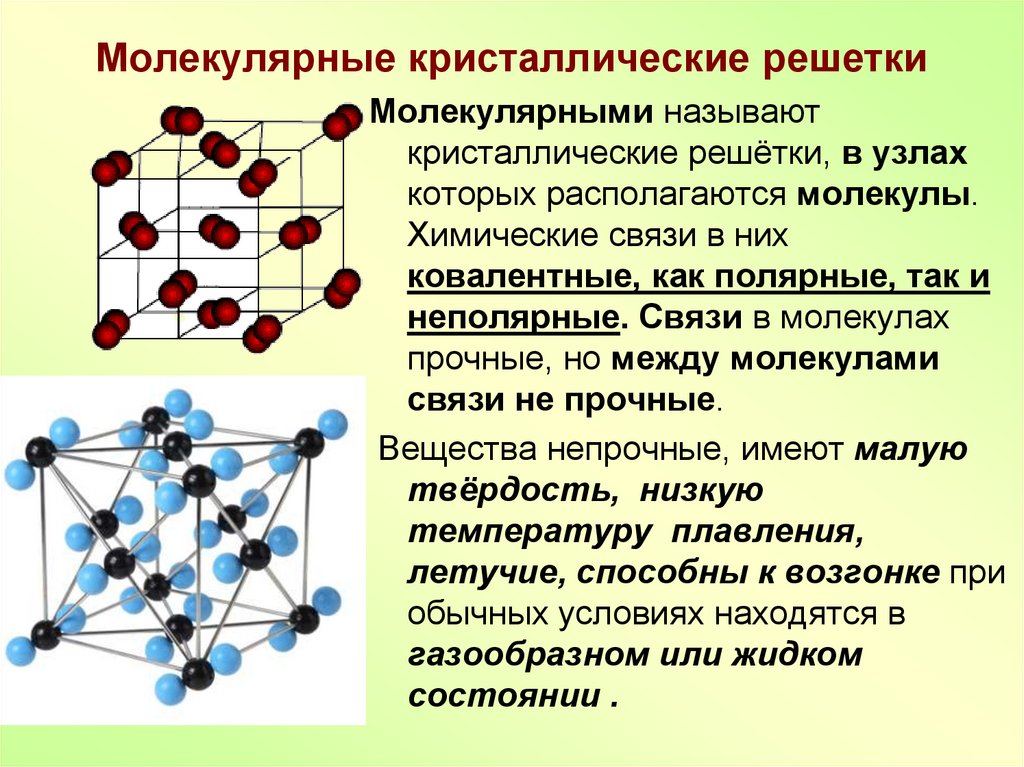
Свойства диэтилового эфира
Диэтиловый эфир имеет химическую формулу C 4 H 10 O и молекулярную массу 74,12 г/моль. Он бесцветен, но имеет сильный отчетливый запах и острый сладкий вкус. Этиловый эфир легко воспламеняется и летуч. Температура кипения диэтилового эфира составляет 34,6 ° C, а температура плавления диэтилового эфира составляет -116,3 ° C. Структура диэтилового эфира: CH 3 -CH 2 -O-CH 2 -CH 3 , с шарико-стержневой моделью следующим образом:
Хотя простые эфиры обладают высокой химической стабильностью , они могут подвергаться расщеплению с помощью определенных реагентов или в экстремальных условиях. Диэтиловый эфир также может образовывать перекиси в присутствии кислорода и света. Это также основание Льюиса и Бренстеда и важный растворитель для реактивов Гриньяра.
Синтез диэтилового эфира
Промышленное производство диэтилового эфира осуществляется конденсация спиртов . При повышенных температурах (от 130°С до 140°С) две молекулы спирта конденсируются, образуя одну молекулу эфира и воды. Эта реакция катализируется кислотами, обычно серной кислотой, с механизмом, описанным ниже:
••• Нарисовано с помощью ChemDraw
Однако при температуре выше 150 °C этанол подвергается дегидратации (элиминированию) с образованием этилена. Этот метод конденсации также непригоден для получения несимметричных эфиров. Поскольку нет способа контролировать, какой ОН протонируется или действует как нуклеофил, это приведет к смеси двух разных симметричных и желаемого несимметричного эфира.
Для безводного диэтилового эфира продукт конденсации сушат над тонкими пластинами металлического натрия с последующей перегонкой на водяной бане. Более удобный метод сушки лабораторного диэтилового эфира заключается в использовании осушителя, такого как молекулярные сита, которые представляют собой взаимосвязанные сети тетраэдров оксида алюминия и кремнезема.
Его можно активировать путем нагревания для создания однородных полостей, которые избирательно поглощают молекулы определенного размера. Для диэтилового эфира размер пор 4Å подходит для удаления воды.
Использование диэтилового эфира
Эфир использовался на протяжении всей истории медицины для лечения цинги или воспаления легких. В 1846 году американский дантист Уильям Т. Г. Мортон впервые публично продемонстрировал использование эфира в качестве эффективного хирургического анестетика . Использование диэтилового эфира имеет большие преимущества перед хлороформом из-за его более широкого терапевтического/безопасного окна, но все же имеет нежелательные побочные эффекты.
Сегодня на смену эфирам пришли современные анестетики с еще лучшими свойствами. Диэтиловый эфир по-прежнему обычный лабораторный растворитель для химических реакций и жидкостной экстракции. Например, он используется в качестве растворителя при производстве целлюлозных пластиков.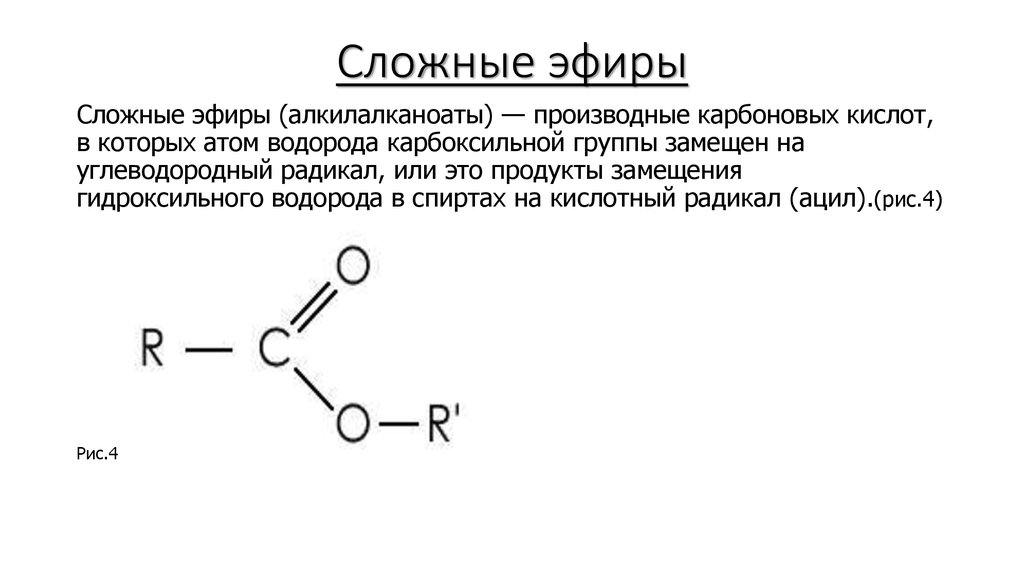

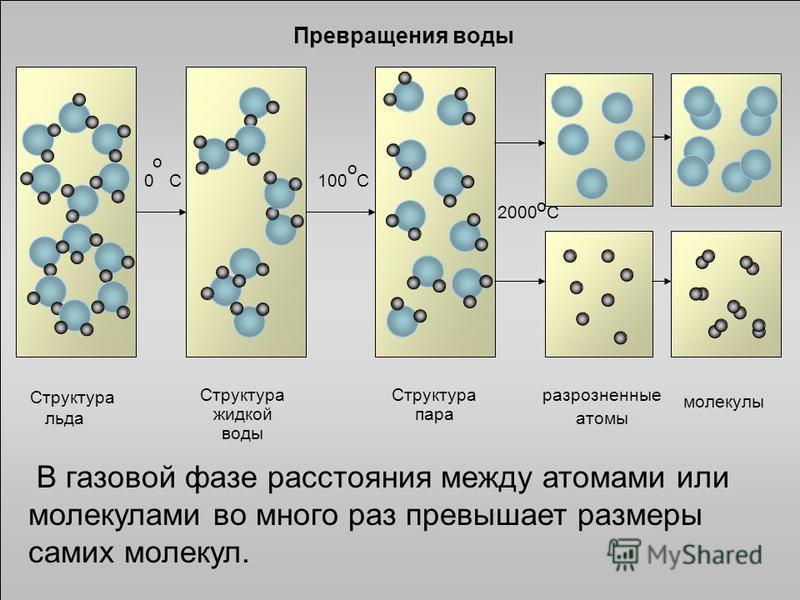 Следовательно, поваренная соль, железо и графит имеют немолекулярное строение.
Следовательно, поваренная соль, железо и графит имеют немолекулярное строение.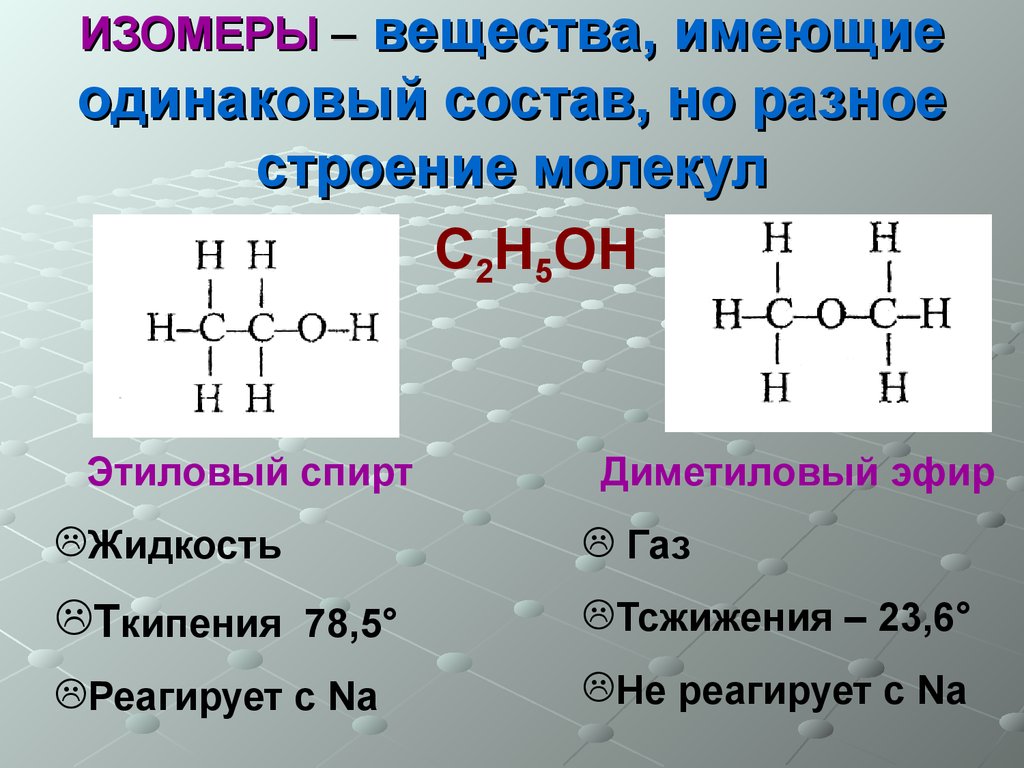 Для углекислого газа характерна кристаллическая решетка
Для углекислого газа характерна кристаллическая решетка
 Соединение представляет собой изопропилметиловый эфир.
Соединение представляет собой изопропилметиловый эфир.