Содержание
Сложные эфиры — получение, примеры и формула
Запах банана и вкус грушевого лимонада — дело рук сложных эфиров. Жаль, что на контрольных по химии не просят определить сложный эфир по вкусу. 🍌 Зато обязательно спросят про названия, свойства и образование этого класса соединений — так что давайте разбираться.
Для начала дадим определение и разберемся, почему эти эфиры — сложные.
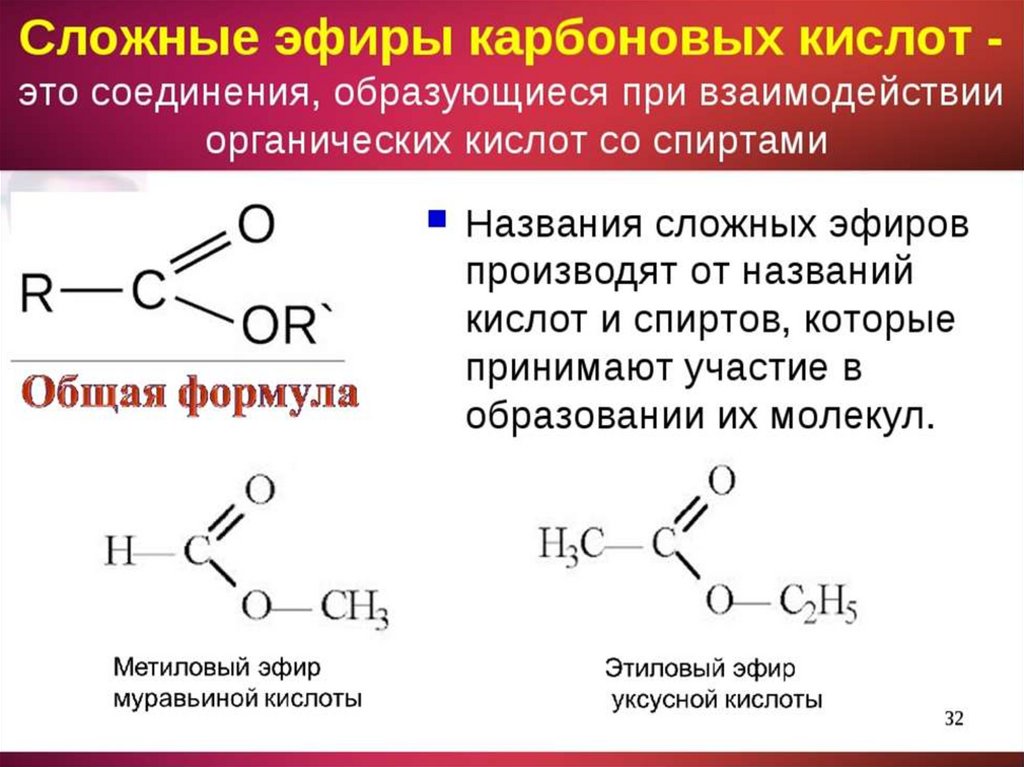
Сложные эфиры или эсте́ры (от древнегреческого αἰθήρ — «эфир») — это класс соединений на основе неорганических (минеральных) или органических (карбоновых) одно- или многоосновных кислот, у которых атом водорода в гидроксогруппе замещен на радикал. Эпитет «сложные» они получили для того, чтобы их не путали с простыми эфирами — производными спиртов.
Общая формула сложных эфиров выглядит так:
Однако представители сложных эфиров муравьиной кислоты выглядят иначе. Для них общая формула приобретает такой вид:
Для них общая формула приобретает такой вид:
Номенклатура сложных эфиров
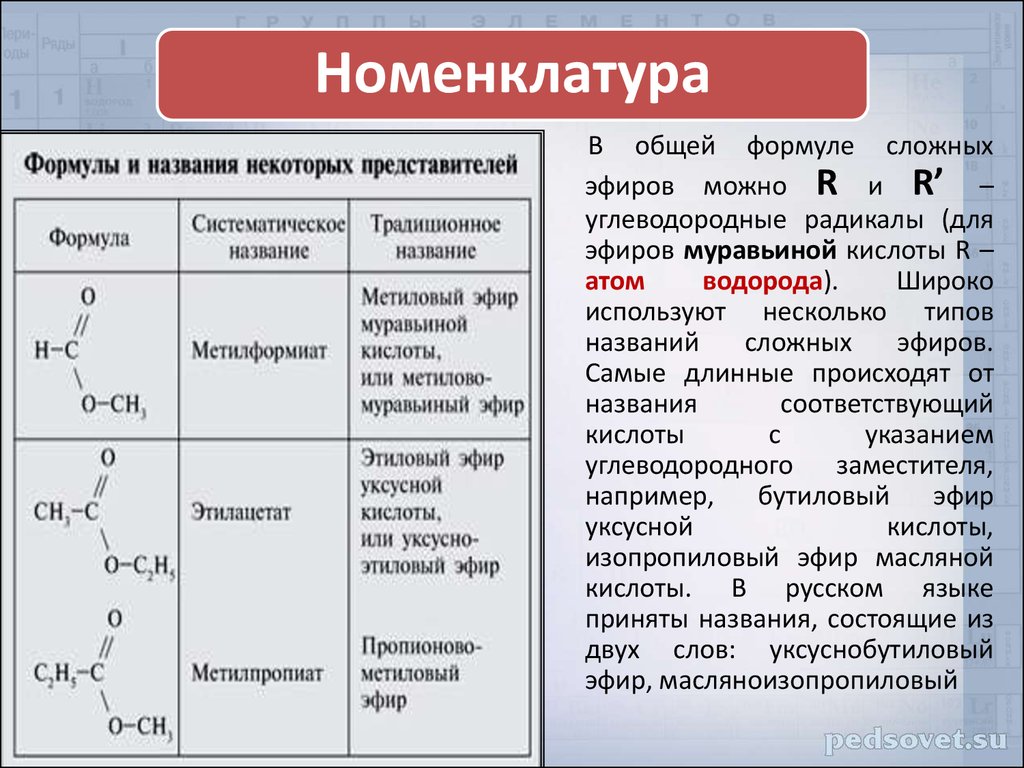
Теперь поговорим о том, как называть представителей данного класса. Различают два способа, позволяющие назвать сложные эфиры: по систематической номенклатуре (ИЮПАК) или по рациональной номенклатуре. Рассмотрим оба варианта.
По номенклатуре ИЮПАК название строится следующим образом:
Например:
По рациональной номенклатуре название строится так:
Например:
По этой же номенклатуре эфиры можно называть, используя четыре слова: радикал спирта + слово «эфир» + название кислоты + слово «кислота». Например, муравьинометиловый эфир можно иначе назвать метиловый эфир муравьиной кислоты:
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Запишитесь и участвуйте в розыгрыше 8 уроков
Изомерия сложных эфиров
Возможна ли изомерия для сложных эфиров? Давайте разбираться.
Возможна изомерия углеродного скелета у радикала кислоты и радикала спирта при наличии трех и более углеродных атомов.
Изомерия положения функциональной группы:
Межклассовая изомерия также определяется общей формулой органических соединений. Например:
Физические свойства сложных эфиров
Агрегатное состояние сложного эфира напрямую зависит от молекулярной массы образующих его кислоты и спирта. Так, например, сложные эфиры низших и средних гомологов являются летучими жидкостями с характерным запахом. Чаще всего у них фруктовые или плодовые ароматы. Сложные эфиры хуже растворяются в воде, чем образующие их кислоты и спирты. Чем больше атомов углерода в составе сложного эфира, тем хуже его растворимость в воде.
Сложные эфиры хуже растворяются в воде, чем образующие их кислоты и спирты. Чем больше атомов углерода в составе сложного эфира, тем хуже его растворимость в воде.
Эфиры высших карбоновых кислот и высших одноатомных первичных спиртов — основа природного воска. Например, известный пчелиный воск — это сложный эфир пальмитиновой кислоты (C15H31COOH) и мирицилового спирта (С31H63OH).
Химические свойства сложных эфиров
Сложные эфиры подвергаются гидролизу (разложению под действием воды), который бывает двух видов: в кислой среде и в щелочной. Рассмотрим каждый из этих видов.
В кислой среде реакция протекает следующим образом:
Эта реакция обратима, так как образующиеся в процессе кислота и спирт подвергаются взаимодействию с образованием этого же сложного эфира. Обратная реакция имеет название реакция этерификации.

Щелочной гидролиз или реакция омыления:
Этот вид гидролиза протекает необратимо, так как образовавшаяся в ходе реакции соль не может реагировать со спиртом.
Сложные эфиры можно восстановить водородом в присутствии катализатора до двух спиртов. Причем один из спиртов будет иметь в составе столько атомов углерода, сколько было в кислоте, а во втором спирте количество углерода будет соответствовать исходному спирту. Рассмотрим на примере:
Эфиры подвергаются полному окислению, то есть горят с образованием углекислого газа и воды:
Следующее химическое свойство относится только к тем сложным эфирам, которые образованы непредельной карбоновой кислотой. Сложные эфиры таких кислот могут подвергаться галогенированию. Посмотрим, как происходит эта реакция:
Способы получения сложных эфиров
Реакция этерификации.

Реакция обратимая, поэтому требуется либо избыток одного из реагентов, либо отгонка образующегося сложного эфира, чтобы предотвратить обратную реакцию гидролиза.
Взаимодействие ангидрида карбоновой кислоты со спиртом с образованием сложного эфира и карбоновой кислоты.
Взаимодействие солей карбоновых кислот с галогеналканами.
Нахождение сложных эфиров в природе и применение
Сложные эфиры широко представлены в природе, но их количество минимально. Они участвуют в процессах, которые протекают в живых организмах, а также являются компонентами аромата ряда растений.
Некоторые эфиры получают искусственным способом. Например, за грушевый вкус в лимонаде отвечает уксусноизоамиловый эфир, а за яблочный — изовалерианоэтиловый эфир.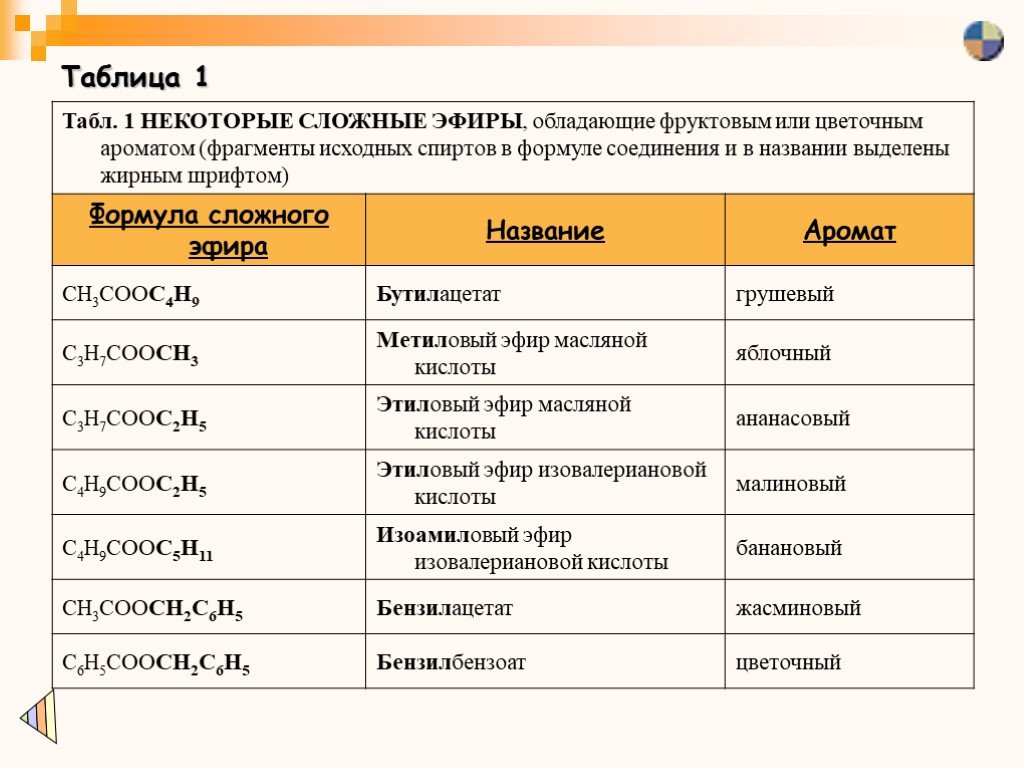
Помимо пищевой промышленности, сложные эфиры применяют в качестве растворителей для приготовления лаков, а также как пластификаторы для приготовления пластических масс.
Сложные эфиры на основе ароматических спиртов нашли применение в парфюмерной промышленности.
Метилэтиловый эфир, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
эфир | химическое соединение | Britannica
- Ключевые люди:
- Дж. Фрейзер Стоддарт
Александр Уильям Уильямсон
- Похожие темы:
- этиловый эфир
тетрагидрофуран
метиловый эфир
метил-трет-бутиловый эфир
Неролин II
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
простой эфир , любое из класса органических соединений, характеризующееся атомом кислорода, связанным с двумя алкильными или арильными группами. Эфиры по структуре аналогичны спиртам, а эфиры и спирты по структуре аналогичны воде. В спирте один атом водорода в молекуле воды замещен алкильной группой, тогда как в эфире оба атома водорода замещены алкильной или арильной группами.
При комнатной температуре эфиры представляют собой бесцветные жидкости с приятным запахом. По сравнению со спиртами простые эфиры обычно менее плотные, менее растворимы в воде и имеют более низкие температуры кипения. Они относительно нереакционноспособны, поэтому их можно использовать в качестве растворителей жиров, масел, восков, отдушек, смол, красителей, смол и углеводородов. Пары некоторых эфиров используются как инсектициды, акарициды и фумиганты для почвы.
Они относительно нереакционноспособны, поэтому их можно использовать в качестве растворителей жиров, масел, восков, отдушек, смол, красителей, смол и углеводородов. Пары некоторых эфиров используются как инсектициды, акарициды и фумиганты для почвы.
Эфиры также важны в медицине и фармакологии, особенно для использования в качестве анестетиков. Например, этиловый эфир (CH 3 CH 2 ―O―CH 2 CH 3 ), известный просто как эфир, впервые был использован в качестве хирургического анестетика в 1842 году. Кодеин, сильнодействующее болеутоляющее средство , представляет собой метиловый эфир морфина. Поскольку эфир легко воспламеняется, его заменили менее воспламеняющимися анестетиками, включая закись азота (N 2 O) и галотан (CF 3 — CHClBr).
Этиловый эфир является отличным растворителем для экстракции и широкого спектра химических реакций. Он также используется в качестве летучей пусковой жидкости для дизельных двигателей и бензиновых двигателей в холодную погоду. Диметиловый эфир используется в качестве топлива для распыления и хладагента. Метил t -бутиловый эфир (МТБЭ) представляет собой присадку к бензину, повышающую октановое число и снижающую содержание оксидов азота в выхлопных газах. Эфиры этиленгликоля используются в качестве растворителей и пластификаторов.
Диметиловый эфир используется в качестве топлива для распыления и хладагента. Метил t -бутиловый эфир (МТБЭ) представляет собой присадку к бензину, повышающую октановое число и снижающую содержание оксидов азота в выхлопных газах. Эфиры этиленгликоля используются в качестве растворителей и пластификаторов.
Общие названия простых эфиров просто дают названия двух алкильных групп, связанных с кислородом, и добавляют слово эфир . Текущая практика состоит в том, чтобы перечислять алкильные группы в алфавитном порядке ( t -бутилметиловый эфир), но более старые названия часто перечисляют алкильные группы в порядке возрастания размера (метил t -бутиловый эфир). Если в названии описана только одна алкильная группа, это подразумевает две идентичные группы, как в этиловом эфире для диэтилового эфира.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Систематические (IUPAC) названия простых эфиров используют более сложную группу в качестве корневого названия, с атомом кислорода и меньшей группой, называемой алкоксизаместителем. Примерами, приведенными выше, являются этоксиэтан (диэтиловый эфир), метоксиэтан (метилэтиловый эфир), 2-метокси-2-метилпропан (МТБЭ) и феноксибензол (дифениловый эфир). Номенклатура ИЮПАК хорошо работает для соединений с дополнительными функциональными группами, поскольку другие функциональные группы могут быть описаны в корневом названии.
Примерами, приведенными выше, являются этоксиэтан (диэтиловый эфир), метоксиэтан (метилэтиловый эфир), 2-метокси-2-метилпропан (МТБЭ) и феноксибензол (дифениловый эфир). Номенклатура ИЮПАК хорошо работает для соединений с дополнительными функциональными группами, поскольку другие функциональные группы могут быть описаны в корневом названии.
Физические свойства простых эфиров
В эфирах отсутствуют гидроксильные группы спиртов. Без сильно поляризованной связи O—H молекулы эфира не могут образовывать водородные связи друг с другом. Однако у простых эфиров есть несвязывающие электронные пары на атомах кислорода, и они могут образовывать водородные связи с другими молекулами (спиртами, аминами и т. д.), которые имеют связи O-H или N-H. Способность образовывать водородные связи с другими соединениями делает эфиры особенно хорошими растворителями для широкого круга органических соединений и удивительно большого числа неорганических соединений. (Для получения дополнительной информации о водородных связях, см. химическая связь: межмолекулярные силы.)
химическая связь: межмолекулярные силы.)
Щелкните здесь, чтобы увидеть таблицу в полном размере. Поскольку молекулы эфира не могут образовывать водородные связи друг с другом, они имеют гораздо более низкую температуру кипения, чем спирты с аналогичной молекулярной массой. Например, температура кипения диэтилового эфира (C 4 H 10 O, молекулярная масса [MW] 74) составляет 35 °C (95 °F), но температура кипения 1-бутанола (или n -бутиловый спирт C 4 H 10 O, молекулярная масса 74) составляет 118 ° C (244 ° F). На самом деле точки кипения простых эфиров намного ближе к точкам кипения алканов с аналогичным молекулярным весом; температура кипения пентана (C 5 H 12 , молекулярная масса 72) составляет 36 ° C (97 ° F), что близко к температуре кипения диэтилового эфира.
Комплексы простых эфиров с реагентами
Уникальные свойства простых эфиров (то есть, они сильно полярны, с несвязывающими электронными парами, но без гидроксильной группы) способствуют образованию и использованию многих реагентов.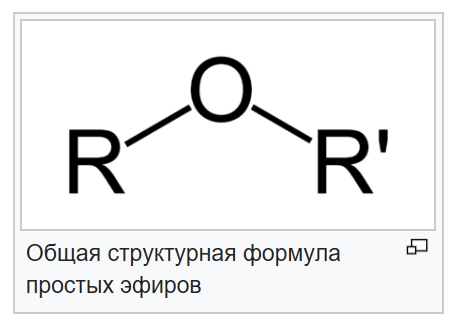 Например, реактивы Гриньяра не могут образовываться, если не присутствует эфир, который разделяет свою неподеленную пару электронов с атомом магния. Комплексообразование атома магния стабилизирует реактив Гриньяра и помогает удерживать его в растворе.
Например, реактивы Гриньяра не могут образовываться, если не присутствует эфир, который разделяет свою неподеленную пару электронов с атомом магния. Комплексообразование атома магния стабилизирует реактив Гриньяра и помогает удерживать его в растворе.
Электронодефицитные реагенты также стабилизируются эфирами. Например, боран (BH 3 ) является полезным реагентом для получения спиртов. Чистый боран существует в виде его димера, диборана (B 2 H 6 ), токсичного газа, который неудобен и опасен в использовании. Однако боран образует стабильные комплексы с простыми эфирами, и его часто поставляют и используют в виде жидкого комплекса с тетрагидрофураном (ТГФ). Точно так же газообразный трифторид бора (BF 3 ) легче использовать в виде его жидкого комплекса с диэтиловым эфиром, называемого BF 3 эфират, а не как токсичный коррозионный газ.
Краун-эфиры представляют собой специализированные циклические полиэфиры, которые окружают определенные ионы металлов, образуя циклические комплексы в форме короны.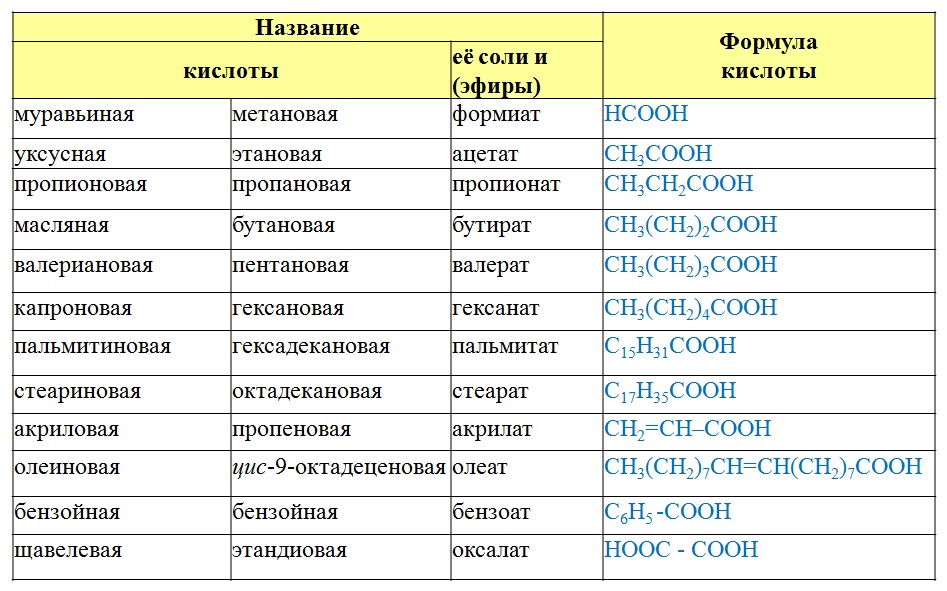 Они названы с использованием родительского имени Crown , которому предшествует число, описывающее размер кольца, а за ним следует количество атомов кислорода в кольце. В комплексе краун-эфира ион металла помещается в полость краун-эфира и сольватируется атомами кислорода. Внешний вид комплекса неполярный, замаскированный алкильными группами краун-эфира. Многие неорганические соли можно сделать растворимыми в неполярных органических растворителях путем их комплексообразования с соответствующим краун-эфиром. Ионы калия (К + ) образуют комплексы с 18-краун-6 (18-членное кольцо с 6 атомами кислорода), ионами натрия (Na + ) с 15-краун-5 (15-членное кольцо, 5 атомов кислорода) и литием ионы (Li + ) по 12-краун-4 (12-членное кольцо, 4 атома кислорода).
Они названы с использованием родительского имени Crown , которому предшествует число, описывающее размер кольца, а за ним следует количество атомов кислорода в кольце. В комплексе краун-эфира ион металла помещается в полость краун-эфира и сольватируется атомами кислорода. Внешний вид комплекса неполярный, замаскированный алкильными группами краун-эфира. Многие неорганические соли можно сделать растворимыми в неполярных органических растворителях путем их комплексообразования с соответствующим краун-эфиром. Ионы калия (К + ) образуют комплексы с 18-краун-6 (18-членное кольцо с 6 атомами кислорода), ионами натрия (Na + ) с 15-краун-5 (15-членное кольцо, 5 атомов кислорода) и литием ионы (Li + ) по 12-краун-4 (12-членное кольцо, 4 атома кислорода).
В каждом из этих краун-эфирных комплексов только катион сольватируется краун-эфиром. В неполярном растворителе анион не сольватируется, а увлекается в раствор катионом. Эти «голые» анионы в неполярных растворителях могут быть гораздо более реакционноспособными, чем в полярных растворителях, которые сольватируют и экранируют анион. Например, комплекс 18-краун-6 перманганата калия, KMnO 4 , растворяется в бензоле с образованием «фиолетового бензола» с чистым ионом MnO 4 − , действующим как мощный окислитель. Точно так же чистый ион — OH в гидроксиде натрия (NaOH), растворимый в гексане (C 6 H 14 ) с помощью 15-краун-5, является более мощным основанием и нуклеофилом, чем когда он сольватирован полярные растворители, такие как вода или спирт.
Например, комплекс 18-краун-6 перманганата калия, KMnO 4 , растворяется в бензоле с образованием «фиолетового бензола» с чистым ионом MnO 4 − , действующим как мощный окислитель. Точно так же чистый ион — OH в гидроксиде натрия (NaOH), растворимый в гексане (C 6 H 14 ) с помощью 15-краун-5, является более мощным основанием и нуклеофилом, чем когда он сольватирован полярные растворители, такие как вода или спирт.
8.15: Эфиры — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Page ID
- 49463
- Ed Vitz, John W. Moore, Justin Shorb, Xavier Prat-Resina, Tim Wendorff, & Adam Hahn
- Chemical Education Digital Library (ChemEd DL)
В спиртах одна из двух связей с атомом кислорода связана с водородом, а другая с участием углерода. Однако когда присутствуют два или более атомов углерода, становятся возможными изомерные структуры, в которых кислород связан с двумя разными атомами углерода. Такие соединения называются эфирами. Например, диметиловый эфир изомерен с этанолом, а метилэтиловый эфир изомерен с пропанолом:
Однако когда присутствуют два или более атомов углерода, становятся возможными изомерные структуры, в которых кислород связан с двумя разными атомами углерода. Такие соединения называются эфирами. Например, диметиловый эфир изомерен с этанолом, а метилэтиловый эфир изомерен с пропанолом:
Структуры диметилового эфира, метилэтилового эфира и диэтилового эфира, где буква «О» выделена красным.
Общая формула простого эфира — R—O—R’, где R’ означает, что обе группы R не обязательно должны быть одинаковыми.
Пример \(\PageIndex{1}\): Формулы проекции
Нарисуйте формулы проекции и назовите все изомеры, которые соответствуют молекулярной формуле C 3 H 8 O.
Решение Формула C 3 Ч 8 будет соответствовать алкану. Дополнительный атом кислорода может быть добавлен между двумя атомами углерода, давая эфир, или он может быть добавлен между углеродом и водородом, давая спирт. Молекулы спирта могут иметь гидроксильную группу на конце трехуглеродной цепи или у второго атома углерода:
Возможна только одна структура простого эфира, в которой одна метильная и одна этильная группы присоединены к кислороду:
In В эфире нет атомов водорода, связанных с сильно электроотрицательным соседом, и поэтому, в отличие от спиртов, молекулы эфира не могут водородно связываться между собой. Каждая связь С—О полярна, но связи расположены примерно под тетраэдрическим углом. Полярность одного частично отменяет полярность другого. Следовательно, силы между двумя молекулами эфира ненамного превышают лондоновские силы между молекулами алканов сравнимого размера. Температура кипения диметилового эфира, например, составляет –23°С, что немного выше, чем у пропана (–42°С), но значительно ниже, чем у этанола (78,5°С). Все три молекулы содержат 26 электронов и имеют примерно одинаковый размер. В таблице температур кипения сопоставимых органических соединений мы снова видим эту тенденцию, на этот раз для соединений, содержащих 32 или 34 электрона.
Каждая связь С—О полярна, но связи расположены примерно под тетраэдрическим углом. Полярность одного частично отменяет полярность другого. Следовательно, силы между двумя молекулами эфира ненамного превышают лондоновские силы между молекулами алканов сравнимого размера. Температура кипения диметилового эфира, например, составляет –23°С, что немного выше, чем у пропана (–42°С), но значительно ниже, чем у этанола (78,5°С). Все три молекулы содержат 26 электронов и имеют примерно одинаковый размер. В таблице температур кипения сопоставимых органических соединений мы снова видим эту тенденцию, на этот раз для соединений, содержащих 32 или 34 электрона.
Химическая активность простых эфиров также ближе к алканам, чем к спиртам. Эфиры вступают в несколько характерных реакций, кроме горения, поэтому их обычно используют в качестве растворителей. Диэтиловый эфир также используется в качестве анестетика, хотя воспламеняемость его паров требует принятия мер предосторожности для предотвращения пожаров.