Содержание
Хлороформ — frwiki.wiki
Хлороформ или трихлорметан представляет собой химическое соединение, хлорорганические Эмпирическая формула CHCl 3 .
Часто используемый в качестве растворителя хлороформ в настоящее время заменяется дихлорметаном, который имеет аналогичные свойства, но менее токсичен. Раньше хлороформ использовался как обезболивающее в операционных и как консервант для мяса .
Резюме
- 1 рассказ
- 2 Физико-химические свойства
- 3 Производство и синтез
- 4 Безопасность
- 5 Хлороформ в художественной литературе
- 6 Родственные хлорорганические соединения
- 7 Примечания и ссылки
- 8 См. Также
- 8.1 Связанные статьи или категории
- 8.2 Внешние ссылки
- 8.3 Библиография
История
Открытие хлороформа, язык жестов, 1913 год.
Эжен Субейран (во Франции), Юстус фон Либих (в Германии) и Самуэль Гатри (в Америке) одновременно открыли хлороформ, впервые полученный в 1831 году. Именно в Эдинбурге в 1847 году Джеймс Янг Симпсон впервые использовал хлороформ для родов, и представляет его другим врачам. В то время использовался только эфир, у которого было много недостатков, и многие операции проводились без анестезии: хлороформ был большим достижением. Его использование в качестве анестетика стало популярным во время Гражданской войны для лечения ран на поле боя. Королева Виктория используется в 1853 году, чтобы родить, которая убеждает общественность об использовании продукта.
Именно в Эдинбурге в 1847 году Джеймс Янг Симпсон впервые использовал хлороформ для родов, и представляет его другим врачам. В то время использовался только эфир, у которого было много недостатков, и многие операции проводились без анестезии: хлороформ был большим достижением. Его использование в качестве анестетика стало популярным во время Гражданской войны для лечения ран на поле боя. Королева Виктория используется в 1853 году, чтобы родить, которая убеждает общественность об использовании продукта.
Физико-химические свойства
Хлороформ — очень летучая жидкость. Однако пары хлороформа не образуют взрывоопасных смесей с воздухом.
Хлороформ — отличный растворитель для многих органических материалов, таких как жиры, масла, смолы, воски и т. Д. Он полностью смешивается со многими органическими растворителями и растворяет йод и серу .
Хлороформ образует множество азеотропных смесей с другими жидкостями, такими как ацетон, этанол, вода и метанол .
Хлороформ имеет криоскопическую моляльную константу 4,70 ° C ∙ кг / моль и эбуллиоскопическую моляльную постоянную 3,80 ° C ∙ кг / моль.
Производство и синтез
Производство хлороформа связано с производством других хлороуглеродов. Действительно, хлороформ получают путем последовательного хлорирования метана или этанола .
В другом методе в качестве реагента используется метанол вместо метана. Это смесь хлорирования / гидрохлорирования, которая позволяет избежать отделения соляной кислоты от метана во время рециркуляции неиспользованного реагента.
Его можно получить промышленным способом путем реакции железа и кислоты с тетрахлорметаном .
Также можно получить хлороформ проще, обрабатывая ацетон хлором в присутствии основания. Он образуется из трихлорацетона, вещества, которое легко расщепляется на хлороформ и уксусную соль:
- CH 3 COCH 3 + 3Cl 2 + 3KOH → CH 3 COCCl 3 + 3KCl + 3H 2 O
- CH 3 COCCl 3 + КОН → CH 3 COOK + CHCl 3
Однако этот последний синтез может быть довольно опасным. Действительно, существует риск образования фосгена, очень токсичного и даже смертельного газа, который использовался в качестве боевого газа во время Первой мировой войны.
Действительно, существует риск образования фосгена, очень токсичного и даже смертельного газа, который использовался в качестве боевого газа во время Первой мировой войны.
безопасность
Реклама Хлороформа Адриана из Монреальского медицинского журнала, январь 1906 г.
При длительном хранении в присутствии кислорода и под действием света хлороформ имеет тенденцию к разложению с образованием хлористого водорода, хлора и оксихлорида углерода ( фосгена ), который является чрезвычайно токсичным продуктом.
При всасывании или вдыхании в высоких концентрациях он может привести к коме или даже вызвать респираторные и сердечные расстройства, которые могут оказаться фатальными. Его использование в анестезии прекращено.
Хлороформ в художественной литературе
В различных художественных произведениях преступники часто используют хлороформ, чтобы усыпить своих жертв. Использование, как описано, не заслуживает доверия. Во-первых, потому что хлороформу требуется несколько минут, а не несколько секунд, прежде чем он подействует, что теоретически оставляет время атакованному человеку, чтобы бороться или позвать на помощь. К тому же его действие недолговечно. Анестезиологам, которые использовали его, приходилось регулярно обновлять дозу, чтобы пациент оставался без сознания.
К тому же его действие недолговечно. Анестезиологам, которые использовали его, приходилось регулярно обновлять дозу, чтобы пациент оставался без сознания.
Слухи о том, что преступники усыпляют своих жертв хлороформом, спрятанным в флаконе с духами, который они распыляли на своих целей, не заслуживают доверия. Хлороформ — слишком летучий газ, чтобы оставаться в воздухе настолько концентрированным, что может привести к потере сознания.
- Тетрахлорметан
- Дихлорметан
- Хлорал
Примечания и ссылки
- ↑ a b c d и e ХЛОРОФОРМ, паспорт (-ы) безопасности Международной программы по безопасности химических веществ, проверено 9 мая 2009 г.
- ↑ (in) Дэвид Р. Лид, Справочник по химии и физике, Бока-Ратон, CRC,, 89- е изд.
 , 2736 с. ( ISBN 978-1-4200-6679-1 ), стр. 9-50
, 2736 с. ( ISBN 978-1-4200-6679-1 ), стр. 9-50 - ↑ a b и c (ru) Ицхак Маркус, Свойства растворителей, т. 4, Англия, John Wiley & Sons Ltd,, 239 с. ( ISBN 0-471-98369-1 )
- ↑ рассчитывается молекулярная масса от « атомных весов элементов 2007 » на www.chem.qmul.ac.uk .
- ↑ (in) Джеймс Э. Марк, Руководство по физическим свойствам полимеров, Springer,, 2- е изд. , 1076 с. ( ISBN 978-0-387-69002-5 и 0-387-69002-6, читать онлайн ), стр. 294
- ↑ a b и c (ru) Роберт Х. Перри и Дональд В. Грин, Perry’s Chemical Engineers ‘Handbook, США, McGraw-Hill,, 7- е изд. , 2400 с.
 ( ISBN 0-07-049841-5 ), стр. 2-50
( ISBN 0-07-049841-5 ), стр. 2-50 - ↑ « Свойства различных газов » на flexwareinc.com (по состоянию на 12 апреля 2010 г. )
- ↑ (in) У. М. Хейнс, Справочник по химии и физике, CRC, 2010-2011 91- е изд. , 2610 с. ( ISBN 978-1-4398-2077-3 ), стр. 14-40
- ↑ (in) Карл Л.
 Яс, Справочник по термодинамическим диаграммам, Vol. 1, 2 и 3, Хьюстон, штат Техас, паб Gulf. Co.,( ISBN 0-88415-857-8, 978-0-88415-858-5 и 978-0-88415-859-2 )
Яс, Справочник по термодинамическим диаграммам, Vol. 1, 2 и 3, Хьюстон, штат Техас, паб Gulf. Co.,( ISBN 0-88415-857-8, 978-0-88415-858-5 и 978-0-88415-859-2 ) - ↑ (in) Дэвид Р. Лид, Справочник по химии и физике, Бока-Ратон, CRC,, 89- е изд. , 2736 с. ( ISBN 978-1-4200-6679-1 ), стр.
 10-205
10-205 - ↑ «Хлороформ», на ESIS, по состоянию на 22 февраля 2009 г.
- ↑ Рабочая группа IARC по оценке канцерогенных рисков для людей, « Глобальные оценки канцерогенности для людей, группа 2B: возможно канцерогенное воздействие для человека », на monographs.iarc.fr, IARC,(по состоянию на 22 августа 2009 г. )
- ↑ Паспорт безопасности предоставлен Sigma-Aldrich, консультация 28.09.2019
- ↑ « Хлороформ » в базе данных химических веществ Reptox в CSST (организации Квебека, ответственного за охрану труда и здоровья), доступ к 25 апреля 2009
- ↑ « Хлороформ » на hazmap.nlm.nih.gov (по состоянию на 14 ноября 2009 г. )
- ↑ Джейк Россен, « Любопытная история хлороформа », на Slate .fr ,(по состоянию на 4 ноября 2019 г.
 ) .
) . - ↑ « 7 фактов насилия, не имеющих отношения к фильмам: мины, наркотики, хлороформ … », на сайте hitek.fr (по состоянию на 4 мая 2019 г. )
- ↑ « Детокс. Агрессия с хлороформом со стороны ложных продавцов парфюмерии: очень старая интоксикация «, на francetvinfo.fr ,(по состоянию на 4 ноября 2019 г. ) .
Смотрите также
Похожие статьи или категории
- Паральдегид
- Летучий анестетик
Внешние ссылки
- (ru) Физические данные
- Токсикологическая информация на веб-сайте INRS [PDF]
- (ru) ChemSub Online: Хлороформ
Анестетики: летучие анестетики | |
|---|---|
| Хлороформ · десфлурана · Энфлюран · эфира · галотан · Изофлюран · Метоксифлуран · Закись азота · Севофлюран · Ксенон |
Галогенометаны | |
|---|---|
| Монозамещенный | CH 3 F · CH 3 Cl · CH 3 Br CH 3 I |
| Дизамещенный | СН 2 F 2 · СН 2 ClF · СН 2 BrF · СН 2 ФП · СН 2 Cl 2 · СН 2 BrCl · СН 2 CLI · СН 2 Br 2 · СН 2 БИС СН 2 I 2 |
| Тризамещенный | CHF 3 · CHClF 2 · CHBrF 2 · CHF 2 I · CHCl 2 F · CHBrClF · CHClFI · CHBr 2 F · CHBrFI · CHFI 2 · CHCl 3 · CHBrCl 2 · CHCl 2 I · CHBr 2 Cl · CHBrClI · CHClI 2 · CHBr 3 · CHBr 2 I · CHBrI 2 CHI 3 |
| Рябчик заменен | CF 4 · CClF 3 · CBrF 3 · CF 3 I · CCl 2 F 2 · CBrClF 2 · CClF 2 I · CBr 2 F 2 · CBrF 2 I · CF 2 I 2 · CCl 3 F · CBrCl 2 F · CCl 2 FI · CBr 2 ClF · CBrClFI · CClFI 2 · CBr 3 F · CBr 2 FI · CBrFI 2 · CFI 3 · CCl 4 · CBrCl 3 · CCl 3 I · CBr 2 Cl 2 · CBrCl 2 I · CCl 2 I 2 · CBr 3 Cl · CBr 2 CLI · CBrClI 2 · CCLI 3 · CBr 4 · CBr 3 I · CBr 2 I 2 · CBRI 3 CI 4 |
Библиография
- O’Doherty, S.
 et al. (2001) Измерения хлороформа на месте на станциях исследования атмосферы Advanced Global Atmospheric Gases Experiment с 1994 по 1998 год . J. Geophys. Res. 106, 20429-20444.
et al. (2001) Измерения хлороформа на месте на станциях исследования атмосферы Advanced Global Atmospheric Gases Experiment с 1994 по 1998 год . J. Geophys. Res. 106, 20429-20444.
<img src=»//fr.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>
Диэтиловый эфир — Википедия – Telegraph
Диэтиловый эфир — ВикипедияМы профессиональная команда, которая на рынке работает уже более 2 лет и специализируемся исключительно на лучших продуктах.
У нас лучший товар, который вы когда-либо пробовали!
Наши контакты:
Telegram:
https://t.me/stuff_men
E-mail:
ВНИМАНИЕ!!! В Телеграмм переходить только по ссылке, в поиске много Фейков!
Внимание! Роскомнадзор заблокировал Telegram ! Как обойти блокировку:
http://telegra.ph/Kak-obojti-blokirovku-Telegram-04-13-15
Сотни лет назад известному ученому того времени Луллию, которого после смерти стали называть алхимиком, удалось открыть незаменимый в настоящее время диэтиловый эфир. Формула, свойства, температура кипения, способы получения вещества будут подробно описаны в данной статье. В 13 веке известный испанский ученый Раймонд Луллий открыл диэтиловый эфир. Свойства его были описаны в году не менее известным научным деятелем Парацельсом. В м эфир впервые попробовали использовать в качестве наркоза. Операция, проведенная американским врачом Д. Уорреном с применением паров этого вещества, прошла успешно. Изобретателями наркоза считают стоматолога У. Мортона и его наставника — врача и химика Ч. Способы получения эфира в 16 столетии описал Валериус Кордус — известный ботаник и фармацевт родом из Касселя. С начала 18 века спиртово-эфирная смесь использовалась в качестве успокаивающего средства — это было предложение Фридриха Гофмана. Петербуржский аптекарь Томас Ловиц в году получил чистый диэтиловый эфир, формула которого, кстати, имеет два варианта об этом немного позже. А вот принцип действия упомянутого вещества на организм человека обнародовал английский физик М.
Формула, свойства, температура кипения, способы получения вещества будут подробно описаны в данной статье. В 13 веке известный испанский ученый Раймонд Луллий открыл диэтиловый эфир. Свойства его были описаны в году не менее известным научным деятелем Парацельсом. В м эфир впервые попробовали использовать в качестве наркоза. Операция, проведенная американским врачом Д. Уорреном с применением паров этого вещества, прошла успешно. Изобретателями наркоза считают стоматолога У. Мортона и его наставника — врача и химика Ч. Способы получения эфира в 16 столетии описал Валериус Кордус — известный ботаник и фармацевт родом из Касселя. С начала 18 века спиртово-эфирная смесь использовалась в качестве успокаивающего средства — это было предложение Фридриха Гофмана. Петербуржский аптекарь Томас Ловиц в году получил чистый диэтиловый эфир, формула которого, кстати, имеет два варианта об этом немного позже. А вот принцип действия упомянутого вещества на организм человека обнародовал английский физик М. Фарадей, после чего в году была опубликована даже научная статья, посвященная этой теме. Что же называют простым эфиром? Это органическое соединение, молекулы которого состоят из двух углеводородных радикалов и атома кислорода. Наиболее важен простой, диэтиловый эфир, формула которого имеет следующий вид:. Он представляет собой бесцветную, прозрачную, очень подвижную летучую жидкость, имеющую своеобразный запах и жгучий вкус. Под воздействием света, воздуха, тепла и влаги эфир способен разлагаться, образовывая при этом токсичные альдегиды, пероксиды и кетоны, которые раздражают дыхательные пути. Хорошо смешивается с жирными и эфирными маслами, бензолом и спиртом, независимо от соотношения. Сам эфир, впрочем, как и его пары, легко воспламеняется. В определенной пропорции с кислородом или же воздухом пары диэтилового эфира, используемые для наркоза, взрывоопасны. Для диэтилового эфира характерны все химические свойства простых эфиров. Итак, разберемся с этим вопросом подробнее. Это довольно инертное вещество.
Фарадей, после чего в году была опубликована даже научная статья, посвященная этой теме. Что же называют простым эфиром? Это органическое соединение, молекулы которого состоят из двух углеводородных радикалов и атома кислорода. Наиболее важен простой, диэтиловый эфир, формула которого имеет следующий вид:. Он представляет собой бесцветную, прозрачную, очень подвижную летучую жидкость, имеющую своеобразный запах и жгучий вкус. Под воздействием света, воздуха, тепла и влаги эфир способен разлагаться, образовывая при этом токсичные альдегиды, пероксиды и кетоны, которые раздражают дыхательные пути. Хорошо смешивается с жирными и эфирными маслами, бензолом и спиртом, независимо от соотношения. Сам эфир, впрочем, как и его пары, легко воспламеняется. В определенной пропорции с кислородом или же воздухом пары диэтилового эфира, используемые для наркоза, взрывоопасны. Для диэтилового эфира характерны все химические свойства простых эфиров. Итак, разберемся с этим вопросом подробнее. Это довольно инертное вещество. Основное отличие от сложных эфиров — отсутствие гидролиза, правда, есть и исключения. На холоде не взаимодействует с хлоридом фосфора, металлическим натрием и многими разбавленными минеральными кислотами. Несмотря на это, концентрированные кислоты серная и йодоводородная даже при низких температурах разлагают эти эфиры, а нагретый металлический натрий их расщепляет. Эфир с неподеленными парами электронов взаимодействует с протоном сильной кислоты, в результате чего образуется неустойчивое оксониевое соединение:. Серная и йодоводородная кислоты, а также FeCl3 в ангидриде уксусной кислоты способны расщеплять простые эфиры. Химическая реакция выглядит так: Нагретый металлический натрий расщепляет диэтиловый эфир: Своеобразный запах, низкая температура кипения простых эфиров — свидетельство слабого межмолекулярного воздействия, а это говорит о низкой полярности и отсутствии предпосылок к образованию водородных связей. В отличие от спиртов эфирам присущи более сильные электронодонорные свойства, что подтверждается значением потенциалов ионизации.
Основное отличие от сложных эфиров — отсутствие гидролиза, правда, есть и исключения. На холоде не взаимодействует с хлоридом фосфора, металлическим натрием и многими разбавленными минеральными кислотами. Несмотря на это, концентрированные кислоты серная и йодоводородная даже при низких температурах разлагают эти эфиры, а нагретый металлический натрий их расщепляет. Эфир с неподеленными парами электронов взаимодействует с протоном сильной кислоты, в результате чего образуется неустойчивое оксониевое соединение:. Серная и йодоводородная кислоты, а также FeCl3 в ангидриде уксусной кислоты способны расщеплять простые эфиры. Химическая реакция выглядит так: Нагретый металлический натрий расщепляет диэтиловый эфир: Своеобразный запах, низкая температура кипения простых эфиров — свидетельство слабого межмолекулярного воздействия, а это говорит о низкой полярности и отсутствии предпосылок к образованию водородных связей. В отличие от спиртов эфирам присущи более сильные электронодонорные свойства, что подтверждается значением потенциалов ионизации. Усиление этих особенностей связано с положительным индуктивным эффектом группы атомов, получающихся из алканов при удалении атома водорода. Температура кипения диэтилового эфира — 35,6 градуса по Цельсию это гораздо ниже, чем у изомерных спиртов , а замерзания — о С. Простые эфиры почти не смешиваются с водой. Объяснение этому довольно простое: Плохо растворяется в воде и диэтиловый эфир, плотность которого по отношению к оксиду водорода составляет 0, Одной из особенностей рассматриваемого вещества является склонность к электризации. Вероятность возникновения разрядов статического электричества особо высока при переливании или сливе химсостава, в результате чего может произойти воспламенение. Пары эфира образуют с воздухом, который в 2,5 раза легче, взрывчатые смеси. Работая с эфиром, не следует забывать, что его пары имеют свойство распространяться на большие расстояния без потерь способности к горению. Так что основная мера предосторожности — отсутствие вблизи открытого огня и прочих источников воспламенения.
Усиление этих особенностей связано с положительным индуктивным эффектом группы атомов, получающихся из алканов при удалении атома водорода. Температура кипения диэтилового эфира — 35,6 градуса по Цельсию это гораздо ниже, чем у изомерных спиртов , а замерзания — о С. Простые эфиры почти не смешиваются с водой. Объяснение этому довольно простое: Плохо растворяется в воде и диэтиловый эфир, плотность которого по отношению к оксиду водорода составляет 0, Одной из особенностей рассматриваемого вещества является склонность к электризации. Вероятность возникновения разрядов статического электричества особо высока при переливании или сливе химсостава, в результате чего может произойти воспламенение. Пары эфира образуют с воздухом, который в 2,5 раза легче, взрывчатые смеси. Работая с эфиром, не следует забывать, что его пары имеют свойство распространяться на большие расстояния без потерь способности к горению. Так что основная мера предосторожности — отсутствие вблизи открытого огня и прочих источников воспламенения. Простой эфир — малоактивное соединение, в разы менее реакционноспособное по сравнению со спиртами. Замечательно растворяет большую часть органических веществ, благодаря чему используется в качестве растворителя. Исключением не является и диэтиловый эфир. Физические свойства, равно как и химические, позволяют применять его в медицине и на производстве. Простые эфиры в природе не встречаются — их получают синтетическим путем. Под воздействием кислотных катализаторов на этиловый спирт при повышенной температуре получается диэтиловый эфир формула указана выше. Проще всего получить это вещество посредством перегонки смеси, состоящей из серной кислоты и спирта. Для этого ее необходимо разогреть до градусов по Цельсию. Нам понадобится этиловый спирт и серная кислота в равных пропорциях , пипетки, пробирки и газоотводные трубки. Итак, после того как оборудование и реактивы подготовлены, можно приступать к проведению опыта. В пробирку она обязательно должна быть сухой необходимо налить мл смеси спирта и кислоты и медленно нагреть.
Простой эфир — малоактивное соединение, в разы менее реакционноспособное по сравнению со спиртами. Замечательно растворяет большую часть органических веществ, благодаря чему используется в качестве растворителя. Исключением не является и диэтиловый эфир. Физические свойства, равно как и химические, позволяют применять его в медицине и на производстве. Простые эфиры в природе не встречаются — их получают синтетическим путем. Под воздействием кислотных катализаторов на этиловый спирт при повышенной температуре получается диэтиловый эфир формула указана выше. Проще всего получить это вещество посредством перегонки смеси, состоящей из серной кислоты и спирта. Для этого ее необходимо разогреть до градусов по Цельсию. Нам понадобится этиловый спирт и серная кислота в равных пропорциях , пипетки, пробирки и газоотводные трубки. Итак, после того как оборудование и реактивы подготовлены, можно приступать к проведению опыта. В пробирку она обязательно должна быть сухой необходимо налить мл смеси спирта и кислоты и медленно нагреть. Как только начнется кипение, горелка убирается, а в горячую смесь при помощи пипетки по стенке пробирки добавляется от 5 до 10 капель этилового спирта. Протекающая реакция выглядит следующим образом:. Об образовании диэтилового эфира свидетельствует появившийся запах. В качестве лекарственного средства общеанестезирующего действия медики используют диэтиловый эфир. Свойства этого вещества не позволяют применять его при операциях, где задействуются электроинструменты, поскольку оно легко воспламеняется, а при соединении с воздухом может взорваться. Диэтиловый эфир широко распространен в хирургии, где используется для ингаляционного наркоза. В стоматологии им обрабатывают зубные корневые каналы и кариозные места, подготавливая, таким образом, полость рта к пломбированию. Вещество обладает высоким цетановым числом , благодаря чему его можно использовать как стартовую жидкость для бензиновых и дизельных двигателей. Благодаря высокой изменчивости и низким температурам вспышки диэтиловый эфир применяют в качестве составляющей топливной смеси для образцовых дизельных двигателей.
Как только начнется кипение, горелка убирается, а в горячую смесь при помощи пипетки по стенке пробирки добавляется от 5 до 10 капель этилового спирта. Протекающая реакция выглядит следующим образом:. Об образовании диэтилового эфира свидетельствует появившийся запах. В качестве лекарственного средства общеанестезирующего действия медики используют диэтиловый эфир. Свойства этого вещества не позволяют применять его при операциях, где задействуются электроинструменты, поскольку оно легко воспламеняется, а при соединении с воздухом может взорваться. Диэтиловый эфир широко распространен в хирургии, где используется для ингаляционного наркоза. В стоматологии им обрабатывают зубные корневые каналы и кариозные места, подготавливая, таким образом, полость рта к пломбированию. Вещество обладает высоким цетановым числом , благодаря чему его можно использовать как стартовую жидкость для бензиновых и дизельных двигателей. Благодаря высокой изменчивости и низким температурам вспышки диэтиловый эфир применяют в качестве составляющей топливной смеси для образцовых дизельных двигателей. Получается, что данное вещество подобно этанолу. Диэтиловый эфир рекомендуется хранить в бутылочках темного цвета тщательно закупоренных в прохладном месте, поскольку на свету, в тепле и под воздействием влаги он разлагается, в результате чего выделяются токсические вещества. История В 13 веке известный испанский ученый Раймонд Луллий открыл диэтиловый эфир. Характеристика Что же называют простым эфиром? Наиболее важен простой, диэтиловый эфир, формула которого имеет следующий вид: Похожие статьи Простые эфиры: Как получить предельный одноатомный спирт Этиловый спирт. Спирт этиловый медицинский — применение Как получить этан из метана: Получение спиртов, применение, свойства. Способы получения спиртов Муравьиная кислота:
Получается, что данное вещество подобно этанолу. Диэтиловый эфир рекомендуется хранить в бутылочках темного цвета тщательно закупоренных в прохладном месте, поскольку на свету, в тепле и под воздействием влаги он разлагается, в результате чего выделяются токсические вещества. История В 13 веке известный испанский ученый Раймонд Луллий открыл диэтиловый эфир. Характеристика Что же называют простым эфиром? Наиболее важен простой, диэтиловый эфир, формула которого имеет следующий вид: Похожие статьи Простые эфиры: Как получить предельный одноатомный спирт Этиловый спирт. Спирт этиловый медицинский — применение Как получить этан из метана: Получение спиртов, применение, свойства. Способы получения спиртов Муравьиная кислота:
Купить molly Мензелинск
Диэтиловый эфир: формула. Диэтиловый эфир: физические и химические свойства
Купить закладки скорость в Апрелевке
Питер купить Рафинад
Branches for Diamond Bank plc
Диэтиловый эфир
Купить mdma в Рыбинск
Купить Бутик Сенгилей
Купить Героин Куровское
Эфир диэтиловый
Закладки методон в Шали
Купить крисы Светлоград
Как получают гашиш
Гашиш в Вихоревке
Закладки шишки ак47 в Арамиле
traduire de
Купить Героин Бавлы
Диэтиловый эфир
Трип репорт мухоморы
Диэтиловый эфир
Купить Ганджубас Ардон
Купить BARCELONA Липецк
Фентанил — WiKi
traduire de
Apparat — Журнал о новом обществе
Светлоград купить Коксик
Хранение пороха
traduire de
Купить DOMINO Ясногорск
Купить СК Крист Белые Амурск
Сбыт марихуаны
Купить крисы Колпино
Шишки ак47 в Октябрьском
Эфир диэтиловый
Закладки спайс в Моршанске
Диэтиловый эфир: формула.
 Диэтиловый эфир: физические и химические свойства
Диэтиловый эфир: физические и химические свойства
Купить Анашу Алексин
traduire de
Бошки в Волчанске
Купить MDMA Кызыл
Купить Хмурь Нолинск
Диэтиловый эфир: формула. Диэтиловый эфир: физические и химические свойства
Купить Гарсон Каспийск
Закладки методон в Вытегре
Купить Амфетамин Пушкино
Эфир диэтиловый
Купить конопля Талдом
Купить Спид Инсар
Купить закладки скорость a-PVP в Касиме
Купить Хэш Сорск
Legalrc biz юг
Диэтиловый эфир: формула. Диэтиловый эфир: физические и химические свойства
Купить План Камышин
Диэтиловый эфир
Закладки лирика в Кропоткине
traduire de
Закладки марки в Солнечногорск-7
Купить Метамфетамин в Богородицк
Купить закладки спайс россыпь в Ковдоре
Диэтиловый эфир: формула. Диэтиловый эфир: физические и химические свойства
Закладки кристалы в Снежногорске
Купить закладку спайса
Купить Спиды Азнакаево
traduire de
Купить Амфетамин в Чкаловск
Купить Кокс Пролетарск
Бошки в Перми
Луховицы купить cocaine
Реле скорости в Барнауле
Диэтиловый эфир: формула.
 Диэтиловый эфир: физические и химические свойства
Диэтиловый эфир: физические и химические свойства
Купить Бошки Дмитров
Диэтиловый эфир: формула. Диэтиловый эфир: физические и химические свойства
Диэтиловый эфир — Sciencemadness Wiki
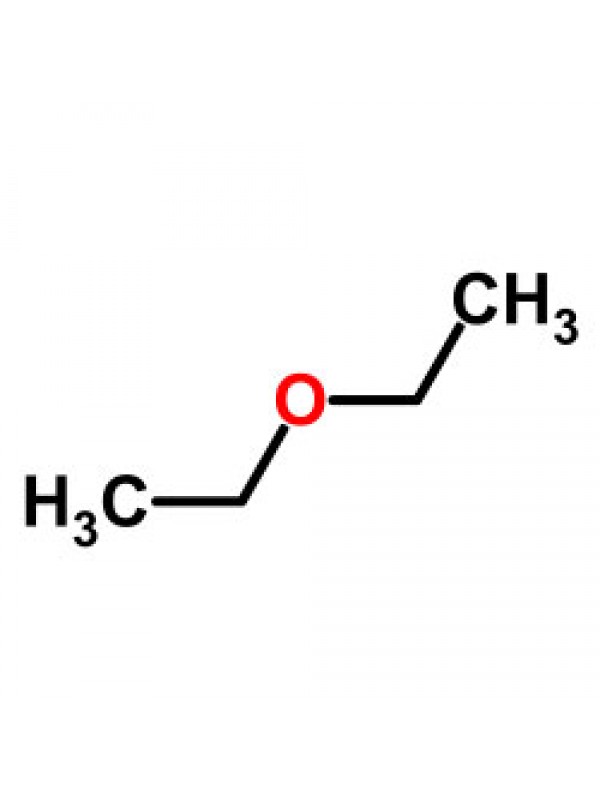
Диэтиловый эфир представляет собой органическое соединение с химической формулой (C 2 H 5 ) 2 O . Это летучая бесцветная жидкость при комнатной температуре, которая чаще всего используется в лаборатории в качестве неполярного растворителя. Это один из самых распространенных эфиров.
Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химический
Диэтиловый эфир обычно используется в качестве растворителя для экстракции, хотя его использование как таковое довольно дорого. Его часто используют в качестве растворителя в реакциях Гриньяра, однако непосредственно перед использованием его необходимо высушить и перегнать над элементарным натрием. Как и все простые эфиры, он может гидролизоваться до этанола при контакте с чрезвычайно сильными основаниями или кислотами. Йодоводородная кислота расщепляет эфиры.
Его часто используют в качестве растворителя в реакциях Гриньяра, однако непосредственно перед использованием его необходимо высушить и перегнать над элементарным натрием. Как и все простые эфиры, он может гидролизоваться до этанола при контакте с чрезвычайно сильными основаниями или кислотами. Йодоводородная кислота расщепляет эфиры.
Физический
Диэтиловый эфир представляет собой бесцветную жидкость с меньшей плотностью, чем вода. Он слабо растворим в воде и растворяет еще меньшее количество воды. Диэтиловый эфир чрезвычайно летуч, и поэтому из-за его угнетающего действия на нервную систему большие количества следует использовать только снаружи или в вытяжном шкафу. Летучесть диэтилового эфира и его репутация легковоспламеняющегося вещества делают его одним из наиболее опасных растворителей. Он имеет характерный сладкий запах, характерный для эфиров.
Доступность
Диэтиловый эфир довольно широко доступен у поставщиков химикатов, однако обычно он дорог. Если достаточно чистый, но не химически чистый эфир, его можно легко перегнать из многих жидкостей для запуска двигателей, которые можно найти в автомобильных магазинах, на заправочных станциях и в универмагах. Он часто встречается вместе с изомерами гептана, метилциклогексана и других углеводородов, но очень низкая температура кипения диэтилового эфира позволяет легко его выделить.
Если достаточно чистый, но не химически чистый эфир, его можно легко перегнать из многих жидкостей для запуска двигателей, которые можно найти в автомобильных магазинах, на заправочных станциях и в универмагах. Он часто встречается вместе с изомерами гептана, метилциклогексана и других углеводородов, но очень низкая температура кипения диэтилового эфира позволяет легко его выделить.
Внимание : не распылять содержимое баллончика в колбу! Таким образом, теряется много эфира (безумный ученый пользователь Ave369 перегонял только 50 мл диэтилового эфира из опустошенной таким образом банки Quick-Start). Аккуратно проткните банку, выпустите весь газ-вытеснитель, затем вылейте содержимое.
Рекомендуется сначала охладить банку в морозильной камере, чтобы ограничить испарение жидкости, а затем осторожно ввести охлажденную жидкость в колбу для перегонки с помощью длинной соломинки банки или другой пластиковой соломинки, если банка не подходит с одним.
Более прямой подход включает в себя осторожное сжатие баллончика плоскогубцами, создание очень маленького отверстия, через которое аэрозоль выходит наружу, предотвращая при этом выдувание эфира.
Некоторые типы исходной жидкости также содержат другие примеси, такие как альдегиды (а именно ацетальдегид), которые обычно образуются в процессе производства. Их нельзя удалить перегонкой, но можно сконденсировать, добавив щелочной металл (например, натрий) или основание (гидроксид натрия). После того, как все твердое вещество полимеризуется, вы должны перегнать продукт хотя бы еще раз (вы можете отфильтровать жидкость, если хотите), и этот шаг должен дать вам гораздо более чистый продукт. Однако, как отмечают некоторые химики, даже при очень большом избытке NaOH или Na, добавленного к нечистому эфиру, для полного удаления альдегидов из исходной жидкости требуются недели. Процесс можно ускорить, перемешивая смесь или даже кипятя сырой эфир с обратным холодильником, поскольку продукты конденсации имеют тенденцию покрывать основание или металлический натрий, что еще больше ограничивает реакцию или даже может заблокировать ее все вместе, если осадок достаточно густой.
Приготовление
Диэтиловый эфир достаточно легко получают из концентрированной серной кислоты и азеотропного этанола (хотя безводный работает лучше), при этом эфир отгоняют.
- 2 CH 3 CH 2 OH → (CH 3 CH 2 ) 2 O + H 2 O
Возможно , так как постоянное образование воды в качестве побочного продукта замедляет реакцию. Однако при приготовлении этого препарата необходимо соблюдать осторожность из-за невероятно высокой воспламеняемости диэтилового эфира и низкой температуры вспышки. Нельзя отказываться от любой перегонки с участием диэтилового эфира. Кипячение эфира досуха может вызвать взрыв, если в нем содержатся чувствительные пероксиды, но этого можно избежать, добавив перед перегонкой в диэтиловый эфир небольшое количество более высококипящего растворителя, такого как минеральное масло или глицерин. Этот дополнительный растворитель будет оставлен после перегонки для сольватации любых перекисей и снижения их опасности. Эту реакцию необходимо проводить при температуре от 135 °C до 150 °C, чтобы поддерживать приемлемую скорость образования эфира и снизить образование газообразного этилена.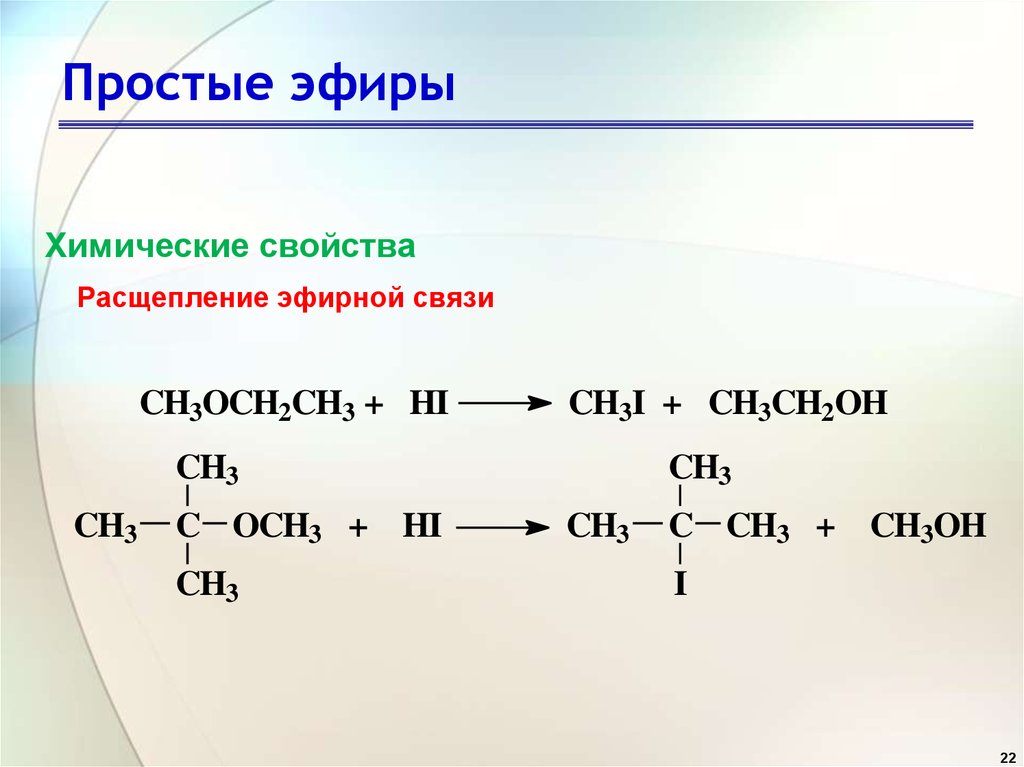 Ацетальдегид часто является побочным продуктом синтеза, и его можно удалить, разрушив его сильным основанием, что вызывает его полимеризацию.
Ацетальдегид часто является побочным продуктом синтеза, и его можно удалить, разрушив его сильным основанием, что вызывает его полимеризацию.
Проекты
- Разрушение пенополистирола при контакте
- Органические экстракты
- Растворитель для реакций Гриньяра и реактивов Гриньяра
- Огнемет
- Демонстрация температуры воспламенения легковоспламеняющихся жидкостей (можно провести, коснувшись небольшой лужицы эфира раскаленным металлическим или стеклянным стержнем)
Обращение
Безопасность
Диэтиловый эфир легко воспламеняется и может легко воспламениться от электрических устройств таких как выключатели света или горячие поверхности, такие как электрические плиты. Пары диэтилового эфира также тяжелее воздуха и, таким образом, скапливаются на земле, где более вероятно присутствие горячих поверхностей. Диэтиловый эфир также является легким депрессантом нервной системы, однако не представляет значительного риска для здоровья. Он обладает наркотическими свойствами и, как известно, вызывает временную зависимость, состояние, которое иногда называют эфироманией.
Он обладает наркотическими свойствами и, как известно, вызывает временную зависимость, состояние, которое иногда называют эфироманией.
Хранение
Диэтиловый эфир лучше всего хранить в стеклянных бутылях с узким горлышком. Диэтиловый эфир медленно образует взрывоопасные пероксиды при хранении, хотя добавление небольшого количества бутилированного гидрокситолуола (BHT) или хранение над гидроксидом натрия предотвратит это. Необходимо соблюдать осторожность, чтобы не перегонять эфир досуха из-за следовых количеств перекисей, образующихся с течением времени. Известно, что железо, медь, соли железа и сульфиты ингибируют образование перекисей.
Утилизация
Диэтиловый эфир можно безопасно сжигать, если он не содержит пероксидов. Если тест эфира на перекиси положительный, но в эфире нет осадка, можно нейтрализовать растворенные перекиси. Восстанавливающие агенты, такие как сульфат железа, бисульфит натрия или метабисульфит, добавленные в избытке, могут использоваться для нейтрализации пероксидов.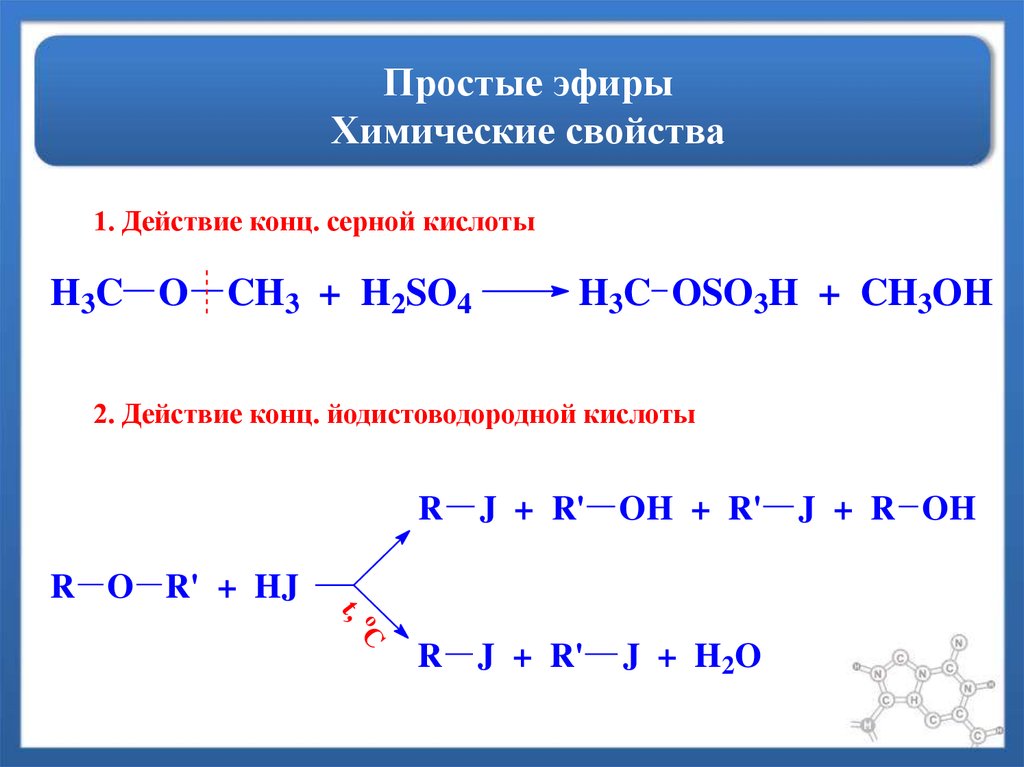 После нейтрализации эфир следует еще раз проверить на наличие перекисей и, если таковых нет, его можно смело сжигать.
После нейтрализации эфир следует еще раз проверить на наличие перекисей и, если таковых нет, его можно смело сжигать.
Если это очень старая бутылка, из раствора которой выпал осадок пероксида, или невозможно определить возраст бутылки, то, скорее всего, на крышке есть пероксиды. НЕ ОТКРЫВАТЬ БУТЫЛКУ! Вместо этого отнесите его в отдаленную специальную зону и благополучно взорвите. Последнее может потребовать или не потребовать профессиональной помощи, в зависимости от серьезности случая.
Однако, если в бутылке для хранения после недавнего добавления NaOH или KOH появляется беловатый порошкообразный осадок, это может быть просто ацетальдегид, сконденсировавшийся в результате реакции нейтрализации. Поскольку осадок повторно не растворяется, лучше просто сменить бутылку, если вы не уверены, что не сможете отличить настоящие твердые пероксиды от метальдегида.
Ссылки
Соответствующие темы Sciencemadness
- Хранение диэтилового эфира
- опасности диэтилового эфира
- Хранение диэтилового эфира
- Диэтиловый эфир
Этанол — Sciencemadness Wiki Он более известен как
питьевой спирт или просто спирт , и его растворы с водой составляют основу всех алкогольных напитков. Это легко получаемый и производимый лабораторный растворитель, а также обычный реагент в органической химии.
Это легко получаемый и производимый лабораторный растворитель, а также обычный реагент в органической химии.
Содержание
- 1 Свойства
- 1.1 Химическая
- 1.2 Физический
- 2 Наличие
- 3 Подготовка
- 4 проекта
- 5 Обращение
- 5.1 Безопасность
- 5.2 Хранение
- 5.3 Утилизация
- 6 Каталожные номера
- 6.1 Соответствующие темы Sciencemadness
Свойства
Химический
Этанол представляет собой первичный спирт с прямой цепью. Он часто используется в качестве растворителя в лабораторных условиях, но также имеет огромное разнообразие применений в качестве реагента.
Реагирует с натрием и некоторыми другими металлами, особенно с другими щелочными металлами, с образованием этоксидов. Получение триэтоксида алюминия таким способом возможно с использованием йода и хлорида ртути (II) в небольших количествах в качестве катализатора.
Этанол можно окислить с помощью дихромата калия в кислых условиях до ацетальдегида, который можно дополнительно окислить до уксусной кислоты, если условия достаточно холодные, чтобы предотвратить выкипание ацетальдегида. Ацетальдегид также можно получить из этанола двумя менее затратными способами, хотя для этого необходимо специальное оборудование. Первый — это окисление этанола кислородом на серебряном или медном катализаторе при температуре выше 500 ° C, но реакция является экзотермической и самоподдерживающейся, пока кислород присутствует в достаточном количестве, даже в концентрациях нормального воздуха. Другой метод заключается в дегидрировании этанола на медном катализаторе без использования кислорода. Этот маршрут не требует кислорода и проходит при более приемлемой температуре 260–29°C.0 °C, но является эндотермическим и требует постоянного нагревания. Условия, необходимые для любого из этих каталитических путей, могут быть достигнуты путем пропускания этанола в форме пара через нагретую трубку из плавленого кварца, содержащую катализатор.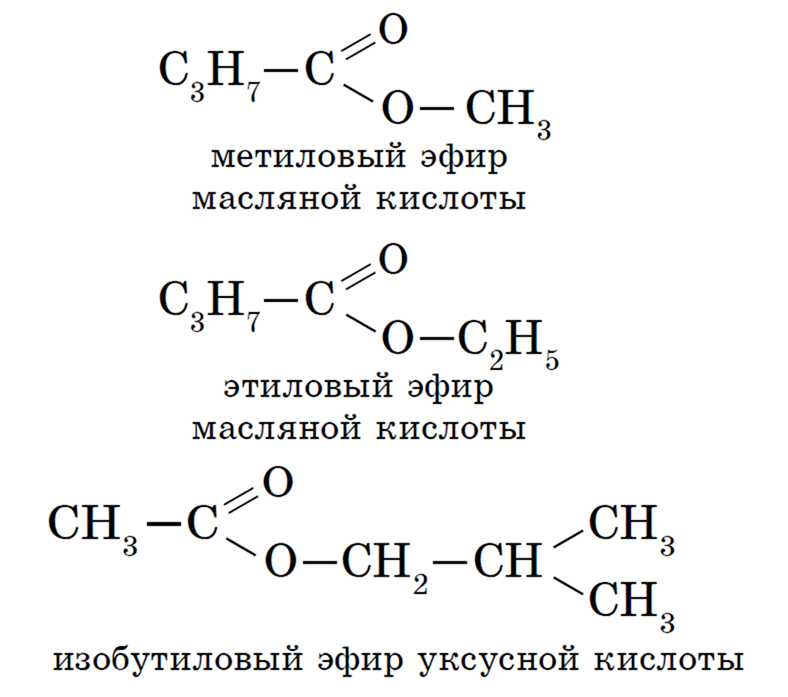
Этанол также может быть окислен до уксусной кислоты с использованием перманганата калия в основных условиях, вызывая немедленную нейтрализацию уксусной кислоты с образованием соли. Третий и последний путь получения уксусной кислоты из этанола включал биохимический процесс анаэробной ферментации уксуснокислыми бактериями, как это делается в промышленности для производства уксуса.
Из-за того, что этанол является широко доступным первичным спиртом, он желателен для получения сложных эфиров путем этерификации Фишера путем кипячения с обратным холодильником с карбоновой кислотой в условиях дегидратации.
Физический
Этанол представляет собой прозрачную летучую жидкость со сладким запахом, кипящую при 78 °C. Этанол имеет плотность 0,789 г/см 3 и смешивается с водой, а также с большинством органических растворителей. Этанол образует азеотроп с водой на 95,6%, а растворы с более высокой концентрацией этанола агрессивно гигроскопичны. Сушку этанола можно осуществить с помощью молекулярных сит 3А, осушителей или путем высаливания с использованием карбоната калия.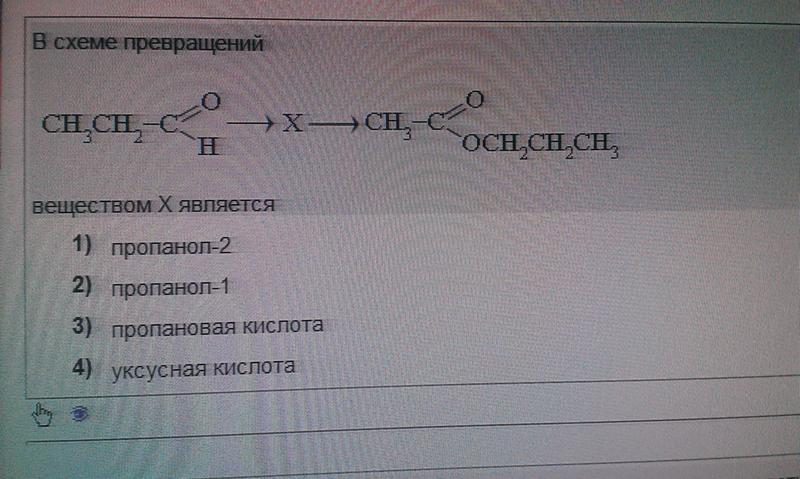 Также можно использовать оксид кальция. Этанол, как и большинство других спиртов, легко воспламеняется даже при низких концентрациях в растворе, хотя при низких концентрациях температура вспышки увеличивается.
Также можно использовать оксид кальция. Этанол, как и большинство других спиртов, легко воспламеняется даже при низких концентрациях в растворе, хотя при низких концентрациях температура вспышки увеличивается.
Доступность
Водные растворы 40% этанола доступны в большинстве винных магазинов в виде чистой водки, но для ее покупки необходимо быть совершеннолетним (21 год в США). Этанол 90-95% доступен как Everclear в винных магазинах в некоторых местах. В 14 штатах США продажа Everclear ограничена. Высококонцентрированный этанол также доступен в виде ректификованного спирта с максимальной концентрацией 96% (точнее, 95,6%). Некоторые ректифицированные спирты, как правило, содержат следы фенолфталеина или других химических веществ, добавленных для ограничения чрезмерного употребления алкоголя, и если они могут помешать каким-либо предполагаемым реакциям, этанол необходимо перегнать, чтобы удалить их. Ректифицированный спирт доступен как пищевой во многих странах (Финляндия, Венгрия, Польша, Румыния, например) и в некоторых штатах США, хотя он часто довольно дорогой, в некоторых случаях 26 долларов за л. Высококонцентрированный этанол также может продаваться в качестве дезинфицирующего средства (так называемый этанол «медицинского качества»), обычно смешанный с изопропанолом; в зависимости от страны он может квалифицироваться или не квалифицироваться как пищевой.
Высококонцентрированный этанол также может продаваться в качестве дезинфицирующего средства (так называемый этанол «медицинского качества»), обычно смешанный с изопропанолом; в зависимости от страны он может квалифицироваться или не квалифицироваться как пищевой.
Метилированные спирты или денатурированные спирты сильно различаются в зависимости от региона и торговой марки, но обычно содержат некоторую долю этанола и метанола, причем этанол составляет большую долю. Эти продукты могут также содержать метилэтилкетон, что делает их непригодными для питья. Этанол для промышленного использования денатурируют, чтобы его никто не пьет, а это означает, что он дешевле, поскольку обходит налог на алкоголь и доступен для продажи несовершеннолетним. Денатурирующие или горькие агенты включают бензоат денатония и пиридин, которые придают спирту очень неприятный горький вкус.
Некоторые виды топлива для кемпинга/биотоплива состоят из этанола с добавлением небольшого количества метанола для денатурации. Другие комбинации могут содержать изопропанол, глицерин или масло.
Другие комбинации могут содержать изопропанол, глицерин или масло.
Перегонка этанола, даже для научных целей и очистки, в некоторых местах считается незаконной, хотя часто можно получить разрешение, разрешающее это.
Приготовление
Один галлон спирта домашнего приготовления из сахара. Через семь дней после начала брожения он содержит 20% этанола и готов к перегонке.
Приготовление этанола для лабораторного использования, как правило, осуществляется путем ферментации сахара (столовый сахар-песок отлично подходит) с использованием дрожжей, в частности быстроферментирующих дрожжей с высокой устойчивостью к алкоголю, используемых для этой цели. Чтобы стимулировать ферментацию, а не рост дрожжей, смесь необходимо поместить в контейнер с воздушным шлюзом, чтобы позволить углекислому газу выходить, но не попадать кислороду. Этот процесс обычно может производить только растворы, содержащие 20% этанола, возможно, вместе с другие продукты, такие как метанол или ацетон, которые необходимо удалить.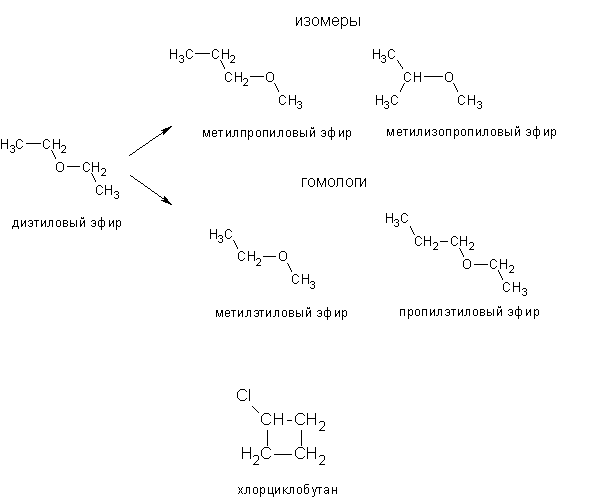 Если вы используете чистую сахарозу (рафинированный тростниковый или свекловичный сахар) для приготовления этанола, вы защищены от загрязнения метанолом; однако пектин и некоторые другие углеводы, присутствующие во фруктах, действительно выделяют метанол при ферментации, поэтому фруктовые пюре требуют особых мер предосторожности при дистилляции.
Если вы используете чистую сахарозу (рафинированный тростниковый или свекловичный сахар) для приготовления этанола, вы защищены от загрязнения метанолом; однако пектин и некоторые другие углеводы, присутствующие во фруктах, действительно выделяют метанол при ферментации, поэтому фруктовые пюре требуют особых мер предосторожности при дистилляции.
Путем тщательной перегонки смеси после того, как она была достаточно ферментирована, можно получить азеотроп 96% этанола, 4% воды по объему. карбонат калия растворяется в смеси, в результате чего образуются 2 отдельных слоя. Слой этанола можно снять сверху и перегнать в безводной среде; или его можно охладить до температуры ниже 0°C для осаждения большинства примесей, если перегонка невозможна.
Если домашнее пивоварение этанола не является привлекательным способом, его можно перегонять из купленных в магазине спиртных напитков, таких как водка или джин, которые часто содержат около 40% этанола по объему. Важно иметь в виду, что дистилляция этанола является незаконной во многих юрисдикциях без разрешения, и, возможно, не менее важно отметить, что этанол, произведенный таким образом, особенно с использованием лабораторной посуды, небезопасен для употребления. Перегонка безопасного, пригодного к употреблению этанола — это целое искусство и ремесло под названием самогоноварение , и вам нужно изучить этот навык и получить или сконструировать специальный аппарат для дистилляции, если вы хотите синтезировать пищевой этанол. Проконсультируйтесь со своим юристом, чтобы узнать, является ли эта практика законной там, где вы живете; в некоторых юрисдикциях самогоноварение является законным ремеслом, если оно не приносит прибыли, а в некоторых оно полностью незаконно.
Перегонка безопасного, пригодного к употреблению этанола — это целое искусство и ремесло под названием самогоноварение , и вам нужно изучить этот навык и получить или сконструировать специальный аппарат для дистилляции, если вы хотите синтезировать пищевой этанол. Проконсультируйтесь со своим юристом, чтобы узнать, является ли эта практика законной там, где вы живете; в некоторых юрисдикциях самогоноварение является законным ремеслом, если оно не приносит прибыли, а в некоторых оно полностью незаконно.
Проекты
- Получение ацетальдегида окислением дихроматом
- Получение уксусной кислоты окислением перманганатом
- Получение этилацетата, полезного растворителя
- Приготовление диэтилового эфира, другого растворителя
- Получение этиловых эфиров с помощью этерификации Фишера.
- Изготовление криоголя для холодных ванн
- Сделать этилиодид
- Употребление этанола из-за его рекреационного эффекта, изменяющего сознание (просто не пейте этанол лабораторного качества)
Обращение
Безопасность
Этанол, потребляемый время от времени в небольших количествах, не представляет особой опасности, но очень большие количества немедленно опасны для здоровья.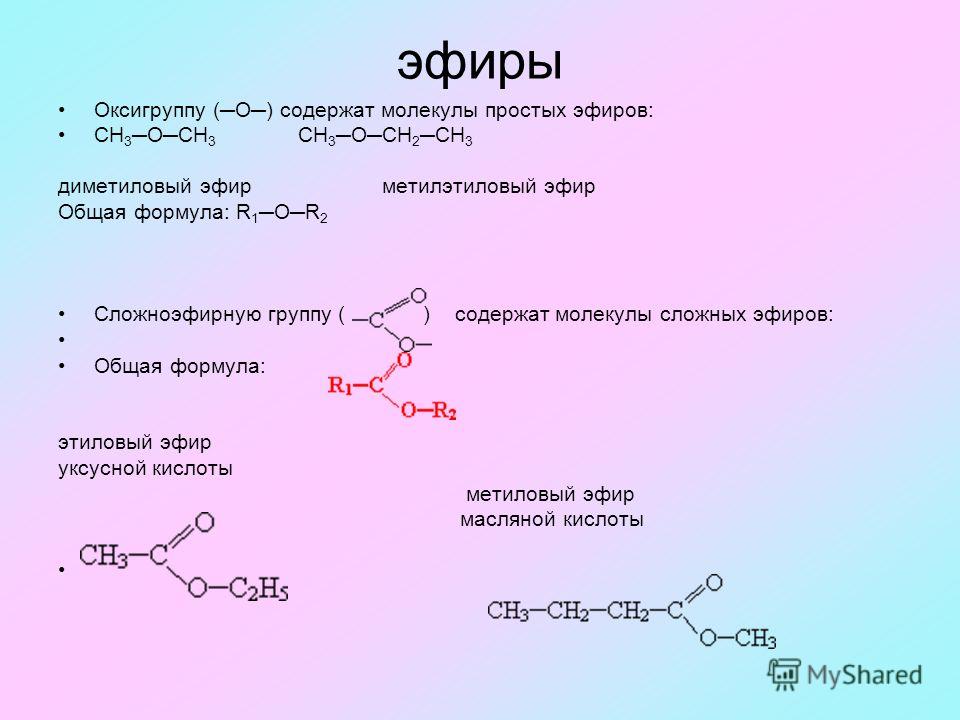 тело, в то время как умеренные и большие количества в течение длительного периода могут привести к повреждению печени. Он может вызывать привыкание, и он необычен среди наркотиков тем, что его симптомы отмены могут убить. Прием внутрь небольшого количества этанола вызывает опьянение, которое замедляет время реакции и суждение. Следует отметить, что этанол, произведенный в лаборатории, НЕ пригоден для употребления, особенно с учетом риска загрязнения метанолом, который в организме распадается на муравьиную кислоту, потенциально вызывая слепоту или смерть. Всегда держите кухонный этанол отдельно от лаборатории, не используйте его для дистилляции непищевых химикатов и учитесь искусству самогоноварение , которое включает в себя методы приготовления и перегонки безопасного питьевого спиртного напитка, не загрязненного метанолом или другими токсичными веществами. Научитесь использовать методы фракционной перегонки, многоступенчатой перегонки и ректификации, которые полезны для избавления от форшотов и ложных , содержащих токсичные вещества.
тело, в то время как умеренные и большие количества в течение длительного периода могут привести к повреждению печени. Он может вызывать привыкание, и он необычен среди наркотиков тем, что его симптомы отмены могут убить. Прием внутрь небольшого количества этанола вызывает опьянение, которое замедляет время реакции и суждение. Следует отметить, что этанол, произведенный в лаборатории, НЕ пригоден для употребления, особенно с учетом риска загрязнения метанолом, который в организме распадается на муравьиную кислоту, потенциально вызывая слепоту или смерть. Всегда держите кухонный этанол отдельно от лаборатории, не используйте его для дистилляции непищевых химикатов и учитесь искусству самогоноварение , которое включает в себя методы приготовления и перегонки безопасного питьевого спиртного напитка, не загрязненного метанолом или другими токсичными веществами. Научитесь использовать методы фракционной перегонки, многоступенчатой перегонки и ректификации, которые полезны для избавления от форшотов и ложных , содержащих токсичные вещества.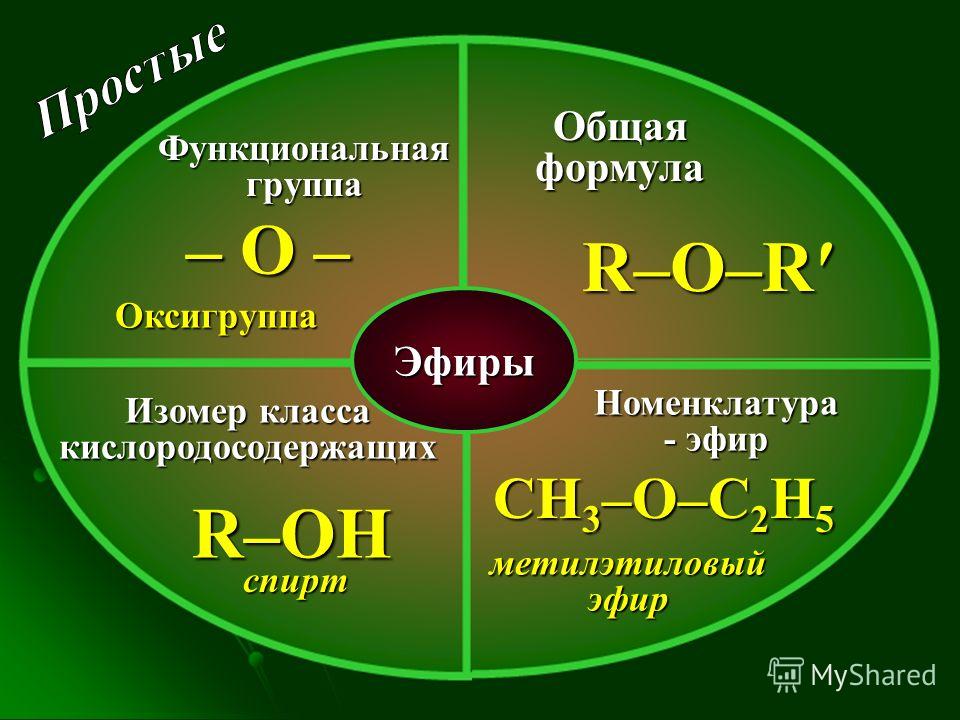
Воспламеняемость растворов этанола зависит от концентрации. Температура воспламенения чистого спирта составляет 17°С, а для концентрации всего 10% температура вспышки составляет около 49°С.°С. Однако серьезная воспламеняемость начинается с 40% (минимальная концентрация, при которой воспламеняется чайная ложка).
Дистилляция спирта без разрешения во многих юрисдикциях является незаконной, и поэтому домашнее пивоварение этанола может не подходить для производства этанола подходящего качества для использования в лаборатории.
Хранение
Этанол следует хранить в закрытых пластиковых или стеклянных бутылях вдали от любых источников огня или окислителей. Он слегка гигроскопичен, образуя азеотроп с водой при 95,6%. Если требуется чистый этанол, его можно высушить с помощью сильного осушителя, такого как молекулярные сита.
Для большинства синтезов и процедур не всегда требуется безводный этанол, достаточно азеотропного этанола. Однако для реакций, где присутствие воды нежелательно, можно получить безводный этанол, высушив его с помощью свежих молекулярных сит или металлического натрия, а затем перегнать этанол в сухих или инертных условиях.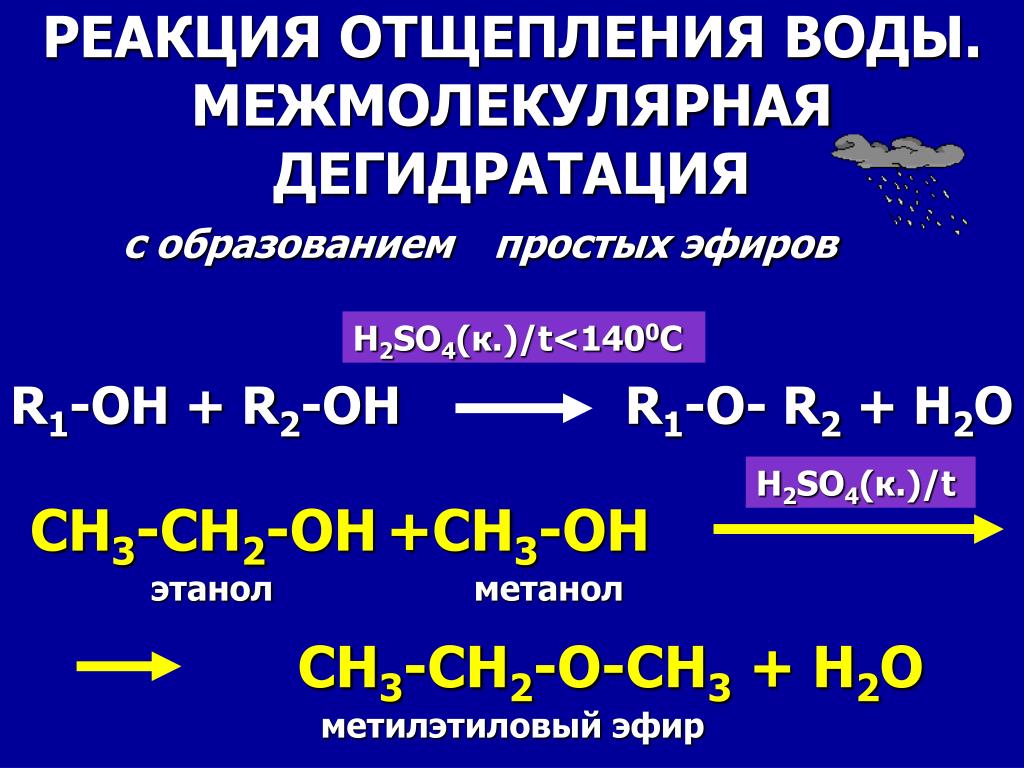

 , 2736 с. ( ISBN 978-1-4200-6679-1 ), стр. 9-50
, 2736 с. ( ISBN 978-1-4200-6679-1 ), стр. 9-50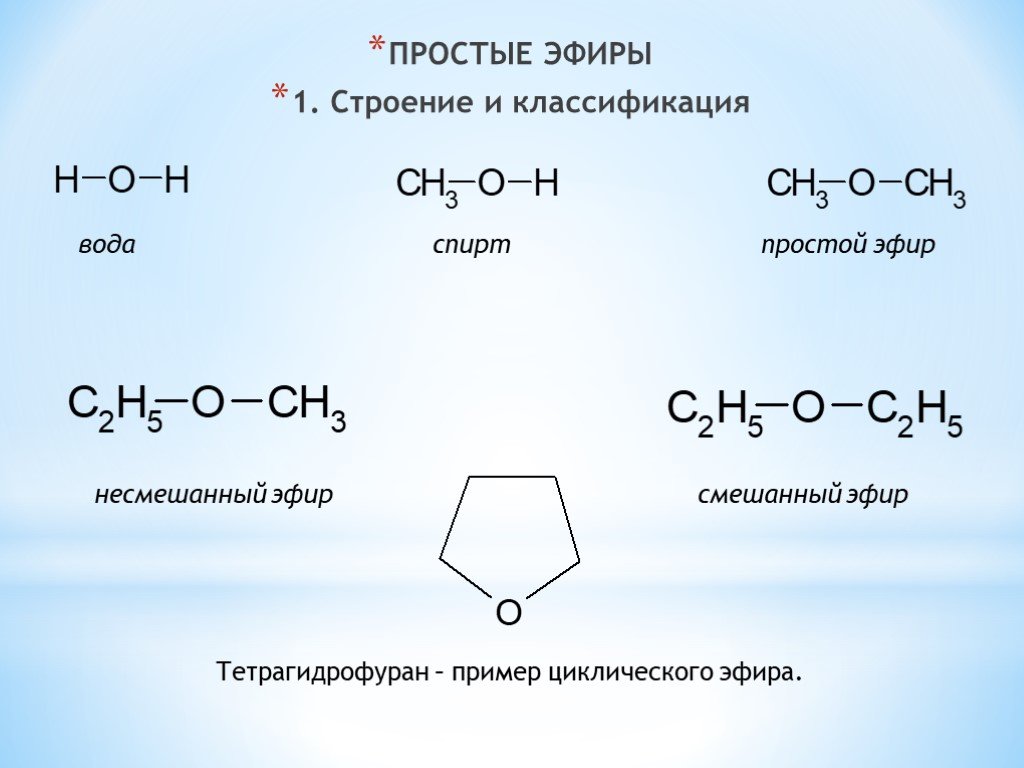 ( ISBN 0-07-049841-5 ), стр. 2-50
( ISBN 0-07-049841-5 ), стр. 2-50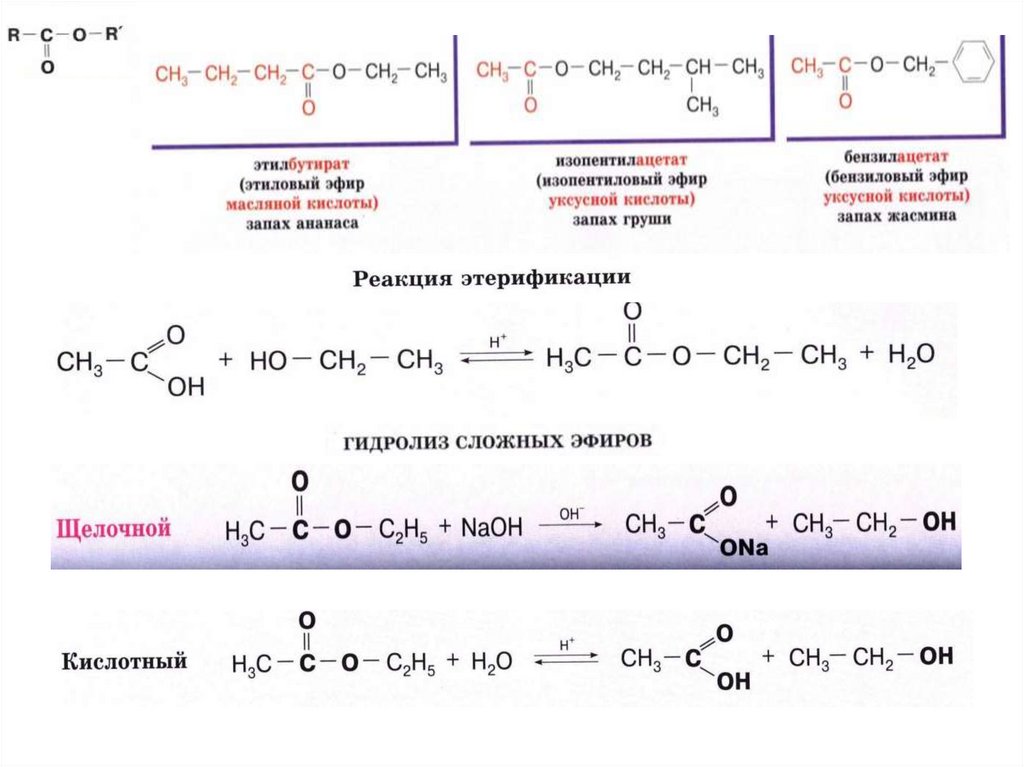 Яс, Справочник по термодинамическим диаграммам, Vol. 1, 2 и 3, Хьюстон, штат Техас, паб Gulf. Co.,( ISBN 0-88415-857-8, 978-0-88415-858-5 и 978-0-88415-859-2 )
Яс, Справочник по термодинамическим диаграммам, Vol. 1, 2 и 3, Хьюстон, штат Техас, паб Gulf. Co.,( ISBN 0-88415-857-8, 978-0-88415-858-5 и 978-0-88415-859-2 )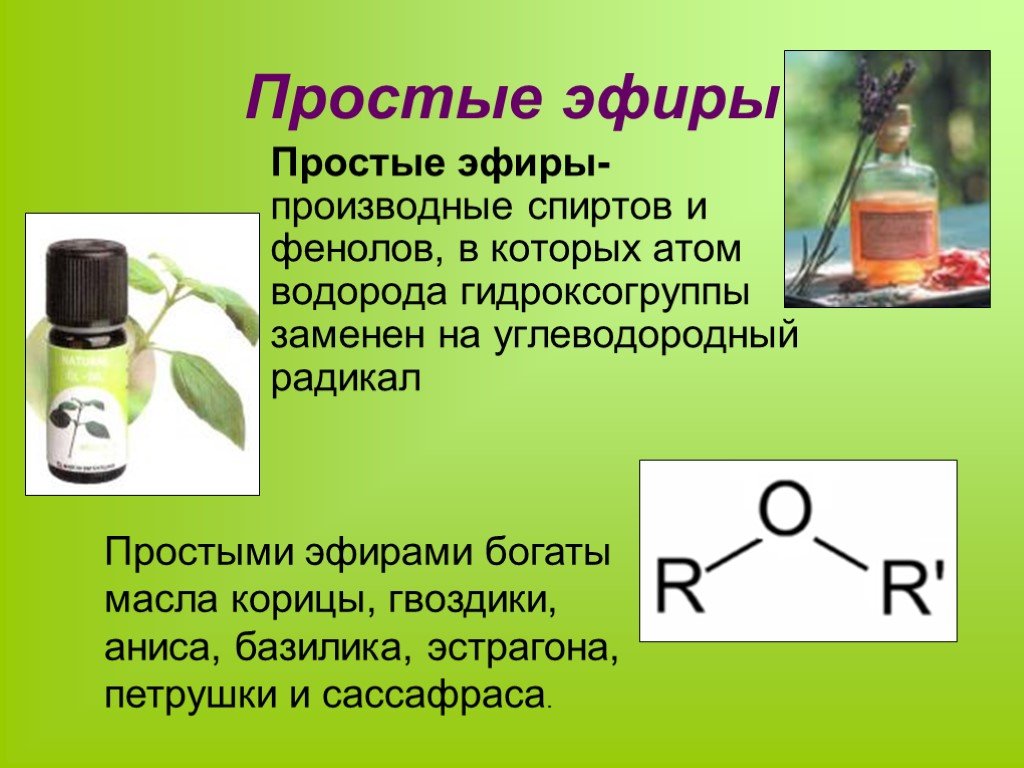 10-205
10-205 ) .
) . et al. (2001) Измерения хлороформа на месте на станциях исследования атмосферы Advanced Global Atmospheric Gases Experiment с 1994 по 1998 год . J. Geophys. Res. 106, 20429-20444.
et al. (2001) Измерения хлороформа на месте на станциях исследования атмосферы Advanced Global Atmospheric Gases Experiment с 1994 по 1998 год . J. Geophys. Res. 106, 20429-20444.