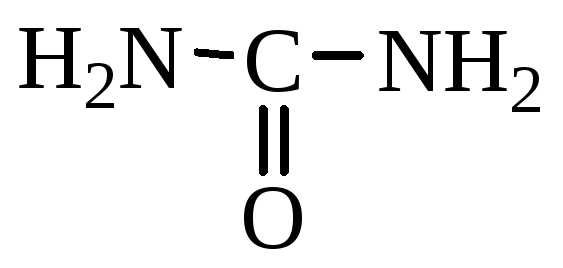Кето-енольная таутомерия ацетоуксусного эфира Таутомерия способность химических. Кето енольная таутомерия ацетоуксусного эфира
5 Оксокислоты. Общие хим св-ва. Реакции на карбонильную и карбоксильную группы. Взаимодействие пировиноградной кислоты с н2, nh3 – nh3,c6h5 – nh3, c6h5ohNaOh/
Оксокислоты - называют соединения, содержащие в молекуле одновременно карбоксильную и альдегидную (или кетонную) группы. Они проявляютобщие свойства, присущие альдегидам или кетонам и кислотам, но как кислоты они сильнее соответствующих карбоновых кислот (сказывается –Iэффект карбонильной группы)
П Специфические свойства, обусловленные взаимным влиянием
>C=Oи -COOHгрупп:
1. Расщепление - и- оксокислот при нагревании – декарбоксилирование:
ˉ
++ t°, h3SO4разб.
а) + CO2
ˉ
t° комн.
б) + CO2
2. Кето-енольная таутомерия -оксокислот.
+
:
–
кето-форма енольная форма
ацетоуксусная кислота (АУК)
Реакции на карбоксильную группу 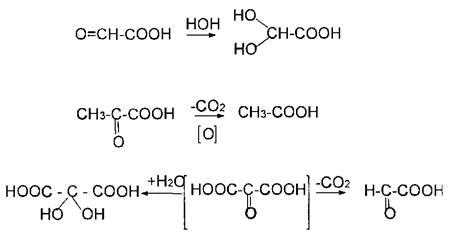
Пировиноградная была в кр !!!!! но не могу ее найти
6 Оксокислоты. Кето – енольная таутомерия на примере ацетоуксусного эфира и оксалилуксусной кислоты. Реакции с nh3-nh3, FeCl3
Для ацетоуксусного эфира, как и для других 1,3-дикарбонильных соединений характерна кето-енольная таутомерия:
III Амины. Аминокислоты. Пептиды. Белки
1 Амины. Классифификация. Химические св-ва. Основность по теории Лоури – Бренстеда. Сравните основность этиламина, диэтиламина, триэтиламина, анилина. Напишите реакции взаимодействия анилина с соляной кислотой. Аминами называются органические производные аммиака, в которых один, два или три атома водорода замещены на углеводородные радикалы (первичные, вторичные и третичные амины).
Все протеиногенные -аминокислоты – за исключением пролина – содержат первичную аминогруппуКлассификация аминов разнообразна и определяется тем, какой признак строения взят за основу.
В зависимости от числа органических групп, связанных с атомом азота, различают:
первичные амины – одна органическая группа у азота RNh3
вторичные амины – две органических группы у азота R2NH, органические группы могут быть различными R'R"NH
третичные амины – три органических группы у азота R3N или R'R"R"'N
По типу органической группы, связанной с азотом, различают алифатические Сh4 – N< и ароматические С6H5 – N< амины, возможны и смешанные варианты.
По числу аминогрупп в молекуле амины делят на моноамины Сh4 – NН2, диамины h3N(Сh3)2NН2, триамины и т.д.
2 Нуклеофильные св-ва аминов. Реакции алкилирования по Гофману на примере метиламина с Ch4J.Реакция алкилирования аминов на примере анилина с уксусной кислотой 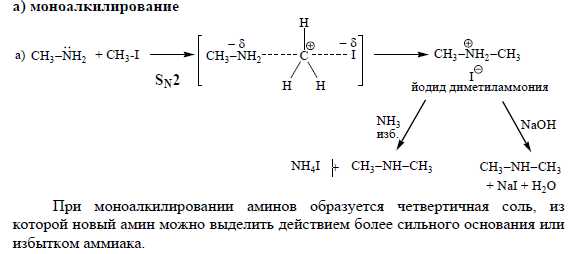
метила (возможно исчерпывающее алкилирование).
3 Аминокислоты. Классификация альфа – аминокислот на основные физико- химические св-ва их радикалов. Примеры каждого класса. Строение. Название. Поведение в водных р-рах. Понятие о биполярных ионах. Влияние рН среды на суммарный заряд аминокислот, пептидов. Изоэлектрическая точка.
Аминокислотами называются органические соединения, содержащие
карбоксильную и аминогруппу: (Nh3)m-R –(COOH)n
Классификация:
1) по количеству СООН- и Nh3-групп аминокислоты делятся на моноаминокарбоновые, диаминокарбоновые, моноаминодикарбоновые и т.д.
2) по взаимному расположению двух функциональных групп: , , - и т.д. аминокислоты.
Изомерия: 1) по строению углеродного скелета; 2) оптическая (стерео) изомерия.
Формула Название Биологическая роль
Nh3-CH-COOH* - аланин Входит в состав пеп-
( - аминопро- тидов, белков
СН3 пионовая кислота)
h3N-Ch3-Ch3-COOH -Аланин Входит в состав
(-аминопро- пантотеновой кислоты
пионовая кислота) (витамина В3)
h3N-Ch3-Ch3- СН2 –COOH -Аминомасляная Природный транкви-
кислота (ГАМК) лизатор
Примечание: * - оптически активна
С биологической точки зрения огромное значение имеют - аминокислоты. Это «кирпичики», из которых построены молекулы белка –протеиногенные аминокислоты. Основным источником - аминокислот для живого организма служат белки пищи. Большинство - аминокислот синтезируются в организме, но некоторые, необходимые для синтеза белков, не синтезируются в организме или синтезируются в недостаточном количестве и должны поступать извне. Такие аминокислоты называются незаменимыми, это:
Валин, лейцин, изолейцин, фенилаланин, метионин, триптофан, треонин, лизин, гистидин, аргинин.
Классификация -аминокислот.
Общая структурная формула протеиногенных аминокислот:
R
Аминокислоты классифицируют на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группу), то они называются нейтральными аминокислотами. Если же аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой.
Современная рациональная классификация аминокислот основана на полярности радикалов, т.е. способности их к взаимодействию с водой. Она включает четыре класса аминокислот:
неполярные(гидрофобные)
полярные (гидрофильные) незаряженные
отрицательно заряженные
положительно заряженные при физиологических значениях pH

studfiles.net
Органическая химия: Лабораторный практикум, страница 24
Опыт № 66. Кето-енольная таутомерия ацетоуксусного эфира
Ацетоуксусная кислота и ее этиловый эфир (ацетоуксусный эфир) существует в виде двух таутомерных форм - кетонной и енольной.
Таутомерные формы находятся в состоянии динамического равновесия, одна из таутомерных форм способна самопроизвольно переходить в другую.
При комнатной температуре равновесие устанавливается при содержании 92,5% кетонной формы и 7,5% енольной формы.
Реактивы:
Ацетоуксусный эфир
Раствор бромной воды
Раствор хлорида железа (III)
Ход работы:
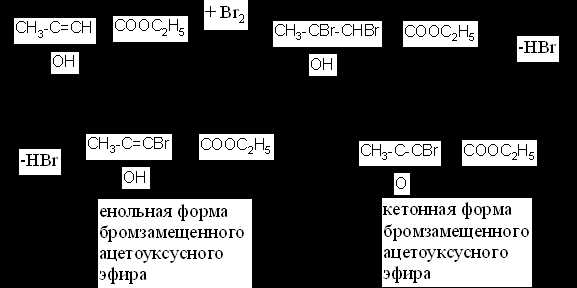
В пробирку к ~2 мл воды приливают ~10 капель ацетоуксусного эфира и 1-2 капли хлорида железа (III). Раствор окрашивается с сине-фиолетовый цвет, обусловленный образованием комплексной соли с енольной формой ацетоуксусного эфира.
Затем к раствору прибавляют по каплям бромную воду, раствор обесцвечивается, т.к. бром присоединяется по месту разрыва двойной связи и енольная группировка исчезает. Через некоторое время сине-фиолетовая окраска вновь появляется.
Появление окраски с хлоридом железа (III) объясняется наличием в растворе енольной формы бромзамещенного ацетоуксусного эфира.
Процесс можно изобразить следующей схемой:
IX. УГЛЕВОДЫ
Моносахариды
Опыт № 67. Реакция на обнаружение углеводов с a-нафтолом (реакция Молиша)
Эта реакция очень чувствительна и позволяет определять даже следовые количества моносахаридов и др. углеводов. Она основана на превращении гексоз при нагревании с серной кислотой в оксиметилфурфурол, пентоз – в фурфурол. Полученные соединения с a-нафтолом дают продукты конденсации окрашенные в красный или синий цвет
Реактивы:
Глюкоза
Спиртовой раствор a-нафтола
Концентрированная серная кислота
Ход работы:
В пробирку наливают ~1 мл раствора глюкозы. Далее прибавляют небольшое количество спиртового раствора a-нафтола и не перемешивая содержимое пробирки приливают (осторожно!) концентрированную серную кислоту до образования красно-фиолетового кольца.
Опыт № 68. Доказательство наличия гидроксильных групп в глюкозе
Реактивы:
Раствор глюкозы
Раствор гидроксида натрия
Раствор сульфата меди
Ход работы:
В пробирку наливают ~1 мл раствора глюкозы, добавляют несколько капель гидроксида натрия и сульфата меди. Образующийся осадок гидроксида меди (II), при взбалтывании содержимого пробирки, растворяется и получается прозрачный раствор синего цвета.
Растворение гидроксида меди (II) происходит в результате образования комплексного соединения – сахарата меди за счет имеющихся в глюкозе гидроксильных групп.
vunivere.ru
Ацетоуксусный эфир кето-енольная таутомерия - Справочник химика 21
Таутомерия ацетоуксусного эфира. Истинное строение ане-тоуксусного эфира было предметом длительной полемики до тех пор, пока не было понято явление таутомерии (разд, 7.1.4,В). Теперь установлено, что обычный ацетоуксусный эфир содержит оба таутомера. Равновесная смесь состоит из 93% кето- и 7% енольного таутомера. С помощью специальной техники можно отделить чистые образцы таутомеров, которые в отсутствие кислоты или основного катализатора взаимопревращаются очень медленно. Поскольку даже щелочная поверхность натриевого стекла является эффективным катализатором, в обычных лабораторных условиях равновесие устанавливается очень быстро. [c.246]
Кето-енольная таутомерия и ацетоуксусный эфир [c.893]Кето-енольная таутомерия. На примере ацетоуксусной кислоты или ее этилового эфира можно познакомиться с интересным видом изомерии — таутомерией. Этиловый эфир ацетоуксусной кислоты и сама кислота могут существовать в виде [c.189]
Кето-енольная таутомерия. Роль кислотно-основного катализа при енолизации. Устойчивость енольных форм. Двойственная реакционная способность (натрийацетоуксусный эфир). Синтезы при помощи ацетоуксусного и малонового эфиров. [c.220]
Реакция ацетоуксусного эфира с хлорным железом и бромом (кето-енольная таутомерия ацетоуксусного эфира) [c.87]
Помимо ацетоуксусного эфира, кето-енольную таутомерию можно обнаружить и у ряда других веществ, причем устойчивость обеих форм и соответственно положение равновесия между ними могут быть совершенно различными. Ниже приведены схемы кето-енольной таутомерии некоторых соединений и их константы енолизации — числа, показывающие способность к енолизации сравнительно с ацетоуксусным эфиром, условно принятым за единицу (табл. 14). [c.275]
Помимо ацетоуксусного эфира кето-енольную таутомерию можно обнаружить и у ряда других веществ, причем устойчивость-обеих форм может быть различной. Строение таких веществ можно. в общем виде выразить формулой X—СНг—Y, где X и Y — группы R O, OOR, N, NO2. [c.367]
Кето-енольная таутомерия. Ацетоуксусный эфир существует в двух формах — кетонной и енольной [c.229]
Ацетоуксусный эфир способен к кето-енольной таутомерии [c.232]
С помощью ацетоуксусного эфира впоследствии было выполнено множество синтезов, например пирамидона, акрихина, витамина Bl и др. На основе ацетоуксусного эфира Л. Кнорр и Р. Клайзен в 1896—1897 г. изучили кето-енольную таутомерию, что содействовало дальнейшему развитию теоретической органической химии. [c.243]
В случае (3-кетокислот, на примере ацетоуксусного эфира, мы наблюдаем интереснейшее явление двойственной реакционной способности, называемое таутомерией. Применительно к указанному классу соединений, это явление названо кето-енольной таутомерией. Суть данного явления заключается в следуюш,ем карбонильная и карбоксильная функции, будучи сильными электроноакцепторами (-М-эффект), оголяют протоны метиленовой группы, расположенной между ними, что делает их кислыми. В силу этого водород в виде катиона может мигрировать к карбонильному кислороду несуш,ему на себе избыточную электронную плотность синхронно этому переходу электронная плотность карбонильной группы и а-связей метиленового фрагмента перераспределяется так, как это указано на схеме 2.2.4, образуя систему [c.26]
Интересно отметить, что А. М. Бутлеров, исходя из теории строения предсказал еще в 1877 г. возможность двойственного реагирования и таутомерии как обратимой изомеризации. Однако первые явления этого рода были открыты Байером в 80-х годах прошлого века не в области кето-енольной таутомерии, рассмотренной нами на примере ацетоуксусного эфира, а на так называемой лактим-лактамной таутомерии (стр. 424) изатина первые же исследования кето-енольной таутомерии относятся к самому концу XIX и началу XX века. [c.417]
Специальные исследования показали, что ацетоуксусный эфир едставляет смесь двух изомеров — кетона (92,5%) и енола, 5 %), находящихся в таутомерном равновесии. Это еще один имер кето-енольной таутомерии, описанной ранее на примере етилацетона (см. 9.2.1). [c.267]
Как и в ацетоуксусной эфире, в малоновом эфире существуют структурные предпосылки для кето-енольной таутомерии [c.425]
Таутомеры существуют совместно в одном и том же образце вещества и постоянно переходят друг в друга. Чаще всего встречается прототропная таутомерия, которая состоит во взаимопревращении таутомеров с переносом протона. Ацетоуксусному эфиру присуща кето-енольная таутомерия — одна из разновидностей про-тотропной таутомерии. В равновесной смеси при температуре 25 С содержится 92,5% кетонной и 7,5% енольной форм. [c.334]
Особенность кислотной диссоциации в случае кето-енольной таутомерии заключается в том, что обе формы, являющиеся кислотами разной силы, имеют общий анион, отрицательный заряд в котором распределен между двумя атомами—кислорода и углерода, с большей долей отрицательного заряда на кислороде. Например, для ацетоуксусного эфира [c.560]
При взаимодействии ацетоуксусного эфира, а также других соединений, способных к кето-енольной таутомерии, с различными реагентами, в зависимости от условий реакции образуются производные кетонной или енольной форм. Вопрос о механизме этих реакций до сих пор обсуждается в литературе [71]. Так, при взаимодействии ацетоуксусного эфира с хлорангидридами кислот получаются либо С-, либо 0-производные при действии хлористого ацетила в присутствии пиридина образуется 0-производное если же реакция проте- [c.573]
Разрешению вопроса о таутомерных формах ацетоуксусного эфира предшествовало разрешение его для ряда более сложных случаев кето-енольной таутомерии, как, например, для диацетилянтарного эфира, для которого были най- [c.615]
Ацетоуксусный эфир СНз—С—СНа—ССЮС2Н5. Исключительный интерес с теоретических позиций и большое практическое значение в разнообразных синтезах играет этиловый эфир ацетоуксусной кислоты (ацетоуксусный эфир), существующий в двух изомерных формах, которые легко переходят друг в друга и находятся в состоянии подвижного равновесия. Это явление получило название подвижной (динамической) изомерии, или таутомерии. Одна из изомерных форм ацетоуксусного эфира содержит кетогруппу (кето-форма), другая гидроксильную группу у ненасыщенного углеродного атома (еноль-ная форма) отсюда и название этого вида таутомерии — кето-енольная таутомерия [c.160]
Ацетоуксусный эфир — классический пример соединения, способного к кето-енольной таутомерии [c.253]
В многочисленных исследованных реакциях ацетоуксусный эфир реагирует в одних случаях так, как если бы он обладал строением эфира кетокислоты, а в других случаях — в согласии с енольной формулой (как оксикротоновый эфир). Здесь имеется один из типичнейших примеров явления таутомерии, или десмотропии (стр. 289). Именно этот пример является одним из наиболее хорошо исследованных случаев характерных взаимных отношений веществ, содержащих карбонильную группу >СН—СО—, к веществам, содержащим гидроксил у этиленовой связи >С=С(ОН)—, или енолам. Эти отношения носят название кето-енольной таутомерии. [c.521]
Разрешению вопроса о таутомерных формах ацетоуксусного эфира предшествовало разрешение его для ряда более сложных случаев кето-енольной таутомерии, как, например, для диацетилянтарного эфира, для которого были найдены три таутомерные ( десмотропизомерные ) формы [c.528]
Самопроизвольный переход кетонной формы ацетоуксусного эфира в енольную форму и обратно называется кето-енольной таутомерией. [c.179]
С давних пор известен класс соединений, применяемых в качестве термостабилизаторов галогепсодержащих полимеров, — хелаты металлов 1,3-дикарбонильных соединений, которые способны к кето-енольной таутомерии, например ацетилацетон или этиловый эфир ацетоуксусной кислоты. Особенно большое практическое значение получил этилацетоацетат кальция [c.222]
Особенно широко применяется электронная спектроскопия при исследовании кето-енольной таутомерии [2]. Наиболее хорошо изученным соединением, для которого наблюдается кето-енольная тау томерия, является ацетоуксусный эфир. Чистая жидкость содержит около 93% кетонной формы (I) и 7% енольной формы (II) [c.181]
АЛЬДЕГИДОКНСЛОТЫ И КЕТОКИСЛОТЫ. КЕТО-ЕНОЛЬНАЯ ТАУТОМЕРИЯ. СИНТЕЗЫ С АЦЕТОУКСУСНЫМ ЭФИРОМ [c.103]
chem21.info
17.1.2.Нитрозирование кетонов
Алифатические и алициклические кетоны, содержащие a-метиленовую группу, нитрозируются под действием азотистой кислоты, изоамилнитрита или хлористого нитрозила. Реакционноспособной формой при нитрозировании является енол.
a-Нитрозосоединение изомеризуется в более стабильное a-окси-иминопроизводное (изонитрозосоединение). Направление нитрозирования несимметричных кетонов соответствует образованию более стабильного енола и приводит к введению нитрозогруппы у наиболее замещенного a-углеродного атома. a-Oксиминопроизводные восстанавливают цинком и уксусной кислотой в a-аминокетоны, используемые в синтезе пирролов по Кнорру.
a-Аминокетоны можно обычным образом восстанавливать до a-амино-спиртов. С другой стороны, a-оксиминокетоны после кислотного гидролиза дают 1,2-дикетоны.
17.1.3. Keто-енольная таутомерия
В предыдущем разделе был подробно описан механизм катализируемой кислотой енолизации кетонов. В действительности кетоны находятся в равновесии с енольной формой и кислота только ускоряет взаимопревращение обеих форм. Равновесие двух форм: кетонной и енольной, отличающихся положением атома водорода и двойной связи, принято называть кето-енольной таутомерией.
Для незамещенных и пространственно не затрудненных кетонов равновесная концентрация енола очень мала и колеблется в интервале от 8.10-6 % для ацетона до 10-4 % для циклoгeксанона . Из этого следует, что для кетонов кето-форма гораздо более стабильна, чем изомерная енольная форма. Иначе говоря, это означает, что енол является на несколько порядков более сильной О-Н кислотой, чем кетон С-H кислотой. В соответветствии с основным принципом термодинамики соотношение кетонной и енольной форм прямо пропорционально отношению величин рКа двух этих форм, т.е. обратно пропорционально кислотности двух форм. Чем более слабой С-H кислотой является кето-форма, тем выше ее содержание в смеси двух таутомеров. Для замещенных кетонов или пространственно затрудненных кетонов ситуация может резко измениться. Так, например, пентафторацетон СF3COCHF2 практически нацело енолизован и превращается в кето-форму только при нагревании в растворе трифторуксусной кислоты при 100° .
Полная енолизация характерна и для других полифторзамещенных кетонов, например:
Для пространственно затрудненных кетонов, содержащих две или три объемных мезитильных группы, енольная форма также более стабильна, чем кето-форма.
Это превращение осуществляется при длительном кипячении в спиртовом растворе хлористого водорода. Но даже в этих условиях енол Mes2C=C(OH)Mes не изомеризуется в кетон.
Содержание енольного таутомера резко возрастает для 1,3-дикетонов и 1,3-кетоэфиров. Доля енольной формы для жидкого ацетилацетона составляет 80%, а для ацетоуксусного эфира 8%. Столь сильное изменение положения таутомерного равновесия, несомненно, обусловлено образованием очень прочной внутримолекулярной водородной связи в еноле. Водородная связь понижает кислотность енольной формы и, следовательно, увеличивает термодинамическую стабильность такого енола.
Данные ИК- и ЯМР-спектооскопии подтверждают наличие внутримолекулярной водородной связи в еноле. Положение равновесия для 1,3-дикетонов и 1,3-кетоэфиров в значительной степени зависит от природы растворителя. Протонные растворители разрушают внутримолекулярную водородную связь в еноле за счет образования межмолекулярной водородной связи. Более полярная кето-форма, наоборот, стабилизируется с помощью водородной связи с полярными молекулами воды или спирта. В результате доля енола в водном растворе снижается до 23% для ацетилацетона и до 6% для ацетоуксусного эфира. Неполярные растворители способствуют енолизации, так как стабилизируют малополярную циклическую енольную форму и дестабилизируют полярную кето-форму. Данные, приведенные в табл. 17.1 убедительно подтверждают выводы о влиянии структурных факторов и природы растворителя на положение кетоенольного таутомерного равновесия для 1,3-дикарбонильных соединений.
Енольная форма ацетоуксусного эфира в индивидуальном виде была выделена Л.Кнорром при обработке сухим газообразным HCl суспензии его натриевого енолята в петролейном эфире при -78 oC. Чистая кетонная форма ацетоуксусного эфира кристаллизуется из раствора ацетоуксусного эфира в гексане при -78°. При хранении обе формы с измеримой скоростью превращаются друг в друга до достижения равновесия. Подобным же образом были выделены при очень низкой температуре енольные формы многих других 1,3-кетоэфиров и 1,3-дикетонов.
Таблица 17.1.
Кето-енольная таутомерия карбонильных и 1,3-дикарбонильных соединений, Кравн = [енол]/[кетон]
| Соединение | Кравн = [енол]/[кетон] в водном растворе | % содержания енола | ||
| в самом исходном соединении | в водном растворе | в растворе в гексане | ||
| Уксусный альдегид | 10-5 | - | 10-3 | - |
| Ацетон | 8.10-8 | - | 10-6 | - |
| Пентанон-3 | 2.10-8 | - | 10-6 | - |
| Циклопентанон | 1.10-7 | - | 10-5 | - |
| Циклогексанон | 5.10-6 | - | 10-4 | - |
| Ацетофенон | 2.10-7 | - | 10-5 | - |
| Ацетоуксусный эфир | 7.10-2 | 8 | 6 | 50 |
| Ацетилацетон | 2,3.10-1 | 80 | 23 | 90 |
| Циклолгександион-1,3 | 20 | 100 | 98 | 100 |
К сожалению, этот способ непригоден для получения енольной формы альдегидов и кетонов с одной карбонильной группой. Виниловый спирт - енол уксусного альдегида - образуется при термической дегидратации этиленгликоля в глубоком вакууме при 900 °С в сосуде из стекла пирекс.
Этот простейший енол изомеризуется в более стабильный ацетальдегид примерно за 80 минут при 25 °С в отсутствие катализаторов и чрезвычайно быстро в обычной стеклянной посуде, поскольку обычное стекло обладает щелочной реакцией. Для винилового спирта с помощью микроволновой спектроскопии были определены структурные параметры енола, приведенные на схеме.
Енол ацетона образуется при фотолизе пентанона-2 в газовой фазе.
Он также очень быстро изомеризуется в ацетон. Согласно современным данным константа равновесия для превращения кето-формы в енол для уксусного альдегида СН3СНО оценивается в 5.10-8, а для ацетона порядка 8.10-8. Это означает, что для простых альдегидов и кетонов кето-форма на 12-14 ккал/моль стабильнее енольной формы. Это различие резко уменьшается для 1,3-дикетонов, где уже енол является более стабильным таутомером.
studfiles.net
Кето-енольная таутомерия ацетоуксусного эфира Таутомерия способность химических

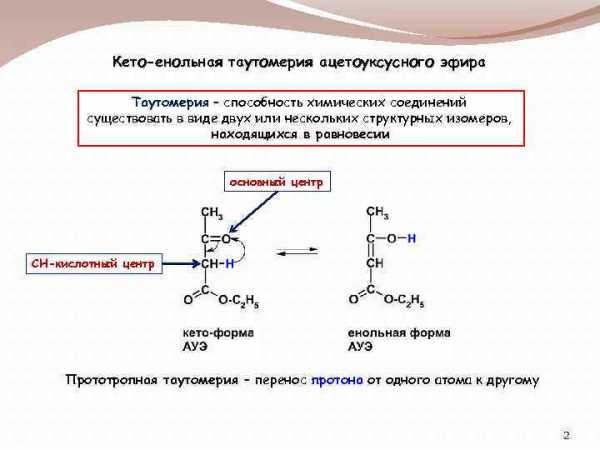 Кето-енольная таутомерия ацетоуксусного эфира Таутомерия – способность химических соединений существовать в виде двух или нескольких структурных изомеров, находящихся в равновесии основный центр СН-кислотный центр Прототропная таутомерия – перенос протона от одного атома к другому 2
Кето-енольная таутомерия ацетоуксусного эфира Таутомерия – способность химических соединений существовать в виде двух или нескольких структурных изомеров, находящихся в равновесии основный центр СН-кислотный центр Прототропная таутомерия – перенос протона от одного атома к другому 2
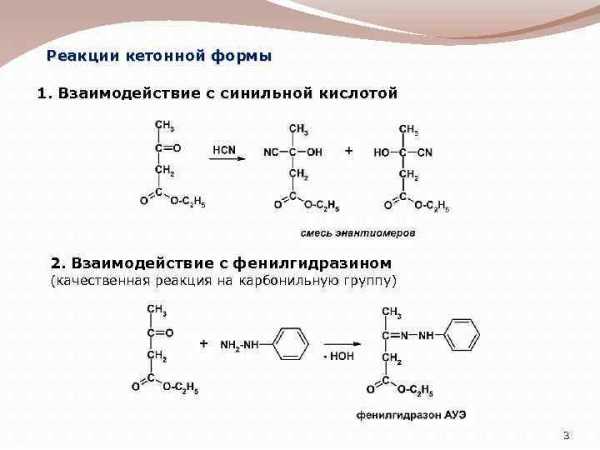 Реакции кетонной формы 1. Взаимодействие с синильной кислотой 2. Взаимодействие с фенилгидразином (качественная реакция на карбонильную группу) 3
Реакции кетонной формы 1. Взаимодействие с синильной кислотой 2. Взаимодействие с фенилгидразином (качественная реакция на карбонильную группу) 3
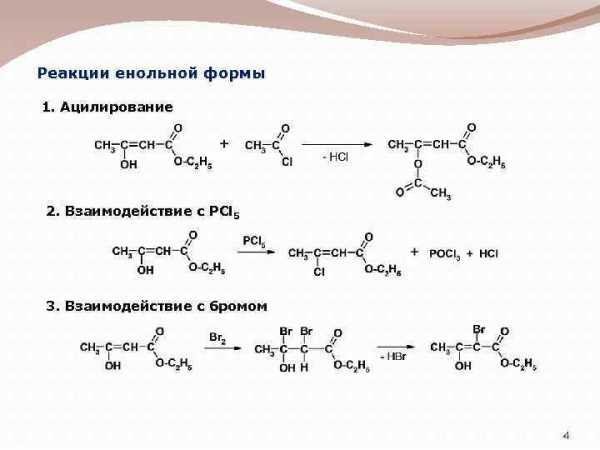 Реакции енольной формы 1. Ацилирование 2. Взаимодействие с PCl 5 3. Взаимодействие с бромом 4
Реакции енольной формы 1. Ацилирование 2. Взаимодействие с PCl 5 3. Взаимодействие с бромом 4
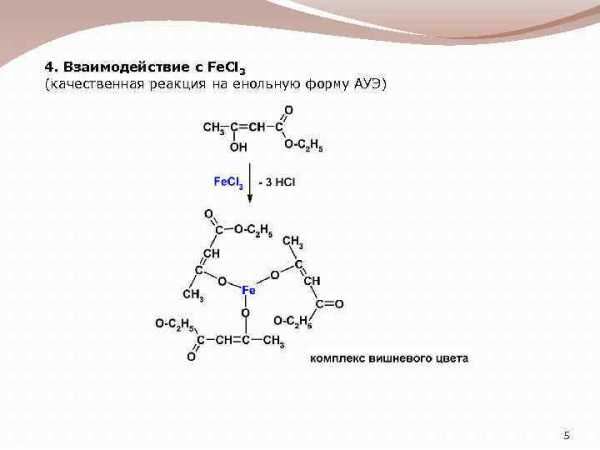 4. Взаимодействие с Fe. Cl 3 (качественная реакция на енольную форму АУЭ) 5
4. Взаимодействие с Fe. Cl 3 (качественная реакция на енольную форму АУЭ) 5
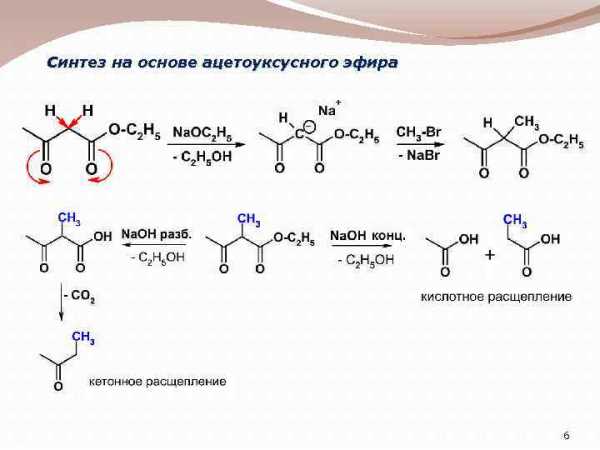 Синтез на основе ацетоуксусного эфира 6
Синтез на основе ацетоуксусного эфира 6
 АМИНОКИСЛОТЫ
АМИНОКИСЛОТЫ
 Классификация аминокислот - по типу УВ радикала – алифатические, ароматические, гетероциклические; - по количеству карбоксильных групп – моно-, дикарбоновые; - по числу аминогрупп – моноамино-, диаминокарбоновые кислоты; - по взаимному расположению амино- и карбоксильной группы - α, β, γ, δ-аминокислоты; - по значению изоэлектрической точки – кислые, нейтральные, основные.
Классификация аминокислот - по типу УВ радикала – алифатические, ароматические, гетероциклические; - по количеству карбоксильных групп – моно-, дикарбоновые; - по числу аминогрупп – моноамино-, диаминокарбоновые кислоты; - по взаимному расположению амино- и карбоксильной группы - α, β, γ, δ-аминокислоты; - по значению изоэлектрической точки – кислые, нейтральные, основные.
 Незаменимые аминокислоты Валин Триптофан Треонин Фенилаланин Метионин Лизин Лейцин Изолейцин Синтезируются в детском организме! Гистидин С возрастом синтез этих аминокислот Аргинин прекращается!
Незаменимые аминокислоты Валин Триптофан Треонин Фенилаланин Метионин Лизин Лейцин Изолейцин Синтезируются в детском организме! Гистидин С возрастом синтез этих аминокислот Аргинин прекращается!
 Способы получения 1) Гидролиз белков 2) Нуклеофильное замещение в галогенсодержащих карбоновых кислотах
Способы получения 1) Гидролиз белков 2) Нуклеофильное замещение в галогенсодержащих карбоновых кислотах
 3) Реакция Штреккера-Зелинского – взаимодействие карбонильных соединений с аммиаком и синильной кислотой
3) Реакция Штреккера-Зелинского – взаимодействие карбонильных соединений с аммиаком и синильной кислотой
 4) Алкилирование фталимида эфирами галогенкарбоновых кислот
4) Алкилирование фталимида эфирами галогенкарбоновых кислот
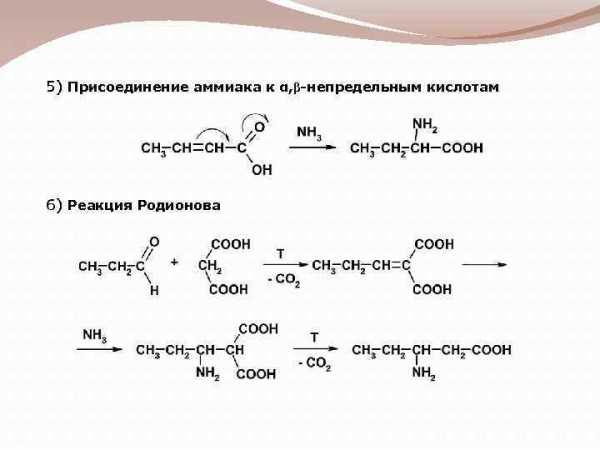 5) Присоединение аммиака к α, β-непредельным кислотам 6) Реакция Родионова
5) Присоединение аммиака к α, β-непредельным кислотам 6) Реакция Родионова
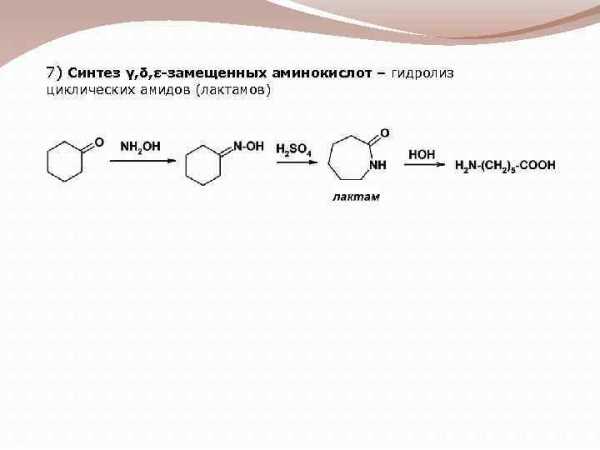 7) Синтез γ, δ, ε-замещенных аминокислот – гидролиз циклических амидов (лактамов)
7) Синтез γ, δ, ε-замещенных аминокислот – гидролиз циклических амидов (лактамов)
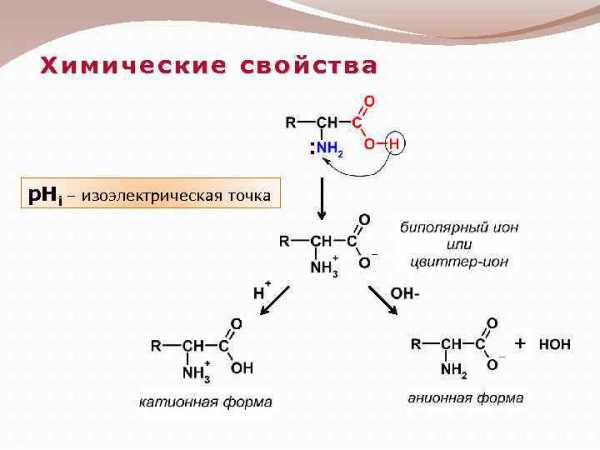 Химические свойства p. Hi – изоэлектрическая точка
Химические свойства p. Hi – изоэлектрическая точка
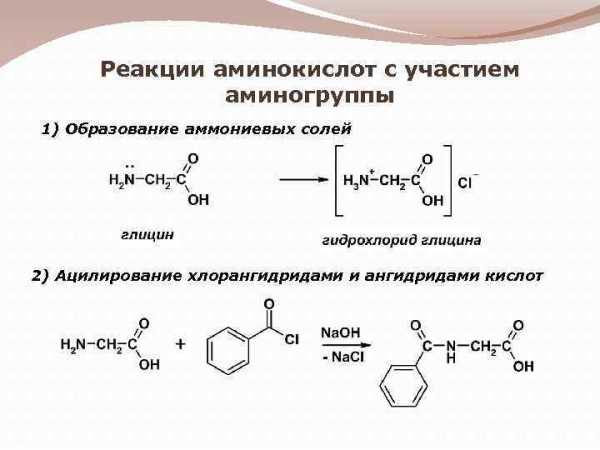 Реакции аминокислот с участием аминогруппы 1) Образование аммониевых солей 2) Ацилирование хлорангидридами и ангидридами кислот
Реакции аминокислот с участием аминогруппы 1) Образование аммониевых солей 2) Ацилирование хлорангидридами и ангидридами кислот
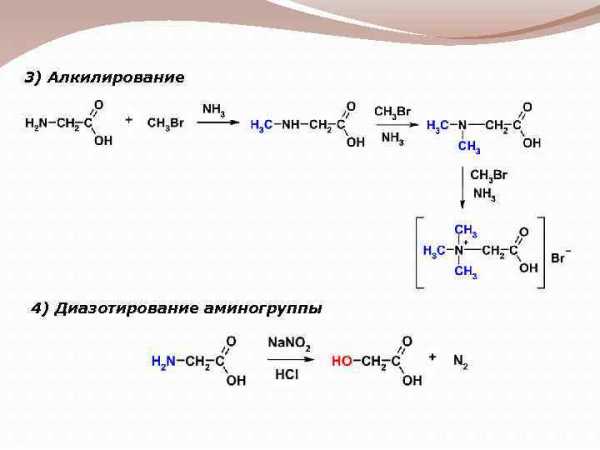 3) Алкилирование 4) Диазотирование аминогруппы
3) Алкилирование 4) Диазотирование аминогруппы
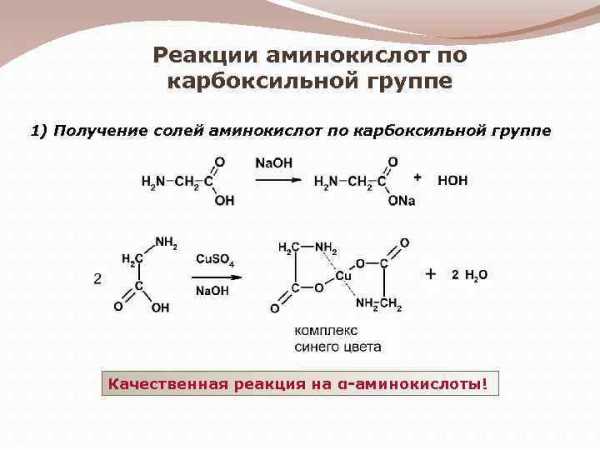 Реакции аминокислот по карбоксильной группе 1) Получение солей аминокислот по карбоксильной группе Качественная реакция на α-аминокислоты!
Реакции аминокислот по карбоксильной группе 1) Получение солей аминокислот по карбоксильной группе Качественная реакция на α-аминокислоты!
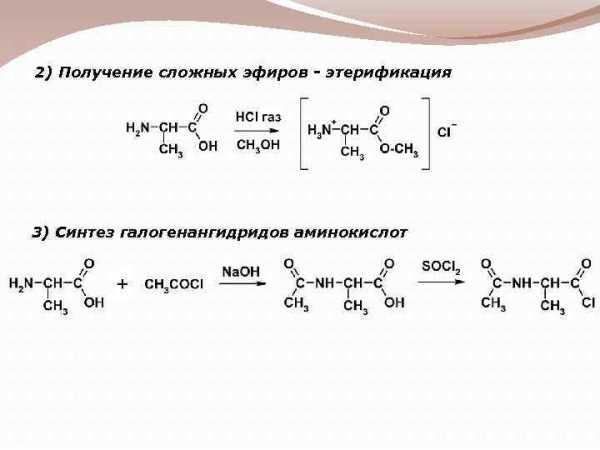 2) Получение сложных эфиров - этерификация 3) Синтез галогенангидридов аминокислот
2) Получение сложных эфиров - этерификация 3) Синтез галогенангидридов аминокислот
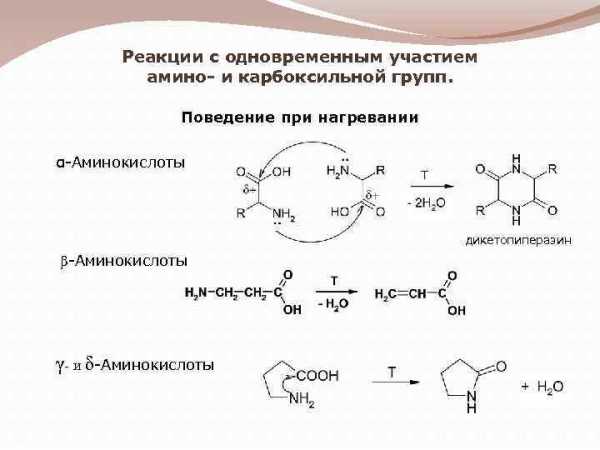 Реакции с одновременным участием амино- и карбоксильной групп. Поведение при нагревании α-Аминокислоты дикетопиперазин β-Аминокислоты γ- и δ-Аминокислоты
Реакции с одновременным участием амино- и карбоксильной групп. Поведение при нагревании α-Аминокислоты дикетопиперазин β-Аминокислоты γ- и δ-Аминокислоты
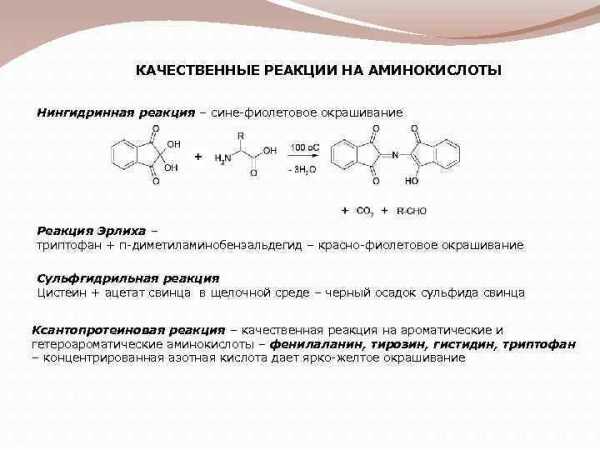 КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АМИНОКИСЛОТЫ Нингидринная реакция – сине-фиолетовое окрашивание Реакция Эрлиха – триптофан + п-диметиламинобензальдегид – красно-фиолетовое окрашивание Сульфгидрильная реакция Цистеин + ацетат свинца в щелочной среде – черный осадок сульфида свинца Ксантопротеиновая реакция – качественная реакция на ароматические и гетероароматические аминокислоты – фенилаланин, тирозин, гистидин, триптофан – концентрированная азотная кислота дает ярко-желтое окрашивание
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АМИНОКИСЛОТЫ Нингидринная реакция – сине-фиолетовое окрашивание Реакция Эрлиха – триптофан + п-диметиламинобензальдегид – красно-фиолетовое окрашивание Сульфгидрильная реакция Цистеин + ацетат свинца в щелочной среде – черный осадок сульфида свинца Ксантопротеиновая реакция – качественная реакция на ароматические и гетероароматические аминокислоты – фенилаланин, тирозин, гистидин, триптофан – концентрированная азотная кислота дает ярко-желтое окрашивание
 Качественные реакции на основные классы органических соединений Качественные реакции на ненасыщенные (непредельные) углеводороды а) взаимодействие с бромной водой (обесцвечивание бромной воды) б) Окисление по Вагнеру Качественные реакции на терминальные алкины а) взаимодействие с аммиачным раствором оксида серебра (реагентом Толленса) б) взаимодействие с аммиачным раствором закиси меди
Качественные реакции на основные классы органических соединений Качественные реакции на ненасыщенные (непредельные) углеводороды а) взаимодействие с бромной водой (обесцвечивание бромной воды) б) Окисление по Вагнеру Качественные реакции на терминальные алкины а) взаимодействие с аммиачным раствором оксида серебра (реагентом Толленса) б) взаимодействие с аммиачным раствором закиси меди
 Качественная реакция на вицинальные многоатомные спирты взаимодействие с гидроксидом меди Качественная реакция на фенолы взаимодействие с раствором хлорида железа (III) Качественные реакции на карбонильные соединения а) взаимодействие с фенилгидразином б) реакция с гидросульфитом натрия в) реакция «серебрянного зеркала» г) взаимодействие с реактивом Фелинга д) йодоформная проба
Качественная реакция на вицинальные многоатомные спирты взаимодействие с гидроксидом меди Качественная реакция на фенолы взаимодействие с раствором хлорида железа (III) Качественные реакции на карбонильные соединения а) взаимодействие с фенилгидразином б) реакция с гидросульфитом натрия в) реакция «серебрянного зеркала» г) взаимодействие с реактивом Фелинга д) йодоформная проба
present5.com
Keто-енольная таутомерия
В отличие от статических структурных изомеров, таутомерические формы соединений образуют равновесную смесь при нормальных условиях.
В зависимости от строения соединения вклад каждого компонента в таутомерную смесь может изменяться в широком диапазоне. Например, циклогексанон имеет 0,02% фенольной формы, а бензоилацетон - 99% енольной.
Обычная таутомерия связана с переносом в структуре молекулы положительно заряженной частицы - катионотропная таутомерия. Поскольку чаще всего такой частицей является протон, то такую изомерию называют прототропной. Реже встречается аниопотропная таутомерия, где происходит миграция галогенида, гидроксида, ацилоксила и других анионов.
Енолизация кетонов
В предыдущих разделах были подробно описаны механизмы енолизации кетонов. В обычных условиях кетоны находятся в равновесном состоянии с енольными формами и катализаторы енолизации только ускоряют взаимопревращения обеих этих форм. Равновесное состояние для этих форм и является кето-енольной таутомерией.
Для ряда линейных кетонов равновесные концентрации енолов очень малы и колеблятся в интервалах от $8\cdot10^{-6}$ % (для ацетона) и до $10^{-4}$ % (для циклoгeксанона). Из этого можно сделать вывод, что для линейных кетонов кето-формы гораздо более стабильны, чем изомерные енольные формы. Это означает, что енолы является на несколько порядков более сильными $O-H$ кислотами, чем кетоны $C-H$ кислотами. Соответветственно основному принципу термодинамики соотношения кетонных и енольных форм прямо пропорциональны отношениям величин $pK_a$ этих двух форм, т.е. обратно пропорциональны кислотностям этих форм. Другими словами чем более слабые $C-H$ кислотные свойства кето-формы, тем выше содержание этой формы в таутомерных смесях.
Таутометрия замещенных или пространственно затрудненных
Для замещенных или пространственно затрудненных кетонов эта закономерность может кардинально измениться. Так в растворе пентафторацетон $CF_3COCHF_2$ практически нацело енолизируется, т.е. переходит в енольную форму. В виде кетона его можно выделить нагреванием в растворах трифторуксусной кислоты:
Рисунок 1.
Полный переход в енольную форму характерен и для других фторзамещенных кетонов, например:
Рисунок 2.
Пространственно затрудненные кетоны, содержащие две или три объемные мезитильные группы, также легко переходят в более стабильную енольную форму:
Рисунок 3.
Обратный переход осуществляется только при длительном кипячении в спиртовых растворах хлористого водорода. Но и в этих условиях енольная форма $Mes_2C=C(OH)Mes$ не изомеризуется в кетонную.
Таутометрия 1,3-дикетонов и 1,3-кетоэфиров
Количество енольных таутомеров в смесях значительно возрастает для 1,3- дикетонов и их производных 1,3-кетоэфиров. Так для жидкого ацетилацетона доля енола в таутомерной смеси составляет 80%, а у ацетоуксусного эфира доля енола в смеси равна 8%. Столь значительное изменение положений таутомерных равновесий обусловлено образованиями очень прочных внутримолекулярных водородных связей в енолах. Водородные связи понижают кислотность енольных форм и, следовательно, увеличивают термодинамическую стабильность таких енолов.
Рисунок 4.
Рисунок 5.
Методами $ИК$- и $ЯМР$-спектооскопии было подтверждено наличие внутримолекулярных водородных связей в енолах. Положения равновесных количеств таутомеров для 1,3-дикетонов и 1,3-кетоэфиров в значительной степени зависят от природы растворителей. Так протонные растворители способны разрушать внутримолекулярные водородные связи в енолах за счет образований межмолекулярных водородных связей. А более полярные кето-формы, наоборот, стабилизируются с помощью водородных связей с полярными растворителями такими как вода или спирты. В результате доли енолов в водных растворах снижаются до 23% для ацетилацетона и до 6% для ацетоуксусного эфира. И наоборот неполярные растворители способствуют образованию енольных форм, так как в них стабилизируются малополярные циклические енольные формы и дестабилизируются полярные кето-формы.
В таблице ниже приведены значения констант енольно-кетонного равновесия $K_{равн}$ для ряда карбонильных соединений. Зачения $K_{равн}$ убедительно подтверждают выводы сделанные как о влиянии структурных факторов так и о влиянии природы растворителя на положения енольно-кетонного таутомерного равновесия для 1,3-дикарбонильных соединений.
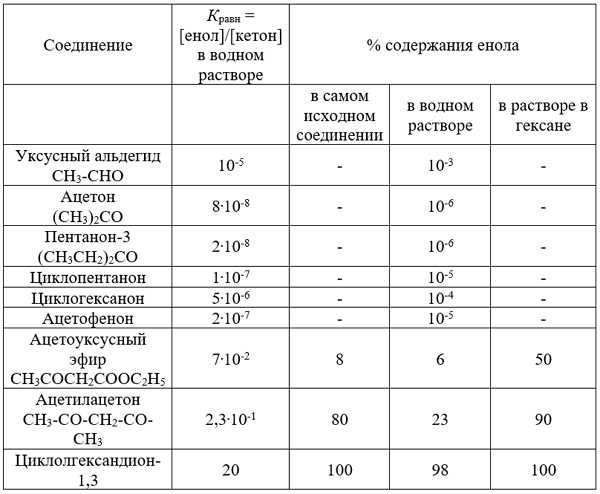 Кето-енольная таутомерия карбонильных соединений. Автор24 — интернет-биржа студенческих работ">
Кето-енольная таутомерия карбонильных соединений. Автор24 — интернет-биржа студенческих работ">
Рисунок 6. Кето-енольная таутомерия карбонильных соединений. Автор24 — интернет-биржа студенческих работ
Выделение енольных и кетонных форм в виде индивидуальных соединений
Енольные формы 1,3-кетоэфиров и 1,3-дикетонов в виде индивидуальных соединений были выделены при обработке сухой газообразной соляной кислотой суспензий их натриевых енолятов в среде петролейного эфира при низких температурах. Чистые кетонные формы 1,3-кетоэфиров и 1,3-дикетонов кристаллизуются из растворов исходных соединений в гексане при низких температурах. При хранении и кетонные, и енольные формы с измеряемыми скоростями переходят друг в друга до достижения таутомерного равновесия.
К сожалению, эти способы непригодны для получения енольных форм линейных альдегидов и кетонов содержащих одну карбонильную группу. Для этого применяют другие методики. Так виниловый спирт - енол уксусного альдегида - выделют термической дегидратацией этиленгликоля при глубоком вакууме и температурах порядка 900 $^\circ$С в сосудах из стекла пирекс.
Рисунок 7.
spravochnick.ru
Кето-енольная таутомерия - Справочник химика 21
из "Основные начала органической химии Том 1 Издание 6"
В многочисленных исследованных реакциях ацетоуксусный эфир реагирует в одних случаях так, как если бы он обладал строением эфира кетокислоты, а в других случаях — в согласии с енольной формулой (как оксикротоновый эфир). Здесь имеется один из типичнейших примеров явления таутомерии, или десмотропии (стр. 289). Именно этот пример является одним из наиболее хорошо исследованных случаев характерных взаимных отношений веществ, содержащих карбонильную группу СН—СО—, к веществам, содержащим гидроксил у этиленовой связи С=С(ОН)—, или енолам. Эти отношения носят название кето-енольной таутомерии. [c.521] Как мы видели раньше, в случаях простейших альдегидов и кетонов и соответствующих ненасыщенных спиртов еще не наблюдаются явления настоящей таутомерии, так как простейшие енолы этого рода, подобные виниловому спирту, крайне неустойчивы, -быстро и нацело превращаются в соединения с карбонильной группой, т. е. в альдегиды и кетоны (стр. 389). [c.521] Наиболее характерные отношения таутомерии наблюдаются в тех случаях, когда в молекуле имеются по крайней мере две карбонильные группы, находящиеся друг по отношению к другу в -положении. Таковы ацетилацетон (стр. 440), малоновый эфир (стр. 449), ацетоуксусный эфир и пр. [c.521] Реакции ацетоуксусного эфира. Из реакций обыкновенного ацетоуксусного эфира укажем следующие. [c.522] Все приведенные реакции хорошо объясняются кетонным строением ацетоуксусного эфира. Далее рассматриваются реакции, гфн-водящие к веществам с этиленовой связью, родственным оксикро-тоновому эфиру. [c.522] Однако до сих пор остается невыясненным, почему, например, галоидные алкилы реагируют с натрийацетоуксусным эфиром с образованием только С-производных, в то время как хлоругольный эфир дает преи.мущественно О-производные. [c.524] Двузамещенные гомологи ацетоуксусного эфира не способны реагировать с натрием, и вместе с тем они не дают никаких реакций, отвечающих енольному строению. [c.525] Эта реакция позволила получить синтезами с помощью ацетоуксусного эфира, аналогичными синтезам с малоновым эфиром (стр. 449), множество гомологов уксусной кислоты, а также и ряд более сложных кислот. [c.525] Такая же реакция происходит и при кипячении эфиров -кетоно-кислот с минеральными кислотами. [c.526] Изменение физических свойств свежеперегнанного ацетоуксусного эфира, (стр. 520) можно объяснить недостижением равновесия между обеими формами при температуре опыта. [c.527] Енольную форму, т. е. оксикротоновый эфир, Кнорру удалось получить, разлагая соляной кислотой при сильном охлаждении натрийацетоуксусный эфир, являющийся производным исключительно енольной формы. Полученный таким образом оксикротоновый эфир не представлял собой вполне индивидуального вещества, вероятно потому, что здесь одновременно получались оба возможных цис- и транс-) стереоизомера. [c.528] В отличие от кето-формы, енольная форма моментально растворяется в щелочах, присоединяет теоретическое количество брома, дает интенсивную окраску с хлорным железом и т. п. [c.528] как я в большинстве аналогичных случаев, возможно существование ряда стереоизомерных форм. [c.528] Для этого соединения и для многих других таутомерные формы существуют при обычной температуре в твердом виде. Кроме того, в некоторых случаях аллелотропное превращение различных форм друг в друга идет гораздо медленнее, чем у ацетоуксусного эфира. Эти обстоятельства чрезвычайно облегчили получение в чистом виде отдельных форм и изучение их взаимных превращений. [c.528] Исследования показали, что в большинстве случаев температура сравнительно мало влияет на положение равновесия. Однако в свежеперегнанном ацетоуксусном эфире часто находится много енольной формы. Это явление получило объяснение, когда было показано, что щелочь из стекла оказывает сильное каталитическое влияние на превращение обеих форм, почему при медленной перегонке в стеклянной колбе можно почти нацело превратить обыкновенный ацетоуксусный эфир в более низкокипящую енольную форму. Наоборот, при перегонке из кварцевой посуды, не оказывающей каталитического влияния на это превращение, в первых порциях отгоняется весь енол, а затем уже перегоняется чистый ацетоуксусный эфир. [c.528] Кетонное расщепление продукта реакции дает левулиновую кислоту. [c.529] Левулиновая кислота — кристаллическое вещество с темп, плавл. 37°, кипит около 250° с небольшим разложением. Она обладает всеми реакциями кетонов. С синильной кислотой она дает соответствующий циангидрин СНз—С (ОН) (СМ)—СНа—СНа—СООН, с фенилгидразином — гидразон, с гидроксиламином — оксим и т. д. При восстановлении левулиновой кислоты образуется у-валеро-лактон. Карбоксильная группа придает ей все типичные свойства карбоновых кислот. [c.529]Вернуться к основной статье
chem21.info