Элементный анализ органических веществ. Качественная реакция на простые эфиры
Качественные реакции органической химии | Дистанционные уроки
09-Дек-2012 | комментариев 10 | Лолита Окольнова
В качественном анализе используют легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Реакции должны быть как можно более селективны и высокочувствительны.
Это означает, что качественные реакции — это реакции с ощутимым эффектом -цвет, запах, изменение состояния вещества. «Селективность» — означает, что желательно, чтобы такая реакция на данный класс веществ или на данное вещество была уникальна. Высокая чувствительность — даже очень небольшое количество вещества должно проявляться в такой реакции.
С уникальностью в органической химии немного проблематично, но тем не менее, есть достаточно много реакций для определения того или иного вещества.
Итак, классы органических соединений и соответствующие им качественные реакции:
Как вы видите, все вещества, имеющие кратные связи (кратные=двойные и тройные), обесцвечивают бромную воду. Многие из них изменяют окраску раствора перманганата калия. Поэтому эти вещества надо разделять по их индивидуальным, характерным только для них качественным реакциям.
Здесь перечислены самые основные качественные реакции органической химии. Если говорить о высокомолекулярных соединениях — белках, жирах, углеводах, то для них качественные реакции определяются функциональными группами, входящими в состав. Зная функциональную группу, вы легко сможете подобрать реактив, т.к. в таблице они разобраны именно по классам.
- в ЕГЭ это вопрос B6— Качественные реакции органических соединений
Еще на эту тему:
Обсуждение: "Качественные реакции органической химии"
(Правила комментирования)distant-lessons.ru
КАЧЕСТВЕННЫЕ РЕАКЦИИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
| Соединение | Реактив | Наблюдаемая реакция |
| Алканы | Пламя | Обычно определяют путем исключения. Низшие алканы горят голубоватым пламенем |
| Алкены С=С | 1) Бромная вода 2) р-р КМп04 3) Горение | Обесцвечивание раствора. Обесцвечивание раствора, выпадение бурого осадка Мn02Горят-слегка желтоватым пламенем (частицы углерода). |
| Бензол | Горение | Обычно определяют путем исключения. Горит коптящим пламенем. |
| Фенол | 1) Бромная вода 2) р-р Na2СО3 3) FeCI3 | Обесцвечивание, выпадение белого осадка трибромфенола Выделение углекислого газа. Фиолетовое окрашивание. |
| Спирты | 1) Na 2) Горение 3) Черная горячая прокаленная Сu-проволока | Выделение водорода. Горят светлым голубоватым пламенем. Восстановление красной окраски у прокаленной горячей медной проволоки. |
| Многоатомные спирты | Сu(ОН)2 + NaOH | Синее окрашивание — образование глицератов и др. |
| Амины | 1) Лакмус 2) HHal | В водном растворе — синее окрашивание. Образуют соли с галогеноводородами — после выпаривания твердый осадок. |
| Анилин | 1) Бромная вода 2) HHal | Обесцвечивание бромной воды, выпадение осадка триброманилина. После упаривания твердый осадок — соль гидрогалогенида анилина. |
| Альдегиды | 1) Ag20 2) Сu(ОН)2 | Реакция серебряного зеркала Выпадение красного осадка Cu20 |
| Карбоновые кислоты | Лакмус | Красное окрашивание Муравьиная — реакция серебряного зеркала Олеиновая — обесцвечивание бромной воды |
| Крахмал | Раствор l2 в KI или спиртовой раствор иода | Синее окрашивание |
| Белки | конц. HNO3 | Желтое окрашивание, при добавлении щелочного раствора — оранжевое |
1. Качественная реакция на алканы. Определить, что какое-то вещество в смеси или в чистом виде алкан, несложно. Для этого газ либо поджигают — горение алканов сопровождается синим пламенем, либо пропускают через раствор перманганата калия. Алканы не окисляются перманганатом калия на холоду, вследствие этого раствор не будет изменять окраску.
2. Качественная реакция на алкены. Чтобы убедиться в наличии алкена, нужно пропустить его в раствор перманганата калия (реакция Вагнера). В ходе реакции раствор обесцветится, выпадает бурый диоксид марганца MnO2 (реакция на примере этилена):
3C2h5 + 2KMnO4 + 4h3O ——> 3Ch3OH-Ch3OH + 2KOH + 2MnO2
Так же, алкены обесцвечивают бромную воду:
C2h5 + Br2 ——> C2h5Br2
Бромная вода обесцвечивается, образуется дибромпроизводное.
3. Качественная реакция на алкины. Алкины можно выявить и по реакции Вагнера или с помощью бромной воды:
3C2h3 + 8KMnO4 ——> 3KOOC-COOK + 8MnO2 + 2KOH + 2h3O
C2h3 + 2Br2 —-> C2h3Br4
Алкины с тройной связью у крайнего атома углерода реагируют с аммиачным раствором оксида серебра (гидроксид диаминсеребра (I)) (реактив Толленса):
C2h3 + 2[Ag(Nh4)2]OH ——-> Ag2C2 + 4Nh4 + 2h3O
Получившийся ацетиленид серебра (I) выпадает в осадок.Алкины, у которых тройная связь в середине (R-C-=C-R) в эту реакцию не вступают.Такая способность алкинов — замещать протон на атом металла, подобно кислотам — обусловлено тем, что атом углерода находится в состоянии sp-гибридизации и электроотрицательность атома углерода в таком состоянии такая же, как у азота. Вследствие этого, атом углерода сильнее обогощается электронной плотностью и протон становится подвижным.
4. Качественная реакция на альдегиды. Одна из самых интересных качественных реакций в органической химии — на альдегиды, предназначена исключительно для выявления соединений, содержащих альдегидную группу. К альдегиду приливают аммиачный раствор оксида серебра, реакция идет при нагревании:
Ch4-CHO + 2[Ag(Nh4)2]OH —t—> Ch4-COOH + 2Ag + 4Nh4 + h3O
Если опыт проведен грамотно, то выделяющееся серебро покрывает колбу ровным слоем, создавая эффект зеркала. Именно поэтому реакция называется реакцией серебряного зеркала.Примечание: реакцией серебряного зеркала также можно выявить метановую (муравьиную) кислоту HCOOH. При чем тут кислота, если мы говорим про альдегиды? Все просто: муравьиная кислота — единственная из карбоновых кислот, содержащая одновременно альдегидную и карбоксильную группы:
В ходе реакции метановая кислота окисляется до угольной, которая разлагается на углекислый газ и воду:
HCOOH + 2[Ag(Nh4)2]OH —t—> CO2 + 2h3O + 4Nh4 + 2Ag
Помимо реакции серебряного зеркала существует также реакция с гидроксидом меди (II) Cu(OH)2. Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
CuSO4 + 2NaOH ——> Na2SO4 + Cu(OH)2
Ch4-CHO + 2Cu(OH)2 —t—> Ch4-COOH + Cu2O + 2h3O
Выпадает оксид меди (I) Cu2O — осадок красного цвета.
Еще один метод определения альдегидов — реакция с щелочным раствором тетраиодомеркурата (II) калия, известный нам из предыдущей статьи как реактив Несслера:
Ch4-CHO + K2[HgI4] + 3KOH ——> Ch4-COOK + Hg + 4KI + 2h3O
При добавлении альдегида к раствору фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
5. Качественные реакции на спирты. Спирты по количеству гидроксильных групп бывают одно-, двух-, многоатомными. Для одно- и многоатомных реакции различны.
Качественные реакции на одноатомные спирты:Простейшая качественная реакция на спирты — окисление спирта оксидом меди. Для этого пары спирта пропускают над раскаленным оксидом меди. Затем полученный альдегид улавливают фуксинсернистой кислотой, раствор становится фиолетовым:
Ch4-Ch3-OH + CuO —t—> Ch4-CHO + Cu + h3O
Спирты идентифицируются пробой Лукаса — конц. раствор соляной кислоты и хлорида цинка. При пропускании вторичного или третичного спирта в такой раствор образуется маслянистый осадок соответствующего алкилхлорида:
Ch4-CHOH-Ch4 + HCl —ZnCl2—> Ch4-CHCl-Ch4 + h3O
Первичные спирты в реакцию не вступают.
Еще одним известным методом является иодоформная проба:
Ch4-Ch3-OH + 4I2 + 6NaOH ——> CHI3? + 5NaI + HCOONa + 5h3O
Качественные реакции на многоатомные спирты.Наиболее известная качественная реакция на многоатомные спирты — взаимодействие их с гидроксидом меди (II). Гидроксид растворяется, образуется хелатный комплекс темно-синего цвета. Обратите внимание на то, что в отличии от альдегидов многоатомные спирты реагируют с гидроксидом меди (II) без нагревания. К примеру, при приливании глицерина образуется глицерат меди (II):
6. Качественные реакции на карбоновые кислоты. На карбоновые кислоты обычно подчеркивают образование цветных осадков с тяжелыми металлами. Но наиболее осуществимая качественная реакция на метановую кислоту HCOOH. При добавлении концентрированной серной кислоты h3SO4 к раствору муравьиной кислоты образуется угарный газ и вода:
HCOOH —h3SO4—> CO? + h3O
Угарный газ можно поджечь. Горит синем пламенем:
2CO + O2 —t—> 2CO2
Из многоосновных кислот рассмотрим качественную реакцию на щавелевую h3C2O4 (HOOC-COOH). При добавлении к раствору щавелевой кислоты раствор соли меди (II) выпадет осадок оксалата меди (II):
Cu2+ + C2O42- ——> CuC2O4?
Щавелевая кислота также, как и муравьиная, разлагается концентрированной серной кислотой:
h3C2O4 —-h3SO4—> CO + CO2 + h3O
7. Качественные реакции на амины. На амины качественных реакций нет (за исключением анилина). Можно доказать наличие амина окрашиванием лакмуса в синий цвет. Если же амины нельзя выявить, то можно различить первичный амин от вторичного путем взаимодействия с азотистой кислотой HNO2. Для начала нужно ее приготовить, а затем добавить амин:
NaNO2 + HCl ——> NaCl + HNO2
Первичные дают азот N2:
Ch4-Nh3 + HNO2 ——> Ch4-OH + N2? + h3O
Вторичные — алкилнитрозоамины — вещества с резким запахом (на примере диметилнитрозоамина):
Ch4-NH-Ch4 + HNO2 ——> Ch4-N(NO)-Ch4 + h3O
Третичные амины в мягких условиях с HNO2 не реагируют.
Анилин образует осадок при добавлении бромной воды:
C6H5Nh3 + 3Br2 ——> C6h3Nh3(Br)3? + 3HBr
Анилин также можно обнаружить по сиреневой окраске при добавлении хлорной извести.
8. Качественные реакции на фенол. Фенол лучше всего обнаруживает хлорид железа (III) — образуется фиолетовое окрашивание раствора. Это лучший метод обнаружения фенола, т.к. реакция очень чувствительна.
Также фенол наряду с анилином дает осадок желтоватого цвета при пропускании в водный раствор брома — 2, 4, 6 — трибромфенол:
C6H5OH + 3Br2 ——> C6h3OH(Br)3? + 3HBr
Фенолы дают фенол-альдегидные смолы при реакции с альдегидом в кислой среде. При этом образуются мягкие пористые массы фенол-альдегидных смол (реакция поликонденсации).
9. Качественная реакция на алкилхлориды. Вещества, содержащие хлор, могут окрашивать пламя в зеленый цвет. Для этого нужно обмакнуть медную проволоку в алкилхлориде и поднести к пламени (проба Бельштейна).
10. Качественная реакция на углеводы. Большинство углеводов имеют альдегидные и гидроксильные группы, поэтому для них характерны все реакции альдегидов и многоатомных спиртов.Существует способ, который помогает различить глюкозу от фруктозы — проба Селиванова. Для того, чтобы различить эти углеводы, к ним приливают смесь резорцина и соляной кислоты. Реагирует со смесью фруктоза, при этом раствор окрашивается в малиновый цвет.
Крахмал в присутствии иода окрашивается в темно-синий цвет. При нагревании окраска исчезает, при охлаждении появляется вновь.
11. Качественная реакция на белки. Белки выявляются в основном на реакциях, основанных на окрасках.Ксантопротеиновая реакция. Данная реакция обнаруживает ароматические аминокислоты, входящие в белки (на примере тирозина):
(OH)C6h5CH(Nh3)COOH + HNO3 —-h3SO4——> (OH)C6h4(NO2)CH(Nh3)COOH? + h3O — выпадает осадок желтого цвета.
(OH)C6h4(NO2)CH(Nh3)COOH + 2NaOH ——-> (ONa)C6h4(NO2)CH(Nh3)COONa + h3O — раствор становится оранжевым.
Обнаружение серосодержащих аминокислот:
Белок + (Ch4COO)2Pb —NaOH—> PbS (осадок черного цвета).
Биуретовая реакция для обнаружения пептидной связи (CO-NH):
Белок + CuSO4 + NaOH ——> красно-фиолетовое окрашивание.
Спецефический запах при горении:Белок —-обжиг—-> запах паленой шерсти.
mykonspekts.ru
| Класс органических соединений | Качественные реакции |
| Алканы | У алканов нет качественных реакций.Их определяют методом исключения |
| Алкены | 1. Обесцвечивание бромной воды: 2. Изменение окраски раствора перманганата калия: 3Сh3=Ch3 + 2KMnO4 + 4h3O → 3C2h5(OH)2 + 2MnO2 + 2KOH |
| Циклоалканы | Обесцвечивание бромной воды: |
| Алкины | 1. Обесцвечивание бромной воды,2. Образование ацетиленидов серебра и меди: C2h3 → HOOC-COOH |
| Алкадиены | Т.к. алкадиены содержат 2 двойные связи, то они так же как и алкены, обесцвечивают бромную воду |
| Арены | 1. Обесцвечивание бромной воды 2. реакция с аммиачным раствором цианида никеля (II).Выпадает осадок комплексного соединения бензоцианоаммината никеля Ni(CN)2Nh4(C6H6). |
| Спирты | Реакция с оксидом серебра - в осадок выпадает медь: |
| Многоатомные спирты | С гидрокисдом меди (II) - Cu(OH)2 образуется комплекс синего цвета |
| Альдегиды | Реакция "серебряного зеркала" и реакция "медного зеркала": |
| Кислоты органические | Дают окрашенные соли тяжелых металлов - см. таблицу растворимости |
| Амины | Качественных реакций нет (только анилин - имеет характерный запах) |
organichimik.blogspot.com
Эфиры простые, анализ качественный - Справочник химика 21
Дальнейшая возможность качественного определения представителей опреде.ченных классов веществ в смеси состоит в селективном превращении этих соединений в летучие производные перед газохроматографическим анализом. Превращенные компоненты можно узнавать по сдвигу пиков на хроматограмме предварительно обработанной пробы, которая отличается по своему качественному составу от исходной пробы. К таким методам селективного превращения можно отнести все виды гидрирования двойных связей и другие реакции с функциональными группами, как, папример, этерификация, омыление, образование простых эфиров и т. д. При практическом осуществлении этих методов анализа также можно использовать непрерывные и прерывные способы работы. Селективное превращение компонентов пробы особенно целесообразно в тех случаях, если нет в наличии чистых образцов тех соединений, которые присутствуют в анализируемой смеси соединений, или они менее доступны, чем продукты их превращения. [c.246]
При определении углеродного скелета молекулы методом хроматографии от молекулы отщепляют функциональные группы и насыщают ее кратные связи. Подобный метод, описанный в недавно вышедшем обзоре [23], применяли в анализах большого числа различных соединений кислот, спиртов, альдегидов, ангидридов, простых и сложных эфиров, эпоксисоединений, кетонов, аминов, амидов, алифатических и ароматических углеводородов, нитрилов, сульфидов, галогенидов, олефинов и соединений других типов. Область применения этого метода очень широка и потому он обсуждается именно в этом общем разделе, а не в главах, посвященных анализам отдельных функциональных групп. Сам по себе этот метод дает качественные результаты, но его можно использовать и в количественных определениях. Однако основным применением этого метода является определение структуры, для которого часто необходимы количественные анализы функциональных групп. В определении химической структуры молекул важен метод, основанный на индексах удерживания углеродного [c.433]
Сложность строения многих алкалоидов сильно затрудняет определение их структуры. Прежде всего выясняют, содержит ли изучаемый алкалоид кислород или нет, для чего проводят качественный и количественный анализ, определяют молекулярный вес и устанавливают его молекулярную формулу. Если алкалоид оказался кислородсодержащим, устанавливают, в какой форме представлен в нем кислород для этого применяют ряд реакций, характеризующих ту или иную кислородсодержащую группу например, гидроксильную группу открывают с помощью хлорангидридов кислот или уксусным ангидридом, сложные эфиры — путем их омыления, простые эфиры — действием на них иодистого водорода, что приводит к образованию соответствующего галоидоалкила. [c.370]
На остальных трех полочках располагаются реактивы в тематической последовательности качественный анализ органических веществ, предельные и непредельные углеводороды, галогенопроизводные углеводородов жирного ряда, спирты, простые эфиры, альдегиды и кетоны. По мере проведения лабораторных работ состав реактивов на этих трех полочках меняется. [c.214]
В этом разделе в общих чертах описываются основные применения спектроскопии в органической химии. Можно выделить два главных направления применения спектроскопии, которые, однако, иногда не могут быть строго разграничены. Это, во-первых, качественный и количественный анализы, которые проводятся эмпирическим сравнением спектров исследуемых и известных веществ, и, во-вторых, более или менее полное определение строения молекул вещества по его спектру. Спектральный анализ основывается на том, что всякое вещество обладает в одной из областей (инфракрасной, видимой или ультрафиолетовой) специфическим спектром, который может быть удобной и дающей высокую чувствительность анализа характеристикой вещества для его обнаружения и количественного определения. Одним из наиболее простых и наиболее распространенных применений спектроскопии является определение загрязнений, которое очень просто выполняется в том случае, когда примеси имеют полосы поглощения в области, прозрачной для основного соединения. Например, парафины и насыщенные алифатические спирты, эфиры и кислоты только очень слабо поглощают в большей части ультрафиолетовой области, пропускаемой кварцем, и наличие любого поглощения в близкой ультрафиолетовой области указывает на присутствие примесей. Небольшое количество бензола в этиловом спирте, полученном азеотропной перегонкой, определяется [c.165]
Смесь цис- п /гаракс-изомеров циклических диолов проанализирована на основе реакции с борной кислотой — последняя реагирует только с цис-гидроксильными группами [17]. Количественное определение простых моноэфиров гликолей основано главным образом на реакциях ацилирования и осуществляется так же, как и анализ гликолей. Сложные эфиры гликолей определяют качественно и количественно гидролизо.м щелочалш. После гидродиза раствор титруют соляной кислотой в присутствии фенолфталеина уменьшение содержания щелочи пропорционально количеству сложного эфира в пробе. Параллельно проводят холостой опыт [4, р. 981]. [c.340]
Характерная для простых э(1зиров связь С—О—С разрушается при нагревании простых эфиров с концентрированной HI. Эту реакцию применяют в анализе, улавливая продукты реакции и определяя их качественно и количественно. [c.262]
Ч1ротеииы с помощью кислотного, основного или ферментативного гидролиза могут расщепляться на простейшие составляющие — а-ами-нокарбоновые кислоты, обычно называемые просто а-аминокислотами. Ка.чественный анализ получающихся при этом смесей аминокислот связан с относительно большими трудностями. Э. Фишер (1901 г.) обрабатывал такие смеси спиртом и разделял образующиеся в результате смеси сложных эфиров а-аминокислот дробной перегонкой. В настоящее время эти соединения разделяют и идентифицируют методами газовой хроматографии. Использование ионообменной хроматографии позволяет разделить подобные смеси без предварительной этерификации. Существуют приборы, которые автоматически проводят качественный и количественный анализ смесей такого рода. При этом первоначально а-аминокислоты разделяются на ионообменных смолах, элюаты обрабатываются нингидрином, а образующиеся синие окрашенные вещества анализируются колориметрически, кривые поглощения записываются с помоп ью самописца. [c.647]
Расщепление простых эфиров (общая методика для качественного анализа). Способ А. Симметричный алифатический эфир кипятят 3—4 ч с обратным холедильником приблизительно с пятикратным по объему количествам постоянно кипящей иодоводородной кислоты. Затем прибавляют четырехкратный объем воды и отгоняют алкилиодид с водяным паром органическую фазу извлекают небольшими порциями эфира, сушат и идентифицируют алкилиодид в виде S-алкилизотиурониевой соли (разд. Г,2.6.6). [c.277]
Для качественного анализа гликолей можно использовать специфические только для данного диола нерастворимые сложные и простые эфиры, которые образуются прп взаимодействии гликолей с некоторыми ароматическими соединен1шми. Это — сложные ди-эфпры бензойной, г-нитробензойной и 3,5-динитробензойной кислот сложные диэфиры Ь -замещенных карбаминовых кислот (уретаны) бис(трифенплметил)эфиры [6]. [c.336]
Более простой метод прямого пиролиза метиловых эфиров кислот при 650 °С и последующего газо-жидкостного хроматографического анализа полученных осколков — олефинов и метиловых эфиров кислот (получение так называемых хроматографических отпечатков ) испытан в работе [407 ] для ряда мононенасыщенных кислот транс-18 1 , цисЛВ> 1 ыс-16 1 и 11 1 ,. Этот метод при строго соблюдаемых условиях пиролиза дает возможность качественной идентификации каждой из указанных кислот, но для анализа полиненасыщенных кислот, по-видимому, будет малоэффективным вследствие усложнения состава осколков. [c.177]
Действительно, сравнение масс-спектров н-нонилмеркаптана X и н-октилового спирта указывает на качественное сходство основных путей фрагментации этих классов соединений (ср. рис. 3-6 и 2-3). Наиболее существенным отличием в этих спектрах является более высокая интенсивность молекулярного пика меркаптанов (ср. также тиоэфиры и простые эфиры). Даже в масс-спектре ундецилмеркаптана СиНгзЗН интенсивность молекулярного пика составляет 7% от интенсивности основного пика [8]. Высокая интенсивность молекулярных пиков в масс-спектрах меркаптанов имеет особо важное значение потому, что дает возможность обнаруживать присутствие серы без элементарного анализа по наличию пика с величиной т/е на две массовых единицы выше, чем у молекулярного иона (природное содержание изотопа составляет 4,4 °/о). [c.81]
В лаборатории авторов требовалось разработать простой и быстрый метод, который давал бы достаточно точные результаты при анализе большого числа проб, содержащих два или большее число таких соединений, как вода, ацетон, диэтиловый и диизо-пропиловый эфиры, а также этиловый и изопропиловый спирты. Алализ проб с помощью масс спектрометрии нарушил бы настройку прибора кроме того затруднения, с которыми связан масс-спектрометрический анализ кислородсодержащих соединений, вообще исключает возможность использования этого метода. Перегонка в большинстве случаев могла бы дать удовлетворительные результаты для веществ, присутствующих в больших количествах, но по этому методу нельзя разделить ацетон и ди-изопропиловый эфир. Кроме того, перегонка требует постоянного внимания экспериментатора в течение длительного времени. Например, перегонка проб, содержащих эфир и ацетон, а также спирт, требует 8 часов. Авторами была исследована возможность использования метода газо-жидкостной распределительной хроматографии для рассматриваемого случая анализа. Для разделения низкокипящих спиртов и кетонов была предложена колонка с триэтиленгликолем в качестве стационарной жидкости . Была установлена опытная колонка такого типа и проведена качественная и количественная калибровка. [c.147]
Качественный анализ масс-спектров установил, что в продуктах пиролиза не содержатся насыщенные углеводороды— парафины и нафтены, однако не исключено присутствие алифатических и алициклических ненасыщенных углеводородов и кислородсодержащих соединений. На наличие кислородсодержащих соединений указывали пики характерных ]юнов с массой 45, 46, 59, 60, 61, 74 и 75. Эти соединения представляют собой, по-ви-димо.му, алифатические спирты, простые и (или) сложные эфиры и кетоны. Относительно высокая интенсивность пиков ионов с массой 78, 79, 93 и 94 позволяет предположить наличие в продуктах пиролиза высокоиенасы-щенных алифатических н циклических структур. Основную часть продуктов пиролиза трибополимеров составляли ароматические соединения, содержащие бензольные, нафталиновые, дифениловые, антраценовые, фенантреновые и другие ароматические ядра, [c.131]
Пектиновые вещества — это углеводные полимеры, состоящие главным образом из неразветвленных цепей, которые построены из остатков a-D-галактуроновой кислоты, связанных (14)-связями. Простых химических производных, которые могли бы служить для характеристики пектиновых веществ, нет, однако результаты химического и физического анализов [4, 7, 10] могут дать полезную информацию. Для сухого пектина из цитрусовых обычно характерно следующее содержание уроновых кислот 83%, —ОСНз 10%, —ОССНз 0,3%, [i]] 3,5, желирующее число 200, [а] В + 230°, качественная гидроксамовая реакция на сложный эфир положительна [И]. Сухая пектовая кислота из цитрусовых, приготовленная, как описано выше, обычно дает следующие результаты анализа содержание уроновых кислот 92%, [a]ff - - 272°, эквивалентный вес 192, гидроксамовая реакция на сложные эфиры отрицательна. [c.377]
Появление полосы 1340 см" средней интенсивности в ИК-спектрах сложных глицидиловых эфиров (см. рисунок), которая отсутствует у простых глицидиловых эфиров и глицидилалкиловых производных, вероятно, обусловлено увеличением полярности связи С—Н в эпоксидном кольце при одновременном сильном индукционном влиянии карбонила и эпоксикислорода. Мы считаем возможным использовать полосу 1340 см для качественного анализа сложных глицидиловых эфиров. [c.150]
chem21.info
4. Присоединение спиртов:
полуацеталь
В присутствии следов минеральных кислот образуются ацетали:
ацеталь
5. Присоединение магнийгалогеналкилов, гидролиз которых приводит к получению первичных, вторичных и третичных спиртов соответственно:
НСОН + RMgBr R-Ch3–OMgBr
R–Ch3-OMgBr + h3O R–Ch3-OH + Mg(OH)Br
R COH + RMgBr R2–CH–OMgBr
R2-CH-OMgBr + h3O R2-CH-OH + Mg(OH)Br
R2C=O + RMgBr R3COMgBr
R3COMgBr + h3O R3C-OH + Mg(OH)Br
Некоторые реакции присоединения протекают с отщеплением молекул воды. К таковым относятся реакции взаимодействия альдегидов с аммиаком с образованием альдиминов (кетоны подобных соединений не образуют), с гидроксиламином с образованием альдоксимов и кетоксимов, с гидразином с образованием гидразонов.
6. Взаимодействие с аммиаком:
Альдимины легко полимеризуются в циклические альдегидаммиаки, используемые как ускорители вулканизации каучуков:
Взаимодействием формальдегида с аммиаком получают уротропин:
6 НСОН + 4Nh4 (Ch3)6N4 + 6h3O
7. Образование оксимов с гидроксиламином:
R – CH = O + h3N-OH h3O + R-CH = NOH
альдоксим
R2C = O + h3N-OH R2C = N – OH + Н2О
кетоксим
Эти реакции применяют для количественного определения карбонильных соединений, используя солянокислый гидроксиламин.
8. Взаимодействие с гидразином и его замещенными. В зависимости от условий гидразин образует гидразоны:
или азины (альдазины и кетазины):
9. Реакции полимеризации альдегидов в присутствии следов минеральных кислот. При этом формальдегид может превращаться в параформ:
nСН2О (-CН2О-)n
со степенью полимеризации n=8-10, полиформальдегид со степенью полимеризации n=1000, циклический продукт – триоксиметилен:
Полимеризация уксусного альдегида приводит к образованию паральдегида:
паральдегид
10. Реакции конденсации альдегидов, приводящие к образованию альдолей, называют альдольной конденсацией (а). Конденсация, сопровождающаяся отщеплением воды и образованием непредельного альдегида, называется кротоновой конденсацией (б). Альдольная конденсация кетонов протекает в более жестких условиях с образованием -кетоноспиртов (в):
а) СН3СНО + НСН2СОН СН3СН(ОН)СН2СНО
3-оксибутаналь (альдоль)
б) СН3СН(ОН)СН2СНО СН3СН=СН-СНО
-h3O
кротоновый альдегид
в) (СН3)2С=О+НСН2-СО-СН3(СН3)2С(ОН)-СН2-СО-СН3(СН3)2С=СН-СО-СН3
-h3O
диацетоновый спирт окись мезитила
(4-окси-4-метилпентанон-2) (4-метилпентен-3-он-2)
Из соединений, участвующих в ключевой стадии при альдольной конденсации, одно должно быть донором пары электронов, а другое – акцептором.
Альдегиды, не способные к альдольной конденсации, вступают в реакцию Канниццаро (реакция дисмутации альдегидов):
2 (СН3)2СНСНО + КОН (СН3)2СНСООК + (СН3)2СНСН2ОН
11. Сложноэфирная конденсация (по Тищенко) в присутствии алкоголятов алюминия приводит к получению из ацетальдегида этилацетата:
СН3СНО + СН3СНО СН3СООС2Н5
12. Получение пентаэритрита (щелочной катализ):
СН3СНО + 3СН2О С (СН2ОН)4
13. Замещение карбонильного кислорода хлором при действии РCI5 позволяет получить геминальные дигалогенпроизводные:
R2C=О + РСI5 R2CCI2 + POCI3
14. Карбонильная группа оказывает активирующее действие на реакционную способность связанных с ней углеродных атомов (особенно -атомов), вследствие чего для альдегидов и кетонов характерны реакции замещения в углеводородном радикале:
СН3СН2СНО + CI2 Ch4CHCICHO
Реакции отличаются от реакций галогенирования алканов тем, что протекают в присутствии кислых или щелочных катализаторов.
При пропускании хлора через ацетальдегид получается 2,2,2-трихлорацетальдегид (хлораль) –CI3-CH=O, который широко используется в органическом синтезе.
15. Галоформная реакция, индуцируемая основаниями, приводит к получению галоидпроизводных типа СНHal3 и может служить качественной реакцией на метилкетоны .
Образующийся тригалогенкетон легко атакуется основанием, что приводит к расщеплению С-С связи:
Образование иодоформа (осадок в виде желтых кристаллов) является качественной реакцией на группу СН3СО-.
16. Реакции окисления. Альдегиды окисляются до карбоновых кислот даже такими слабыми окислителями, как аммиачный раствор оксида серебра (реактив Толленса). Эта качественная реакция на альдегиды известна под названием “реакции серебряного зеркала”:
RCOH + 2Ag(Nh4)2OH RCOONh5 + 2Ag + 3Nh4 + h3O
Альдегиды окисляются также феллинговой жидкостью (“реакция медного зеркала”).
Кетоны окисляются труднее. Они более устойчивы к слабым окислителям и к кислороду воздуха. При действии сильных окислителей происходит разрыв углеродной цепи и образование смеси кислот. При окислении симметричных кетонов образуется не более двух кислот:
О
СН3-СН2-СО-СН2-СН3 СН3-СН2-СООН + СН3СООН
studfiles.net
Элементный анализ органических веществ
Цель работы. Освоение качественных методов обнаружения органогенных элементов в составе различных органических веществ.
Качественный анализ позволяет определить, из каких элементов построены молекулы вещества и установить его простейшую формулу. Наиболее часто в состав органических веществ, помимо углерода и водорода, входят кислород, сера, азот и галогены.
При выполнении элементного анализа органическое соединение разлагают таким образом, чтобы исследуемые элементы «перешли» в состав неорганических веществ – углерод в оксид углерода(IV), водород – в воду, азот – в цианид-ион, аммиак или молекулярный азот, сера – в сульфид-ион.
Опыт 1. Обнаруживание углерода пробой на обугливание
Первой пробой исследования неизвестного вещества для проверки его принадлежности к классу органических соединений является прокаливание вещества в пробирке, на крышке тигля и т.п. Очень многие органические соединения при этом чернеют, обугливаются, выявляя таким образом углерод, входящий в их состав.
Иногда обугливание наблюдается при действии водоотнимающих веществ, например, концентрированной h3SO4. Особенно резко такое обугливание проявляется при нагревании. Так, при нагревании обугливающее действие оказывает даже разбавленная h3SO4.
На белом листе бумаги сделайте надпись 1 %-м раствором h3SO4. После высыхания надпись невидима.
При осторожном нагреве бумаги над пламенем или над электроплиткой участки бумаги, смоченные серной кислотой, обугливаются, невидимая надпись проявляется, как написанная черной тушью.
“Коптящее пламя” – тоже пример обугливания органического вещества.
Проба на обугливание – вспомогательный, ориентировочный прием, так как отсутствие обугливания еще не позволяет утверждать об отсутствии углерода, поскольку многие органические соединения не подвергаются обугливанию.
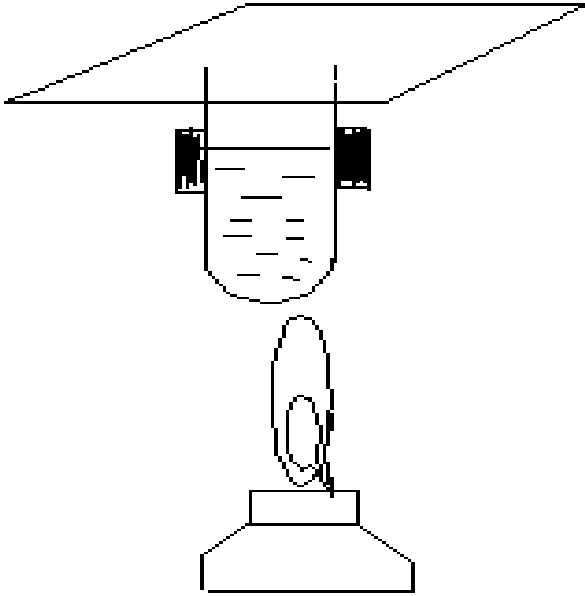
Опыт 2. Обнаружение углерода и водорода
В
3
2
1
пробирку с газоотводной трубкой поместите,предварительно перемешав в фарфоровой чашке, около 1 г сахарозы и 2-3 г CuO. В верхнюю часть пробирки поместите комочек ваты, на который насыпьте немного обезвоженного CuSO4. При нагреве смеси идет реакция (рис. 1):
5
4
Выделяющийся при разложении сахарозы газ пропускается через раствор баритовой воды для обнаружения в нем CO2. Факт образования воды фиксируется с помощью безводного CuSO4, который образует синий кристаллогидрат CuSO45h3O.
Напишите соответствующие уравнения реакций и сделайте вывод о наличии в составе сахарозы углерода и водорода.
Опыт 3. Обнаружение азота по характерному запаху
жженого органического вещества
Метод прост и надёжен, запах очень специфичен. Он характерен для всех азотсодержащих белковых веществ (шерсть, волосы, мясо, кожа, яичный белок, желатин, казеин и др.) и позволяет обнаруживать таким образом ничтожные количества указанных веществ:
а) сжечь волос – познакомиться с запахом.
б) сравнить при сжигании поведение хлопчатобумажной (х/б) и шерстяной нитей.
Запишите наблюдения.
Опыт 4. Обнаружение азота в составе мочевины
по образованию аммиака
– мочевина (карбамид)
Р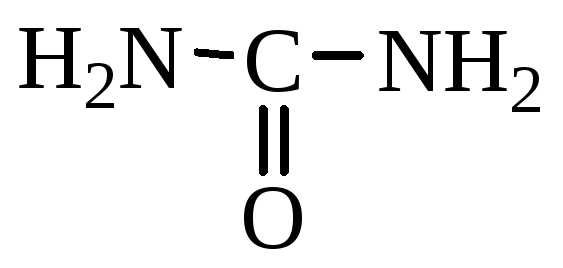
 астворите ~ 0,5 г мочевины в 2 мл дистиллированной h3O и добавьте 2 мл 10 %-го раствора NaOH. Нагрейте в пламени спиртовки. Красный лакмус, смоченный водой, держать над парами (без контакта лакмуса со щелочью), рис. 2.
астворите ~ 0,5 г мочевины в 2 мл дистиллированной h3O и добавьте 2 мл 10 %-го раствора NaOH. Нагрейте в пламени спиртовки. Красный лакмус, смоченный водой, держать над парами (без контакта лакмуса со щелочью), рис. 2.
Напишите уравнения реакций и вы- воды.
Рис.2. Схема прибора
для обнаружения аммиака
Опыт 5. Обнаружение серы в составе тиомочевины
по образованию осадка PbS
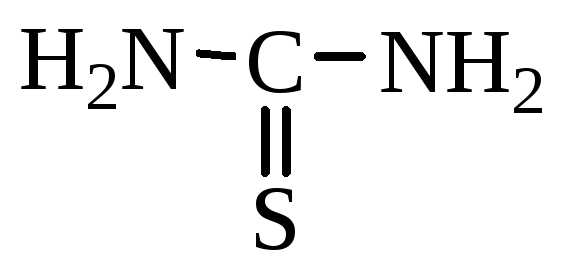
– тиомочевина (тиокарбамид)
Сульфид свинца – очень плохо растворимое соединение черного цвета. Добавление растворимых солей свинца к растворам, содержащим анион S2–, приводит к образованию черного осадка и является чувствительной реакцией на cульфидную серу.
Опыт 5(а). К небольшому количеству раствора тиомочевины добавьте 1-2 капли раствора соли свинца. Объясните отсутствие осадка PbS.
Опыт 5(б). В сухую пробирку поместите ~0,5 г тиомочевины и таблетку NaOH. Смесь сплавьте, охладите и растворите в 2-3 мл дистиллированной h3O – перевод органической серы в неорганическое состояние (S2–). Добавьте к раствору плава соли каплю нитрата свинца.
Напишите уравнения реакций, наблюдения и выводы.
studfiles.net
Простые эфиры анализ - Справочник химика 21
Количественный групповой анализ ГАС ряда типов (сульфидов, тиофенов, простых эфиров, фуранов, пиридинов) затруднен из-за отсутствия в их спектрах полос, пригодных для использования в качестве аналитических. При изучении тяжелых фракций нефтей и битумов методами ИК спектроскопии возникают дополнительные трудности в связи с теж, что некоторые типы функциональных групп (фенольные, карбонильные, сульфоксидные), присутствуя в составе высокомолекулярных, соединений нефти, поглощают при меньших частотах, чем в составе чистых модельных соединений. Этот эффект связывают с более интенсивными меж-молекулярными взаимодействиями и ассоциацией молекул ВМС, содержащих повышенное количество этих функциональных групп [129, 131, 230]. [c.29]
Расщепление простых эфиров (общая методика для качественного анализа). [c.262]
Дальнейшая возможность качественного определения представителей опреде.ченных классов веществ в смеси состоит в селективном превращении этих соединений в летучие производные перед газохроматографическим анализом. Превращенные компоненты можно узнавать по сдвигу пиков на хроматограмме предварительно обработанной пробы, которая отличается по своему качественному составу от исходной пробы. К таким методам селективного превращения можно отнести все виды гидрирования двойных связей и другие реакции с функциональными группами, как, папример, этерификация, омыление, образование простых эфиров и т. д. При практическом осуществлении этих методов анализа также можно использовать непрерывные и прерывные способы работы. Селективное превращение компонентов пробы особенно целесообразно в тех случаях, если нет в наличии чистых образцов тех соединений, которые присутствуют в анализируемой смеси соединений, или они менее доступны, чем продукты их превращения. [c.246]
Охлажденную до комнатной температуры реакционную массу встряхивают в делительной воронке с примерно равным объёмом 2%-кого водного раствора едкого натра. Органический слой отделяют, промывают водой до нейтральной реакции, фильтруют через слой прокаленного сульфата натрия и фракционируют при обычном или уменьшенном давлении. Получают простые эфиры с выходами 95—97% от теоретических их температуры кипения, удельные веса и результаты элементарного анализа приведены в таблице. [c.22]
Классификация химических реакций целлюлозы как полимера рассмотрена выше в разделе, посвященном особенностям химических реакций полисахаридов древесины (см. П.3.1). У технической целлюлозы, выделенной из древесины, наибольшее значение из полимераналогичных превращений на практике имеют реакции функциональных групп. К этим реакциям относятся реакции получения сложных и простых эфиров, получения щелочной целлюлозы, а также окисление с превращением спиртовых групп в карбонильные и карбоксильные. Из макромолекулярных реакций наиболее важны реакции деструкции. Реакции сшивания цепей с получением разветвленных привитых сополимеров или сшитых полимеров пока имеют ограниченное применение, главным образом, для улучшения свойств хлопчатобумажных тканей. Реакции концевых групп используются в анализе технических целлюлоз для характеристики их степени деструкции по редуцирующей способности (см. 16.5), а также для предотвращения реакций деполимеризации в щелочной среде. Как и у всех полимеров, у целлюлозы одновременно могут протекать реакции нескольких типов. Так, реакции функциональных групп, как правило, сопровождаются побочными реакциями деструкции. [c.544]
Интересным примером применения групповых частот в количественном анализе является прямое определение таких функциональных групп, как альдегидные, кислотные, спиртовые, при этом структура конкретных молекул не учитывается. Такое определение концентраций групп представляет интерес для нефтяной и химической промышленности. В одном из исследований [95, 96] спирты, кислоты, альдегиды, кетоны, сложные и простые эфиры были определены измерением их поглощения при 3635 см" (2,75 мкм), 3550 см (2,82 мкм), 2720 см (3,68 мкм), 1720 см (5,8 мкм), 1140-1300 см (7,7 — 8,8 мкм) и 1060 — 1220 см (8,2 — 9,4 мкм) соответственно. В другой работе [61] проводился контроль методом ИК-спектроско-пии содержания тронс-ненасыщенности в жирах, нефти и сложных эфирах. [c.270]
Анализ простых эфиров [c.543]
Спектральный анализ простых эфиров [c.544]
Применяя комбинацию метода с использованием сжигание полученного продукта в сосуде с кислородом и измерение жидкостным сцинтилляционным счетчиком, можно определять малые концентрации карбоксильных групп, присутствующих на поверхности частиц газовой сажи [103]. В анализе, описанном в работе [103], 2 г газовой сажи добавляли в 100 мл раствора радиореагента в толуоле и перемешивали смесь в течение 20 ч при комнатной температуре. После фильтрования, экстракции и высушивания радиоактивность, обусловленную метильными группами сложных и простых эфиров, измеряли методом Цейзеля. Отдельную пробу обрабатывали примерно 6 н. раствором НС1 с целью гидролиза сложных эфиров. По разности результатов, полученных в анализах первой и второй проб, определяли сложные эфиры. [c.154]
Была изучена также возможность применения эфиров борной кнслоты типа В (OR) (0R ) (OR ) для структурного анализа спиртов методом масс-спектрометрии [335]. Эти соединения при ЭУ ведут себя подобно простым эфирам и ортоэфирам. Однако [c.195]
Было исследовано также влияние растворителя на колориметрическое определение сложных эфиров. Поскольку нередко необходимы или желательны другие растворители, помимо этанола были исследованы некоторые из них (рис. 3.3). Растворы реактива, содержащего Ре +, и пробы сложного эфира в изопропаноле оказались во всех отношениях сравнимы с этанольными. Можно растворять пробу в бензоле, оставляя все прочие реактивы без изменения. Диоксан при соответствующей очистке мог бы, вероятно, оказаться также подходящим растворителем. Успешно применяли смеси хлористого метилена с этанолом и петролейный эфир. Томпсон [14] пользовался диэтиловым эфиром после весьма тщательной его очистки. По-видимому, при соответствующей очистке можно применять в качестве растворителей и другие простые эфиры и спирты. Можно анализировать и водные растворы сложных эфиров, однако в этом случае наблюдается некоторое ослабление интенсивности окраски, вероятно, из-за конкурирующих взаимодействий воды и гидроксамовой кислоты с ионами Ре +. Для построения калибровочных кривых всегда необходимо пользоваться тем же растворителем, что и при анализе пробы. [c.146]
Сложные эфиры, спирты, карбоновые кислоты и простые эфиры не мешают определению алифатических амидов. В условиях определения амины, альдегиды и метилкетоны подвергаются окислению. Помехи, однако, удается устранить предварительным окислением этих групп бромом в нейтральном растворе. Большинство ароматических амидов и N-метилформамид мешают определению алифатических амидов, присутствие же высших N-алкиламидов и ди-Ы-алкиламидов не влияет на анализ. [c.168]
В диенах с сопряженными связями пероксиды реагируют медленно, и результаты зависят от размера пробы, температуры и концентрации кислорода. Пероксиды в других материалах реагируют почти мгновенно, и результат зависит только от концентрации кислорода и в меньшей степени от размера пробы. Эти результаты анализа согласуются с тем, что пероксиды в моноолефинах и, вероятно, в простых эфирах представляют собой реакционноспособные алкилгидропероксиды, тогда как пероксиды диенов с сопряженными связями являются нереакционноспособными пероксидами мостикового типа. Очевидно, что точные результаты анализа этих соединений могут быть получены лишь при регулировании условий реакции в узких пределах. Особое поведение проявляет бензоилпероксид, который быстро реагирует с иодид-ионом, но [c.280]
Ход определения и прибор для проведения анализа такие же, как и в методе с использованием реактива Гриньяра. Единственное различие заключается ь применении в качестве растворителей простых эфиров. [c.377]
Анализ масс-спектров простых эфиров может быть затруднительным вследствие слабости пика молекулярного иона (Af). Однако при увеличении концентрации образца пик М -)- 1 часто становится более интенсивным. Это происходит в результате переноса Н при ион-молекулярных соударениях [c.350]
Полную этерификацию высших полиолов осуществить довольно трудно объясняют это тем, что некоторые гидроксилы полиолов более устойчивы в этой реакции, или же пространственными затруднениями. Простые эфиры образуются под действием метил-или этилсульфатов, алкил- или аралкилхлорида и щелочи, метил-йодида и окиси серебра. Разработаны различные методы получения наиболее летучих триметилсилильных производных полиолов, применяемых при газохроматографическом анализе углеводоЕ и многоатомных спиртов [40]. При действии трифенилметилхло- [c.18]
Характерная для простых э(1зиров связь С—О—С разрушается при нагревании простых эфиров с концентрированной HI. Эту реакцию применяют в анализе, улавливая продукты реакции и определяя их качественно и количественно. [c.262]
Расщепление простых эфиров находит примененне в количественном анализе для определения метоксигрупп. Образующийся при действии нодистоводородной кислоты метилнодид отгоняется и затем определяется титрованием. [c.262]
После того как было установлено понятие хим. элемента и заложены основы хим. атомистики, гл. целью X. стало изучение зависимости св-в хим. соед. от их состава. Тогда же стали привлекать к себе внимание в-ва животного и растит, происхождения, систематич. изучение к-рых привело к появлению новой ветви X., получившей наименование органической. Благодаря работам Берцелиуса, Ю. Либиха, Ж. Дюма и др. были разработаны методы анализа орг. соединений и исследованы мн. природные орг. в-ва. С течением времени был накоплен обширный опытный материал, к-рый потребовал обобщений, направленных на выявление особенностей хим. природы орг. в-в. Так стали возникать первые теории орг. химии. В 1828 Дюма предложил теорию чэтерина>, или масляного газа (позднее названного этиленом), в к-рой этерин рассматривался как составная часть спирта, а также простого и сложного эфиров. При этом спирт и простые эфиры считали гидратами этернна (сильного основания), а сложные эфиры — солеподобными производными этерина и к-т. Теория радикалов, развитая Ф. Велером и Либихом (1832), утверждала, что орг. соед. состоят из сложных групп атомов (радикалов), способных без изменения переходить из одного соед. в другое. [c.652]
С помощью Л. X, удается выделять и разделять соед., склонные к координации с ионами металлов, в присут. больших кол-в минер, солей и некоординирующихся в-в. Напр, с использованием иминодиацетатной смолы с ионами Си из морской воды выделяют своб. аминокислоты На катионитах с ионами Ре разделяют фенолы, с ионами Лg -сахара. На карбоксильных катионитах с N1 разделяют амины, азотсодержащие гетероциклы, алкалоиды. На силикагеле с нанесенным слоем силиката Си в водно-орг. среде в присут. ННз проводят быстрый анализ смесей аминокислот и пептидов, причем элюируемые из колонки комплексы легко детектируются спектрофотометрически. На высокопроницаемых декстрановых сорбентах с иминодиацетатными группами, удерживающими ионы N1 или Си- , селективно выделяются из сложных смесей индивидуальные белки и ферменты, содержащие иа пов-сти своих глобул остатки гистидина, лизина или цистеина. Силикагели с фиксированными на пов-сти инертными т/)ис-этилендиа.миновыми комплексами Со используют для т. наз. внешнесферной Л. х. смесей нуклеотид-фосфатов. Методом газовой Л. х. с помощью фаз, содержащих соли Ag , разделяют олефины, ароматич. соед., простые эфиры. Тонкослойная Л. х. на носителях, пропитанных солями Ag , применяется для анализа стероидов и липидов. [c.590]
В третьем методе анализа ассоциированных объектов их спектры записывают при условии полной ассоциации. Это можно сделать, используя в качестве растворителя либо основание Льюиса (или кислоту в зависимости от условий), либо само исследуемое вещество. Например, полипропиленгликоли можно проанализировать на гидрок-сидные группы in situ [22], так как группы ОН образуют внутри-, молекулярную водородную связь с кислородом простого эфира, и возникающая в результате этого полоса поглощения достаточно точно подчиняется закону Бугера — Бера. Для коррекции величины оптической плотности группы ОН может оказаться необходимым независимое определение воды. В ближней ИК-области в качестве ассоциирующего растворителя для связывания гвдроксвдных групп и гарантии воспроизводимости анализа часто используется хлороформ. Простые и сложные полиэфиры анализировались с целью определения гидроксидного числа в области 2—3,2 мкм, при этом в качестве растворителя применялся Q4, содержащий 10 % H I3 [54]. Смеси [c.269]
При отсутствии данных о размере второго кольца приведенные соображения почти полностью исчерпывают возможности структурного анализа. Поскольку соединение должно содержать двойную связь, можно показать, что эта связь находится не в кольце, так как тогда она, как отмечено выше, будет являться аллильной по отношению к ароматическому ядру (винильной по отношению к бензильному остатку) или структурным элементом замещенного винилового простого эфира, масс-спектр которого характеризуется специфическими перегруппированными ионами [109]. Оба эти варианта невозможны, поэтому второе кольцо должно представлять собой замещенный фурановый цикл, т, е. строение молекулы можно представить следующим образом [c.65]
В отсутствие полярных групп эфиры легко количественно определить методом ГХ. В этих анализах ншроко применяют полиэфирные жидкие фазы, которые позволяют получать симметричные хроматографические пики для простых эфиров и, кроме того, обеспечивают разделение в зависимости от числа ненасыщенных связей. Симметричные пики и хорошие количественные данные можно получить и на неполярных жидких фазах, но они не позволяют разделять насыщенные и ненасыщенные эфиры. Колонки с неполярными фазами можно использовать только для грубого разделения эфиров по их молекулярным весам (например, отделить эфиры H- i6 от эфиров я- is), а колонки с полиэфирами — для дополнительного разделения по числу ненасыщенных связей (О, 1, 2 или большее число двойных связей). Эфиры с высоким молекулярным весом или их нелетучие комплексы (например, фосфолипид) обычно превращают в более летучие производные (по кислотной или спиртовой группе или по обеим этим группам) путем переэтерификации, алкоголиза или омыления с последующим превращением в простые или сложные эфиры. Если эфиры содержат полярные группы, то на одном из этапов определения получают производные по этим группам. Так, например, ацетилирование моно- и диглицеридов обеспечивало полное элюирование этих эфиров в ГХ-анализе в то же время без ацетилирования элюирование может оказаться неполным [41, 42]. Моноглицериды (Сг— is) и диглицериды (С4—Сзб) определяли также и путем превращения их по свободным оксигруппам в триметилсилильные эфиры под действием бис- (триметилсилил) ацетамида [43]. [c.140]
Для обеспечения стабильности подготовленной колонки неподвижные фазы часто связывают химически с носителем (обычно с помощью сложного или простого эфира). Простая эфирная связь обеспечивает более устойчивый продукт, чем сложноэфирная связь, которая может гидролизоваться полярными растворителями например, в покрытых октадецилсила-ном бусинках углеводородная цепь связана простой эфирной связью со стеклянными бусинками, покрытыми тонким слоем кремния, и это обеспечивает весьма эффективную систему с обращенной фазой, которая исключительно стабильна в пользовании. Для хроматографирования эти частицы укладывают в колонки с узким отверстием (внутренним диаметром обычно 2—4 мм) вполне очевидно, что такой мелкий материал, упакованный в колонки длиной до 1 м, будет создавать значительное сопротивление потоку подвижной фазы, в силу чего и должно применяться высокое давление. Типичная длина колонок составляет 20— 30 см, а условия, обычные для количественного анализа, — скорость потока около 1— 3 мл в минуту и давление до 28 000 кПа (4000 фунтов/дюйм ). [c.103]
Для качественного анализа гликолей можно использовать специфические только для данного диола нерастворимые сложные и простые эфиры, которые образуются прп взаимодействии гликолей с некоторыми ароматическими соединен1шми. Это — сложные ди-эфпры бензойной, г-нитробензойной и 3,5-динитробензойной кислот сложные диэфиры Ь -замещенных карбаминовых кислот (уретаны) бис(трифенплметил)эфиры [6]. [c.336]
И трижды защищенного производного этого же тетраола — ортоэфира 78 как реагента для наращивания цепей. Трансформацией 77 в бромид 77а с последующим стандартным алкилированием этим бромидом алкоголята 78а бьш получен защищенный дендример первого поколения 79. После удаления за-щитньгх групп этот дендример был подвергнут аналогичной последовательности реакций и т. д., что вело к дендримерам второго (81) и третьего (82) поколений. Таким образом, чрезвычайно простая химия (старый добрый метод синтеза простых эфиров по Вильямсону) оказалась очень эффективной для построения достаточно сложных структур. Но дальнейшее продвижение по этому пути оказалось практически невозможным из-за стерических препятствий. Анализ молекулярных моделей дендримера третьего поколения, 82, показал, что эти шарообразные молекулы (около 22—24 A в диаметре) имеют весьма плотную упаковку ветвей. Поэтому нереалистично бьшо бы рассчитывать на необходимую полноту конверсии 108 поверхностных гидроксильных групп в соответствующий полибромид, не говоря уже о достижении полноты последующей конденсации с реагентом 78а, который и сам предъявляет достаточно жесткие пространственные требования к реакционному партнеру. [c.410]
При этом часть гидроперекиси расходуется на образование побочных продуктов. Исследование побочных продуктов реакции грет-бутилгидроперекиси с м-бутилбутен-2-ил-сульфидом показало, что они состоят из ди- -бутилдисульфида и смеси трудноразделимых веществ. Последняя -по данным анализа состоит из 1 -метилбутен-2-ола, 1 -метилбутен-2-ил-трет-бутилперекиси, бис-1-метилбутен-2-илового эфира и бис-1-метилбутен-2-ил-пере-киси. Очевидно, образование этих продуктов происходит с разрывом связи С—3 по радикальному механизму. Однако образование перекисей наряду с простыми эфирами может протекать и по другому механизму. [c.51]
Карбоксильные производные простых эфиров исследуются путем непродолжительного нагревания с обратным холодильником с концентрированной иодистоводородной кислотой и последующей осторожной лерегоикой смеси. Если исследуемый продукт представляет собой алкоксикислоту, в дестиллате содержится соответственный иодистый алкил. Образовавшуюся а результате анализа оксикислоту следуег выделить и идентифицировать- [c.523]
Было установлено, что органические соединения многих классов, именно кислоты, высшие спирты, амины, высшие сложные эфиры, простые эфиры, углеводороды, насыщенные кетоны и нитрилы, не оказывают влияния на анализ а-эпоксидов методами, основанными на гидрохлорироваиии. Можно ожидать, что нерастворимые в воде вещества будут снижать результаты определения гидрохлорированием в водном растворе хлорида магния тех эпоксипроизводных, которые трудно переходят в водный слой. [c.248]
chem21.info