4.1.5. Качественные реакции органических соединений. Качественная реакция сложные эфиры
Качественные реакции простых эфиров — Студопедия.Нет
Характерная для простых эфиров связь С-О-С разрушается при нагревании простых эфиров с концентрированной HI. Эту реакцию применяют в анализе, улавливая продукты реакции и определяя их качественно и количественно. Используется также способность простых эфиров к образованию оксониевых соединений. В ароматических и жирноароматических эфирах используется реакционная способность ароматического кольца. Простых качественных проб на связь С-О-С не имеется, и часто заключение о принадлежности вещества к классу простых эфиров делается на основании отрицательных проб на другие кислородсодержащие функциональные группы. Известны, однако, качественные реакции, которые позволяют отличить одни группы простых эфиров от других.
Так, простые алифатические эфиры R-О-R можно отличать от простых эфиров фенолов Аr-О-R по растворимости в холодной концентрированной серной или концентрированной соляной кислотах. Это связано со способностью простых алифатических эфиров образовывать с кислотами оксониевые соединения.
Циклические простые эфиры, особенно а-окиси, настолько легко реагируют с НСl, что при прибавлении их к водному раствору NaCl появляется щелочная реакция, которую можно обнаружить по фенолфталеину:
| RCH RCHCl | O +h3O NaCl → | + Na+ + OH- RCH RCHOH |
Если добавить к раствору α-окиси MgCl2 или FeCl3, выпадает осадок гидроокиси металла.
Качественные реакции сложных эфиров
В анализе сложных эфиров R-COOR' используется их способность к гидролизу и замещению алкоксильной группы другими остатками. Большинство сложных эфиров обладает характерным запахом и не растворимо в воде. Однако эти признаки не могут служить критерием для отнесения веществ к классу сложных эфиров, так как известны вещества со сходным запахом, а неполные эфиры многоатомных спиртов обычно растворимы в воде.
Реакция с гидроксиламином. При взаимодействии сложного эфира с гидроксиламином протекает образование гидроксамовой кислоты:
| O O R – C +h3NOH → R – C + R`OH OR` NHOH |
Гидроксамовые кислоты образуют с FeCl3 интенсивно окрашенные соединения:
Применение этой качественной реакции ограничено, так как еедают также галогенангидриды и ангидриды кислот и некоторые дру-гие соединения.
Качественные реакции аминов
Качественное и количественное определение аминов базируется главным образом на их основности, а также на подвижности атомов водорода, связанных с азотом. Для аминов ароматического ряда используется также реакционная способность атомов водорода ароматического ядра, находящихся в п-положении. Если азотсодержащее вещество значительно лучше растворимо в соляной кислоте, чем в воде, или содержит ион Hal- или другой анион, то это может быть амин или соль амина. Дальнейшие уточнения ведутся с помощью следующих реакций.
Реакция с HNO2. Первичные алифатические амины при действии азотистой кислоты превращаются в соответствующие спирты, при этом выделяется азот (проба не вполне надежна, так как HNO2 разлагается с образованием NO и NO2 ):
| R – Nh3 + HONO → ROH + N2 + h3O |
Ароматические амины превращаются в диазосоединения, которые дают азокрасители (например, с β-нафтолом):
| Ar – Nh3 + NaNO2 + 2HCl → ArN2Cl + 2h3O ArN2Cl + β –C10H7ONa → ArN = NC10H6OH + NaCl |
Вторичные амины, как алифатические, так и ароматические, при действии азотистой кислоты образуют нитрозамины, которые могут быть обнаружены по характерной реакции:
| R2NH + HONO → R2N – N = O + h3O Ar2NH = HONO → Ar2N – N = O + h3O |
Чисто алифатические и чисто ароматические третичные амины не реагируют с азотистой кислотой. Жирноароматические третичные амины при обработке HNO2 образуют С-нитрозосоединения:
Реакция с n-толуолсульфохлоридом. Первичные, вторичные и третичные амины можно различить также по реакции с n-толуолсульфохлоридом. Первичные амины, как жирные, так и ароматические, реагируют, образуя замещенные n-толуолсульфамиды:
| Ch4C6h5SO2Cl + RNh3 → Ch4C6h5SO2NHR + HCl |
Такие амиды растворимы в избытке едкого натра:
| Ch4C6h5SO2NHR + NaOH → Ch4C6h5SO2NNaR +h3O |
Вторичные амины реагируют по той же схеме, но образующиеся в этом случае амиды Ch4C6h5SO2NR2 не растворяются в растворах NaOH. Третичные амины и соли четвертичных аммониевых оснований не реагируют с п-толуолсульфохлоридом.
Реакция с хингидроном. Амины дают многочисленные цветные реакции, которые не являются вполне надежными методами классификации амидов, но могут с успехом применяться как ориентировочные. Одной из таких реакций является реакция с хингидроном. Окраска полученной реакционной смеси зависит от характера амина. Первичные амины дают пурпурную окраску, вторичные — красную, третичные — оранжево-желтую.
Изонитрильная проба.Изонитрильную пробу дают только первичные амины:
| RNh3 + CHCl3 + 3NaOH → R – N → C + 3NaCl + 3h3O |
Появление характерного неприятного запаха свидетельствует об образовании изонитрила. Изонитрилы разрушаются концентрированной НСl.
Реакция с кислым ферроцианидом калия.Для третичных аминов всех типов характерна реакция с комплексными ионами, в частности с кислым ферроцианидом калия:
| 2R3N + K4 [Fe(CN)6] + 4HCl → (R3NH)2h3[Fe(CN)6] + 4KCl |
Кислый ферроцианид алкил- или ариламмония выпадает в осадок.
Реакция с иодистым метилом. Третичные амины дают с иодистым метилом легко кристаллизующиеся соли четвертичных аммониевых оснований:
R3N + Ch4I à R3(Ch4)N+I-
studopedia.net
| Вещество, функциональная группа | Реактив | Схема реакции | Характерные признаки |
| Непредельные углеводороды (алкены, алкины, диены), кратные связи | р-р KMnO4 (розовый) | СН2=СН2 + Н2О + КMnO4 → КОН + MnO2↓+ СН2(ОН)-СН2(ОН) | обесцвечивание р-ра |
| р-р I2 (бурый) | СН2=СН-CН3 + I2 → СН2(I)-СН(I)-Ch4 | обесцвечивание р-ра | |
| р-р Br2 (желтый) | СН2=СН2 + Br2 → СН2(Br)-СН2(Br) | обесцвечивание р-ра | |
| Ацетилен | аммиачныйр-р Ag2O | СН≡СН + [Ag(Nh4)2]OH → AgC≡CAg↓ + Nh4↑ + h3O | образование осадка желтого цвета (взрывоопасен) |
| Бензол | нитрующая смесь HNO3 + h3SO4 | t0C, h3SO4(конц.) C6Н6 + HNO3 → C6H5-NO2 + h3O | образование тяжелой жидкости светло-желтого цвета с запахом горького миндаля |
| Толуол | р-р KMnO4 (розовый) | C6Н5-СН3 + KMnO4 + h3SO4 → C6H5-COOH + h3O + K2SO4 + MnSO4 | обесцвечивание р-ра |
| Фенол (карболовая кислота) | р-р FeCl3 (светло-желтый) | C6H5OH + FeCl3 → (C6H5O)3Fe + HCl | окрашиваниер-ра в фиолетовый цвет |
| насыщенный р-р Br2 (бромная вода) | C6H5OH + Br2 → C6h3Br3OH↓ + HBr | образование белого осадка со специфическим запахом | |
| Анилин (аминобензол) | р-р хлорной извести CaOCl2 (бесцветный) |
| |
| Этанол | насыщенный р-р I2 + р-р NaOH | C2H5OH + I2 + NaOH → CHI3↓ + HCOONa + NaI + h3O | образование мелкокристаллического осадка СНI3 светло-желтого цвета со специфическим запахом |
| CuO (прокаленная медная проволока) | C2H5OH + CuO → Cu↓ + Ch4-CHO + h3O | выделение металлической меди, специфический запах ацетальдегида | |
| Гидроксогруппа (спирты, фенол, гидроксикислоты) | Металлический Na | R-OH + Na → R-O—Na+ + h3↑ C6H5-OH + Na → C6H5-O—Na+ + h3↑ | выделение пузырьков газа (Н2), образование бесцветной студенистой массы |
| Эфиры (простые и сложные) | Н2О (гидролиз) в присутствии NaOH при нагревании | Ch4-C(O)-O-C2H5 + h3O ↔ Ch4COOH + C2H5OH | специфический запах |
| Многоатомные спирты, глюкоза | Свежеосажденный гидроксид меди (II) в сильно щелочной среде |
| ярко-синее окрашивание р-ра |
| Карбонильная группа – СНО (альдегиды, глюкоза) | Аммиачный р-р Ag2O | R-CHO + [Ag(Nh4)2]OH → R-COOH + Ag↓ + Nh4↑ + h3O | образование блестящего налета Ag («серебряное зеркало») на стенках сосудов |
| Свежеосажденный Сu(OH)2 | R-CHO + Cu(OH)2 → R-COOH + Cu2O↓ + h3O | образование красного осадка Сu2O | |
| Карбоновые кислоты | лакмус |
| окрашивание р-ра в розовый цвет |
| р-р Na2CO3 | R-COOH + Na2CO3 → R-COO—Na+ + h3O + CO2↑ | выделение СО2 | |
| спирт +h3SO4 (КОНЦ.) | R-COOH + HO-R1 ↔ RC(O)OR1 + h3O | специфический запах образующегося сложного эфира | |
| Муравьиная кислота | лакмус |
| окрашивание р-ра в розовый цвет |
| Свежеосажденный Сu(OH)2 | HCOOH + Cu(OH)2 → Cu2O↓ + h3O + CO2↑ | образование красного осадка Сu2O | |
| аммиачныйр-р Ag2O | HCOOH + [Ag(Nh4)2]OH → Ag↓ + h3O + CO2↑ | «серебряное зеркало» на стенках сосуда | |
| Олеиновая кислота | р-р KMnO4 (розовый) или I2 (бурый) или Br2 (желтый) | C17h43COOH + KMnO4 + h3O → C8h27-CH(OH)-CH(OH)-(Ch3)7-COOH + MnO2↓ + KOH
C17h43COOH + I2 → C8h27-CH(I)-CH(I)-(Ch3)7-COOH | обесцвечивание р-ра |
| Ацетаты (соли уксусной кислоты) | р-р FeCl3 | Ch4COONa + FeCl3 → (Ch4COO)3Fe + NaCl | окрашивание р-ра в красно-бурый цвет |
| Стеарат натрия (мыло) | Н2О (гидролиз) + фенолфталеин | C17h45COONa + h3O ↔ C17h45COOH↓ + NaOH | окрашивание р-ра в малиновый цвет |
| насыщенный р-р соли кальция | C17h45COONa + Ca2+ ↔ (C17h45COO)2Ca↓ + Na+ | образование серого осадка | |
| Концентрированная неорганическая кислота | C17h45COONa + H+ ↔ C17h45COOH↓ + Na+ | образование белого осадка | |
| Белок | пламя | реакция горения | запах «паленого», жженых перьев |
| НNO3 (конц.);t, °С | ксантопротеиновая реакция (происходит нитрование бензольных колец в молекуле белка) | без нагревания – появляется желтое окрашивание р-ра; при нагревании и добавлении раствора аммиака белок окрашивается в желтый цвет | |
| Свежеосажденный Сu(OH)2 | биуретовая реакция (образуется комплексное соединение) | сине-фиолетовое окрашивание р-ра |
himege.ru
Простые эфиры – легколетучие жидкости (низшие) с характерным запахом. Качественной реакцией на простые эфиры является реакция с иодистоводородной кислотой:
СН3-О-СН3 + 2НJ ® 2Ch4J + h3O
C6H5-O-Ch4 + HJ ® C6H5OH + Ch4J
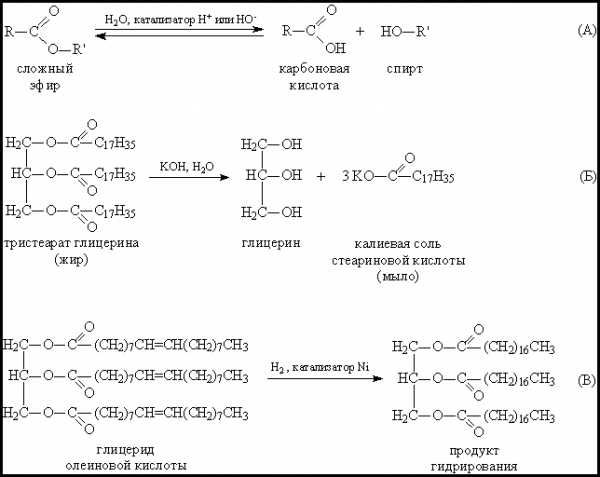
Качественной реакцией на сложные эфиры является реакция с водой. Они легко омыляются.
Нитросоединения первичные и вторичные могут давать изонитроформу:
O OH
R-Ch3-N ® R-CH = N
O O
O OH
R2 – CH N ® R2 –C = N
В щелочной среде получаются соли первичных нитросоединений с красной окраской, соли вторичных – с синей. Третичные нитросоединения не дают изонитроформу.
Нитросоединения различaются по отношению к действию азотистой кислоты. Первичные превращаются в нитрооксимы или нитроловую кислоту; вторичные – в нитрозонитрокислоту:
R-CH = N(O)ONa + NaNO2 + h3SO4 ® Na2SO4 + R –C (NO2) = NOH + NO2
R2 –C = N (O) – ONa + NaNO2 + h3SO4 ® h3O + Na2SO4 + R2-C=N (O) –NO2
Для открытия нитросоединений пользуются реакцией восстановления их до аминов. Восстановление проводят в кислой или щелочной средах. В качестве восстановителя используют атомарный водород (водород в момент выделения).
Нитросоединения ароматического ряда открывают цветными реакциями с алюмогидридом лития (окраска от розовой до фиолетовой) или с безводным бромистым алюминием ( оранжевая или фиолетовая окраска).
Качественные реакции на аминогруппу позволяют различить ароматические и жирные амины, а также первичные, вторичные и третичные.
Ароматические и алифатические амины различаются по основности. Более сильные основания – алифатические амины.
По отношению к действию азотистой кислоты можно различить первичные , вторичные и третичные амины.
Первичные амины жирного ряда образуют спирты, а ароматические – диазосоединения:
СН3-Nh3 + NaNO2 + h3SO4 ® Na2SO4 + h3O + Ch4OH + N2
C6H5- Nh3 + NaNO2 + 2HCl ® [C6H5 N = N]Cl + NaCl + 2h3O
Вторичные амины дают нитрозоамины:
Ch4- NH- Ch4 + HONO ® Ch4 – N- Ch4 + h3O
NO
Ароматические амины реагируют аналогично. Разница только в том, что под действием минеральных кислот от азота нитрозогруппа переходит в бензольное кольцо в пара-положение:
C6H5-NH – C6H5 + HONO ® C6H5-N(NO) –C6H5 ®O=N-C6h5-NH-C6H5
Третичные амины жирного ряда с азотистой кислотой не взаимодействуют или осмоляются. Ароматические амины взаимодействуют за счет водорода бензольного кольца:
Нитрозогруппу распознают по реакции Либермана. Если нитрозоамин смешать с фенолом в кислой среде, то появляется зеленая окраска. Если вылить раствор в воду – розовая окраска, в раствор КОН – зеленая окраска.
31.2.Экспериментальная часть
Реактивы и материалы: отдельные представители всех классов органических соединений; бромная вода, насыщенный раствор; раствор Br2 в CCl4; 2%-ный раствор KMnO4; аммиачный раствор оксида серебра ; аммиачный раствор однохлористой меди; металлический натрий; водный раствор NaOH; спиртовый раствор NaOH; раствор FeCl3; раствор НСl, раствор NaNO2; солянокислый гидроксиламин; раствор CuSO4; нитропруссид натрия; универсальная индикаторная бумага, фильтровальная бумага
Пробирки, штативы для пробирок, спиртовки, держатели для пробирок, водяные бани
studfiles.net
| Соединение, функциональная группа | Реагент | Что наблюдается, уравнение реакции |
| Алкены>C=C< | Водный раствор KMnO4 | Наблюдают исчезновение фиолетовой окраски KMnO4 и образование хлопьевидного осадка диоксида марганца бурого цвета 3 >C=C< + 2KMnO4 + 4h3O → 3 >C(OH)-C(OH)< + 2MnO2↓ + 2KOH |
| Раствор Br2 в органическом растворителе или воде (бромная вода) | Исчезает желто-коричневая окраска раствора брома из-за протекания реакции: >C=C< + Br2 → >C(Br)=C(Br)< | |
| Алкины -С≡С- | Раствор Br2 в органическом растворителе или воде (бромная вода) | Исчезает желто-коричневая окраска раствора брома из-за протекания реакции: R-С≡С-R’ + 2Br2 → R-CBr2-CBr2-R’ |
| Водные растворы аммиачных комплексов Ag(I), например, аммиачный раствор оксида серебра [Ag(Nh4)2]OH | Алкины с тройной связью на конце молекулы дают желтый осадок: R-С≡СН + [Ag(Nh4)2]OH → R-С≡СAg↓ + 2Nh4 + h3O Алкины, у который при тройной связи нет атомов водорода в такую реакцию не вступают | |
| Водный раствор аммиачных комплексов одновалентной меди Cu(I), например, аммиачный раствор оксида меди (I) [Cu(Nh4)2]OH | Алкины с тройной связью на конце молекулы дают красный осадок : R-С≡СН + [Cu(Nh4)2]OH → R-С≡СCu↓ + 2Nh4 + h3O Алкины, у которых при тройной связи нет атомов водорода в такую реакцию не вступают, что позволяет отличить их друг от друга | |
| Бензол | Нитрующая смесь – смесь конц. азотной и серной кислот | Образование желтой жидкости с запахом горького миндаля на дне реакционной смеси |
| Гомологибензола | Нейтральный водный раствор KMnO4 | При кипячении с каким-либо гомологом бензола водный раствор перманганата калия обесцвечивается и выпадает бурый осадок оксида марганца (IV). На примере с толуолом и этилбензолом реакции выглядят следующим образом: C6H5Ch4 +2KMnO4 = C6H5COOK + 2MnO2↓ + KOH + h3O (при кипячении) C6H5Ch3Ch4 + 4KMnO4 = C6H5COOK + K2CO3 + 2h3O + 4MnO2↓ + KOH (при нагревании) |
| Подкисленный водный раствор перманганата калия KMnO4(водн.), H+ | Постепенное обесцвечивание подкисленного раствора KMnO4. Выпадения бурого осадка MnO2 не наблюдается, поскольку марганец восстанавливается до практически бесцветной соли двухвалентного марганца. Чаще всего в качестве подкислителя изпользуют серную кислоту. На примере с толуолом реакция выглядит следующим образом: 5C6H5Ch4 + 6KMnO4 + 9h3SO4 → 5C6H5COOH + 6MnSO4 + 3K2SO4 +14h3O | |
| Фенол | Бромная вода | Исчезновение желто-коричневой окраски бромной воды с одновременным выпадением белого осадка трибромфенола: |
| Разбавленный водный раствор соли железа (III), например, FeCl3 | Светло-желтая окраска разбавленного раствора соли трехвалентного железа сменяется на фиолетовую | |
| Анилин | Бромная вода | Исчезновение желто-коричневой окраски бромной воды с одновременным выпадением белого осадка триброманилина: |
| Одноатомные первичные и вторичные спирты Ch4OH, C2H5OH,(Ch4)2CH-OH и т.д. | Оксид меди (II) CuO | Черный CuO при нагревании со спиртом изменяет свою окраску на красную в связи с восстановлением до Cu0. Первичный спирт при этом превращается в альдегид: R-Ch3-OH + CuO =to=> R-CHO + Cu + h3O, вторичный — в кетон: R-C(OH)-R’+ CuO =to=> R-C(O)-R’ + Cu + h3O, В случае метанола появляется легко узнаваемый запах формальдегида (естественно, чтобы он был узнаваемым, нужно до этого быть знакомым с его запахом:-) ) В случае реакции с CuO этилового спирта чувствуется специфический запах ацетальдегида, схожий с ароматом прелых яблок сорта «антоновка» |
| Многоатомные спирты | Свежеосажденный Cu(OH)2 (II) | Растворение голубого осадка Cu(OH)2 с образование ярко-синего раствора комплексного соединения меди. На примере с глицерином уравнение реакции выглядит следующим образом: |
| Альдегиды, —CHO | Аммиачный раствор оксида серебра [Ag(Nh4)2]OH | Так называемая реакция серебряного зеркала. В результате восстановления Ag+1 в металлическое серебро Ag0 на стенках сосуда образуется зеркало. При небрежном смешении реагентов или в недостаточно чистом сосуде вместо серебряного зеркала может образоваться черный осадок, состоящий из мелкодисперсных частиц металлического серебра. В обоих случаях наблюдаемые явления описываются уравнением в общем виде: R-CHO + 2[Ag(Nh4)2]OH = R-СООNh5 + 2Ag↓ + 3Nh4↑ + h3O |
| Свежеосажденный Cu(OH)2 | Образование оранжево-красного осадка Cu2O при нагревании в результате реакции: R-CHO + 2Cu(OH)2 = R-COOH + Cu2O↓ + 2h3O | |
| Карбоновые кислоты, -COOH | Лакмус | Окрашивание лакмуса в красный цвет |
| Карбонаты, например, K2CO3 | Выделение углекислого газа в результате разложения образующейся нестойкой угольной кислоты h3CO3: 2R-COOH + CO32- → CO2 + h3O + R-COO— | |
| Спирт + конц. h3SO4 | Появление запаха сложного эфира, образующегося в результате реакции: R-COOH + R’-OH → R-COO-R’ + h3O Запахи эфиров весьма разнообразны, но общим является ярко выраженная пахучесть, нередко, могут напоминать ароматы различных фруктов. | |
| Муравиная кислота -СНО и -СООН | Лакмус | Окрашивание лакмуса в красный цвет, по причине кислой среды, создаваемой муравьиной кислотой: HCOOH ↔ HCOO— + H+ |
| Аммиачный раствор оксида серебра [Ag(Nh4)2]OH | Молекуле муравьиной кислоты, не смотря на ее малый размер удается сочетать в себе помимо карбоксильной группы также и карбонильную, которая позволяет вступать муравьиной кислоте в реакцию серебряного зеркала подобно альдегидам: HCOOH + 2[Ag(Nh4)2]OH → 2Ag↓ + 4Nh4↑ + CO2↑ + 2h3O | |
| Растворимые соли жирных карб. кислот, например, стеарат натрия Ch4(Ch3)16COONa (мыло) | Любая сильная неорганическая кислота или кислота средней силы h3SO4 (разб.) HCl HI HBr HNO3(разб.) h4PO4 | Выпадение хлопьевидного белого осадка малорастворимой жирной кислоты: Ch4(Ch3)16COONa + H+ → Na+ + Ch4(Ch3)16COOH |
| Раствор соли Ca или Mg | Выпадение белого осадка нерастворимой кальциевой или магниевой соли жирной кислоты. Ионное уравнение в общем виде: 2R-COO— + Ca2+ → (R-COO)2Ca↓, где R-длинный углеводородный радикал. На примере, стеарата натрия и хлорида кальция молекулярное уравнение реакции выглядит так: 2Ch4(Ch3)16COONa + CaCl2 → (Ch4(Ch3)16COONa)2Ca↓ | |
| Фенолфталеин | Окрашивание фенолфталеина в малиновый цвет как в щелочах, ввиду того, что соли жирных кислот гидролизуются по аниону: Ch4(Ch3)16COO— + h3O → Ch4(Ch3)16COOH + OH— | |
| Олеиновая кислота, -COOH; >C=C< | Водный раствор KMnO4(водн.) | Наблюдают исчезновение фиолетовой окраски KMnO4 и образование хлопьевидного осадка оксида марганца бурого цвета MnO2 3>C=C< + 2KMnO4 + 4h3O → 3>C(OH)-C(OH)< + 2MnO2↓ + 2KOH |
| Раствор Br2 в орг. растворителе или воде (бромная вода) | Исчезает желто-коричневая окраска раствора брома из-за протекания реакции (указан структурный фрагмент молекулы олеиновой кислоты): >C=C< + Br2 → C(Br)=C(Br)< | |
| Раствор щелочи, например, NaOH | Олеиновая кислота, будучи практически нерастворимой в воде жирной кислотой, растворяется в водных растворах щелочей: C17h43COOH + NaOH → C17h43COONa + h3O | |
| Глюкоза, -CHO -C(OH)-C(OH)- | Аммиачный раствор оксида серебра [Ag(Nh4)2]OH | Глюкоза относится к так называемым альдегидоспиртам, т.к. ее молекулы содержат альдегидную группу и 5 гидроксильных групп. Поэтому она вступает в реакцию «серебряного зеркала» |
| Свежеосажденный Cu(OH)2 | Если раствор глюкозы прибавить к свежеосажденному гидроксиду меди без нагревания наблюдается растворение осада гидроксида меди и образование синего раствора. В этом случае глюкоза реагирует как многоатомный спирт — с образованием растворимых комплексов меди.Если же полученный синий раствор нагреть, выпадает оранжево-красный осадок одновалентного оксида меди Cu2O. При этом глюкоза реагирует как альдегид — альдегидная группа молекулы глюкозы окисляется до карбоксильной — образуется глюкуроновая кислота. | |
| Крахмал | Йод, I2 | Появление синей окраски |
| Белок | концентрированная азотная кислота НNО3(конц.) | Ксантопротеиновая реакция Появление ярко-желтого окрашивания по причине нитрования бензольных колец молекул белка |
| Свежеосажденный Cu(OH)2 | Появляется сине-фиолетовое окрашивание раствора в следствие образование комплексов меди (II) с белком |
scienceforyou.ru
| Вещество, функциональная группа | Реактив | Схема реакции | Характерные признаки |
| Непредельные углеводороды (алкены, алкины, диены), кратные связи | р-р KMnO4 (розовый) | СН2=СН2 + Н2О + КMnO4 → КОН + MnO2↓+ СН2(ОН)-СН2(ОН) | обесцвечивание р-ра |
| р-р I2 (бурый) | СН2=СН-CН3 + I2 → СН2(I)-СН(I)-Ch4 | обесцвечивание р-ра | |
| р-р Br2 (желтый) | СН2=СН2 + Br2 → СН2(Br)-СН2(Br) | обесцвечивание р-ра | |
| Ацетилен |
аммиачный р-р Ag2O |
СН ≡СН + (Ag(Nh4)2)OH → AgC≡CAg↓ + Nh4↑ + h3O |
образование осадка желтого цвета (взрывоопасен) |
| Бензол | нитрующая смесь HNO3 + h3SO4 |
t0C, h3SO4(конц.) C6Н 6 + HNO3 → C6H5-NO2 + h3O |
образование тяжелой жидкости светло-желтого цвета с запахом горького миндаля |
| Толуол | р-р KMnO4 (розовый) |
C6Н 5 -СН 3 + KMnO4 + h3SO4 → C6H5-COOH + h3O + K2SO4 + MnSO4 |
обесцвечивание р-ра |
| Фенол (карболовая кислота) | р-р FeCl3 (светло-желтый) |
C6H5OH + FeCl3 → (C6H5O)3Fe + HCl |
окрашивание р-ра в фиолетовый цвет |
| насыщенный р-р Br2 (бромная вода) |
C6H5OH + Br2 → C6h3Br3OH↓ + HBr |
образование белого осадка со специфическим запахом | |
| Анилин (аминобензол) | р-р хлорной извести CaOCl2 (бесцветный) |
|
окрашивание р-ра в фиолетовый цвет |
| Этанол |
насыщенный р-р I2 + р-р NaOH |
C2H5OH + I2 + NaOH → CHI3↓ + HCOONa + NaI + h3O |
образование мелкокристалличес-кого осадка СНI3 светло-желтого цвета со специфическим запахом |
| CuO (прокаленная медная проволока) |
t0C
C2H5OH + CuO → Cu↓ + Ch4-CHO + h3O |
выделение металлической меди, специфический запах ацетальдегида | |
| Гидроксогруппа (спирты, фенол, гидроксикислоты) | Металличес-кий Na |
R-OH + Na → R-O-Na+ + h3↑ t0C C6H5-OH + Na → C6H5-O-Na+ + h3↑ |
выделение пузырьков газа (Н2), образование бесцветной студенистой массы |
| Эфиры (простые и сложные) | Н2О (гидролиз) в присутствии NaOH при нагревании |
Ch4-C(O)-O-C2H5 + h3O ↔ Ch4COOH + C2H5OH |
специфический запах |
| Многоатомные спирты, глюкоза | Свежеосаж-денный гидроксид меди (II) в сильно щелочной среде |
OH- Ch3(OH)-CH(OH)-Ch3(OH) + Cu(OH)2 → h3O + Ch3-O- -O-Ch3
|
ярко-синее окрашивание р-ра |
| Карбонильная группа – СНО (альдегиды, глюкоза) |
Аммиачный р-р Ag2O |
t0C R-CHO + (Ag(Nh4)2) OH → R-COOH + Ag↓ + Nh4↑ + h3O |
образование блестящего налета Ag («серебряное зеркало») на стенках сосудов |
| Свежеосаж-денный Сu(OH)2 |
t0C
R-CHO + Cu(OH)2 → R-COOH + Cu2O↓ + h3O |
*Гидроксид меди II восстанавливается до гидроксида меди I (желтого цвета, а затем он распадается на Сu2O(осадок красного цвета) и воду | |
| Карбоновые кислоты | лакмус |
|
окрашивание р-ра в розовый цвет |
| р-р Na2CO3 |
R-COOH + Na2CO3 → R-COO-Na+ + h3O + CO2↑ |
выделение СО2 | |
|
спирт + h3SO4 (КОНЦ.) |
t0C R-COOH + HO-R1 ↔ RC(O)OR1 + h3O |
специфический запах образующегося сложного эфира | |
| Муравьиная кислота | лакмус |
|
окрашивание р-ра в розовый цвет |
| Свежеосаж-денный Сu(OH)2 |
t0C
HCOOH + Cu(OH)2 → Cu2O↓ + h3O + CO2↑ |
образование красного осадка Сu2O | |
|
аммиачный р-р Ag2O |
t0C
HCOOH +OH → Ag↓ + h3O + CO2↑ |
«серебряное зеркало» на стенках сосуда | |
| Олеиновая кислота | р-р KMnO4 (розовый) или I2 (бурый) или Br2 (желтый) |
C17h43COOH + KMnO4 + h3O → C8h27-CH(OH)-CH(OH)-(Ch3)7-COOH + MnO2↓ + KOH
C17h43COOH + I2 → C8h27-CH(I)-CH(I)-(Ch3)7-COOH |
обесцвечивание р-ра |
| Ацетаты (соли уксусной кислоты) | р-р FeCl3 |
Ch4COONa + FeCl3 → (Ch4COO)3Fe + NaCl |
окрашивание р-ра в красно-бурый цвет |
| Стеарат натрия (мыло) | Н2О (гидролиз) + фенолфта-леин |
C17 h45 COONa + h3 O ↔ C17 h45 COOH↓ + NaOH |
окрашивание р-ра в малиновый цвет |
| насыщенный р-р соли кальция |
C17h45COONa + Ca2+ ↔ (C17h45COO)2Ca↓ + Na+ |
образование серого осадка | |
| Концентри-рованная неорганичес-кая кислота |
C17 h45 COONa + H+ ↔ C17 h45 COOH↓ + Na+ |
образование белого осадка | |
| Белок | пламя |
реакция горения |
запах «паленого», жженых перьев |
|
НNO3 (конц.); t, °С |
ксантопротеиновая реакция (происходит нитрование бензольных колец в молекуле белка) |
без нагревания –
появляется желтое окрашивание р-ра; при нагревании и добавлении раствора аммиака белок окрашивается в желтый цвет |
|
| Свежеосаж-денный Сu(OH)2 |
биуретовая реакция (образуется комплексное соединение) |
сине-фиолетовое
окрашивание р-ра |
biofile.ru
Качественные реакции сложных эфиров
В анализе сложных эфиров R-COOR' используется их способность к гидролизу и замещению алкоксильной группы другими остатками. Большинство сложных эфиров обладает характерным запахом и не растворимо в воде. Однако эти признаки не могут служить критерием для отнесения веществ к классу сложных эфиров, так как известны вещества со сходным запахом, а неполные эфиры многоатомных спиртов обычно растворимы в воде.
Реакция с гидроксиламином. При взаимодействии сложного эфира с гидроксиламином протекает образование гидроксамовой кислоты:
| O O R – C +h3NOH → R – C + R`OH OR` NHOH |
Гидроксамовые кислоты образуют с FeCl3 интенсивно окрашенные соединения:
Применение этой качественной реакции ограничено, так как еедают также галогенангидриды и ангидриды кислот и некоторые дру-гие соединения.
Качественные реакции аминов
Качественное и количественное определение аминов базируется главным образом на их основности, а также на подвижности атомов водорода, связанных с азотом. Для аминов ароматического ряда используется также реакционная способность атомов водорода ароматического ядра, находящихся в п-положении. Если азотсодержащее вещество значительно лучше растворимо в соляной кислоте, чем в воде, или содержит ион Hal- или другой анион, то это может быть амин или соль амина. Дальнейшие уточнения ведутся с помощью следующих реакций.
Реакция с HNO2. Первичные алифатические амины при действии азотистой кислоты превращаются в соответствующие спирты, при этом выделяется азот (проба не вполне надежна, так как HNO2 разлагается с образованием NO и NO2 ):
| R – Nh3 + HONO → ROH + N2 + h3O |
Ароматические амины превращаются в диазосоединения, которые дают азокрасители (например, с β-нафтолом):
| Ar – Nh3 + NaNO2 + 2HCl → ArN2Cl + 2h3O ArN2Cl + β –C10H7ONa → ArN = NC10H6OH + NaCl |
Вторичные амины, как алифатические, так и ароматические, при действии азотистой кислоты образуют нитрозамины, которые могут быть обнаружены по характерной реакции:
| R2NH + HONO → R2N – N = O + h3O Ar2NH = HONO → Ar2N – N = O + h3O |
Чисто алифатические и чисто ароматические третичные амины не реагируют с азотистой кислотой. Жирноароматические третичные амины при обработке HNO2 образуют С-нитрозосоединения:
Реакция с n-толуолсульфохлоридом. Первичные, вторичные и третичные амины можно различить также по реакции с n-толуолсульфохлоридом. Первичные амины, как жирные, так и ароматические, реагируют, образуя замещенные n-толуолсульфамиды:
| Ch4C6h5SO2Cl + RNh3 → Ch4C6h5SO2NHR + HCl |
Такие амиды растворимы в избытке едкого натра:
| Ch4C6h5SO2NHR + NaOH → Ch4C6h5SO2NNaR +h3O |
Вторичные амины реагируют по той же схеме, но образующиеся в этом случае амиды Ch4C6h5SO2NR2 не растворяются в растворах NaOH. Третичные амины и соли четвертичных аммониевых оснований не реагируют с п-толуолсульфохлоридом.
Реакция с хингидроном. Амины дают многочисленные цветные реакции, которые не являются вполне надежными методами классификации амидов, но могут с успехом применяться как ориентировочные. Одной из таких реакций является реакция с хингидроном. Окраска полученной реакционной смеси зависит от характера амина. Первичные амины дают пурпурную окраску, вторичные — красную, третичные — оранжево-желтую.
Изонитрильная проба.Изонитрильную пробу дают только первичные амины:
| RNh3 + CHCl3 + 3NaOH → R – N → C + 3NaCl + 3h3O |
Появление характерного неприятного запаха свидетельствует об образовании изонитрила. Изонитрилы разрушаются концентрированной НСl.
Реакция с кислым ферроцианидом калия.Для третичных аминов всех типов характерна реакция с комплексными ионами, в частности с кислым ферроцианидом калия:
| 2R3N + K4 [Fe(CN)6] + 4HCl → (R3NH)2h3[Fe(CN)6] + 4KCl |
Кислый ферроцианид алкил- или ариламмония выпадает в осадок.
Реакция с иодистым метилом. Третичные амины дают с иодистым метилом легко кристаллизующиеся соли четвертичных аммониевых оснований:
R3N + Ch4I à R3(Ch4)N+I-
Качественные реакции нитросоединений
В качественном и количественном анализе нитросоединений одной из важнейших реакций является восстановление в амины. Эту реакцию дают все нитросоединения. Первичные и вторичные нитросоединения жирного ряда обладают также свойствами С-Н-кислот. Третичные нитросоединения жирного ряда и ароматические нитросоединения этих реакций не дают.
| RNO2 + 6«H» → RNh3 + 2h3O |
Реакция с азотистой кислотой. Характерной качественной реакцией на первичные и вторичные нитросоединения является реакция с азотистой кислотой.
| R – Ch3 – NO2 + NOHO → R – C – NO2 + h3O || NOH R – C – NO2 + NaOH → R – C – NO2 + h3O || || NOH NONa |
Вторичные нитросоединения с азотистой кислотой дают так называемые псевдонитролы, которые в расплавах и в растворах органических растворителей имеют бирюзовую окраску:
| R2CHNO2 + HONO → R2C – NO2 + h3O | N=O |
Для третичных алифатических нитросоединений специфических реакций обнаружения не имеется.
Обнаружение ароматических нитросоединений.Ароматические нитросоединения обычно окрашены в бледно-желтый цвет. При наличии других заместителей интенсивность и глубина окраски часта усиливается. Для обнаружения ароматических нитросоединений их восстанавливают в первичные амины, последние диазотируют и сочетают с β-нафтолом:
| ArNO2 →ArNh3 → ArN2Cl → ArN=N |
Эта реакция, однако, не является специфической, так как амины образуются при восстановлении не только нитросоединений, но и нитрозо-, азоокси-и гидразосоединений. Для того чтобы сделать окончательный вывод о наличии в соединении нитрогруппы, нужно провести количественное определение.
Качественные реакции N-нитрозосоединений
Реакция с HI. С-Нитрозосоединения можно отличить от N- нитрозосоединений по их отношению к подкисленному раствору йодистого калия: С-нитрозосоединения окисляют иодистоводородную кислоту, N-нитрозосоединения с иодистоводородной кислотой не реагируют.
Реакция с первичными ароматическими аминами. С-Нитрозосоединения конденсируются с первичными ароматическими аминами, образуя окрашенные азосоединения:
| ArN = O + h3N – Ar → Ar – N = N – Ar + h3O |
Гидролиз N-нитрозосоединений. Чистоароматические и жирноароматические N-нитрозосоединения (нитрозамины) легко гидролизуются спиртовыми растворами НСl, образуя вторичный амин и азотистую кислоту. Если гидролиз вести в присутствии а-нафтиламина, то последний диазотируется образующейся азотистой кислотой, а диазосоединение вступает в реакцию азосочетания с избыточным а-нафтиламином. Образуется азокраситель:
Реакционная смесь окрашивается в розовый цвет; постепенно окраска становится пурпурной.
stydopedya.ru
Эфиры сложные, анализ качественный - Справочник химика 21
Этерификации Органические кислоты Сложные эфиры — 300 Качественный анализ кислот Азот, аргон гелий [c.177]
Если известны удерживаемые объемы или соответственно времена удерживания веществ, их можно идентифицировать методом газовой хроматографии (качественный анализ). Для гомологического ряда органических соединений, например парафинов, спиртов, сложных эфиров и т. д., установлена линейная зависимость между логарифмами значений удерживаемых объемов и числом групп СНг в молекулах, что также дает возможность провести качественный анализ веществ внутри каждого гомологического ряда. [c.245]
Получение эфиров бензойной кислоты алкоголизом бензоилхлорида по Шоттен — Бауману (общая методика для качественного анализа). В пробирке растворяют или суспендируют 0,5 т спирта в 5 мл воды, прибавляют 1 каплю раствора Метилового красного в ацетоне и 1 мл свежеперегнанного бензоилхлорида. Затем по каплям постепенно прибавляют 5 л. КОН. После прибавления каждой порции пробирку закрывают пробкой и сильно встряхивают, пока желтая окраска индикатора не перейдет в красную. Прибавление раствора едкого калн и встряхивание продолжают до тех пор, когда появится неисчезающая желтая окраска и исчезнет запах бензоилхлорида. Образовавшийся сложный эфир отсасывают, промывают небольшим количеством воды и перекристаллизовывают. Жидкие [c.81]
На основании комплексного качественного и количественного анализа сложных низкомолекулярных летучих продуктов окисления высших моноолефинов методами ИК-спектроскопии и хромато-масс-спект-рометрии, в летучих продуктах жидкофазного окисления промышленных фракций а-олефинов идентифицированы следующие классы органических соединений углеводороды (предельные, непредельные, ароматические), альдегиды, спирты, кислоты, эфиры, перекиси. Основными компонентами легколетучих продуктов окисления являются альдегиды (до 87%), представленные главным образом соединениями, содержащими два или три углеродных атома в молекуле. За ними в количественном отношении следуют гидроксилсодержащие соединения и углеводороды, содержание которых с увеличением глубины окисления растет от 5—8% до 12—15% мол. Данные по составу летучих продуктов также представляют интерес для выяснения механизма жидкофазного окисления а-олефинов. [c.57]
При определении углеродного скелета молекулы методом хроматографии от молекулы отщепляют функциональные группы и насыщают ее кратные связи. Подобный метод, описанный в недавно вышедшем обзоре [23], применяли в анализах большого числа различных соединений кислот, спиртов, альдегидов, ангидридов, простых и сложных эфиров, эпоксисоединений, кетонов, аминов, амидов, алифатических и ароматических углеводородов, нитрилов, сульфидов, галогенидов, олефинов и соединений других типов. Область применения этого метода очень широка и потому он обсуждается именно в этом общем разделе, а не в главах, посвященных анализам отдельных функциональных групп. Сам по себе этот метод дает качественные результаты, но его можно использовать и в количественных определениях. Однако основным применением этого метода является определение структуры, для которого часто необходимы количественные анализы функциональных групп. В определении химической структуры молекул важен метод, основанный на индексах удерживания углеродного [c.433]
В некоторых случаях компонент неизвестной смеси не может быть получен в чистом виде для непосредственного сравнения удерживаемых объемов или относительных удерживаний. Однако и в этих случаях при наличии двух или большего числа членов того же гомологического ряда объем удерживания может быть надежно найден графическим путем или математическим расчетом. Джеймс и Мартин [27] впервые обратили внимание на то, что график зависимости логарифма приведенного удерживаемого объема от числа углеродных атомов в каждом члене гомологического ряда представляет почти прямую линию. Многие авторы показали, что и другие гомологические ряды дают аналогичные прямолинейные графики. Примеры, взятые из работы Рэя [48], для гомологических рядов нормальных парафинов, спиртов, сложных эфиров и кетонов представлены на рис. Х1-1. Такие графики часто оказываются ценными для качественного анализа, когда приходится определять удерживаемый объем недоступного соединения. [c.264]
Получение 3,5-динитробензойных эфиров ацидолизом эфиров карбоновых кислот (общая методика для качественного анализа). Смешивают около 0,5 Л1Л сложного эфира с 0,5 г тщательно измельченной 3,5-динитробензойной кислоты, прибавляют маленькую каплю концентрированной серной кислоты и нагревают с обратным холодильником 30 мин. В случае высококипящих эфиров нагревают до 150°. После охлаждения растворяют смесь в 30 лл эфира, освобождают от кислоты встряхиванием с избытком раствора соды (Повторяют два раза. Осторожно Сильное выделение углекислого газа, вспенивание ) и промывают водой. Остаток после упаривания эфира растворяют в возможно меньшем количестве спирта, фильтруют и добавляют воды до первого помутнения. При охлаждении выкристаллизовывается эфир динитробензойной кислоты. [c.406]
По числу наименований сложные эфиры занимают одно из первых мест среди синтетических душистых веществ и компонентов эфирных масел. Поэтому качественное открытие и количественное определение этих соединений представляет важную, а при анализе смесей и достаточно трудную задачу. [c.156]
Сложность строения многих алкалоидов сильно затрудняет определение их структуры. Прежде всего выясняют, содержит ли изучаемый алкалоид кислород или нет, для чего проводят качественный и количественный анализ, определяют молекулярный вес и устанавливают его молекулярную формулу. Если алкалоид оказался кислородсодержащим, устанавливают, в какой форме представлен в нем кислород для этого применяют ряд реакций, характеризующих ту или иную кислородсодержащую группу например, гидроксильную группу открывают с помощью хлорангидридов кислот или уксусным ангидридом, сложные эфиры — путем их омыления, простые эфиры — действием на них иодистого водорода, что приводит к образованию соответствующего галоидоалкила. [c.370]
Холестерин, один из наиболее распространенных стероидов, в чистом виде представляет собой бесцветное кристаллическое вещество (ромбические пластинки) с температурой плавления 150° С. В холестерине имеется вторичная спиртовая группа у третьего атома и двойная связь у пятого атома углерода (см. формулу на стр, 267). Химические свойства холестерина определяются этими функциональными группами. Например, холестерин образует сложные эфиры с жирными кислотами, находящимися в тканях, присоединяет водород, осаждается из растворов дигитонином. Йодное число холестерина составляет 65,8. Для определения холестерина в качественном и количественном анализах применяется несколько цветных реакций. Например, по методу Салковского раствор холестерина в хлороформе встряхивают с серной кислотой, при этом хлороформный слой окрашивается в красный цвет, а кислый слой приобретает зеленую флуоресцирующую окраску. [c.273]
С помощью газо-жидкостной хроматографии метиловых эфиров жирных кислот осуществляют количественный и качественный анализ сложных смесей кислот, а также их препаративное разделение [И, 13]. Преимуществами данного способа являются быстрота осуществления анализа, четкость деления компонентов, возможность проведения большого числа анализов (100 и более) без регенерации фаз, высокая чувствительность метода (до 1%), возможность автоматического управления процессом, достаточная точность результатов. С помощью данного метода достигается разделение жирных кислот по длине цепи и степени ненасыщенности, возможно также разделение структурных и геометрических изомеров. Точный количественный анализ высших жирных кислот стал доступен вследствие совершенствования техники ГЖХ и с введением масс-спектрометрической идентификации выделенных компонентов. [c.197]
Описан метод идентификации, пригодный для качественного анализа растворителей, заключающийся в том, что пик расшифровывается в процессе выхода. Метод применен для идентификации различных классов соединений (сложные эфиры, хлорпроизводные углеводороды, ароматич. углеводороды). Показано преимущество данного метода перед ИК-спектрометрией. [c.52]
Однако в идентификации таких важных продуктов реакции, как карбонилсодержащие соединения, имеются существенные трудности. ИК-полосы карбонильных групп в этих соединениях (альдегиды, кетоны, кислоты и сложные эфиры) в большинстве случаев не разрешаются и сливаются в одну широкую полосу в области 1700 см . Поэтому невозможно вести качественный и, следовательно, количественный анализ этих продуктов реакции. [c.253]
Смесь цис- п /гаракс-изомеров циклических диолов проанализирована на основе реакции с борной кислотой — последняя реагирует только с цис-гидроксильными группами [17]. Количественное определение простых моноэфиров гликолей основано главным образом на реакциях ацилирования и осуществляется так же, как и анализ гликолей. Сложные эфиры гликолей определяют качественно и количественно гидролизо.м щелочалш. После гидродиза раствор титруют соляной кислотой в присутствии фенолфталеина уменьшение содержания щелочи пропорционально количеству сложного эфира в пробе. Параллельно проводят холостой опыт [4, р. 981]. [c.340]
Ч1ротеииы с помощью кислотного, основного или ферментативного гидролиза могут расщепляться на простейшие составляющие — а-ами-нокарбоновые кислоты, обычно называемые просто а-аминокислотами. Ка.чественный анализ получающихся при этом смесей аминокислот связан с относительно большими трудностями. Э. Фишер (1901 г.) обрабатывал такие смеси спиртом и разделял образующиеся в результате смеси сложных эфиров а-аминокислот дробной перегонкой. В настоящее время эти соединения разделяют и идентифицируют методами газовой хроматографии. Использование ионообменной хроматографии позволяет разделить подобные смеси без предварительной этерификации. Существуют приборы, которые автоматически проводят качественный и количественный анализ смесей такого рода. При этом первоначально а-аминокислоты разделяются на ионообменных смолах, элюаты обрабатываются нингидрином, а образующиеся синие окрашенные вещества анализируются колориметрически, кривые поглощения записываются с помоп ью самописца. [c.647]
Для качественного определения гидроксильной группы в большнн стве случаев прибегают к образованию хорошо кристаллизующихся сложных эфиров. Этим же методом часто пользуются, чтобы соединение, содержащее гидроксильную группу, выделить из смеси с другими веществами. После омыления эфира можно идептифицировать кислотный остаток, входивший в соединение (уксусная кислота), или с помощью элементарного анализа определить состав полученного эфира. Необходимо отметить, что амины и меркаптаны при некоторых из нижеприведенных реакций также дают производные, содержащие кислотный остаток. [c.17]
Число гидроксильных групп, содержащихся в органическом соединении, может быть установлено путем количественно го элементарного анализа тех же производных, которые применялись при качественном определении для этого наиболее пригодны сложные эфиры (стр. 17). Если эфиры содержат азот, как напри.мер уретаны (стр. 28) и их производные, или эфиры нитробензойной кислоты, то часто можно ограничиться только определением азота точно так же достаточно определить содержание галоида в галоидосодержащих соединениях, как например зфирах бромбензойной кислоты или серы в содержащих серу сложных эфирах (стр. 22). В уретанах, полученных с помощью хлорангадрида карбаминовой кислоты, можно определить азот в виде аммиака путем отщепления его щелочью [c.58]
Для качественного анализа гликолей можно использовать специфические только для данного диола нерастворимые сложные и простые эфиры, которые образуются прп взаимодействии гликолей с некоторыми ароматическими соединен1шми. Это — сложные ди-эфпры бензойной, г-нитробензойной и 3,5-динитробензойной кислот сложные диэфиры Ь -замещенных карбаминовых кислот (уретаны) бис(трифенплметил)эфиры [6]. [c.336]
В первой четверти текущего столетия такая задача представлялась практически не выполнимой. Даже качественный анализ любого из перечисленных продуктов следовало оценивать как трудное и продолжительное исследование, в результате которого можно было получить весьма ограниченную информацию. Данные же о количественном составе можно было получить в основном лишь для тех или иных групп соединений, например, данные о содержании 2ЭВ, сложных эфиров, кетоков и т. д. В 1930—1940 гг. была разработана аналитическая ректификация. С ее помощью исследуемый продукт делили на большое число фракций приблизительно равного объема, рассчитывая таким путем получить чистые компоненты и ряд бинарных смесей с тем, чтобы потом установить их состав физическими методами. Результаты анализов отдельных фракций суммировали. В дальнейшем аналитическая ректификация непрерывно совершенствовалась. Физические методы анализа стали распространять и на тройные смеси терпенов [148, 322]. Внедрение аналитической ректификации в практику химических лабораторий позволило выполнить большинство перечисленных задач. Однако трудоемкость метода и продолжительность каждого из перечисленных исследований ограничивали его применение. [c.163]
При определении количественного и качественного состава кислородсодержащих соединений широко применяется инфракрасная спектроскопия благодаря наличию характеристических полос кислородных функциональных групп 3400—3600 см — валентные колебания атомов водорода гидроксильных групп кислот и фенолов, 1650—1740 см —валентные колебания карбонильной группы кислот, кетонов, сложных эфиров (лактонов), ангидридов кислот, амидов. Показано [49], что с помощью специфических химических реакций возможно провести идентификацию полос поглощения карбонильных групп различных классов соединений. Так, обработка карбоновых кислот бикарбонатом натрия приводит к образованию карбоксилатанионов, для которых характерно поглощение в области 1580—1610 см . Дальнейшая обработка образца гидроксидом натрия при нагревании вызывает омыление сложных эфиров, лактонов, ангидридов и образование карбоксилатанионов. В результате в области 1650— 1740 СМ наблюдается только поглощение кетонов. Пользуясь групповыми интегральными коэффициентами поглощения (для карбоновых кислот 1,24-10 л/(моль-см), сложных эфиров 1,15 10 кетонов 0,72-10 л/(моль-см) [50], можно определить концентрацию соединений каждого типа. Применение методов ИК-спектроскопии в исследованиях состава нефтей 51] позволило обнаружить и количественно оценить наличие карбоновых кислот, фенолов, амидов, 2-хинолонов. Отмечено, что точность анализа значительно снижается вследствие межмолекулярной ассоциации компонентов, что приводит к уменьшению интенсивности поглощения групп и занижению результатов. Повышение точности достигается разбавлением растворов и использованием в качестве растворителей тетрагидрофурана или дихлорметана. Однако более значительные ошибки возникают из-за неверной оценки молекулярных масс определяемых соединений и наличия в молекуле более одного гетероатома. Исправление этого положения возможно препаративным выделением одного класса соединений и установления коэффициента поглощения данной функциональной группы. [c.50]
Опксана конструкция высокотемпературного газового хроматографа, предназначенного для качественного разделения г. анализа высококипящих смесей органических веществ. При разделении смеси углеводородов, сложных эфиров и гликолей распределительные колонки работают в интервале температур 150—350 Детекторы для излкрения теплопроводности работают при температуре на 10 — 100" выше, чем колонки, что исключает конденсацию высококипящих компонентов. [c.73]
| Таблица 2.1. Характерисгическйе ионы, используемые для качественного анализа сложный эфиров (/), кислот |
Для качественного органического анализа предложен следующий метод пирогидролиза [4.507]. Пробу смешивают с соединениями, которые при нагревании теряют воду (дигидрат щавелевой кислоты, фталевая кислота или MnS04-4h30) и нагревают. При этом анилиды алифатических кислот, сложные ароматические эфиры и О- или N-ацетилсодержащие соединения гидролизуются, сложные ароматические эфиры образуют фенолы, галогензаме-щенные алифатические соединения дают галогенводороды, из сульфоновых кислот выделяется SO . [c.111]
Качественный анализ масс-спектров установил, что в продуктах пиролиза не содержатся насыщенные углеводороды— парафины и нафтены, однако не исключено присутствие алифатических и алициклических ненасыщенных углеводородов и кислородсодержащих соединений. На наличие кислородсодержащих соединений указывали пики характерных ]юнов с массой 45, 46, 59, 60, 61, 74 и 75. Эти соединения представляют собой, по-ви-димо.му, алифатические спирты, простые и (или) сложные эфиры и кетоны. Относительно высокая интенсивность пиков ионов с массой 78, 79, 93 и 94 позволяет предположить наличие в продуктах пиролиза высокоиенасы-щенных алифатических н циклических структур. Основную часть продуктов пиролиза трибополимеров составляли ароматические соединения, содержащие бензольные, нафталиновые, дифениловые, антраценовые, фенантреновые и другие ароматические ядра, [c.131]
Задачи качественного и во мнотих случаях количественного определения функциональных групп в настоящее время в большой степени решаются инструментальными физическими и физико-химическими методами. Однако при исследовании строения многофункциональных соединений, в тех случаях, когда спектральное исследование дает сложную картину (одни функциональные труппы нивелируют другие), приходится прибегать к количественному определению функциональных групп другими методами. В связи с этим в МГУ велись поиски новых спектрофотометрических. потенциометрических, газовохроматографических и химических методов определения спиртов, меркаптанов, аминов, гидразинов, гидразидов, альдегидов, сложных эфиров, ангидридов, галоидангид-ридов и ненасыщенных соединений. Например, в нашей лаборатории разработано несколько новых методов количественного анализа акрилонитрила [22—27]. Наиболее точным и удо бным из них является метод, основанный на реакции акрилонитрила с сульфитом натрия [c.450]
Из 1 л крови, полученной из раков, находивщихся в фазе прострации вследствие отравления ДДТ, нейроактивное вещество получено в количестве, достаточном для проведения проб на присутствие ряда функциональных групп. Применявшиеся методы качественного химического анализа [5], полученные результаты и интерпретация результатов суммированы в таблице. Кровь из неотравленных раков, обработанная таким же путем, как и из отравленных, служила в качестве контроля. Контрольные образцы дали отрицательные результаты. Результаты качественного анализа показывают, что нейроактивное вещество может быть первичным ароматическим амином или возможно сложным эфиром. [c.158]
Применение комплексного хроматографического анализа позволяет осуш ствлять методом тонкослойной хроматографии идентификацию гидразидов пиридиннарбоновых кислот, а методом газовой хроматографш качественно и количественно определять возможные в них примеси соответствующих сложных эфиров пиридинварбоновых кислот. [c.59]
Об образовании и накоплении в смазках продуктов окисления позволяют судить данные ИК-сиектроскопии носледняя впервые применена для качественного и количественного анализа окисления смазок [18]. При окислении в ИК-сиектре смазок появляется полоса поглощения в области 1710—1740 см В этой области находятся характеристические полосы поглощения карбонильной группы альдегидов, кетонов, сложных эфиров и кислот. С равнеиие спектров до и после окпсления смазок свидетельствует о значительном повышении концентрации карбонильных соединений, поглощающих в области 1710 см- , а также об увеличении интенсивности полосы при 3300 см- , указывающей на образование гидроксисоединений, т. е. спиртов. Методом ИКС можно оценить и влияние окисления мыльных дисперсий на изменение ассоциации мыла (начальная стадия структурообразования смазок) и роль кислородсодержащих продуктов на образование структуры смазки. [c.41]
Для качественного и количественного анализа высших жирных спиртов, являющихся составной частью липидов, применяют различные методы. Большая часть из них основана на выделении алкиловых эфиров глицерина при помощи щелочного гидролиза или восстановления Ь1АШ4 фракции нейтральных или сложных липидов и последующего разделения полученной смеси алкиловых и алкен-1-иловых эфиров глицерина либо тонкослойной хроматографией на силикагеле, пропитанном А ЫОз, либо расщеплением алкен-1-иловых эфиров глицерина кислотным гидролизом. [c.215]
Пектиновые вещества — это углеводные полимеры, состоящие главным образом из неразветвленных цепей, которые построены из остатков a-D-галактуроновой кислоты, связанных (14)-связями. Простых химических производных, которые могли бы служить для характеристики пектиновых веществ, нет, однако результаты химического и физического анализов [4, 7, 10] могут дать полезную информацию. Для сухого пектина из цитрусовых обычно характерно следующее содержание уроновых кислот 83%, —ОСНз 10%, —ОССНз 0,3%, [i]] 3,5, желирующее число 200, [а] В + 230°, качественная гидроксамовая реакция на сложный эфир положительна [И]. Сухая пектовая кислота из цитрусовых, приготовленная, как описано выше, обычно дает следующие результаты анализа содержание уроновых кислот 92%, [a]ff - - 272°, эквивалентный вес 192, гидроксамовая реакция на сложные эфиры отрицательна. [c.377]
chem21.info