18-Краун-6. 18 краун 6 эфир
18-Краун-6 — Википедия
Материал из Википедии — свободной энциклопедии
Перейти к навигации Перейти к поиску| Систематическое наименование | 1,4,7,10,13,16-гексаоксациклооктадекан |
| Сокращения | 18С6 |
| Хим. формула | C₁₂H₂₄O₆ |
| Молярная масса | 264,32 г/моль |
| Т. плав. | 36,5—38 ℃ |
| Т. кип. | 116 ℃ (0,267 кПа) |
| Т. всп. | >113 °C |
| 17455-13-9 | |
| PubChem | 28557 |
| ChemSpider | 26563 |
| Номер EINECS | 241-473-5 |
| RTECS | MP4500000 |
| ChEBI | 32397 |
C1COCCOCCOCCOCCOCCO1 | |
1S/C12h34O6/c1-2-14-5-6-16-9-10-18-12-11-17-8-7-15-4-3-13-1/h2-12h3 | |
| ЛД50 | 525 мг/кг, крысы, перорально |
| R-фразы | R22, R36/37/38 |
| S-фразы | |
ru.wikipedia.org
18-Краун-6 Википедия
| Систематическое наименование | 1,4,7,10,13,16-гексаоксациклооктадекан |
| Сокращения | 18С6 |
| Хим. формула | C₁₂H₂₄O₆ |
| Молярная масса | 264,32 г/моль |
| Т. плав. | 36,5—38 ℃ |
| Т. кип. | 116 ℃ (0,267 кПа) |
| Т. всп. | >113 °C |
| Номер CAS | 17455-13-9 |
| PubChem | 28557 |
| ChemSpider | 26563 |
| Номер EINECS | 241-473-5 |
| RTECS | |
| ChEBI | 32397 |
C1COCCOCCOCCOCCOCCO1 | |
1S/C12h34O6/c1-2-14-5-6-16-9-10-18-12-11-17-8-7-15-4-3-13-1/h2-12h3 | |
| ЛД50 | 525 мг/кг, крысы, перорально |
| R-фразы | R22, R36/37/38 |
| S-фразы | S26, S36 |
| H-фразы | h402, h415, h419, h435 |
| P-фразы | P261, P305+P351+P338 |
| Сигнальное слово | Осторожно |
| Пиктограммы СГС | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
18-Краун-6 — органическое соединение состава C12h34O6, относящееся к классу циклических простых эфиров (краун-эфиры) и имеющее в единственном цикле 6 атомов кислорода, расположенных в симметричном порядке. Представляет собой белые гигроскопичные кристаллы с низкой температурой плавления. Находит широкое применение как специфичный комплексообразователь для ионов калия K+. Синтез краун-эфиров принёс Нобелевскую премию Чарлзу Педерсену (1987 год).
Получение
18-Краун-6 синтезируют по реакции Вильямсона, где в качестве строительных блоков выступают две олигоэтиленгликольные заготовки: одна — с гидроксильными группами, а другая — с какими-либо уходящими группами, например, хлоридом или тозилатом:
HO(Ch3Ch3O)2Ch3Ch3OH+Cl(Ch3Ch3O)2Ch3Ch3Cl+2KOH→{\displaystyle {\mathsf {HO(CH_{2}CH_{2}O)_{2}CH_{2}CH_{2}OH+Cl(CH_{2}CH_{2}O)_{2}CH_{2}CH_{2}Cl+2KOH\rightarrow }}} →(Ch3Ch3O)6+2KCl+2h3O{\displaystyle {\mathsf {\rightarrow (CH_{2}CH_{2}O)_{6}+2KCl+2H_{2}O}}}[1]В данном синтезе катион калия выступает в качестве координирующего иона и позволяет получить именно циклический эфир, избежав образования эфирных макроцепей. Это достигается за счёт того, что при сшивке двух концов реагирующих молекул, другие два конца сближаются в пространстве за счёт координации атомов кислорода вокруг иона калия[1].
Также 18-краун-6 может быть получен путём олигомеризации оксида этилена в присутствии ионов калия[1].
Физические свойства
18-Краун-6 представляет собой белые кристаллы, плавящиеся при температуре 36,5—38 °С. Он очень гигроскопичен и легко растворим в воде и большинстве органических растворителей[2][3].
Химические свойства
Подобно другим простым эфирам, 18-краун-6 химически и термически стабилен[3].
Комплексообразование
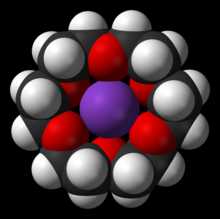 Комплекс 18С6 с ионом калия
Комплекс 18С6 с ионом калия 18-Краун-6 позволяет солюбилизировать соли металлов в полярных и неполярных органических растворителях. Поскольку диаметр полости в молекуле этого краун-эфира составляет 2,6—3,2 Å, а и ионный диаметр иона калия равен 2,66 Å, 18-краун-6 более специфичен по отношению к этому металлу. Тем не менее, он также эффективно координируется с ионами натрия и цезия[2].
| вода | 0,80 | 2,03 | 0,99 | 2,72 | 3,87 |
| метанол | 6,06 | 4,79 | >5,5 | 7,04 |
Вследствие комплексообразования краун-эфира с катионами калия происходит образование реакционноспособных анионов. Реакционноспособность анионов увеличивается по двум причинам. Во-первых, неполярные (например, бензол) или полярные апротонные растворители (ацетонитрил) не должны иметь большого сродства к анионам, вследствие чего анион в их среде не сольватирован. Во-вторых, физическое удаление закомплексованного краун-эфиром катиона от аниона уменьшает силу кулоновского взаимодействия. За счёт этого в дальнейших реакциях аниона снижается энергия активации, и он приобретает более нуклеофильные и более основные свойства. Такие анионы получили название «голых» анионов (англ. naked)[2].
Примечания
- ↑ 1 2 3 Gokel G. W. Crown Ethers (англ.) // Encyclopedia of Supramolecular Chemistry. — Marcel Dekker, 2004. — P. 326—333.
- ↑ 1 2 3 Liotta C. L., Berkner J. 18-Crown-6 (англ.) // e-EROS Encyclopedia of Reagents for Organic Synthesis. — 2001. — DOI:10.1002/047084289X.rc261.
- ↑ 1 2 3 Weber E. Crown Ethers (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — 2007. — DOI:10.1002/14356007.a08_091.pub2.
Ссылки
wikiredia.ru
18-Краун-6 — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
| Систематическое наименование | 1,4,7,10,13,16-гексаоксациклооктадекан |
| Сокращения | 18С6 |
| Хим. формула | C12h34O6 |
| Молярная масса | 264,32 г/моль |
| Т. плав. | 36,5—38 ℃ |
| Т. кип. | 116 ℃ (0,267 кПа) |
| Т. всп. | >113 °C |
| Номер CAS | [www.chemnet.com/cas/supplier.cgi?exact=dict&terms=17455-13-9 17455-13-9] |
| PubChem | [pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=28557 28557] |
| ChemSpider | [www.chemspider.com/26563 26563] |
| RTECS | MP4500000 |
| ChEBI | CHEBI: 32397+ |
O1CCOCCOCCOCCOCCOCC1 | |
| InChI = 1/C12h34O6/c1-2-14-5-6-16-9-10-18-12-11-17-8-7-15- 4-3-13-1/h2-12h3 InChIKey = XEZNGIUYQVAUSS-UHFFFAOYAP | |
| ЛД50 | 525 мг/кг, крысы, перорально |
| R-фразы | R22, R36/37/38 |
| S-фразы | S26, S36 |
| H-фразы | h402, h415, h419, h435 |
| P-фразы | P261, P305+P351+P338 |
| Сигнальное слово | Осторожно |
| Пиктограммы СГС | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
18-Краун-6 — органическое соединение состава C12h34O6, относящееся к классу циклических простых эфиров (краун-эфиры) и имеющее в единственном цикле 6 атомов кислорода, расположенных в симметричном порядке. Представляет собой белые гигроскопичные кристаллы с низкой температурой плавления. Находит широкое применение как специфичный комплексообразователь для ионов калия K+. Синтез краун-эфиров принёс Нобелевскую премию Чарлзу Педерсену (1987 год).
Получение
18-Краун-6 синтезируют по реакции Вильямсона, где в качестве строительных блоков выступают две олигоэтиленгликольные заготовки: одна — с гидроксильными группами, а другая — с какими-либо уходящими группами, например, хлоридом или тозилатом:
<math>\mathsf{HO(CH_2CH_2O)_2CH_2CH_2OH + Cl(CH_2CH_2O)_2CH_2CH_2Cl + 2KOH \rightarrow }</math> <math>\mathsf{ \rightarrow (CH_2CH_2O)_6 + 2KCl + 2H_2O}</math>[1]
Также 18-краун-6 может быть получен путём олигомеризации оксида этилена в присутствии ионов калия[1].
Физические свойства
18-Краун-6 представляет собой белые кристаллы, плавящиеся при температуре 36,5—38 °С. Он очень гигроскопичен и легко растворим в воде и большинстве органических растворителей[2][3].
Химические свойства
Подобно другим простым эфирам, 18-краун-6 химически и термически стабилен[3].
Комплексообразование
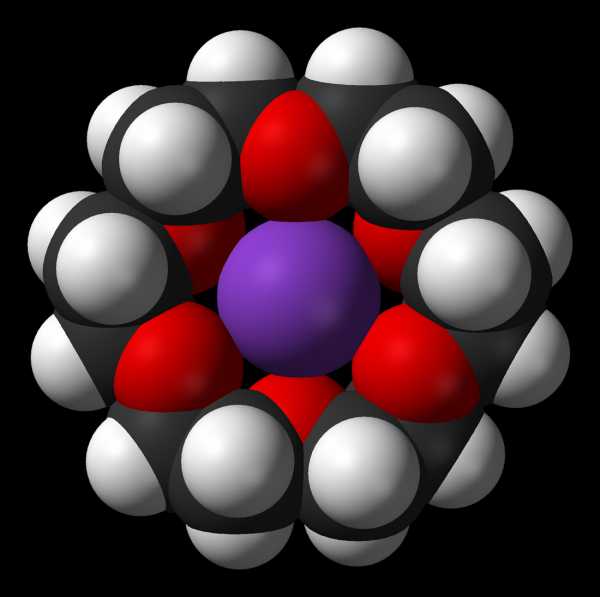
18-Краун-6 позволяет солюбилизировать соли металлов в полярных и неполярных органических растворителях. Поскольку диаметр полости в молекуле этого краун-эфира составляет 2,6—3,2 Å, а и ионный диаметр иона калия равен 2,66 Å, 18-краун-6 более специфичен по отношению к этому металлу. Тем не менее, он также эффективно координируется с ионами натрия и цезия[2].
| вода | 0,80 | 2,03 | 0,99 | 2,72 | 3,87 |
| метанол | 4,36 | 6,06 | 4,79 | >5,5 | 7,04 |
Вследствие комплексообразования краун-эфира с катионами калия происходит образование реакционноспособных анионов. Реакционноспособность анионов увеличивается по двум причинам. Во-первых, неполярные (например, бензол) или полярные апротонные растворители (ацетонитрил) не должны иметь большого сродства к анионам, вследствие чего анион в их среде не сольватирован. Во-вторых, физическое удаление закомплексованного краун-эфиром катиона от аниона уменьшает силу кулоновского взаимодействия. За счёт этого в дальнейших реакциях аниона снижается энергия активации, и он приобретает более нуклеофильные и более основные свойства. Такие анионы получили название «голых» анионов (англ. naked)[2].
Напишите отзыв о статье "18-Краун-6"
Примечания
- ↑ 1 2 3 Gokel G. W. [books.google.by/books?id=XIXdfetQz1QC Crown Ethers] (англ.) // Encyclopedia of Supramolecular Chemistry. — Marcel Dekker, 2004. — P. 326—333.
- ↑ 1 2 3 Liotta C. L., Berkner J. 18-Crown-6 (англ.) // e-EROS Encyclopedia of Reagents for Organic Synthesis. — 2001. — DOI:10.1002/047084289X.rc261.
- ↑ 1 2 3 Weber E. Crown Ethers (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — 2007. — DOI:10.1002/14356007.a08_091.pub2.
Ссылки
- Sigma-Aldrich. [www.sigmaaldrich.com/spectra/ftir/FTIR002201.PDF ИК-спектр 18-крауна-6]. Проверено 2 января 2015.
- Sigma-Aldrich. [www.sigmaaldrich.com/spectra/rair/RAIR002994.PDF КР-спектр 18-крауна-6]. Проверено 2 января 2015.
Отрывок, характеризующий 18-Краун-6
Убегая из Москвы, люди этого войска захватили с собой все, что было награблено. Наполеон тоже увозил с собой свой собственный tresor [сокровище]. Увидав обоз, загромождавший армию. Наполеон ужаснулся (как говорит Тьер). Но он, с своей опытностью войны, не велел сжечь всо лишние повозки, как он это сделал с повозками маршала, подходя к Москве, но он посмотрел на эти коляски и кареты, в которых ехали солдаты, и сказал, что это очень хорошо, что экипажи эти употребятся для провианта, больных и раненых. Положение всего войска было подобно положению раненого животного, чувствующего свою погибель и не знающего, что оно делает. Изучать искусные маневры Наполеона и его войска и его цели со времени вступления в Москву и до уничтожения этого войска – все равно, что изучать значение предсмертных прыжков и судорог смертельно раненного животного. Очень часто раненое животное, заслышав шорох, бросается на выстрел на охотника, бежит вперед, назад и само ускоряет свой конец. То же самое делал Наполеон под давлением всего его войска. Шорох Тарутинского сражения спугнул зверя, и он бросился вперед на выстрел, добежал до охотника, вернулся назад, опять вперед, опять назад и, наконец, как всякий зверь, побежал назад, по самому невыгодному, опасному пути, но по знакомому, старому следу. Наполеон, представляющийся нам руководителем всего этого движения (как диким представлялась фигура, вырезанная на носу корабля, силою, руководящею корабль), Наполеон во все это время своей деятельности был подобен ребенку, который, держась за тесемочки, привязанные внутри кареты, воображает, что он правит.wiki-org.ru
18-Краун-6 — Википедия. Что такое 18-Краун-6
Материал из Википедии — свободной энциклопедии
| Систематическое наименование | 1,4,7,10,13,16-гексаоксациклооктадекан |
| Сокращения | 18С6 |
| Хим. формула | C₁₂H₂₄O₆ |
| Молярная масса | 264,32 г/моль |
| Т. плав. | 36,5—38 ℃ |
| Т. кип. | 116 ℃ (0,267 кПа) |
| Т. всп. | >113 °C |
| Номер CAS | 17455-13-9 |
| PubChem | 28557 |
| ChemSpider | 26563 |
| Номер EINECS | 241-473-5 |
| RTECS | MP4500000 |
| ChEBI | 32397 |
C1COCCOCCOCCOCCOCCO1 | |
1S/C12h34O6/c1-2-14-5-6-16-9-10-18-12-11-17-8-7-15-4-3-13-1/h2-12h3 | |
| ЛД50 | 525 мг/кг, крысы, перорально |
| R-фразы | R22, R36/37/38 |
| S-фразы | S26, S36 |
| H-фразы | h402, h415, h419, h435 |
| P-фразы | P261, P305+P351+P338 |
| Сигнальное слово | Осторожно |
| Пиктограммы СГС | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
18-Краун-6 — органическое соединение состава C12h34O6, относящееся к классу циклических простых эфиров (краун-эфиры) и имеющее в единственном цикле 6 атомов кислорода, расположенных в симметричном порядке. Представляет собой белые гигроскопичные кристаллы с низкой температурой плавления. Находит широкое применение как специфичный комплексообразователь для ионов калия K+. Синтез краун-эфиров принёс Нобелевскую премию Чарлзу Педерсену (1987 год).
Получение
18-Краун-6 синтезируют по реакции Вильямсона, где в качестве строительных блоков выступают две олигоэтиленгликольные заготовки: одна — с гидроксильными группами, а другая — с какими-либо уходящими группами, например, хлоридом или тозилатом:
HO(Ch3Ch3O)2Ch3Ch3OH+Cl(Ch3Ch3O)2Ch3Ch3Cl+2KOH→{\displaystyle {\mathsf {HO(CH_{2}CH_{2}O)_{2}CH_{2}CH_{2}OH+Cl(CH_{2}CH_{2}O)_{2}CH_{2}CH_{2}Cl+2KOH\rightarrow }}} →(Ch3Ch3O)6+2KCl+2h3O{\displaystyle {\mathsf {\rightarrow (CH_{2}CH_{2}O)_{6}+2KCl+2H_{2}O}}}[1]В данном синтезе катион калия выступает в качестве координирующего иона и позволяет получить именно циклический эфир, избежав образования эфирных макроцепей. Это достигается за счёт того, что при сшивке двух концов реагирующих молекул, другие два конца сближаются в пространстве за счёт координации атомов кислорода вокруг иона калия[1].
Также 18-краун-6 может быть получен путём олигомеризации оксида этилена в присутствии ионов калия[1].
Физические свойства
18-Краун-6 представляет собой белые кристаллы, плавящиеся при температуре 36,5—38 °С. Он очень гигроскопичен и легко растворим в воде и большинстве органических растворителей[2][3].
Химические свойства
Подобно другим простым эфирам, 18-краун-6 химически и термически стабилен[3].
Комплексообразование
 Комплекс 18С6 с ионом калия
Комплекс 18С6 с ионом калия 18-Краун-6 позволяет солюбилизировать соли металлов в полярных и неполярных органических растворителях. Поскольку диаметр полости в молекуле этого краун-эфира составляет 2,6—3,2 Å, а и ионный диаметр иона калия равен 2,66 Å, 18-краун-6 более специфичен по отношению к этому металлу. Тем не менее, он также эффективно координируется с ионами натрия и цезия[2].
| вода | 0,80 | 2,03 | 0,99 | 2,72 | 3,87 |
| метанол | 4,36 | 6,06 | 4,79 | >5,5 | 7,04 |
Вследствие комплексообразования краун-эфира с катионами калия происходит образование реакционноспособных анионов. Реакционноспособность анионов увеличивается по двум причинам. Во-первых, неполярные (например, бензол) или полярные апротонные растворители (ацетонитрил) не должны иметь большого сродства к анионам, вследствие чего анион в их среде не сольватирован. Во-вторых, физическое удаление закомплексованного краун-эфиром катиона от аниона уменьшает силу кулоновского взаимодействия. За счёт этого в дальнейших реакциях аниона снижается энергия активации, и он приобретает более нуклеофильные и более основные свойства. Такие анионы получили название «голых» анионов (англ. naked)[2].
Примечания
- ↑ 1 2 3 Gokel G. W. Crown Ethers (англ.) // Encyclopedia of Supramolecular Chemistry. — Marcel Dekker, 2004. — P. 326—333.
- ↑ 1 2 3 Liotta C. L., Berkner J. 18-Crown-6 (англ.) // e-EROS Encyclopedia of Reagents for Organic Synthesis. — 2001. — DOI:10.1002/047084289X.rc261.
- ↑ 1 2 3 Weber E. Crown Ethers (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — 2007. — DOI:10.1002/14356007.a08_091.pub2.
Ссылки
wiki.sc
18-Краун-6 — WiKi
18-Краун-6 — органическое соединение состава C12h34O6, относящееся к классу циклических простых эфиров (краун-эфиры) и имеющее в единственном цикле 6 атомов кислорода, расположенных в симметричном порядке. Представляет собой белые гигроскопичные кристаллы с низкой температурой плавления. Находит широкое применение как специфичный комплексообразователь для ионов калия K+. Синтез краун-эфиров принёс Нобелевскую премию Чарлзу Педерсену (1987 год).
| Систематическое наименование | 1,4,7,10,13,16-гексаоксациклооктадекан |
| Сокращения | 18С6 |
| Хим. формула | C₁₂H₂₄O₆ |
| Молярная масса | 264,32 г/моль |
| Т. плав. | 36,5—38 ℃ |
| Т. кип. | 116 ℃ (0,267 кПа) |
| Т. всп. | >113 °C |
| Номер CAS | 17455-13-9 |
| PubChem | 28557 |
| ChemSpider | 26563 |
| Номер EINECS | 241-473-5 |
| RTECS | MP4500000 |
| ChEBI | 32397 |
C1COCCOCCOCCOCCOCCO1 | |
1S/C12h34O6/c1-2-14-5-6-16-9-10-18-12-11-17-8-7-15-4-3-13-1/h2-12h3 | |
| ЛД50 | 525 мг/кг, крысы, перорально |
| R-фразы | R22, R36/37/38 |
| S-фразы | S26, S36 |
| H-фразы | h402, h415, h419, h435 |
| P-фразы | P261, P305+P351+P338 |
| Сигнальное слово | Осторожно |
| Пиктограммы СГС | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Получение
18-Краун-6 синтезируют по реакции Вильямсона, где в качестве строительных блоков выступают две олигоэтиленгликольные заготовки: одна — с гидроксильными группами, а другая — с какими-либо уходящими группами, например, хлоридом или тозилатом:
HO(Ch3Ch3O)2Ch3Ch3OH+Cl(Ch3Ch3O)2Ch3Ch3Cl+2KOH→{\displaystyle {\mathsf {HO(CH_{2}CH_{2}O)_{2}CH_{2}CH_{2}OH+Cl(CH_{2}CH_{2}O)_{2}CH_{2}CH_{2}Cl+2KOH\rightarrow }}} →(Ch3Ch3O)6+2KCl+2h3O{\displaystyle {\mathsf {\rightarrow (CH_{2}CH_{2}O)_{6}+2KCl+2H_{2}O}}} [1]В данном синтезе катион калия выступает в качестве координирующего иона и позволяет получить именно циклический эфир, избежав образования эфирных макроцепей. Это достигается за счёт того, что при сшивке двух концов реагирующих молекул, другие два конца сближаются в пространстве за счёт координации атомов кислорода вокруг иона калия[1].
Также 18-краун-6 может быть получен путём олигомеризации оксида этилена в присутствии ионов калия[1].
Физические свойства
18-Краун-6 представляет собой белые кристаллы, плавящиеся при температуре 36,5—38 °С. Он очень гигроскопичен и легко растворим в воде и большинстве органических растворителей[2][3].
Химические свойства
Подобно другим простым эфирам, 18-краун-6 химически и термически стабилен[3].
Комплексообразование
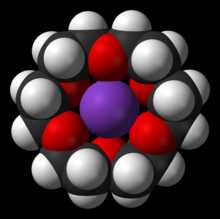 Комплекс 18С6 с ионом калия
Комплекс 18С6 с ионом калия 18-Краун-6 позволяет солюбилизировать соли металлов в полярных и неполярных органических растворителях. Поскольку диаметр полости в молекуле этого краун-эфира составляет 2,6—3,2 Å, а и ионный диаметр иона калия равен 2,66 Å, 18-краун-6 более специфичен по отношению к этому металлу. Тем не менее, он также эффективно координируется с ионами натрия и цезия[2].
| вода | 0,80 | 2,03 | 0,99 | 2,72 | 3,87 |
| метанол | 4,36 | 6,06 | 4,79 | >5,5 | 7,04 |
Вследствие комплексообразования краун-эфира с катионами калия происходит образование реакционноспособных анионов. Реакционноспособность анионов увеличивается по двум причинам. Во-первых, неполярные (например, бензол) или полярные апротонные растворители (ацетонитрил) не должны иметь большого сродства к анионам, вследствие чего анион в их среде не сольватирован. Во-вторых, физическое удаление закомплексованного краун-эфиром катиона от аниона уменьшает силу кулоновского взаимодействия. За счёт этого в дальнейших реакциях аниона снижается энергия активации, и он приобретает более нуклеофильные и более основные свойства. Такие анионы получили название «голых» анионов (англ. naked)[2].
Примечания
- ↑ 1 2 3 Gokel G. W. Crown Ethers (англ.) // Encyclopedia of Supramolecular Chemistry. — Marcel Dekker, 2004. — P. 326—333.
- ↑ 1 2 3 Liotta C. L., Berkner J. 18-Crown-6 (англ.) // e-EROS Encyclopedia of Reagents for Organic Synthesis. — 2001. — DOI:10.1002/047084289X.rc261.
- ↑ 1 2 3 Weber E. Crown Ethers (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — 2007. — DOI:10.1002/14356007.a08_091.pub2.
Ссылки
ru-wiki.org
18-Краун-6 — Википедия РУ
18-Краун-6 — органическое соединение состава C12h34O6, относящееся к классу циклических простых эфиров (краун-эфиры) и имеющее в единственном цикле 6 атомов кислорода, расположенных в симметричном порядке. Представляет собой белые гигроскопичные кристаллы с низкой температурой плавления. Находит широкое применение как специфичный комплексообразователь для ионов калия K+. Синтез краун-эфиров принёс Нобелевскую премию Чарлзу Педерсену (1987 год).
| Систематическое наименование | 1,4,7,10,13,16-гексаоксациклооктадекан |
| Сокращения | 18С6 |
| Хим. формула | C₁₂H₂₄O₆ |
| Молярная масса | 264,32 г/моль |
| Т. плав. | 36,5—38 ℃ |
| Т. кип. | 116 ℃ (0,267 кПа) |
| Т. всп. | >113 °C |
| Номер CAS | 17455-13-9 |
| PubChem | 28557 |
| ChemSpider | 26563 |
| Номер EINECS | 241-473-5 |
| RTECS | MP4500000 |
| ChEBI | 32397 |
C1COCCOCCOCCOCCOCCO1 | |
1S/C12h34O6/c1-2-14-5-6-16-9-10-18-12-11-17-8-7-15-4-3-13-1/h2-12h3 | |
| ЛД50 | 525 мг/кг, крысы, перорально |
| R-фразы | R22, R36/37/38 |
| S-фразы | S26, S36 |
| H-фразы | h402, h415, h419, h435 |
| P-фразы | P261, P305+P351+P338 |
| Сигнальное слово | Осторожно |
| Пиктограммы СГС | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Получение
18-Краун-6 синтезируют по реакции Вильямсона, где в качестве строительных блоков выступают две олигоэтиленгликольные заготовки: одна — с гидроксильными группами, а другая — с какими-либо уходящими группами, например, хлоридом или тозилатом:
HO(Ch3Ch3O)2Ch3Ch3OH+Cl(Ch3Ch3O)2Ch3Ch3Cl+2KOH→{\displaystyle {\mathsf {HO(CH_{2}CH_{2}O)_{2}CH_{2}CH_{2}OH+Cl(CH_{2}CH_{2}O)_{2}CH_{2}CH_{2}Cl+2KOH\rightarrow }}} →(Ch3Ch3O)6+2KCl+2h3O{\displaystyle {\mathsf {\rightarrow (CH_{2}CH_{2}O)_{6}+2KCl+2H_{2}O}}} [1]В данном синтезе катион калия выступает в качестве координирующего иона и позволяет получить именно циклический эфир, избежав образования эфирных макроцепей. Это достигается за счёт того, что при сшивке двух концов реагирующих молекул, другие два конца сближаются в пространстве за счёт координации атомов кислорода вокруг иона калия[1].
Также 18-краун-6 может быть получен путём олигомеризации оксида этилена в присутствии ионов калия[1].
Физические свойства
18-Краун-6 представляет собой белые кристаллы, плавящиеся при температуре 36,5—38 °С. Он очень гигроскопичен и легко растворим в воде и большинстве органических растворителей[2][3].
Химические свойства
Подобно другим простым эфирам, 18-краун-6 химически и термически стабилен[3].
Комплексообразование
 Комплекс 18С6 с ионом калия
Комплекс 18С6 с ионом калия 18-Краун-6 позволяет солюбилизировать соли металлов в полярных и неполярных органических растворителях. Поскольку диаметр полости в молекуле этого краун-эфира составляет 2,6—3,2 Å, а и ионный диаметр иона калия равен 2,66 Å, 18-краун-6 более специфичен по отношению к этому металлу. Тем не менее, он также эффективно координируется с ионами натрия и цезия[2].
| вода | 0,80 | 2,03 | 0,99 | 2,72 | 3,87 |
| метанол | 4,36 | 6,06 | 4,79 | >5,5 | 7,04 |
Вследствие комплексообразования краун-эфира с катионами калия происходит образование реакционноспособных анионов. Реакционноспособность анионов увеличивается по двум причинам. Во-первых, неполярные (например, бензол) или полярные апротонные растворители (ацетонитрил) не должны иметь большого сродства к анионам, вследствие чего анион в их среде не сольватирован. Во-вторых, физическое удаление закомплексованного краун-эфиром катиона от аниона уменьшает силу кулоновского взаимодействия. За счёт этого в дальнейших реакциях аниона снижается энергия активации, и он приобретает более нуклеофильные и более основные свойства. Такие анионы получили название «голых» анионов (англ. naked)[2].
Примечания
- ↑ 1 2 3 Gokel G. W. Crown Ethers (англ.) // Encyclopedia of Supramolecular Chemistry. — Marcel Dekker, 2004. — P. 326—333.
- ↑ 1 2 3 Liotta C. L., Berkner J. 18-Crown-6 (англ.) // e-EROS Encyclopedia of Reagents for Organic Synthesis. — 2001. — DOI:10.1002/047084289X.rc261.
- ↑ 1 2 3 Weber E. Crown Ethers (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — 2007. — DOI:10.1002/14356007.a08_091.pub2.
Ссылки
http-wikipediya.ru
Краун-эфиры — Википедия
Материал из Википедии — свободной энциклопедии
Краун-эфиры (краун-соединения) — макрогетероциклические соединения, содержащие в своих циклах более 11 атомов, из которых не менее четырёх — гетероатомы, которые связаны между собой этиленовыми мостиками.
Как правило, гетероатомом является атом кислорода. Если один или несколько атомов кислорода заменены атомами азота или серы, то соответствующие соединения называются соответственно азакраун- или тиакраун-эфирами. Если краун-эфиры конденсированы с бензольными или циклогексановыми кольцами, то они относятся к бензокраун- или циклогексанкраун-эфирам. Получены краун-эфиры, содержащие в цикле атомы P, Si, As, а также амидные, сложноэфирные и некоторые другие функциональные группы.
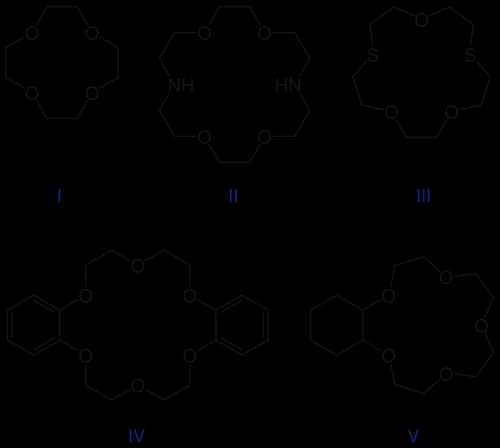
В тривиальных названиях краун-эфиров общее число атомов в цикле и число гетероатомов обозначают цифрами, которые ставят перед и после слова «краун». Согласно ИЮПАК краун-эфиры представляются как производные циклических углеводородов:
- формула I — 12-краун-4; (1,4,7,10-тетраоксациклододекан)
- формула II — 1,10-диаза-18-краун-6; (4,7,13,16-тетраокса-1,10-диазациклооктадекан)
- формула III — 1,7-дитиа-15-краун-5
- формула IV — дибензо-18-краун-6
- формула V — циклогексано-15-краун-5
Краун-эфиры являются вязкими жидкостями или кристаллическими веществами, хорошо растворимыми в большинстве органических растворителей и плохо растворимыми в воде. Их химические свойства зависят от природы гетероатомов и функциональных групп в цикле.
Краун-эфиры образуют устойчивые липофильные комплексы с катионами металлов, особенно щелочных и щелочноземельных. При этом катион металла включается во внутримолекулярную полость краун-эфира и удерживается благодаря ио
ru.wikipedia.org