Сложные эфиры: химические свойства и применение. Химические свойства эфиры
 Обратная связь ПОЗНАВАТЕЛЬНОЕ Сила воли ведет к действию, а позитивные действия формируют позитивное отношение Как определить диапазон голоса - ваш вокал Как цель узнает о ваших желаниях прежде, чем вы начнете действовать. Как компании прогнозируют привычки и манипулируют ими Целительная привычка Как самому избавиться от обидчивости Противоречивые взгляды на качества, присущие мужчинам Тренинг уверенности в себе Вкуснейший "Салат из свеклы с чесноком" Натюрморт и его изобразительные возможности Применение, как принимать мумие? Мумие для волос, лица, при переломах, при кровотечении и т.д. Как научиться брать на себя ответственность Зачем нужны границы в отношениях с детьми? Световозвращающие элементы на детской одежде Как победить свой возраст? Восемь уникальных способов, которые помогут достичь долголетия Как слышать голос Бога Классификация ожирения по ИМТ (ВОЗ) Глава 3. Завет мужчины с женщиной
Оси и плоскости тела человека - Тело человека состоит из определенных топографических частей и участков, в которых расположены органы, мышцы, сосуды, нервы и т.д.
| Сложные эфиры термически нестабильны: при нагревании до 200 – 250оС они разлагаются на гораздо более стабильные карбоновые кислоты и алкены, например: Если у первого атома углерода спиртовой части сложного эфира имеется разветвление, то получаются два разных алкена, причём каждый из них может получаться в виде двух цис- и транс - изомеров: Сложные эфиры могут гидролизоваться в кислой, нейтральной и щелочной средах. В реакция обратима и скорость её зависит от концентрации добавленной сильной кислоты. Кинетические кривые, то есть кривые в координатах время – концентрация представляют собой нисходящую экспоненту для сложного эфира и одинаковые восходящие экспоненты для спирта и карбоновой кислоты. Ниже представлен график для реакции гидролиза в общем виде:
Если кислоту не добавлять, то наблюдается автокаталитический процесс: гидролиз сначала идёт очень медленно, но при этом образуется карбоновая кислота – катализатор и процесс ускоряется, а через некоторое время скорость его опять падает и концентрация сложного эфира доходит до равновесной. Эта равновесная концентрация при прочих равных условиях ничем не отличается от той равновесной концентрации, которая получается при катализе сильными кислотами. Однако время для достижения полупревращения (t1/2) значительно больше: Под действием щелочей сложные эфиры так же «гидролизуются», но здесь щёлочь не катализатор, а реагент: Сложные эфиры вступают в реакцию переэтерификации как со спиртами, так и с кислотами: Для того чтобы сдвинуть равновесие в сторону образования целевого сложного эфира спирт - исходный реагент берут в большом избытке. При переэтерификации кислотой берут в большом избытке её.
Сложные эфиры вступают в реакцию с аммиаком и аминами. Равновесие в этих реакциях очень сильно сдвинуто в сторону образования амидов и алкиламидов кислот: избыток аммиака или амина не нужен (!!!)
Сложные эфиры могут быть окислены сильными окислителями в кислой среде. По-видимому, сначала проходит гидролиз и фактически окисляется только образовавшийся при этом спирт. Например: Сложные эфиры могут быть восстановлены до спиртов металлическим натрием в среде какого-либо спирта. Реакция была предложена в 1903 году и подробно изучена в 1906 году французскими химиками Буво и Бланом и носит их имя. Например: В две стадии сложные эфиры могут быть восстановлены до спиртов с помощью комплексных гидридов металлов. На первой стадии в случае использования тетрагидридобората натрия получаются эфир борной кислоты и алкоголят натрия, на второй они гидролизуются до спиртов:
В случае применения тетрагидридоалюмината лития на первой стадии получаются алкоголяты алюминия и лития, а на второй они так же гидролизуются до спиртов:
Содержание
|
megapredmet.ru
Сложные эфиры: химические свойства и применение
Сложными эфирами принято называть соединения, полученные по реакции этерификации из карбоновых кислот. При этом происходит замещение ОН- из карбоксильной группы на алкоксирадикал. В результате образуются сложные эфиры, формула которых в общем виде записывается как R-СОО-R'.
Строение сложноэфирной группы
Полярность химических связей в молекулах сложных эфиров аналогична полярности связей в карбоновых кислотах. Главным отличием является отсутствие подвижного атома водорода, на месте которого размещается углеводородный остаток. Вместе с тем электрофильный центр располагается на атоме углерода сложноэфирной группы. Но и углеродный атом алкильной группы, соединенный с ней, тоже положительно поляризован.
Электрофильность, а значит, и химические свойства сложных эфиров определяются строением углеводородного остатка, занявшего место атома Н в карбоксильной группе. Если углеводородный радикал образует с атомом кислорода сопряженную систему, то реакционная способность заметно возрастает. Так происходит, например, в акриловых и виниловых эфирах.
Физические свойства
Большинство сложных эфиров представляют собой жидкости или кристаллические вещества с приятным ароматом. Температура их кипения обычно ниже, чем у близких по значениям молекулярных масс карбоновых кислот. Что подтверждает уменьшение межмолекулярных взаимодействий, а это, в свою очередь, объясняется отсутствием водородных связей между соседними молекулами.

Однако так же, как и химические свойства сложных эфиров, физические зависят от особенностей строения молекулы. А точнее, от типа спирта и карбоновой кислоты, из которых он образован. По этому признаку сложные эфиры делят на три основные группы:
- Фруктовые эфиры. Они образованы из низших карбоновых кислот и таких же одноатомных спиртов. Жидкости с характерными приятными цветочно-фруктовыми запахами.
- Воски. Являются производными высших (число атомов углерода от 15 до 30) кислот и спиртов, имеющих по одной функциональной группе. Это пластичные вещества, которые легко размягчаются в руках. Основным компонентом пчелиного воска является мирицилпальмитат С15Н31СООС31Н63, а китайский - цериловый эфир церотиновой кислоты С25Н51СООС26Н53. Они не растворяются в воде, но растворимы в хлороформе и бензоле.
- Жиры. Образованные из глицерина и средних и высших карбоновых кислот. Животные жиры, как правило, твердые при нормальных условиях, но легко плавятся при повышении температуры (сливочное масло, свиной жир и др.). Для растительных жиров характерно жидкое состояние (льняное, оливковое, соевое масла). Принципиальным отличием в строении этих двух групп, что и сказывается на различиях в физических и химических свойствах сложных эфиров, является наличие или отсутствие кратных связей в кислотном остатке. Животные жиры являются глицеридами непредельных карбоновых кислот, а растительные - предельных кислот.
Химические свойства
Эфиры реагируют с нуклеофилами, что приводит к замещению алкоксигруппы и ацилированию (или алкилированию) нуклеофильного агента. Если в структурной формуле сложного эфира имеется α-водородный атом, то возможна сложноэфирная конденсация.
1. Гидролиз. Возможен кислотный и щелочной гидролиз, представляющий собой реакцию, обратную этерификации. В первом случае гидролиз обратим, а кислота выступает в роли катализатора:
R-СОО-R' + Н2О <―> R-СОО-Н + R'-OH
Основной гидролиз необратим и обычно называется омылением, а натриевые и калиевые соли жирных карбоновых кислот - мылами:
R-СОО-R' + NaOH ―> R-СОО-Na + R'-OΗ

2. Аммонолиз. Нуклеофильным агентом может выступать аммиак:
R-СОО-R' + Nh4 ―> R-СО-Nh3 + R'-OH
3. Переэтерификация. Это химическое свойство сложных эфиров можно причислить также к способам их получения. Под действием спиртов в присутствии Н+ или ОН- возможна замена углеводородного радикала, соединенного с кислородом:
R-СОО-R' + R''-OH ―> R-СОО-R'' + R'-OH
4. Восстановление водородом приводит к образованию молекул двух разных спиртов:
R-СО-OR' + LiAlh5 ―> R-СΗ2-ОΗ + R'OH
5. Горение - еще одна типичная для сложных эфиров реакция:
2CΗ3–COO–CΗ3 + 7O2 = 6CO2 + 6h3O
6. Гидрирование. Если в углеводородной цепи молекулы эфира имеются кратные связи, то по ним возможно присоединение молекул водорода, которое происходит в присутствии платины или других катализаторов. Так, например, из масел возможно получение твердых гидрогенизированных жиров (маргарина).

Применение сложных эфиров
Сложные эфиры и их производные применяются в различных отраслях промышленности. Многие из них хорошо растворяют различные органические соединения, используются в парфюмерии и пищевой промышленности, для получения полимеров и полиэфирных волокон.
Этилацетат. Используется как растворитель для нитроцеллюлозы, ацетилцеллюлозы и других полимеров, для изготовления и растворения лаков. Благодаря приятному аромату применяется в пищевой и парфюмерной промышленностях.
Бутилацетат. Также применяют в качестве растворителя, но уже и полиэфирных смол.
Винилацетат (СН3-СОО-СН=СН2). Используется как основа полимера, необходимого в приготовлении клея, лаков, синтетических волокон и пленок.
Малоновый эфир. Благодаря своим особым химическим свойствам этот сложный эфир широко используется в химическом синтезе для получения карбоновых кислот, гетероциклических соединений, аминокарбоновых кислот.

Фталаты. Эфиры фталевой кислоты используют в качестве пластифицирующих добавок к полимерам и синтетическим каучукам, а диоктилфталат - еще и как репеллент.
Метилакрилат и метилметакрилат. Легко полимеризуются с образованием устойчивого к различным воздействиям листов органического стекла.
загрузка...
fjord12.ru
Сложные эфиры: химические свойства и применение
Образование 5 марта 2018Сложными эфирами принято называть соединения, полученные по реакции этерификации из карбоновых кислот. При этом происходит замещение ОН- из карбоксильной группы на алкоксирадикал. В результате образуются сложные эфиры, формула которых в общем виде записывается как R-СОО-R'.
Строение сложноэфирной группы
Полярность химических связей в молекулах сложных эфиров аналогична полярности связей в карбоновых кислотах. Главным отличием является отсутствие подвижного атома водорода, на месте которого размещается углеводородный остаток. Вместе с тем электрофильный центр располагается на атоме углерода сложноэфирной группы. Но и углеродный атом алкильной группы, соединенный с ней, тоже положительно поляризован.
Электрофильность, а значит, и химические свойства сложных эфиров определяются строением углеводородного остатка, занявшего место атома Н в карбоксильной группе. Если углеводородный радикал образует с атомом кислорода сопряженную систему, то реакционная способность заметно возрастает. Так происходит, например, в акриловых и виниловых эфирах.
Физические свойства
Большинство сложных эфиров представляют собой жидкости или кристаллические вещества с приятным ароматом. Температура их кипения обычно ниже, чем у близких по значениям молекулярных масс карбоновых кислот. Что подтверждает уменьшение межмолекулярных взаимодействий, а это, в свою очередь, объясняется отсутствием водородных связей между соседними молекулами.

Однако так же, как и химические свойства сложных эфиров, физические зависят от особенностей строения молекулы. А точнее, от типа спирта и карбоновой кислоты, из которых он образован. По этому признаку сложные эфиры делят на три основные группы:
- Фруктовые эфиры. Они образованы из низших карбоновых кислот и таких же одноатомных спиртов. Жидкости с характерными приятными цветочно-фруктовыми запахами.
- Воски. Являются производными высших (число атомов углерода от 15 до 30) кислот и спиртов, имеющих по одной функциональной группе. Это пластичные вещества, которые легко размягчаются в руках. Основным компонентом пчелиного воска является мирицилпальмитат С15Н31СООС31Н63, а китайский - цериловый эфир церотиновой кислоты С25Н51СООС26Н53. Они не растворяются в воде, но растворимы в хлороформе и бензоле.
- Жиры. Образованные из глицерина и средних и высших карбоновых кислот. Животные жиры, как правило, твердые при нормальных условиях, но легко плавятся при повышении температуры (сливочное масло, свиной жир и др.). Для растительных жиров характерно жидкое состояние (льняное, оливковое, соевое масла). Принципиальным отличием в строении этих двух групп, что и сказывается на различиях в физических и химических свойствах сложных эфиров, является наличие или отсутствие кратных связей в кислотном остатке. Животные жиры являются глицеридами непредельных карбоновых кислот, а растительные - предельных кислот.
Видео по теме
Химические свойства
Эфиры реагируют с нуклеофилами, что приводит к замещению алкоксигруппы и ацилированию (или алкилированию) нуклеофильного агента. Если в структурной формуле сложного эфира имеется α-водородный атом, то возможна сложноэфирная конденсация.
1. Гидролиз. Возможен кислотный и щелочной гидролиз, представляющий собой реакцию, обратную этерификации. В первом случае гидролиз обратим, а кислота выступает в роли катализатора:
R-СОО-R' + Н2О <―> R-СОО-Н + R'-OH
Основной гидролиз необратим и обычно называется омылением, а натриевые и калиевые соли жирных карбоновых кислот - мылами:
R-СОО-R' + NaOH ―> R-СОО-Na + R'-OΗ

2. Аммонолиз. Нуклеофильным агентом может выступать аммиак:
R-СОО-R' + Nh4 ―> R-СО-Nh3 + R'-OH
3. Переэтерификация. Это химическое свойство сложных эфиров можно причислить также к способам их получения. Под действием спиртов в присутствии Н+ или ОН- возможна замена углеводородного радикала, соединенного с кислородом:
R-СОО-R' + R''-OH ―> R-СОО-R'' + R'-OH
4. Восстановление водородом приводит к образованию молекул двух разных спиртов:
R-СО-OR' + LiAlh5 ―> R-СΗ2-ОΗ + R'OH
5. Горение - еще одна типичная для сложных эфиров реакция:
2CΗ3–COO–CΗ3 + 7O2 = 6CO2 + 6h3O
6. Гидрирование. Если в углеводородной цепи молекулы эфира имеются кратные связи, то по ним возможно присоединение молекул водорода, которое происходит в присутствии платины или других катализаторов. Так, например, из масел возможно получение твердых гидрогенизированных жиров (маргарина).
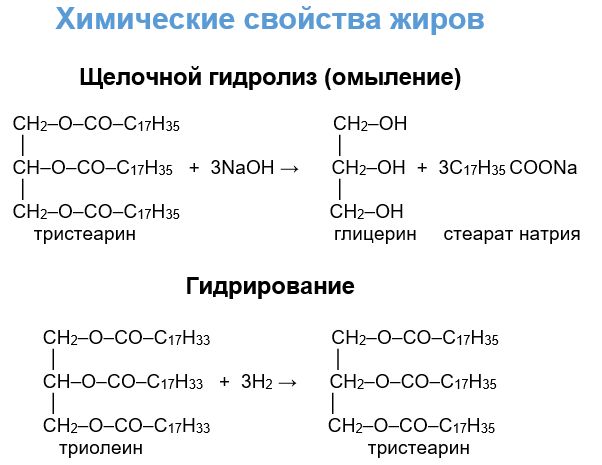
Применение сложных эфиров
Сложные эфиры и их производные применяются в различных отраслях промышленности. Многие из них хорошо растворяют различные органические соединения, используются в парфюмерии и пищевой промышленности, для получения полимеров и полиэфирных волокон.
Этилацетат. Используется как растворитель для нитроцеллюлозы, ацетилцеллюлозы и других полимеров, для изготовления и растворения лаков. Благодаря приятному аромату применяется в пищевой и парфюмерной промышленностях.
Бутилацетат. Также применяют в качестве растворителя, но уже и полиэфирных смол.
Винилацетат (СН3-СОО-СН=СН2). Используется как основа полимера, необходимого в приготовлении клея, лаков, синтетических волокон и пленок.
Малоновый эфир. Благодаря своим особым химическим свойствам этот сложный эфир широко используется в химическом синтезе для получения карбоновых кислот, гетероциклических соединений, аминокарбоновых кислот.
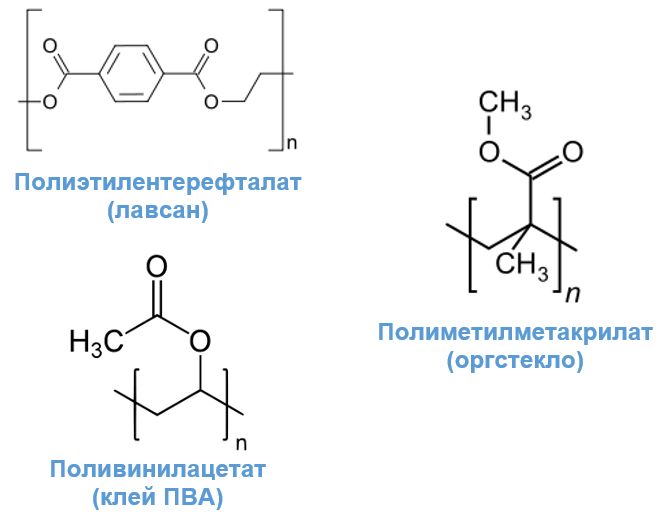
Фталаты. Эфиры фталевой кислоты используют в качестве пластифицирующих добавок к полимерам и синтетическим каучукам, а диоктилфталат - еще и как репеллент.
Метилакрилат и метилметакрилат. Легко полимеризуются с образованием устойчивого к различным воздействиям листов органического стекла.
Источник: fb.ruКомментарии
 Идёт загрузка...
Идёт загрузка... Похожие материалы
 Образование Фосфорная кислота, ее физико-химические свойства и применение
Образование Фосфорная кислота, ее физико-химические свойства и применениеФосфорная кислота, формула которой Н3РО4, также называется ортофосфорной. Это соединение при нормальных условиях имеет твердое агрегатное состояние. Мелкие кристаллы данного вещества бесцветны. К...
 Образование Непредельные углеводороды: алкены, химические свойства и применение
Образование Непредельные углеводороды: алкены, химические свойства и применениеАлкены - непредельные углеводороды, в молекулах которых между двумя атомами углерода одна двойная связь. Их часто называют углеводородами этиленового ряда, поскольку простым представителем его является этилен НС2=СН2....
 Образование Сложные эфиры: общая характеристика и применение
Образование Сложные эфиры: общая характеристика и применениеСложные эфиры - продукты замещения атомов водорода гидроксильной группы карбоновых и минеральных кислот на карбоновый радикал. Различают моно-, ди- и полиэфиры. Для одноосновных кислот существуют моно...
 Бизнес Силумин - это... Силумин: описание, химические свойства и применение
Бизнес Силумин - это... Силумин: описание, химические свойства и применениеВ настоящее время практически во всех отраслях используется сплав из алюминия. Его применяют всюду, начиная от производства посуды, и до изготовления запчастей для автомобилей.СилуминНачать стоит с тог...
 Образование Серный эфир: формула, свойства и применение
Образование Серный эфир: формула, свойства и применениеВ современной мире нужно постоянно развиваться, узнавать что-то новое, нельзя стоять на месте. Однако, по непонятным причинам, под развитием многие понимают только лишь погоню за моделями айфонов, освоение появляющихс...
 Здоровье Бихромат калия - физико-химические свойства и область применения
Здоровье Бихромат калия - физико-химические свойства и область примененияБихромат калия представляет собой неслеживающиеся кристаллы преимущественно оранжевого цвета (иногда красноватые), которые хорошо растворяются в водной среде и по форме напоминают тончайшие иголочки либо пластинки. Пр...
 Образование Химический элемент олово. Свойства и применение олова
Образование Химический элемент олово. Свойства и применение оловаКаждый химический элемент периодической системы и образованные им простые и сложные вещества уникальны. Они имеют неповторимые свойства, а многие вносят неоспоримо значимый вклад в жизнь человека и существование в цел...
 Здоровье Цетрария исландская (исландский мох): описание, фармакологические свойства, химический состав и применение
Здоровье Цетрария исландская (исландский мох): описание, фармакологические свойства, химический состав и применениеЧто представляет собой такое растение, как цетрария (исландский мох)? Где произрастает? В каких сферах находит свое применение? На все эти вопросы постараемся ответить в нашей публикации, а также расскажем, какие имее...
 Автомобили Универсальный растворитель «Бензин-калоша»: свойства и применение
Автомобили Универсальный растворитель «Бензин-калоша»: свойства и применениеРастворители – химические соединения, применяемые для растворения различных веществ. Для практических бытовых целей они необходимы не менее, нежели для применения в промышленном производстве. На прилавках строит...
 Бизнес Горючие газы: названия, свойства и применение
Бизнес Горючие газы: названия, свойства и применениеГорючие газы – вещества с низким порогом теплоты сгорания. Это основной компонент газообразного топлива, которое используется для газоснабжения городов, в промышленности и других сферах жизнедеятельности. Физико...
monateka.com


 Отёска стен и прирубка косяков - Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу.
Отёска стен и прирубка косяков - Когда на доме не достаёт окон и дверей, красивое высокое крыльцо ещё только в воображении, приходится подниматься с улицы в дом по трапу. Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) - В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар.
Дифференциальные уравнения второго порядка (модель рынка с прогнозируемыми ценами) - В простых моделях рынка спрос и предложение обычно полагают зависящими только от текущей цены на товар.














