Содержание
4.2. Простые эфиры спиртов
Простыми
эфирами
называются органические соединения, в
которых два углеводородных радикала
связаны между собой атомом кислорода.
Простые эфиры можно рассматривать как
продукты замещения атома водорода в
гидроксиле спирта радикалом:
R
– O
– H
R
– O
– R/
Общая
формула простых эфиров СnH2n+2O.
Радикалы
в молекуле простого эфира могут быть
одинаковыми, например, в эфире СН3
– О – СН3,
или же разными, например, в эфире СН3
– О – С3Н7.
Эфир, имеющий различные радикалы,
называется смешанным.
Номенклатура
простых эфиров
Обычно
эфиры называются по тем радикалам,
которые входят в их состав (рациональная
номенклатура).
По
международной номенклатуре простые
эфиры обозначают как производные
углеводородов, в которых атом водорода
замещен алкоксигруппой
(RO
–), например, метоксигруппой СН3О
–, этоксигруппой С2Н5О
– и т. д.
д.
Простой | Рациональная | Номенклатура |
СН3– О – СН3 | диметиловый | метокисметан |
С2Н5– О – С2Н5 | диэтиловый | этоксиэтан |
СН3– О – С2Н5 | метилэтиловый | метоксиэтан |
С2Н5– О – С3Н7 | этилпропиловый | этоксипропан |
Изомерия
простых эфиров
1.
Изомерия простых эфиров определяется
изомерией радикалов, связанных с
кислородом.
С4Н10О
СН3– О –
СН2– СН2– СН3 метилпропиловый
эфир
С2Н5– О – С2Н5диэтиловый эфир
СН3— О – СН – СН3метилизопропиловый
эфир
СН3
2. Межклассовыми
изомерами простых эфиров являются
одноатомные спирты.
СН3– СН2– СН2– СН2– ОН бутанол-1
Физические
свойства простых эфиров
Диметиловый
и метилэтиловый эфиры представляют
собой при обычных условиях газообразные
вещества.
Начиная
с диэтилового эфира, вещества этого
класса представляют собой бесцветные,
легкоподвижные жидкости с характерным
запахом.
Простые эфиры
легче воды и почти не растворяются в
ней. Из-за отсутствия водородных связей
между молекулами, простые эфиры кипят
при более низкой температуре, чем
соответствующие спирты.
В органических
растворителях простые эфиры растворяются
легко и сами растворяют многие вещества.
Наиболее
распространенным соединением этого
класса является диэтиловый
эфир С2Н5
– О – С2Н5.
Получен диэтиловый эфир был еще в XVI
веке Кордусом.
Очень часто его называют “серный эфир”.
Это название, полученное в XVIII
веке, связано со способом получения
эфира: взаимодействие этилового спирта
с серной кислотой.
Диэтиловый
эфир – бесцветная, очень подвижная
жидкость с сильным характерным запахом.
Это вещество чрезвычайно взрывопожароопасно.
Температура
кипения диэтилового эфира 34,60С,
температура замерзания 1170С.
Эфир плохо растворим в воде (1 объем
эфира растворяется в 10 объемах воды).
Эфир легче воды (плотность 714 г/л).
Диэтиловый
эфир склонен к электризации: разряды
статического электричества могут
возникнуть в момент переливания эфира
и послужить причиной его воспламенения.
Пары
диэтилового эфира в 2,5 раза тяжелее
воздуха и образует с ним взрывоопасные
смеси. Концентрационные пределы
распространения пламени КПР 1,7 – 49 %.
Пары
эфира могут распространяться на
значительные расстояния, сохраняя при
этом способность к горению. Основная
мера предосторожности при работе с
эфиром –
это удаление от открытого огня и сильно
нагретых приборов и поверхностей,
включенных электрических плиток.
Температура
вспышки эфира – 450С,
температура самовоспламенения 1640С.
При
горении эфир горит синеватым пламенем
с выделением большого количества тепла.
Пламя эфира быстро увеличивается, т.к.
верхний слой его быстро нагревается до
температуры кипения. При горении эфир
нагревается в глубину. Скорость роста
Скорость роста
нагретого слоя составляет 45 см/час, а
скорость выгорания его со свободной
поверхности 30 см/час.
При
контакте с сильными окислителями (KMnO4,
CrO3,
галогены) диэтиловый эфир самовозгорается.
Кроме
этого, при контакте с кислородом воздуха
диэтиловый эфир может образовывать
перекисные соединения, которые являются
чрезвычайно взрывоопасными веществами.
Способы
получения простых эфиров
1.
Межмолекулярная дегидратация спиртов
H2SO4конц.
С2Н5–ОН
+ НО – С2Н5С2Н5– О – С2Н5+ Н2О
этанол
диэтиловый эфир
2.
Взаимодействие галогеноводородов и
алкоголятов
СН3–I+NaOС2Н5СН3– О –
С2Н5+NaI
иодметан
этилат метилэтиловый
натрия эфир
Химические
свойства простых эфиров
1.
Простые эфиры – довольно инертные
вещества, не склонные к химическим
реакциям. Однако при действии
концентрированных кислот они разлагаются
С2Н5–
О – С2Н5+ НI
конц.С2Н5ОН
+ С2Н5I
диэтиловый
этанол иодэтан
эфир
2.
Реакции окисления
Полное
окисление — горение:
С4Н10О
+ 6(О2+ 3,76N2)4СО2+ 5Н2О + 63,76N2
Неполное
окисление
При стоянии,
особенно на свету, эфир под влиянием
кислорода окисляется и разлагается с
образованием ядовитых и взрывоопасных
продуктов– перекисных соединений и
продуктов их дальнейшего разложения.
Н
ОН
\
/
О
– С – СН3
С2Н5– О – С2Н5+ 3[О]
О
– С – СН3
/
\
НО
Н гидроперекись оксиэтила
Применение
простых эфиров
Диэтиловый
эфир является хорошим органическим
растворителем. Его применяют для
извлечения различных полезных веществ
из растений, для чистки тканей, при
изготовлении порохов и искусственного
волокна.
В
медицине эфир применяется для общего
наркоза.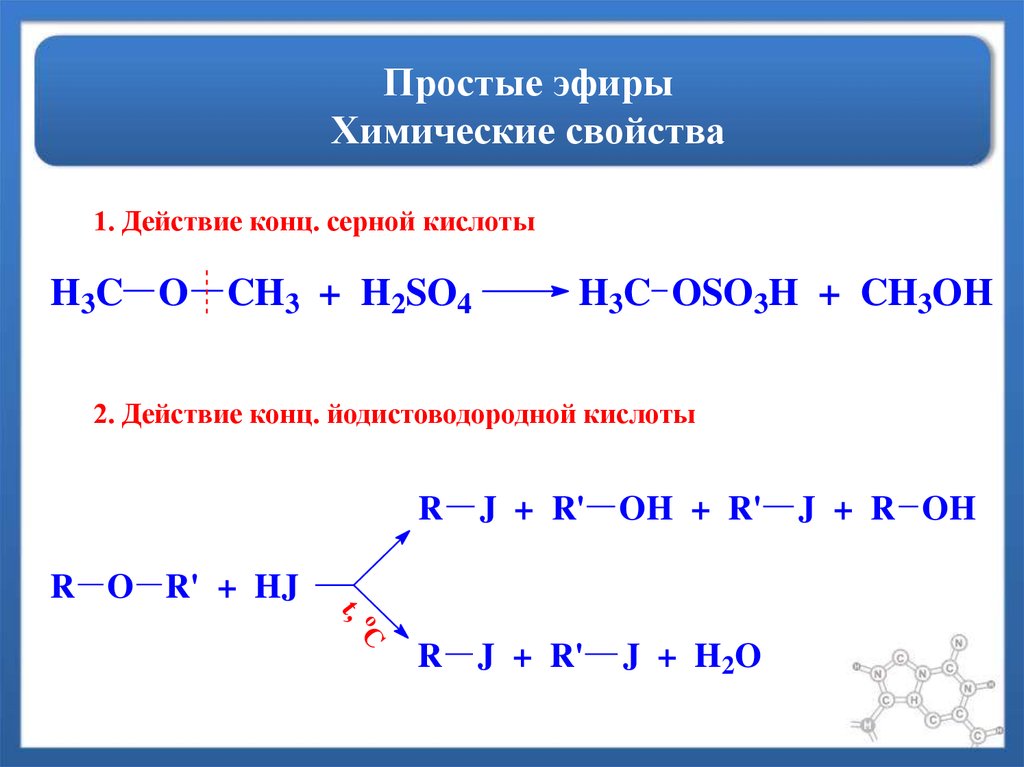 Впервые с этой целью при
Впервые с этой целью при
проведении хирургической операции эфир
был использован американским врачом
Джексоном
в 1842 году. За введение этого метода
горячо боролся русский хирург Н.И.
Пирогов.
Эксперимент по органической химии
|
Главная
|
Химия
|
Чёрная
|
Гостевая
|
Скачать
Предельные углеводороды
Метан
Получение метана
в лаборатории (60)
Метан легче
воздуха (63)
Горение метана
(64)
Определение
качественного состава метана (65)
Взрыв смеси
метана с кислородом (66)
Горение метана в
хлоре (67)
Замещение в
метане водорода хлором (68)
Разложение
метана в искровом разряде (70)
Термическое разложение
метана (72)
Другие способы
получения метана (72)
Опыты с
природным газом (74)
Гомологи метана
Получение этана
и опыты с ним (74)
Опыты с пропаном
(76)
Синтез бутана из
галогенопроизводных этана (79)
Синтез
диизоамила С10Н22 (80)
Доказательство
качественного состава высших углеводородов (81)
Галогенопроизводные предельных углеводородов
Взаимодействие
галогенопроизводных с азотнокислым серебром (81)
Вытеснение
галогенами друг друга из соединений (82)
Термическое
разложение йодоформа (82)
Открытие
галогенов в органических веществах (82)
Непредельные углеводороды
Этилен
Горение этилена
(84)
Взрыв смеси
этилена с кислородом (84)
Разложение
этилена в искровом разряде (85)
Реакция этилена
с бромом (86)
Окисление
этилена раствором перманганата (92)
Реакция этилена
с хлором (реакция соединения) (92)
Горение этилена
в хлоре (94)
Получение
этилена из этилового спирта в присутствии серной кислоты (94)
Получение
этилена из спирта над окисью алюминия (98)
Получение
этилена из дибром-зтана (100)
Опыты с
полиэтиленом (100)
Опыты с другими углеводородами, содержащими двойную связь
Получение
амилена из амилового спирта (102)
Ацетилен
Получение
ацетилена (102)
Синтез ацетилена
(105)
Растворение
ацетилена в воде (107)
Растворение ацетилена
в ацетоне (107)
Горение
ацетилена (107)
Взрыв ацетилена
с кислородом (108)
Реакция ацетилена
с бромом и раствором перманганата (108)
Горение
ацетилена в хлоре (109)
Комбинированные
опыты с ацетиленом (110)
Опыты с полихлорвинилом (111)
Каучук
Отношение
каучука и резины к растворителям (112)
Взаимодействие
каучука с бромом (112)
Разложение
каучука при нагревании (112)
Опыты с
резиновым клеем (113)
Открытие серы в
вулканизированном каучуке (ИЗ)
Извлечение
каучука из млечного сока растений (ИЗ)
Ароматические углеводороды
Бензол
Растворимость
бензола (114)
Бензол как
растворитель (114)
Температура
замерзания бензола (114)
Горение бензола
(115)
Отношение
бензола к бромной воде и раствору марганцовокислого калия
Бромирование
бензола (115)
Нитрование
бензола (117)
Присоединение
хлора к бензолу (119)
Получение
бензола из ацетилена (120)
Получение
бензола из бензойной кислоты и ее солей (122)
Гомологи бензола
Окисление
толуола (122)
Галогенирование
толуола (123)
Подвижность
атомов галогена в бензольном ядре и в боковой цепи (124)
Синтез гомологов
бензола (124)
Нафталин
Возгонка нафталина
(127)
Стирол
Непредельные
свойства стирола (128)
Получение
стирола из полистирола (128)
Опыты с
полистиролом (129)
Полимеризация
стирола (129)
Каменный уголь
Пирогенетическое
разложение каменного угля (130)
Разгонка
каменноугольной смолы (131)
Определение
содержания влаги и летучих продуктов в твердом топливе (132)
Нефть
Удельный вес и
растворимость нефти (133)
Сравнительная
летучесть нефтепродуктов (133)
Бензин и керосин
как растворители (133)
Горение высших
углеводородов (134)
Взрыв паров
бензина с воздухом (134)
Отношение
углеводородов нефти к химическим реагентам (135)
Фракционная перегонка
нефти (135)
Перегонка нефти
на ректификационной колонке (137)
Перегонка
мазута с водяным паром (137)
Крекинг
нефтепродуктов (138)
Каталитический
крекинг нефтепродуктов (142)
Ароматизация
нефтепродуктов (144)
Очистка бензина
и керосина (145)
Определение
температуры вспышки нефтепродуктов (146)
Спирты, Фенол, Простые эфиры
Этиловый спирт
Удельный вес
спирта и изменение объема при смешении с водой
Обнаружение воды
в спирте (148)
Обнаружение высших
спиртов (сивушного масла) в спирте (148)
Концентрирование
раствора спирта (148)
Получение
абсолютного спирта (148)
Спирт-растворитель
(149)
Горение спирта
(150)
Обнаружение
спирта в вине или пиве (150)
Взаимодействие
спирта с натрием (151)
Дегидратация
этилового спирта (153)
Взаимодействие
спирта с хлористым водородом (155)
Взаимодействие
спирта с бромистым водородом (157)
Получение
йодистого этила (158)
Качественная
реакция на спирт (159)
Получение
этилового спирта из бромистого этила 1би)
Получение
этилового спирта брожением сахара (161)
Получение этилового
спирта из этилена в присутствии серной кислоты (162)
Получение этилового
спирта прямой гидратацией этилена (164)
Метиловый спирт
Взаимодействие
метилового спирта с хлористым водородом (165)
Получение
метилового спирта при сухой перегонке дерева (166)
Сравнение
свойств одноатомных спиртов (168)
Глицерин
Растворимость
глицерина в воде (169)
Понижение точки
замерзания водных растворов глицерина (169)
Гигроскопичность
глицерина (169)
Сладкий вкус
глицерина (169)
Горение
глицерина (169)
Реакция
глицерина с натрием (171)
Реакция с
гидратом окиси меди (171)
Фенол
Растворимость
фенола в воде и щелочах (171)
Фенол —слабая
кислота (171)
Реакция фенола с
бромной водой (171)
Качественная
реакция фенола (172)
Дезинфицирующее
действие фенола (172)
Нитрование
фенола (172)
Получение фенола
из салициловой кислоты (174)
Простые эфиры
Низкая
температура кипения эфира (174)
Охлаждение при
испарении эфира (174)
Пары эфира
тяжелее воздуха (174)
Взаимная
растворимость эфира и воды (174)
Эфир как
растворитель (175)
Получение эфира
из спирта (175)
Проверка чистоты
эфира (176)
Сравнение
свойств диэтилового эфира и бутилового спирта (178)
Альдегиды и кетоны
Формальдегид
Запах
формальдегида (178)
Горючесть
формальдегида (178)
Получение
формальдегида (178)
Взаимодействие
формальдегида с окисью серебра (180)
Дезинфицирующее
действие формальдегида (182)
Полимеризация и
деполимеризация альдегида (182)
Взаимодействие
формальдегида с аммиаком (182)
Получение
фенолформальдегидных смол (183)
Уксусный альдегид
Получение
уксусного альдегида окислением этилового спирта (185),
Получение уксусного
альдегида каталитической дегидрогенизацией этилового спирта (186)
Получение
уксусного альдегида гидратацией ацетилена (189)
Бензойный альдегид
Запах
бензальдегида и окисление кислородом воздуха (192)
Реакция
серебряного зеркала (192)
Ацетон
Горение ацетона
(193)
Растворимость
ацетона в воде (193)
Растворимость
ацетилена в ацетоне (193)
Ацетон как
растворитель смол и пластмасс (193)
Отношение к
аммиачному раствору окиси серебра (193)
Окисление
ацетона (193)
Получение
бромацетона (194)
Получение ацетона
(195)
Карболовые кислоты
Уксусная кислота
Кристаллизация
уксусной кислоты (197)
Горение уксусной
кислоты (197)
Отношение
уксусной кислоты к окислителям (198)
Действие
уксусной кислоты на индикаторы (198)
Взаимодействие
кислоты с металлами (198)
Взаимодействие с
основаниями (198)
Взаимодействие
с солями (198)
Уксусная кислота
— кислота слабая (199)
Основность
уксусной кислоты (199)
Термическое
разложение уксусной кислоты (200)
Количественное
получение метана из солей уксусной кислоты (202)
Получение
кислоты окислением этилового спирта (205)
Получение
уксусной кислоты из ее солей (206)
Получение
кислоты из продуктов сухой перегонки дерева (206)
Получение
уксусного ангидрида (206)
Получение
хлористого ацетила (207)
Исследование
образца уксусной кислоты (208)
Муравьиная кислота
Разложение
муравьиной кислоты на окись углерода и воду (209)
Взаимодействие
кислоты с металлом (210)
Окисление муравьиной
кислоты (211)
Получение муравьиной
кислоты (211)
Взаимодействие муравьинокислого
натрия с натровой известью (212)
Стеариновая кислота
Свойства
стеариновой кислоты (213)
Стеариновая
кислота — кислота слабая (213)
Получение мыла
(стеариново-кислого натрия) из стеарина (213)
Получение
стеариновой кислоты из мыла (214)
Моющее действие
мыла (214)
Действие жесткой
воды на мыло (215)
Непредельные кислоты
Получение
метакриловой кислоты (216)
Свойства
метакриловой кислоты (216)
Непредельность
олеиновой кислоты (216)
Щавелевая кислота
Получение
щавелевой кислоты из муравьиной (217)
Разложение
щавелевой кислоты при нагревании с серной кислотой (217)
Окисление
щавелевой кислоты (218)
Образование
кислых и средних солей щавелевой кислоты (219)
Получение
препарата щавелевой кислоты (219)
Бензойная кислота
Растворимость
бензойной кислоты в воде (220)
Растворимость
бензойной кислоты в щелочах (220)
Возгонка бензойной
кислоты (220)
Получение
бензойной кислоты окислением бензальдегида (221)
Получение
бензола из бензойной кислоты (221)
Молочная и салициловая кислоты
Свойства молочной
кислоты (221)
Опыты с
салициловой кислотой (222)
Сложные эфиры, Жиры
Сложные эфиры
Получение
уксусноэтилового эфира (223), Получение уксусноизоамилового эфира (226)
Получение
бензойноэтилового эфира (226)
Получение
салициловометилового эфира (227)
Синтез аспирина
(227)
Получение
диметилового эфира щавелевой кислоты (228)
Омыление
сложных эфиров (228)
Гидролиз
аспирина (229)
Получение
метилового эфира метакриловой кислоты из органического стекла (230)
Получение,
поли-метилметакрилата (231)
Опыты с
полиметилметакрилатом (231)
Жиры
Растворимость
жиров (231)
Экстрагирование
жиров и масел (231)
Плавление и
затвердевание жиров (233)
Реакция
непредельных жиров (масел) (234)
Определение
степени непредельности жиров (235)
Определение
содержания кислот в жирах (235)
Высыхающие и
невысыхающие масла (235)
Омыление жиров
(236)
Определение
общей и свободной щелочи в мыле (237)
Гидрогенизация
масел (238)
Углеводы
Глюкоза
Физические
свойства глюкозы (242)
Реакция
спиртовых групп глюкозы (242)
Реакция
альдегидной группы (243)
Обнаружение глюкозы
в фруктах и ягодах (244)
Брожение глюкозы
(244)
Синтез моносахаридов
из формальдегида (244)
Сахароза
Изменение сахара
при нагревании (245)
Обугливание
сахара концентрированной серной кислотой (246)
Обнаружение
гидроксильных групп в сахаре (246)
Отношение
сахарозы к раствору окиси серебра и гидрату окиси меди (247)
Гидролиз
сахарозы (247)
Получение сахара
из свеклы (248)
Опыты с молочным
сахаром (250)
Крахмал
Приготовление
крахмального клейстера (251)
Реакция крахмала
с йодом (251)
Исследование
различных продуктов на присутствие крахмала (252)
Гидролиз
крахмала (252)
Получение патоки
и глюкозы из крахмала (254)
Получение
крахмала из картофеля (255)
Клетчатка (целлюлоза)
Гидролиз
клетчатки до глюкозы (256)
Гидролиз
клетчатки до амилоида (258)
Нитрование
клетчатки и опыты с нитроклетчаткой (258)
Получение
искусственного волокна (260)
Получение ацетил
целлюлозы и опыты с ней (264)
Амины, Красители
Жирные амины
Получение аминов
из селедочного рассола (265)
Получение
метиламина из хлористоводородной соли и опыты с ним (266)
Получение
метиламина из ацетамида (267)
Получение
ацетамида (268)
Анилин
Отношение
анилина к индикаторам (268)
Взаимодействие
анилина с кислотами (269)
Взаимодействие
анилина с бромной водой (269)
Окисление
анилина (271)
Реакция анилина
с хлорной известью (271)
Получение
анилина (272)
Получение
анилинформальдегидной смолы (274)
Красители и крашение
Синтез
диметиламиноазобензола (275)
Синтез
гелиантина (метилоранжа) (276)
Синтез
нафтолоранжа (277)
Синтез красителя
«пара-красный»
Ледяное крашение
(278)
Крашение
ализарином (279)
Амиды кислот, Карбамид
Гидролиз
карбамида (280)
Взаимодействие
карбамида с азотной кислотой (280)
Взаимодействие
карбамида с щавелевой кислотой (280)
Образование биурета
(281)
Получение
карбамидоформальдегидной (мочевиноформальде-гидной) смолы (281)
Полимеры
Капрон
Распознавание полимеров
Опыты с капроном
(282)
Распознавание
пластмасс (283)
Распознавание
волокнистых материалов (284)
Белки
Открытие в
белках азота (286)
Открытие в
белках серы (286)
Прохождение
светового луча через коллоидный раствор белка (286)
Свертывание
белков (287)
Цветные реакции
белков (288)
Действие
температуры на белки
Распознавание
белковых материалов
Измерения скорости плоского пламени диэтилового эфира в воздухе
[1] Kohse-Hoinghaus K, Osswald P, Cool TA, Kasper T, Hansen N, Qi F, et al.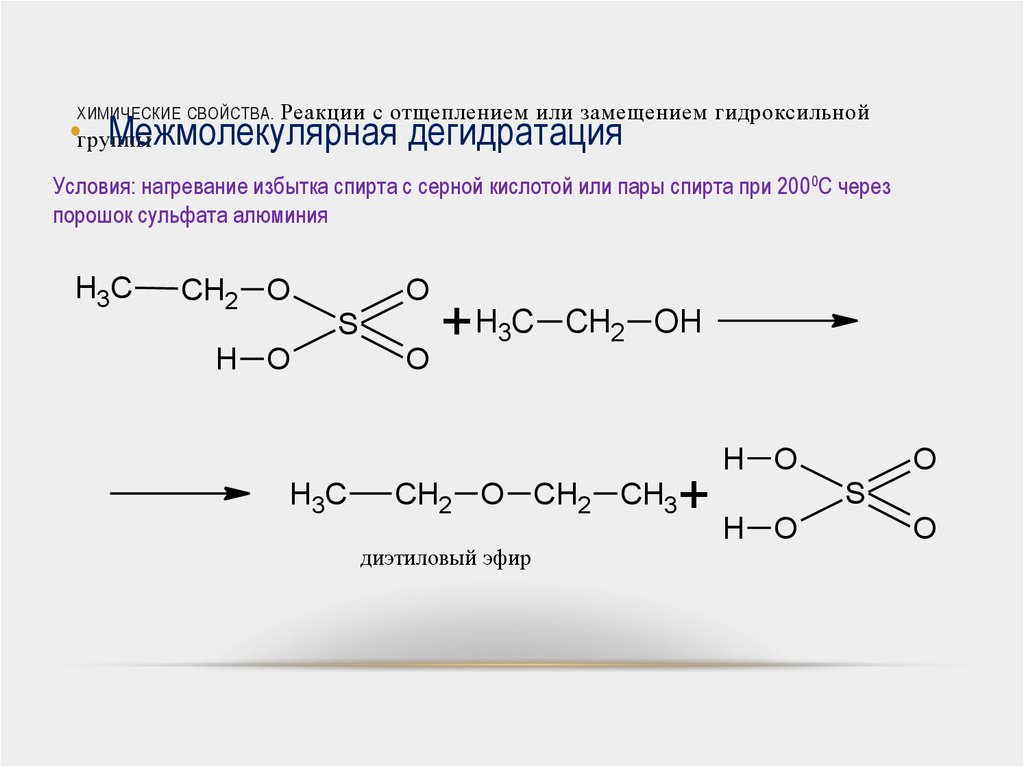 Химия сжигания биотоплива: от этанола до биодизеля. Angew Chem-Int Edit. 2010;49(21):3572–97. [PubMed] [Google Scholar]
Химия сжигания биотоплива: от этанола до биодизеля. Angew Chem-Int Edit. 2010;49(21):3572–97. [PubMed] [Google Scholar]
[2] Пиментел Д. Этаноловое топливо: энергетический баланс, экономика и воздействие на окружающую среду отрицательны. Исследования природных ресурсов. 2003;12(2):127–34. [Google Scholar]
[3] Bailey B, Eberhardt J, Goguen S, Erwin J. SAE Paper. 972978 1997. Диэтиловый эфир (ДЭЭ) как возобновляемое топливо. [Google Scholar]
[4] Davoud JG, Hinshelwood CN. Термическое разложение диэтилового эфира. Труды Лондонского королевского общества, серия А, математические и физические науки. 1939; 171 (944): 39–54. [Google Scholar]
[5] Freeman GR, Danby CJ, Hinshelwood C. Термическое разложение диэтилового эфира. I. Отношения ставка-давление. Труды Лондонского королевского общества, серия А, математические и физические науки. 1958;245(1240):28–39. [Google Scholar]
[6] Danby CJ, Freeman GR. Термическое разложение диэтилового эфира. II. Аналитический обзор продуктов реакции в зависимости от условий реакции. Труды Лондонского королевского общества, серия А, математические и физические науки. 1958; 245 (1240): 40–8. [Google Scholar]
Труды Лондонского королевского общества, серия А, математические и физические науки. 1958; 245 (1240): 40–8. [Google Scholar]
[7] Freeman GR. Термическое разложение диэтилового эфира. III. Действие ингибиторов и механизм реакции. Труды Лондонского королевского общества, серия А, математические и физические науки. 1958;245(1240):49–67. [Google Scholar]
[8] Freeman GR, Danby CJ. Термическое разложение диэтилового эфира. IV. Получение цианидов и механизм реакции, вызванной оксидом азота. Труды Лондонского королевского общества, серия А, математические и физические науки. 1958; 245 (1240): 68–74. [Google Scholar]
[9] Freeman GR. Термическое разложение диэтилового эфира. V. Производство этанола из диэтилового эфира и пиролиз этанола. Труды Лондонского королевского общества, серия А, математические и физические науки. 1958;245(1240):75–83. [Google Scholar]
[10] Waddington DJ. Газовое окисление диэтилового эфира. Труды Лондонского королевского общества, серия А, математические и физические науки.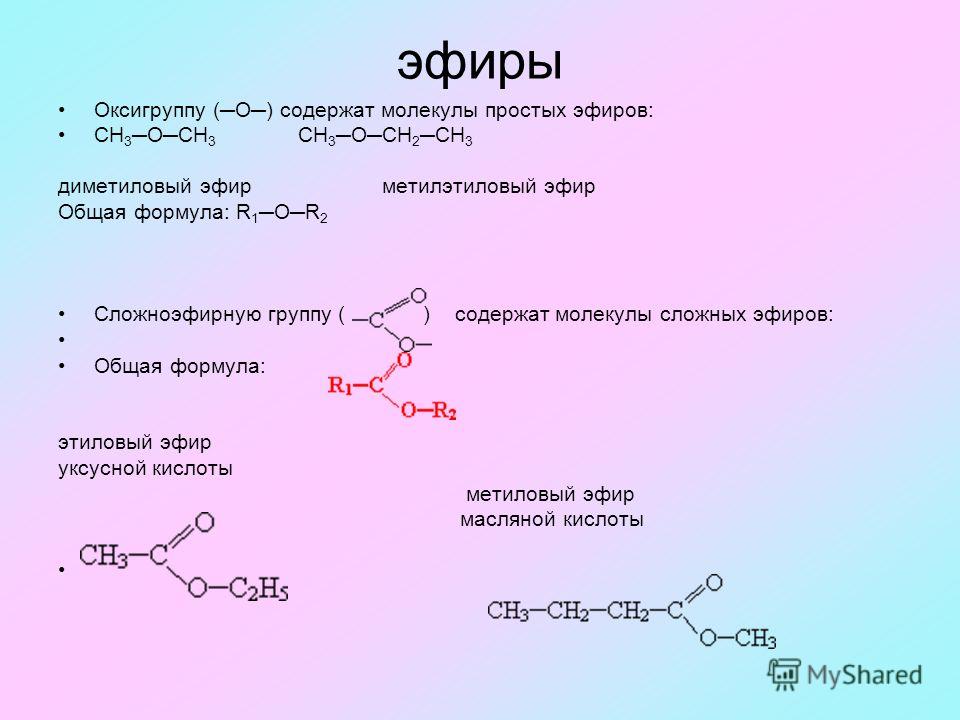 1959; 252 (1269): 260–72. [Google Scholar]
1959; 252 (1269): 260–72. [Google Scholar]
[11] Laidler KJ, McKenney DJ. Кинетика и механизмы пиролиза диэтилового эфира. I. Незаторможенная реакция. Труды Лондонского королевского общества, серия А, математические и физические науки. 1964; 278 (1375): 505–16. [Академия Google]
[12] Лейдлер К.Дж., МакКенни Д.Дж. Кинетика и механизмы пиролиза диэтилового эфира. II. Реакция, ингибируемая оксидом азота. Труды Лондонского королевского общества, серия А, математические и физические науки. 1964; 278 (1375): 517–26. [Google Scholar]
[13] Mack JH, Flowers DL, Buchholz BA, Dibble RW. Исследование сжигания HCCI смесей диэтилового эфира и этанола с использованием трассировки углерода-14 и численного моделирования. Инст. сжигания проц. 2005; 30: 2693–700. [Академия Google]
[14] Мосбах С., Крафт М., Бхав А., Мосс Ф., Мак Дж. Х., Диббл Р. В. Документ SAE 2006-01-1362. 2006. Моделирование двигателя с воспламенением от сжатия с однородным зарядом, работающего на смеси DEE/EtOH. [Google Scholar]
[Google Scholar]
[15] Миллер Джоти Н.К., Нагараджан Г., Ренганараянан С. Экспериментальные исследования двигателя с однородным зарядом, работающего на сжиженном нефтяном газе, с использованием ДЭЭ в качестве усилителя воспламенения. Возобновляемая энергия. 2007;32(9):1581–93. [Google Scholar]
[16] Судхиш К., Малликарджуна Дж.М. Диэтиловый эфир как улучшитель воспламенения для воспламенения от сжатия гомогенного заряда биогаза (HCCI) — экспериментальное исследование. Энергия. 2010;35(9): 3614–22. [Google Scholar]
[17] Cinar C, Can O, Sahin F, Yucesu HS. Влияние предварительно смешанного диэтилового эфира (ДЭЭ) на выбросы при сгорании и выхлопе в дизельном двигателе HCCI-DI. Прикладная теплотехника. 2010;30(4):360–5. [Google Scholar]
[18] Иранманеш М., Субраманьям Дж. П., Бабу МКГ. Документ SAE 2008-28-0044. 2008. Потенциал диэтилового эфира в качестве дополнительного топлива для улучшения характеристик сгорания и выбросов дизельных двигателей. [Google Scholar]
[19] Иранманеш М. , Субрахманьям Дж. П., Бабу MKG. Документ SAE 2008-01-1805. 2008. Потенциал диэтилового эфира в качестве смешанного дополнительного оксигенированного топлива с биодизелем для улучшения характеристик сгорания и выбросов дизельных двигателей. [Академия Google]
, Субрахманьям Дж. П., Бабу MKG. Документ SAE 2008-01-1805. 2008. Потенциал диэтилового эфира в качестве смешанного дополнительного оксигенированного топлива с биодизелем для улучшения характеристик сгорания и выбросов дизельных двигателей. [Академия Google]
[20] Yasunaga K, Gillespie F, Simmie JM, Curran HJ, Kuraguchi Y, Hoshikawa H, et al. Исследование пиролиза и окисления диэтилового эфира с использованием нескольких ударных трубок и химико-кинетического моделирования. Журнал физической химии А. 2010; 114 (34): 9098–109. [PubMed] [Google Scholar]
[21] Agnew W, Agnew J. Спектры видимого излучения двухступенчатого пламени диэтилового эфира, полученного в плоскопламенной горелке. Промышленная и инженерная химия. 1956; 48 (12): 2224–31. [Google Scholar]
[22] Гриффитс Дж. Ф., Иномата Т. Колебательное холодное пламя при горении диэтилового эфира. Журнал Химического общества, Faraday Transactions. 1992;88(21):3153–8. [Google Scholar]
[23] Gibbs GJ, Calcote HF.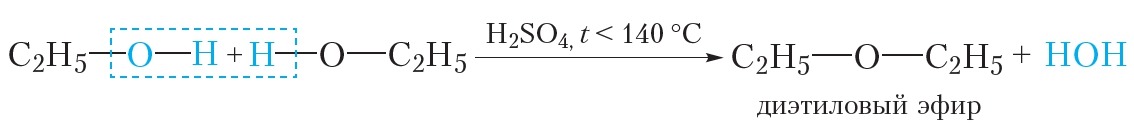 Влияние молекулярной структуры на скорость горения. Журнал химических и инженерных данных. 1959; 4 (3): 226–37. [Google Scholar]
Влияние молекулярной структуры на скорость горения. Журнал химических и инженерных данных. 1959; 4 (3): 226–37. [Google Scholar]
[24] Di YG, Huang ZH, Zhang N, Zheng B, Wu XS, Zhang ZY. Измерение ламинарных скоростей горения и маркштейновых длин смесей диэтилового эфира с воздухом при различных начальных давлениях и температурах. Энергетическое топливо. 2009;23:2490–7. [Google Scholar]
[25] Zhang N, Di Y, Huang Z, Zheng B, Zhang Z. Экспериментальное исследование характеристик горения смесей диэтилового эфира с воздухом, разбавленных азотом. Энергетическое топливо. 2009 г.;23(12):5798–805. [Google Scholar]
[26] Zhang N, Di YG, Huang ZH, Zhang ZY. Анализ нестабильности пламени предварительно смешанных смесей диэтилового эфира с воздухом при повышенных давлениях. Бюллетень китайской науки. 2010;55(3):314–20. [Google Scholar]
[27] de Goey LPH, van Maaren A, Quax RM. Стабилизация адиабатических предварительно смешанных ламинарных пламен на плоскопламенной горелке. Технология горения. 1993;92(1):201–7. [Google Scholar]
Технология горения. 1993;92(1):201–7. [Google Scholar]
[28] Dirrenberger P, Le Gall H, Bounaceur R, Herbinet O, Glaude PA, Konnov AA, et al. Измерения скорости ламинарного пламени компонентов природного газа. Энергетическое топливо. 2011;25(9): 3875–84. [Google Scholar]
[29] Davis SG, Law CK. Определение влияния структуры топлива на скорость ламинарного пламени углеводородов от C1 до C8. Технология горения. 1998;140(1):427–49. [Google Scholar]
[30] Saeed K, Stone CR. Измерения ламинарной скорости горения смесей метанола и воздуха из сосуда постоянного объема с использованием многозонной модели. Горение и пламя. 2004;139(1-2):152–66. [Google Scholar]
[31] Ó Conaire M, Curran HJ, Simmie JM, Pitz WJ, Westbrook CK. Комплексное моделирование окисления водорода. Междунар. Дж. Хим. Кинет. 2004; 36: 603–622. [Академия Google]
[32] Healy D, Kalitan DM, Aul CJ, Petersen EL, Bourque G, Curran HJ. Окисление смесей природного газа четвертичных алканов С1-С5 при высоких давлениях.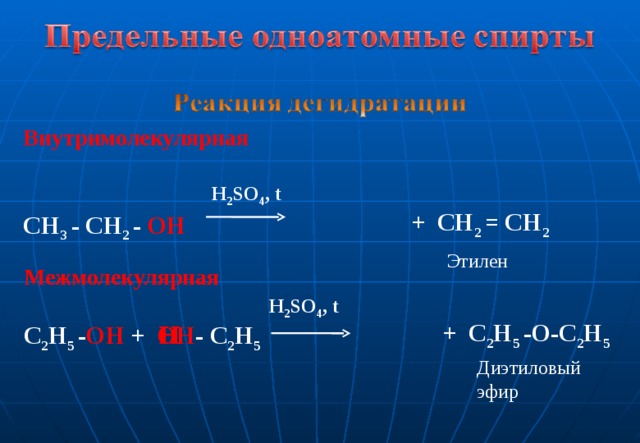 Энергетическое топливо. 2010; 24:1521–1528. [Google Scholar]
Энергетическое топливо. 2010; 24:1521–1528. [Google Scholar]
[33] Lowry W, de Vries J, Krejci M, Petersen EL, Serinyel Z, Metcalfe WK, et al. Ламинарные измерения скорости пламени и моделирование чистых алканов и смесей алканов при повышенных давлениях; Материалы конференции ASME.2010. стр. 855–873. [Google Scholar]
[34] Керомнес А., Меткалф В.К., Донохью Н., Карран Х.Дж., Питц В.Дж. 7 -е Национальное собрание США Института горения. Технологический институт Джорджии; Atlanta: 2011. [Google Scholar]
[35] Metcalfe WK, Burke SM, Aul CJ, Petersen EL, Curran HJ. Материалы Европейского совещания по проблемам горения; Кардифф. 2011. [Google Scholar]
[36] CHEMKIN-PRO 15101. Дизайн реакций; Сан-Диего: 2010. [Google Scholar]
[PDF] Теплота сгорания: диэтиловый эфир и 1,1-диэтоксиэтан.
- DOI:10.3891/ACTA.CHEM.SCAND.22-2731
- Идентификатор корпуса: 96048132
@article{Pihlaja1968HeatsOC,
title={Теплота сгорания: диэтиловый эфир и 1,1-диэтоксиэтан. },
автор={Калеви Пихлая и Юсси Хейккиль{\"а} и О. Бухардт и Торбй{орн Норин},
журнал = {Acta Chemica Scandinavica},
год = {1968},
объем = {22},
страницы={2731-2732}
}
},
автор={Калеви Пихлая и Юсси Хейккиль{\"а} и О. Бухардт и Торбй{орн Норин},
журнал = {Acta Chemica Scandinavica},
год = {1968},
объем = {22},
страницы={2731-2732}
} - К. Пихлая, Юсси Хейккиля, Т. Норин
- Опубликовано в 1968 г.
- Химия
- Acta Chemica Scandinavica
Просмотр через Publisher
actachemscand.org
О прогнозировании стандартной энтальпии образования кислородсодержащих соединений C2-C4.
При сравнении различных квантово-химических методов, использующих изодесмические реакции, производительность G4 является лучшей при среднем отклонении без знака (MUE) и стандартном отклонении (SD), но M06-2X может эффективно и точно предсказать ∆f Ho.
Влияние термохимии на предсказания оптимизированной кинетической модели: Самовоспламенение диэтилового эфира
- F. vom Lehn, L. Cai, H. Pitsch
Химия
- 2019
Квантово-химическое и кинетическое моделирование механизма самовоспламенения диэтилового эфира
- Jyu Herzkai Yasu.
 Werler, C. Schulz, M. Fikri
Werler, C. Schulz, M. Fikri Химия
- 2017
Экспериментальное исследование химических равновесия в жидко-фазой реакции между 1-оцтанолом и этанолом до 1 -этоксиктана
- и этанол до 1 -этоксиктана
- 7777777 гг. , М. Иборра, Х. Техеро, Ф. Кунил
Химия
- 2013
Константы равновесия для жидкофазной реакции дегидратации между 1-октанолом и этанолом до 1-этоксиоктана (ЭОЭ) и воды и реакции дегидратации между двумя молекулами этанола до…
Термохимия гетероатомные соединения: анализ и расчет термодинамических функций органических соединений V-VII групп Периодической системы Менделеева
- В. Овчинников
Химия
- 2013
Теплота парообразования (∆vapНo), все термодинамические функции ∆с,fGo, ∆с,fHo, So, ∆cSocond и теплоемкость (Cp) органических соединений V-VII групп Менделеева’ s Периодическая таблица может быть хорошо…
Управление воспламенением при воспламенении от сжатия гомогенного заряда (HCCI) путем адаптации молекулярной структуры топлива путем реакции с озоном
- A.
 Schönborn, P. Hellier, A. Aliev, N. Ladommatos
Schönborn, P. Hellier, A. Aliev, N. Ladommatos Инженерия, наука об окружающей среде
- 2010
Относительная энергия органических соединений I. Углеводороды и их кислородсодержащие производные
- Á. Фурка
Химия
- 2009
Энергия следующих типов соединений характеризуется расчетными относительными энтальпиями: алканы и циклоалканы, алкены и циклоалкены, полиолефины и циклические полиолефины Химические улучшители,…
3
- Такахиро Йоней, Кохтаро Хасимото и Мицуру Араи, М. Тамура
Химия
- 2003
Выполнены квантово-химические расчеты для выяснения химических свойств эффекта повышения цетанового числа и связи между химической структурой цетанового числа…
Улучшенные инкременты Бенсона для оценки Стандартные энтальпии образования и энтальпии испарения алкиловых эфиров, ацеталей, кеталей и ортоэфиров
- Веревкин С.
Химия
- 2002
Работа выполнена для оценки и уточнения значений групповой аддитивности, необходимых для прогнозирования стандартных энтальпий образования и энтальпий испарения эфиров, ацеталей,… OF THE CENTRAL CARBON ATOM
- S.


 },
автор={Калеви Пихлая и Юсси Хейккиль{\"а} и О. Бухардт и Торбй{орн Норин},
журнал = {Acta Chemica Scandinavica},
год = {1968},
объем = {22},
страницы={2731-2732}
}
},
автор={Калеви Пихлая и Юсси Хейккиль{\"а} и О. Бухардт и Торбй{орн Норин},
журнал = {Acta Chemica Scandinavica},
год = {1968},
объем = {22},
страницы={2731-2732}
}  Werler, C. Schulz, M. Fikri
Werler, C. Schulz, M. Fikri Schönborn, P. Hellier, A. Aliev, N. Ladommatos
Schönborn, P. Hellier, A. Aliev, N. Ladommatos