Содержание
Гидролиз — сложный эфир — Большая Энциклопедия Нефти и Газа, статья, страница 3
Cтраница 3
Гидролиз сложных эфиров катализируется как кислотами, так и основаниями.
[31]
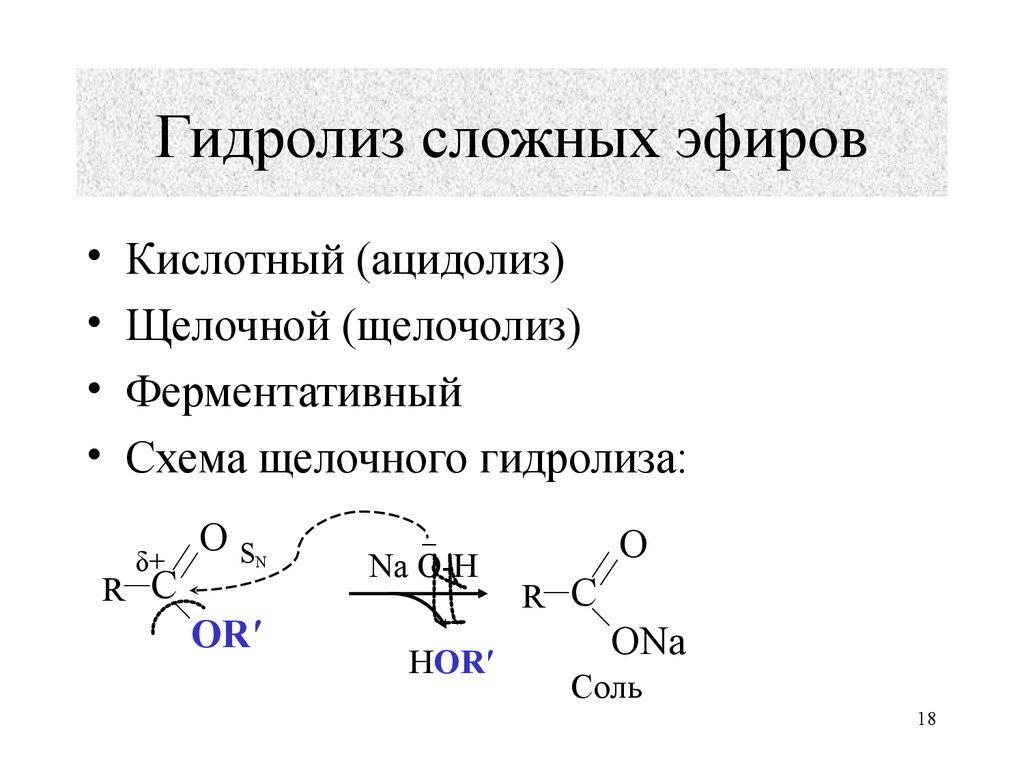
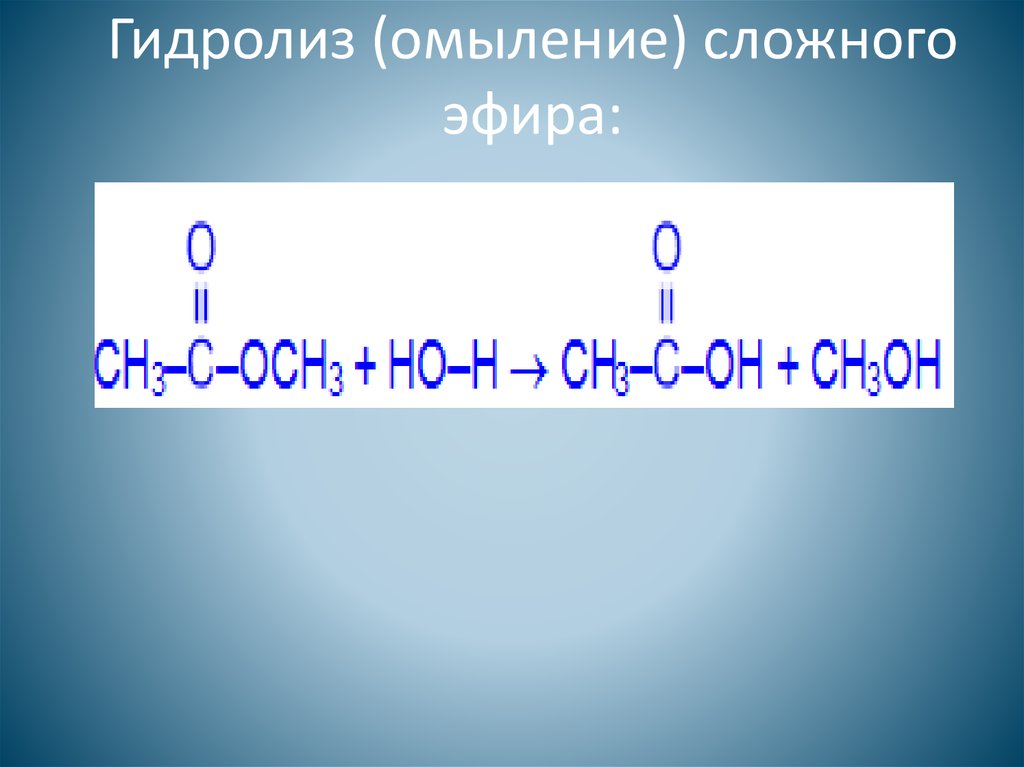
Гидролиз сложного эфира может протекать под действием оснований и называется в этом случае реакцией омыления.
[32]
Гидролиз сложных эфиров и амидов, реакция Канниццарог расщепление и циклизация четвертичных аммониевых солей и другие реакции ускоряются гидроокисями металлов. Очевидно, что каталитическая активность растворов гидроокисей связана с гид-роксильными ионами.
[33]
Гидролиз сложных эфиров оптически активных спиртов дает спирты, в которых стереохимическая конфигурация сохраняется. Сложные эфиры аллиловых и неопентютового спирта при гидролизе не перегруппировываются. Ясно, что эти факты говорят о том, что связь алкил-кислород в этих реакциях не затрагивается.
[34]
Гидролиз сложных эфиров и других соединений в водном растворе, катализирующийся ионом водорода, в кинетическом смысле принадлежит к той же категории реакций, к которой относятся и только что рассмотренные.
[35]
Гидролиз сложных эфиров в щелочной среде находит широкое практическое применение. Многие сложные эфиры, встречающиеся в природе, используют для получения кислот. Наиболее важную группу таких веществ составляют жиры, масла, вооки.
[36]
Гидролиз сложных эфиров усиливается гидроксильными ионами.
[37]
Гидролиз сложных эфиров усиливается гндроксид-ионами.
[38]
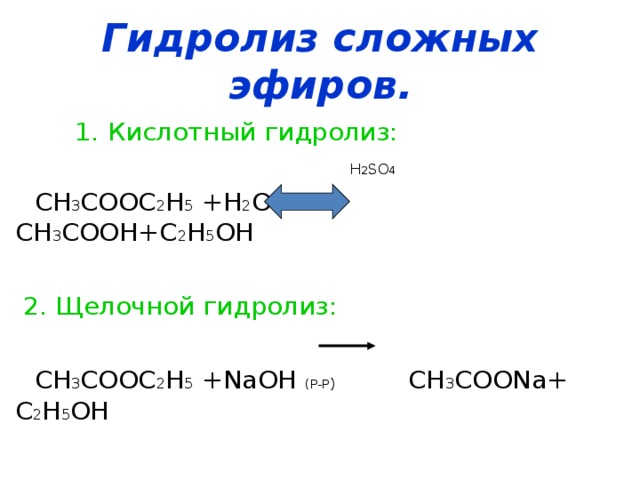
Гидролиз сложного эфира на спирт и кислоту при действии воды происходит медленно, но при прибавлении небольшого количества минеральной кислоты реакция значительно ускоряется. Точно так же ускоряют омыление и щелочи, однако в этом случае реакция несколько усложняется.
[39]
Гидролиз сложных эфиров усиливается гидроксид-ионами.
[40]
Гидролиз сложных эфиров заслуживает особого упоминания, так как этот процесс очень часто происходит в живых организмах. Щелочь нейтрализует образующуюся в результате гидролиза кислоту, при этом равновесие реакции сдвигается вправо.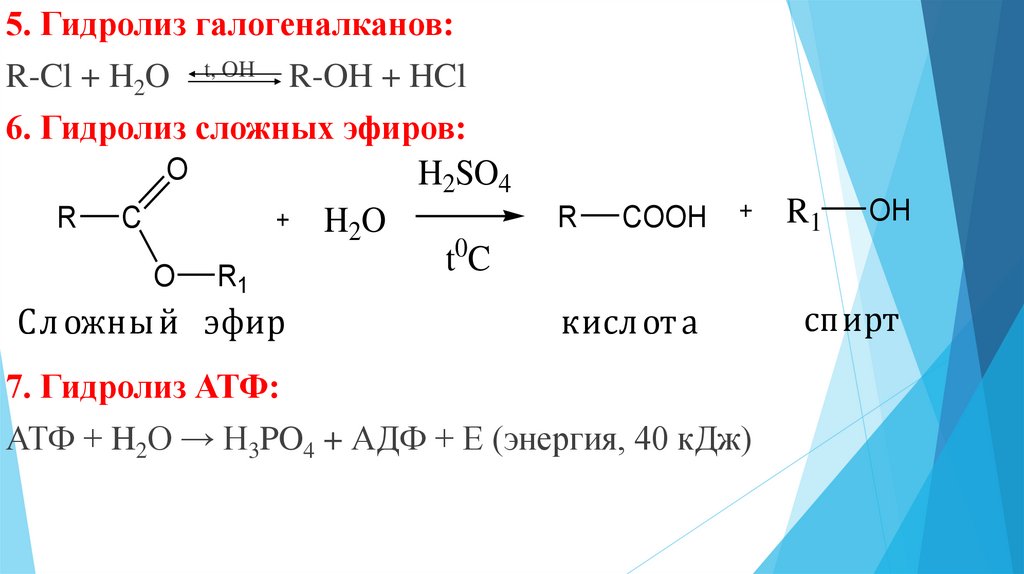 Реакции гидролиза, протекающие под действием щелочей, называют омылением. Происхождение этого термина связано с производством мыла ( солей высших жирных кислот) из жиров при использовании растворов щелочей.
Реакции гидролиза, протекающие под действием щелочей, называют омылением. Происхождение этого термина связано с производством мыла ( солей высших жирных кислот) из жиров при использовании растворов щелочей.
[41]
Гидролиз сложных эфиров обычно катализируется как кислотами, так и основаниями. Поскольку группа OR обладает более слабыми нуклеофугными свойствами, чем галогены или OCOR, вода не гидролизует большинство сложных эфиров. При катализе основаниями атакующей частицей служит более сильный нуклеофил — ОН-группа. Эта реакция носит название омыления и приводит к соли кислоты. Кислоты катализируют реакцию за счет того, что положительный заряд атома углерода карбонильной группы становится больше, и, следовательно, он легче подвергается атаке нуклеофилом. Обе реакции обратимы, и поэтому практической ценностью обладают только тогда, когда равновесия удается каким-либо способом сместить вправо.
[42]
Гидролиз сложных эфиров при помощи других катализаторов, например энзимов или реактива Твитчела, применяют обычно только в промышленности, а не в лабораторной практике.
[43]
Гидролиз сложных эфиров производится обычно в присутствии кислот или щелочей, играющих роль катализаторов.
[44]
Гидролиз сложных эфиров, называемый также омылением, является одной из наиболее важных реакций этой группы веществ.
[45]
Страницы:
1
2
3
4
ХиМиК.ru — СЛОЖНЫЕ ЭФИРЫ — Вредные вещества в промышленности
Сложные эфиры широко распространены в природе; многие из них входят в состав эфирных масел и являются основой жиров, восков и спермацета. Сложные эфиры — продукты замещения атомов водорода в кислотах (для карбоновых кислот — водорода гидроксильной группы) алкильными, алкенильными или арильными радикалами. Многоосновные кислоты могут давать продукты полного и неполного замещения (кислые эфиры).
Применяются как промежуточные продукты в органическом синтезе, растворители, экстрагенты, ацилирующие средства, инсектициды, гербициды, флотоагенты, пластификаторы, присадки к маслам и т.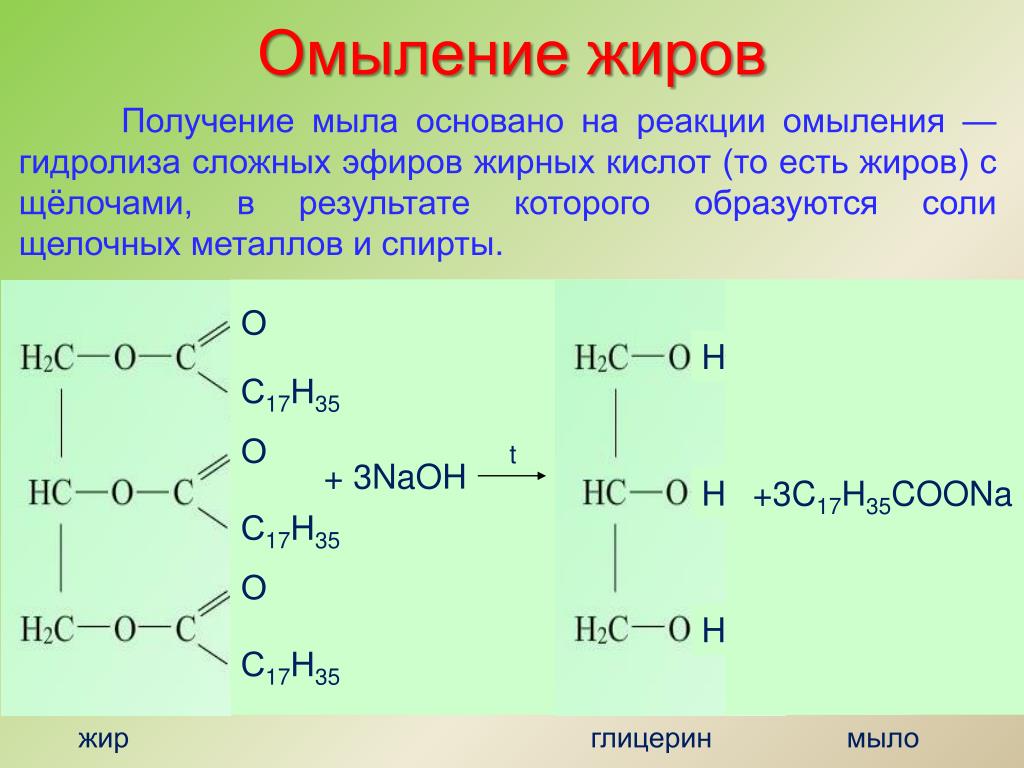 д. Полиэфиры полифункциональных кислот и ненасыщенные сложные эфиры — для производства синтетических смол, пластмасс, органических стекол, эластомеров, волокон, фармацевтических препаратов и т. д.
д. Полиэфиры полифункциональных кислот и ненасыщенные сложные эфиры — для производства синтетических смол, пластмасс, органических стекол, эластомеров, волокон, фармацевтических препаратов и т. д.
Физические и химические свойства. Сложные эфиры низших карбоновых кислот и простейших спиртов — бесцветные летучие жидкости, часто с приятным запахом фруктов. Сложные эфиры высших карбоновых кислот — твердые бесцветные вещества. Температуры кипения эфиров низших спиртов ниже, чем у соответствующих кислот, с ростом цепи спирта температуры кипения повышаются. Сложные эфиры ароматического ряда — малолетучие жидкости с высокой температурой кипения или кристаллические вещества. Нерастворимы в воде и обычно хорошо растворимы в органических растворителях (в этиловом спирте и диэтиловом эфире — неограниченно). Низшие алифатические сложные эфиры легче воды и, как правило, хорошие растворители для многих соединений.
В отсутствие влаги сложные эфиры относительно стабильны к нагреванию, термическая устойчивость их существенно зависит от длины цепи и степени разветвленности радикалов.
Для сложных эфиров карбоновых кислот наиболее характерен разрыв связи ацил—кислород в реакциях нуклеофильного замещения. Склонность к ацилированию возрастает с увеличением кислотности спиртового остатка. Характерными примерами таких реакций являются омыление (гидролиз) и переэтерификация (алкоголиз). Многие сложные эфиры водой гидролизуются очень медленно; омыление катализируется кислотами или щелочами, связывающими образующуюся при гидролизе кислоту. Для многих сложных эфиров (главным образом жиров) гидролиз может быть вызван действием энзимов (липаз). Сложные эфиры хорошо реагируют с аммиаком и аминами с образованием амидов кислот. Устойчивы к действию окислителей и температуры до 300 °С.
Токсическое действие. Сложные эфиры действуют прежде всего молекулой в целом и обладают наркотическими свойствами. Но на действие молекулы могут оказывать влияние и входящие в ее состав особые группы. Сложные эфиры частично гидролизуются в организме, поэтому характер их действия в значительной степени зависит от образующейся из них кислоты, в меньшей степени от спирта.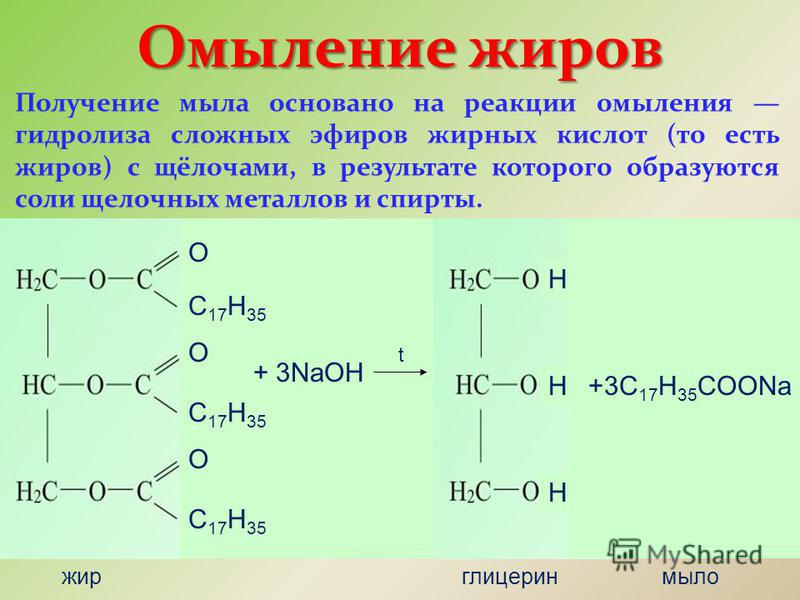 Характер и место действия определяются скоростью гидролиза. Эфиры сильных кислот, гидролизующиеся быстро и освобождающие большое количество ионов водорода, раздражают преимущественно слизистые оболочки дыхательных путей. Типичные примеры — сложные эфиры галогензамещенных кислот (хлормуравьиной или хлоругольной, галогенуксусных). Некоторые из этих соединений обладают и высокой общей ядовитостью, объясняемой высокой токсичностью продуктов их распада (например, в случае эфиров хлормуравьиной или хлоругольной кислоты — фосгена).
Характер и место действия определяются скоростью гидролиза. Эфиры сильных кислот, гидролизующиеся быстро и освобождающие большое количество ионов водорода, раздражают преимущественно слизистые оболочки дыхательных путей. Типичные примеры — сложные эфиры галогензамещенных кислот (хлормуравьиной или хлоругольной, галогенуксусных). Некоторые из этих соединений обладают и высокой общей ядовитостью, объясняемой высокой токсичностью продуктов их распада (например, в случае эфиров хлормуравьиной или хлоругольной кислоты — фосгена).
Сложные эфиры жирных кислот обладают лишь слабыми раздражающими свойствами. Вследствие высокого коэффициента распределения паров накопление в организме до высоких концентраций происходит довольно медленно и проявляется сравнительно слабым наркотическим эффектом. Опасность внезапных острых отравлений обычно не так велика, как при вдыхании углеводородов.
Раздражающее действие увеличивается для сложных эфиров, образованных взаимодействием кислот с непредельными спиртами (винилацетат гораздо сильнее раздражает, чем этилацетат).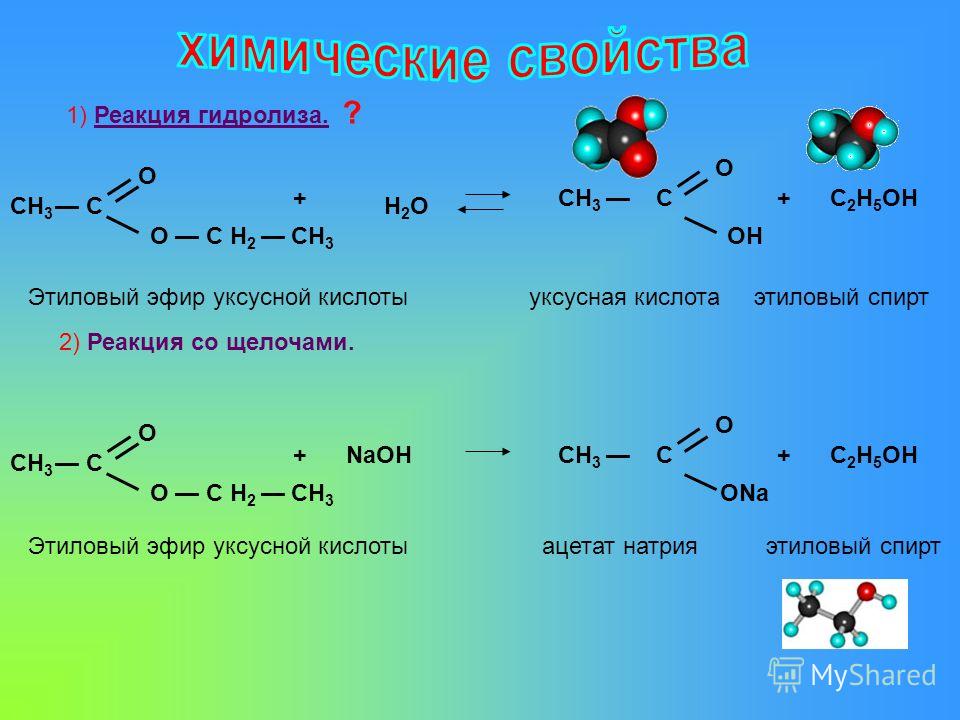 Еще сильнее раздражающее действие эфиров галогензамещенных спиртов. Наличие двойной связи в кислотном радикале, по-видимому, меньше влияет на усиление раздражающих свойств (судя по действию эфиров акриловой и метакриловой кислот) [88].
Еще сильнее раздражающее действие эфиров галогензамещенных спиртов. Наличие двойной связи в кислотном радикале, по-видимому, меньше влияет на усиление раздражающих свойств (судя по действию эфиров акриловой и метакриловой кислот) [88].
Несколько особняком среди сложных эфиров жирных кислот стоят сложные эфиры муравьиной кислоты, которые, очевидно, более токсичны, а также метиловые сложные эфиры. У сложных эфиров этиленгликоля или его производных также имеются особенности, частично связанные с образованием из них в организме щавелевой кислоты. Сложные эфиры ароматических кислот малолетучи и поэтому сравнительно менее опасны. Сложный эфир фталевой кислоты при длительном действии оказывают токсический нейротропный эффект.
Превращения в организме. Сложные эфиры низших кислот и низкомолекулярных спиртов, как правило, расщепляются по эфирной связи (омыляются на кислотную и спиртовую часть) под влиянием эстераз. Скорость расщепления у разных видов животных различна (Филов). Скорость омыления различна и внутри гомологического ряда; в ряду метиловых и этиловых сложных эфиров разных кислот скорость наибольшая у средних членов ряда, содержащих в кислотной части 4—6 атомов углерода; медленно происходит омыление низших членов ряда, почти не омыляются высшие (Matlack, Tucher). В ряду ацетатов скорость гидролиза увеличивается от метил- до амилацетата. Очень велика скорость омыления сложных эфиров винилового спирта и жирных кислот; образующийся в результате расщепления виниловый спирт изомеризуется в ацетальдегид (Филов). Сравнительно быстро гидролизуется также бензилбутират (Sabalitschka et al.). Сложные эфиры п-гидроксибензойной кислоты образуют у человека соединения с серной кислотой (Sabalitschka et al.).
Скорость омыления различна и внутри гомологического ряда; в ряду метиловых и этиловых сложных эфиров разных кислот скорость наибольшая у средних членов ряда, содержащих в кислотной части 4—6 атомов углерода; медленно происходит омыление низших членов ряда, почти не омыляются высшие (Matlack, Tucher). В ряду ацетатов скорость гидролиза увеличивается от метил- до амилацетата. Очень велика скорость омыления сложных эфиров винилового спирта и жирных кислот; образующийся в результате расщепления виниловый спирт изомеризуется в ацетальдегид (Филов). Сравнительно быстро гидролизуется также бензилбутират (Sabalitschka et al.). Сложные эфиры п-гидроксибензойной кислоты образуют у человека соединения с серной кислотой (Sabalitschka et al.).
Определение в воздухе. Для сложных эфиров одноосновных органических кислот основано на реакции взаимодействия их с гидроксиламином и последующем колориметрическом определении образованных гидроксамовых кислот с солями железа (III). Мешают формальдегид, ангидриды и хлорангидриды органических кислот.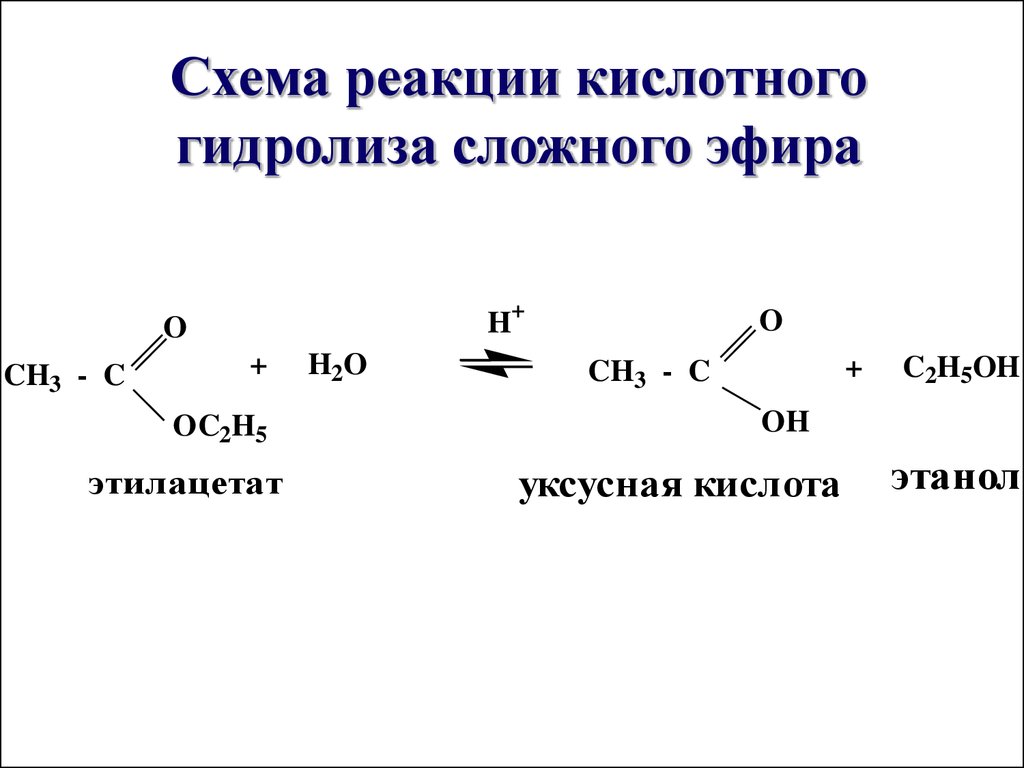 Метод не специфичен и применяется обычно с некоторыми уточнениями для определения индивидуальных сложных эфиров. Определение метиловых и бутиловых эфиров карбоновых кислот основано часто на определении метилового и бутилового спирта. Для определения виниловых эфиров низших карбоновых кислот разработан полярографический метод или же их определяют по ацетальдегиду, образующемуся при изомеризации винилового спирта.
Метод не специфичен и применяется обычно с некоторыми уточнениями для определения индивидуальных сложных эфиров. Определение метиловых и бутиловых эфиров карбоновых кислот основано часто на определении метилового и бутилового спирта. Для определения виниловых эфиров низших карбоновых кислот разработан полярографический метод или же их определяют по ацетальдегиду, образующемуся при изомеризации винилового спирта.
Определение в организме основано на тех же реакциях, что и определение в воздухе. В силу быстрого гидролиза сложных эфиров в организме большое значение может иметь определение их метаболитов. При отравлении метиловыми эфирами карбоновых кислот определяют метиловый спирт в крови и моче (Кузьменко), при отравлении виниловыми эфирами — ацетальдегид в крови (Филов). Ход анализов см. [4].
Гидролиз сложных эфиров: механизм, катализируемый кислотами и основаниями
Карбоновые кислоты и их производные
Гидролиз сложных эфиров: механизм, катализируемый кислотами и основаниями
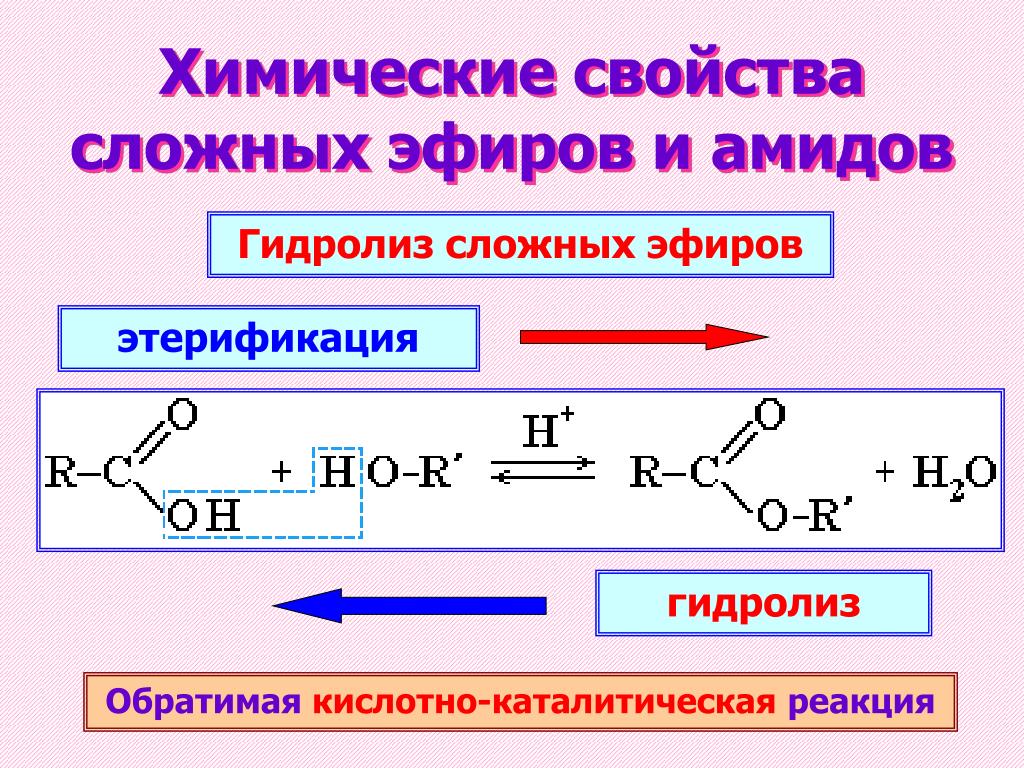
Мы видели, что все стадии этерификации Фишера обратимы и равновесие смещается к сложноэфирному продукту с использованием избытка спирта.
Этот характер реакции позволяет гидролизовать сложные эфиры обратно в карбоновую кислоту и спирт, когда вода теперь используется в большом избытке :
Реакция протекает даже лучше при основном катализе ( омыление ), потому что она делает процесс необратимым . Мы увидим, почему это происходит, когда будем обсуждать механизм каждого гидролиза .
Начнем с механизма кислотно-катализируемого гидролиза сложных эфиров . По сути, мы рисуем обратный порядок этерификации Фишера 9.0008 Итак, на первом этапе сложный эфир протонируется, способствуя нуклеофильной атаке воды:
Обратите внимание, что, как и в случае этерификации Фишера, этот процесс является равновесным, что делает реакцию немного сложной, так как может потребовать более высокой температуры 9000°С и удаление спирта по мере его образования, чтобы сдвинуть равновесие вперед.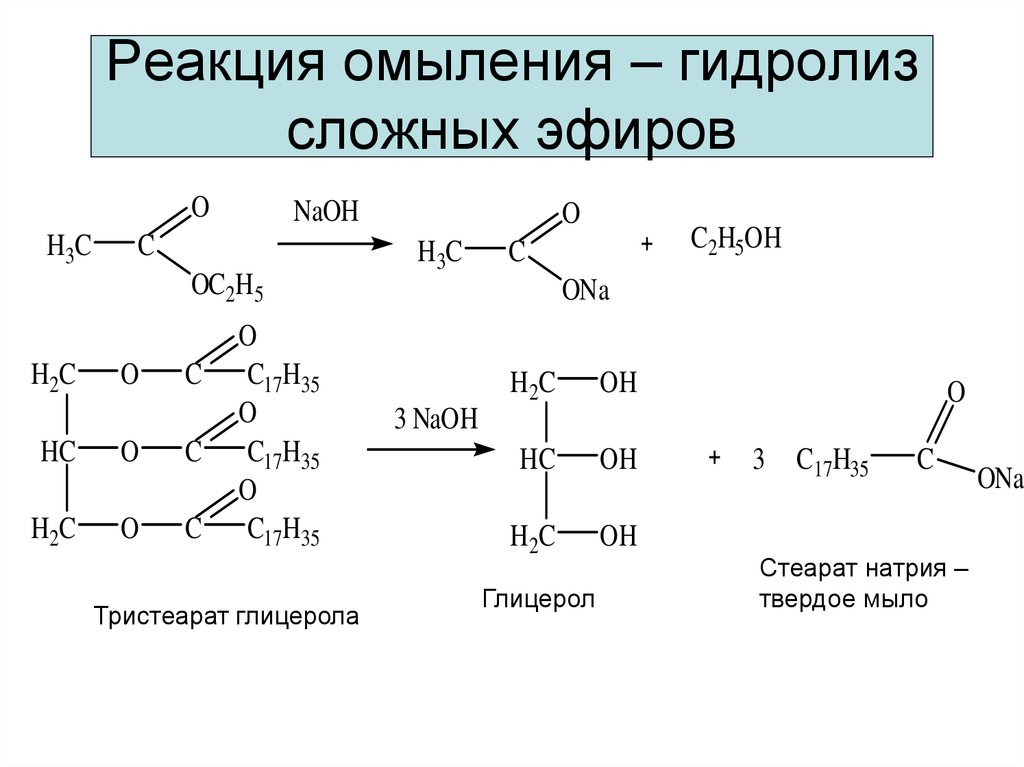
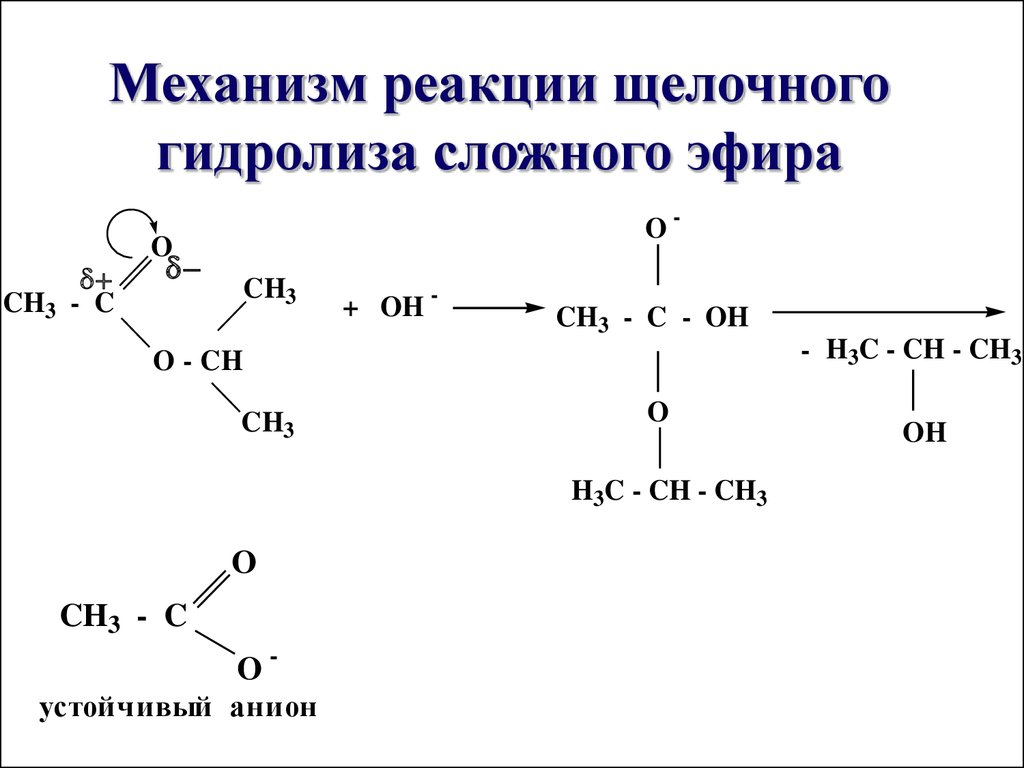
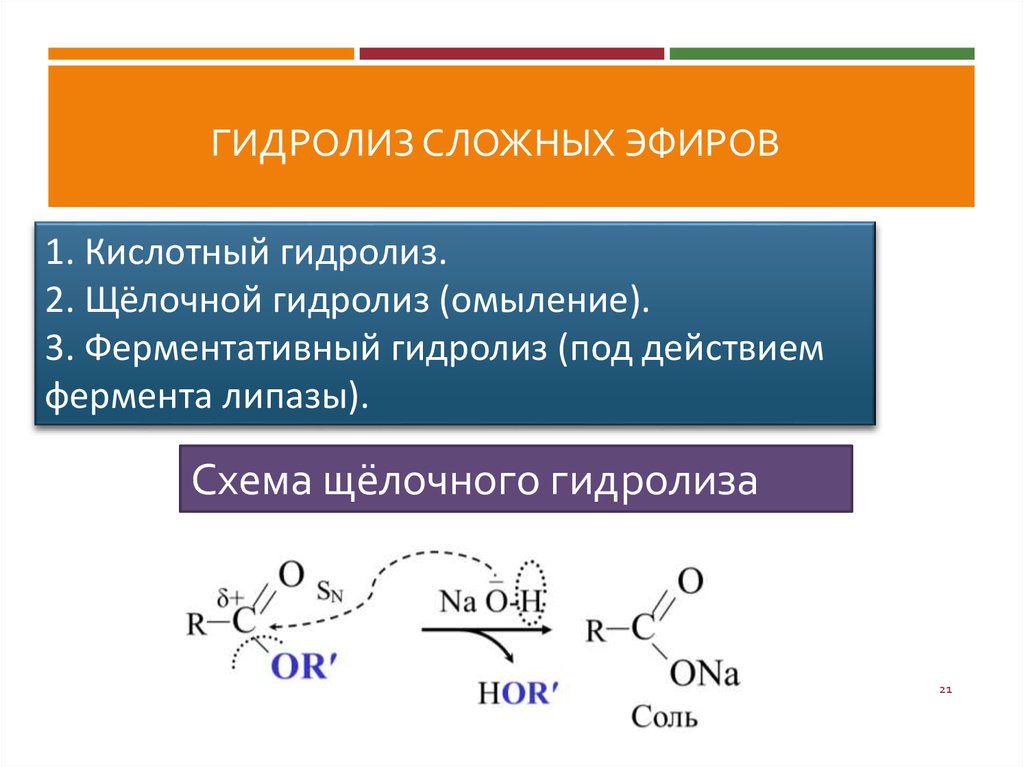
И вот тогда гидролиз сложного эфира, катализируемый основанием , оказывается более выгодным . Карбоновая кислота , образующаяся во время реакции, депротонируется ионами алкоксида или гидроксида, что делает общую реакцию необратимой.
Давайте посмотрим, как это происходит, нарисовав полный механизм реакции:
И быстро реагирует с – ОН или – OR сильные основания, превращающиеся в карбоксилат-ион , который менее электрофилен , чем карбоновые кислоты, и больше не может быть атакован алкоксидом R’O – .
Гидролиз сложного эфира, катализируемый основанием , также известен как омыление , поскольку он используется в производстве мыла из жиров . Помните, что мыло — это соль жирной кислоты, и оно может образовываться при гидролизе жира (сложного эфира, полученного из глицерина и трех молекул жирной кислоты) с помощью основного катализа:
Один интересный вопрос здесь;
Откуда мы знаем, что этот является правильным механизмом катализируемого основанием гидролиза сложного эфира ?
Рассмотрим конкретный пример сложного эфира с метильным или первичным алкильным производным:
Может ли эта реакция S N 2 быть подходящей альтернативой механизму присоединения-отщепления, который мы обсуждали выше?
У нас есть первичный углерод и ацетат — не самая плохая уходящая группа — определенно лучше, чем этоксид .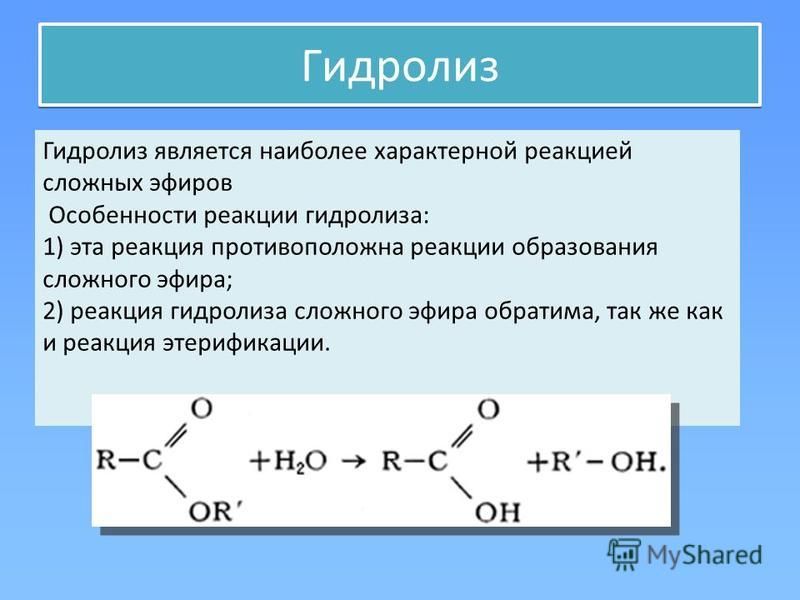 Итак, атакует ли этоксид карбонильный углерод или CH 2 этильной группы?
Итак, атакует ли этоксид карбонильный углерод или CH 2 этильной группы?
Это можно проверить с помощью изотопной маркировки . Берем сложный эфир, содержащий 18 O изотоп в алкоксильной части, и реагируем с гидроксидом. Вот если бы реакция была S N 2, то кислород 18 O все равно должен появиться в карбоксилат-ионе:
Однако экспериментальные исследования показали, что реакция протекает по механизму присоединения-отщепления , поскольку кислород в карбоксилате поступает из гидроксид-иона:
2 и другие исследования, подтверждающие, что путь добавления-исключения не был бы полным, если бы мы не нашли
одного исключения, верно?
А это катализируемый кислотой гидролиз сложных эфиров, содержащих третичную алкильную группу:
Продукты, как и ожидалось, представляют собой карбоновую кислоту и спирт.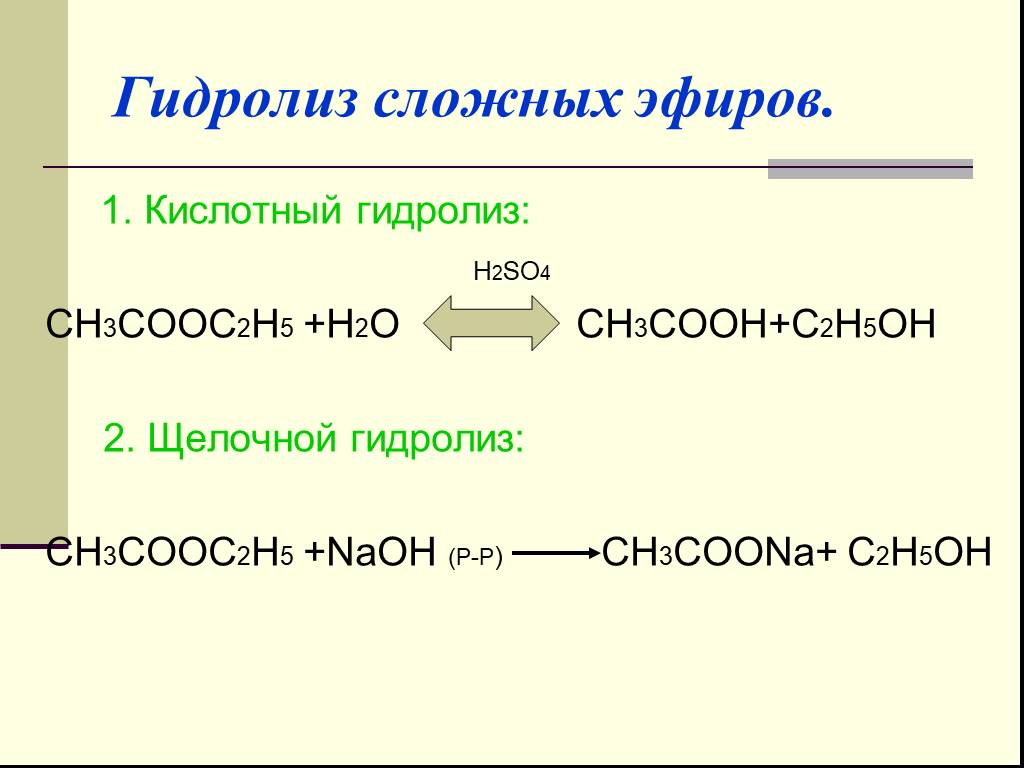 Однако механизм немного другой. После протонирования карбонила вместо нуклеофильного присоединения к карбонилу мы имеем потерю уходящей группы по механизму S N 1: образует относительно стабильную третичную алкильную группу точно так же, как мы видели в S N 1 механизм.
Однако механизм немного другой. После протонирования карбонила вместо нуклеофильного присоединения к карбонилу мы имеем потерю уходящей группы по механизму S N 1: образует относительно стабильную третичную алкильную группу точно так же, как мы видели в S N 1 механизм.
Подводя итог, да, в гидролизе эфира преобладает нуклеофильный механизм присоединения-отщепления, однако не следует исключать возможность протекания реакций S N 2 и S N 1 в зависимости от структуры эфира.
Нужен хороший опыт по реакциям карбоновых кислот и их производных?
Проверьте этот тест из 45 вопросов с несколькими вариантами ответов и 50-минутное видеорешение, охватывающее Реакции кислот, сложных эфиров, лактонов, амидов, хлоридов кислоты и т. Д. Практические задачи Реактивы Гилмана (органокупрат) . Механизм восстановления LiAlh5 и DIBAL до амина или альдегида ГИДРОЛИЗУЮЩИЕ ЭФИРЫ На этой странице описаны способы гидролиза сложных эфиров — расщепления их на карбоновые кислоты (или их соли) и спирты действием воды, разбавленной кислоты или разбавленной щелочи. Гидролиз простых эфиров Что такое гидролиз? Технически гидролиз — это реакция с водой. Именно это происходит при гидролизе сложных эфиров водой или разбавленными кислотами, такими как разбавленная соляная кислота. Щелочной гидролиз сложных эфиров на самом деле включает реакцию с ионами гидроксида, но общий результат настолько похож, что его объединяют с двумя другими. Гидролиз с использованием воды или разбавленной кислоты Реакция с чистой водой настолько медленная, что ее никогда не используют. Реакция катализируется разбавленной кислотой, поэтому сложный эфир нагревают с обратным холодильником с разбавленной кислотой, такой как разбавленная соляная кислота или разбавленная серная кислота. Вот два простых примера гидролиза с использованием кислотного катализатора. Во-первых, гидролиз этилового спирта: . . . а затем гидролиз метилпропаноата: Обратите внимание, что реакции обратимы. Чтобы гидролиз был максимально полным, пришлось бы использовать избыток воды. Вода получается из разбавленной кислоты, поэтому вы должны смешать эфир с избытком разбавленной кислоты. Примечание: Эти реакции в точности обратны тем, которые используются для получения сложного эфира из карбоновой кислоты и спирта. Единственная разница в том, что в качестве катализатора используется концентрированная кислота. Чтобы получить как можно больше сложного эфира, вы не будете добавлять воду, иначе вы будете способствовать реакции гидролиза. Механизм кислотного гидролиза сложных эфиров описан в разделе о катализе этого сайта. Это не требуется для какой-либо учебной программы по химии в Великобритании уровня A (или эквивалентной). Если вы перейдете по этой ссылке, используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. Гидролиз с использованием разбавленной щелочи Это обычный способ гидролиза сложных эфиров. Сложный эфир нагревают с обратным холодильником с разбавленной щелочью, такой как раствор гидроксида натрия. Это дает два больших преимущества перед использованием разбавленной кислоты. Реакции являются односторонними, а не обратимыми, и продукты легче разделить. Взятие тех же сложных эфиров, что и выше, но с использованием раствора гидроксида натрия, а не разбавленной кислоты: Во-первых, гидролиз этилового спирта с использованием раствора гидроксида натрия: . . . а затем таким же образом гидролизовать метилпропаноат: Обратите внимание, что вы получаете образованную натриевую соль, а не саму карбоновую кислоту. Эту смесь относительно легко разделить. Если вы используете избыток раствора гидроксида натрия, эфира не останется, так что вам не о чем беспокоиться. Образовавшийся спирт можно отогнать. Это просто! Если вам нужна кислота, а не ее соль, все, что вам нужно сделать, это добавить избыток сильной кислоты, такой как разбавленная соляная кислота или разбавленная серная кислота, к раствору, оставшемуся после первой перегонки. Если вы это сделаете, смесь насытится ионами водорода. Они улавливаются ионами этаноата (или ионами пропаноата или чем-то еще), присутствующими в солях, с образованием этановой кислоты (или пропановой кислоты и т. д.). Поскольку это слабые кислоты, когда они объединяются с ионами водорода, они, как правило, остаются вместе. Теперь можно отогнать карбоновую кислоту. Гидролиз сложных эфиров с получением мыла Этот следующий фрагмент касается щелочного гидролиза (с использованием раствора гидроксида натрия) больших сложных эфиров, содержащихся в животных и растительных жирах и маслах. Важно: Если вы еще не читали эту страницу, прочтите введение в сложные эфиры, чтобы понять природу жиров и масел, о которых пойдет речь далее. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. Если большие сложные эфиры, содержащиеся в животных или растительных жирах и маслах, нагревают с концентрированным раствором гидроксида натрия, происходит точно такая же реакция, как и с простыми эфирами. Образуется соль карбоновой кислоты — в данном случае натриевая соль большой кислоты, такой как октадекановая кислота (стеариновая кислота). Эти соли являются важными ингредиентами мыла — теми, которые очищают. Производится также спирт — в данном случае более сложный спирт, пропан-1,2,3-триол (глицерин). Из-за связи с производством мыла щелочной гидролиз сложных эфиров иногда называют омылением . Вопросы для проверки вашего понимания Если это первый набор вопросов, который вы задали, пожалуйста, прочтите вводную страницу, прежде чем начать. Begin typing your search term above and press enter to search. Press ESC to cancel.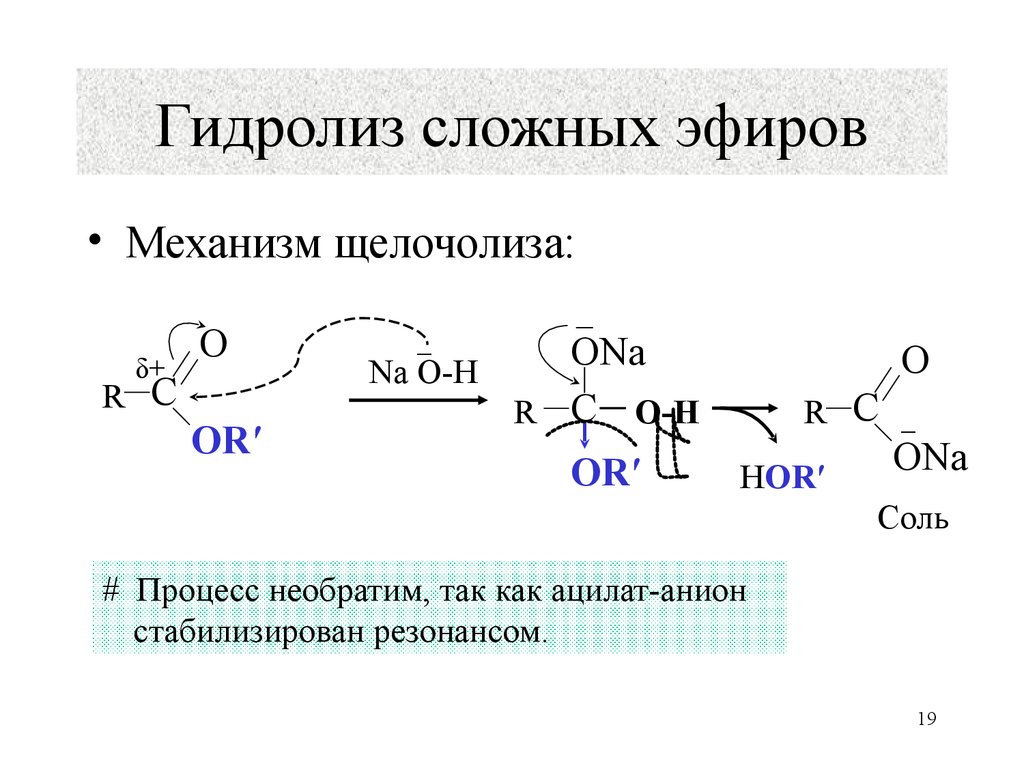 Сводка и практические задачи
Сводка и практические задачи гидролиз сложных эфиров
 Он начинается с рассмотрения гидролиза простых эфиров, таких как этилэтанолат, и продолжается гидролизом более крупных и сложных эфиров для получения мыла.
Он начинается с рассмотрения гидролиза простых эфиров, таких как этилэтанолат, и продолжается гидролизом более крупных и сложных эфиров для получения мыла.