Содержание
Решутест. Продвинутый тренажёр тестов
Решутест. Продвинутый тренажёр тестов
- Главная
ЕГЭ
- Химия
Строение органических веществ:
Гомология и изомерия
Решил заданий
Не решил заданий
Осталось заданий
История решения
7498 —
не приступал
8925 —
не приступал
2639 —
не приступал
9272 —
не приступал
6104 —
не приступал
8361 —
не приступал
9778 —
не приступал
6323 —
не приступал
6028 —
не приступал
8635 —
не приступал
5021 —
не приступал
5830 —
не приступал
6419 —
не приступал
8875 —
не приступал
8058 —
не приступал
1343 —
не приступал
2118 —
не приступал
5856 —
не приступал
3574 —
не приступал
6560 —
не приступал
Формат ответа: цифра или несколько цифр, слово или несколько слов. Вопросы на соответствие «буква» — «цифра» должны записываться как несколько цифр. Между словами и цифрами не должно быть пробелов или других знаков.
Вопросы на соответствие «буква» — «цифра» должны записываться как несколько цифр. Между словами и цифрами не должно быть пробелов или других знаков.
Примеры ответов: 7 или здесьисейчас или 3514
Раскрыть
Скрыть
Гексен-2 является структурным изомером
- 2,3-диметилпентена-2
- Гексана
- Циклобутана
- Циклогексана
- Гексена-1
Бутен-1 является структурным изомером
- бутина
- бутен-2
- циклобутана
- бутадиена
- бутана
Изомером этилацетата является
- бутановая кислота
- бутанол-2
- метилпропионат
- бутаналь
- диэтиловый эфир
Изомером диэтилового эфира является
- бутанол-2
- бутановая кислота
- бутанол-1
- бутаналь
- этандиол-1,2
Цис-транс-изомерия возможна для
- 3,4-диметилгексена-2
- бутина-1
- этан
- 2,3-диметилпентена-2
- гексена-2
Изомером пентена-1 не является
- циклопентан
- циклогексан
- 2-метилбутен-1
- 3-метилбутен-1
- 3,3-Диметилбутен-1
Изомерами не являются
- Гексин и циклогексан
- пентен-1 и пентен-2
- этанол и диметиловый эфир
- этанол и этандиол
- пропановая кислота и метилацетат
Пара структурных изомеров
- пентан и циклопентан
- пропин и пропен
- этанол и этандиол
- пентан и 2-метилбутан
- гексин-1 и гексин-3
Гомологом метилпропанола-1 является
- 2-метилбутанол-1
- 2-метилпентанол-1
- Пропанон
- пропандиол-1,2
- бутанол-1
Из предложенного перечня выберите два вещества, которые не являются изомерами пентена-1
- 3,3-Диметилбутен-1
- Циклопентан
- 2-метилбутен-1
- 3 -метилбутен-1
- пентин-2
Из предложенного перечня выберите два вещества, которые являются структурными изомерами бутена-1.
- Бутан
- Циклобутан
- бутин-2
- бутадиен-1,3
- метилпропен
Из предложенного перечня выберите два вещества, которые являются изомерами этилацетата
- диэтиловый эфир
- бутановая кислота
- пропилформиат
- бутанол-2
- бутаналь
Цис-транс-изомерия возможна для
- гексена-2
- бутина-1
- 2,3-диметилпентана
- 2,3-диметилбутена-2
- 1,3-диметилциклобутан
Из предложенного перечня выберите два вещества, которые являются изомерами гексина-2
- гексадиен-2,4
- 2-метилбутен-2
- 3-метилбутин-1
- циклогексен
- гексен-2
Из предложенного перечня выберите два вещества, которые не имеют структурных изомеров
- бутанол-1
- пропанол-2
- пропан
- этаналь
- этин
Из предложенного перечня выберите два вещества, которые являются изомерами пропионовой кислоты.
- уксусная кислота
- метилацетат
- уксусный альдегид
- метилформиат
- этилформиат
Бутен-1 и цис-бутен-2 являются
- структурными изомерами
- изомерами по положению кратной связи
- геометрическими изомерами
- межклассовыми изомерами
- оптическими изомерами
Геометрическими изомерами являются:
- 2-метилбутан и 2,2-диметилпропан
- цис-пентен-2 и транс-пентен-2
- пентадиен-1,2 и пентадиен-1,3
- цис-1,2-дихлорэтилен и транс-1,2-дихлорэтилен
- бутанол-1 и бутанол-2
Изомерны друг другу
- пропанол и изопропиловый спирт
- метанол и диметиловый эфир
- уксусная кислота и метиловый эфир муравьиной кислоты
- ацетон и ацетальдегид
- бутен-1 и бутадиен-1,3
Изомерами положения кратной связи являются
- 2-метилбутан и 2,2-диметилпропан
- пентин-1 и пентен-2
- пентадиен-1,2 и пентадиен-1,3
- 2-метилпентен-1 и 3-метилпентен-2
- бутанол-1 и бутанол-2
Так твой прогресс будет сохраняться.
Регистрация
Мы отправили код на:
Изменить
Получить код повторно через
00:00
Я прочитал(-а) Политику конфиденциальности и согласен(-на) с правилами использования моих персональных данных
Ништяк!
Решено верно
Браво!
Решено верно
Крутяк!
Решено верно
Зачёт!
Решено верно
Чётко!
Решено верно
Бомбезно!
Решено верно
Огонь!
Решено верно
Юхууу!
Решено верно
Отпад!
Решено верно
Шикарно!
Решено верно
Блестяще!
Решено верно
Волшебно!
Решено верно
Диэтиловый эфир — кислота — Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
Константы полученных хлорангидридов.
[1] |
Диэтиловый эфир р-ацетокси-р-хлорэтилфосфиновой кислоты ( X) ги-дролизуется водой при комнатной температуре в ацетоновом растворе в течение 3 — — 4 суток, или при нагревании в диоксане в течение 5 час.
[2]
Диэтиловый эфир у-оксопимелиновой кислоты был получен насыщением хлористым водородом раствора фурилакриловой кислоты2 6 в этиловом спирте или же дилактона у-оксопиме-линовой кислоты 4 хлористым водородом.
[3]
Диэтиловый эфир иминоуксуснопропионовой кислоты получают из свежеперегнанного глицинового эфира ( 1 3 моля) и свежеперегнанного этилового эфира акриловой кислоты ( 1 0 моля) в 100 мл абсолютного этанола при длительном стоянии в темноте. После отгонки спирта эфир перегоняют в вакууме масляного насоса.
[4]
Диэтиловый эфир фешлэпилмалоновой кислоты представляет собой бесцветную жидкость с темп.
[5]
Диэтиловый эфир бензоилмалоновой кислоты был получен при действии на медное производное этилового эфира бензои.
[6]
Диэтиловый эфир у-оксопнмелиновой кислоты был получен насыщением хлористым водородом раствора фурилакриловой кислоты в этиловом спирте или же дилактона у-оксопиме-линовой кислоты хлористым водородом.
[7]
Диэтиловый эфир у-оксопнмелиновой кислоты был получен насыщением хлористым водородом раствора фурилакриловой кислоты в этиловом спирте или же дилактона у-оксопиме-линовой кислоты 4 хлористым водородом.
[8]
Диэтиловый эфир диметилщавелевоуксусной кислоты перегоняется при 230 и атмосферном давлении без декарбонилирования.
[9]
Аналогично диэтиловый эфир 7-кетонопимелиновой кислоты может быть получен из фурилакриловой кислоты, Выход 63 % от теоретического.
[10]
У диэтилового эфира ге-нитрофенилфосфорной кислоты наблюдается третья волна, которая по характеристикам совпадает со второй волной восстановления и-нитрофенолят-аниона.
[11]
Диэтилоксалат, диэтиловый эфир этандиовой кислоты, этилокса-лат, СвНюО4, горючая жидкость. Ом — м; в воде разлагается.
Ом — м; в воде разлагается.
[12]
Для получения диэтилового эфира фенилэтилмалоиовой кислоты служит тот же прибор, что и для предыдущего продукта. В реакционную колбу помещают 92 мл абсолютного спирта и прибавляют, как указывалось выше, 5 5 г металлического натрия. Полученный раствор алкоголята натрия охлаждают до 25 — 30 и из капельной воронки при работе мешалки прибавляют сначала раствор 56 г фенилмалоната 37 мл абсолютного спирта, а затем постепенно вводят 31 г бромистого этила, после чего реакционную смесь при размешивании нагревают на водяной бане до кипения и кипятят так, чтобы струя жидкости, стекаюшая из обратного холодильника, ле была слишком сильной. Кипячение продолжают до тех пор, пока реакционная жидкость не будет иметь нейтральную реакцию на фенолфталеин. Чтобы определить конец реакции ( после примерно 4 час.
[13]
Получен из диэтилового эфира я-метилбензилмалоиовой кислоты [51] взаимодействием ( — хлормасляной кислоты с лптийгидридом, а затем этиловым эфиром.
[14]
При электролизе диэтилового эфира кс-циклопентан-1 3-диакриловой кислоты ( Z С5Н3 и R СООС2Н8) получено два главных продукта, один из которых представлял собой соответствующее насыщенное соединение ( его цис-изомер), а другой — терамс-изомер диэтилового эфира 2 3-нор-борнандиуксусной кислоты.
[15]
Страницы:
1
2
3
4
Какой тип изомерии характерен для диэтилового эфира и метилпропилового эфира?A. ЦепьБ. ФункциональныйC. МетамерияD. Позиция
Ответ
Проверено
210k+ просмотров
Подсказка: Метилпропиловый эфир и диэтиловый эфир действительно являются изомерами друг друга. На самом деле существует два изомера метилпропилового эфира: метил-н-пропиловый эфир и изопропилметиловый эфир. Таким образом, у нас есть три изомера диэтилового эфира, все они простые эфиры. Могут быть неэфирные изомеры, особенно н-бутанол и 2-метилпропанол, а также их изомеры.
Полный пошаговый ответ:
Нам дано определить, какой тип изомерии проявляют диэтиловый эфир и метилпропиловый эфир.
Химическая формула диэтилового эфира: $C{H_3}C{H_2} — O — C{H_2}C{H_3}$.
Химическая формула метилпропилового эфира: $C{H_3} — O — C{H_2}C{H_2}C{H_3}$.
Рассмотрев расположение двух этильных групп ($-C{H_2}C{H_3}$) вокруг одного атома кислорода в диэтиловом эфире и метильной ($C{H_3}-$), пропильной ($-C{H_2}C {H_2}C{H_3}$) группируются вокруг одного атома кислорода в метилпропиловом эфире, эти соединения считаются метамерами.
Метамерия — устаревший термин изомерии. Первоначально он использовался для обозначения соединений с одинаковым соотношением атомов (те же формулы), но в другом расположении. Метамеры — это соединения с одинаковой молекулярной формулой, но разным количеством алкильных групп по обе стороны от функциональной группы. В метамерах функциональная группа должна быть одинаковой, здесь это кетоновая группа.
Следовательно, вариант C является правильным ответом.
Примечание: Эти две молекулы эфира имеют одинаковое количество атомов (четыре атома углерода, один атом кислорода и десять атомов водорода), и поэтому их можно было бы считать «метамерами» в старой терминологии. Теперь эти молекулы считаются «конституционными изомерами», поскольку они различаются положением атома кислорода и разветвлением углеродных фрагментов.
Недавно обновленные страницы
В Индии по случаю бракосочетания фейерверк 12 класса химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть организованы 12 класса химии JEE_Main
Что из следующего имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим радиусом атомов Химический класс 11 JEE_Main
Фосфин получают из следующей руды А Кальций класса 12 по химии JEE_Main
В Индии по случаю бракосочетания фейерверков класс 12 по химии JEE_Main
Щелочноземельные металлы Ba Sr Ca и Mg могут быть отнесены к классу 12 по химии JEE_Main
Что из нижеперечисленного имеет самый высокий электродный потенциал Химический класс 12 JEE_Main
Что из следующего является истинным пероксидом A rmSrmOrm2 Химический класс 12 JEE_Main
Какой элемент обладает наибольшим атомным радиусом А Химический класс 11 JEE_Main
Фосфин получают из следующей руды A Кальций класса 12 по химическому составу JEE_Main
Тенденции сомнения
Диэтиловый эфир — Энциклопедия Нового Света
- Эта статья о химическом соединении.

| Диэтиловый эфир | |
|---|---|
| Название ИЮПАК | этоксиэтан |
| Другие названия | диэтиловый эфир этиловый эфир этилоксид 3-оксапентан |
| Идентификаторы | |
| Номер CAS | [60-29-7] |
| Номер РТЭКС | КИ5775000 |
| УЛЫБКИ | ССОСС |
| Недвижимость | |
| Молекулярная формула | C 4 H 10 O C 2 H 5 OC 2 H 5 |
| Молярная масса | 74,12 г/моль |
| Внешний вид | прозрачная бесцветная жидкость |
| Плотность | 0,7134 г/см³, жидкость |
| Температура плавления | -116,3 ° С (156,85 К) |
| Температура кипения | 34,6 ° С (307,75 К) |
| Растворимость в воде | 6,9 г/100 мл (20 °C) |
| Вязкость | 0,224 сП при 25 °C |
| Структура | |
| Дипольный момент | 1,15 Д (газ) |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности |
| Основные опасности | Чрезвычайно легковоспламеняющийся (F+), Вредный (Xn) |
| NFPA 704 | 4 2
|
| R-фразы | Р12 Р19 Р22 Р66 Р67 |
| S-фразы | С9 С16 С29 С33 |
| Температура вспышки | -45 °С |
| Родственные соединения | |
| Родственные эфиры | Диметиловый эфир Метоксипропан |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 °C, 100 кПа) | |
Диэтиловый эфир , также известный как эфир и этоксиэтан , представляет собой прозрачную, бесцветную и легковоспламеняющуюся жидкость с низкой температурой кипения и характерным запахом.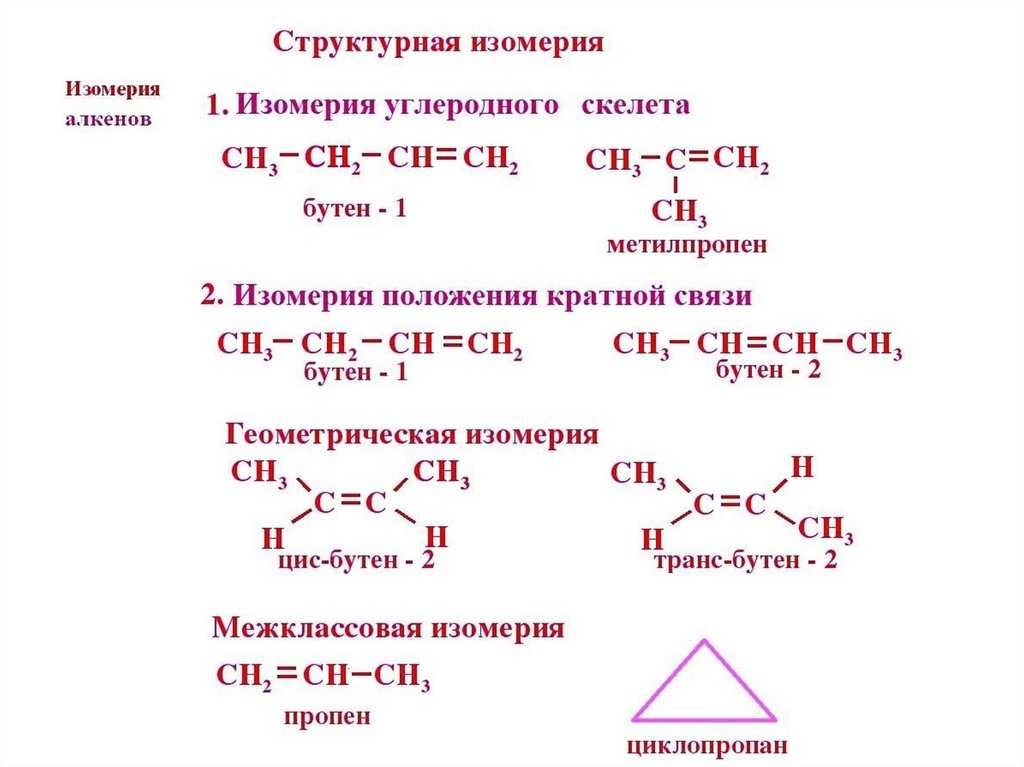 Это наиболее распространенный член класса химических соединений, известных как простые эфиры. Это изомер бутанола. Диэтиловый эфир имеет формулу CH 3 -CH 2 -O-CH 2 -CH 3 . Он используется в качестве обычного растворителя, а в прошлом применялся в качестве общего анестетика. Умеренно растворим в воде (6,9г/100 мл). Учитывая его высокую воспламеняемость и летучесть, его следует хранить вдали от открытого огня и устройств с электрическим нагревом.
Это наиболее распространенный член класса химических соединений, известных как простые эфиры. Это изомер бутанола. Диэтиловый эфир имеет формулу CH 3 -CH 2 -O-CH 2 -CH 3 . Он используется в качестве обычного растворителя, а в прошлом применялся в качестве общего анестетика. Умеренно растворим в воде (6,9г/100 мл). Учитывая его высокую воспламеняемость и летучесть, его следует хранить вдали от открытого огня и устройств с электрическим нагревом.
Содержание
- 1 История
- 2 Производство
- 3 Приложения
- 3.1 Применение анестезии
- 3.2 Рекреационное использование
- 4 Метаболизм
- 5 Безопасность
- 6 См. также
- 7 Примечания
- 8 Каталожные номера
- 9 Внешние ссылки
- 10 кредитов
История
Алхимику Раймундусу Луллу приписывают открытие соединения в 1275 г. н.э., хотя современных свидетельств этому нет. Впервые он был синтезирован в 1540 году Валериусом Кордусом, который назвал его «маслом сладкого купороса» (oleum dulcis vitrioli) . Это название было выбрано потому, что оно было первоначально обнаружено путем перегонки смеси этанола и серной кислоты (тогда известной как купоросное масло) и отметило некоторые из его лечебных свойств. Примерно в то же время Теофраст Бомбаст фон Гогенгейм, более известный как Парацельс, открыл обезболивающие свойства эфира. Имя эфир был дан веществу в 1730 году Августом Зигмундом Фробениусом.
н.э., хотя современных свидетельств этому нет. Впервые он был синтезирован в 1540 году Валериусом Кордусом, который назвал его «маслом сладкого купороса» (oleum dulcis vitrioli) . Это название было выбрано потому, что оно было первоначально обнаружено путем перегонки смеси этанола и серной кислоты (тогда известной как купоросное масло) и отметило некоторые из его лечебных свойств. Примерно в то же время Теофраст Бомбаст фон Гогенгейм, более известный как Парацельс, открыл обезболивающие свойства эфира. Имя эфир был дан веществу в 1730 году Августом Зигмундом Фробениусом.
Производство
Диэтиловый эфир редко получают в лабораториях из-за связанной с этим опасности и потому, что он легко доступен для законных лабораторий. Большая часть диэтилового эфира производится как побочный продукт парофазной гидратации этилена с получением этанола. В этом процессе используются катализаторы на основе фосфорной кислоты на твердом носителе, и при необходимости его можно отрегулировать для получения большего количества эфира. [1] Парофазная дегидратация этанола над некоторыми алюмооксидными катализаторами может давать выход диэтилового эфира до 95 процентов. [2]
[1] Парофазная дегидратация этанола над некоторыми алюмооксидными катализаторами может давать выход диэтилового эфира до 95 процентов. [2]
Диэтиловый эфир может быть получен как в лабораторных, так и в промышленных масштабах синтезом кислого эфира. Этанол смешивают с сильной кислотой, обычно с серной кислотой, H 2 SO 4 . Кислота диссоциирует с образованием ионов водорода H + . Ион водорода протонирует электроотрицательный атом кислорода этанола, придавая молекуле этанола положительный заряд:
- СН 3 СН 2 ОН + Н + → CH 3 CH 2 OH 2 +
Нуклеофильный атом кислорода непротонированного этанола вытесняет молекулу воды из протонированной (электрофильной) молекулы этанола с образованием иона воды, диэтилового эфира и водорода.
- CH 3 CH 2 OH 2 + + CH 3 CH 2 OH → H 2 O + H + +
9
9
9
9
9
9
9
9
9
9.
 2 Ч 3
2 Ч 3
Эта реакция должна проводиться при температуре ниже 150°C, чтобы продукт элиминирования (этилен) не был продуктом реакции. При более высоких температурах этанол дегидратируется с образованием этилена. Реакция получения диэтилового эфира обратима, поэтому в конечном итоге достигается равновесие между реагентами и продуктами. Для получения хорошего выхода эфира необходимо, чтобы эфир был отогнан из реакционной смеси до того, как он превратится в этанол, используя принцип Ле Шателье.
Другой реакцией, которую можно использовать для получения эфиров, является синтез эфира Вильямсона, в котором алкоксид (полученный путем растворения щелочного металла в используемом спирте) осуществляет нуклеофильное замещение на алкилгалогениде.
Применение
Диэтиловый эфир — обычный лабораторный растворитель. Он имеет ограниченную растворимость в воде, поэтому обычно используется для жидкостной экстракции. Будучи менее плотным, чем вода, эфирный слой обычно находится сверху.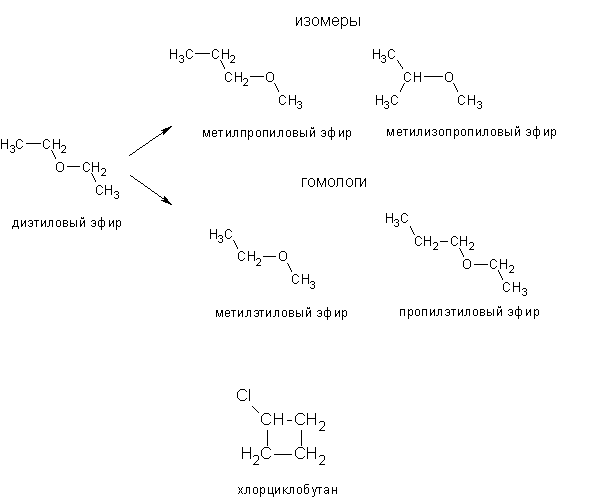 Диэтиловый эфир является обычным растворителем для реакции Гриньяра и многих других реакций с участием металлоорганических реагентов. Он особенно важен в качестве растворителя при производстве целлюлозных пластиков, таких как ацетат целлюлозы. [1] Диэтиловый эфир имеет высокое цетановое число 85-96 и используется в качестве пусковой жидкости для дизельных и бензиновых двигателей из-за его высокой летучести и низкой температуры самовоспламенения.
Диэтиловый эфир является обычным растворителем для реакции Гриньяра и многих других реакций с участием металлоорганических реагентов. Он особенно важен в качестве растворителя при производстве целлюлозных пластиков, таких как ацетат целлюлозы. [1] Диэтиловый эфир имеет высокое цетановое число 85-96 и используется в качестве пусковой жидкости для дизельных и бензиновых двигателей из-за его высокой летучести и низкой температуры самовоспламенения.
Использование анестезии
Американский врач Кроуфорд Уильямсон Лонг, доктор медицинских наук, был первым хирургом, который 30 марта 1842 года применил его в качестве общего наркоза. [3] William T.G. Ранее Мортону приписывали первую публичную демонстрацию эфирной анестезии 16 октября 1846 года в Эфирном куполе в Бостоне, штат Массачусетс, хотя теперь известно, что доктор Кроуфорд Лонг публично продемонстрировал ее использование другим официальным лицам в Джорджии.
Иногда вместо хлороформа использовали эфир, поскольку он имел более высокий терапевтический индекс, большую разницу между рекомендуемой дозировкой и токсическую передозировку. Эфир по-прежнему является предпочтительным анестетиком в некоторых развивающихся странах из-за его низкой цены и высокого терапевтического индекса (около 1,5-2,2). [4]
Эфир по-прежнему является предпочтительным анестетиком в некоторых развивающихся странах из-за его низкой цены и высокого терапевтического индекса (около 1,5-2,2). [4]
Основываясь на своих ассоциациях с Бостоном, использование эфира стало известно как «Уловка Янки».
Сегодня эфир редко используется для анестезии. Использование легковоспламеняющегося эфира уменьшилось, когда стали доступны негорючие анестетики, такие как галотан. Кроме того, у эфира было много нежелательных побочных эффектов, таких как посленаркозная тошнота и рвота. Современные анестетики, такие как метилпропиловый эфир (неотил) и метоксифлуран (пентран), уменьшают эти побочные эффекты. [3]
Эфир можно использовать для обезболивания клещей перед их удалением из тела животного или человека. Анестезия расслабляет клеща и не позволяет ему удерживать свой ротовой аппарат под кожей.
Рекреационное использование
Обезболивающее действие эфира сделало его рекреационным наркотиком, хотя и не очень популярным.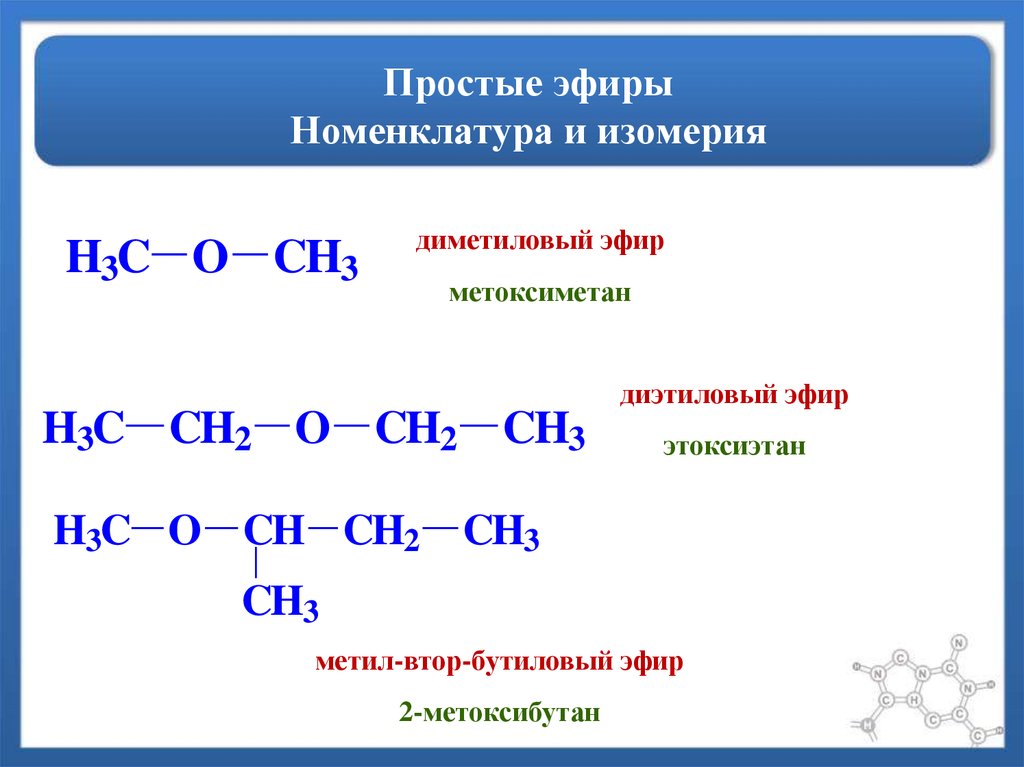 Диэтиловый эфир не так токсичен, как другие растворители, используемые в качестве рекреационных наркотиков.
Диэтиловый эфир не так токсичен, как другие растворители, используемые в качестве рекреационных наркотиков.
Эфир, смешанный с этанолом, продавался в девятнадцатом веке как панацея и рекреационный наркотик во время одного из движений западного общества за воздержание. В то время считалось неприличным для женщин употреблять алкогольные напитки на общественных мероприятиях, и иногда вместо них употребляли наркотики, содержащие эфир. Лекарство от кашля под названием «Капли Хоффмана» в то время продавалось как одно из таких лекарств и содержало в своих капсулах как эфир, так и спирт. [5] Эфир, как правило, трудно употреблять отдельно, поэтому его часто смешивали с такими наркотиками, как этанол, для рекреационного использования. Эфир также можно использовать в качестве ингалятора.
Из-за его несмешиваемости с водой и того факта, что неполярные органические соединения хорошо растворяются в ней, эфир также используется в производстве свободного основания кокаина и включен в Таблицу II в качестве прекурсора в соответствии с Конвенцией Организации Объединенных Наций о борьбе с незаконным оборотом.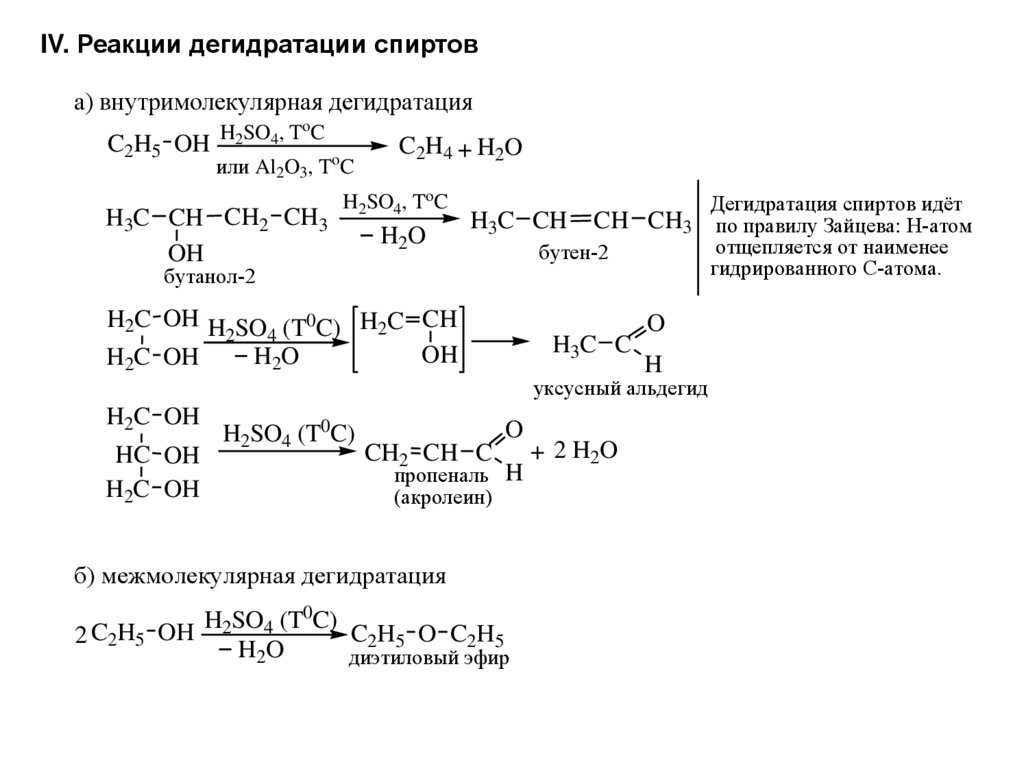 по наркотическим средствам и психотропным веществам. [6]
по наркотическим средствам и психотропным веществам. [6]
Метаболизм
Предполагается, что фермент цитохром Р450 метаболизирует диэтиловый эфир. [7]
Диэтиловый эфир ингибирует алкогольдегидрогеназу и тем самым замедляет метаболизм этанола. [8] Он также ингибирует метаболизм других лекарственных средств, требующих окислительного метаболизма. [9]
Безопасность
Эфир — легковоспламеняющийся материал. При использовании эфира следует избегать открытого огня и даже устройств с электрическим нагревом, поскольку он легко воспламеняется от пламени или искры. Температура самовоспламенения эфира составляет всего 170°C (338°F), поэтому он может воспламениться от горячей поверхности без пламени или искры. Наиболее распространенной практикой в химических лабораториях является использование пара (таким образом ограничивая температуру до 100 ° C (212 ° F), когда эфир необходимо нагревать или перегонять.
Диэтиловый эфир склонен к образованию перекиси и может образовывать взрывоопасную перекись диэтилового эфира.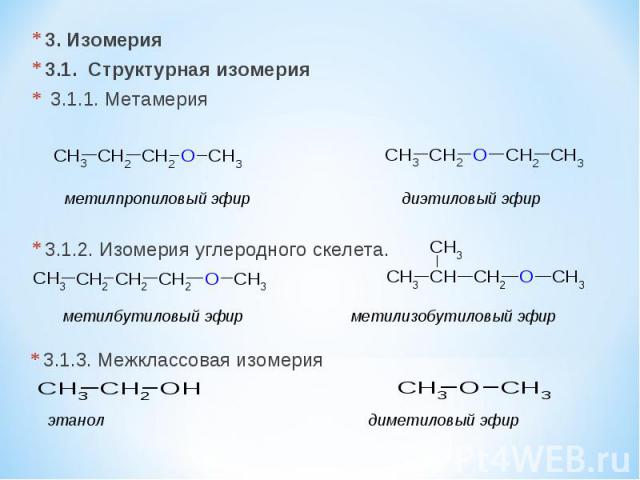 Пероксиды эфира имеют более высокую температуру кипения и в сухом виде являются контактными взрывчатыми веществами. Диэтиловый эфир обычно поставляется со следовыми количествами антиоксиданта BHT (2,6-ди-трет-бутил-4-метилфенол), который уменьшает образование пероксидов. Хранение над NaOH приводит к осаждению промежуточных гидропероксидов эфира. Воду и пероксиды можно удалить либо отгонкой натрия и бензофенона, либо пропусканием через колонку с активированным оксидом алюминия. [10]
Пероксиды эфира имеют более высокую температуру кипения и в сухом виде являются контактными взрывчатыми веществами. Диэтиловый эфир обычно поставляется со следовыми количествами антиоксиданта BHT (2,6-ди-трет-бутил-4-метилфенол), который уменьшает образование пероксидов. Хранение над NaOH приводит к осаждению промежуточных гидропероксидов эфира. Воду и пероксиды можно удалить либо отгонкой натрия и бензофенона, либо пропусканием через колонку с активированным оксидом алюминия. [10]
См. Также
- Эфир
Примечания
- ↑ 1,0 1.1 Lawrence Karas and W. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J. J.. , Inc., 2004).
- ↑ Этиловый эфир, Chem. Справочник по экономике (Менло Парк, Калифорния: SRI International, 1991).
- ↑ 3.0 3.1 Джон В. Хилл и Дорис К. Колб, Химия для меняющихся времен, 10-е изд.
 (Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004, ISBN 0536836841).
(Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004, ISBN 0536836841). - ↑ Ф. А. Кальдероне, Исследования дозировки эфира после анестезии наркотическими средствами, J. Pharmacology Experimental Therapeutics 55(1): 24-39. Проверено 24 ноября 2008 г.
- ↑ Эровид, Капли Гофмана. Проверено 24 ноября 2008 г.
- ↑ Международный комитет по контролю над наркотиками, Список химических веществ и прекурсоров, часто используемых при незаконном производстве наркотических средств и психотропных веществ, находящихся под международным контролем. Проверено 24 ноября 2008 г.
- ↑ Мэтью П. Браун и Гэри А. Пейн, 109. Мутантный штамм 241 Aspergillus flavus, заблокированный в биосинтезе афлатоксина, не накапливает транскрипт aflR, Университет штата Северная Каролина, Роли, Северная Каролина 27695. Проверено 24 ноября 2008 г.
- ↑ П.Т. Норманн, А. Рипель и Дж. Морланд, Диэтиловый эфир ингибирует метаболизм этанола in vivo путем взаимодействия с алкогольдегидрогеназой, Алкоголизм: клинические и экспериментальные исследования 11(2): 163–166.
 (doi = 10.1111/j.1530-0277.1987.tb01282.x).
(doi = 10.1111/j.1530-0277.1987.tb01282.x). - ↑ Ларри К. Кифер, Уильям А. Гарланд, Нил Ф. Олдфилд, Джеймс Э. Свагздис и Брюс А. Мико, 1985, Ингибирование метаболизма N-нитрозодиметиламина у крыс с помощью эфирной анестезии, Cancer Research 45: 5457– 60.
- ↑ W.L.F. Армарего и Кристина Ли Лин Чай, Очистка лабораторных химикатов (Амстердам: Butterworth-Heinemann, 2004, ISBN 978-0750675710).
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Хилл, Джон В. и Дорис К. Колб. Химия меняющихся времен, 10-е изд. Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004. ISBN 0536836841
- Макмерри, Джон. Органическая химия, 6-е изд. Бельмонт, Калифорния: Брукс/Коул, 2004. ISBN 0534420052
- Моррисон, Роберт Т. и Роберт Н. Бойд. Органическая химия, 6-е изд. Энглвуд Клиффс, Нью-Джерси: Prentice Hall, 1992. ISBN 0136436692
- Соломоновы острова, Т.В. Грэм и Крейг Б.
 Фрайл. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: John Wiley, 2004. ISBN 0471417998
Фрайл. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: John Wiley, 2004. ISBN 0471417998
Внешние ссылки
Все ссылки получены 28 июля 2022 г.
- «Более сильный эфир» от Dr. Nostrum.
| Общие анестетики (N01A) | |
|---|---|
| Барбитураты | Гексобарбитал, Метогекситал, Наркобарбитал, Тиопентал |
| Эфиры | Диэтиловый эфир, десфлуран, энфлуран, изофлуран, метоксифлуран, метоксипропан, севофлуран, виниловый эфир |
| Галогеналканы | Хлороформ, Галотан, Трихлорэтилен |
| Опиоиды | Алфентанил, анилеридин, фентанил, феноперидин, ремифентанил, суфентанил |
| Прочие | Альфаксалон, Дроперидол, Эскетамин, Этомидат, Гидроксимасляная кислота, Кетамин, Минаксолон, Закись азота, Пропанидид, Пропофол, Ксенон |
Авторы
Энциклопедия Нового Света авторов и редакторов переписали и дополнили Википедия статья
в соответствии со стандартами New World Encyclopedia .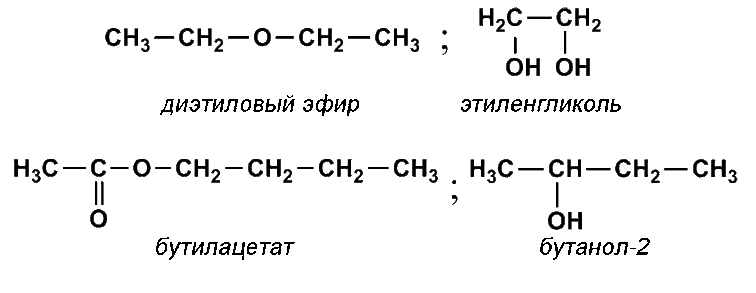


 2 Ч 3
2 Ч 3  (Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004, ISBN 0536836841).
(Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004, ISBN 0536836841). (doi = 10.1111/j.1530-0277.1987.tb01282.x).
(doi = 10.1111/j.1530-0277.1987.tb01282.x). Фрайл. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: John Wiley, 2004. ISBN 0471417998
Фрайл. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: John Wiley, 2004. ISBN 0471417998