Содержание
404 Cтраница не найдена
Размер:
AAA
Изображения
Вкл.
Выкл.
Обычная версия сайта
К сожалению запрашиваемая страница не найдена.
Но вы можете воспользоваться поиском или картой сайта ниже
|
|
404 Cтраница не найдена
- О Вузе
- Структура университета
- Устав
- Лицензия с приложениями
- Дополнительное образование
- Видеогалерея
- Фотогалерея
- Выпускникам
- Библиотека
- Бассейн
- Ботанический сад
- Сведения об образовательной организации
- Абитуриенту
- Приемная комиссия
- Новости приемной комиссии
- Прием 2023.
 Бакалавриат. Специалитет
Бакалавриат. Специалитет - Прием 2023. Магистратура
- Прием 2023. Аспирантура
- Прием 2022. Ординатура
- Программы вступительных испытаний
- Сведения о ходе подачи документов
- Рейтинговые списки
- Целевое обучение
- Подготовительные курсы
- Расписание и результаты вступительных испытаний
- Информация о зачислении
- Информация для иностранных граждан
- Общежития
- Студенту
- Расписание занятий
- Оплата обучения
- Учебные материалы
- Профком студентов
- Внеучебная деятельность
- Международная деятельность
- Иностранным студентам
- Вакцинация
- Объединенный совет обучающихся
- Наука
- Научная жизнь
- Основные направления НИР
- Гранты
- Стажировки
- Конференции
- Информер конференций
- Конкурсы
- Олимпиады
- Научные труды КГУ
- Журнал «Вестник Калужского университета»
- Журнал «Вестник Калужского университета.
 Серия 1. Психологические науки. Педагогические науки»
Серия 1. Психологические науки. Педагогические науки» - Центр поддержки НКО
- Выпускникам
- Контакты
- Контакты
- Часто задаваемые вопросы
18.1: Названия и свойства эфиров
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 36365
Цели
После завершения этого раздела вы сможете
- Напишите два приемлемых названия для простого диалкилового эфира, учитывая его структуру Кекуле, сокращенную или сокращенную структуру.

- назовите сложный эфир по системе ИЮПАК, учитывая его Кекуле, сокращенную или сокращенную структуру.
- нарисуйте Кекуле, сокращенную или сокращенную структуру эфира, дав приемлемое название.
- объясняют, почему температура кипения эфира обычно выше, чем у алкана с аналогичной молекулярной массой.
Структура эфиров
Простые эфиры представляют собой класс органических соединений, которые содержат sp 3 гибридизованный кислород между двумя алкильными группами и имеют формулу R-O-R’. Эти соединения используются в красках, парфюмерии, маслах, восках и других промышленных целях. Алифатические эфиры не имеют арильных групп, непосредственно связанных с кислородом эфира.
Примеры алифатических эфиров
Ароматические эфиры имеют по крайней мере одно арильное кольцо, непосредственно связанное с кислородом эфира. В ариловых эфирах неподеленная пара электронов на кислороде сопряжена с ароматическим кольцом, что существенно изменяет свойства эфира.
Пример ароматических эфиров
Гибридизация кислорода sp 3 дает эфирам примерно ту же геометрию, что и спирты и вода. Валентный угол R-O-R’ близок к ожидаемому в тетраэдрической геометрии. Валентный угол диметилового эфира составляет 112 o , что больше валентного угла HO в воде (104,5 o ) из-за стерического отталкивания метильных групп.
Наличие электроотрицательного атома кислорода придает эфирам небольшой дипольный момент с электронной плотностью преимущественно на кислороде (красный и оранжевый на карте электростатического потенциала).
Сравнение физических свойств спиртов и эфиров
Эфиры, в отличие от спиртов, не имеют атома водорода на атоме кислорода (то есть группы ОН). Следовательно, межмолекулярная водородная связь между молекулами эфира отсутствует, что делает их температуру кипения намного ниже, чем у спирта с аналогичной массой. Несмотря на наличие небольшого дипольного момента, температуры кипения простых эфиров примерно такие же, как у алканов сопоставимой молярной массы.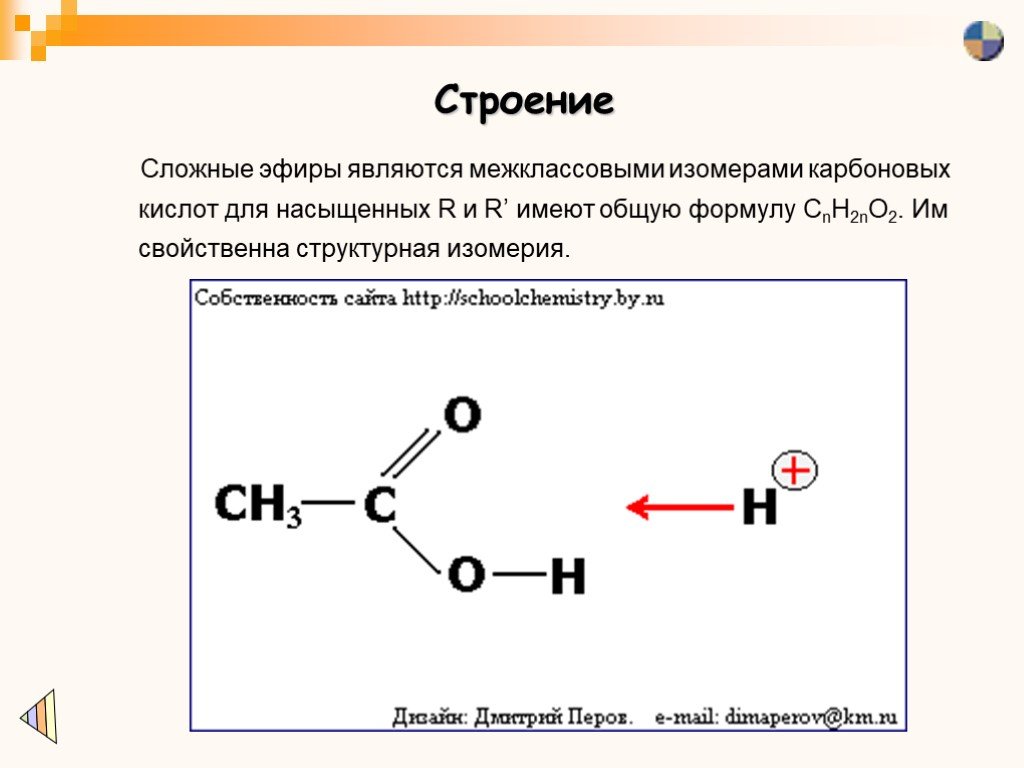 (таблица 18.1.2).
(таблица 18.1.2).
| Краткая структурная формула | Имя | Молярная масса | Температура кипения (°С) | Межмолекулярная водородная связь в чистой жидкости? |
|---|---|---|---|---|
| CH 3 CH 2 CH 3 | пропан | 44 | –42 | нет |
| СН 3 ОЧ 3 | диметиловый эфир | 46 | –25 | нет |
| CH 3 CH 2 OH | спирт этиловый | 46 | 78 | да |
| CH 3 CH 2 CH 2 CH 2 CH 3 | пентан | 72 | 36 | нет |
| CH 3 CH 2 OCH 2 CH 3 | диэтиловый эфир | 74 | 35 | № |
| CH 3 CH 2 CH 2 CH 2 OH | бутиловый спирт | 74 | 117 | да |
Однако молекулы эфира содержат атом кислорода и образуют водородные связи с молекулами воды. Следовательно, эфир имеет примерно такую же растворимость в воде, как изомерный ему спирт. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) практически не растворимы в воде (8 г/100 мл воды).
Следовательно, эфир имеет примерно такую же растворимость в воде, как изомерный ему спирт. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) практически не растворимы в воде (8 г/100 мл воды).
Образование пероксидов
Многие простые эфиры могут реагировать с кислородом с образованием взрывоопасных пероксидных соединений в свободнорадикальном процессе, называемом самоокислением. По этой причине эфиры не следует хранить в течение длительного времени и не следует хранить в стеклянных бутылках. Опасность особенно велика, когда эфирные растворы перегоняются почти досуха. Гидропероксиды могут стать более концентрированными во время перегонки, потому что они, как правило, имеют несколько более высокую температуру кипения, чем соответствующий эфир. Перед проведением перегонки с эфиром необходимо тщательно проверить наличие перекисей.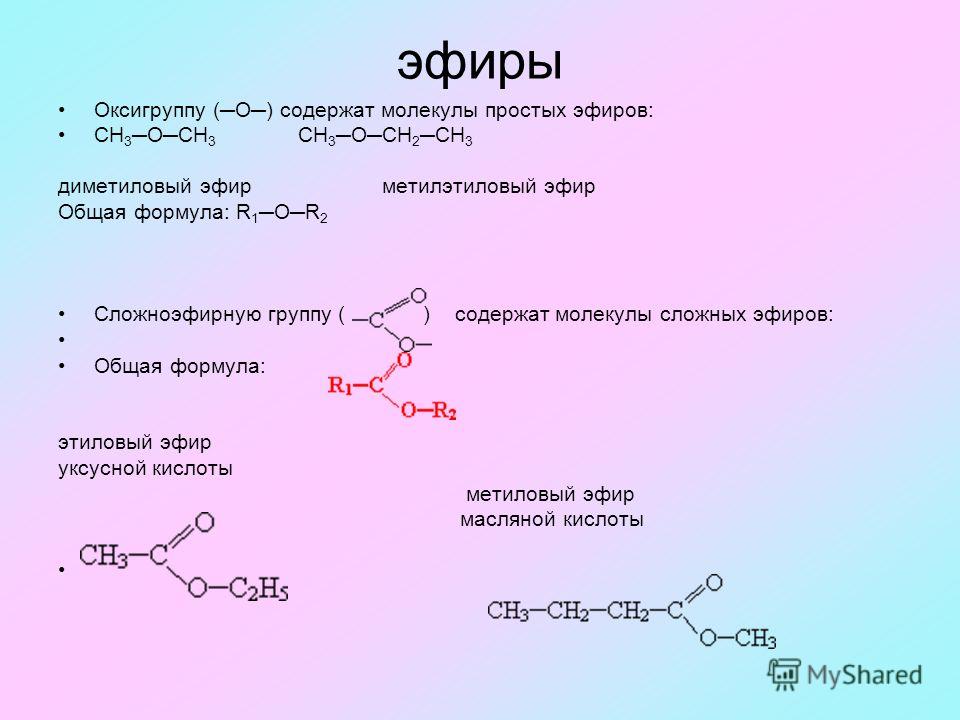
Именование простых эфиров
Когда нет другой функциональной группы, простым эфирам часто дают общие имена функциональных классов. Обе алкильные группы, присоединенные к атому кислорода, называются заместителями (в алфавитном порядке), а затем добавляется слово эфир . Часто используются общие названия для алкильных заместителей, обсуждаемые в Раздел 3.3 .
Пример 18.1.1
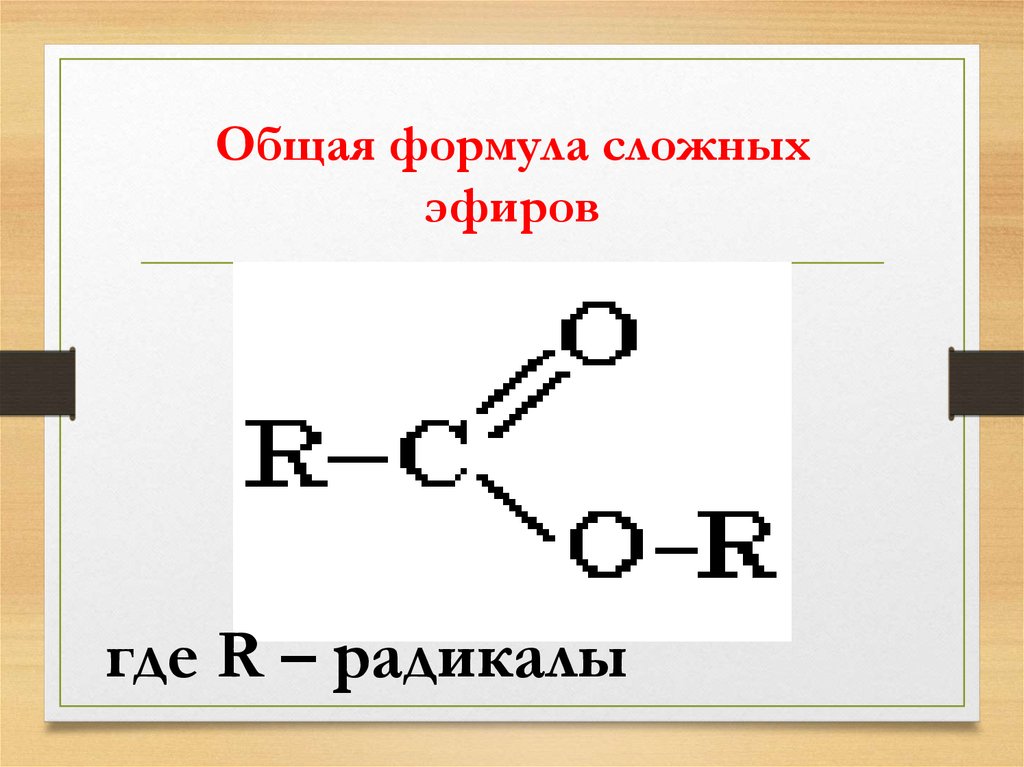
Номенклатура ИЮПАК для простых эфиров должна использоваться для сложных простых эфиров, соединений с более чем одной простой эфирной связью и соединений, в которых другие функциональные группы присутствуют с простым эфиром. В этих случаях RO-группа эфира называется алкокси-заместителем. Обычные алкоксизаместители получили названия, полученные от их алкильного компонента. Суффикс -ил заменен на -окси . (Таблица 18.1.1):
| Алкильная группа | Имя | Алкоксигруппа | Имя | |
|---|---|---|---|---|
| СН 3 – | Метил | СН 3 О– | Метокси | |
| CH 3 CH 2 – | Этил | СН 3 СН 2 О– | Этокси | |
| (CH 3 ) 2 CH– | Изопропил | (CH 3 ) 2 CHO– | Изопропокси | |
| (CH 3 ) 3 С– | трет-бутил | (CH 3 ) 3 CO– | трет-Бутокси | |
| С 6 Н 5 – | Фенил | С 6 Н 5 О– | Фенокси |
Пример 18.
 1.2
1.2
Циклические простые эфиры
Циклические простые эфиры представляют собой тип гетероцикла с одним или несколькими атомами кислорода, расположенными в кольце. Многие циклические эфиры имеют общие названия и часто используются в качестве растворителей из-за их инертной природы. Эти кольцевые структуры также встречаются во многих биологических молекулах, таких как сахара и ДНК. Кольца пронумерованы так, чтобы кислород занимал позицию 1.
Пример 18.1.3
Упражнение 18.1.1
Назовите следующие эфиры:
б)
в)
г)
д)
е)
г)
- Ответы
а) 3-изопропоксипентан
б) 1,3-Диметоксибензол
в) 2-метилтетрагидропиран
г) циклопентилэтиловый эфир
д) 4-бром-1-этоксибензол
е) Дициклогексиловый эфир
г) 4-бутоксициклогексен
Авторы и авторство
Уильям Ройш, почетный профессор (штат Мичиган, Университет штата Мичиган), виртуальный учебник органической химии
Джим Кларк (Chemguide.
 co.uk)
co.uk)
18.1: Names and Properties of Ethers распространяется под лицензией CC BY-SA 4.0, автором, ремиксом и/или куратором выступили Steven Farmer & Dietmar Kennepohl.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- автор@Дитмар Кеннеполь
- автор@Стивен Фармер
- эфиры
14,8 Эфиры | Основы общей, органической и биологической химии
Цели обучения
- Описать структурные различия между спиртом и эфиром, влияющие на физические характеристики и реакционную способность каждого из них.
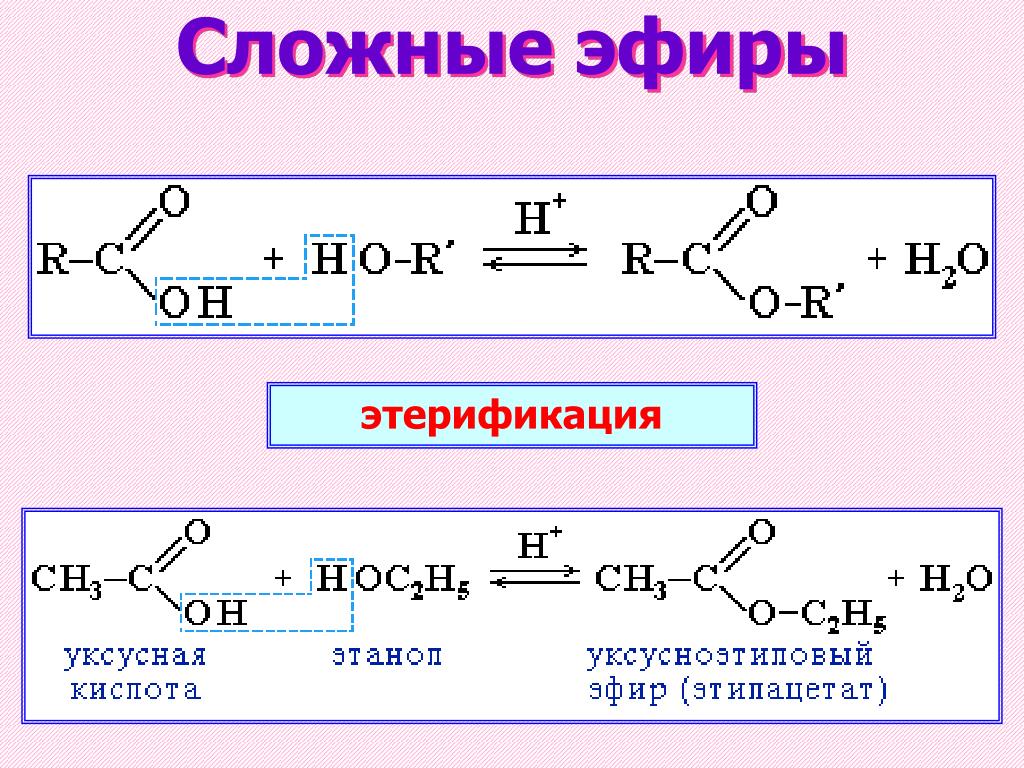
 9{replace\,H\,atom}}\,ROH[/latex]
9{replace\,H\,atom}}\,ROH[/latex]Простые эфиры имеют простые общие названия, образованные из названий групп, присоединенных к атому кислорода, за которыми следует общее название эфир . Например, CH 3 –O–CH 2 CH 2 CH 3 представляет собой метилпропиловый эфир. Если обе группы одинаковы, перед названием группы должен стоять префикс di -, как в случае диметилового эфира (CH 3 –O–CH 3 ) и диэтилового эфира CH 3 CH 2 –O–CH 2 CH 3 .
Молекулы эфира не имеют атома водорода на атоме кислорода (то есть группы ОН). Следовательно, межмолекулярная водородная связь между молекулами эфира отсутствует, и поэтому эфиры имеют довольно низкие температуры кипения для данной молярной массы. Действительно, температуры кипения простых эфиров примерно такие же, как у алканов сопоставимой молярной массы, и значительно ниже, чем у соответствующих спиртов (табл.
 14.4 «Сравнение температур кипения алканов, спиртов и эфиров»).
14.4 «Сравнение температур кипения алканов, спиртов и эфиров»).Таблица 14.4 Сравнение температур кипения алканов, спиртов и эфиров
Краткая структурная формула Имя Молярная масса Температура кипения (°С) Межмолекулярная водородная связь в чистой жидкости? CH 3 CH 2 CH 3 пропан 44 –42 нет СН 3 ОЧ 3 диметиловый эфир 46 –25 нет CH 3 CH 2 OH спирт этиловый 46 78 да CH 3 CH 2 CH 2 CH 2 CH 3 пентан 72 36 нет СН 3 СН 2 ОСН 2 Ч 3 диэтиловый эфир 74 35 нет CH 3 CH 2 CH 2 CH 2 OH бутиловый спирт 74 117 да Однако молекулы эфира содержат атом кислорода и образуют водородные связи с молекулами воды.
 Следовательно, эфир имеет примерно такую же растворимость в воде, как изомерный ему спирт. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) практически не растворимы в воде (8 г/100 мл воды).
Следовательно, эфир имеет примерно такую же растворимость в воде, как изомерный ему спирт. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) практически не растворимы в воде (8 г/100 мл воды).Пример 5
Каково общее название каждого эфира?
- CH 3 CH 2 CH 2 OCH 2 CH 2 CH 3
Раствор
- Углеродные группы по обе стороны от атома кислорода представляют собой пропил (CH 3 CH 2 CH 2 ), поэтому соединение представляет собой дипропиловый эфир.
- Трехуглеродная группа присоединена к среднему атому углерода, поэтому это изопропильная группа. Одноуглеродная группа представляет собой метильную группу. Соединение представляет собой изопропилметиловый эфир.

Упражнение для развития навыков
Каково общее название каждого эфира?
CH 3 CH 2 CH 2 CH 2 OCH 2 CH 2 CH 2 CH 3
Для вашего здоровья: эфиры как средства для общей анестезии
Общий анестетик воздействует на мозг, вызывая потерю сознания и общую нечувствительность к ощущениям или боли. Диэтиловый эфир (CH 3 CH 2 OCH 2 CH 3 ) был первым общим анестетиком, который использовался.
Диэтиловый эфир относительно безопасен, поскольку существует довольно большой разрыв между дозой, вызывающей эффективный уровень анестезии, и смертельной дозой. Однако, поскольку он легко воспламеняется и имеет дополнительный недостаток, вызывающий тошноту, его заменили более новыми ингаляционными анестетиками, включая фторсодержащие соединения галотан, энфлуран и изофлуран.
 К сожалению, безопасность этих соединений для персонала операционной ставится под сомнение. Например, женщины-сотрудники операционных, подвергшиеся воздействию галотана, чаще страдают от выкидышей, чем женщины в общей популяции.
К сожалению, безопасность этих соединений для персонала операционной ставится под сомнение. Например, женщины-сотрудники операционных, подвергшиеся воздействию галотана, чаще страдают от выкидышей, чем женщины в общей популяции.Упражнения по обзору концепции
Why does diethyl ether (CH 3 CH 2 OCH 2 CH 3 ) have a much lower boiling point than 1-butanol (CH 3 CH 2 CH 2 CH 2 ОЙ)?
Что более растворимо в воде — этилметиловый эфир (СН 3 СН 2 ОСН 3 ) или 1-бутанол (СН 3 СН 2 СН 2 19 СН 2 ОН)? Объяснять.
Показать ответ
Ключевые выводы
- Чтобы дать простым эфирам общие названия, просто назовите группы, присоединенные к атому кислорода, а затем общее название эфир .
 Если обе группы одинаковые, перед именем группы должен стоять префикс di -.
Если обе группы одинаковые, перед именем группы должен стоять префикс di -. - Молекулы эфира не имеют ОН-группы и, следовательно, не имеют межмолекулярных водородных связей. Следовательно, эфиры имеют довольно низкие температуры кипения для данной молярной массы.
- Молекулы эфира имеют атом кислорода и могут образовывать водородные связи с молекулами воды. Молекула эфира имеет примерно такую же растворимость в воде, как изомерный ей спирт.
Упражнения
Как этанол может давать два разных продукта при нагревании с серной кислотой? Назовите эти продукты.
Какой из этих простых эфиров изомерен этанолу — CH 3 CH 2 OCH 2 CH 3 , CH 3 OCH 2 CH 3 или CH 3 OCH 3 ?
Назовите каждое соединение.
- CH 3 OCH 2 CH 2 CH 3
Назовите каждое соединение.



 Бакалавриат. Специалитет
Бакалавриат. Специалитет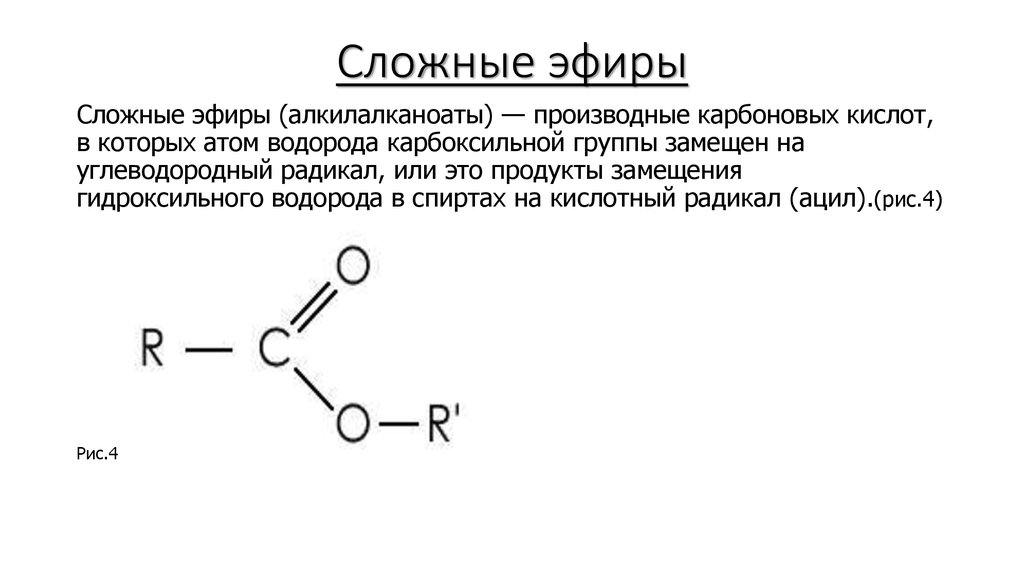 Серия 1. Психологические науки. Педагогические науки»
Серия 1. Психологические науки. Педагогические науки»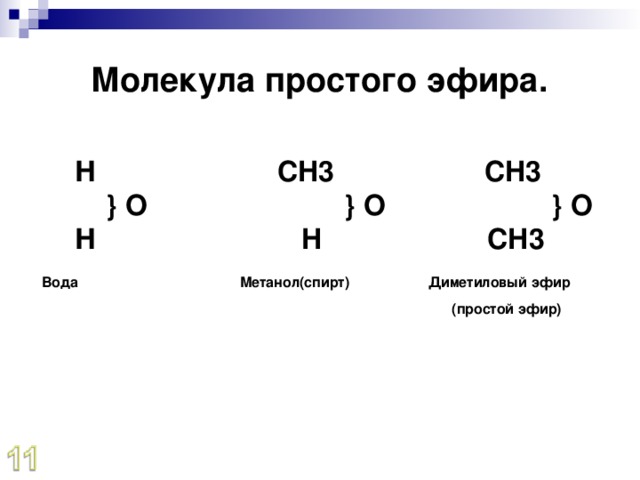
 co.uk)
co.uk) 9{replace\,H\,atom}}\,ROH[/latex]
9{replace\,H\,atom}}\,ROH[/latex] 14.4 «Сравнение температур кипения алканов, спиртов и эфиров»).
14.4 «Сравнение температур кипения алканов, спиртов и эфиров»). Следовательно, эфир имеет примерно такую же растворимость в воде, как изомерный ему спирт. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) практически не растворимы в воде (8 г/100 мл воды).
Следовательно, эфир имеет примерно такую же растворимость в воде, как изомерный ему спирт. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) практически не растворимы в воде (8 г/100 мл воды).
 К сожалению, безопасность этих соединений для персонала операционной ставится под сомнение. Например, женщины-сотрудники операционных, подвергшиеся воздействию галотана, чаще страдают от выкидышей, чем женщины в общей популяции.
К сожалению, безопасность этих соединений для персонала операционной ставится под сомнение. Например, женщины-сотрудники операционных, подвергшиеся воздействию галотана, чаще страдают от выкидышей, чем женщины в общей популяции.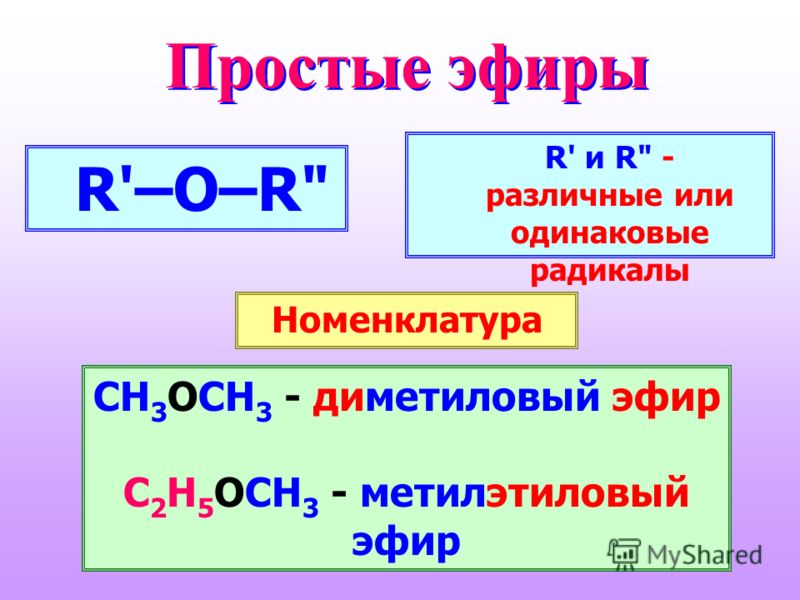 Если обе группы одинаковые, перед именем группы должен стоять префикс di -.
Если обе группы одинаковые, перед именем группы должен стоять префикс di -.