Содержание
Сложные эфиры: способы получения и свойства
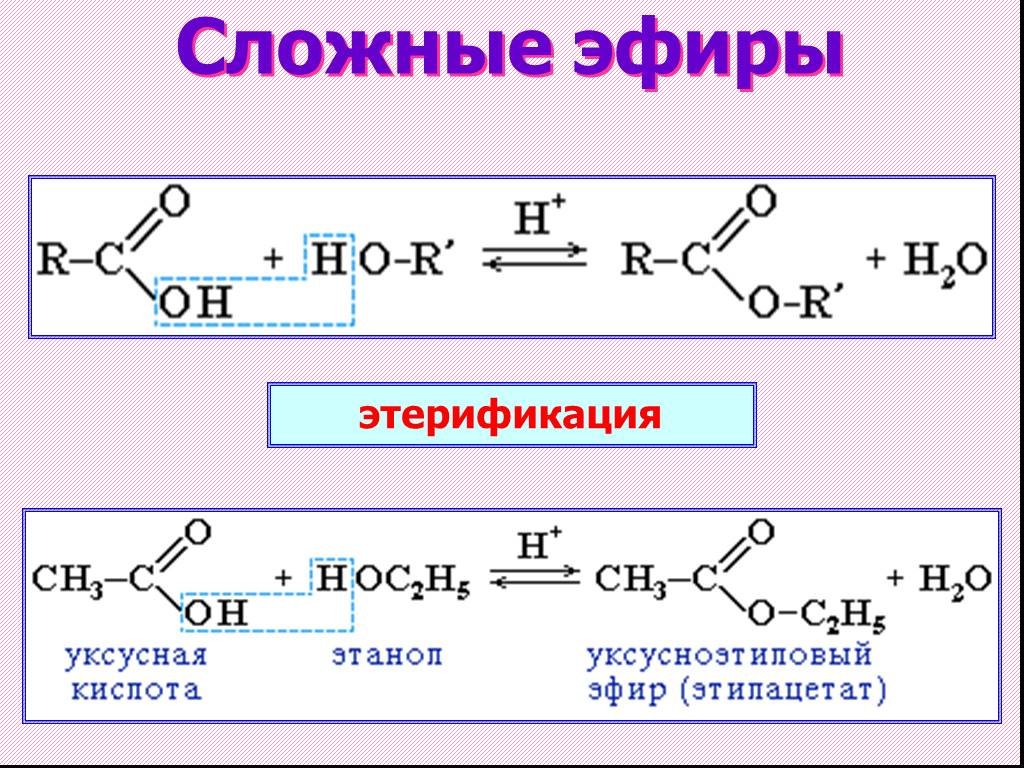
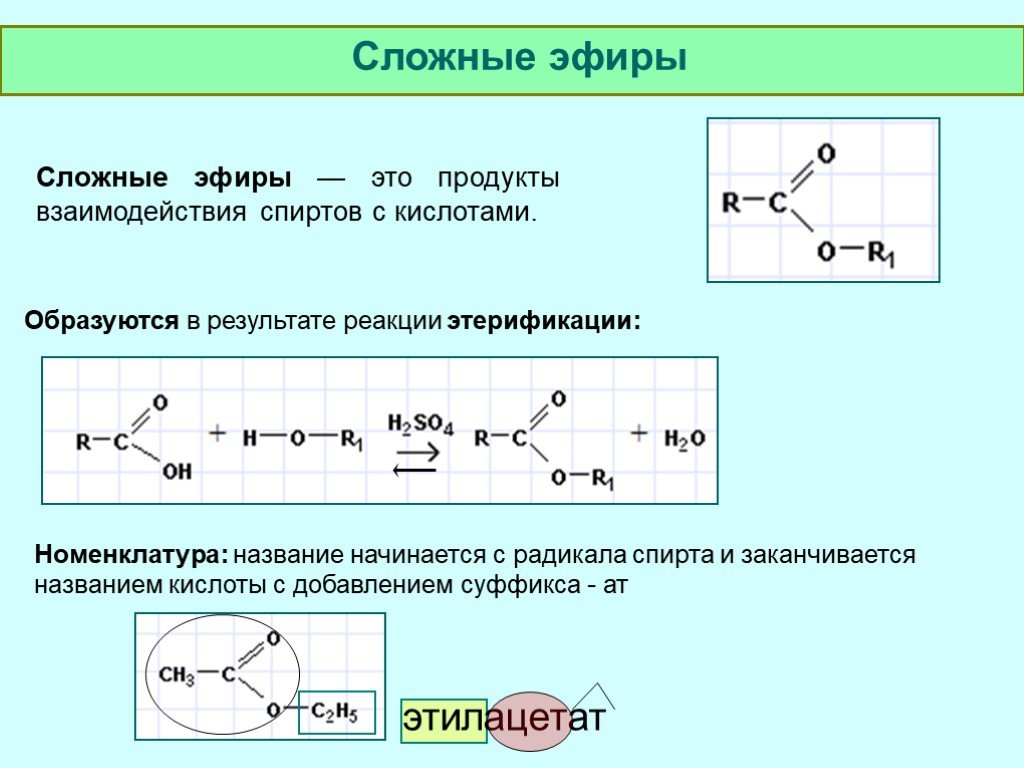
Сложные эфиры: способы получения, химические и физические свойства, строение.
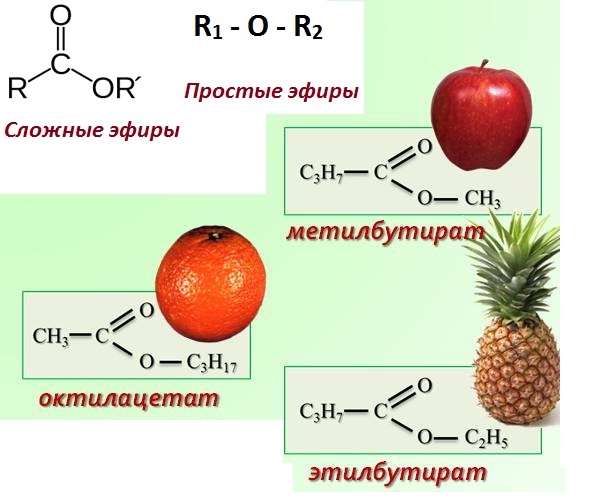
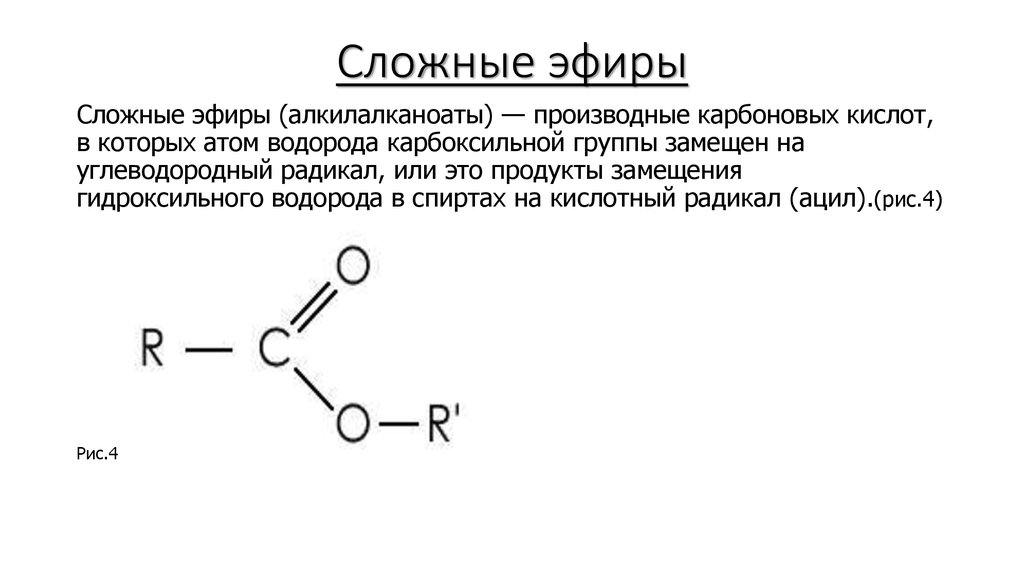
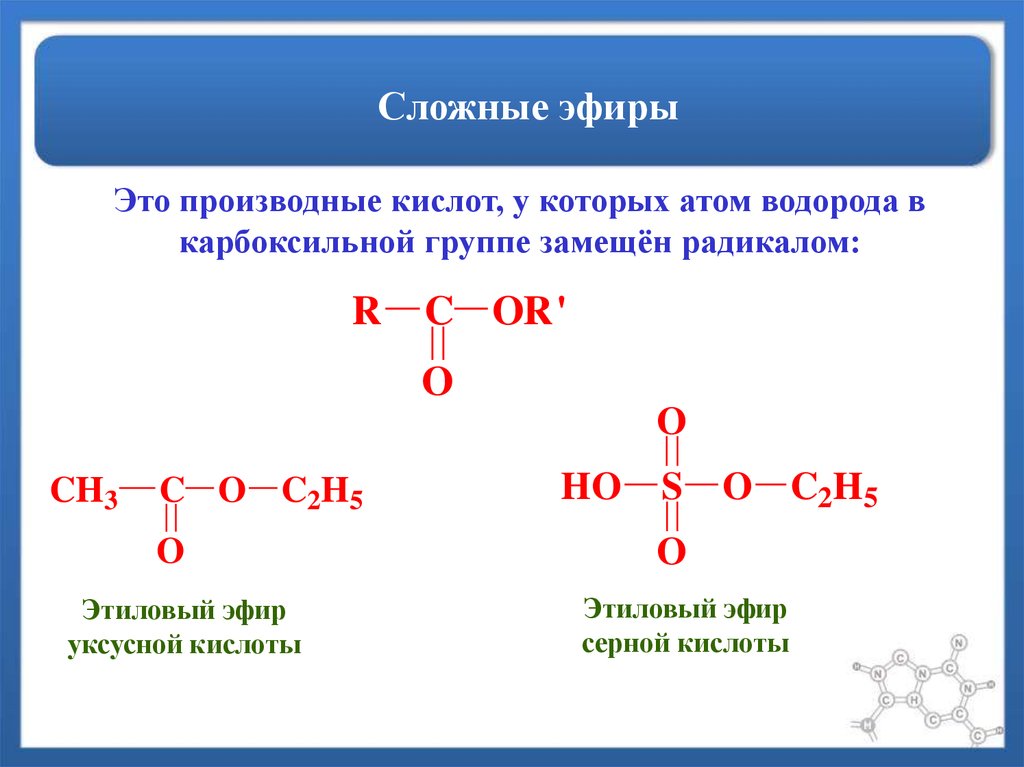
| Сложные эфиры – это органические вещества, в молекулах которых углеводородные радикалы соединены через карбоксильную группу -СОО-, а именно R1-COOH-R2. |
Общая формула предельных сложных эфиров: СnH2nO2
По числу карбоксильных групп:
- сложные эфиры одноосновных карбоновых кислот — содержат одну карбоксильную группу -СОО-. Общая формула CnH2nO2.
| Например, метилформиат |
H-COO-CH3
- сложные эфиры многоатомных спиртов — содержат две и более карбоксильные группы -СОО-.

| Например, тристеарат глицерина |
- Сложные эфиры многоосновных органических кислот.
Например, общая формула сложных эфиров двухосновных карбоновых кислот CnH2n-2O4
В названии сложного эфира сначала указывают алкильную группу, связанную с кислородом, затем кислоту, заменяя суффикс в названии кислоты (-овая кислота) на суффикс -оат.
| Название сложного эфира | Тривиальное название | Формула эфира |
| Метилметаноат | Метилформиат | HCOOCH3 |
| Этилметаноат | Этилформиат | HCOOC2H5 |
| Метилэтаноат | Метилацетат | CH3COOCH3 |
| Этилэтаноат | Этилацетат | CH3COOC2H5 |
| Пропилэтаноат | Пропилацетат | CH3COOCH2CH2CH3 |
. 1. Гидролиз
1. Гидролиз
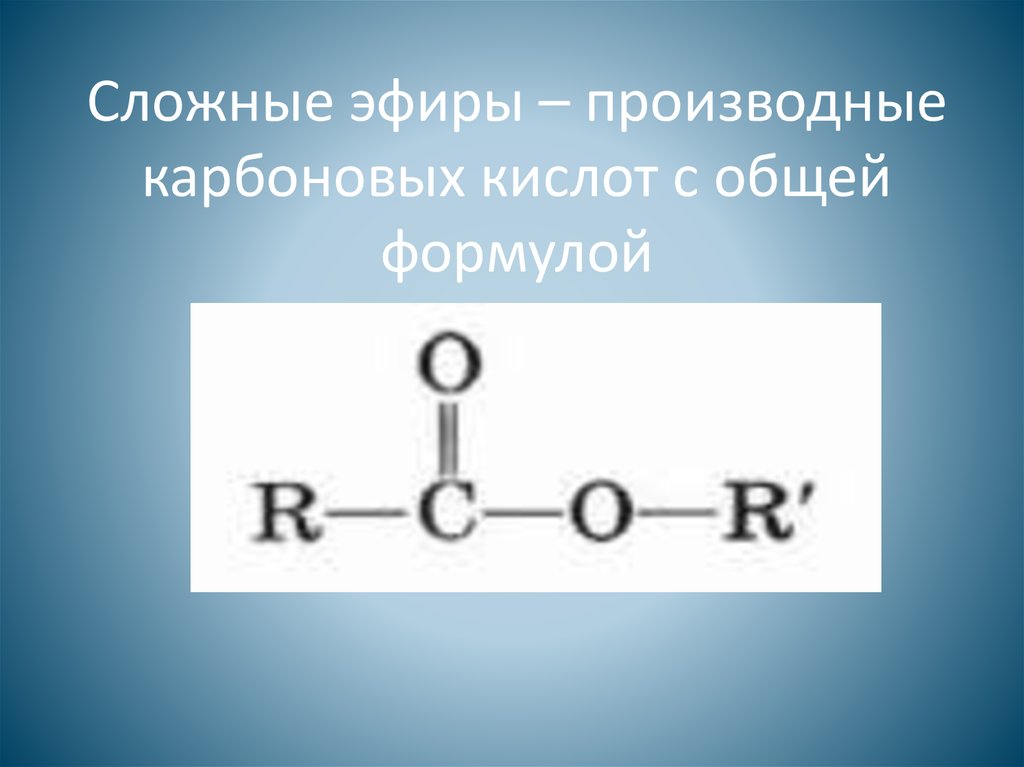
| Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей. |
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
Например, при гидролизе метилацетата образуются уксусная кислота и метанол.
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
Например, при щелочном гидролизе этилформиата образуются этанол и формиат натрия:
При щелочном гидролизе этилацетата образуются ацетат и этанол:
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла.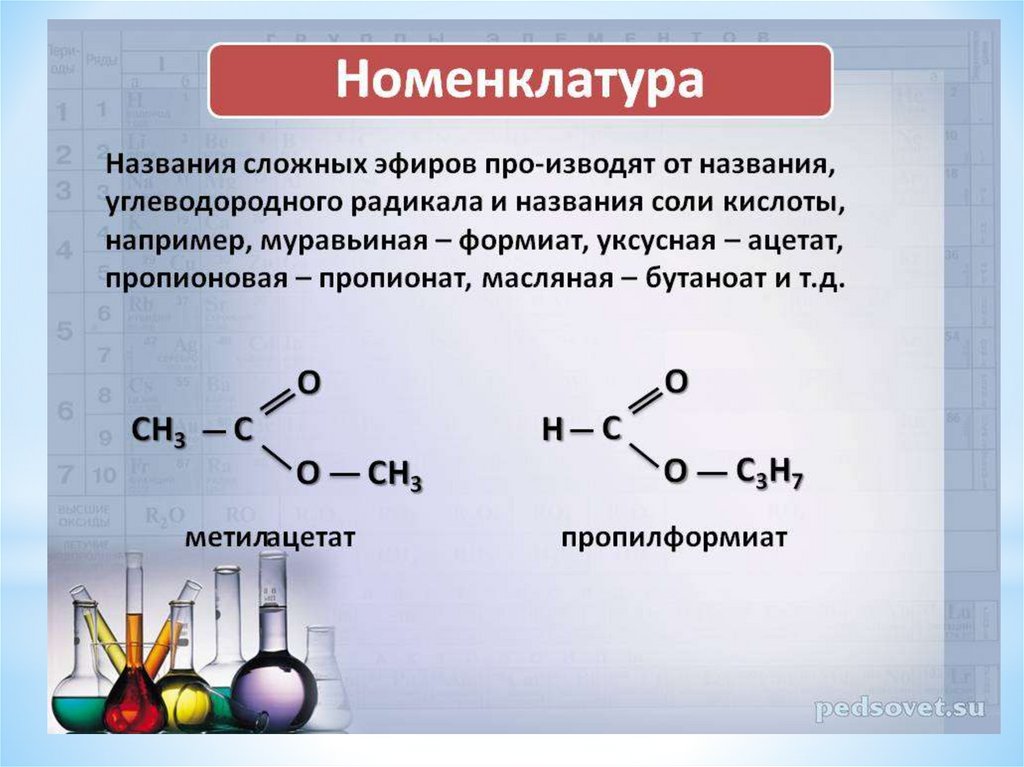 Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
2. Переэтерификация
Переэтерификация — это реакция превращения одного сложного эфира в другой под действием соответствующих спиртов в присутствии катализатора (кислоты или основания)
R-COO-CH3 + R’-OH = R-COOR’ + CH3-OH
3.Восстановление сложных эфиров
Сложные эфиры восстанавливаются с разрывом связи С-О карбоксильной группы. При этом образуется смесь спиртов.
| Например, этилбензоат восстанавливается литийалюминийгидридом до бензилового спирта и этанола |
C6H5-COO-C2H5 + [H] = C6H5-CH2OH + C2H5-OH
1. Этерификация карбоновых кислот спиртами
Этерификация карбоновых кислот спиртами
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2. Соли карбоновых кислот с галогеналканами
При взаимодействии солей карбоновых кислот с галогеналканами образуются сложные эфиры.
| Например, при взаимодействии ацетата натрия с хлорметаном образуется метилацетат. |
CH3-COONa + CH3-Cl = CH3-COOCH3 + NaCl
| Например, при взаимодействии формиата натрия с хлорэтаном образуется этилформиат. |
H-COONa + C2H5-Cl = H-COOC2H5 + NaCl
Понравилось это:
Нравится Загрузка. ..
..
Синтетические и природные краун-эфиры
Цитировать:
Хомидов И.И., Мамажонов Ж.Ш., Чалабоева З.М. Синтетические и природные краун-эфиры // Universum: химия и биология : электрон. научн. журн. 2019. № 12 (66). URL: https://7universum.com/ru/nature/archive/item/8317 (дата обращения: 04.11.2022).
Прочитать статью:
АННОТАЦИЯ
Краун-эфиры, с химической точки зрения, являются гетероциклическими соединениями. Своеобразность краун-эфиров заключается в том, что они способны образовать циклические макромолекулы с различными атомами. В данной статье приведены некоторые свойства и области применения как синтетических, так и природных краун-эфиров.
ABSTRACT
Crown ethers, from a chemical point of view, are heterocyclic compounds. Their originality lies in the fact that they are able to form cyclic macromolecules with various atoms. This article presents some properties and applications of both synthetic and natural crown ethers.
Kлючевые слова: химия, краун-эфиры, соединения, алкалоиды, растения, физиологически активные, гетероциклические, циклические макромолекулы, синтетическиe, природные, бензилизохинолины.
Keywords: chemistry, compounds, crown ethers, alkaloids, plants, physiologically active, heterocyclic, cyclic macromolecules, synthetic, natural, benzilizohinolines.
Вопрос изучение закономерностей химического поведения основных классов гетероциклических: как синтетических, так и природных соединений во взаимосвязи с их строением остается актуальной задачей биоорганической химии.
По химической структуре все краун-эфиры относятся к классу гетероциклических соединений, однако разнообразные физические и химические свойства, а также физиологические действие этих соединений позволили выделить их в самостоятельный класс соединений. Характерное свойства этих краун-эфиров образовывать комплексные соединение с многими металлами за счет неподелённых электронных пар гетероатомов.
В последние время всё чаще появляется информация о синтезе и применение синтетических краун-эфиров. В частности, авторами приведены синтез эффективного наноматериала, введением наножелеза (Fe60) в полость олигомерного краун-эфира. Ими установлено, что полученное соединение улучшает реологические свойства нефти: уменьшение вязкости, отделение воды и механических примесей от нефти, уменьшение удельной массы нефти [1].
В современной медицине часто появляются данные о макроциклических лигандов – краун-эфиров как противотоксичных средств. Способность макроциклических соединений строго избирательно, в соответствии с устройством своей внутримолекулярной полости, захватывать и удерживать определенные ионы делает их высокоэффективными специфическими экстрагентами: с их помощью можно выводит из организма попавшие в него радиоактивные вещества или токсичные тяжелые металлы. Многие макроциклические соединения обладают антимикробными, антипаразитарными свойствами, способны регулировать работу сердца, предотвращая аритмию и фибрилляцию.
В растениях, природные краун-эфиры специфически связываясь с щелочными и щелочноземельными металлами, которые играют решающую роль в функционирование ферментов, открывают большие возможности для управления состояния растительного организма.
Нами было исследованы различные органы растений рода Веrberis. Во время исследования алкалоидного состава Веrberis нами было выделено и установлено строение нейтрального, циклического соединения цикловератрилена (I).
Из эфирной суммы молодых побегов B.turcomanica выделено нейтральное вещество I. Для определения cтруктуры I проведено рентгеноструктурный анализ и установлено, что соединение I является циклотривератриленом (ЦТВ).
Соединение I дает положительную реакцию с реактивом Драгендорфа, которое характерно для азотсодержащих соединений.
В масс-спектре имеются пики ионов с m/z 450 (30), 449(100), 435 (25), 419 (80), 299 (95), 151 (50). В УФ-спектре присутствуют максимумы поглощения в области 234 и 296 нм. В ИК-спектре отсутствуют полосы поглощения, соответствующие гидроксильной и карбонильной группе.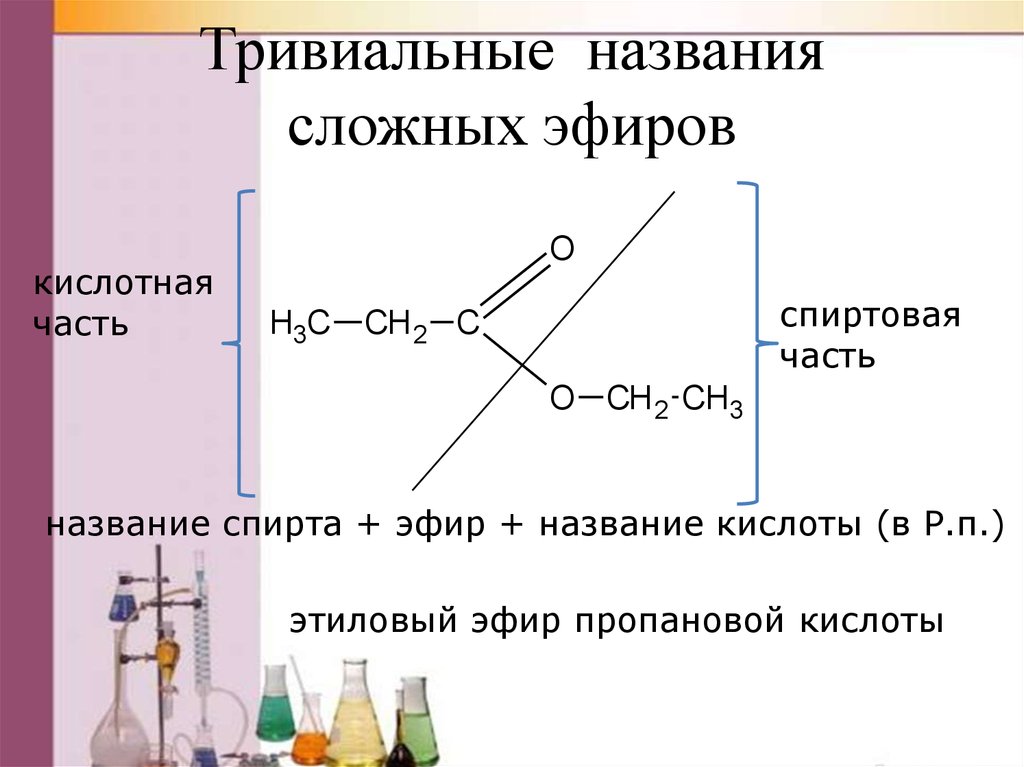
В ПМР-спектре oбнаружены четыре группы сигналов: в ароматической области — синглет при 6.80 м.д., два дублета от метиленовых протонов при 4.69 и 3.46 м.д.(J=14 Гц) и синглет от метоксильной (ОСН3) группы при 3.76 м.д. с соотношением интенсивностей 2:1:1:6. Такая групповая эквивалентность протонов свидетельствует о высокой симметричности соединения I.
Это же подтверждает ЯМР 13С-спектр I, в котором имеется только пять сигналов для углеродных атомов. Для определения структуры I проведено рентгеноструктурный анализ и установлено, что соединение I является природным краун-эфиром — циклотривератриленом, пространственное строение которого изучено рентгеноструктурным анализом. Отнесение сигналов в спектре ЯМР 13С: 113,0 (д, С-2), 147.6 (с, С-3), 132.7 (с, С-6), 36.3 (т, С-7), 55.9 (к, ОСН3).
Известно, что циклотривератрилен в лабораторных условиях получается конденсацией вератрола с формальдегидом или из вератрилового спирта при нагревании с концентрированными кислотами. Однако окончательная структура для циклотривератрилена установлена намного позднее [2]. Поскольку при экстракции сырья — молодых побегов B.turcomanica и разделении смеси алкалоидов нами не применялось концентрированные кислоты, считаем что ЦТВ является нативным соединением, впервые выделенным из растения.
Однако окончательная структура для циклотривератрилена установлена намного позднее [2]. Поскольку при экстракции сырья — молодых побегов B.turcomanica и разделении смеси алкалоидов нами не применялось концентрированные кислоты, считаем что ЦТВ является нативным соединением, впервые выделенным из растения.
Вероятно, биосинтез I и II идет в растении параллельно из общего предшественника. Однако, не исключено, что I является конечным продуктом превращений бензилизохинолиновых алкалоидов, так как имеются сведения о получении циклотривератрилена при окислении бензилизохинолинового алкалоида — лауданозина [3].
Список литературы:
1. Шабанов А.Л. и др. Комплексы наножелеза с краун-эфирами – эффективные регуляторы улучшения реологических свойств нефтей.//. Журнал «Нефтепромысловое дело». – 2014. — № 4. – 60-62 стр.
2. Lindsey A. The structure of Cyclotriveratrilene and Related Compounds // J. Chem. Soc. — 1965. — P. 1685-1692.
3. Goldup A. , Morrison A.B., Smith G.W. The Structure of Cycloveratril. J. Chem. Soc. — 1965. — P. 3864-3865.
, Morrison A.B., Smith G.W. The Structure of Cycloveratril. J. Chem. Soc. — 1965. — P. 3864-3865.
эфир | Описание, типы и реакции
комплекс липопротеинов низкой плотности (ЛПНП)
Посмотреть все СМИ
- Ключевые люди:
- Луи-Жак Тенар
- Похожие темы:
- ацетилхолин
нитрит
лактон
карбонат
фосфат
См. все сопутствующие материалы →
сложный эфир , любое из класса органических соединений, которые реагируют с водой с образованием спиртов и органических или неорганических кислот. Наиболее распространены сложные эфиры карбоновых кислот. Срок 9Эфир 0023 был введен в первой половине 19 века немецким химиком Леопольдом Гмелином.
Сложные эфиры карбоновых кислот, формула RCOOR’ (R и R’ представляют собой любые органические сочетающиеся группы), обычно получают реакцией карбоновых кислот и спиртов в присутствии соляной или серной кислоты, этот процесс называется этерификацией. В реакции гидроксильная группа (ОН) карбоновой кислоты заменяется алкоксигруппой (R’O) спирта.
В реакции гидроксильная группа (ОН) карбоновой кислоты заменяется алкоксигруппой (R’O) спирта.
Подробнее по этой теме
Карбоновая кислота: сложные эфиры карбоновых кислот
Функциональная группа сложного эфира карбоновой кислоты представляет собой ацильную группу, связанную с OR или OAr, где R представляет собой алкильную группу и…
Обратная реакция этерификации является примером гидролиза. Сложные эфиры могут быть также получены реакцией галогенангидридов или ангидридов кислот со спиртами или реакцией солей карбоновых кислот с алкилгалогенидами. Один сложный эфир можно превратить в другой эфир путем реакции (переэтерификации) со спиртом, карбоновой кислотой или третьим эфиром в присутствии катализатора.
Гидролиз сложных эфиров в присутствии щелочей, таких как гидроксид калия (щелок) или натрия, — реакция, называемая омылением, — используется при приготовлении мыла из жиров и масел, а также для количественной оценки сложных эфиров. Влажные химические огнетушители, которые используются для пожаров, связанных с жирами и маслами, основаны на реакциях омыления для преобразования горящих жиров в негорючее мыло. Масляные картины также могут подвергаться омылению, особенно те, которые созданы с использованием пигментов, содержащих тяжелые металлы. Исследования показывают, что тяжелые металлы в пигментах реагируют с маслами в краске с образованием мыла; при воздействии влаги (например, исходное мокрое покрытие краски или повышенная влажность) мыло может стать липким или раствориться, что приведет к повреждению картины.
Влажные химические огнетушители, которые используются для пожаров, связанных с жирами и маслами, основаны на реакциях омыления для преобразования горящих жиров в негорючее мыло. Масляные картины также могут подвергаться омылению, особенно те, которые созданы с использованием пигментов, содержащих тяжелые металлы. Исследования показывают, что тяжелые металлы в пигментах реагируют с маслами в краске с образованием мыла; при воздействии влаги (например, исходное мокрое покрытие краски или повышенная влажность) мыло может стать липким или раствориться, что приведет к повреждению картины.
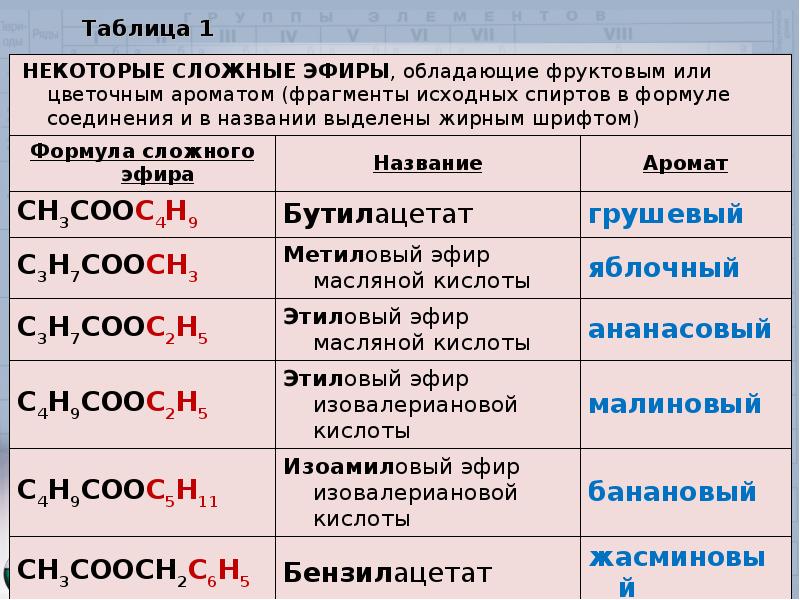
Низкомолекулярные эфиры карбоновых кислот представляют собой бесцветные летучие жидкости с приятным запахом, слабо растворимые в воде. Многие отвечают за аромат и вкус цветов и фруктов; например, изопентилацетат присутствует в бананах, метилсалицилат — в грушанке и этилбутират — в ананасах. Эти и другие летучие эфиры с характерным запахом используются в синтетических ароматизаторах, парфюмерии и косметике. Некоторые летучие сложные эфиры используются в качестве растворителей лаков, красок и лаков; для этой цели в промышленных масштабах производятся большие количества этилацетата и бутилацетата. Воски, выделяемые животными и растениями, представляют собой сложные эфиры, образованные длинноцепочечными карбоновыми кислотами и длинноцепочечными спиртами. Жиры и масла представляют собой сложные эфиры длинноцепочечных карбоновых кислот и глицерина.
Некоторые летучие сложные эфиры используются в качестве растворителей лаков, красок и лаков; для этой цели в промышленных масштабах производятся большие количества этилацетата и бутилацетата. Воски, выделяемые животными и растениями, представляют собой сложные эфиры, образованные длинноцепочечными карбоновыми кислотами и длинноцепочечными спиртами. Жиры и масла представляют собой сложные эфиры длинноцепочечных карбоновых кислот и глицерина.
Жидкие сложные эфиры с низкой летучестью служат в качестве мягчителей для смол и пластмасс. Сложные эфиры также включают многие промышленно важные полимеры. Полиметилметакрилат представляет собой заменитель стекла, продаваемый под названиями Lucite и Plexiglas; полиэтилентерефталат используется в качестве пленки (майлара) и текстильных волокон, продаваемых как терилен, фортрель и дакрон.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подписаться сейчас
Сложные эфиры также образуются из спиртов и таких неорганических кислот, как серная, фосфорная и азотная кислоты.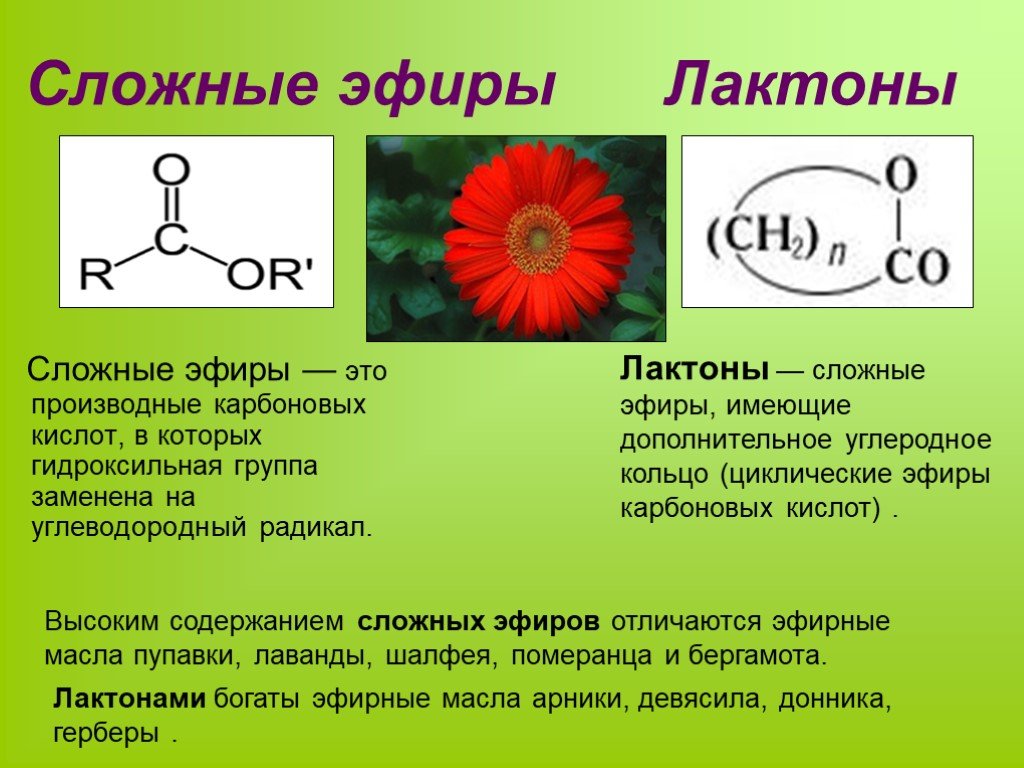 Нитратные эфиры (например, тринитрат глицерина или нитроглицерин) взрывоопасны. Эфиры фосфорной кислоты имеют биологическое значение (к этой группе относятся нуклеиновые кислоты) и широко используются в промышленности в качестве растворителей, пластификаторов, антипиренов, присадок к бензину и маслам, инсектицидов.
Нитратные эфиры (например, тринитрат глицерина или нитроглицерин) взрывоопасны. Эфиры фосфорной кислоты имеют биологическое значение (к этой группе относятся нуклеиновые кислоты) и широко используются в промышленности в качестве растворителей, пластификаторов, антипиренов, присадок к бензину и маслам, инсектицидов.
Эфиры серной и сернистой кислот используются в производстве красителей и фармацевтических препаратов. Диметилсульфат, наиболее известный эфир серной кислоты, является опасным ядом.
Редакторы Британской энциклопедии Эта статья была недавно отредактирована и обновлена Карой Роджерс.
ПРЕДСТАВЛЕНИЕ ЭФИРОВ На этой странице объясняется, что такое сложные эфиры, и рассматриваются их простые физические свойства, такие как растворимость и температуры кипения. Он включает в себя введение в более сложные природные эфиры, такие как животные и растительные жиры и масла. Что такое сложные эфиры? Сложные эфиры получают из карбоновых кислот. Карбоновая кислота содержит группу -COOH, а в сложном эфире водород в этой группе заменен какой-либо углеводородной группой. Это может быть алкильная группа, такая как метил или этил, или группа, содержащая бензольное кольцо, такая как фенил. Эфир обыкновенный — этилэтаноат Наиболее часто обсуждаемым сложным эфиром является этилэтанолат. В этом случае водород в группе -COOH заменен этильной группой. Формула этилового спирта: Обратите внимание, что название сложного эфира противоположно тому, как написана формула. Бит «этаноат» происходит от этановой кислоты. Бит «этил» происходит от этильной группы на конце. | |||||||||||||
Примечание: По моему опыту, студенты, начинающие изучать органическую химию, больше путаются при написании названий и формул сложных эфиров, чем почти что-либо еще, особенно когда речь идет о менее часто встречающихся сложных эфирах, таких как те, что будут описаны ниже. | |||||||||||||
Еще несколько сложных эфиров В каждом случае убедитесь, что вы видите, как имена и формулы соотносятся друг с другом. Обратите внимание, что название кислоты определяется путем подсчета общего числа атомов углерода в цепи — , включая атом в группе -COOH . Так, например, CH 3 CH 2 COOH — пропановая кислота, а CH 3 CH 2 COO — пропаноатная группа. | |||||||||||||
Примечание: Дополнительную информацию о присвоении названий кислотам и сложным эфирам можно получить, перейдя по этой ссылке в другую часть этого сайта. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||
Жиры и масла Различия между жирами и маслами Животные и растительные жиры и масла — это просто большие сложные эфиры. Если температура плавления ниже комнатной температуры, это будет жидкость — масло. Если температура плавления выше комнатной температуры, это будет твердое вещество — жир. Причины различий в температурах плавления будут обсуждаться далее на странице в разделе физических свойств. Простое введение в их структуру Жиры и масла в виде больших сложных эфиров Сложные эфиры могут быть получены из карбоновых кислот и спиртов. Это подробно обсуждается на другой странице, но в общих чертах они объединяются вместе, теряя в процессе молекулу воды. Мы начнем с очень простого эфира, такого как этиловый спирт, а не с чего-то сложного, как жир или масло! На диаграмме показано соотношение между этановой кислотой, этанолом и сложным эфиром. Это не полное уравнение. Вода, конечно, тоже производится. | |||||||||||||
Примечание: Цветовая кодировка относится к названию сложного эфира, а не строго к структуре. При получении сложного эфира теряется вода из всей -ОН-группы кислоты и только из одного водорода из спирта. Это означает, что до структура связана с тем, что кислород, присоединенный к этильной группе, на самом деле должен быть окрашен в красный цвет. Не беспокойтесь об этом на этом уровне. | |||||||||||||
Теперь давайте немного усложним спирт, добавив более одной группы -ОН. На приведенной ниже диаграмме показана структура пропан-1,2,3-триола (старое название: глицерин). Так же, как и с этанолом в предыдущем уравнении, я нарисовал это задом наперед, чтобы сделать следующие диаграммы более четкими. Обычно он рисуется с группами -ОН справа. Если вы сделаете из этого сложный эфир с этановой кислотой, вы можете присоединить три этаноатные группы. Теперь удлините кислотные цепочки, и вы, наконец, получите жир. | |||||||||||||
Примечание. Цветовая кодировка по-прежнему используется только для того, чтобы помочь вам увидеть, как создаются формулы. В каждом случае, если вы хотите быть строго точным, конечный кислород в каждой строке должен быть окрашен в красный цвет, потому что он поступает из пропан-1,2,3-триола. Хотя для простоты я показал все цепи в последней структуре одинаковыми, нет причин, по которым три цепи в любой конкретной молекуле жира или масла должны быть одинаковыми. | |||||||||||||
Кислота CH 3 (CH 2 ) 16 COOH называется октадекановой кислотой, но до сих пор широко используется старое название. Это стеариновая кислота. Полное название сложного эфира этого соединения с пропан-1,2,3-триолом – пропан-1,2,3-триилтриоктадеканоат. Насыщенные и ненасыщенные жиры и масла Если жир или масло являются насыщенными , это означает, что кислота, из которой они получены, не имеет двойных углерод-углеродных связей в своей цепи. Стеариновая кислота является насыщенной кислотой, поэтому глицерилтристеарат является насыщенным жиром. Если кислота имеет только одну углерод-углеродную двойную связь где-то в цепи, она называется мононенасыщенной . Если он имеет более одной двойной углерод-углеродной связи, это полиненасыщенные . Те же условия будут применяться к образующимся сложным эфирам. Все они являются насыщенными кислотами и поэтому образуют насыщенные жиры и масла: Олеиновая кислота является типичной мононенасыщенной кислотой: . . . а линолевая и линоленовая кислоты являются типичными полиненасыщенными кислотами. Возможно, вы уже встречали термины «омега-6» и «омега-3» в контексте жиров и масел. Линолевая кислота является омега-6 кислотой. Это просто означает, что первая углерод-углеродная двойная связь начинается с шестого атома углерода от конца CH 3 . Линоленовая кислота является омега-3 кислотой по той же причине. | |||||||||||||
Примечание: Это довольно запутанно, потому что это прямо противоположно тому, как кислоты систематически именуются. «9» или «12» и так далее в систематических именах считаются с другого конца! В карбоновой кислоте углерод в группе -COOH считается углеродом номер 1. | |||||||||||||
Из-за их взаимосвязи с жирами и маслами все вышеуказанные кислоты иногда описываются как жирные кислоты . Физические свойства Простые сложные эфиры Я думаю о таких вещах, как этилэтанолат. Точки кипения Небольшие сложные эфиры имеют точки кипения, подобные температурам кипения альдегидов и кетонов с таким же числом атомов углерода. Подобно альдегидам и кетонам, они представляют собой полярные молекулы и поэтому обладают диполь-дипольными взаимодействиями, а также ван-дер-ваальсовыми дисперсионными силами. Однако они не образуют водородных связей, поэтому их температура кипения не так высока, как у кислоты с таким же числом атомов углерода. Например:
| |||||||||||||
Примечание: Если вас не устраивают межмолекулярные силы (включая водородные связи), то вам действительно следует пройти по этой ссылке, прежде чем продолжить. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||
Растворимость в воде Небольшие сложные эфиры хорошо растворимы в воде, но растворимость падает с длиной цепи. Например:
Причина растворимости заключается в том, что, хотя сложные эфиры не могут водородной связи сами с собой, они могут водородной связи с молекулами воды. Один из слегка положительных атомов водорода в молекуле воды может быть достаточно притянут к одной из неподеленных пар на одном из атомов кислорода в сложном эфире для образования водородной связи. Конечно, между молекулами эфира и воды будут действовать дисперсионные силы и диполь-дипольное притяжение. Формирование этих достопримечательностей высвобождает энергию. Это помогает поставлять энергию, необходимую для отделения молекулы воды от молекулы воды и молекулы сложного эфира от молекулы сложного эфира, прежде чем они смогут смешаться вместе. По мере увеличения длины цепи углеводородные части молекул эфира начинают мешать. Проникая между молекулами воды, они разрывают относительно прочные водородные связи между молекулами воды, не заменяя их чем-либо столь же хорошим. Это делает процесс энергетически менее выгодным, и поэтому растворимость снижается. Физические свойства жиров и масел Растворимость в воде Ни одна из этих молекул не растворяется в воде. Точки плавления Точки плавления определяют, является ли вещество жиром (твердым при комнатной температуре) или маслом (жидким при комнатной температуре). Жиры обычно содержат насыщенные цепи. Это обеспечивает более эффективные дисперсионные силы Ван-дер-Ваальса между молекулами. Это означает, что вам нужно больше энергии, чтобы разделить их, что увеличивает температуру плавления. Чем больше степень ненасыщенности в молекулах, тем ниже температура плавления, потому что дисперсионные силы Ван-дер-Ваальса менее эффективны. Почему это должно быть? Мы говорим о молекулах очень похожих размеров, поэтому потенциал временных диполей должен быть во всех них примерно одинаковым. Однако важно то, насколько близко друг к другу могут подойти молекулы. Дисперсионные силы Ван-дер-Ваальса нуждаются в том, чтобы молекулы могли упаковываться близко друг к другу, чтобы быть действительно эффективными. Вот упрощенная диаграмма насыщенных жиров : Углеводородные цепи, конечно, находятся в постоянном движении в жидкости, но они могут лежать аккуратно, когда вещество затвердевает. Если цепочки в одной молекуле могут лежать аккуратно, значит, и соседние молекулы могут сближаться. Это увеличивает притяжение между одной молекулой и ее соседями и, таким образом, увеличивает температуру плавления. Ненасыщенные жиры и масла имеют по крайней мере одну углерод-углеродную двойную связь по крайней мере в одной цепи. Нет никакого вращения вокруг двойной углерод-углеродной связи, поэтому в цепи образуется постоянный изгиб. Это затрудняет упаковку молекул близко друг к другу. Если они не упаковываются так хорошо, силы Ван-дер-Ваальса не будут работать. Этот эффект намного хуже для молекул, в которых углеводородные цепи на обоих концах двойной связи расположены цис друг к другу, другими словами, обе они находятся на одной стороне двойной связи: Если они находятся на противоположных сторонах двойной связи (форма транс ), эффект не так заметен. Транс-жиры и масла имеют более высокую температуру плавления, чем цис-жиры, потому что упаковка не так сильно влияет на упаковку. Встречающиеся в природе ненасыщенные жиры и масла, как правило, находятся в цис-форме. | |||||||||||||
Примечание: Перейдите по этой ссылке, если вы не уверены в цис- и транс-формах вокруг двойной углерод-углеродной связи. Используйте кнопку НАЗАД в браузере, чтобы вернуться на эту страницу. | |||||||||||||
| |||||||||||||


 Потратьте время и заботьтесь, чтобы убедиться, что вы понимаете!
Потратьте время и заботьтесь, чтобы убедиться, что вы понимаете! Разница между жиром (например, маслом) и маслом (например, подсолнечным маслом) заключается просто в температурах плавления смеси сложных эфиров, которые они содержат.
Разница между жиром (например, маслом) и маслом (например, подсолнечным маслом) заключается просто в температурах плавления смеси сложных эфиров, которые они содержат.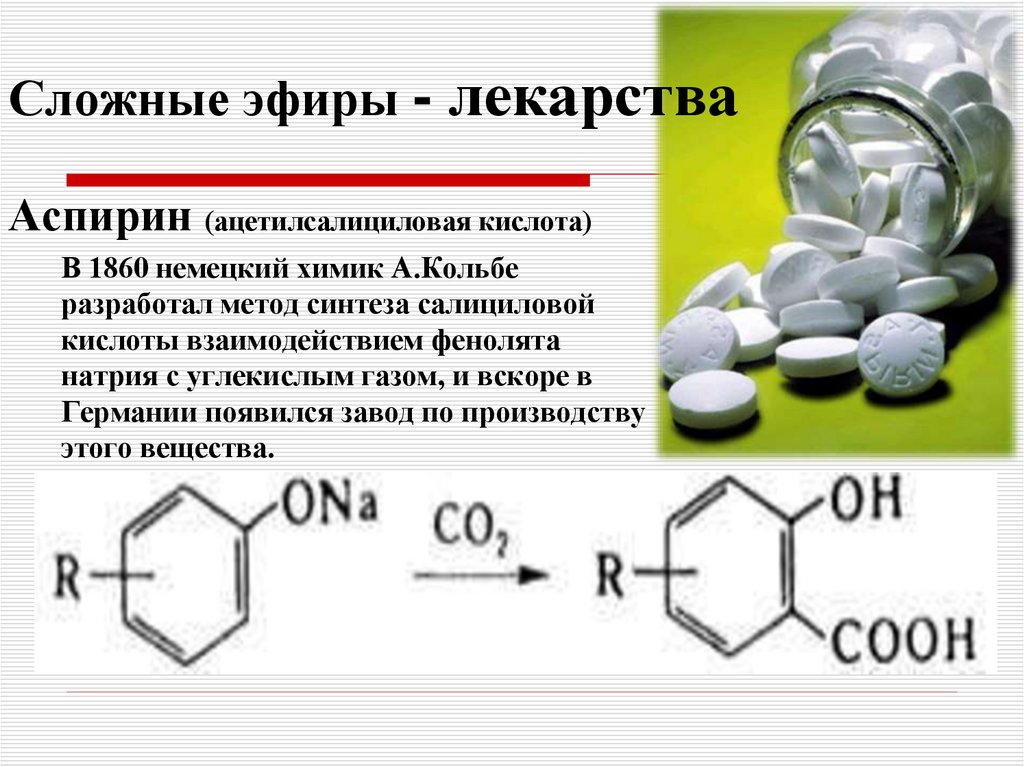
 Но правда в том, что почти все называют его (что неудивительно!) старым названием глицерилтристеарат.
Но правда в том, что почти все называют его (что неудивительно!) старым названием глицерилтристеарат.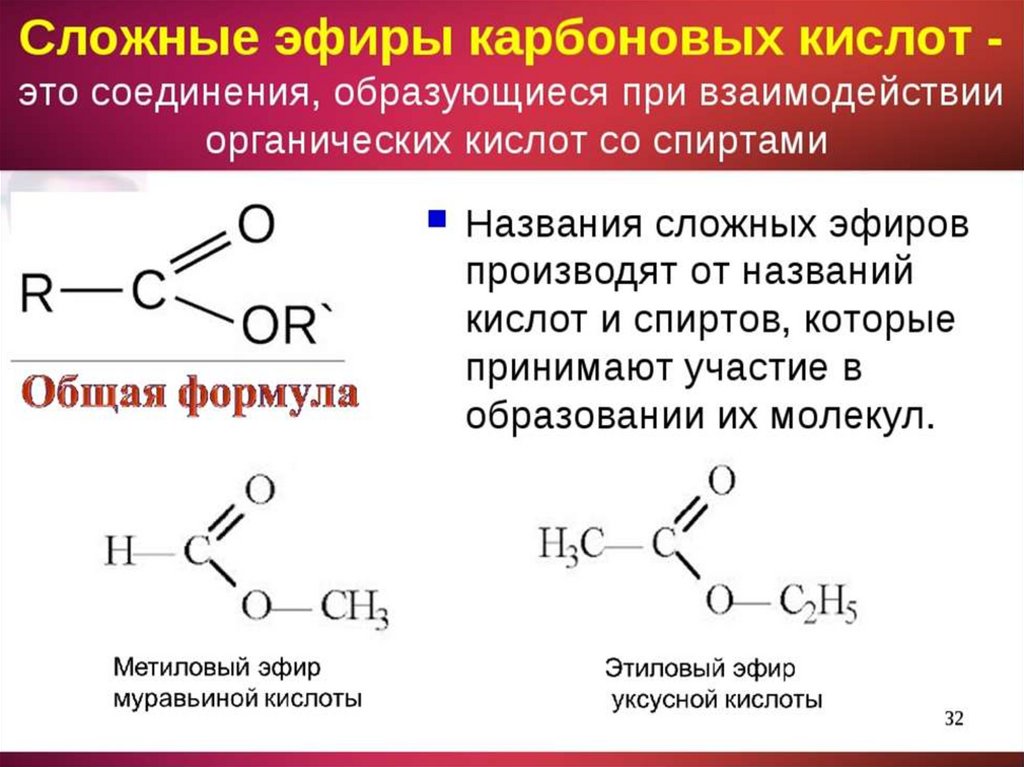

 Длина цепей теперь настолько велика, что пришлось бы разорвать слишком много водородных связей между молекулами воды, поэтому это энергетически невыгодно.
Длина цепей теперь настолько велика, что пришлось бы разорвать слишком много водородных связей между молекулами воды, поэтому это энергетически невыгодно.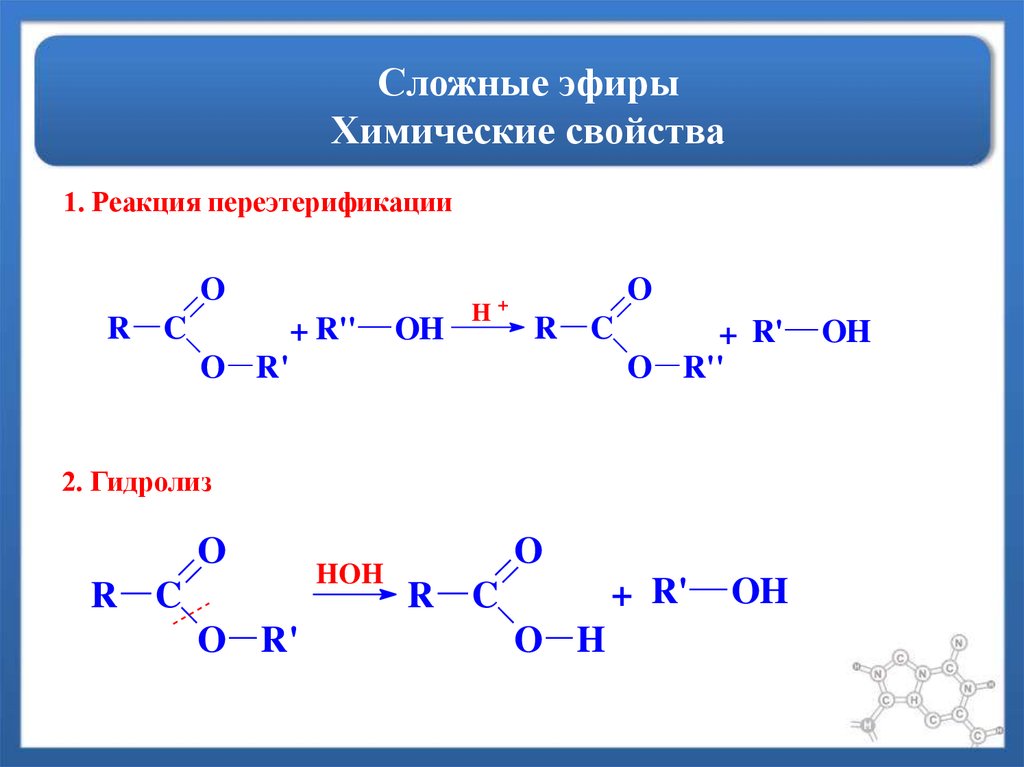 Наличие углерод-углеродных двойных связей в цепях мешает аккуратной упаковке.
Наличие углерод-углеродных двойных связей в цепях мешает аккуратной упаковке. Однако это гораздо больше, чем показано на диаграмме ниже, из-за изменений валентных углов вокруг двойной связи по сравнению с остальной частью цепи.
Однако это гораздо больше, чем показано на диаграмме ниже, из-за изменений валентных углов вокруг двойной связи по сравнению с остальной частью цепи.