Вывод формул органических соединений. Формула метиловый эфир аминоуксусной кислоты
Упражнения и задачи по получению и свойствам азотсодержащих органических веществ с примерами решений. Уроки химии
Сегодня у нас урок химии 95 — Упражнения и задачи по получению и свойствам азотсодержащих органических веществ с примерами решений. Как изучить? Полезные советы и рекомендации — повторите предыдущие уроки химии. В качестве примеров, даны решения к первым пяти заданиям, остальные надо сделать самостоятельно. При обнаружении неточностей, или если появятся неясные моменты, просьба написать в комментариях. Отвечу на все вопросы.
- 16,5г смеси амина и 2-аминокислоты (молярное соотношение 2:1) реагируют с 50г 21,9% раствора соляной кислоты. Определить качественный и количественный состав смеси, если известно, что оба соединения содержат одинаковое число атомов углерода.
Решение
Найдем массу хлороводорода и его количество в молях: m(HCl) = 50⃰ 21,9/100 = 10.95г; n(HCl) = 10.95/36.5 = 0.3 моль, где 36,5 – масса одного моля HCl.
Амин и аминокислота могут иметь формулы: Cnh3n+1Nh3 (первичный амин), Cnh3n+2NH (вторичный амин), CnH 2n-1O2Nh3 (аминокислота).
Амины и аминокислоты могут взаимодействовать с хлороводородной кислотой по реакциям:
Cnh3n+1Nh3 + HCl → Cnh3n+1Nh3∙HCl
Cnh3n+2NH + HCl → Cnh3n+2NH∙HCl
Cnh3n-1O2Nh3 + HCl → Cnh3n-1O2Nh3∙HCl
Раз по условию задачи на каждые 2 моля амина в смеси приходится 1 моль аминокислоты, а сними реагирую 0,3 моля хлороводорода, то очевидно, что 0,2 моля кислоты взаимодействуют с 0,2 молями амина, а 0,1 моль хлороводорода – с 0,1 моль аминокислоты. Масса 0,3-х молей смеси из условия задачи равна 16,5г, масса 3-х молей будет 16,5⃰ 10 = 165.
Оттуда можем составить уравнение:
2(12n + 2n + 1 +16) + 12n + 2n -1 +32 +16 = 165
42n = 84; n = 2.
Ответ: h3NCh3COOH и Ch4Ch3Nh3, (Ch4)2NH.
- Определить молекулярную массу и строение сложного эфира аминокислоты, если он содержит 15,73% азота.
Решение
Учитывая, что атомная азота равна 14, найдем молекулярную массу сложного эфира аминокислоты: 14⃰100/M = 15,73; М = 14⃰100/15,73 = 89. Общая формула сложного эфира аминокислоты — Cnh3n-1O2Nh3. Из этого, можем написать равенство: 12n + 2n -1 + 32 +16 = 89; 14n = 42; n = 3. Это метиловый эфир глицина (аминоуксусной кислоты): h3NCh3COOCh4, молекулярная масса – 89г/моль.
Ответ: метиловый эфир глицина, 89г/моль.
- В смесь аминоуксусной кислоты и безводного этилового спирта пропустили ток сухого хлороводорода, при этом образовалось 1,395г твердого вещества. Какая масса спирта прореагировала?
Напишем схемы возможных реакций:
h3NCh3COOH + HCl → HCl∙h3NCh3COOH
HCl∙ h3NCh3COOH + C2H5OH → HCl∙h3NCh3COOC2H5 + h3O
Образовавшееся твердое вещество – этиловый эфир аминоуксусной кислоты, ее грамм-молекулярная масса равна 139,5г/моль.
По условию задачи образовалось 1,395г осадка, что равно 1,395/139,5 = 0,01 моль. Из стехиометрии реакции этерификации следует, что количества молей сложного эфира и этилового спирта равны друг другу. Тогда n(C2H5OH) = 0,01 моль, его масса равна 46⃰0,01 = 0,46г., где 46 – грамм-молекулярная масса C2H5OHэ
Ответ: 0,46г.
- Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
Н2О KMnO4 Cl2 изб Nh4
С2Н2 → Х1 → СН3СООН → Х2 → Х3 → N2
Hg2+ h3SO4 P
Назвать Х3.
Решение.
Hg2+
С2Н2 + Н2О → СН3СОН
5СН3СОН + 2KMnO4 + 3h3SO4 → 5СН3СООН + 2MnSO4 + К2SO4 +3Н2О
Р
СН3СООН + Cl2 → ClСН2СООН + HCl
ClСН2СООН + Nh4 (изб) → h3NCh3COOH + HCl
4h3NCh3COOH + 9О2 → 10Н2О + 8СО2 + 2N2
Ответ: Х3 – аминоуксусная кислота (h3NCh3COOH).
- Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
h3 Nh4 CO2+h3O t°
СН3СНCl2 → СН3СНО → Х1 → Х2 → Х3 → Х2
кат 300, кат
Назвать Х2.
Решение.
h3O
СН3СНCl2 + 2NaOH → СН3СНО + 2NaCl + h3O
Ni
СН3СНО + h3 → СН3СН2ОH
Al2O3, P
СН3СН2ОH + Nh4 → Ch4Ch3Nh3 +Н2О
Ch4Ch3Nh3 + CO2 + h3O → Ch4Ch3Nh3∙h3CO3
t°
Ch4Ch3Nh3∙h3CO3 → Ch4Ch3Nh3 + CO2 + h3O
Ответ: Х2 – этиламин, Ch4Ch3Nh3.
- При сжигании органического вещества массой 1,78г в избытке кислорода получили 0,28г азота, 1,344л углекислого газа и 1,26г воды. Определить молекулярную формулу вещества, зная, что в навеске массой 1,78г содержится 1,204·1022молекул.
- Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
Br2 Nh4 HNO2 CuO KMnO4
Х1 → Сh4Br → Х2 → Х3 → h3CO → Х4
свет t h3SO4
Назвать Х3.
- Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
h3O KMnO4 h3SO4(k) t°,P h4PO4(k)
CaC2 → X1 → K2C2O4 → Х2 → HCOOH → Х3
t°
Назвать Х3.
- Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
Hg2+, H+ +Ag2O +Cl2 +2Nh4
CaO → X → C2h3 → Х1 → X2 → Х3 → Х4
h3O аммиак
Назвать Х4.
- Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
Сакт HNO3 h3 HCl NaOH
СН ≡ СН → X1 → Х2 → Х3 → X4 → Х5
h3SO4 кат
Назвать Х5.
- Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
h3O Сакт HNO3 Fe Br2(изб)
CaC2 → X1 → Х2 → Х3 → Х4 → Х5
h3SO4 HCl
Назвать Х5.
- Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
h3O Сакт +Сl2 2Nh4 Br2
CaC2 → X1 → Х2 → Х3 → Х4 → Х5
t° FeCl3 t, P
Назвать Х5.
- Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
NaOH (тв) HNO3 h3 HCl NaOH
Ch4COONa → X1 → Х2 → Х3 → Х4 → Х5
t° кат
Назвать Х5.
- Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
NaOH CuO +Ag2O +Cl2 +2Nh4
Сh4Ch3-Ch3Cl → X1 → X2 → Х3 → X4 → Х5
водн t° аммиак hn
Назвать Х5.
- Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
+Cl2 NaOH Nh4 h3SO4 NaOH
С2Н6 → X1 →X2 →Х3 → X4 → Х5
hn водн кат
Назвать Х5.
- Растворы глицерина, белка и глюкозы можно распознать
а) азотной кислотой; в) раствором лакмуса;
б) известковой водой; г) гидроксидом меди(II).
- При действии концентрированной азотной кислоты на белки появляется … окрашивание
а) фиолетовое в) зеленое
б) желтое г) синее
- Растворы уксусной кислоты, глюкозы и этиламина можно распознать:
а) хлороводородом в) раствором щелочи
б) этанолом г) раствором лакмуса
- Для всех белков характерны свойства:
а) растворимость и свертывание в) гидролиз и растворимость в солях
б) амфотерность и денатурация г) летучесть и горение
- Аминоуксусная кислота в отличии от уксусной реагирует с
а) этанолом в) щелочью
б) соляной кислотой г) карбонатом натрия
- Нейтральную реакцию на индикатор окажут вещества:
а) Ch4COONa и C6H5Nh3 в) C6H5OH и Nh3Ch3COOH
б) Ch4Nh3 и C2H5OH г) C6H5Nh3 и Nh3Ch3COOH.
- Число дипептидов, которые можно получить из двух различных аминокислот равно:
а) 4 б) 3 в) 6 г) 2
- Основные свойства веществ увеличиваются в ряду
а) C6H5Nh3 Nh4 C2H5Nh3
б) Nh4 Nh3 – Ch3COOH C2H5OH
в) Ch4Nh3 Ch4 – NH – Ch4 Nh3 – Ch3COOH
г) Nh4 C2H5Nh3 C6H5Nh3
- Написать уравнения реакций, с помощью которых можно осуществить следующие превращения. Указать Х.
NaOH
C2H5COONa → C2H6 → C2H5NO2 → C2H5Nh3 → [C2H5Nh4]Cl → X
- Написать уравнения реакций, с помощью которых можно осуществить следующие превращения. Указать Х.
Ch4OH
C2h3 → Ch4 – CHO → Ch4COOH → Ch3ClCOOH → Nh3Ch3COOH → X
Ответы
1- h3NCh3COOH и Ch4Ch3Nh3, (Ch4)2NH. 2- метиловый эфир глицина, 89г/моль. 3- 0,46г. 4- аминоуксусная кислота. 5- этиламин. 6- C3H7NO2. 7- Ch4OH. 8- HCOOH. 9- глицин. 10- бензоат натрия. 11- 2,4,6 – триброманилин. 12- 2,4,6 – триброманилин. 13- изопропиламин. 14- аминоуксусная кислота. 15- этиламин. 16- г). 17- б). 18- г). 19- б). 20- б). 21- г). 22- а) 23- а). 24- этиламин. 25- сложный эфир аминоуксусной кислоты.
Это был у нас урок химии 95 — Упражнения и задачи по получению и свойствам азотсодержащих органических веществ с примерами решений.
sovety-tut.ru
Аминокислоты пептиды задача 1 стр. 22
Аминокислоты. Пептиды.
Задача 1.
С 14,8 г смеси первичного амина и аминокислоты прореагировало 0,2 моль хлороводорода. Количество амина в смеси равно количеству кислоты. Кислота и амин содержат одинаковое число атомов углерода. Определить формулы амина и аминокислоты.
Решение.
Составляем уравнение реакции взаимодействия амина и аминокислоты с хлороводородом:
Сnh3n+3N + НCl→ Сnh3n+3N×НCl (1)
Сnh3n+1О2N + НCl→ Сnh3n+1О2N×НCl (2)
Пусть в первую реакцию вступает (х) моль НСl. Тогда во вторую реакцию вступит (0,2-х) моль НСl.
Составляем количественные соотношения между хлороводородом и амином и хлороводородом и аминокислотой по уравнениям (1),(2), находими количества и массы амина и кислоты:
ν(Сnh3n+3N): ν(НCl)=1:1 ( по уравнению (1))
ν(Сnh3n+3N)=х моль,
ν(Сnh3n+1О2N): ν(НCl)=1:1 ( по уравнению (2))
ν(Сnh3n+1О2N)=(0,2-х)моль.
Согласно условию задачи количество амина равно количеству аминокислоты:
ν(Сnh3n+3N)= ν(Сnh3n+1О2N)
х=0,2-х, 2х=0,2, х=0,1
ν(Сnh3n+3N)=0,1 моль, ν(Сnh3n+1О2N)=0,1 моль.
Выражаем массы амина и аминокислоты:
m(Сnh3n+3N)=ν×М=(12n+2n+17)×0,1=(14n+17) ×0,1 (г)
m(Сnh3n+1О2N)=ν×М=(12n+2n+47)×0,1=(14n+47)×0,1(г)
Составляем уравнение:
(14n+17) ×0,1 +(14n+47)×0,1 =14,8
1,4n+1,7 +1,4n+ 4,7=14,8
2,8n=14,8-4,7-1,7, 2,8n=8,4, n=3.
Формула амина-С3Н7NН2, аминокислоты-СН3-СН(NН2)-СООН.
Ответ: С3Н7NН2, СН3-СН(NН2)-СООН.
Задачи для самостоятельного решения.
1. При действии азотистой кислоты на моноаминокарбоновую кислоту массой 1,17 г получено 224 мл (н.у.) газа. Какая это природная кислота?
2.С 25,2 г смеси предельной одноосновной карбоновой кислоты и α-аминокислоты прореагировало 0,3 моль едкого натра. Количество аминокислоты в смеси в 2 раза больше количества кислоты. Кислота и аминокислота содержат одинаковое число атомов углерода. Определить молекулярную формулу и массу кислоты в смеси.
3.Со смесью первичного амина и α-аминокислоты массой 18,1 г прореагировало 0,3 моль хлороводорода. Количество амина в смеси в 2 раза меньше количества аминокислоты. В составе аминокислоты содержится атомов углерода в 2 раза больше, чем в составе амина. Определить формулу аминокислоты. Найти ее массу.
4.Со смесью предельной одноосновной карбоновой кислоты и α-аминокислоты массой 19,6 г прореагировало 0,3 моль NаОН. Количество кислоты в смеси в 2 раза меньше количества аминокислоты. В составе аминокислоты содержится атомов углерода в 2 раза больше, чем в составе кислоты. Определить формулу аминокислоты. Найти ее массу.
5. 38,2 г смеси аминокислоты и первичного амина (молярное соотношение 3:1) могут прореагировать с 40 г 36,5%-ной соляной кислоты. Определите качественный и количественный состав исходной смеси, если известно, что оба вещества содержат одинаковое количество атомов углерода.
6.6 г смеси аминокислоты и первичного амина (молярное соотношение 1:1) могут прореагировать с 20 г 40,5%-ной бромоводородной кислоты. Определите качественный и количественный состав исходной смеси, если известно, что оба вещества содержат одинаковое количество атомов углерода.
7.31,5 г смеси α-аминокислоты и вторичного амина (молярное соотношение 2:3) могут прореагировать с 100 г 18,25-процентной соляной кислоты. Определите качественный и количественный (в%) состав исходной смеси, если известно, что оба вещества содержат одинаковое число атомов углерода.
8.16,3 г смеси α-аминокислоты и первичного амина (молярное соотношение 3:1) могут прореагировать с 20 г 36,5-процентной соляной кислоты. Определите качественный и количественный (в%) состав исходной смеси, если известно, что оба вещества содержат одинаковое число атомов углерода.
9.3,3 г смеси предельного алифатического амина и предельной одноосновной аминокислоты с одинаковым числом атомов углерода (соотношение аминокислоты и амина по молям 1:2) обработали избытком водного раствора гидрокарбоната калия, при этом выделилось 448 мл газа (н.у.). Определите строение исходных веществ и состав смеси в %.
10.При нагревании предельной α-аминокислоты массой 1,78 г выделился углекислый газ объемом 0,448 л (н.у.). Какая кислота была взята для реакции?
11.В ходе реакции этерификации предельной аминокислоты массой 15 г образовался ее этиловый эфир массой 12,36 г. Практический выход эфира составил 60% от теоретически возможного. Какая аминокислота соответствует условию задачи?
12. При сгорании природной аминокарбоновой кислоты (с одной аминогруппой в молекуле) получена смесь азота и углекислого газа объемом 0,56 л (н.у.) и плотностью по водороду 20,4. При растворении образца аминокислоты той же массы в избытке водного раствора гидрокарбоната натрия выделился газ объемом 224 мл. Определить массу (мг) взятой аминокислоты и ее молекулярную формулу.
13.Неизвестная моноаминокарбоновая кислота полностью прореагировала с гидроксидом натрия (150 мл 0,1М раствора), при этом получено 1,665 г соли. Найти молекулярную формулу кислоты и вычислить ее массу.
14. При обработке неизвестной моноаминокарбоновой кислоты 300 мл 0,1М хлороводородной кислоты получено 3,765 г соли. Установить формулу аминокислоты и найти ее массу.
15.После щелочного гидролиза метилового эфира природной моноаминокарбоновой кислоты получено 200 г раствора, в котором массовые доли спирта и натриевой соли аминокислоты равны соответственно 3,2% и 11,1%. Выведите формулу исходного эфира.
16.Сжиганием 5,34 г природной одноосновной аминокарбоновой кислоты получено 3,78 г воды и 5,376 л (н.у.) газовой смеси, объем которой после пропускания через раствор избытка КОН стал равным 1,344 л (н.у.) и содержащим 0,03 моль азота. Выведите молекулярную формулу этой кислоты.
17.При щелочном гидролизе сложного эфира массой 81,2 г образуется соль А и спирт. При дегидратации спирта получается 17,92 л (н.у.) этилена. Для получения из соли А соли природной
α-аминокислоты требуется 43,8 г хлороводорода. Установить строение сложного эфира.
18.Для этерификации смеси двух природных аминокислот с равными мольными долями компонентов было израсходовано 0,96 г метанола, а при полном сгорании такого же образца исходной смеси аминокислот была получена газовая смесь с относительной плотностью по воздуху, равной 1,425, объем которой составил 2,016 л (н.у.). Определите строение аминокислот.
19.Смесь двух изомерных моноаминосоединений, принадлежащих к разным классам органических соединений, может прореагировать с 6,72 л хлороводорода. При обработке такого же количества исходной смеси избытком водного раствора гидрокарбоната калия выделяется 2,24 л углекислого газа и образуется 12,7 г калиевой соли. Определите строение исходных соединений и массу исходной смеси.
20. При полном сгорании 22,5 г неизвестной аминокарбоновой кислоты в кислороде собрано 13,5 мл воды, 13,44 л (н.у.) углекислого газа и 3,36 л (н.у.) азота. Выведите формулу этой кислоты.
21. Действием 200 мл 0,36%-ной хлороводородной кислоты (пл.1,044 г/мл) на неизвестную аминокарбоновую кислоту образовалось 2,51 г соли. О какой аминокислоте идет речь? Найти ее массу.
22. Неизвестная аминокарбоновая кислота добавлена к 100 мл 0,4%-го раствора едкого натра. Получено 1,11 г соли. О какой аминокислоте идет речь? Определите затраченную массу кислоты.
23.В реакции между метанолом (взят в избытке) и неизвестной аминокарбоновой кислотой образовалось 5,34 г органического продукта с массовой долей азота 15,73%. Найти молекулярную формулу аминокислоты.
24.Провзаимодействовали 22,25 г неизвестной аминокарбоновой кислоты и 11,5 г этанола. Какой продукт получился в результате реакции? Какова его масса?
25. При действии на раствор 9,63 г неизвестной моноаминокарбоновой кислоты избытком азотистой кислоты было получено 2,01 л азота при 748 мм рт. ст. и 200С. Определите молекулярную формулу этого соединения. Может ли эта кислота быть одной из природных аминокислот? Если да, то какая это кислота? В состав молекулы этой кислоты не входит бензольное кольцо.
26.Природный дипептид массой 3,96 г полностью прореагировал с 21,9 г 10%-й хлороводородной кислоты и образовал соль одной аминокарбоновой кислоты. Выведите формулу исходного дипептида.
27. При действии избытком соляной кислоты на 5,84 г природного дипептида, содержащего остатки глицина и другой аминокарбоновой кислоты, получено 4,46 г хлорида глициния. Выведите молекулярную формулу этого дипептида. Сколько изомеров может существовать с такой молекулярной формулой.
Ответы.
1.Валин 2.17,8 г 3.СН2NН2-СООН, 15г 4.15г
5.7,3 г аминобутана; 30,9 г 2-аминобутановой кислоты
6.2,25 г этиламина; 3,75 г аминоуксусной кислоты
7.28,57% диметиламина; 71,43% глицина
8.13,55г α–аминопропионовой килоты, 2,95г пропиламина
9.Этиламин 54,5%; аминоуксусная кислота 45,5%
10.α–аминопропионовая кислота 11.Глицин
12.750 мг NН2СН2СООН 13.1,335г NН2СН(СН3)СООН
14.2,67г NН2СН(СН3)СООН 15.NН2СН(СН3)СООСН3 (метиловый эфир аланина) 16.NН2СН(СН3)СООСН3 17.Диэтиловый эфир глутаминовой кислоты 18.Аланин и глицин
19.Аланин, метиловый эфир аланина, 26,7 г 20.Аминоуксусная кислота 21.1,78 г NН2СН(СН3)СООН 22.0,89 г NН2СН(СН3)СООН 23.Аминоуксусная кислота 24.29,25 г NН2СН(СН3)СООС2Н525.Валин 26.Глицилглицин 27. Гли-ала или ала-гли.
Азотсодержащие гетероциклические соединения.
Задача 1.
При сжигании в кислороде порции азотсодержащего гетероциклического соединения (без заместителей в кольце) образовалось 0,75 моль углекислого газа, 0, 375 моль воды и 0,075 моль азота. Выведите формулу исходного соединения.
Решение.
Запишем уравнение реакции горения азотсодержащего гетероциклического соединения в общем виде:
СхНyNz+(х+0,25y)О2→хСО2+0,5yН2О +0,5zN2
Вычислим количества веществ атомов, входящих в состав искомого соединения:
ν(СО2)= 0,75 моль; ν(С)=0,75 моль;
ν(Н2О)=0,375 моль; ν(Н)=0,75 моль;
ν(N2)=0,075 моль; ν(N)=0,15 моль;
х:y:z= ν(C): ν(Н): ν(N)=0,75:0,75:0,15
Находим среди этих цифр самое маленькое и все делим на него, получая: х:y:z=5:5:1
С5Н5N.
Ответ: С5Н5N- пиридин.
Задача 2.
Смесь двухизомеров, один из которых представляет собой гомолог анилина, а другой- гомолог пиридина, содержит 13,1% азота по массе. Некоторое количество этой смеси может прореагировать с 0,95 л хлороводорода (объем измерен при 16,50С и нормальном давлении) или с 320 г 4%-ной бромной воды. Установите возможные структурные формулы компонентов смеси и рассчитайте их массовые доли.
Решение.
Общая формула изомеров СnН2n-5N.
Так как вещества- изомеры, массовая доля азота в смеси не зависит от содержания веществ, следовательно через формулу массовой доли можно найти (n):
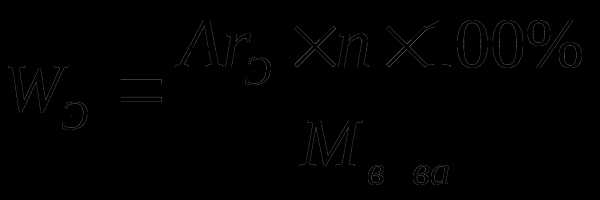
0,131=14/(14n+9), n=7.
Вещества в смеси- один из метиланилинов С6Н4(СН3)NН2 и гомолог пиридина: один из диметилпиридинов или этилпиридинов.
С хлороводородом реагируют оба вещества по уравнению:
СnН2n-5N + НCl→ СnН2n-5N×НCl
Приведем объем НСl к нормальным условиям, учитывая, что Т=(273 +16,5)К=289,5 К
По «объединенному газовому закону»
V0=Р×V×Т0/Р0×Т
V0(НCl)=(101,3×0,95×273)/(101,3×289,5)=0,896 л
Находим количество вещества хлороводорода, составляем соотношение со смесью изомеров, находим общее количество смеси изомеров:
ν(НСl)=V/Vm=0,896 л/22,4 л/моль=0,04 моль;
ν(Сnh3n-5N): ν(НCl)=1:1 ( по уравнению)
ν(Сnh3n-5N)=0,04 моль,
С бромной водой реагирует только метиланилин, причем в зависимости от положения метильного радикала, молярное отношение реагентов может быть либо 1:2, либо 1:3.
Находим массу брома и его количество:
m(Вr2)=m(р-ра)×w/100%=320×4/100=12,8 г
ν(Вr2)=m/M=12,8 г/160 г/моль=0,08 моль
Если метильный радикал находится в орто или пара- положении, то метиланилин реагирует с бромом в соотношении 1:2, тогда
ν(С6Н4(СН3)NН2)=0,08/2=0,04 моль, что невозможно, т.к.0,04 моль- это общее количество метиланилина и гомолога пиридина.
Следовательно, гомолог анилина- 3- метиланилин, который реагирует с бромом в соотношении 1:3;
ν (С6Н4(СН3)NН2)=0,08/3=0,027 моль, тогда ν(гомолога пиридина) равно 0,04-0,027=0,013 моль. Массовые доли изомерных веществ в смеси равны мольным долям :
w(С6Н4(СН3)NН2)=0,027/0,04=0,675 или 67,5%
w(гомолога пиридина)=0,013/0,04=0,325 или 32,5%.
Ответ: w(С6Н4(СН3)NН2)=67,5%;w(гомолога пиридина)= 32,5%.
Задачи для самостоятельного решения.
1.После приведения к нормальным условиям масса газовой смеси, полученной при сгорании в кислороде 1,675 г азотсодержащего гетероциклического соединения, составила 4,75 г с плотностью 1,8849 г/л (без учета избытка окислителя). Выведите формулу этого соединения.
2. Продукты полного сгорания азотсодержащего гетероциклического соединения (в том числе и водяной пар) пропустили через избыток известковой воды. Масса выпавшего осадка составила 7,5 г, масса раствора уменьшилась на 3,525 г, объем непоглощенного газа оказался равным 168 мл (н.у.). О каком соединении идет речь?
3.Газовую смесь, полученную при сгорании 0,168 г ароматического азотсодержащего гетероцикла привели к н.у. Объем полученной газовой смеси составил 268,8 мл, а относительная плотность газовой смеси по метану равна 2,684. Определите возможное строение исходного гетероцикла.
4.Продукты полного сгорания 0,072 моль незамещенного азотсодержащего гетероцикла были пропущены без предварительного охлаждения через 150 г 25%-ного раствора КОН.
Масса полученного раствора составила 165,26 г, концентрация карбоната калия в этом растворе 24,05%. Объем непоглотившегося газа равен 1,61 л (н.у.). Определите состав и предложите строение исходного гетероцикла.
5. При сжигании в кислороде порции азотсодержащего гетероциклического соединения (без заместителей в кольце) образовалось 280 мл углекислого газа, 140 мл паров воды и 70 мл азота (объемы измерялись при одинаковых условиях). Выведите формулу исходного соединения.
6.При сжигании в кислороде порции азотсодержащего гетероциклического соединения (без заместителей в кольце) образовалось 240 мл углекислого газа, 150 мл паров воды и 30 мл азота (объемы измерялись при одинаковых условиях). Выведите формулу исходного соединения.
7.При сжигании в кислороде порции азотсодержащего гетероциклического соединения (без заместителей в кольце) образовалось 1,2 л углекислого газа, 0,8 л паров воды и 0,4 л азота (объемы измерялись при одинаковых условиях). Выведите формулу исходного соединения.
8.При сжигании в кислороде порции азотсодержащего гетероциклического соединения, имеющего один углеводородный радикал в кольце образовалось 0,18 моль углекислого газа, 0, 105 моль воды и 0,015 моль азота. Выведите формулу исходного соединения.
9.Смесь двухизомеров, один из которых представляет собой гомолог анилина, а другой- гомолог пиридина, содержит 78,5% углерода по массе. Некоторое количество этой смеси может прореагировать с 1,21 л бромоводорода (объем измерен при 220С и нормальном давлении) или с 400 г 4%-ной бромной воды. Установите возможные структурные формулы компонентов смеси и рассчитайте их массовые доли.
10. Смесь двухизомеров, один из которых представляет собой гомолог анилина, а другой- гомолог пиридина, содержит 11,6% азота по массе. Некоторое количество этой смеси может прореагировать с 0,73 л хлороводорода (объем измерен при 240С и нормальном давлении) или с 240 г 4%-ной бромной воды. Установить возможные структурные формулы компонентов смеси и рассчитайте их массовые доли.
11.Смесь двухизомеров, один из которых представляет собой гомолог анилина, а другой- гомолог пиридина, содержит 9,09% водорода по массе. Некоторое количество этой смеси может прореагировать с 1,45 л бромоводорода (объем измерен при 220С и нормальном давлении) или с 600 г 4%-ной бромной воды. Установить возможные структурные формулы компонентов смеси и рассчитайте их массовые доли.
Ответы.
1.С4Н5N-пиррол 2.С5Н5N –пиридин 3.С7Н7N–винилпиридин 4.С4Н4N2, пиримидин 5.С4Н4N2, пиримидин 6. С4Н5N-пиррол 7.Имидазол 8.Метилпиридин 9.66,7% 3-метиланилина; 33,3% диметилпиридин или этилпиридин 10.66,7% 3,5-диметиланилина или 3-этиланилина; 33,3% гомолога пиридина с тремя атомами углерода в боковых цепях 11.83% 3,5-диметиланилина или 3-этиланилина; 17% гомолога пиридина с тремя атомами углерода в боковых цепях.
uchebana5.ru
получение и применение :: SYL.ru
Аминоуксусная кислота (или глицин) имеет значение для нормальной жизнедеятельности организма человека. Именно поэтому важно рассмотреть подробнее основные физические и химические свойства данного органического вещества, обратить внимание на его использование.

Способы получения
Сначала остановимся на основных способах получения глицина. Аминоуксусная кислота может быть получена двухстадийным синтезом.
На первом этапе осуществляется взаимодействие хлоруксусной кислоты с хлором. В качестве основного условия успешного протекания данного химического процесса является использование катализатора.
На второй стадии происходит реакция между полученной хлоруксусной кислотой и аммиаком, конечным продуктом будет 2-аминоуксусная кислота.

Биологическое значение глицина
Данное вещество есть в составе многих биологически активных веществ и белковых молекул. Аминоуксусная кислота является исходным сырьем для синтеза пуриновых оснований и порфиринов.
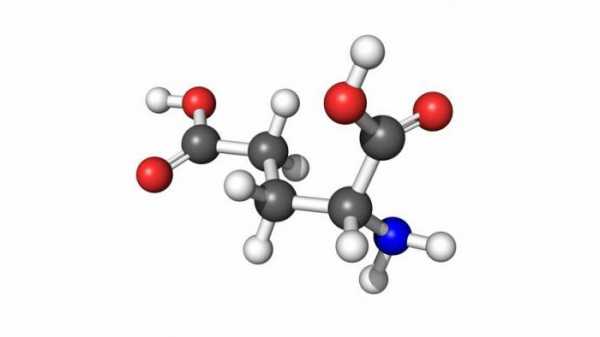
Что такое аминоуксусная кислота? Формула вещества: Nh3 —Ch3 —COOH, что свидетельствует о наличии амфотерных свойств.
Во многих участках спинного и головного мозга есть рецепторы к глицину. По мере связывания с рецепторами, аминоуксусная кислота оказывает «тормозящий» эффект на нейроны. Данное вещество уменьшает процесс выделения импульсов нейронами, которые являются «возбудителями» таких соединений, как глютаминовая кислота.
Кроме того, глицин связывается с индивидуальными системами рецепторов, которые стимулируют передачу сигнала от аспартата и нейротрансмиттеров глутамата.
В спинном мозге аминоуксусная кислота вызывает торможение нейронов, поэтому применяется в неврологии для снижения повышенного тонуса мышц.
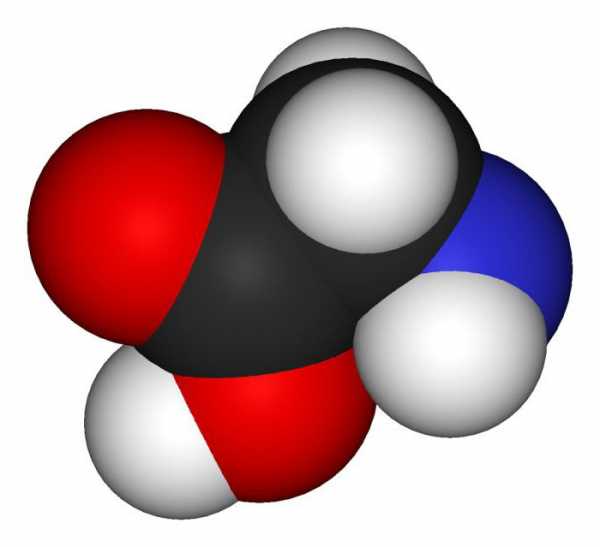
Химические свойства
Аминоуксусная кислота реагирует с кислотами, проявляя свои слабые основные свойства. Данная реакция возможна благодаря наличию неспаренной пары электронов на азоте в аминогруппе. Реакция имеет донорно-акцепторный механизм, связана с образованием солей.
Кроме того, аминоуксусная кислота легко вступает во взаимодействие со спиртами (этерификацию), образуя при этом сложный эфир. Проводят ее с применением в качестве катализатора концентрированной серной кислоты.
Использование в медицине
Фармакологический препарат аминоуксусной кислоты оказывает успокаивающее (седативное) действие на пациента. Глицин признан мягким транквилизатором, слабым антидепрессантом, позволяющим снижать чувство страха, тревоги, психоэмоционального напряжения.
Глицин включен в перечень веществ, позитивно воздействующих на снижение алкогольного отравления. В качестве вспомогательного препарата данное вещество является ноотропным компонентом, способствует улучшению памяти, ассоциативным процессам.
Глицин стимулирует обменные процессы, активизирует и нормализует процессы защитного торможения, происходящие в центральной нервной системе. При его употреблении повышается умственная работоспособность, снижается психоэмоциональное напряжение.
Благодаря антитоксичному действию, препарат справляется со следующими задачами:
- снижает агрессивность, психоэмоциональное напряжение, конфликтность, повышает социальную адаптацию;
- улучшает настроение;
- облегчает засыпание и нормализует сон;
- повышает умственную работоспособность;
- уменьшает вегетососудистые расстройства;
- понижает токсическое воздействие алкоголя, а также лекарственных препаратов, негативно действующих на центральную нервную систему;
- уменьшает общемозговые расстройства при черепно-мозговой травме, ишемическом инсульте.
Глицин достаточно быстро попадает во многие биологические жидкости и ткани организма, включая и головной мозг. Данная аминокислота метаболизируется до углекислого газа и воды, она не накапливается в тканях.
Анализируемая аминокислота признана регулятором обменных процессов. При систематическом употреблении данного вещества наблюдается адреноблокирующее действие. Часто препарат назначают детям и подросткам с повышенной активностью, выражающейся в отклонениях от нормального поведения.
Использование в промышленности
Глицин в пищевой промышленности представлен в виде добавки Е 640. Он применяется в качестве модификатора аромата и вкуса.
www.syl.ru
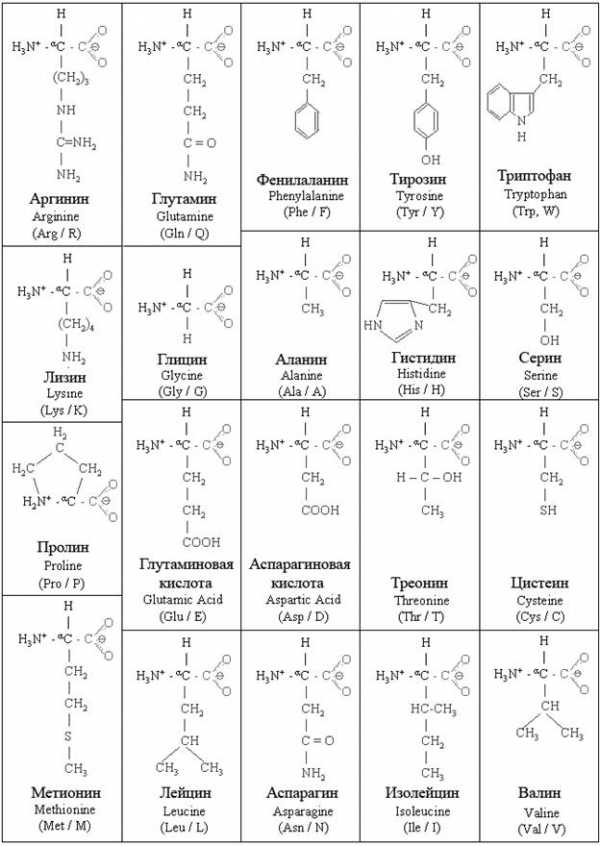
Формулы аминокислот в химии
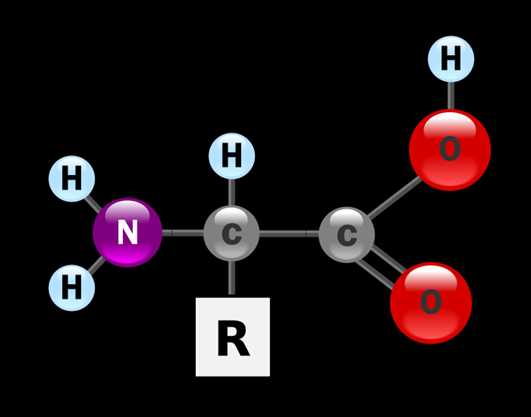
Аминокислоты можно рассматривать как производные карбоновых кислот, в которых один или несколько атомов водорода замещены на аминогруппы.
Различают -аминокислоты, в молекулах которых аминогруппа и карбоксильная группа связаны с одним атомом углерода, и -,-, -аминокислоты, функциональные группы которых разделены нескольким атомам углерода.
Структурные формулы аминокислот
Общая структурная формула -аминокислот:
Все аминокислоты являются амфотерными соединениями, кислотные свойства обусловлены карбоксильной группой –COOH, а основные – аминогруппой – Nh3. Благодаря этому водные растворы аминокислот обладают свойствами буферных растворов, т.е. находятся в состоянии внутренних солей:
Такая форма молекулы аминокислоты называется цвиттер-ионом. В этой форме молекула обладает значительным дипольным моментом при суммарном нулевом заряде. Кристаллы большинства аминокислот построены именно из таких молекул.
Изоэлектрическая точка аминокислоты – значение pH, при котором максимум молекул обладает нулевым зарядом. При таком значении pH аминокислота наименее подвижна в электрическом поле. Это свойство можно использовать для разделения аминокислот, белков и пептидов методом электрофореза.
Группы аминокислот
В зависимости от кислотно-основных свойств, обусловленных строением радикала, аминокислоты делятся на четыре группы:
- Неполярные или гидрофобные (аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофан).
- Полярные незаряженные (заряды компенсируются) при pH=7 (серин, треонин, цистеин, аспарагин, глутамин, тирозин).
- Полярные и заряженные отрицательно при pH=7 (аспарагиновая кислота, глутаминовая кислота)
- Полярные заряженные положительно при pH=7 (лизин, аргинин, гистидин)
Важнейшим свойством аминокислот является их способность к реакциям поликонденсации с образованием пептидов:
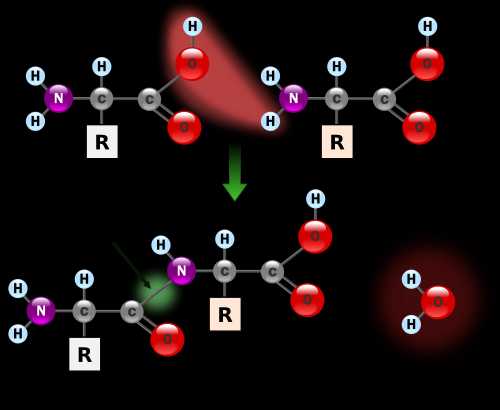
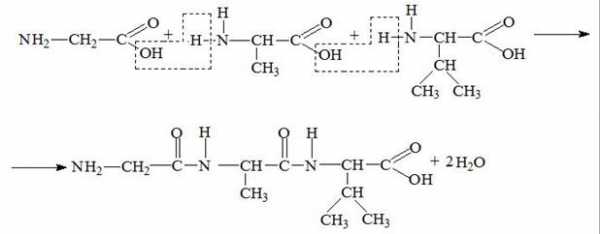
Пример образования трипептида (глицил – аланил – валин):
Формулы 20 аминокислот
В живых организмах при синтезе белков (полипептидов) в большинстве случаев используется 20 стандартных (протеиногенных) аминокислот:
Примеры решения задач
ru.solverbook.com
Аминоуксусная кислота взаимодействует с – nh3ch3cooh название вещества
скачатьЗадания В 8 (2012г)
Ответом является последовательность трех цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания.
- Аминоуксусная кислота реагирует с
- Fe(OH)2 3) Ch4OH 5) SiO2
- Cu 4) HI 6) S Ответ ___________.
- Глицин вступает в реакцию этерификации с
- Пропанолом-1 3) уксусной кислотой 5) этиловым спиртом
- Пропанолом-2 4) оксидом магния 6) металлическим кальцием. Ответ________
- Аминопропионовая кислота не реагирует с
- Zn(OH)2 3) C2H5OH 5) SiO2
- Hg 4) HClO4 6) C2H6 Ответ__________
- Аминобутановая кислота реагирует с
- Mg(OH)2 3) C3H7OH 5) SiO2
- Cu 4) HBrO4 6) C3H8 Ответ __________
- 3-хлор-2-аминопропановая кислота реагирует с
- Nh4 3) HBrO4 5) Si
- Hg 4) C2H5OH 6) C5h22 Ответ __________
- Верны следующие утверждения о белках:
- Белки гидролизуются до аминов
- В макромолекулах белка присутствуют амидные связи
- При гидролизе белков образуются аминокислоты
- В макромолекулах белков существуют водородные связи
- Белки дают с азотной кислотой черное окрашивание
- Основная функция белков в организме-энергетическая. Ответ __________
- При гидролизе белков могут образоваться вещества:
- С2Н5ОН 3) Nh3Ch3COOH 5) Ch3(OH)CH(Nh3)COOH
- СН3СООН 4) Ch4CH(Nh3)COOH 6) Nh3 – Nh3 Ответ _________
- Как аминоуксусная кислота, так и уксусная кислота
- Реагируют с кислотами 4) обладают резким запахом
- Реагируют с аммиаком 5) реагируют со спиртами
- Являются жидкими при обычных условиях 6) образуют соли с оксидами металлов
Ответ___________
- Щелочную среду имеют водные растворы
- С2Н5ОН 3) Nh3Ch3COOH 5) Nh3Ch4
- С2Н4(ОН)2 4) Nh3Nh3 6) Ch4NHCh4 Ответ __________
- При гидролизе белков могут образоваться:
- Полипептиды 3) этанол 5) этиленгликоль
- Глицерин 4) глицин 6) аминокислоты Ответ __________
- Для метиламина характерны
- Взаимодействие с соляной кислотой
- Изомеризация
- Изменение окраски фенолфталеина в водном растворе
- Резкий неприятный запах
- sp2 – гибридное состояние атома углерода
- более слабые основные свойства, чем у анилина. Ответ __________
- Метилэтиламин участвует в реакциях
- Горения на воздухе 4) окисления оксидом меди (II)
- Нейтрализации серной кислотой 5) взаимодействия с водным раствором щелочи
- Восстановления водородом 6) взаимодействия с бромметаном.
Ответ___________
- Этиламин участвует в реакциях
- Изменения окраски лакмуса в синий цвет в вводом растворе
- Окисления аммиачным раствором оксида серебра
- Замещения с бромной водой 5) поликонденсации
- Горения на воздухе 6) с соляной кислотой Ответ __________
- Анилин участвует в реакциях
- Получения бензола 2) нейтрализации водным раствором гидроксида калия
- Замещения с бромной водой 4) с соляной кислотой
- Окисления 6) гидратации Ответ __________
- Глицин участвует в реакциях
- С ромоводородом 4) окисления гидроксидом меди (II)
- С раствором гидроксида натрия 5) гидролиза
- Этерификации со спиртами 6) с бензолом Ответ __________
- Для алкина характерны
- окисление аммиачным раствором оксида серебра 4) взаимодействие с серной кислотой
- присоединение брома 5) жидкое агрегатное состояние при обычных услов.
- образование пептидов 6) реакция этерификации Ответ __________
- Белок альбумин
- Синеет под действием йода
- Гидролизуется при кипячении в растворе соляной кислоты
- Не подвергается денатурации при нагревании 5) состоит из остатков аминокислот
- Содержит пептидные связи 6) подвергается брожению
Ответ __________
- Анилин
- Более сильное основание, чем метиламин 4) реагирует с бромной водой
- Содержит сопряженную электронную систему 5) является первичным амином
- Стоек к окислению 6) имеет твердое агрегатное состояние при обычных услов.
Ответ __________
- Аланин
- Полимеризуется 4) может быть получен при гидролизе пептида
- Имеет в молекуле пептидные связи 5) существует в виде двух оптических изомеров
- Не реагирует со щелочью 6) вступает в реакцию с хлороводородом
Ответ __________
- Анилин
- Более сильное основание, чем аммиак 4) Стоек к окислению
- Содержит сопряженную электронную систему 5) реагирует с бромной водой
- Образует соли с кислотами 6) содержит атомы углерода в sp-гибридном состоянии
Ответ __________ скачать
Смотрите также:Аминоуксусная кислота реагирует с1. Солянокислотная обработка скважинГруппы Общие свойства веществ данной группыВита-Глицин Vita-Glycine Природная аминоуксусная кислота с выраженным седативным, ноотропным и антистрессорным действием 100 капсулТесты Кислоты. Разбавленная серная кислота реагирует с каждым из двух веществОтветом является последовательность трех цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастанияКонтрольная работа №3 вариант 0 Изомером бутановой кислоты является 1 бутанол 2 пентановая кислота 3 бутаналь 4 2-метилпропановая кислотаКонтрольная работа №3 вариант 0 Изомером бутановой кислоты является 1 бутанол 2 пентановая кислота 3 бутаналь 4 2-метилпропановая кислотаОсновный оксид 10 Кислотный оксидРебенок после развода родителей1. Олеиновая кислота сочетает в себе свойства карбоновой кислоты и 1 амина 2 спирта 3 альдегида 4 алкена1. Олеиновая кислота сочетает в себе свойства карбоновой кислоты и 1 амина 2 спирта 3 альдегида 4 алкена
Калькулятор молярной массы, молекулярной массы и строения элементов
| Молярная масса of Ch3Nh3COOH is 75,0666 g/molФормула в системе Хилл C2H5NO2 Элементный состав Ch3Nh3COOH:
Прямая ссылка на эту страницу Расскажите, пожалуйста, об этом бесплатном химическом портале вашим друзьям. | ||||||||||||||||||||
Вычисление молярной массыДля расчета молярной массы химического соединения введите его формулу и нажмите кнопку ‘Рассчитать!’. В химической формуле, вы можете использовать:
Примеры расчета молярной массы: NaCl, Ca(OH)2, K4[Fe(CN)6], CuSO4*5h3O, water, nitric acid, potassium permanganate, ethanol, fructose. Аминоуксусная кислота взаимодействует сВычисление молекулярной массы (молекулярная масса)Для того, чтобы рассчитать молекулярную массу химического соединения, введите её формулу, указав его количество массы изотопа после каждого элемента в квадратных скобках.Примеры молекулярные вычисления веса: C[14]O[16]2, S[34]O[16]2. Определение молекулярной массы, молекулярный вес, молекулярная масса и молярная массаМассы атомов и изотопов с NIST статью . Оставьте нам свой отзыв о своем опыте с калькулятором молекулярной массы. См. также: молекулярные массы аминокислот | ||||||||||||||||||||
| молекулярный вес рассчитывается сегодня |
Используя данный веб-сайт, вы соглашаетесь с Положением и условиями и Политикой Конфиденциальности.© 2018 webqc.org Все права защищены
Аминокислоты – это гетерофункциональные органические соединения, вступающие в реакции, характерные для карбоксильных групп, аминогрупп, и проявляющие ряд специфических биохимических свойств.
Как амфолиты a-аминокислоты образуют соли при взаимодействии с кислотами и основаниями.
аланин натриевая соль аланина
аланин гидрохлорид аланина
2.Реакция декарбоксилирования a-аминокислоты – это ферментативный процесс образования биогенных аминов из соответствующих a-аминокислот.
Декарбоксилирование происходит с участием фермента – декарбоксилазы и кофермента (KoF) – пиридоксальфосфата.
Гистамин является медиатором аллергических реакции организма.
При декарбоксилировании глутаминовой α-аминокислоты образуется ГАМК (γ-аминомасляная кислота), которая является медиатором торможения нервной системы.
3. Реакция дезаминирования – эта реакция является процессом удаления аминогруппы путем окислительного, восстановительного, гидролитического или внутримолекулярного дезаминирования.
В организме преобладает путь окислительного дезаминирования с участием ферментов – дегидрогеназ и кофермента – NAD+.
На первой стадии процесса осуществляется дегидрирование a-звена с образованием a-иминокислоты. На второй стадии происходит неферментативный гидролиз a-аминокислоты, приводящий к образованию a-кетокислоты и сопровождающийся выделением аммиака, включающегося в цикл образования мочевины.
Общая схема процесса окислительного дезаминирования:
Например, реакция окислительного дезаминирования аланина:
С помощью подобных процессов снижается уровень избыточных АК в клетке.
Трансаминированиеили переаминирование a-аминокислоты – это путь синтеза необходимых АК из a-кетокислот. При этом донором аминогруппы является a-аминокислота, находящаяся в избытке, а акцептором аминогруппы – a-кетокислота (ПВК, ЩУК, a-кетомасляная кислота). Процесс происходит с участием фермента – трансаминазы и кофермента – пиридоксальфосфата.
Например, процесс трансаминирования L-аланина и ЩУК:
Процесс переаминирования связывает обмен белков и углеводов в организме, он регулирует содержание a-аминокислот и синтез заменимых a-аминокислот.
Кроме этих реакций a-аминокислоты способны образовывать сложные эфиры, ацильные производные и вступать в реакции, которые не имеют аналогий в химии in vitro.
К таким процессам относятся гидроксилирование фенилаланина в тирозин.
При отсутствии необходимого фермента в организме накапливается фенилаланин, при его дезаминировании образуется токсичная кислота, накопление которой приводит к тяжелому заболеванию – фенилкетонурии.
Контрольные вопросы
1. Строение α-аминокислот, номенклатура, изомерия.
Классификация α-аминокислот по характеру бокового радикала, физико-химические характеристики боковой радикала. Классификация α-аминокислот по способности синтезироваться в организме.
3. Кислотно-основные свойства α-аминокислот.
Общие пути обмена α-аминокислот в организме. Реакции декарбоксилирования, трансаминирования, окислительного дезаминирования.
Типовые задания
Задание 1.
Аминоуксусная кислота взаимодействует ли с этанолом
Напишите все возможные стереоизомеры треонина в проекционных формулах Фишера. Укажите конфигурацию каждого хирального центра. Какие структуры являются энантиомерами, а какие диастереомерами? Есть ли среди приведенных структур мезоформа?
Решение. Молекула треонина содержит два хиральных центра:
следовательно, число оптических изомеров равно 2n = 22 = 4.
I и II, III и IV — энантиомеры;
I и III, I и IV, II и III, II и IV — σ-диастереомеры.
Среди приведенных структур мезоформы нет, так как каждый стереоизомер имеет свой энантиомер.
Задание 2.
Приведите примеры α-аминокислот, входящих в состав белков, с гидрофобными и гидрофильными боковыми радикалами.
Решение.α-Аминокислоты с гидрофобными радикалами: глицин, аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан и пролин (иминокислота). Радикалы этих аминокислот воду не притягивают, а стремятся друг к другу или к другим гидрофобным молекулам.
α-Аминокислоты с гидрофильными радикалами:серин, треонин, тирозин, аспарагиновая кислота, глутаминовая кислота, цистеин и оксипролин (иминокислота). В состав радикалов этих аминокислот входят полярные функциональные группы, образующие водородные связи с водой.
В свою очередь, эти аминокислоты делят на две группы:
— неионогенные α-аминокислоты, не способные к ионизации.
Например, гидроксильная группа треонина:
— ионогенные α-аминокислоты, способные к ионизации в условиях организма.
К α-аминокислотам с отрицательно заряженными радикалами относятся тирозин, цистеин, аспарагиновая и глутаминовая кислоты.
Эти аминокислоты называют кислыми.
Например, при рН 7 фенольная гидроксильная группа тирозина ионизирована на 0,01%; тиольная группа цистеина — на 8%.
Полностью ионизированные формы аспарагиновой и глутаминовой кислот называют аспартатом и глутаматом:
К α-аминокислотам с положительно заряженными радикалами относятся лизин, аргинин и гистидин.
Эти аминокислоты называют оснóвными.
У лизина есть вторая аминогруппа, способная присоединять протон:
У аргинина положительный заряд приобретает гуанидиновая группа:
Пиридиновый атом азота в имидазольном ядре гистидина содержит неподеленную пару электронов, которая также может присоединять протон:
Задание 3.
Для аланина напишите уравнения реакций, иллюстрирующих его амфотерный характер.
Решение. Напишем формулу аланина – 2-аминопропановой кислоты
Как все аминокислоты, аланин за счет наличия карбоксильной группы обладает кислотными свойствами, а за счет аминогруппы проявляет основные свойства.
Реакция, иллюстрирующая кислотные свойства аланина, – это реакция взаимодействия со щелочью, с образованием натриевой соли аланина.
Реакция, доказывающая основные свойства аланина, – это реакция взаимодействия с соляной кислотой, с образованием соответствующей соли.
Задание 4.
Смесь глицина, аланина, лизина, аргинина, серина и глутаминовой кислоты разделяли методом электрофореза при рН 6.
Аминокислоты, белки
Вариант 1
1. Напишите уравнения реакций взаимодействия аминоуксусной кислоты с этанолом, гидроксидом кальция, соляной кислотой.
2.
Изобразите структурные формулы изомерных аминокислот C₃H₇O₂N и назовите эти вещества.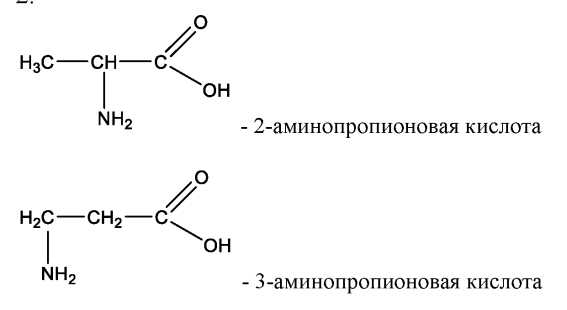
3. Что подразумевают под первичной, вторичной и третичной структурами белков? Какие связи соответствуют каждой структуре?

Вариант 2
1.
Напишите уравнения реакций, с помощью которых можно из этанола и неорганических веществ получить глицин (аминоэтановую кислоту).
2. Сильнее или слабее проявляются кислотные свойства у аминокислот по сравнению с карбоновыми кислотами (муравьиной, уксусной)? Почему?Аминокислоты слабее карбоновых кислот проявляют кислотность. Радикал с аминогруппой увеличивает электронную плотность на атоме кислорода сильнее, чем радикал без аминогруппы.
При увеличении электронной плотности связь между кислородом и протоном карбоксильной группы становится прочнее, а следовательно снижается кислотность.
3.
Аминоуксусная кислота: получение и применение
Что такое денатурация белков? В чем ее сущность и какие факторы ее вызывают?
Денатурация – это разрушение третичной и вторичной структуры белка с сохранением первичной структуры.
Она происходит под воздействием физических (температура, радиация) или химических (действие кислот, щелочей) факторов.
Вариант 3
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: метан → А → уксусный альдегид → Б → В → аминоуксусная кислота.
Назовите вещества А, Б, и В.
2. Почему не все аминокислоты имеют нейтральную реакцию на индикатор в отличие от аминоуксусной кислоты? Ответ подтвердите конкретными примерами.
3.
К какому классу веществ принадлежат белки? Из атомов каких элементов состоят молекулы белков?Белки (протеины, полипептиды) – высокомолекулярные органические вещества, состоящие из соединенных в цепочку пептидной связью аминокислот.
В состав любого белка входят углерод, водород, азот и кислород. Кроме того, часто в состав белков входит сера.
Вариант 4
1. Напишите уравнения реакций между: а) α-аминомасляной кислотой и гидроксидом натрия; б) аминоуксусной и соляной кислотой; в) β-аминопропионовой кислотой и метанолом.
2. Сильнее или слабее проявляются основные свойства у аминокислот по сравнению с метиламином?
Почему?Метиламин является более сильным основанием, чем аминокислоты. Карбоксильная группа аминокислот обладает акцепторным эффектом и оттягивает на себя электронную плотность с атома азота аминогруппы, тем самым уменьшая ее способность отрывать протон. А метильная группа метиламина обладает донорным эффектом и увеличивает электронную плотность на атоме азота аминогруппы.
3.
Почему необходима белковая пища? Что происходит с белками пищи в организме человека?

Химические свойства аминокислот.
1. Горение:
4Nh3Ch3COOH + 13O2 → 8CO2 + 10h3O + 2N2
2. Взаимодействие с водой:
Nh3Ch3COOH + h3O +Nh4Ch3COOH + OH−
Nh3Ch3COOH + h3O Nh3Ch3COO−+ h4O+
(Nh3Ch3COOH Nh3Ch3COO− + H+)
Т.е.
Аминокислоты. Свойства аминокислот.
кислотно-основные превращение можно представить в виде:
Аминокислоты — амфотерные органические вещества. В водных растворах большинства аминокислот среда слабокислотная.
Так как аминокислоты в водных растворах ведут себя как типичные амфотерные соединения, то в живых организмах они играют роль буферных веществ, поддерживающих определенную концентрацию ионов водорода.
Группа −СООН (карбоксильная группа) определяет кислотные свойства этих соединений. Реакции с растворами щелочей:
Nh3Ch3COOH + NaOH → Nh3Ch3COO−Na + h3O
аминоацетат натрия
4. Реагируют как кислоты со спиртами в присутствие газообразного HCl (реакция этерификация):
Nh3Ch3COOH + C2H5OH → Nh3Ch3COOC2H5 + h3O
Аминогруппа —NН2 определяет основные свойства аминокислот, так как способна присоединять к себе катион водорода по донорно-акцепторному механизму за счет наличия свободной электронной пары у атома азота. Реакции с растворами кислот
2Nh3Ch3COOH + h3SO4 → (Nh4Ch3COOH)2SO4
сульфат глициния
Конденсация:
а) димеризация
Nh3−(Ch3)5−COOH + H−NH−(Ch3)5−COOH →h3N−(Ch3)5−CO−NH−(Ch3)5−COOH+h3O
аминокапроновая (6-аминогексановая) кислота димер (дипептид)
б) поликонденсация
nNh3−(Ch3)5−COOH → [−NH−(Ch3)5−COO−]n+ (n − 1)h3O
аминокапроновая кислота капрон
Группа −CO−NH− называется амидной группой (пептидная группа, связь (−C−N−) − пептидной связью, а образующиеся полимеры – полиамидами (полимеры α−аминокислот − полипептидами).
В зависимости от числа остатков аминокислот различают дипептиды, трипептиды, полипептиды.
К полипептидам относятся белки. При гидролизе белков (в кислотной среде или под действием ферментов) образуется смесь α−аминокислот.
Дата добавления: 2017-06-13; просмотров: 435;
Похожие статьи:
аминоуксусная кислота взаимодействует ли с этанолом
Свойства аминокислот
Cвойства аминокислот можно разделить на две группы: химические и физические.
Химические свойства аминокислот
В зависимости от соединений, аминокислоты могут проявлять различные свойства.
Взаимодействие аминокислот:
Аминокислоты как амфотерные соединения образуют соли и с кислотами, и со щелочами.
Как карбоновыекислоты аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
Взаимодействие и свойства аминокислот с основаниями:Образуются соли:
Nh3-Ch3-COOH + NaOH Nh3-Ch3-COONa + h3O
Натриевая соль + 2-аминоуксусной кислоты Натриевая соль аминоуксусной кислоты (глицина) + вода
Взаимодействие со спиртами:
Аминокислоты могут реагировать со спиртами при наличии газообразного хлороводорода, превращаясь в сложный эфир.
Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
Nh3-Ch3-COOH + Ch4OH Nh3-Ch3-COOCh4 + h3O.
Метиловый эфир / 2-аминоуксусной кислоты /
Взаимодействие с аммиаком:
Образуются амиды:
Nh3-CH(R)-COOH + H-Nh3 = Nh3-CH(R)-CONh3 + h3O
Амид
Взаимодействие аминокислот с сильными кислотами:
Получаем соли:
HOOC-Ch3-Nh3 + HCl → [HOOC-Ch3-Nh4]Cl (или HOOC-Ch3-Nh3*HCl↑)
Таковы основные химические свойства аминокислот.
Физические свойства аминокислот
Перечислим физические свойства аминокислот:
- Бесцветные
- Имеют кристаллическую форму
- Большинство аминокислот со сладким привкусом, но в зависимости от радикала (R) могут быть горькими или безвкусными
- Хорошо растворяются в воде, но плохо растворяются во многих органических растворителях
- Аминокислоты имеют свойство оптической активности
- Плавятся с разложением при температуре выше 200°C
- Нелетучие
- Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток
Категории
ekoshka.ru
Тест "Аминокислоты". 11 класс
11 класс. Аминокислоты. Контрольный тест вариант 1
1. В состав аминокислот обязательно входит элемент: А) Cl В) Fe C) Na Д) Р Е) С
2. Аминокислота, структурная формула которой приведена СН3 – СН – СН2 – СООН
׀
NН 2
по исторической номенклатуре называется:
А) 2 – аминобутановая В) α – аминопропионовая С) 3 – аминобутановая
Д) β – аминомасляная Е) ү – аминомасляная
3. Относительная молекулярная масса глицина: А) 89 В) 75 С) 103 Д) 117 Е) 145
4. Аминокислоты – амфотерные соединения, так как:
А) Содержат амино – и карбоксильные группы
В) Реагируют с водой
С) Образуют сложные эфиры
Д) Содержат карбоксильные группы
Е) Относятся к азотсодержащим органическим соединениям
5. При взаимодействии 18,9 г хлоруксусной кислоты с 18,7 г аммиака, образуется аминоуксусная кислота массой(г): А) 12,2 В) 12,8 С) 13,2 Д) 13,9 Е) 15,0
11 класс. Аминокислоты. Контрольный тест вариант 2
1. К классу аминокислот относится вещество:
А) Nh3 – Ch3 – Ch3 – Nh3 B) Ch3Nh3 – COOH C) C6H5NO2
Д) (Ch4)2 – NH Е) Ch4 – (СН2)2 – СООН
2. Аминокислота, структурная формула которой приведена СН2 – СН – СООН
׀ ׀
NН 2 СН3
по систематической номенклатуре называется:
А) β – аминопропионовая
В) 2 – метил – 3 – аминопропановая
С) ү – аминоуксусная
Д) амиинометилпропановая
Е) 3 – амино – 2 – метилпропановая
3. Относительная молекулярная масса аланина: А) 89 В) 75 С) 103 Д) 117 Е) 145
4. Аминокислота образует сложный эфир в реакции с:
А) кислотой В) ангидридом С) альдегидом Д) спиртом Е) основанием
5. При взаимодействии 150 г 1 %-ного раствора аминоуксусной кислоты с гидроксидом калия образуется соль массой: А) 6,46 г В) 3,36 г С) 4,46 г Д) 5,46 г Е) 2,26 г
11 класс. Аминокислоты. Контрольный тест вариант 3
1. Название аминокислоты: СН3 – СН – СООН
׀
NН 2
А) α – аланин В) β – аланин С) глицин Д) ү – аминомасляная Е) серин
2. Молярная масса аминокислоты, содержащей девять атомов водорода равна:
А) 75 г/моль В) 89 г/моль С) 103 г/моль Д) 117 г/моль Е) 131 г/моль
3. Аминокислоты не взаимодействуют с:
А) Спиртами В) Щелочами С) Циклоалканами Д) Аминокислотами Е) Кислотами
4. α – аминокислоты входят в состав:
А) спиртов В) жиров С) углеводов Д) углеводородов Е) белков
5. Масса аминопропионовой кислоты, которая взаимодействует с 2,8 г гидроксида калия:
А) 6,25 г В) 5,15 г С) 4,45 г Д) 8,15 г Е) 7,05 г
11 класс. Аминокислоты. Контрольный тест вариант 4
1. Органические вещества с общей формулой R – CH – COOH относятся к:
↓
Nh3
А) Альдегидам. В) Карбоновым кислотам. С) Аминокислотам. Д) Эфирам. Е) Аминам
2. Название аминокислоты: Н2N – СН2 – СН2 – СН2 – СООН
А) α – аланин
В) β – аланин
С) глицин
Д) ү – аминомасляная
Е) серин
3. В 187,5 г раствора содержатся 27 г аминоуксусной кислоты. Массовая доля Н2N – СН2 – СООН
в растворе равна (%):
А) 11,6 В) 12,2 С) 13,0 Д) 13,8 Е) 14,4
4. Только аминокислотам свойственно образование:
А) кислот В) оснований С) солей Д) пептидов Е) эфиров
5. Массовая доля углерода в молекуле α – аминомасляной кислоты равна (%):
А) 44,8 В) 46,6 С) 47,1 Д) 48,4 Е) 49,9
11 класс. Аминокислоты. Контрольный тест вариант 5
1. Название аминокислоты: Н2N – СН2 – СООН
А) α – аланин В) β – аланин С) глицин Д) ү – аминомасляная Е) серин
2. Три аминокислоты, последовательно соединяясь, образуют число пептидных связей, равное:
А) 2 В) 1 С) 4 Д) 3 Е) 0
3. Аминоуксусная кислота в водном растворе может реагировать с:
А) Нитратом железа (II) В) Бензиловым спиртом С) Аммиачным раствором оксида серебра
Д) Хлоридом бария Е) Этиловым спиртом
4. Масса соли, которая получается при взаимодействии 150 г аминоуксусной кислоты с 730 г
20 %-ного раствора соляной кислоты:
А) 223 г В) 333 г С) 150 г Д) 146 г Е) 117 г
5. Аминокислоты – мономеры:
А) жиров В) белков С) углеводов Д) нуклеиновых кислот Е) с ложных эфиров
11 класс. Аминокислоты. Контрольный тест вариант 6
1. Отметьте функциональные группы, содержащиеся в аминокислотах:
А) –NO2 и –COOH В) – Nh3 и –COOH С) –Nh3 и –OH Д) –NO2 и –OH Е) –OH и – СООН
2. Определите количество вещества β – аминопропионовой кислоты, если ее масса составляет 111,25 г:
А) 1,10 моль В) 1,25 моль С) 1,40 моль Д) 1,45 моль Е) 1,55 моль
3. В состав аминокислот обязательно входит элемент:
А) C В) Fe C) Na Д) Р Е) Cl
4. Аминокислота образует сложный эфир в реакции с:
А) кислотой В) спиртом С) альдегидом Д) ангидридом Е) основанием
5. С едким калием массой 5,6 г взаимодействует аминопропионовая кислота массой:
А) 6,25 г В) 8,9 г С) 7,05 г Д) 8,15 г Е) 4,45 г
11 класс. Аминокислоты. Контрольный тест вариант 7
1. Аминокислота, структурная формула которой приведена СН3 – СН – СН2 – СООН
׀
NН 2
по исторической номенклатуре называется:
А) 2 – аминобутановая В) α – аминопропионовая С) 3 – аминобутановая
Д) β – аминомасляная Е) ү – аминомасляная
2. Относительная молекулярная масса глицина: А) 89 В) 75 С) 103 Д) 117 Е) 145
3. Используя только глицин и цистеин можно получить различных дипептидов:
А) 2 В) 5 С) 3 Д) 4 Е) 1
4. Вещества В и Е в схеме превращений
NaOH NН3 аланин
Этан → А → Б → В → Г→ хлоруксусная кислота → Д → Е:
А) Уксусная кислота, дипептид В) Ацетальдегид, глицилаланин С) Метан, аланин
Д) Этаналь, солянокислый аланин Е) Этаналь, этиловый эфир аланина
5. При взаимодействии 18,9 г хлоруксусной кислоты с 18,7 г аммиака, образуется аминоуксусная кислота массой (г): А) 12,2 В) 12,8 С) 13,2 Д) 13,9 Е) 15,0
11 класс. Аминокислоты. Контрольный тест вариант 8
1. β-аминопропионовой кислоте соответствует формула
А) СН3
│
СН3-С-COOH
│
Nh3 В) Nh3 - Ch3 - Ch3 - Ch3 - COOH
С) Ch4-CH-COOH
│
Nh3 Д) Nh3 - Ch3-Ch3 – COOH Е) Ch4 - Ch3 – COOH
2. Относительная молекулярная масса аланина: А) 89 В) 75 С) 103 Д) 117 Е) 145
3. Аминокислоты – амфотерные соединения, так как:
А) Содержат амино – и карбоксильные группы В) Реагируют с водой
С) Образуют сложные эфиры Д) Содержат карбоксильные группы
Е) Относятся к азотсодержащим органическим соединениям
4. Для аминокислот нехарактерна реакция:
А) со спиртами В) с активными металлами С) с кислотами Д) с щелочами Е) с солями
5. Объем 50 %-ного раствора метанола (р=0,64 г/мл), необходимый для взаимодействия с 17,8 г аминопропионовой кислоты: А) 50 мл В) 20 мл С) 40 мл Д) 30 мл Е) 10 мл
11 класс. Аминокислоты. Контрольный тест вариант 9
1. К классу аминокислот относится вещество:
А) Nh3 – Ch3 – Ch3 – Nh3 B) Ch3Nh3 – COOH C) C6H5NO2
Д) (Ch4)2 – NH Е) Ch4 – (СН2)2 – СООН
2. Ближайший гомолог глицина называется:
А) Тирозин В) Гуанин С) Треонин Д) Аланин Е) Цистоин
3. Массовая доля углерода в аминоуксусной кислоте: А) 44 В) 68 С) 32 Д) 56 Е) 75
4. Аминокислоты не могут реагировать:
А) С основаниями и кислотами В) С предельными углеводородами С) Друг с другом
Д) С кислотами и спиртами Е) С основаниями и спиртами
5. Смешали 90 г 8 %-ного и 110 г 12 %-ного раствора аминоэтановой кислоты. Массовая доля аминокислоты после смешения растворов равна (%): А) 9,1 В) 9,6 С) 10,2 Д) 10,8 Е) 11,4
11 класс. Аминокислоты. Контрольный тест вариант 10
1. Неверное суждение об аминокислотах:
А) Состоят только из углерода и водорода В) Входят в состав белков С) Амфотерные
Д) Имеют сладковатый вкус Е) Твердые вещества
2. Название аминокислоты: Н2N – СН2 – СН2 – СН2 – СООН
А) α – аланин В) β – аланин С) глицин Д) ү – аминомасляная Е) серин
3. Массовая доля углерода в молекуле α – аминомасляной кислоты равна (%):
А) 44,8 В) 46,6 С) 47,1 Д) 48,4 Е) 49,9
4.Аминокислоты не взаимодействуют с:
А) Щелочами В) Аминокислотами С) Спиртами Д) Кислотами Е) Циклоалканами
5. При взаимодействии 150 г 1 %-ного раствора аминоуксусной кислоты с гидроксидом калия образуется соль массой:
А) 6,46 г В) 3,36 г С) 4,46 г Д) 5,46 г Е) 2,26 г
11 класс. Аминокислоты. Контрольный тест вариант 11
1. Органические вещества с общей формулой R – CH – COOH относятся к:
↓
Nh3
А) Альдегидам. В) Карбоновым кислотам. С) Аминокислотам. Д) Эфирам. Е) Аминам
2. Название аминокислоты: СН3 – СН – СООН
׀
NН 2
А) α – аланин В) β – аланин С) глицин Д) ү – аминомасляная Е) серин
3. Основные свойства α-аминоуксусной кислоты проявляются в реакции:
А) с металлическим натрием В) с гидроксидом калия С) с метиловым спиртом
Д) диссоциации Е) с соляной кислотой
3. Относительная молекулярная масса глицина: А) 89 В) 75 С) 103 Д) 117 Е) 145
4. Аминокислоты не могут реагировать:
А) С основаниями и спиртами
В) С основаниями и кислотами
С) С кислотами и спиртами
Д) Друг с другом
Е) С предельными углеводородами
5. Объем 6 - %-ного метанола (плотность 0,8 г/см 3 ) необходимый для реакции с 112,5 г аминоуксусной кислотой:
А) 110 В) 50 С) 100 Д) 90 Е) 85
11 класс. Аминокислоты. Контрольный тест вариант 12
1. Название аминокислоты: Н2N – СН2 – СООН
А) α – аланин В) β – аланин С) глицин Д) ү – аминомасляная Е) серин
2. Три аминокислоты, последовательно соединяясь, образуют число пептидных связей, равное:
А) 2 В) 1 С) 4 Д) 3 Е) 0
3. В 187,5 г раствора содержатся 27 г аминоуксусной кислоты. Массовая доля Н2N – СН2 – СООН
в растворе равна (%): А) 11,6 В) 12,2 С) 13,0 Д) 13,8 Е) 14,4
4. Глицин образует сложный эфир в реакции с
А) C2H5OH B) Nh3Ch3COOH C) HBr Д) Ch4COOH E) NaOH
5. При взаимодействии 150 г 1 %-ного раствора аминоуксусной кислоты с гидроксидом калия образуется соль массой:
А) 6,46 г В) 3,36 г С) 4,46 г Д) 5,46 г Е) 2,26 г
11 класс. Аминокислоты. Контрольный тест вариант 13
1. Название аминокислоты: СН3 – СН – СООН
׀
NН 2
А) α – аланин В) β – аланин С) глицин Д) ү – аминомасляная Е) серин
2. Молярная масса аминокислоты, содержащей девять атомов водорода равна:
А) 75 г/моль В) 89 г/моль С) 103 г/моль Д) 117 г/моль Е) 131 г/моль
3. Аминокислоты не взаимодействуют с:
А) Спиртами В) Щелочами С) Циклоалканами
Д) Аминокислотами Е) Кислотами
4. α – аминокислоты входят в состав:
А) спиртов В) жиров С) углеводов Д) углеводородов Е) белков
5. Масса аминопропионовой кислоты, которая взаимодействует с 2,8 г гидроксида калия:
А) 6,25 г В) 5,15 г С) 4,45 г Д) 8,15 г Е) 7,05 г
11 класс. Аминокислоты. Контрольный тест вариант 14
1. Название аминокислоты: Н2N – СН2 – СООН
А) α – аланин В) β – аланин С) глицин Д) ү – аминомасляная Е) серин
2. Три аминокислоты, последовательно соединяясь, образуют число пептидных связей, равное:
А) 2 В) 1 С) 4 Д) 3 Е) 0
3. Аминоуксусная кислота в водном растворе может реагировать с:
А) Нитратом железа (II) В) Бензиловым спиртом С) Аммиачным раствором оксида серебра
Д) Хлоридом бария Е) Этиловым спиртом
4. Масса соли, которая получается при взаимодействии 150 г аминоуксусной кислоты с 730 г
20 %-ного раствора соляной кислоты:
А) 223 г В) 333 г С) 150 г Д) 146 г Е) 117 г
5. Аминокислоты – мономеры:
А) жиров В) белков С) углеводов Д) нуклеиновых кислот Е) сложных эфиров
11 класс. Аминокислоты. Контрольный тест вариант 15
1. В состав аминокислот обязательно входит элемент: А) Cl В) Fe C) Na Д) Р Е) С
2. Аминокислота, структурная формула которой приведена СН3 – СН – СН2 – СООН
׀
NН 2
по исторической номенклатуре называется:
А) 2 – аминобутановая В) α – аминопропионовая С) 3 – аминобутановая
Д) β – аминомасляная Е) ү – аминомасляная
3. Относительная молекулярная масса глицина:
А) 89 В) 75 С) 103 Д) 117 Е) 145
4. Аминокислоты – амфотерные соединения, так как:
А) Содержат амино – и карбоксильные группы.
В) Реагируют с водой.
С) Образуют сложные эфиры.
Д) Содержат карбоксильные группы.
Е) Относятся к азотсодержащим органическим соединениям.
5. С едким калием массой 5,6 г взаимодействует аминопропионовая кислота массой:
А) 6,25 г В) 8,9 г С) 7,05 г Д) 8,15 г Е) 4,45 г
11 класс. Аминокислоты. Контрольный тест вариант 16
1. β-аминопропионовой кислоте соответствует формула
А) СН3
│
СН3-С-COOH
│
Nh3 В) Nh3 - Ch3 - Ch3 - Ch3 - COOH
С) Ch4-CH-COOH
│
Nh3 Д) Nh3 - Ch3-Ch3 – COOH Е) Ch4 - Ch3 – COOH
2. Относительная молекулярная масса аланина: А) 89 В) 75 С) 103 Д) 117 Е) 145
3. Аминокислоты – амфотерные соединения, так как:
А) Содержат амино – и карбоксильные группы. В) Реагируют с водой.
С) Образуют сложные эфиры. Д) Содержат карбоксильные группы.
Е) Относятся к азотсодержащим органическим соединениям.
4. Для аминокислот нехарактерна реакция:
А) со спиртами В) с активными металлами С) с кислотами Д) с щелочами Е) с солями
5. Объем 50 %-ного раствора метанола (р=0,64 г/мл), необходимый для взаимодействия с 17,8 г аминопропионовой кислоты: А) 50 мл В) 20 мл С) 40 мл Д) 30 мл Е) 10 мл
11 класс. Аминокислоты. Контрольный тест вариант 17
1. Аминокислоте соответствует формула:
А) СН2 – СН2 – СН2 - NН2 В) СН3 – СН2 – СН(NН2) – СН3 С) СН2ОН - СОNН2
Д) СН3 - СН2 - СОNН2 Е) СН3 – СН(NН2) – СООН
2. Относительная молекулярная масса глицина: А) 89 В) 75 С) 103 Д) 117 Е) 145
3. Глицин образует сложный эфир в реакции с:
А) C2H5OH B) Nh3Ch3COOH C) HBr Д) Ch4COOH E) NaOH 4. Основные свойства α-аминоуксусной кислоты проявляются в реакции:
А) с металлическим натрием В) с гидроксидом калия С) с метиловым спиртом
Д) диссоциации Е) с соляной кислотой
5. Масса пропанола, который взаимодействует с 2 %-ным раствором аминоуксусной кислоты массой 190 г: А) 6 г В) 3 г С) 18 г Д) 15 г Е) 9 г
11 класс. Аминокислоты. Контрольный тест вариант 18
1. В состав аминокислот обязательно входит элемент: А) Cl В) Fe C) Na Д) Р Е) С
2. Аминокислота, структурная формула которой приведена СН3 – СН – СН2 – СООН
׀
NН 2
по исторической номенклатуре называется:
А) 2 – аминобутановая В) α – аминопропионовая С) 3 – аминобутановая
Д) β – аминомасляная Е) ү – аминомасляная
3. Относительная молекулярная масса глицина: А) 89 В) 75 С) 103 Д) 117 Е) 145
4. Аминокислоты – амфотерные соединения, так как:
А) Содержат амино – и карбоксильные группы
В) Реагируют с водой
С) Образуют сложные эфиры
Д) Содержат карбоксильные группы
Е) Относятся к азотсодержащим органическим соединениям
5. При взаимодействии 18,9 г хлоруксусной кислоты с 18,7 г аммиака, образуется аминоуксусная кислота массой(г): А) 12,2 В) 12,8 С) 13,2 Д) 13,9 Е) 15,0
infourok.ru
Аминоуксусная кислота - Большая Энциклопедия Нефти и Газа, статья, страница 3
Аминоуксусная кислота
Cтраница 3
Добавляют к раствору аминоуксусной кислоты 1 мл нейтрализованного формалина. Желтая окраска раствора превращается в красную, следовательно, реакция раствора стала кислой. Формальдегид присоединяется к аминогруппам, связывает их, карбоксильные группы при этом освобождаются и обусловливают кислую реакцию раствора. [31]
Глицин, глико-кол или аминоуксусная кислота СШМШСООН является первой из аминокислот. Она получена была Браконно в 1820 г. при гидролизе клея желатина, в которой содержится около 25 % глицина, и за свой сладкий вкус была названа гликоколом. В настоящее время готовится исключительно синтетическим путем. [32]
Глицин, глико-кол или аминоуксусная кислота СЖМШСООН является первой из аминокислот. Она получена была Браконно в 1820 г. при гидролизе клея желатина, в которой содержится около 25 % глицина, и за свой сладкий вкус была названа гликоколом. В настоящее время готовится исключительно синтетическим путем. [33]
В комплексной медной соли аминоуксусной кислоты двухвалентная медь связана ковалентными связями с атомами кислорода карбоксильных групп и дополнительными связями с неподеленными парами электронов аминогрупп. В растворе отсутствуют ионы Си2, поэтому при добавлении раствора щелочи осадка гидроксида меди ( II) не образуется. [34]
Получение ионита с группами аминоуксусной кислоты проводят по аналогичной методике. [35]
Так как в молекуле аминоуксусной кислоты аминогруппа находится при углероде, соседнем с карбоксилом, эта кислота относится к а-аминокислотам. [36]
Какая масса этилового эфира аминоуксусной кислоты образуется при взаимодействии 150 г 20 % - ного раствора аминоуксусной кислоты с этиловым спиртом. [37]
Так как в молекуле аминоуксусной кислоты аминогруппа находится при углероде, соседнем с карбоксилом, эта кислота относится к а-аминокислотам. [38]
Дри дальнейшем увеличении концентрации аминоуксусной кислоты качает - К получаемых электролитических железных покрытий ухудшается. Хорошие буферные свойства этих добавок можно объяснить еще и вм, что они образуют с некоторыми металлами ( Ре, Hi) прочные ксмп - ексные соединения типа Me ( Lig) 1, благодаря чецу повышается рН гидратообразования. Значительное выделение водорода на катоде приводит быстрому подщелачиванию прикатодного слоя и выпадению гидроокиси лева. [39]
Реактивы: 2-процентный раствор аминоуксусной кислоты ( глицина), 10-процентный раствор аминоуксусной кислоты, 1-процентный раствор аминоуксусной кислоты, растворы индикаторов в капельницах: метиловый оранжевый, метиловый красный, лакмус, 40-процентный раствор формальдегида ( формалин) - нейтрализованный, оксид меди ( II), 10-процентный раствор гидроксида натрия, 10-процентный раствор нитрита натрия, ледяная уксусная кислота, 0 1-процентный раствор нингидрина, натрий металлический, в-капролактам. [40]
В химии ее называют просто аминоуксусной кислотой. В ее составе не имеется асимметрического С - атома, поэтому она является единственной природной оптически не активной сс-аминокислотой и широко распространена во всех белках. [41]
Гликоколь, или глицин ( аминоуксусная кислота), Nh3Ch3 - СООН. [42]
Гликокол, или глицин ( аминоуксусная кислота), Nh3Ch3 - СООН - простейшая аминокислота, содержится в мышцах низших животных, образуется при гидролизе белкового вещества шелка. [43]
При этом избыток НС1 и аминоуксусная кислота дифференцированно не титруются. Содержание аминоуксусной кислоты рассчитывается по участку кривой между первым и вторым изломами. [44]
Гликоколь, или глицин ( аминоуксусная кислота) NHaCh3 - СООН. Эта простейшая аминокислота содержится в мускулах низших животных. Много гликоколя образуется при гидролизе белкового вещества шелка. [45]
Страницы: 1 2 3 4
www.ngpedia.ru