Диметиловый эфир. Формула метилового эфира
Метиловый эфир Википедия
| Диметиловый эфир | |
| C2H6Oh4С-О-СН3 | |
| бесцветный газ | |
| 46,07 г/моль | |
| 0,00209 г/см³ | |
| −138,5 °C | |
| −24,9 °C | |
| −41 °C | |
| 127,0 °C,5370 кПа,0,272 г/см³ | |
| 53 атм | |
| 1,3 Д | |
| 115-10-6 | |
| 8254 | |
| 204-065-8 | |
| PM4780000 | |
| 28887 | |
| 1033 | |
| 7956 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Димети́ловый эфи́р (C2H6O) (метиловый эфир, метоксиметан, древесный эфир) Н3С-О-СН3 — широко применяемый на практике простой эфир.
Свойства[ |
ru-wiki.ru
Диметиловый эфир - это... Что такое Диметиловый эфир?
Димети́ловый эфи́р (C2H6O) (метиловый эфир, метоксиметан, древесный эфир) Н3С-О-СН3 — широко применяемый на практике простой эфир.
Свойства
| 233.128 | 54.61 | 298.172 | 596.21 | 348.147 | 2022.45 |
| 238.126 | 68.49 | 303.160 | 687.37 | 353.146 | 2242.74 |
| 243.157 | 85.57 | 305.160 | 726.26 | 353.158 | 2243.07 |
| 248.152 | 105.59 | 308.158 | 787.07 | 358.145 | 2479.92 |
| 253.152 | 129.42 | 313.156 | 897.59 | 363.148 | 2735.67 |
| 258.160 | 157.53 | 316.154 | 968.55 | 368.158 | 3010.81 |
| 263.160 | 190.44 | 318.158 | 1018.91 | 373.154 | 3305.67 |
| 268.161 | 228.48 | 323.148 | 1152.35 | 378.150 | 3622.60 |
| 273.153 | 272.17 | 328.149 | 1298.23 | 383.143 | 3962.25 |
| 278.145 | 321.87 | 333.157 | 1457.50 | 388.155 | 4331.48 |
| 283.160 | 378.66 | 333.159 | 1457.76 | 393.158 | 4725.02 |
| 288.174 | 443.57 | 338.154 | 1631.01 | 398.157 | 5146.82 |
| 293.161 | 515.53 | 343.147 | 1818.80 | 400.378 | 5355.8 |
J.
Chem. Eng. Data 2004, 49, 32-34Производство
В промышленности производится из природного газа, угля, или биомассы.
Применение
Применение в качестве топлива
Диметиловый эфир — экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Цетановое число диметилового дизеля более 55, при том что у классического нефтяного 38-53. Применение диметилового эфира не требует специальных фильтров, но необходима переделка систем питания (установка газобалонного оборудования, корректировка смесеобразования) и зажигания двигателя. Без переделки возможно применение на автомобилях с LPG-двигателями при 30 % содержании в топливе.
Теплота сгорания ДМЭ около 30 МДж/кг, у классических нефтяных топлив — около 42 МДж/кг. Одна из особенностей применения ДМЭ — его более высокая окисляющая способность (благодаря содержанию кислорода), чем у классического топлива.
В июле 2006 года Национальная Комиссия Развития и Реформ (NDRC) (Китай) приняла стандарт использования диметилового эфира в качестве топлива. Китайское правительство будет поддерживать развитие диметилового эфира, как возможную альтернативу дизельному топливу. В ближайшие 5 лет Китай планирует производить 5—10 млн тонн диметилового эфира в год.
Автомобили с двигателями, работающими на диметиловом эфире разрабатывают KAMAZ, Volvo, Nissan и китайская компания Shanghai Automotive.
Опасность
Является слабым наркотиком. Огнеопасен, смесь с воздухом взрывоопасна, температура вспышки −41 °C. ПДК в воздухе рабочей зоны составляет 200 мг/м³.
biograf.academic.ru
Способ получения метилового эфира n-фенил-n-метоксиацетил-d, l-аланина или его алкильных производных
Сущность изобретения: продукт - метиловый эфир N-фенил-N-метоксиацетил-D, L-аланин или его алкильные производные формулы RC6h5N[CH(Ch4)COOCh4]C(=O)Ch3OCh4. Реагент 1: анилин или его алкильное производное. Реагент 2: смесь метоксиуксусной кислоты, взятая в избытке 5-20% и треххлористого фосфора. Условия реакции: в среде растворителя, после полученное производное N-метоксиацентиланилин RC6h5NH(C=O)Ch3OCh4 непосредственно в реакционной массе или после выделения из нее подвергают алкилированию при 110-140°С, используя 1,2 - 2-кратный избыток метилового эфира галоидпропионовой кислоты и органическое основание, выбранное из группы: щелочной металл, алкоголят щелочного металла, амид щелочного металла, комплексный гидрид металла.
Изобретение относится к органическому синтезу и касается способа получения метилового эфира N-фенил-N-метоксиацетил-Д, L-аланина или его алкильных производных.
Известны представителем производных метилового эфира N-фенил-N-метоксиацетил-Д, L-аланина является метиловый эфир N-(2,6-диметилфенил)-N-метоксиацетил-Д, L-аланина (торговое название металаксил), представляющий собой систематический фунгицид, полученный фирмой ЦИБА-ГЕЙГИ в 1973 году. По способу в соответствии с патентом ФРГ N 2515091 2,6-диметиланилин подвергают взаимодействию с метиловым эфиром ДL-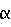 -бромпропионовой кислоты в присутствии гидрокарбоната натрия. В результате этой реакции образуется метиловый эфир N(2,6-диметилфенил)-ДL-аланина, который затем подвергают ацилированию метоксиацетилхлоридом и таким образом получают целевой продукт металаксил. При осуществлении вышеуказанного способа реакцию ацилирования проводят после стадии алкилирования. Ацилирование стерически затрудненных вторичных аминов протекает с меньшей скоростью, чем ацилирование первичных аминов, хлорангидрид кислоты приходится брать в большом избытке, и целевой продукт получается с умеренным выходом. Изобретение относится к способу получения производных метилового эфира N-фенил-N-метоксиацетил-ДL-аланина общей формулы
-бромпропионовой кислоты в присутствии гидрокарбоната натрия. В результате этой реакции образуется метиловый эфир N(2,6-диметилфенил)-ДL-аланина, который затем подвергают ацилированию метоксиацетилхлоридом и таким образом получают целевой продукт металаксил. При осуществлении вышеуказанного способа реакцию ацилирования проводят после стадии алкилирования. Ацилирование стерически затрудненных вторичных аминов протекает с меньшей скоростью, чем ацилирование первичных аминов, хлорангидрид кислоты приходится брать в большом избытке, и целевой продукт получается с умеренным выходом. Изобретение относится к способу получения производных метилового эфира N-фенил-N-метоксиацетил-ДL-аланина общей формулы 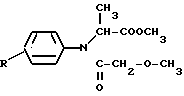 (I) где R означает водород или алкил С1-С4, исходя из соответствующего анилина с использованием реакции алкилирования метиловым эфиром галоидпропионовой кислоты при 110-140оС в присутствии конденсирующего агента, выбранного из неорганических оснований, и реакции ацилирования с использованием метоксиуксусной кислоты. Способ по изобретению отличается тем, что соответствующий анилин подвергают вначале ацилированию смесью метоксиуксусной кислоты, которая берется в избытке 5-20% и треххлористого фосфора в среде растворителя, после чего образующееся производное N-метоксиацетиланилина общей формулы
(I) где R означает водород или алкил С1-С4, исходя из соответствующего анилина с использованием реакции алкилирования метиловым эфиром галоидпропионовой кислоты при 110-140оС в присутствии конденсирующего агента, выбранного из неорганических оснований, и реакции ацилирования с использованием метоксиуксусной кислоты. Способ по изобретению отличается тем, что соответствующий анилин подвергают вначале ацилированию смесью метоксиуксусной кислоты, которая берется в избытке 5-20% и треххлористого фосфора в среде растворителя, после чего образующееся производное N-метоксиацетиланилина общей формулы 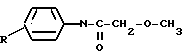 (II) в которой R имеет вышеуказанное определение, непосредственно или после выделения подвергают алкилированию 1,2-2,0-ух кратным избытком метилового эфира галоидпропионовой кислоты в присутствии щелочного металла, алкоголята, амида щелочного металла или комплексного гидрида металла. Предлагаемый способ основан на том факте, что ароматические амины целесообразнее сначала подвергать ацилированию и лишь затем алкилированию. В этом случае вышеописанный процесс протекает более гладко, чем при известных способах, по которым вначале проводят алкилирование, а затем ацилирование. Ацилирование протекает легче, поскольку первичная аминогруппа может быть ацилирована легче, чем стерически затрудненный вторичный амин. Реакция алкилирования в этом случае протекает со значительно более высокой скоростью, так как механизм ее совершенно иной. Было установлено, что кислый атом водорода, связанный с атомом азота метоксиацетанилида, замещенного в 2-, 4- и/или 6-положении, может быть замещен атомом щелочного металла. Это замещение может быть осуществлено путем взаимодействия с щелочными металлами, алкоголятами, амидами щелочных металлов или комплексными гидридами металлов. Образующиеся в результате такого взаимодействия солеподобные соединения легко реагируют с алкилгалогенидами, например метиловым эфиром ДL-
(II) в которой R имеет вышеуказанное определение, непосредственно или после выделения подвергают алкилированию 1,2-2,0-ух кратным избытком метилового эфира галоидпропионовой кислоты в присутствии щелочного металла, алкоголята, амида щелочного металла или комплексного гидрида металла. Предлагаемый способ основан на том факте, что ароматические амины целесообразнее сначала подвергать ацилированию и лишь затем алкилированию. В этом случае вышеописанный процесс протекает более гладко, чем при известных способах, по которым вначале проводят алкилирование, а затем ацилирование. Ацилирование протекает легче, поскольку первичная аминогруппа может быть ацилирована легче, чем стерически затрудненный вторичный амин. Реакция алкилирования в этом случае протекает со значительно более высокой скоростью, так как механизм ее совершенно иной. Было установлено, что кислый атом водорода, связанный с атомом азота метоксиацетанилида, замещенного в 2-, 4- и/или 6-положении, может быть замещен атомом щелочного металла. Это замещение может быть осуществлено путем взаимодействия с щелочными металлами, алкоголятами, амидами щелочных металлов или комплексными гидридами металлов. Образующиеся в результате такого взаимодействия солеподобные соединения легко реагируют с алкилгалогенидами, например метиловым эфиром ДL-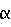 -бромпропионовой кислоты. Предлагаемый способ по сравнению с известными имеет следующие преимущества. Ацилирование анилина, замещенного в ароматическом ядре, осуществляется с помощью смеси метоксиуксусной кислоты и треххлористого фосфора. В этом случае метоксиацетилхлорид, реагирующий с анилином, образуется in situ, благодаря чему на одну стадию, а именно получение метоксиацетилхлорида, становится меньше. Ацилирование метоксиуксусной кислоты треххлористым фосфором осуществлено впервые. Указанное ацилирование проводят в среде растворителя. Предпочтительно используют ароматические растворители, такие как толуол, хлорбензол или ксилол. Ацилирование протекает в течение 0,5-1,0 ч. В качестве алкилирующего агента используют алкилгалогениды, предпочтительно эфиры галогенкарбоновых кислот, например метиловый эфир ДL-
-бромпропионовой кислоты. Предлагаемый способ по сравнению с известными имеет следующие преимущества. Ацилирование анилина, замещенного в ароматическом ядре, осуществляется с помощью смеси метоксиуксусной кислоты и треххлористого фосфора. В этом случае метоксиацетилхлорид, реагирующий с анилином, образуется in situ, благодаря чему на одну стадию, а именно получение метоксиацетилхлорида, становится меньше. Ацилирование метоксиуксусной кислоты треххлористым фосфором осуществлено впервые. Указанное ацилирование проводят в среде растворителя. Предпочтительно используют ароматические растворители, такие как толуол, хлорбензол или ксилол. Ацилирование протекает в течение 0,5-1,0 ч. В качестве алкилирующего агента используют алкилгалогениды, предпочтительно эфиры галогенкарбоновых кислот, например метиловый эфир ДL-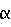 -бромпpопионовой кислоты. Температура реакции может варьироваться в пределах от 100 до 140оС, предпочтительно от 115 до 125оС. В том случае, если алкилирование проводится в присутствии алкоголята щелочного металла, выделяющийся свободный спирт можно удалять, предпочтительно непрерывно, из реакционной смеси. При осуществлении предлагаемого способа, по которому алкилирование проводится после ацилирования, добавление реагентов требует 1 ч, на завершение реакции требуется еще 30 мин, реакция при этом протекает полностью и целевой продукт может быть получен с выходом 90% Метиловый эфир ДL-
-бромпpопионовой кислоты. Температура реакции может варьироваться в пределах от 100 до 140оС, предпочтительно от 115 до 125оС. В том случае, если алкилирование проводится в присутствии алкоголята щелочного металла, выделяющийся свободный спирт можно удалять, предпочтительно непрерывно, из реакционной смеси. При осуществлении предлагаемого способа, по которому алкилирование проводится после ацилирования, добавление реагентов требует 1 ч, на завершение реакции требуется еще 30 мин, реакция при этом протекает полностью и целевой продукт может быть получен с выходом 90% Метиловый эфир ДL-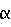 -бромпpопионовой кислоты берется лишь с двукратным избытком. Способ по изобретению по сравнению с известными имеет следующие преимущества. 1. Предложен новый способ синтеза производных метилового эфира N-фенил-N-метоксиацетил-ДL-аланина, например известного фунгицида "металаксила", по которому первичные ароматические амины вначале ацилируют, а затем алкилируют. Оба эти процесса протекают с более высокой скоростью и более высоким выходом, чем в том случае, когда вначале проводят алкилирование, а уже затем ацилирование. Ацилирование протекает легче, поскольку первичные амины ацилируются легче, чем вторичные. Алкилирование также протекает легче, поскольку взаимодействию с алкилгалогенидом по предлагаемому способу подвергается натриевая соль ацилированного амина. 2. Для ацилирования вместо метоксиацетилхлорида используется смесь метоксиуксусной кислоты и треххлористого фосфора, благодаря чему отпадает необходимость в получении, выделении и регенерации метоксиацетилхлорида. 3. При проведении ацилирования по предлагаемому способу ацилирующий агент берется в избытке 10% тогда как по известному уровню техники, когда используется метоксиацетилхлорид, для достижения достаточно высокого выхода, последний необходимо брать с 10-кратным избытком. 4. По известному уровню техники метиловый эфир ДL-
-бромпpопионовой кислоты берется лишь с двукратным избытком. Способ по изобретению по сравнению с известными имеет следующие преимущества. 1. Предложен новый способ синтеза производных метилового эфира N-фенил-N-метоксиацетил-ДL-аланина, например известного фунгицида "металаксила", по которому первичные ароматические амины вначале ацилируют, а затем алкилируют. Оба эти процесса протекают с более высокой скоростью и более высоким выходом, чем в том случае, когда вначале проводят алкилирование, а уже затем ацилирование. Ацилирование протекает легче, поскольку первичные амины ацилируются легче, чем вторичные. Алкилирование также протекает легче, поскольку взаимодействию с алкилгалогенидом по предлагаемому способу подвергается натриевая соль ацилированного амина. 2. Для ацилирования вместо метоксиацетилхлорида используется смесь метоксиуксусной кислоты и треххлористого фосфора, благодаря чему отпадает необходимость в получении, выделении и регенерации метоксиацетилхлорида. 3. При проведении ацилирования по предлагаемому способу ацилирующий агент берется в избытке 10% тогда как по известному уровню техники, когда используется метоксиацетилхлорид, для достижения достаточно высокого выхода, последний необходимо брать с 10-кратным избытком. 4. По известному уровню техники метиловый эфир ДL-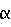 -бромпропионовой кислоты берется с трехкратным избытком. По предлагаемому способу алкилирующий агент берется лишь с 2-кратным избытком, а продолжительность реакции составляет 90 мин по сравнению с 18 ч в случае известного способа. При этом выход целевого продукта на 10% выше. 5. По предлагаемому способу и ацилирование, и алкилирование можно осуществлять без выделения образующихся промежуточных соединений. Более того, проведение процесса таким образом даже более предпочтительно. Этот момент также является существенным отличием предлагаемого способа, поскольку в случае известных способов промежуточные соединения должны быть выделены и очищены. 6. Предлагаемый способ является благоприятным с точки зрения охраны окружающей среды от загрязнений. При его осуществлении в качестве побочных продуктов образуются только полифосфорная кислота и бромид натрия, которые с успехом могут использоваться в других процессах, поскольку они содержат лишь очень незначительное количество примесей. Количества маточного ксилольного раствора, образующегося в конце процесса, очень незначительны, и он может быть сожжен. При осуществлении данного способа не образуется сточных вод. П р и м е р 1. Получение N-метоксиацетил-2,6-диметиланилина. В колбу емкостью 1 дм3, снабженную мешалкой, капельной воронкой, термометром и обратным холодильником, загружают 500 см3 толуола, 121,9 г (1,0 М) 2,6-диметиланилина и 99,0 г (1,1 М) метоксиуксусной кислоты, затем в течение 1 ч при перемешивании добавляют по каплям 50,6 г (0,37 М) треххлористого фосфора, растворенного в 100 см3 толуола, и кипятят смесь в течение 90 мин с обратным холодильником, отводя из нее газообразный хлористый водород. Реакционную смесь затем охлаждают до комнатной температуры и промывают водой. Толуол отгоняют, а следы растворителя удаляют в вакууме. В качестве остатка получают желтоватый кристаллический продукт. Т.пл. 64оС. Выход 183 г (94,6%). П р и м е р 2. Получение N-(2,6-диметилфенил)-N-(метоксиацетил)-ДL-аланина. В колбу, снабженную мешалкой, обратным холодильником, наклонным холодильником, термометром и загрузочной воронкой, добавляют 9,66 г (0,05 М) N-метоксиацетил-2,6-диметиланилина, полученного в соответствии с примером 1, 60 см3 ксилола и 16,7 г (0,1 М) метилового эфира ДL-
-бромпропионовой кислоты берется с трехкратным избытком. По предлагаемому способу алкилирующий агент берется лишь с 2-кратным избытком, а продолжительность реакции составляет 90 мин по сравнению с 18 ч в случае известного способа. При этом выход целевого продукта на 10% выше. 5. По предлагаемому способу и ацилирование, и алкилирование можно осуществлять без выделения образующихся промежуточных соединений. Более того, проведение процесса таким образом даже более предпочтительно. Этот момент также является существенным отличием предлагаемого способа, поскольку в случае известных способов промежуточные соединения должны быть выделены и очищены. 6. Предлагаемый способ является благоприятным с точки зрения охраны окружающей среды от загрязнений. При его осуществлении в качестве побочных продуктов образуются только полифосфорная кислота и бромид натрия, которые с успехом могут использоваться в других процессах, поскольку они содержат лишь очень незначительное количество примесей. Количества маточного ксилольного раствора, образующегося в конце процесса, очень незначительны, и он может быть сожжен. При осуществлении данного способа не образуется сточных вод. П р и м е р 1. Получение N-метоксиацетил-2,6-диметиланилина. В колбу емкостью 1 дм3, снабженную мешалкой, капельной воронкой, термометром и обратным холодильником, загружают 500 см3 толуола, 121,9 г (1,0 М) 2,6-диметиланилина и 99,0 г (1,1 М) метоксиуксусной кислоты, затем в течение 1 ч при перемешивании добавляют по каплям 50,6 г (0,37 М) треххлористого фосфора, растворенного в 100 см3 толуола, и кипятят смесь в течение 90 мин с обратным холодильником, отводя из нее газообразный хлористый водород. Реакционную смесь затем охлаждают до комнатной температуры и промывают водой. Толуол отгоняют, а следы растворителя удаляют в вакууме. В качестве остатка получают желтоватый кристаллический продукт. Т.пл. 64оС. Выход 183 г (94,6%). П р и м е р 2. Получение N-(2,6-диметилфенил)-N-(метоксиацетил)-ДL-аланина. В колбу, снабженную мешалкой, обратным холодильником, наклонным холодильником, термометром и загрузочной воронкой, добавляют 9,66 г (0,05 М) N-метоксиацетил-2,6-диметиланилина, полученного в соответствии с примером 1, 60 см3 ксилола и 16,7 г (0,1 М) метилового эфира ДL-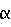 -бромпропионовой кислоты. Смесь нагревают до 120оС и добавляют к ней по каплям в течение 1 ч 20 см3 30% -ного метилата натрия, отгоняя при этом непрерывно метанол. Температура смеси не должна быть ниже 110оС. Реакционную смесь затем перемешивают в течение еще 30 мин, охлаждают до комнатной температуры, смешивают с 100 см3 воды, разделяют фазы и трижды проводят экстракцию из водной фазы ксилолом, порциями по 20 см3. Ксилольные фракции объединяют, высушивают над сульфатом натрия и отгоняют ксилол. Охлажденный осадок отверждается с образованием кристаллического вещества. Т.пл. 73,5оС. Выход 12,5-13,0 г (89,5-93,0%). П р и м е р 3. Получение метилового эфира N-(2,6-диметилфенил)-N-(метоксиацетил)-ДL-аланина из 2,6-диметиланилина, без выделения промежуточного соединения. 6,06 г (0,05 М) 2,6-диметиланилина и 4,95 г (0,055 М) метоксиуксусной кислоты растворяют в 30 см3 ксилола и к полученному раствору добавляют по каплям при перемешивании 2,6 г (0,019 М) треххлористого фосфора, растворенного в 10 см3 ксилола. По окончании добавления смесь кипятят в течение 30 мин с обратным холодильником и охлаждают до комнатной температуры. Ксилольный раствор отделяют от полифосфорной кислоты и добавляют к нему 16,7 г (0,01 М) метилового эфира ДL-
-бромпропионовой кислоты. Смесь нагревают до 120оС и добавляют к ней по каплям в течение 1 ч 20 см3 30% -ного метилата натрия, отгоняя при этом непрерывно метанол. Температура смеси не должна быть ниже 110оС. Реакционную смесь затем перемешивают в течение еще 30 мин, охлаждают до комнатной температуры, смешивают с 100 см3 воды, разделяют фазы и трижды проводят экстракцию из водной фазы ксилолом, порциями по 20 см3. Ксилольные фракции объединяют, высушивают над сульфатом натрия и отгоняют ксилол. Охлажденный осадок отверждается с образованием кристаллического вещества. Т.пл. 73,5оС. Выход 12,5-13,0 г (89,5-93,0%). П р и м е р 3. Получение метилового эфира N-(2,6-диметилфенил)-N-(метоксиацетил)-ДL-аланина из 2,6-диметиланилина, без выделения промежуточного соединения. 6,06 г (0,05 М) 2,6-диметиланилина и 4,95 г (0,055 М) метоксиуксусной кислоты растворяют в 30 см3 ксилола и к полученному раствору добавляют по каплям при перемешивании 2,6 г (0,019 М) треххлористого фосфора, растворенного в 10 см3 ксилола. По окончании добавления смесь кипятят в течение 30 мин с обратным холодильником и охлаждают до комнатной температуры. Ксилольный раствор отделяют от полифосфорной кислоты и добавляют к нему 16,7 г (0,01 М) метилового эфира ДL-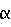 -бромпропионовой кислоты. С колбой соединяют наклонный холодильник, смонтированный вместе с обратным холодильником. Смесь нагревают до 120оС и добавляют к ней в течение 1 ч по каплям 20 см3 30%-ного (об.) раствора метилата натрия, непрерывно отгоняя из реакционной смеси метанол. Температура реакционной смеси при этом не должна быть ниже 110оС. После этого реакционную смесь перемешивают в течение еще 30 мин и затем охлаждают до комнатной температуры. Образующийся в процессе бромид натрия отфильтровывают и дважды промывают ксилолом, порциями по 10 см3. Объединенные ксилольные растворы упаривают до объема 20 см3 и охлаждают остаток до 0оС. Выпадающие кристаллы целевого продукта отфильтровывают. Т.пл. 73-74оС. Выход 13,0 г (93,0%). Дополнительное количество продукта может быть получено из маточного раствора. П р и м е р 4. Получение N-метоксиацетил-2,4,6-триметиланилина. Процесс проводят таким же образом, как это описано в примере 1, с той разницей, что в качестве исходного материала используют 2,4,6-триметиланилин. Т.пл. 88-89оС. Выход 188,85 г (92,0%). П р и м е р 5. Получение метилового эфира N-(2,4,6-триметилфенил)-N-метоксиацетил-ДL-аланина. Процесс проводят таким же образом, как это описано в примере 2, с той разницей, что в качестве исходного материала используют 10,26 г N-метоксиацетил-2,4,6-триметиланилина. В качестве целевого продукта получают вязкую маслянистую жидкость. Выход 12,9 г (88,0%). П р и м е р 6. Получение метилового эфира N-(2-этилфенил)-N-метоксиацетил-ДL-аланина. Процесс проводят таким же образом, как это описано в примере 3, с той разницей, что вместо 2,6-диметиланилина используют 2-этиланилин. Полученный целевой продукт представляет собой вязкую маслянистую жидкость. Выход 13,3 г (94,5%). П р и м е р 7. Получение метилового эфира N-(4-изопропилфенил)-N-метоксиацетил-ДL-аланина. Процесс проводят таким же образом, как это описано в примере 3, с той разницей, что в качестве исходного материала вместо 2,6-диметиланилина используют 4-изопропиланилин. Полученный целевой продукт предcтавляет cобой вязкую маcляниcтую жидкоcть. Выход 13,35 г (91,0).
-бромпропионовой кислоты. С колбой соединяют наклонный холодильник, смонтированный вместе с обратным холодильником. Смесь нагревают до 120оС и добавляют к ней в течение 1 ч по каплям 20 см3 30%-ного (об.) раствора метилата натрия, непрерывно отгоняя из реакционной смеси метанол. Температура реакционной смеси при этом не должна быть ниже 110оС. После этого реакционную смесь перемешивают в течение еще 30 мин и затем охлаждают до комнатной температуры. Образующийся в процессе бромид натрия отфильтровывают и дважды промывают ксилолом, порциями по 10 см3. Объединенные ксилольные растворы упаривают до объема 20 см3 и охлаждают остаток до 0оС. Выпадающие кристаллы целевого продукта отфильтровывают. Т.пл. 73-74оС. Выход 13,0 г (93,0%). Дополнительное количество продукта может быть получено из маточного раствора. П р и м е р 4. Получение N-метоксиацетил-2,4,6-триметиланилина. Процесс проводят таким же образом, как это описано в примере 1, с той разницей, что в качестве исходного материала используют 2,4,6-триметиланилин. Т.пл. 88-89оС. Выход 188,85 г (92,0%). П р и м е р 5. Получение метилового эфира N-(2,4,6-триметилфенил)-N-метоксиацетил-ДL-аланина. Процесс проводят таким же образом, как это описано в примере 2, с той разницей, что в качестве исходного материала используют 10,26 г N-метоксиацетил-2,4,6-триметиланилина. В качестве целевого продукта получают вязкую маслянистую жидкость. Выход 12,9 г (88,0%). П р и м е р 6. Получение метилового эфира N-(2-этилфенил)-N-метоксиацетил-ДL-аланина. Процесс проводят таким же образом, как это описано в примере 3, с той разницей, что вместо 2,6-диметиланилина используют 2-этиланилин. Полученный целевой продукт представляет собой вязкую маслянистую жидкость. Выход 13,3 г (94,5%). П р и м е р 7. Получение метилового эфира N-(4-изопропилфенил)-N-метоксиацетил-ДL-аланина. Процесс проводят таким же образом, как это описано в примере 3, с той разницей, что в качестве исходного материала вместо 2,6-диметиланилина используют 4-изопропиланилин. Полученный целевой продукт предcтавляет cобой вязкую маcляниcтую жидкоcть. Выход 13,35 г (91,0).Формула изобретения
СПОСОБ ПОЛУЧЕНИЯ МЕТИЛОВОГО ЭФИРА N-ФЕНИЛ-N-МЕТОКСИАЦЕТИЛ-D,L-АЛАНИНА ИЛИ ЕГО АЛКИЛЬНЫХ ПРОИЗВОДНЫХ общей формулы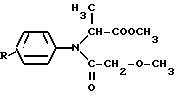 где R водород или С1 С4-алкил, исходя из соответствующего анилина, с использованием реакции алкилирования метиловым эфиром галоидпропионовой кислоты при 110 140oС в присутствии конденсирующего агента, выбранного из неорганических оснований, и реакции ацилирования с использованием метоксиуксусной кислоты, отличающийся тем, что, с целью повышения выхода, соответствующий анилин подвергают вначале ацилированию смесью метоксиуксусной кислоты, взятой в избытке 5 20% и треххлористого фосфора в среде растворителя, после чего полученное производное N-метоксиацетиланилина общей формулы
где R водород или С1 С4-алкил, исходя из соответствующего анилина, с использованием реакции алкилирования метиловым эфиром галоидпропионовой кислоты при 110 140oС в присутствии конденсирующего агента, выбранного из неорганических оснований, и реакции ацилирования с использованием метоксиуксусной кислоты, отличающийся тем, что, с целью повышения выхода, соответствующий анилин подвергают вначале ацилированию смесью метоксиуксусной кислоты, взятой в избытке 5 20% и треххлористого фосфора в среде растворителя, после чего полученное производное N-метоксиацетиланилина общей формулы 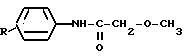 где R имеет указанные значения, непосредственно в реакционной массе или после выделения из нее подвергают алкилированию, используя 1,2-2-кратный избыток метилового эфира галоидпропионовой кислоты и органическое основание, выбранное из группы: щелочной металл, алкоголят щелочного металла, амид щелочного металла, комплексный гидрид металла.
где R имеет указанные значения, непосредственно в реакционной массе или после выделения из нее подвергают алкилированию, используя 1,2-2-кратный избыток метилового эфира галоидпропионовой кислоты и органическое основание, выбранное из группы: щелочной металл, алкоголят щелочного металла, амид щелочного металла, комплексный гидрид металла.www.findpatent.ru