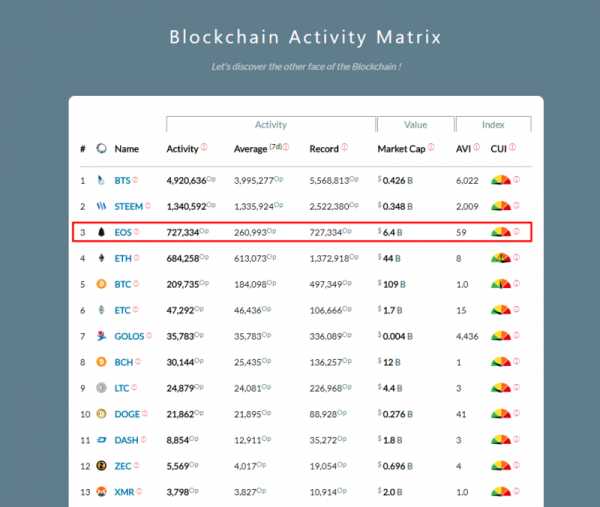
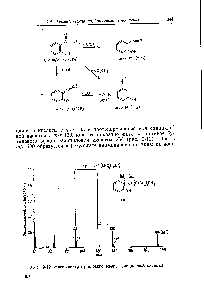
Большая Энциклопедия Нефти и Газа. Этиловый эфир хлоруксусной кислоты
Этиловый эфир - хлоруксусная кислота
Этиловый эфир - хлоруксусная кислота
Cтраница 1
Этиловый эфир хлоруксусной кислоты представляет собой бесцветную подвижную жидкость с острым запахом, напоминающим запах фруктов; раздражает слизистую оболочку. [1]
Этиловый эфир хлоруксусной кислоты применялся продажный. [2]
Этиловый эфир хлоруксусной кислоты представляет собой бесцветную подвижную жидкость с острым запахом, напоминающим запах фруктов; раздражает слизистую оболочку. [3]
Этиловый эфир хлоруксусной кислоты применялся продажный. [4]
Растворяют этиловый эфир хлоруксусной кислоты в спирту, прибавляют растертый в порошок йодистый калий и 25 куб. Реакцию ведут, по возможности, в темном месте. Через 1 - 2 часа выливают смесь в делительную воронку с 200 куб. [5]
С этиловым эфиром хлоруксусной кислоты в качестве реагента при обычных условиях реакции Фриделя - Крафтса получают продукт алкилирования - этиловый эфир фенилуксусной кислоты. [6]
Работать с этиловым эфиром хлоруксусной кислоты следует осторожно, так как он раздражает слизистые оболочки. [7]
Эквимолекулярные количества кетона и этилового эфира хлоруксусной кислоты охлаждают до 0 и при перемешивании постепенно, при исключении доступа воздуха, добавляют тонкоизмельченный порошок 1 моля этилата натрия. После двухчасового перемешивания при этой температуре реакционную смесь оставляют на 12 час. После подкисления уксусной кислотой и промывания водой до нейтральной реакции эфир глицидной кислоты отгоняют при пониженном давлении. [8]
Получают конденсацией бензальдегида с этиловым эфиром хлоруксусной кислоты по реакции Дарзана. [9]
Получают конденсацией ацетофенона с этиловым эфиром хлоруксусной кислоты по реакции Дарзана. [10]
Аналогично может быть получен хлорацетамид из этилового эфира хлоруксусной кислоты. При этом температуру поддерживают около 0, чтобы предотвратить замещение атома галогена. [11]
Получается взаимодействием 0 0-диэтилдитиофосфорной кислоты с этиловым эфиром хлоруксусной кислоты. [12]
Получается взаимодействием 0 0-диэтилдитпофосфорной кислоты с этиловым эфиром хлоруксусной кислоты. [13]
По этому методу альдегиды конденсируют с этиловым эфиром хлоруксусной кислоты. [14]
Аналогичным образом при перемешивании смеси бигуа-нида и этилового эфира хлоруксусной кислоты - в метиловом спирте можно получить с 82 % - ным выходом 2-хлорметил - 4, б-диамино-з-триазин. [15]
Страницы: 1 2 3
www.ngpedia.ru
Этиловый эфир - хлоруксусная кислота
Этиловый эфир - хлоруксусная кислота
Cтраница 2
Аналогичным образом при перемешивании смеси бигуа-нида и этилового эфира хлоруксусной кислоты в метиловом спирте можно получить с 82 % - ным выходом 2 - хлорметил4, 6-диамино - - триазин. [16]
Получают по реакции Дарзана конденсацией тетрагидро-псевдоионона с этиловым эфиром хлоруксусной кислоты и гидролизом образовавшегося глицидного эфира: Применяют как компонент парфюмерных композиций. [17]
Получается взаимодействием О, О-диэтилдитиофосфорной кислоты с этиловым эфиром хлоруксусной кислоты. [18]
Взаимодействием описанных ранее [1] аминов IV с этиловым эфиром хлоруксусной кислоты были получены эфиры аминоуксусных кислот XXXII, которые очищались через гидрохлориды. [19]
Получается этерификацией ацетилгликолевой кислоты этиловым спиртом; нагреванием этилового эфира хлоруксусной кислоты с сухим ацетатом натрия. [20]
Смесь 0 15 моля IV и 0 1 моля этилового эфира хлоруксусной кислоты в 50 мл сухого бензола кипятят 6 - 8 часов, отфильтровывают осадок и фильтрат подкисляют 10 % - ной соляной кислотой. Водный слой насыщают карбонатом натрия и экстрагируют эфиром. Экстракты сушат сульфатом натрия и после отгонки растворителя остаток перегоняют в вакууме. [21]
К смеси 38 5 г ( 314 ммоль) этилового эфира хлоруксусной кислоты Р-20 а н 37 7 г ( 314 ммоль) свежеперегнанного ацетофенона прикапывают в течение 2 ч при комн. Затем смесь перемешивают еще 2 ч при комн. [22]
Получается при этерификации ацетилгликолевой кислоты с этиловым спиртом или нагреванием этилового эфира хлоруксусной кислоты с сухой уксуснонатриевой солью. [23]
Способ его получения следующий: к раствору НОгацетофе-нона и 102 г этилового эфира хлоруксусной кислоты в 200 мл абсолютного эфира в течение 3 час. При этом выделяется аммиак и выпадает хлористый натрий. [24]
Способ его получения следующий: к раствору 110 гацетофе-нона и 102 г этилового эфира хлоруксусной кислоты в 200 мл абсолютного эфира в течение 3 час. При этом выделяется аммиак и выпадает хлористый натрий. [25]
К суспензии 10 г ( 0 48 моля) мелкораздробленного натрия в 150 мл ксилола добавляют в течение двух часов смесь 49 г ( 0 45 моля) этилового эфира хлоруксусной кислоты и 60 г ( 0 43 моля) л-хлорбснзаль-дегида. Затем к смеси добавляют воду и ксилольный слой, содержащий продукт реакции, обрабатывают, как описано выше. [26]
Сухая натриевая соль 5-окси - 2-метилбензтиазола ( полученная из 0.5 г основания и раствора 0.1 г металлического натрия в 3 мл абсолютного этилового спиртч) нагревалась с 0.74 г этилового эфира хлоруксусной кислоты при 125 - 130 в течение 20 минут. [27]
В трехгорлую колбу емкостью 500 мл, снабженную мешалкой и обратным холодильником ( рис. 3 в Приложении I; одно горло закрыто глухой пробкой), помещают раствор 24 8 г этилового эфира хлоруксусной кислоты ( синтез см. стр. Реакционную смесь слегка нагревают для инициирования реакции. Затем отфильтровывают на воронке Бюх-нера выпавший осадок NaCl и тщательно отжимают его на фильтре. Фильтрат оранжевого цвета помещают в делительную воронку и отделяют ацетоновый ( верхний) слой. Растворители отгоняют на водяной бане ( см. стр. [28]
В трехгорлую колбу емкостью 500 мл, снабженную мешалкой н обратным холодильником ( рис. 3 в Приложении I; одно горло закрыто глухой пробкой), помещают раствор 24 8 г этилового эфира хлоруксусной кислоты ( синтез см. стр. Реакционную смесь слегка нагревают для инициирования реакции. Затем отфильтровывают на воронке Бюх-нера выпавший осадок NaCl и тщательно отжимают его на фильтре. Фильтрат оранжевого цвета помещают в делительную воронку и отделяют ацетоновый ( верхний) слой. Растворители отгоняют на водяной бане ( см. стр. [29]
Реакционной смеси дают остыть, промывают ее водой, насыщений раствором NaHCO3 и раствором NaCi, а затем высушивают над Na2SO4 - После отгонки растворителя остаток перегоняют в вакууМе - получая 43 7 г ( 72 %) этилового эфира хлоруксусной кислоты ( ocnwpo но, лакриматор. [30]
Страницы: 1 2 3
www.ngpedia.ru
Хлоруксусная кислота этиловый эфир - Справочник химика 21
В реакциях винилалкиловых эфиров более высокий выход эфира получается с менее сильной кислотой. Например, при взаимодействии винилэтплового эфира с уксусной, хлоруксусной и трихлоруксусной кислотами получаются этиловые эфиры этих кис- чот с выходом 86, 57 п 30% соответственно. [c.15]
Хлордифторуксусная кислота Л-296 Хлормуравьиной кислоты этиловый эфир К-ЗЗб лХлорсульфоновая кислота И-11 Хлоруксусная кислота Р-20а Хлоруксусный альдегид Л-ЗОа Холестерин Ж-4 [c.660]Аналогично может быть получен хлорацетамид из этилового эфира хлоруксусной кислоты. Синтез лроводят при 0°С, чтобы предотвратить замещение галогена. Т.пл. 120° (вода) выход 80%. [c.87]
Этиловый эфир хлоруксусной кислоты представляет собой бесцветную подвижную жидкость с острым запахом, напоминающим запах фруктов раздражает слизистую оболочку. [c.361]
З-Хлорпропил)фенилсульфид Д-1 Хлоруксусной кислоты этиловый эфир Р-20а [c.672]
Этиловый эфир хлоруксусной кислоты получают также из трихлорэтилена путем гидролиза этилдихлорвинилового эфира [c.361]
ВьельиСегюен [87] получили 3-морфолон и 2-метил-З-морфолон с помош,ью аналогичных реакций. Этаноламин был превращен в натриевую соль путем прибавления натрия к раствору его в горячем диоксане. К раствору натриевой соли были добавлены соответственно этиловый эфир хлоруксусной кислоты, этиловый эфир а-бромпропионовой кислоты, и после 2.-часового кипячения реакционной смеси были получены с хорошими выходами 3-морфолон и 2-метил-З-морфолон соответственно. [c.425]
Клайзен [73] и Дарзан [74] показали, что эта реакция имеет общий характер при применении в качестве оснований амида и этилата натрия. По этому способу из циклогексанона и этилового эфира а-бромпропионовой кислоты образуется глицидный эфир LIV [75], из 2-диметиламинометилциклогексанона и эфира хлоруксусной кислоты—глицидный эфир LV [76]. р-Ионон также дает глицидный эфир [9]. [c.14]
Особенно эффективен в этой реакции трепг-бутилат калия при конденсации циклогексанона с этиловым эфиром хлоруксусной кислоты глицидный эфир образуется с 95%-ным выходом (СОП, 6, 99) [c.434]
Кроме того, ее можно получить из ацетилена по реакции Кучерова (см. с. 87) или окислением этилового спирта. Уксусная кислота — слабая кислота, ее р/Са = 4,75. Она довольно широко используется в химической промышленности при производстве ацетатного щелка, красителей, сложных эфиров, ацетона, хлоруксусной кислоты, уксусного ангидрида, солей и т. д. Применяется в пищевой промышленности, а также в органическом синтезе (например, в качестве ацилирующего агента). [c.150]
Составьте уравнення взаимодействия этилового эфира хлоруксусной кислоты с натрнймалоновым эфиром, гидролиза полученного вещества и последующего за этим декарбоксилирования. [c.81]
Уксусный ангидрид 435 Этиловый эфир хлоруксусной кислоты 360 [c.883]
chem21.info
Хлоруксусная кислота, эфир - Справочник химика 21
ЭФИР ЭТИЛОВЫЙ ХЛОРУКСУСНОЙ КИСЛОТЫ ЭФИР ЭТИЛЦЕЛЛОЗОЛЬВА и УКСУС К)й КИСЛОТЫ [c.195]
Затем Реберг с сотрудниками провели реакции ряда сложных эфиров молочной кислоты и спиртов жирного ряда (или простых моноэфиров гликолей) со сложными алкиловыми эфирами хлоруксусной кислоты. Эфиры хлоруксусной кислоты добавляли в таком соотношении, чтобы сумма атомов углерода алкильных радикалов в образующихся ал-килкарбонатах сложных эфиров молочной кислоты составляла от 7 до [c.677]
Как правило, высший предел эфирообразования для одной и той же реакции можно получить при более низких температурах. Например, бутен-2 с хлоруксусной кислотой образует втор.бутил-хлорацетат с выходом при комнатной температуре 86, при 51° С— 78 и при 97 С — 67 % от теоретического. Бутен-2 с уксусной кислотой при 97° С за 19 час. образует втор.бутилацетат с максимальным выходом 62%, а при 165° С, максимальный выход эфира в 50% достигается за 2 часа и остается таким в течение 24 час. [c.22]Реакции алкилирования хлоруксусной кислоты бутеном-1 и бутеном-2 протекают аналогично. При 51°С реакционная смесь после 24 час. представляет черную непрозрачную массу. При обработке продуктов реакции водой на дно цилиндра выпадает втор.бути-ловый эфир хлоруксусной кислоты в виде тяжелого масла, а над водой отслаиваются маслянистые продукты полимеризации буте-на-1. С повышением температуры до 97°С процесс полимеризации ускоряется. [c.37]
Этиловый эфир хлоруксусной кислоты представляет собой бесцветную подвижную жидкость с острым запахом, напоминающим запах фруктов раздражает слизистую оболочку. [c.361]
Данные опытов, представленные в табл. 16, нам кажется, являются весьма интересными, в особенности при сопоставлении их с данными для этой кислоты и бутена-2. При температуре 50°С алкилирование хлоруксусной кислоты бутеном-1 вначале идет быстрее, и в первые два часа выход втор.бутилового эфира [c.37]
Для исследования порядка присоединения хлор- и трихлорук-сусных кислот к пентену-2 в присутствии ВРз 0(С2Н5)2 эфиры, полученные из пентена-2 и хлоруксусных кислот, как описано выше, омылялись содой, едким калием или поташом в спиртовом пли концентрированном водном растворе многочасовым нагреванием с обратным холодильником. Образовавшиеся при этом спирты высаливались поташом и перегонялись [67а]. [c.45]
Как показал С. В. Завгородний [67а], гексен-2, въщеленный из кубовых остатков фракционированием, очень плохо алкилирует уксусную и хлоруксусную кислоты в нрисутствии катализатора ВРз 0(С2Н5)2- Основными продуктами реакции являются жидкие полимеры, а выход эфиров составляет 4—5%. [c.45]
Под действием соляной кислоты получается эфир хлоруксусной кислоты органические кислоты, взаимодействуя с диазоуксусным эфиром, образуют ацильные производные эфира гликолевой кислоты [c.358]
К смеси из 1 г 2-окси-5-метилстирола и Ъ мл 33%-ного раствора едкого натра прибавляют 1,5 г хлоруксусной кислоты. Смесь хорошо встряхивают, причем можно прибавить от 1 до 5 мл воды для растворения натриевой соли 2-окси-5-метилстирола. Реакционную смесь нагревают при 100° в течение часа, охлаждают, разбавляют 10—15 мл воды, подкисляют разбавленной соляной кислотой до кислой реакции на конго красное и экстрагируют 50 мл эфира. Эфирный раствор промывают 10 мл холодной воды и затем встряхивают с 25 мл 5%-ного раствора соды. Содовый раствор подкисляют разбавленной соляной кислотой, отфильтровывают выпавшую 2-винил-4-метилфеноксиуксусную кислоту, сушат и перекристаллизовывают из бензола. [c.170]
Разработаны методы синтеза ряда веществ с ценными прикладными свойствами на основе фракции меркаптанов С2-С5 (т. кип. 35-130°С), выделяемой при очистке газоконденсата Оренбургского месторождения. Взаимодействием этой фракции с 2-хлорэтанолом или эфирами хлоруксусной кислоты в присутствии 20%-ного раствора N301 (50-60°С, 4 ч) получены с выходами 78-90%, соответственно, [c.17]
Взаимодействием вторичного амина, содержащего дноксолановый фрагмент с эфирами моно.хлоруксусной кислоты в условиях межфазного катализа были получены третичные амины с выходом 28 /о /12,13/ [c.162]
Обе реакции являются примером а-дегидрогалогенирования. Если в качестве исходного вещества использовать эфир три-хлоруксусной кислоты, то малодоступный трет-бутоксид калия можно заменить метоксидом натрия. [c.41]
Кроме того, ее можно получить из ацетилена по реакции Кучерова (см. с. 87) или окислением этилового спирта. Уксусная кислота — слабая кислота, ее р/Са = 4,75. Она довольно широко используется в химической промышленности при производстве ацетатного щелка, красителей, сложных эфиров, ацетона, хлоруксусной кислоты, уксусного ангидрида, солей и т. д. Применяется в пищевой промышленности, а также в органическом синтезе (например, в качестве ацилирующего агента). [c.150]
Составьте уравнення взаимодействия этилового эфира хлоруксусной кислоты с натрнймалоновым эфиром, гидролиза полученного вещества и последующего за этим декарбоксилирования. [c.81]
Амиловый эфир хлоруксусной кислоты см. Амиловый эфир монохлоруксусной кислоты [c.25]
Вместо ароматических альдегидов можно с успехом применять алифатические альдегиды ила ароматические кетоны, однако алифатические альдегиды дают очень> низкие кызюды продуктов реакции. Вместо эфиров а-хлоруксусной кислоты могут1 найти применение офиры других а-хлоркислот. [c.753]
Как правило, реакция фенолятов с галоидными алкилами протекает так же легко, как с алкоголятами. Из п-нитробензилбромида получаются арил-п-нитробензоиловые эфиры, очень удобные для охарактеризования и идентификации фенолов . Подобным же образом при действии хлоруксусной кислоты (и других алифатических галоидокислот) получаются кристаллические арилоксикислоты жирного ряда, также удобные для характеристики и идентификации фенолов. [c.341]
chem21.info
Этиловый эфир - хлоруксусная кислота
Этиловый эфир - хлоруксусная кислота
Cтраница 3
Колбу заполняют сухим аргоном и к охлажденному раствору медленно ( 20 мин) прикапывают при перемешивании смесь 7 е ( 0 041 моль) 2 2 6 6-тетраметил - 4-оксопиперидин - 1-оксила и 7 58 г ( 0 062 моль) этилового эфира хлоруксусной кислоты, поддерживая температуру внутри колбы 20 - 25 С. Реакционную смесь оставляют при комнатной температуре на 19 ч, затем нейтрализуют эквивалентным количеством уксусной кислоты ( 3 55мл), основное количество спирта испаряют при пониженном давлении, а остаток выливают в 500 мл ледяной воды. Отделившуюся красную маслянистую жидкость экстрагируют эфиром. Эфирный экстракт промывают раствором бикарбоната натрия, водой и сушат над сульфатом натрия. Остаток после испарения эфира перегоняют при 6 6 - 0 7 мм рпг. После отгонки непрореагировавшего этилхлорацетата глицидный эфир перегоняется при 130 - 140 С. [31]
Можно также использовать этиловый эфир хлоруксусной кислоты, по при этом реакция осуществляется медленнее и с меньшим выходом. [32]
Истинный термодинамический стереохимический контроль встречается редко, в лучшем случае на одной или двух стадиях соответствующего стереонаправ-ленного синтеза. Это веще-ство вводят в глицидный синтез с этиловым эфиром хлоруксусной кислоты и mpem - бутилатом калия. В ходе этой реакции цыс-окталиновая система I эпимеризуется в нужную трснс-окталиновую систему глицидного эфира ( II), очевидно, в результате термодинамически контролируемого процесса. Омыление и декарбоксилирование глицидного эфира ( II) приводит к альдегиду III, в котором входящий в цикл углерод Q может легко эпимеризоваться. [33]
Ряд побочных реакций приводит к уменьшению выхода. В низкокипящей фракции всегда содержатся не вступившие в реакцию ацетофенон и этиловый эфир хлоруксусной кислоты, а также некоторое количество эфира хлоркоричной кислоты. [34]
Масло растворяется, причем остается твердый осадок, который отфильтровывают и промывают 750 мл эфира. Соединенные вместе эфирные вытяжки подвергают перегонке, чтобы удалить эфир, а оставшееся масло нагревают на паровой бане при пониженном давлении ( 35 мм), с целью освободить его от следов этилового эфира хлоруксусной кислоты. Выход триэтилового эфира афталимидо-этан - х а р-трикарбоновой кислоты после высушивания при 45 в течение 2 суток составляет 373 - 389 г ( 95 - 99 % теоретич. [35]
Если же исходить непосредственно из 1-фе-нилбигуанида, то, согласно той же методике, 53 г ( 0 30 моля) 1-фенилбигуанида растворяют в 250 мл метилового спирта, прибавляют 36 8 г этилового эфира хлоруксусной кислоты и в дальнейшем поступают, как описано выше. Выход получается одинаковым независимо от того, исходят ли из свободного основания или из его хлористоводородной соли. [36]
После окончания реакции смесь охлаждают, а затем выливают в стакан со 100 мл ледяной воды. Из стакана смесь переносят в делительную воронку, отделяют нижний водный слой, а эфирный слой нейтрализуют 5 мл насыщенного раствора кислого углекислого натрия и промывают водой до нейтральной реакции. После этого сырой этиловый эфир хлоруксусной кислоты сушат в течение 10 - 12 ч над безводным хлористым кальцием, затем собирают прибор 2 и отгоняют фракцию, кипящую при 142 - 143 С. [37]
После окончания реакции смесь охлаждают, а затем выливают в стакан со 100 мл ледяной воды. Из стакана смесь переносят в делительную воронку, отделяют нижний водный слой, а эфирный слой нейтрализуют 5 мл насыщенного раствора бикарбоната натрия и промывают водой до нейтральной реакции. После этого сырой этиловый эфир хлоруксусной кислоты сушат в течение 10 - 12 ч над безводным хлористым кальцием, затем собирают прибор 2 и отгоняют фракцию, кипящую при 142 - 143 С. [38]
После окончания реакции смесь охлаждают, а затем выли вают в стакан со 100 мл ледяной воды. Из стакана смесь переносят в делительную воронку, отделяют нижний водный слой, а эфирный слой нейтрализуют 5 мл насыщенного раствора кислого углекислого натрия и промывают водой до нейтральной реакции. После этого сырой этиловый эфир хлоруксусной кислоты сушат в течение 10 - 12 ч над безводным хлористым кальцием, затем собирают прибор 2 и отгоняют фракцию, кипящую при 142 - 143 С. [39]
После окончания реакции смесь охлаждают, а затем выливают в стакан со 100 мл ледяной воды. Из стакана смесь переносят в делительную воронку, отделяют нижний водный слой, а эфирный слой нейтрализуют 5 мл насыщенного раствора гидрокарбоната натрия и промывают водой до нейтральной реакции. После этого сырой этиловый эфир хлоруксусной кислоты сушат в течение 10 - 12 ч над безводным хлоридом кальция, затем собирают прибор 2 и отгоняют фракцию, кипящую при 142 - 143 С. [40]
После окончания реакции смесь охлаждают, а затем выливают в стакан со 100 мл ледяной воды. Из стакана смесь переносят в делительную воронку, отделяют нижний водный слои, а эфирный слой нейтрализуют 5 мл насыщенного раствора бикарбоната натрия и промывают водой до нейтральной реакции. После этого сырой этиловый эфир хлоруксусной кислоты сушат в течение 10 - 12 ч над безводным хлористым кальцием, затем собирают прибор 2 и отгоняют фракцию, кипящую при-142 - 143 С. [41]
После окончания реакции смесь охлаждают, а затем выливают в стакан со 100 мл ледяной воды. Из стакана смесь переносят в делительную воронку, отделяют нижний водный слой, а эфирный слой нейтрализуют 5 мл насыщенного раствора кислого углекислого натрия и промывают водой до нейтральной реакции. После этого сырой этиловый эфир хлоруксусной кислоты сушат в течение 10 - 12 ч над безводным хлористым кальцием, затем собирают-прибор 2 и отгоняют фракцию, кипящую при 142 - 143 С. [42]
Страницы: 1 2 3
www.ngpedia.ru
Этиловый эфир хлоруксусной - Справочник химика 21
Составьте уравнення взаимодействия этилового эфира хлоруксусной кислоты с натрнймалоновым эфиром, гидролиза полученного вещества и последующего за этим декарбоксилирования. [c.81]
Этиловый эфир хлоруксусной кислоты представляет собой бесцветную подвижную жидкость с острым запахом, напоминающим запах фруктов раздражает слизистую оболочку. [c.361]
Этиловый эфир хлоруксусной кислоты получают также из трихлорэтилена путем гидролиза этилдихлорвинилового эфира [c.361]Уксусный ангидрид 435 Этиловый эфир хлоруксусной кислоты 360 [c.883]
Аналогично может быть получен хлорацетамид из этилового эфира хлоруксусной кислоты. Синтез лроводят при 0°С, чтобы предотвратить замещение галогена. Т.пл. 120° (вода) выход 80%. [c.87]
Малоновый эфир, этиловый эфир хлоруксусной кислоты [c.177]
В свою очередь, содержание галоида в продуктах конденсации указывает на присутствие эфира -галоид-а, -ненасыщенной кислоты [4]. Часто отмечается также образование высококипящих продуктов, в том числе и смол. Последние могут образоваться за счет самоконденсации альдегидов и кетонов [40] или эфиров галоидозамещенных кислот. Так, например, этиловый эфир хлоруксусной кислоты в эфирном растворе реагирует с металлическим натрием, образуя этоксихлорацетоуксуспый эфир неизвестного строения [41]. [c.325]
ЭТИЛОВОГО эфира хлоруксусной кислоты отгоняют прн давлении 30 ММ до тех пор, пока температура бани не поднимется до 150° М не прекратится отгонка дестиллата (примечание 1). Оставшуюся массу бурого цвета охлаждают и экстрагируют эфиром (1 250 мл). Масло растворяется, причем остается твердый осадок, который отфильтровывают и промывают 750 мл эфира. Соединенные вместе эфирные вытяжки подвергают перегонке, чтобы удалить эфир, а оставшееся масло нагревают на паровой бане при пониженном давлении (35 мм), с целью освободить его от следов этилового эфира хлоруксусной кислоты. Выход триэтилового эфира ач )талимидо-этан-а,а,р-трикарбоновой кислоты после высушивания при 45° в течение 2 суток составляет 373—389 г (95—99% теоретич.) (примечание 2). [c.68]
При этой перегонке удается выделить от 490 до 536 г этилового эфира хлоруксусной кислоты (т. кип. 144—145°). [c.69]
Псевдотиогидаптоин был получен из тиомочевины и этилового эфира хлоруксусной кислоты , а также из тиомочевины и хлор-уксуснои или дихлоруксусной кислоты. [c.435]
Ряд побочных реакций приводит к уменьшению выхода. В низкокипящей фракции всегда содержатся не вступившие в реакцию ацетофенон и этиловый эфир хлоруксусной кислоты, а также некоторое количество эфира хлоркоричной кислоты. [c.517]
Этиловый эфир циануксусной кислоты может быть получен действием ц1ганистого натрия или цианистого калия на этиловый эфир хлоруксусной кислоты и действием цианистого натрия на натрие- [c.561]
chem21.info
Хлоруксусные эфиры, конденсация - Справочник химика 21
Конденсация с образованием глицидных эфиров. Конденсация альдегидов или кетонов с эфирами а-галогенокислот приводит к получению гли-цидных эфиров ( R, 55, 283). Примером может служить синтез этилового эфира метилфенилглицидной кислоты при конденсации ацетофенона с этиловым эфиром хлоруксусной кислоты в присутствии амида натрия (СОП, [c.434]
Хотя эфиры глицидных кислот и служат для технического приготовления альдегидов, однако лабораторные прописи встречаются редко. Эрленмейер мл. [1192] дает лишь очень общие указания о реакции между бензальдегидом, монохлор уксусным эфиром, натрием и спиртом в эфирном растворе. Он смешивает хлоруксусный эфир, растворенный в абсолютном эфире, с натрием и молекулярным количеством бензальдегида, прибавляет несколько капель спирта и находит, что при повышении температуры после нескольких часов стояния исчезает весь взятый натрий. После подкисления уксусной кислотой выпадают хлористый натрий и фенилглициднокислый натрий, тогда как в эфире остается эфир фенилглицидной кислоты, который можно обработать обычным способом. Конденсация проходит, во всяком случае, под действием алкоголята натрия в качестве конден- [c.423]Еще позже К. Розенмунд и Г. Дорнзафт [1195] вновь исследовали конденсацию хлоруксусного эфира с альдегидами, опираясь на работу Клайзена, однако применяя натрий, как Эрленмейер. [c.424]
Витамин А (аксерофтол) синтезируется по следующей схеме. Конденсацией 3-ионона (стр. 80) с хлоруксусным эфиром через промежуточные стадии образования хлоргидрина и глицидного эфира получается у-(2,2,6-триметнлциклогексен- [c.705]
Как известно, фтористый бор широко применяется в качестве катализатора в органическом синтезе, что объясняется его способностью к образованию промежуточных комплексов с ароматическими соединениями, обладающих активными свойствами. Так, например, Ньюланд и сотрудники [22] пользовались ВГз как катализатором при конденсации пропилена с органическими кислотами (уксусной, хлоруксусной, дихлоруксус-ной, бензойной и др.) в соответствующие эфиры. Реакцию проводили при 70° и давлении на 25 мм выше атмосферного (без катализатора эта реакция протекает лишь при высоких температурах и давлениях). [c.448]
В свою очередь, содержание галоида в продуктах конденсации указывает на присутствие эфира -галоид-а, -ненасыщенной кислоты [4]. Часто отмечается также образование высококипящих продуктов, в том числе и смол. Последние могут образоваться за счет самоконденсации альдегидов и кетонов [40] или эфиров галоидозамещенных кислот. Так, например, этиловый эфир хлоруксусной кислоты в эфирном растворе реагирует с металлическим натрием, образуя этоксихлорацетоуксуспый эфир неизвестного строения [41]. [c.325]
Этиловый эфир р, 5-пентаметиленглицпдной кислоты был по.тучеп конденсацией циклогексанона с этиловым эфиро.м хлоруксусной кислоты, причем в присутствии этилата натрия выход составлял 65 а в присутствии натрия в ксилоле —50% В описанной выше методике в качестве конденсирующего агента применяется трег-бутилат калия [c.100]
Н) пиридонов получаются при конденсации вицинальных аминонитрилов с галогенангидридами метоксиуксусной [302], хлоруксусной кислот [303], малоновым [304] и циануксусным эфирами [Зи5]. [c.50]
Очевидно, что в качестве второго компонента в этой реакции могут применяться различные типы реагентов. В одном из вариантов рассматриваемого метода при получении глицидного эфира ЬУ1 [77] в конденсацию с циклогексаноном вместо эфира хлоруксусной кислоты был введен эфир п-толуолсульфонилуксусной кислоты [c.15]
Эфиры тиоиндоксил-2-карбоновых кислот можно получать действием дымящей серной кислоты на этиловый эфир бензоилуксусной кислоты [59] или конденсацией калиевой соли сульфобензойной кислоты с этиловым эфиром моно-хлоруксусной кислоты с последующим замыканием цикла по способу Дикмана [87]. Этот путь получения с льфонов 2-замещенных тиоиндоксилов является, очевидно, наиболее общим [88]. [c.121]
В конденсацию кроме ацетоуксусного эфира вступают также различные замещенные ацетоуксусные эфиры. Кумарины образуются при применении а-метил-, этил-, пропил-, бутил-, аллил- [62, фенил-, бензил- [63] и п-метокси-фенилацетоуксусных эфиров [64]. В случае реакционноспособных фенолов кумарины всегда получаются более или менее легко [47а]. При использовании же менее активных фенолов введение в ацетоуксусный эфир а-алкильных групп понижает выход кумарина степень снижения выхода зависит от величины присутствующей в а-положении алкильной группы [55]. Этиловый эфир хлоруксусной кислоты реагирует подобно ацетоуксусному эфиру [65]. [c.140]
Конденсация метилнонилкетона с эфиром хлоруксусной кислоты по реакции Дарзана с последующим гидролизом глицндного эфира. [c.24]
Получают по реакции Дарзана конденсацией тстрагидро-псевдоионона с этиловым эфиром хлоруксусной кислоты и гидролизом образовавшегося глицвдного эфира [c.26]
Получают конденсацией бензальдегида с этиловым эфиром хлоруксусной кислоты по реакции Дарзана. [c.174]
Имеется много технологических схем химического синтеза витамина А. Одна из них связана с конденсацией р-ионона с эфирами хлоруксусной кислоты. Схематически процесс можно представить следующим образом. [c.97]
Другой способ получения эфиров глицттдпых кислот состоит в конденсации альдегидов или кетонов с эфирами галоидокислот, например с эфиром хлоруксусной кислоты, в присутствии амида натрия (Дарзан, Клайзен) [c.126]
Реакция Дарзана . — Одним из примеров этой реакцин (1904) является присоединение этилового эфира хлоруксусной кислоты по карбонильной группе ацетофенона под влиянием сильного основания (особенно эффективен, как и в конденсации Штоббе, трет-бутил ат калия). Образующийся вначале хлоргидрин (I) необратимо циклизуется в а,р-эпоксиэфир II, называемый глицидным эфиром (этиловый эфир 3-фенил-р-метилглицидной кислоты). Затем сложноэфирную группу омыляют и нагревают глицидную кислоту 1П с разбавленной минеральной кислотой. При этом окисное кольцо раскрывается, и кислота декарбоксилируется с образованием альдегида V [c.568]
Реактив Жирара Т , используемый для выделения карбонильных соединений, является гидразидом, содержащим четвертичную аммониевую группу. Его получают конденсацией триметиламина, этилового эфира хлоруксусной кислоты и гидразина (СОП, 2, 100 выход 89%) [c.370]
Особенно эффективен в этой реакции трепг-бутилат калия при конденсации циклогексанона с этиловым эфиром хлоруксусной кислоты глицидный эфир образуется с 95%-ным выходом (СОП, 6, 99) [c.434]
Синтез альдегида Си по реакции Дарзана. При конденсации р-ионона о метиловым эфиром хлоруксусной кислоты в присутствии метнлата натрия идет образование альдегида Си- [c.679]
chem21.info