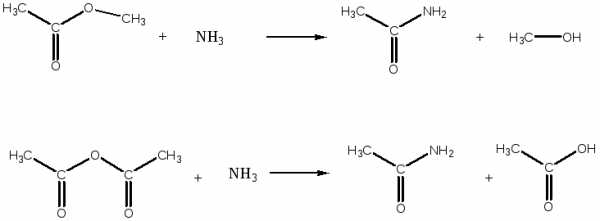
- Полный этиловый эфир бутандиовой кислоты из бутандиовой кислоты. Этиловый эфир этановой кислоты
- Полный этиловый эфир бутандиовой кислоты из бутандиовой кислоты
- полный амид бутандиовой кислоты из полного метилового эфира той же кислоты
- метилацетат из соответствующей карбоновой кислоты и ангидрида
- ацетамид из соответствующих функциональных производных: сложного эфира и ангидрида
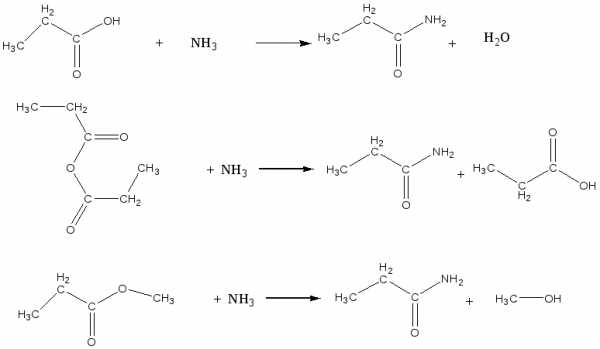
- метилацетат по реакции этерификации
- сложный эфир из бутановой кислоты и этилового спирта
- пропанамид из различных ацилирующих агентов: кислоты, ангидрида, сложного эфира
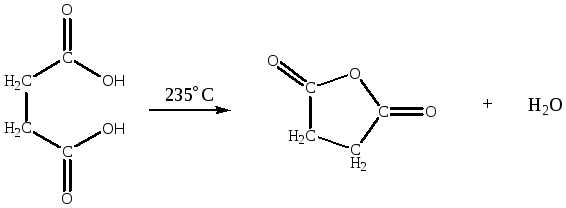
- ангидриды бутановой и бутандиовой кислот из соответствующих кислот
Механизмы реакций:
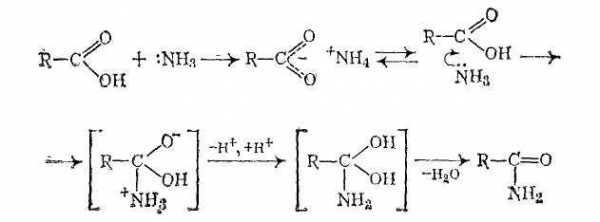
При нагревании сухих аммониевых солей карбоновых кислот происходит их разложение на исходные вещества, после чего аммиак нуклеофильно атакует атом углерода карбонильной группы:
В отсутствие катализаторов реакция этерификации протекает очень медленно, поскольку на атакуемом атоме углерода карбоксильной группы дефицит электронной плотности невелик из-за +М-эффекта группы ОН. Поэтому реакцию этерификации проводят в присутствии катализаторов — минеральных кислот (h3SO4, газообразныйHCl, фосфорная кислота) Эти вещества протонируют атом кислорода карбонильной группы и тем самым увеличивают частичный положительный заряд на атакуемом атоме углерода.
Реакции свободных карбоновых кислот не могут катализироваться основаниями, так как образуются карбоксилат-анионы, не обладающие карбонильной активностью.
Роль катализаторов в реакции этерификации играют ионы водорода.
Механизм реакции можно представить следующим образом:
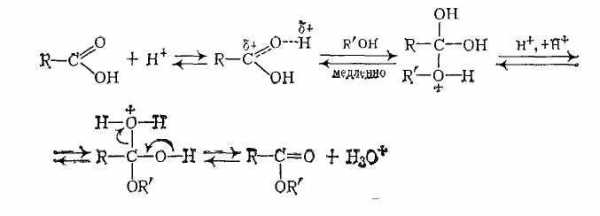
Обычно реализуется тетраэдрический механизм AAC2.
Общие схемы механизмов.
Превращения производных карбоновых кислот могут быть изображены в соответствии с общими схемами следующим образом:
Катализируемые кислотами реакции проходят через аналогичные промежуточные продукты:
Для заместителей с большой основностью (X=Nh3, ОН, OR) сначала происходит протонирование соединения II, а затем отщепление НХ с образованием карбений-оксониевого иона:
9.Напишите уравнения реакций гидролиза:
- метилацетата
- этилового эфира пропановой кислоты
- N-метиламида уксусной кислоты
- метилбутаноата
Опишите механизмы реакций. В какой среде они протекают?
Решение
- Метилацетат
- Этиловый эфир пропановой кислоты
- N-метиламид уксусной кислоты
- Метилбутаноат
Все реакции могут протекать как в кислой, так и в щелочной среде.
Механизм гидролиза сложных эфиров при кислотном катализе:
Механизм гидролиза (омыления) сложных эфиров при основном катализе:
Реакция протекает необратимо, так как образуется соль кислоты.
Механизм гидролиза амидов карбоновых кислот, аналогичен механизмам гидролиза сложных эфиров.
Реакции гидролиза амидов, катализируемые как кислотами, так и основаниями, по существу, необратимы, так как в обоих случаях образуются соли. В случае основного катализа осуществляется механизм ВАС2.
10. Напишите уравнения следующих окислительно-восстановительных реакций:
- окисление пропанола-2
- ОВР в системе гидрохинон - хинон
- ОВР в системе молочная кислота - пировиноградная кислота
- окисление этанола
- окисление бутанола
- восстановление бутанола
- ОВР в системе цистеин - цистин
- ОВР в системе яблочная кислота - щавелевая кислота
- восстановление бутендиовой кислоты
- йодоформная проба для ацетона, ацетальдегида, бутанола
какой кофермент принимает участие в ОВР в организме? В чём заключается принцип его действия.
Решение
- окисление пропанола-2
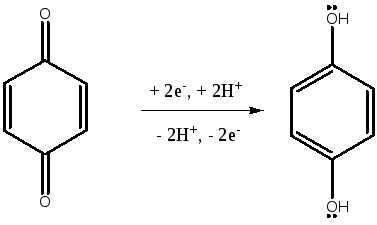
- ОВР в системе гидрохинон - хинон
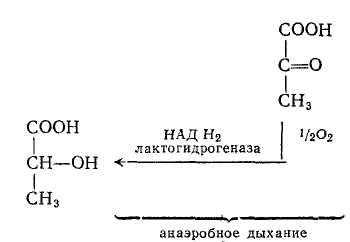
- ОВР в системе молочная кислота - пировиноградная кислота
При анаэробном дыхании протекает восстановление пировиноградной кислоты в молочную.
- окисление этанола
- окисление бутанола
- восстановление бутанола
- ОВР в системе цистеин - цистин
- ОВР в системе яблочная кислота - щавелевая кислота
Протекает в организмах.
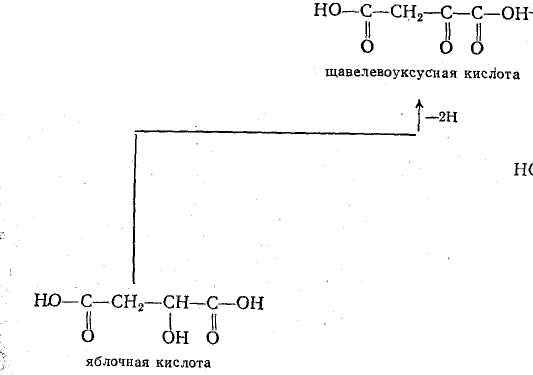
- восстановление бутендиовой кислоты
- йодоформная проба для ацетона, ацетальдегида, бутанола?
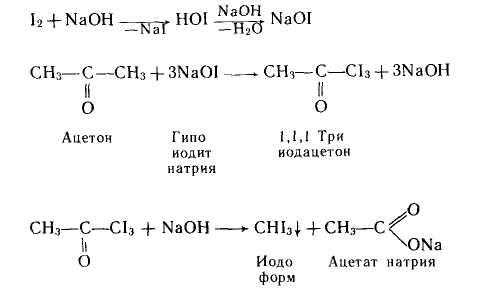
Аналогично реагирует ацетальдегид.
КОФЕРМЕНТЫ орг. прир. соед., необходимые для осуществления каталитич. действия ферментов.
Никотинамидные К. - коферментная форма витамина ниацина. К этой группе К., универсальных по распространению (они найдены буквально во всех живых клетках) и биол. роли, относятся НАД (ф-ла I; R = Н) и никотинамидадениндинуклеотидфосфат, или НАДФ [I; R = РО(ОН)2], а также восстановленные (по пиридиновому кольцу) формы этих соед. (соотв. НАДН и НАДФН).Наиб. важная биохим. ф-ция этих К.-их участие в переносе электронов и водорода от окисляющихся субстратов к кислороду в клеточном дыхании. При участии НАД или НАДФ, связанных прочно или легко диссоциирующих, ферменты дегидрогеназы (напр., алкогольдегидрогеназа, глутаматдегидрогеназа) катализируют обратимое превращ. спиртов, гидроксикислот и нек-рых аминокислот в соответствующие альдегиды, кетоны или кетокислоты.
Флавиновые К.-коферментная форма витамина рибофлавина. Среди оксидоредуктаз дыхательной цепи, участвующих в переносе электронов и водорода.
Главная ф-ция флавиновых К. - перенос электронов (водорода) в окислит.-восстановит, цепи от НАДН и янтарной к-ты к цитохромам. Флавопротеиды катализируют также многочисл. р-ции, механизм к-рых включает стадию одноэлектронного переноса; окисление восстановл. формы амида липоевой к-ты, синтез кобамидного кофермента из АТФ и витамина В12, окисление глюкозы и др.
studfiles.net
Кислота, этиловый эфир синтез - Справочник химика 21
Синтез этиловых эфиров нафтеновых кислот. Этиловые эфиры нафтеновых кислот синтезировались согласно методике, основанной на этерификации калиевых солей нафтеновых кислот диэтилсульфатом [116], т. е. по реакции [c.112]
Спирт этиловый - растворитель, сырье для синтеза дивинила, уксусной кислоты, ацетальдегида, этилацетата, этилового эфира, хлороформа и т.д. [c.112]
Последний пример уже не является асимметрической деструкцией, как все предыдущие это настоящий асимметрический синтез. Это относится и к другой реакции — гидрированию этилового эфира а-фенилкоричной кислоты [c.154]
Аналогичным образом из этилового эфира фенилуксуснои кислоты и диэтилоксалата-Со авторы синтеза получили следующие соединения этиловый эфир этоксалил-Сг -фенилуксусной кислоты, этиловый эфир фенилмалоновой-С кислоты и фе-нилмалоиовую сГ кислоту, т. пл. 162—165° (разл.). Декарбоксилирование полученной кислоты при температуре 163,0° сопровождается изотопным эффектом, равным 8,8 1,8%. [c.119]
Синтез из о-оксибензиловых спиртов. При нагревании о-оксибензиловых спиртов с ненасыщенными соединениями при 180 — 220° образуются хроманы (LXVII —LXIX) [71]. В этой конденсации были использованы стирол, кротоновая кислота, этиловый эфир малеиновой кислоты, аллиловый эфир капроновой кислоты, а-терпинеол, олеиновая кислота, абиетиновая кислота, этиловый эфир фенилпропиоловой кислоты [71], метилциклогексен, дигидро-мирцен и каучук [72]. Основным ограничением рассматриваемого синтеза являются температуры кипения ненасыщенных соединений, так как образующаяся при конденсации вода должна непрерывно удаляться. [c.309]
Исследованы два метода синтеза смол путем одновременной загрузки мочевины, формалина и бутанола с последующим обезвоживанием смолы по окончании реакции и путем предварительной конденсации мочевины и формальдегида в нейтральной или щелочной среде с последующей этерификацией полученных метилолмочевин бутанолом в кислой среде. Исследовано также влияние основных факторов производственного процесса на свойства смол и покрытий на их основе. Установлено, что вязкость смолы зависит не только от степени конденсации,, но и в значительной мере от содержания метилольных групп евз В патентах приводятся различные лаковые композиции совмещенных с алкидными смолами мочевиноформальдегидных смол композиция для покрытий, образующая при отверждении твердые, глянцевые эластичные пленки (20—70% алкидной смолы, 10—70% мочевиноформальдегидной смолы и -10— 70% латекса синтетического полимера, например, полистирол, поливинилхлорид и др.) лакокрасочные покрытия с повышенной стойкостью к действию дезинфицирующих сред из глифталевых мочевиноформальдегидных смол и полимеров дивинилацетилена бензостойкие покрытия горячей сушки из мочевиноформальдегидных смол в сочетании с алкидными смолами алкидномочевинные лаки кислотного отверждения с применением алкилового эфира фосфорной кислоты (этиловый эфир) и алкидно-карбамидный лак холодной сушки для отделки футляров радиоприемников . [c.372]
Симметричные и несимметричные карбоцианины с алкильными или другими заместителями в метиновой цепи, полученные несколькими способами, являются ценными сенсибилизаторами. Брукер и Уайт показали, что при нагревании соединения I с пиридином и триэтиламином можно с 56%-ным выходом получить тиакарбоцианин, в молекуле которого метильная группа связана со средней метиновой группой центральная группа =С—СНз — образуется за счет разрушения тиазолового кольца в соединении I. В другом синтезе симметричных карбоцианинов с алкильной группой, связанной со средней метиновой группой, предусматривается замена этилового эфира ортомуравьиной кислоты этиловым эфиром орто-уксусной кислоты и подобными эфирами для конденсации соединения типа I однако не все подобные четвертичные соли вступают в такую реакцию. Для получения несимметричных карбоцианинов типа XIV соединение I обрабатывают хлористым ацетилом в пиридине, и полученный продукт (XII) конденсируют с четвертичной солью типа XIII в уксусном ангидриде при этом образуется цианиновый краситель XIV. [c.1326]
ROH-i-RO O l (см. Хлоругольной кислоты этиловый эфир). В применении к бензиловому спирту реакция дает продукт, известный как карбобензоксихлорид, который широко используется в синтезе пептидов. Видоизмененная 12] оригинальная методика Берг-манна и Зерваса [3] состоит в следующем. Во взвешенную колбу, содержащую 500 г толуола, при охлаждении льдом пропускают фосген до тех пор, пока привес не достигнет 1,1 моля (1 шс). Затем при осторожном встряхивании и охлаждении до 0° вводят бензиловый спирт (1 моль) и раствор оставляют на 2 час. Упаривание при пониженном давлении (60°) дает 200—220 г раствора, содержащего 155— 160 г карбобензоксихлорида, который используется для получения N-карбобензоксиаминокислот. [c.77]
Днаамещенные циклопентаны. Синтез дизамещенных циклопентанов уже более сложен. Получение углеводородов этого строения можно осуществлять несколькими путями. Одним из наиболее старых методов является хорошо известная конденсация этилового эфира адипиновой кислоты с получением карбэтоксициклопентанона [1]. Однако карбэтоксициклопеп-тапон алкилируется удовлетворительно лишь иодистым метилом, что ограничивает синтетические возможности этой реакции. Более широкие возможности получения 1,2-дизамещенных циклопентанов заключены в реакции, разработанной Платэ и Мельниковым [2] [c.251]
Интересно отметить, что подобная же реакция была замечена в начале развития Zn-органического синтеза А. П. Бородиным, который при действии на этиловьи эфир бензо11ной кислоты Zn( 2H5)2 обнаружил образование -бутана [17] [c.226]
Различные кобальтовые и медные соли [365] сульфоуксусной и сульфопропионовой кислот, включая ряд комплексных соединений, содержащих пиридин, послужили объектом детального исследования. Вследствие различия в кислотности сульфо- и карбоксильной групп, можно предполагать, что кислые соли являются сульфокислыми, а не уксуснокислыми. Обычные соли сульфоуксусной кислоты получены различными исследователями при изучении ее синтеза и реакций. При взаимодействии пятихлористого фосфора С натриевой солью кислоты происходит одновременно хлорирование [366] и образование хлорангидрида. Из сухой серебряной соли и иодистого эти.ла получается [325а, 367] диэтиловый эфир кислоты, который разлагается при перегонке. Непосредственным действием спирта кислота превращается в моно-этиловый эфир НОзЗСНгСООСаН [322]. [c.166]
При нагревании 8-цианэтилового эфира л-толуолсульфокислоты (до 80—120°) с углекислым калием происходит разложение [219а] с образованием нитрила акриловой кислоты с выходом 7а%. Еще более высокий выход получается при аналогичном синтезе этилового эфира акриловой кислоты [c.366]
Исходным соединением в синтезе служил 5-бромпентан-1-ол (2), взаимодействие тетрагидропиранилового эфира которого 3 по реакции Гриньяра с акролеином дало ключевой синтон — алкеновый вторичный спирт 4. Термическая перегруппировка Кляйзена гладко протекает при нагревании аллилового спирта 4 с триэтилортоацетатом в присутствии каталитических количеств пропионовой кислоты. После снятия тетрагидропиранильной защиты получен этиловый эфир 10-гидрокси-4Е-деценовой кислоты (5). Далее спирт 5 действием пири-динийхлорхроматного комплекса окислен в соответствующий альдегид 6, который был вовлечен в реакцию Виттига с фосфорным илидом, [c.23]
Разнообразные асимметрические синтезы данного типа многократно использовались для получения оптически активных аминокислот. Высокого оптического выхода удалось добиться при проведении таких синтезов с помощью диастереомерных металлкарбонилиминных комплексов [137]. Реакция (—)-а-фенилэтиламина с этиловым эфиром глиоксиловой кислоты и Ре2(С0)э дает два диастереомерных комплекса ЬУИ [c.146]
Объектом синтеза служил этиловый эфир а-бромпро-пионовой кислоты, обладающий круговым дихроизмом в ультрафиолетовой области спектра ( макс 245 нм). Освещая этот эфир циркулярно-поляризованным светом с длиной волны 280 нм, Кун и Браун обнаружили у оставшегося неразложе-ным эфира слабое вращение (до 0,05°). Более значительного эффекта удалось добиться в аналогичном опыте с диметил-амидом азидопропионовой кислоты. Здесь величина циркулярного дихроизма при 290 нм составляет 2—3% оптическое вращение остатка до 1,04°. Несмотря на малые углы вращения, нет никакого сомнения в том, что оптическая акгивность возникла именно в результате действия циркулярно-поляризованного света, а не под влиянием каких-то случайных причин. Доказательством этого служит тот факт, что при перемене на обратный знака поляризации используемого света менялся на обратный и знак вращения остатка. Таким образом, работы Куна и Брауна доказали возможность осуществления асимметрической деструкции под действием циркулярно-поляризованного света. [c.156]
chem21.info
Уравнение получения этилового эфира бутановой кислоты Составьте уравнение получения бутановой кислоты
Сложные эфиры получаются с хорошим выходом при насыщении смеси исходного спирта и кислоты газообразным HCl, напр. C2H5OH + HOOCC3H7 = C2H5OOCC3H7 + h3O
спирт + кислота = эфир + вода
h4C-Ch3-Ch3-COOH + C2H5OH → h4C-Ch3-Ch3-CO-O-C2H5 + h3O
C2H5OH+C3H7COOH -- C3H7COOC2H5+h3O
touch.otvet.mail.ru
Этиловый эфир - кислота - Большая Энциклопедия Нефти и Газа, статья, страница 3
Этиловый эфир - кислота
Cтраница 3
Известен этиловый эфир тетратиоортоугольной кислоты. [31]
Применялся этиловый эфир ацетамидциануксусной кислоты, содержащий радиоактивный В этом опыте применялся метиловый эфир циануксусной кислоты. [32]
Поскольку этиловый эфир N-фенилформимидовой кислоты 64 приготовляется из анилина и ортомуравьиного эфира в условиях кислотного катализа и перегруппировывается в N-этилформани-лид 65 тоже в присутствии кислот, то оказывается возможным получить анилид 65 в одну стадию из анилина и ортомуравьиного эфира, без выделения имидоэфира. Анилид 65 быстро и с хорошим выходом гидролизуется до N-этиланилина. [33]
Поскольку этиловый эфир N-фспилформимидошй кислоты 64 приготовляется из анилина и ортомуравьиного эфира в условиях кислотного катализа и перегруппировывается в N-этилфорыяии-лид 65 тоже в присутствии кислот, то оказывается возможным получить аи и лид 65 и о шу стадию из анилина и ортомуравьиного эфира, бед выделении имидоэфира. Анилид 65 бистро и с хорошим выходом гидролизуется до N-этил анилина. [34]
Нагревание этилового эфира 2-хинолилакриловой кислоты с 2 3-диметилбутадиеном в ксилоле приводит к эфиру (2.518), который превращается в соединение (2.519) при дегидрировании с применением палладия, осажденного на угле. [35]
Метилированием этилового эфира тетраацетилглюкозидогалловой кислоты Фишер и Бергман 19 доказали, что в галловой кислоте гидроксил, находящийся в пара-положении, связан с остатком сахарида. [36]
Образование этилового эфира N-этилникотиновой кислоты ( IX) обусловлено алкилирующим действием спирта, применяющегося в качестве растворителя. Этот побочный продукт не образуется, если восстановление проводить в метилциклогексане или диоксане; в этих растворителях восстановление протекает более полно. [37]
Из этилового эфира пропионилацетоуксусной кислоты они получили фенилгидразон, который образуется при отщеплении пропионильной группы. При изучении реакций расщепления несимметрических 1 3-дикетонов типа RCOCh3COR Хаузер, Суо-мер и Ринглер [23] обнаружили зависимость между относительными выходами кислот RCOOH и R COOH и скоростями омыления их этиловых эфиров, хотя в случае чисто алифатических соединений эта зависимость строго не соблюдается. [38]
Из этилового эфира р-бромпропионовой кислоты и набьггк йй в: атрия в абсолютном спирте образуется этЕЛОВЫЙ эфир р-этоксипропиояовой кислот. [39]
Получение этилового эфира я-оксимииокапроновой кислоты из диэтилового эфира к-бутилмалоновой кислоты [8], 64 9 г ( 0 3 моля) диэтилопого эфира н-бутилмалоновой кислоты помещают в колбу емкостью 500 мл, снабженную мешалкой с ртутным затвором, капельной воронкой м охлаждаемым ледяной водой холодильником, защищенным осупште-лыгой трубкой. [40]
Синтез этилового эфира дифенилфосфинистой и дифенилфосфииил-уксусной кислоты проводят в токе сухого азота. [41]
Так как этиловый эфир диэтоксиметилмалоновой кислоты трудно отделить перегонкой от этилового эфира этоксиметилекмало-новой кислоты, то необходимо внимательно следить при перегонке не столько за изменением температуры кипения, сколько за изменением показателя преломления. [42]
Анестезин ( этиловый эфир 4-аминобензойной кислоты) так же, как и новокаин ( прокаин, 2-диэтиламиноэтиловый эфир той же кисло ты), являются анестетиками, особенно широко применяется последнее соединение. [43]
Винпоцетин - этиловый эфир аповинкаминовой кислоты относится к группе лекарственных веществ, избирательно действующих на сосудистую систему головного мозга. Препарат усиливает мозговой кровоток без заметного влияния на общее кровоообращение, улучшает микроциркуляцию, уменьшает агрегацию тромбоцитов, облегчает передачу кислорода тканям, является активатором мозгового метаболизма. [44]
Так как этиловый эфир ацетиламиноциануксусной кислоты вполне доступен и сравнительно недорог, этот метод приемлем для синтезов в небольших лабораторных масштабах. Не ясно, имеет ли способ нитрозирования и восстановления этилцианацетата [122] преимущество перед нитрозированием и восстановлением уже полученных пиримидинов. Изучение конденсации этилового эфира ацетиламиноциануксусной кислоты с другими реагентами, а именно с тиомочевиной, алкилтиомочевинами, 1 3-диметилмочевиной и формамиди-ном, показало широкие возможности применения этого реагента в синтезе пуринов. Аминогруппа, необходимая в положении 5 пиримидинового кольца, может быть получена восстановлением 5-нитрогруппы [100, 123-131] или 5-бензолазогруппы [115, 131-135], введенных в пиримидиновый цикл путем сочетания с солями диазония. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
Антраниловая кислота этиловый эфир - Справочник химика 21
В качестве активных веществ в этих рецептурах применяются ментоловые эфиры салициловой и антраниловой кислот, метиловый эфир к-диметиламинобензойной кислоты, а также бензиловый эфир салициловой кислоты [82]. В аэрозольный состав их включают либо в виде масляного, либо в виде спиртового раствора. В качестве растворителей (носителей) активных веществ применяются минеральное масло и этиловый спирт. Средства для загара, выдаваемые из упаковки в виде жидкой струи, обычно содержат [25] [c.117]
Существенный недостаток средств для загара на основе этилового спирта заключается в том, что в его присутствии эфиры салициловой и антраниловой кислот образуют эфиры этих кислот, обладающие сильным запахом и раздражающие глаза при попадании состава на лицо [80]. [c.120]
Фталевый ангидрид имеет чрезвычайно большое промышленное значение. Ои служит ис. одным материалом для синте а антрахинона, многочисленных родаминовых и флуоресцеиновых красителей, кубовых красителей, фенолфталеина и т. д. Кроме того, пз фталевого ангидрида через фталимид и антраниловую кислоту получают индиго (ср. стр. 657 и 696). И фталевого ангидрида и глицерина получают растворимые в ацетоне, 1го нестойкие по отношению к воде и скусственные смолы — г лифта л и, в молекуле которых остатки фта-лево11 кпслоты и глицерина связаны в виде сложных эфиров в длинные, частично разветвленные цени, Метиловый, этиловый, бутиловый и высшие эфиры фталевой кислоты широко применяются. в качестве добавок к искусственным смолам для увеличения их пластичности. Метиловый эфир фталевой кислоты применяется также в качестве средства для отпугивания насекомых. [c.653]
При этом следует отметить, что для антраниловой кислоты 65 циклизация идет при любых заместителях в 3-ем положении кольца тиолактимного эфира, тогда как этиловый эфир 2-амино-4,5-тетраметилентиофен-2-карбоновой кислоты 66 приводит к продукту циклизации только в случае ге и-диметильной группы. При увеличении объема заместителя в 3-ем положении реакция протекает только по аминогруппе без дальнейшей циклизации. [c.507]
Выпавшие кристаллы фенилового эфира антраниловой кислоты перекристаллизовывают из этилового спирта. Выход равен 1,5 г, что составляет 40% от теоретического т. пл. 70 . [c.159]
Конденсация антраниловой кислоты [1220], этилового эфира 3-аминоизоникотиновой кислоты [1220, 1221] и некоторых их производных с бензоилцианамидом приводит к 2-амипо-3-бензоил-4(ЗН)-хина-золонам и пиридо[3,4- 2 ]пиримидин-4(ЗН)-онам [c.130]
При нагревании ацетофенона и антраниловой кислоты до 120—130° в течение 3 дней образуется 2-фенил-4-оксихинолин [183]. Однако Фьюзон и Бур-несс [187] получили 2-фенил-4-оксихинолин-с выходом, превышающим 80%, конденсацией этилового эфира антраниловой кислоты с диэтилкеталем ацетофенона. [c.43]
При кляйзеновской конденсации этиловых эфиров антраниловой и уксусной кислот с последующим замыканием цикла хинолина образуется 2,4-диоксихинолин [189]. [c.44]
Производные хинолин-З-карбоновой кислоты можно получить также в результате реакции Ниментовского (стр. 42) [672]. Интересно отметить, что продукт конденсации малонового эфира с метиловым эфиром антраниловой кислоты является не этиловым, а метиловым эфиром [672а]. [c.151]
По новой методике [2] антраниловую кислоту диазотируют в разб. серной кислоте и отфильтрованный раствор прибавляют к раствору иодистого калня в разб. серной кислоте. Сырую кислоту (92%), окрашенную в коричневый нвет, превращают в этиловый эфир с т. кип. 150—15Г/Ь3 мм (71%), который при омылении едким кали в этаноле дает чистую кислоту (т. пл. 163°) с почти теоретическим выходом. [c.42]
Указанным выше способом определите класс растворимости для каждого из следующих соединений 1) толуола, 2) бензило-вого спирта, 3) этилового эфира уксусной кислоты, 4) ацетани-лида, 5) сахарозы, 6) этилового эфира бензойной кислоты, 7) ди-метиланилина, 8) фталимида, 9) бензонитрила, 10) антраниловой кислоты. Полученные результаты внесите в протокол, как показано в табл. 15. В этой таблице знак плюс означает растворимость, минус — нерастворимость знак + ставится в сомнительных случаях или для соединений, находящихся на границе между двумя классами. В последних случаях результаты должны быть проверены путем повторного определения. [c.65]
chem21.info
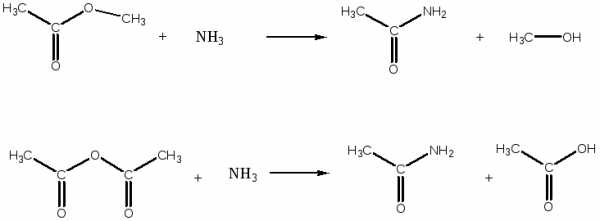
- Полный этиловый эфир бутандиовой кислоты из бутандиовой кислоты
- полный амид бутандиовой кислоты из полного метилового эфира той же кислоты
- метилацетат из соответствующей карбоновой кислоты и ангидрида
- ацетамид из соответствующих функциональных производных: сложного эфира и ангидрида
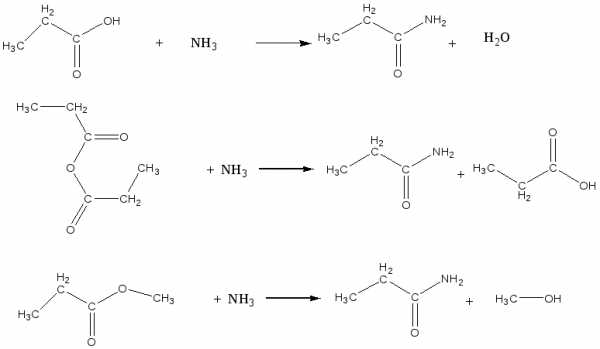
- метилацетат по реакции этерификации
- сложный эфир из бутановой кислоты и этилового спирта
- пропанамид из различных ацилирующих агентов: кислоты, ангидрида, сложного эфира
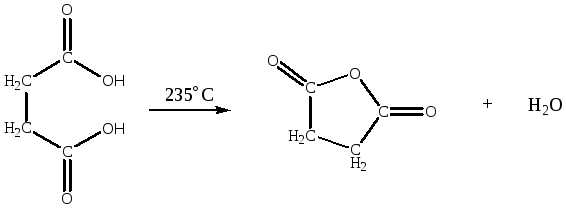
- ангидриды бутановой и бутандиовой кислот из соответствующих кислот
Механизмы реакций:
При нагревании сухих аммониевых солей карбоновых кислот происходит их разложение на исходные вещества, после чего аммиак нуклеофильно атакует атом углерода карбонильной группы:
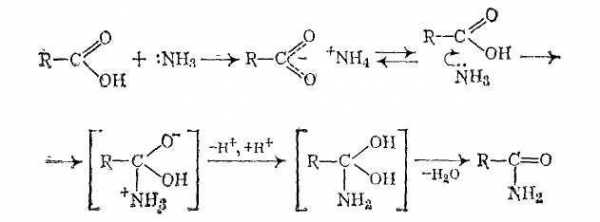
В отсутствие катализаторов реакция этерификации протекает очень медленно, поскольку на атакуемом атоме углерода карбоксильной группы дефицит электронной плотности невелик из-за +М-эффекта группы ОН. Поэтому реакцию этерификации проводят в присутствии катализаторов — минеральных кислот (h3SO4, газообразныйHCl, фосфорная кислота) Эти вещества протонируют атом кислорода карбонильной группы и тем самым увеличивают частичный положительный заряд на атакуемом атоме углерода.
Реакции свободных карбоновых кислот не могут катализироваться основаниями, так как образуются карбоксилат-анионы, не обладающие карбонильной активностью.
Роль катализаторов в реакции этерификации играют ионы водорода.
Механизм реакции можно представить следующим образом:
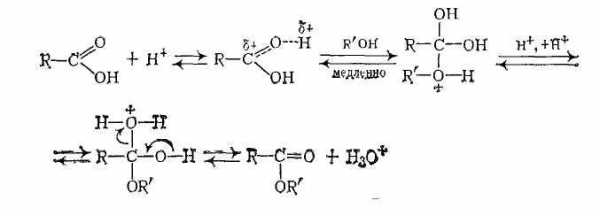
Обычно реализуется тетраэдрический механизм AAC2.
Общие схемы механизмов.
Превращения производных карбоновых кислот могут быть изображены в соответствии с общими схемами следующим образом:
Катализируемые кислотами реакции проходят через аналогичные промежуточные продукты:
Для заместителей с большой основностью (X=Nh3, ОН, OR) сначала происходит протонирование соединения II, а затем отщепление НХ с образованием карбений-оксониевого иона:
9.Напишите уравнения реакций гидролиза:
- метилацетата
- этилового эфира пропановой кислоты
- N-метиламида уксусной кислоты
- метилбутаноата
Опишите механизмы реакций. В какой среде они протекают?
Решение
- Метилацетат
- Этиловый эфир пропановой кислоты
- N-метиламид уксусной кислоты
- Метилбутаноат
Все реакции могут протекать как в кислой, так и в щелочной среде.
Механизм гидролиза сложных эфиров при кислотном катализе:
Механизм гидролиза (омыления) сложных эфиров при основном катализе:
Реакция протекает необратимо, так как образуется соль кислоты.
Механизм гидролиза амидов карбоновых кислот, аналогичен механизмам гидролиза сложных эфиров.
Реакции гидролиза амидов, катализируемые как кислотами, так и основаниями, по существу, необратимы, так как в обоих случаях образуются соли. В случае основного катализа осуществляется механизм ВАС2.
10. Напишите уравнения следующих окислительно-восстановительных реакций:
- окисление пропанола-2
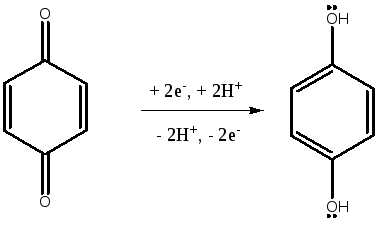
- ОВР в системе гидрохинон - хинон
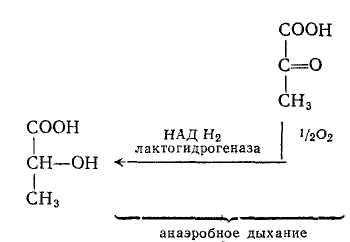
- ОВР в системе молочная кислота - пировиноградная кислота
- окисление этанола
- окисление бутанола
- восстановление бутанола
- ОВР в системе цистеин - цистин
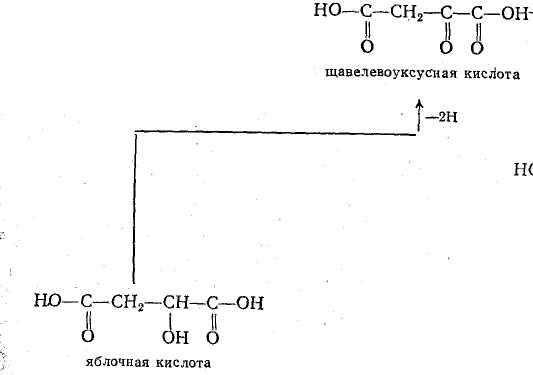
- ОВР в системе яблочная кислота - щавелевая кислота
- восстановление бутендиовой кислоты
- йодоформная проба для ацетона, ацетальдегида, бутанола
какой кофермент принимает участие в ОВР в организме? В чём заключается принцип его действия.
Решение
- окисление пропанола-2
- ОВР в системе гидрохинон - хинон
- ОВР в системе молочная кислота - пировиноградная кислота
При анаэробном дыхании протекает восстановление пировиноградной кислоты в молочную.
- окисление этанола
- окисление бутанола
- восстановление бутанола
- ОВР в системе цистеин - цистин
- ОВР в системе яблочная кислота - щавелевая кислота
Протекает в организмах.
- восстановление бутендиовой кислоты
- йодоформная проба для ацетона, ацетальдегида, бутанола?
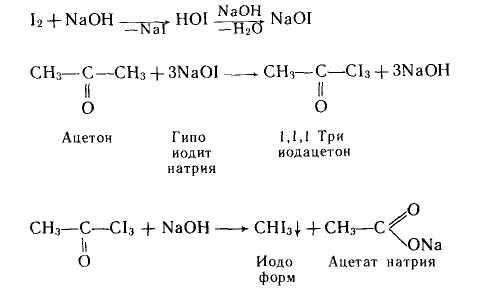
Аналогично реагирует ацетальдегид.
КОФЕРМЕНТЫ орг. прир. соед., необходимые для осуществления каталитич. действия ферментов.
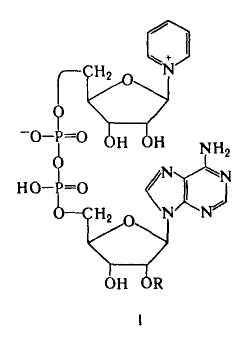
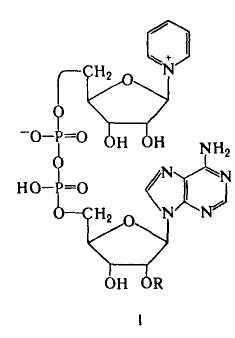
Никотинамидные К. - коферментная форма витамина ниацина. К этой группе К., универсальных по распространению (они найдены буквально во всех живых клетках) и биол. роли, относятся НАД (ф-ла I; R = Н) и никотинамидадениндинуклеотидфосфат, или НАДФ [I; R = РО(ОН)2], а также восстановленные (по пиридиновому кольцу) формы этих соед. (соотв. НАДН и НАДФН).Наиб. важная биохим. ф-ция этих К.-их участие в переносе электронов и водорода от окисляющихся субстратов к кислороду в клеточном дыхании. При участии НАД или НАДФ, связанных прочно или легко диссоциирующих, ферменты дегидрогеназы (напр., алкогольдегидрогеназа, глутаматдегидрогеназа) катализируют обратимое превращ. спиртов, гидроксикислот и нек-рых аминокислот в соответствующие альдегиды, кетоны или кетокислоты.
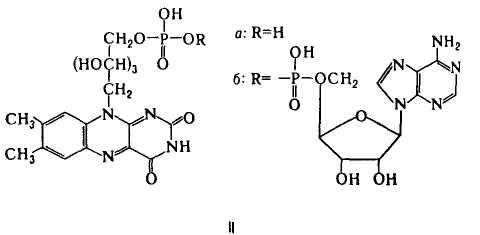
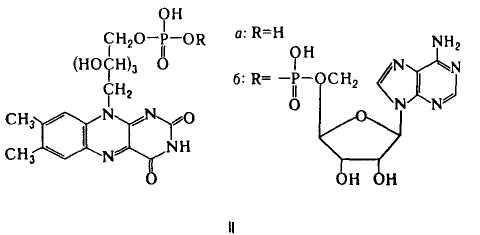
Флавиновые К.-коферментная форма витамина рибофлавина. Среди оксидоредуктаз дыхательной цепи, участвующих в переносе электронов и водорода.
Главная ф-ция флавиновых К. - перенос электронов (водорода) в окислит.-восстановит, цепи от НАДН и янтарной к-ты к цитохромам. Флавопротеиды катализируют также многочисл. р-ции, механизм к-рых включает стадию одноэлектронного переноса; окисление восстановл. формы амида липоевой к-ты, синтез кобамидного кофермента из АТФ и витамина В12, окисление глюкозы и др.
studfiles.net
Как получить из этанола диэтиловый эфир?напишите пожалуйста уравнение реакции,заранее спасибо огромное!
Этиловый спирт и концентрированная серная кислота при нагревании выше 140- 150°С дают преимущественно этилен, при температуре ниже 140°С дают диэтиловый эфир. При образовании эфира серная кислота отнимает воду от каждых двух молекул спирта: С2Н5ОН + НОС2Н5 ---> С2Н5 - О - С2Н5 + Н2О
только ничо что формула серной кислоты h3SO4
серная кислота в качестве катализатора
она не указана в формуле её пишут над направлением реакции
touch.otvet.mail.ru