Содержание
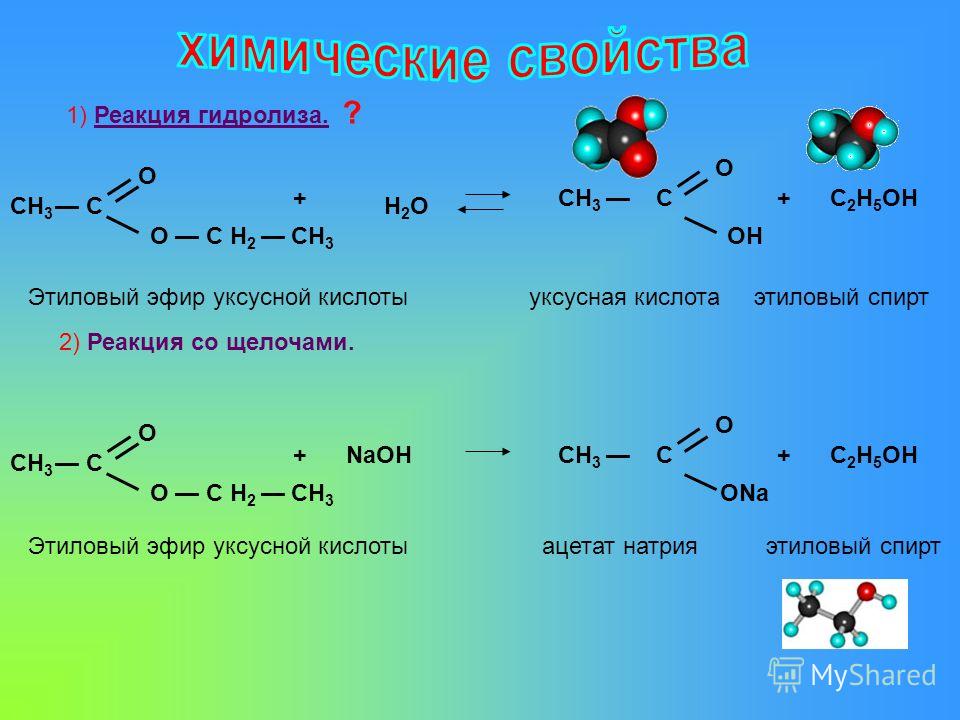
Кислотный гидролиз сложных эфиров
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Эфиры сложные — Словарь терминов | ПластЭксперт
Эфиры сложные
Продукты замещения атомов водорода групп ОН в минеральных или карбоновых кислотах на углеводородные радикалы. Для многоосновных кислот различают полные и кислые эфиры (например, ROSO2OR’ и ROSO2OH, ROCOCH2COOR’ и ROCOCH2COOH соответственно, где R, R’ – алкил, арил, гетерил). Строение сложных эфиров может быть представлено двумя резонансными структурами. Эфирная группировка планарна или близка к планарной: простая связь С–О (структура I) имеет конформацию с цисоидным расположением карбонильной двойной связи и связи О–R. Длина связи С=О в различных сложных эфирах 0,119-0,122 нм, связи С-О 0,131-0,136 нм, углы ОСО 122-126°, СОС 113-118°.
По номенклатуре ИЮПАК названия сложные эфиры производят от названий алкильной или арильной группы гидроксильного компонента и названия кислоты путем замены окончания «овая» на суффикс «ат», например: C2H5COOC2H5 – этилпропионат, CH3OSO2OH – метилсульфат.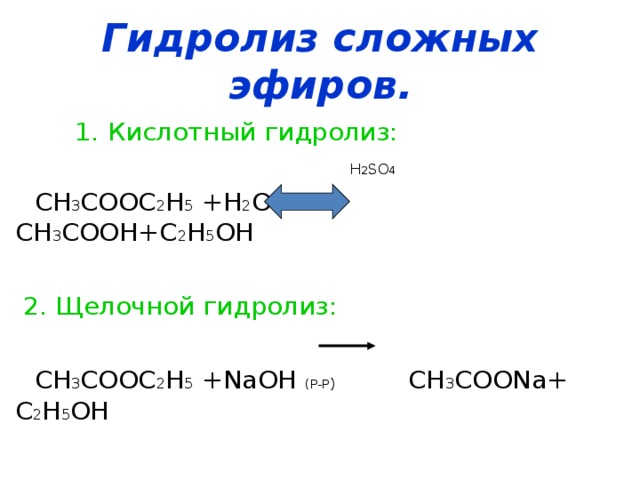
Некоторые сложные эфиры имеют тривиальные названия.
Сложные эфиры – главная составная часть жиров, восков, спермацета; входят в состав минеральные эфирных масел.
Физические свойства.
Сложные эфиры низших карбоновых кислот и простейших спиртов – бесцветные летучие жидкости, часто с приятным фруктовым запахом;
сложные эфиры высших карбоновых кислот – твердые бесцветные вещества, почти лишенные запаха.
Низшие сложные эфиры минеральных кислот (алкилсульфиты, алкилсульфаты, алкилбораты) – маслянистые жидкости с приятным запахом; алкилсульфаты, начиная с С9Н17, – твердые соединения.
Температуры кипения Сложных эфиров низших спиртов ниже, чем соответствующих кислот; температуры кипения сульфитов обычно ниже, чем сульфатов.
Сложные эфиры плохо растворимы в воде, хорошо – в органических растворителях, обладают значительным дипольным моментом.
В ИК спектрах сложные эфиры присутствуют характеристические полосы в области 1750-1700 см-1 (валентные колебания группы С=О) и 1275-1050 см-1 (валентные колебания группы С–О).
Химические свойства.
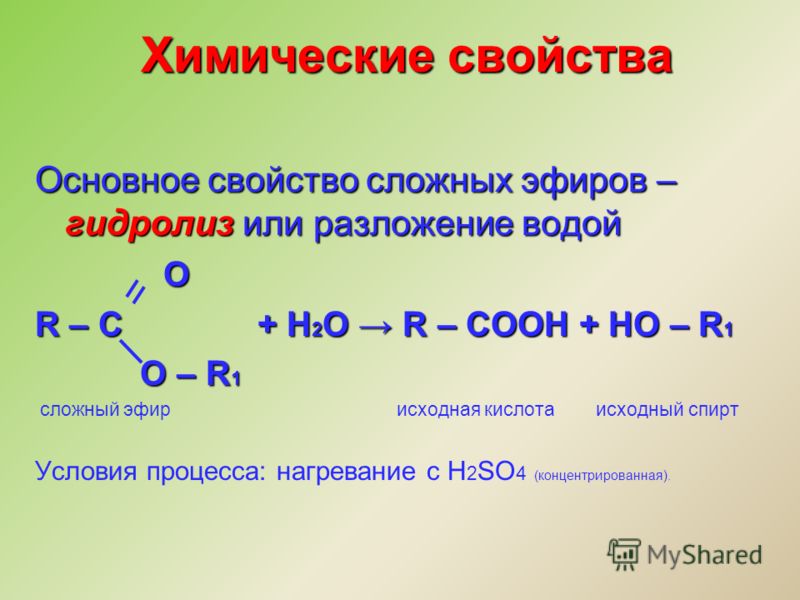
Большинство реакций сложных эфиров связано с нуклеофильной атакой по карбонильному атому углерода и замещением алкоксигруппы.
Гидролиз сложных эфиров протекает как в кислой (минеральных кислоты), так и в щелочной среде (водные или спиртовые растворы NaOH, KOH, а также Ba(OH)2, Ca(ОН)2).
Кислотный гидролиз – обратимый процесс, щелочной – практически необратим, так как карбоксилат-анион RCOO- не атакован нуклеофилом. Скорость гидролиза увеличивается с повышением температуры и с увеличением молекулярной массы эфира. Многие сложные эфиры (главным образом жиры) гидролизуются под действием ферментов.
При взаимодействии сложных эфиров со спиртами происходит пере-этерификация; катализатор – H2SO4 или сухой HCl либо алкоголят-ион.
Аммонолиз и аминолиз cложных эфиров приводит, соотвенно, к амидам RCONH2 и N-замещенным амидам RCONR’R»; катализаторами служат чаще всего NH4Cl или СН3OK, растворителями – диэтиловый эфир, бензол или сам амин (для ароматических аминов). Низкомолекулярные сложные эфиры реагируют с NH3 при комнатной температуре, высокомолекулярные – при повышенных температуре и давлении. Иногда аммонолиз проводят при низкой температуре, чтобы избежать побочных реакций.
Низкомолекулярные сложные эфиры реагируют с NH3 при комнатной температуре, высокомолекулярные – при повышенных температуре и давлении. Иногда аммонолиз проводят при низкой температуре, чтобы избежать побочных реакций.
При взаимодействии сложных эфиров с NH2OH образуются гидроксамовые кислоты RCONHOH, с гидразином – гидразиды RCONHNH2, с ацеталями или карбоновыми кислотами в присутвии минеральных, кислот происходит обменная реакция.
Реакции сложных эфиров с реактивами Гриньяра и других металлоорганические соединения приводят к образованию третичных спиртов (за исключением фэрмиатов, которые дают вторичные спирты).
Сложные эфиры, образующие стабильные карбанионы и не проявляющие тенденции к самоконденсации, легко алкилируются; некоторые из таких эфиров вступают в реакции с разрывом связи алкил-кислород.
Сложные эфиры устойчивы к действию окислителей.
Каталитические гидрирование сложные эфиры в присутствии хромата (III) меди при температуре 200-300 °С и давлении 10-30 МПа – промышленный способ получения спиртов.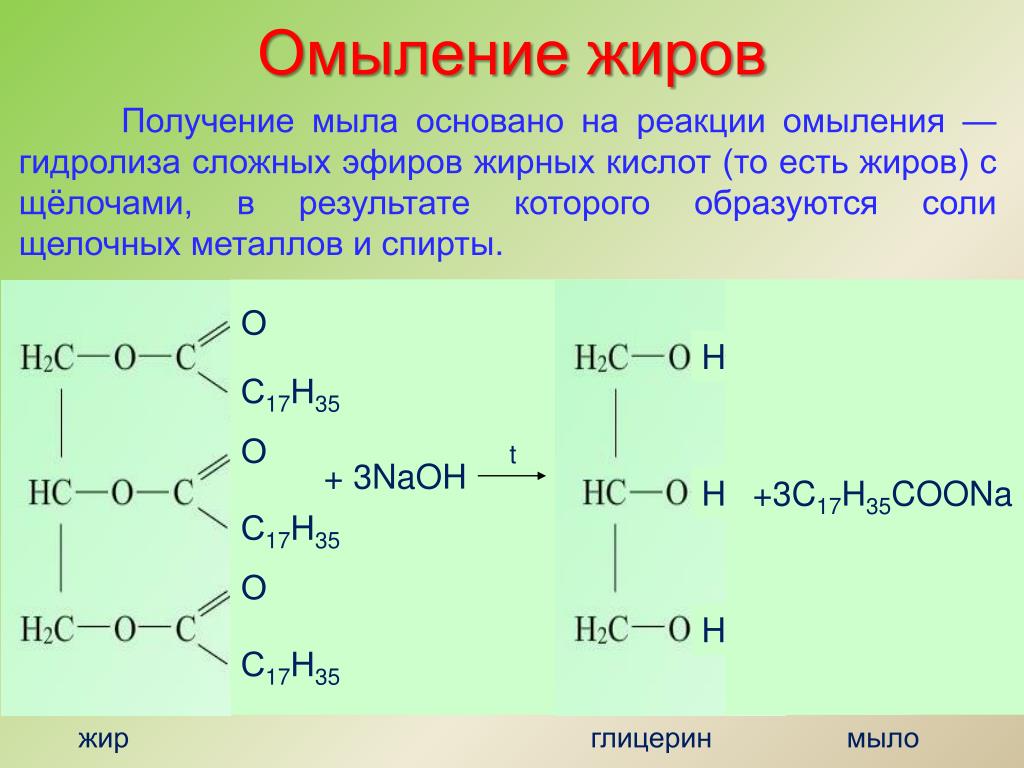 При восстановлении эфиров алифатических моно- и дикарбоновых кислот Na в кипящем ксилоле образуются ацилоины.
При восстановлении эфиров алифатических моно- и дикарбоновых кислот Na в кипящем ксилоле образуются ацилоины.
Получение.
Наиболее широко применяют этерификацию – взаимодействие спиртов с кислотами: RCOOH + R’OH=RCOOR’ + H2O. Это – обратимая реакция, в которой положение равновесия зависит от природы и количества кислоты и спирта и характеризуется равновесной концентрацией продуктов этерификации (так называемый предел этерификации), например при эквимолекулярной соотношении СН3СООН и C2H5OH равновесие устанавливается, когда ~ 2/3 кислоты и спирта превращается в эфир. На скорость достижения предела этерификации влияют температура и катализаторы (сильные кислоты и их ангидриды, арилсульфоновые кислоты, кислые соли и кислые катионообменные смолы). Для повышения выхода воду из реакции среды удаляют азеотропной дистилляцией. Легче всего этери-фицируются первичные спирты, наиболее трудно – третичные.
Этерификацией называют также методы получения сложных эфиров ацилированием спиртов, алкилированием кислот диазоалканами либо солей алкилгалогенидами.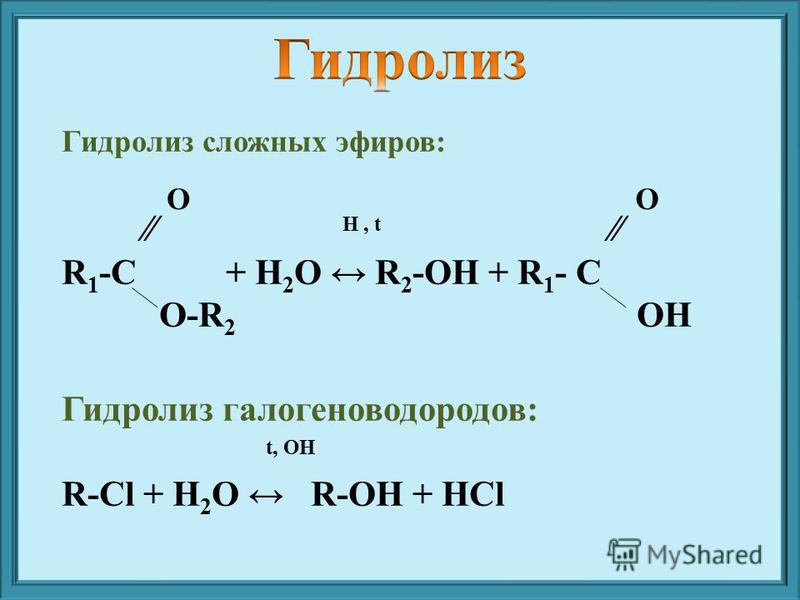
Другой распространенный способ получения сложных эфиров – переэтерификация – замена одного спиртового или кислотного остатка в молекуле Сложного эфира на другой. Осуществляют реакцию взаимодействия сложных эфиров со спиртами, карбоновыми кислотами или другими
Сложными эфирами в присутствии алкоголятов, щелочей, НСl, BF3, солей некоторых металлов.
Сложные эфиры высших дикарбоновых кислот получают из солей кислых эфиров дикарбоновых кислот в условиях электрохимической ре-акции Кольбе:
Наши публикации в соцсетях:
15.9: Гидролиз сложных эфиров — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 68163
Цели обучения
- Описать типичную реакцию, происходящую с эфирами.

- Определите продукты кислотного гидролиза сложного эфира.
- Определите продукты основного гидролиза сложного эфира.
Сложные эфиры являются нейтральными соединениями, в отличие от кислот, из которых они образованы. В типичных реакциях алкоксигруппа (OR’) сложного эфира заменяется другой группой. Одной из таких реакций является гидролиз, буквально «расщепление водой». Гидролиз сложных эфиров катализируется либо кислотой, либо основанием.
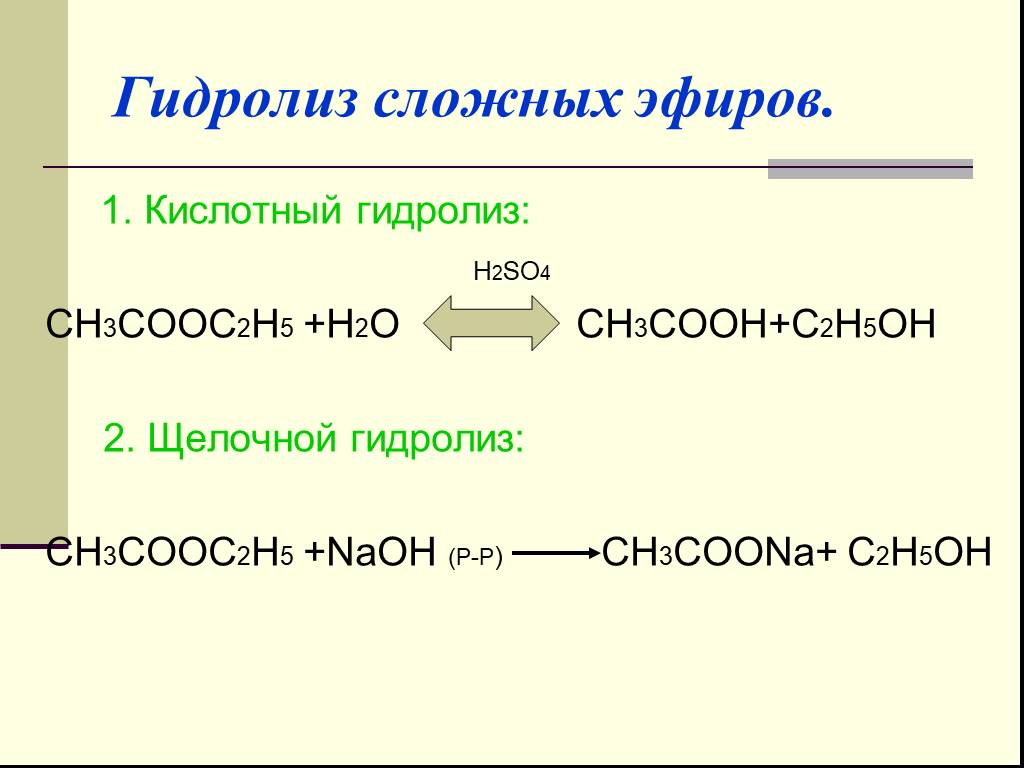
Кислотный гидролиз — это обратная этерификация. Эфир нагревают с большим избытком воды, содержащей сильнокислотный катализатор. Подобно этерификации, реакция обратима и не идет до конца.
В качестве конкретного примера, бутилацетат и вода реагируют с образованием уксусной кислоты и 1-бутанола. Реакция обратима и не идет до конца.
Пример \(\PageIndex{1}\)
Напишите уравнение кислотного гидролиза этилбутирата (CH 3 CH 2 CH 2 COOCH 2 CH 3 . ) и назовите продукты.
) и назовите продукты.
Раствор
Помните, что при кислотном гидролизе вода (HOH) расщепляет эфирную связь. H HOH присоединяется к атому кислорода в OR части исходного эфира, а OH HOH присоединяется к карбонильному атому углерода:
Продукты масляная кислота (бутановая кислота) и этанол.
Упражнение \(\PageIndex{1}\)
Напишите уравнение кислотного гидролиза метилбутаноата и назовите продукты.
Когда основание (такое как гидроксид натрия [NaOH] или гидроксид калия [KOH]) используется для гидролиза сложного эфира, продукты представляют собой карбоксилатную соль и спирт. Поскольку мыла получают щелочным гидролизом жиров и масел, щелочной гидролиз сложных эфиров называется омылением (лат. 9).0068 sapon , что означает «мыло», и facere , что означает «делать»). В реакции омыления основание является реагентом, а не просто катализатором. Реакция идет к завершению:
В качестве конкретного примера, этилацетат и NaOH реагируют с образованием ацетата натрия и этанола:
Пример \(\PageIndex{2}\)
Напишите уравнение гидролиза метилбензоата в растворе гидроксида калия.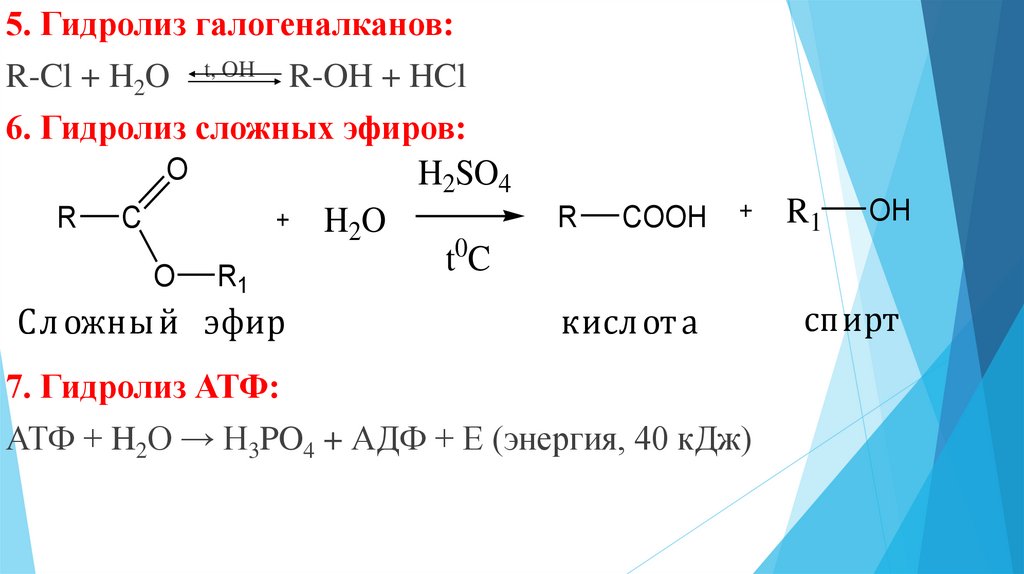
Раствор
При основном гидролизе молекула основания расщепляет эфирную связь. Кислотная часть сложного эфира заканчивается как соль кислоты (в данном случае калиевая соль). Спиртовая часть сложного эфира превращается в свободный спирт.
Упражнение \(\PageIndex{2}\)
Напишите уравнение гидролиза этилпропаноата в растворе гидроксида натрия.
Резюме
Гидролиз является наиболее важной реакцией сложных эфиров. Кислотный гидролиз сложного эфира дает карбоновую кислоту и спирт. Основной гидролиз сложного эфира дает карбоксилатную соль и спирт.
Упражнения по обзору концепции
Чем различаются кислотный гидролиз и основной гидролиз сложного эфира с точки зрения
- полученных продуктов?
- степень реакции?
Что такое омыление?
Ответы
- кислотный гидролиз: карбоновая кислота + спирт; основной гидролиз: карбоксилатная соль + спирт
- основной гидролиз: завершение; кислотный гидролиз: незавершенная реакция
основной гидролиз сложного эфира
Упражнения
Напишите уравнение катализируемого кислотой гидролиза этилацетата.

Напишите уравнение катализируемого основанием гидролиза этилацетата.
Завершите каждое уравнение.
9+} СН_3СООН + СН_3СН_2ОН}\)
- CH 3 COONa(водн.) + CH 3 CH 2 CH 2 OH
- CH 3 CH 2 CH 2 COOH + CH 3 CH 2 OH
15.9: Hydrolysis of Esters распространяется по незаявленной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Вернуться к началу
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.

- Теги
Гидролиз сложных эфиров — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3911
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице описаны способы гидролиза сложных эфиров — расщепления их на карбоновые кислоты (или их соли) и спирты действием воды, разбавленной кислоты или разбавленной щелочи. Он начинается с гидролиза простых эфиров, таких как этилэтанолат, и продолжается гидролизом более крупных и сложных эфиров для получения мыла.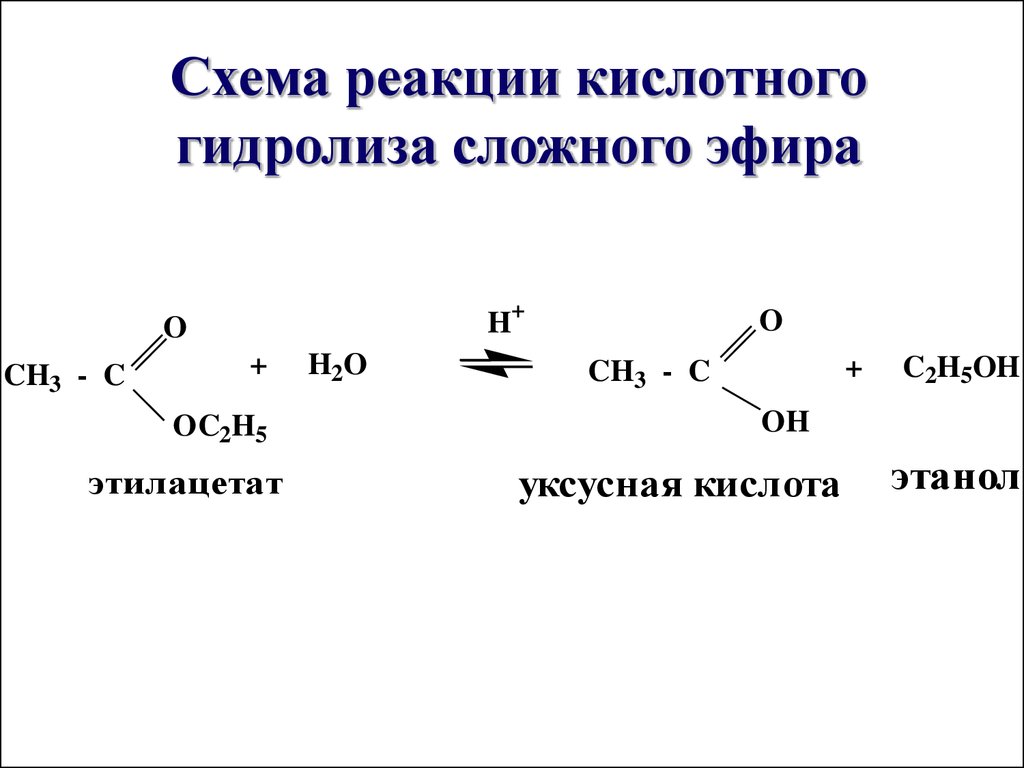
Технически гидролиз — это реакция с водой. Именно это происходит при гидролизе сложных эфиров водой или разбавленными кислотами, такими как разбавленная соляная кислота. Щелочной гидролиз сложных эфиров на самом деле включает реакцию с ионами гидроксида, но общий результат настолько похож, что его объединяют с двумя другими.
Гидролиз с использованием воды или разбавленной кислоты
Реакция с чистой водой настолько медленная, что ее никогда не используют. Реакция катализируется разбавленной кислотой, поэтому сложный эфир нагревают с обратным холодильником с разбавленной кислотой, такой как разбавленная соляная кислота или разбавленная серная кислота. Вот два простых примера гидролиза с использованием кислотного катализатора.
Во-первых, гидролиз этилового спирта:
. . . а затем гидролиз метилпропаноата:
Обратите внимание, что реакции обратимы. Чтобы гидролиз был максимально полным, пришлось бы использовать избыток воды. Вода получается из разбавленной кислоты, поэтому вы должны смешать эфир с избытком разбавленной кислоты.
Вода получается из разбавленной кислоты, поэтому вы должны смешать эфир с избытком разбавленной кислоты.
Гидролиз с использованием разбавленной щелочи
Это обычный способ гидролиза сложных эфиров. Сложный эфир нагревают с обратным холодильником с разбавленной щелочью, такой как раствор гидроксида натрия. Это дает два преимущества перед использованием разбавленной кислоты. Реакции являются односторонними, а не обратимыми, и продукты легче разделить. Берем те же сложные эфиры, что и выше, но с использованием раствора гидроксида натрия, а не разбавленной кислоты:
Сначала гидролиз этилового спирта с использованием раствора гидроксида натрия:
, а затем гидролизовать метилпропаноат таким же образом:
Обратите внимание, что вы получаете образовавшуюся натриевую соль, а не саму карбоновую кислоту. Эту смесь относительно легко разделить. Если вы используете избыток раствора гидроксида натрия, эфира не останется, так что вам не о чем беспокоиться.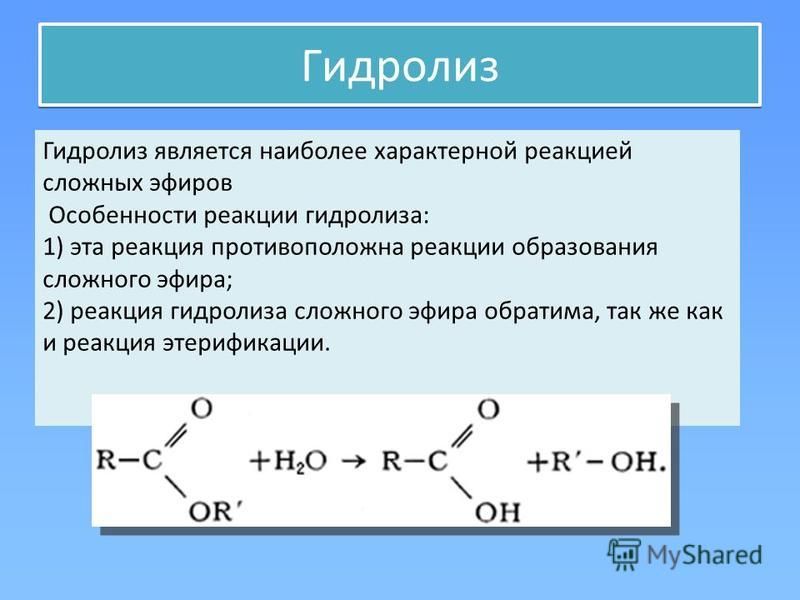 Образовавшийся спирт можно отогнать. Это просто!
Образовавшийся спирт можно отогнать. Это просто!
Если вам нужна кислота, а не ее соль, все, что вам нужно сделать, это добавить избыток сильной кислоты, такой как разбавленная соляная кислота или разбавленная серная кислота, к раствору, оставшемуся после первой перегонки. Если вы сделаете это, смесь насытится ионами водорода. Они улавливаются ионами этаноата (или ионами пропаноата или чем-то еще), присутствующими в солях, с образованием этановой кислоты (или пропановой кислоты и т. д.). Поскольку это слабые кислоты, когда они объединяются с ионами водорода, они, как правило, остаются вместе. Теперь карбоновую кислоту можно отогнать.
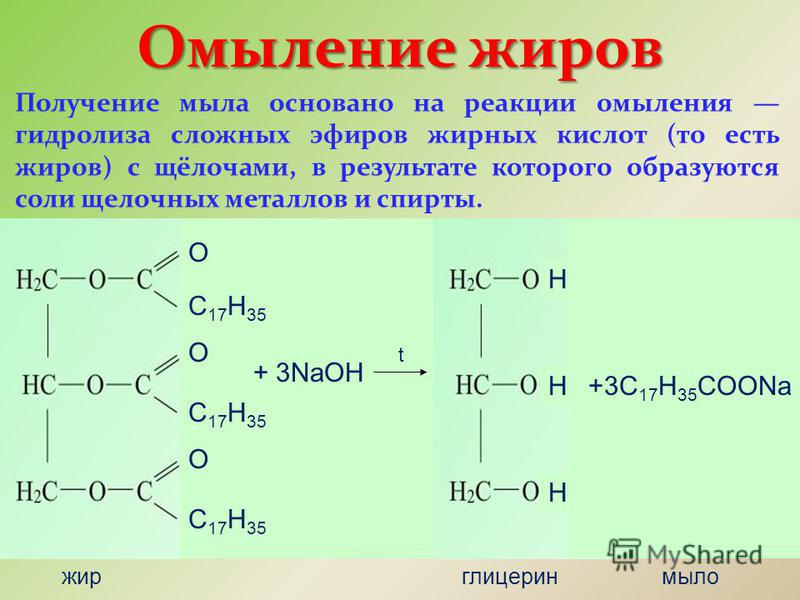
Гидролиз сложных эфиров для получения мыла
Следующий фрагмент посвящен щелочному гидролизу (с использованием раствора гидроксида натрия) больших эфиров, содержащихся в животных и растительных жирах и маслах. Если большие сложные эфиры, содержащиеся в животных или растительных жирах и маслах, нагревать с концентрированным раствором гидроксида натрия, происходит точно такая же реакция, как и с простыми эфирами.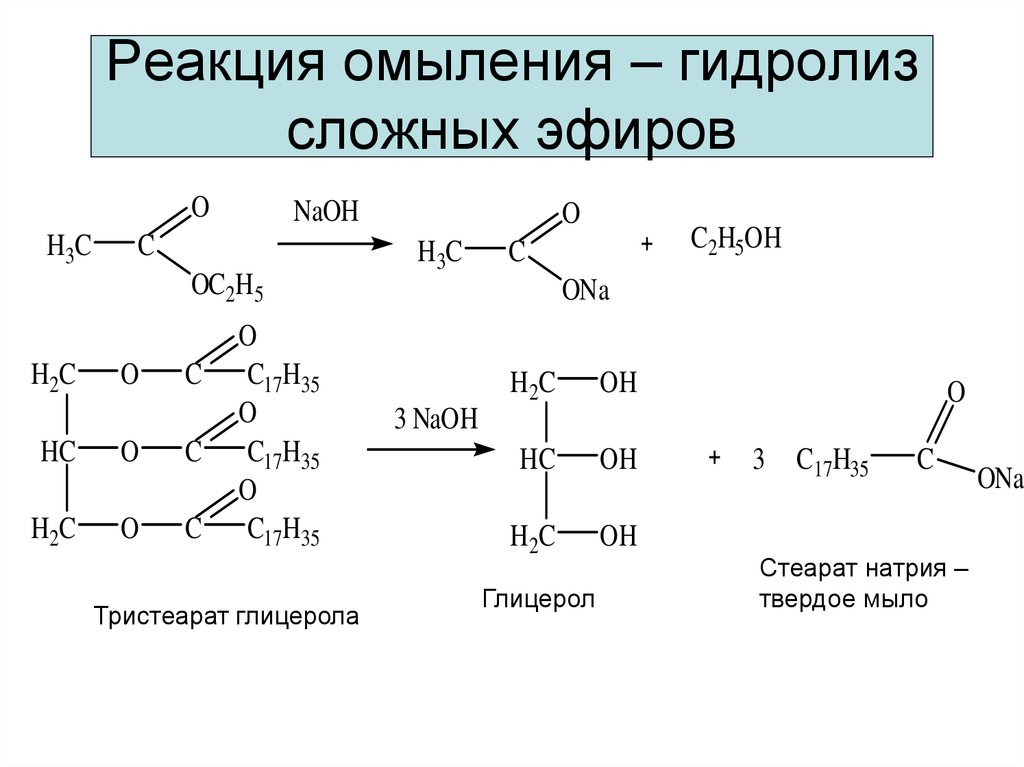 Образуется соль карбоновой кислоты — в данном случае натриевая соль большой кислоты, такой как октадекановая кислота (стеариновая кислота). Эти соли являются важными ингредиентами мыла — теми, которые очищают. Производится также спирт — в данном случае более сложный спирт, пропан-1,2,3-триол (глицерин).
Образуется соль карбоновой кислоты — в данном случае натриевая соль большой кислоты, такой как октадекановая кислота (стеариновая кислота). Эти соли являются важными ингредиентами мыла — теми, которые очищают. Производится также спирт — в данном случае более сложный спирт, пропан-1,2,3-триол (глицерин).
Из-за его связи с производством мыла щелочной гидролиз сложных эфиров иногда называют омылением.
Авторы
Эта страница под названием «Гидролиз сложных эфиров» распространяется по незаявленной лицензии, автором, ремиксом и/или куратором которой является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Показать страницу TOC
- № на стр.