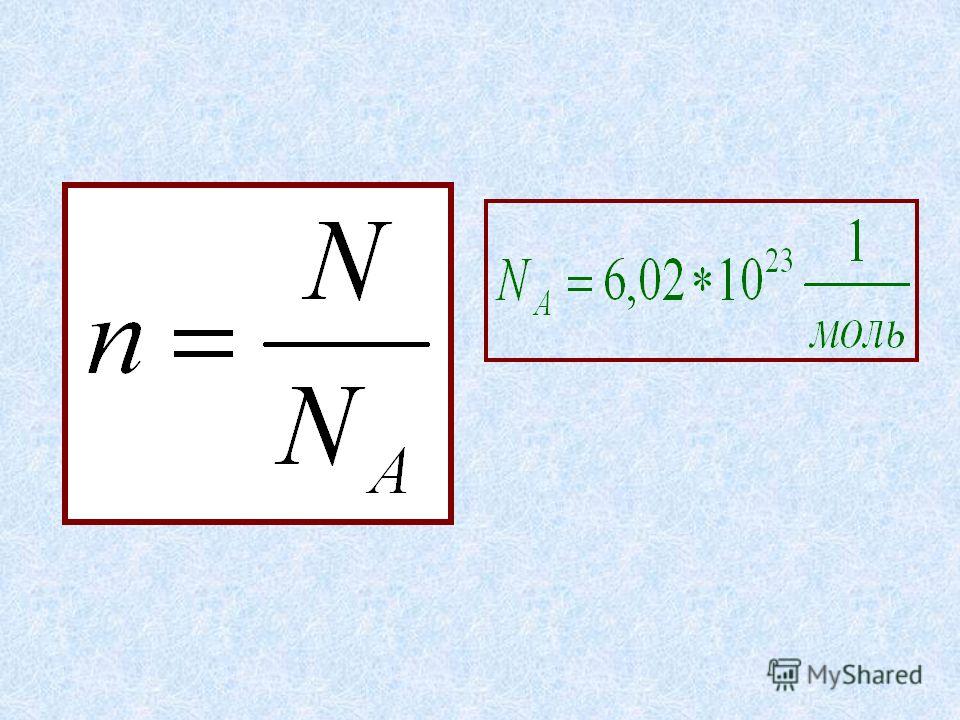Содержание
Примеры задач по химии сложных эфиров и жиров 10 класс онлайн-подготовка на Ростелеком Лицей
Задача 1
Условие задачи.
Какие исходные кислоты и спирты необходимо взять для синтеза сложных эфиров этилбензоата (с запахом мяты) и бензилацетата (с запахом жасмина)?
Решение
1. Вспомните, как образуется название сложного эфира.
Ответ: сначала указывают название радикала – остатка от спирта, а затем название кислотного остатка.
2. Определим исходные вещества для синтеза этилбензоата и бензилацетата.
«Этил» – остаток этилового спирта, «бензоат» – остаток бензойной кислоты. Следовательно, этилбензоат образуется из бензойной кислоты и этилового спирта. «Бензил» – остаток бензилового спирта, «ацетат» – остаток уксусной кислоты.
Формулы сложных эфиров представлены на рисунке 1.
Рис. 1. Формулы и исходные вещества для синтеза этилбензоата и бензилацетата
Приведенные сложные эфиры между собой являются изомерами, их состав соответствует формуле С9Н10О2 (рис. 2).
2).
Рис. 2. Изомерные сложные эфиры
Задача 2
Условие задачи
При гидролизе сложного эфира, молярная масса которого равна 130 г/моль, образуются кислота А и спирт Б. Определите строение эфира, если: а) серебряная соль кислоты А содержит 59,66 % серебра, б) спирт Б не окисляется дихроматом калия.
Решение
- Предположим, что кислота, образующая сложный эфир, одноосновна. Но если задача не будет решена таким образом, то придется рассматривать случаи двух-, трехосновной кислот и так далее.
- Запишем формулу серебряной соли и рассчитаем молярную массу углеводородного радикала R в кислоте.
RCOOAg – формула серебряной соли кислоты А.
Зная молярные массы серебра, углерода и кислорода, выразим молярную массу RCOOAg:
Известно, что серебро составляет 59,66 % от массы всей соли. Составим пропорцию:
59,66 % – 108 г/моль
100 % – (M(R) + 152) г/моль
Произведем соответствующие вычисления и найдем молярную массу R:
Такая молярная масса соответствует радикалу этилу – С2Н5. Следовательно, кислота, образующая сложный эфир, – пропановая. Тогда, общая формула эфира – С2Н5СООR.
Следовательно, кислота, образующая сложный эфир, – пропановая. Тогда, общая формула эфира – С2Н5СООR.
Зная молярную массу эфира С2Н5СООR, можно найти молярную массу радикала R:
Молярной массе 57 г/моль соответствуют 4 изомерных радикала (рис. 3).
Рис. 3. Изомеры состава -С4Н9
В условии задачи сказано, что спирт Б не окисляется дихроматом калия, следовательно, этот спирт является третичным.
Таким образом, исходный сложный эфир образован пропановой кислотой и третбутиловым спиртом:
Задача 3
Условие задачи
Растительное масло массой 17,56 г нагрели с 3,36 г гидроксида калия до полного исчезновения масляного слоя. При действии избытка бромной воды на полученный после гидролиза раствор образуется только одно тетрабромпроизводное.
Установите возможную формулу жира.
Решение
Запишем в общем виде уравнение гидролиза жира:
На 1 моль жира при гидролизе приходится 3 моль гидроксида калия.
Найдем количество вещества гидроксида калия и жира (количество жира втрое меньше):
Зная количество и массу жира, можно найти его молярную массу:
На три углеводородных радикала R кислот приходится 705 г/моль:
Зная, что тетрабромпроизводное получено только одно, можно сделать вывод, что все кислотные остатки одинаковы и содержат по 2 двойные связи. Тогда получаем, что в каждом радикале содержится 17 атомов углерода, это радикал линолевой кислоты:
Возможная формула жира представлена на рисунке 4.
Рис. 4. Формула жира
Список литературы
- Новошинский И. И., Новошинская Н. С. Химия. Учебник для 10 класса общеобр. учрежд. Профильный уровень. – М.: ООО «ТИД «Русское слово – РС», 2008 (§57).
- Рудзитис Г. Е. Химия. Органическая химия. 10 класс: учеб. для общеобр. учрежд.: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2010 (§31).

- Радецкий А. М. Химия. Дидактический материал. 10–11 классы. – М.: Просвещение, 2011 (с. 55–56).
- Хомченко И. Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008 (с. 164–166).
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «school-collection.edu.ru» (Источник)
- Интернет-портал «chemport.ru» (Источник)
- Интернет-портал «fito.nnov.ru» (Источник)
Домашнее задание
- № № 6, 7 с. 128 из Учебника Рудзитиса Г. Е. Химия. Органическая химия. 10 класс: учеб. для общеобр. учрежд. : базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2010.
- Запишите уравнение реакции этерификации, в результате которой образуется метилбензоат.
- Напишите уравнения реакций кислотного и щелочного гидролиза тристеарата.

Молярная масса — что это? Как рассчитать? Формулы и примеры
Что такое моль
Прежде чем говорить о том, как найти молярную массу вещества, определимся с понятием «моль». Его ввели как искусственную величину для упрощения расчетов. Это количество вещества, в котором содержится столько же мельчайших частиц, сколько в 12 г одного из изотопов углерода — C12.
Для всех химических веществ это количество одинаково и представляет собой число Авогадро 6,02 · 1023. Постоянная Авогадро обозначается NA, а измеряется в моль-1.
Число Авогадро — это количество молекул, ионов или других мельчайших частиц в 1 моле вещества.
NA = 6,02 · 1023 моль-1.
Историческая справка
В 1811 году химик Амедео Авогадро предположил, что если взять два равных объема газов в равных значимых условиях (при одинаковой температуре и давлении), то количество молекул в этих объемах тоже будет одинаковым. Опираясь на свою гипотезу, он определил атомные и молекулярные массы многих веществ, а также рассчитал количество атомов в молекулах воды, оксидов азота и т. д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.
Опираясь на свою гипотезу, он определил атомные и молекулярные массы многих веществ, а также рассчитал количество атомов в молекулах воды, оксидов азота и т. д. Однако в научных кругах гипотеза Авогадро долго не находила понимания. Общепринятой она стала только в 1860 году.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Что такое молярная масса
Молярная масса — это масса одного моля вещества, она измеряется в граммах деленных на моль (г/моль). Данная величина представляет собой отношение массы вещества к его количеству, которое измеряется в молях.
Как обозначается молярная масса: М.
, где — это масса вещества, а — количество вещества.
Единица измерения молярной массы: г/моль.
Запоминаем!
Правильно говорить именно молярная, а не мольная масса.
Несмотря на то, что в 1 моле любого химического вещества содержится одинаковое количество молекул (и оно равно числу Авогадро), молярные массы разных веществ отличаются. Все потому, что отличаются атомы, которые входят в состав этих молекул. В частности, разница между ними заключается в относительной атомной массе (Ar) — например, Ar(Mg) = 24, а Ar(Hg) = 200. Сейчас станет ясно, какое это имеет значение.
Как определить молярную массу
Данная величина тесно связана с такими понятиями, как относительные атомная и молекулярная массы. Именно относительные, потому что абсолютную массу молекулы или атома вещества в химии не используют для решения задач — это слишком малые величины.
Относительная атомная масса вещества (Ar) показывает, во сколько раз его атом больше 1/12 атома углерода. Это значение для каждого химического элемента можно увидеть в таблице Менделеева.
Относительная молекулярная масса (Mr) складывается из Ar каждого атома в молекуле вещества с учетом индексов. Она показывает, на сколько масса молекулы больше 1/12 атома углерода.
, где — это количество атомов.
Разберемся на примерах.
В молекуле хлорида натрия NaCl есть 1 атом натрия и 1 атом хлора, при этом Ar(Na) = 23, Ar (Cl) = 35,5.
Mr(NaCl) = 23 + 35,5 = 58,5.
В молекуле NaNO2 есть 1 атом натрия, 1 атом азота и 2 атома кислорода.
Ar(Na) = 23, Ar(N) = 14, Ar(O) = 16.
Mr(NaNO2) = 23 + 14 + 16 · 2 = 69.
Собственно, для вычисления молярной массы больше ничего и не требуется.
Важно
Молярная масса вещества численно равна относительной молекулярной массе. Но путать эти два понятия не стоит — у них разный физический смысл. Молярная масса характеризует 1 моль, а относительная молекулярная — 1 молекулу.
Но путать эти два понятия не стоит — у них разный физический смысл. Молярная масса характеризует 1 моль, а относительная молекулярная — 1 молекулу.
Количество вещества
Из предыдущих формул понятно, что молярная масса и количество вещества тесно связаны. Рассмотрим эту связь подробнее. Начнем с того, что количество вещества может обозначаться как латинской буквой , так и греческой буквой (ню). Международное обозначение — , но не стоит удивляться, встретив в формулах любую из этих букв.
В формуле нахождения молярной массы мы обозначили количество вещества через :
, следовательно .
Пользуясь этим, можно найти количество вещества (в молях), если нам известны его абсолютная и молярная масса.
Пример 1
Как определить, какое количество вещества включают 350 г сульфата бария BaSO4?
Воспользуемся формулой .
Мы помним, что M = Mr (значение молярной массы равно значению относительной молекулярной).
Mr(BaSO4) = Ar(Ba) + Ar(S) + Ar(O) · 4 = 137 + 32 + 16 · 4 = 233.
М(BaSO4) = Mr(BaSO4) = 233 г/моль.
Подставим значение молярной массы в формулу:
моль.
Есть и еще одна формула количества вещества, которая позволяет найти его, если известно число молекул или других структурных единиц.
, где — число структурных единиц, — число Авогадро.
Пример 2
Допустим, некий объем CaCO3 содержит 3,01 · 1023 молекул. Как найти количество вещества, соответствующее данному объему?
Воспользуемся формулой моль.
Молярный объем
Выше мы находили количество вещества через молярную массу, но для газов это можно сделать и через молярный объем. Согласно закону Авогадро количество любого газа, равное 1 моль, будет занимать один и тот же объем, если газы рассматриваются при одинаковой температуре и давлении.
При стандартных физических условиях — температуре 0°С и давлении 1 атм или 760 мм ртутного столба, 1 моль газа занимает объем 22,4 л.
Молярный объем — это объем газа, взятого в количестве 1 моль. Он обозначается Vm.
При нормальных условиях Vm = 22,4 л/моль.
Значения молярного и фактического объема газа помогают найти количество вещества.
, где — фактический объем газа, а — молярный объем.
Пример 1
Сколько молей содержится в 120 литрах газа при нормальных условиях?
Рассчитаем по формуле моль.
Ответ: 120 литров любого газа при стандартных условиях содержат 5,36 моль.
Относительная плотность одного газа по другому
Иногда для решения задачи нужно знать, как найти молярную массу газа, о котором сообщается лишь его плотность по воздуху или по другому газу. Это возможно, если знать формулу относительной плотности, которая обозначается буквой D.
Это возможно, если знать формулу относительной плотности, которая обозначается буквой D.
, где и — некие газы.
Пример 1
Как определить, во сколько раз угарный газ плотнее водорода?
Для начала найдем молярную массу CO и H2:
М(CO) = Mr(CO) = Ar(C) + Ar(O) = 12 + 16 = 28.
М(H) = Mr(H2) = 2 · Ar(H) = 2 · 1 = 2.
.
Ответ: угарный газ в 14 раз плотнее водорода.
Пример 2
Как посчитать молярную массу газа х, о котором известно, что он в 10 раз плотнее углекислого газа CO2?
Подсчитаем для начала молярную массу углекислого газа:
M(CO2) = Mr(CO2) = 12 + 2 · 16 = 44.
Ориентируясь на формулу относительной плотности, произведем расчет молярной массы искомого газа х.
М(х) = D(х/CO2) · M(CO2) = 10 · 44 = 440 г/моль.
Ответ: у данного газа молярная масса 440 г/моль.
Примеры задач
Итак, мы разобрались, как находить молярную массу жидкости, газа или твердого тела и как это понятие связано с количеством вещества, а также с относительной плотностью одного газа по другому. Чтобы закрепить знания, посмотрите, как эти сведения применяются в решении задач.
Задача 1
Известно, что 300 г неустановленного вещества содержат 12,04 · 1023 молекул. Чему равна молярная масса данного вещества?
Дано:
N(х) = 12,04 · 1023.
m(х) = 300 г.
M(х) = ?
Решение:
Найдем количество вещества моль.
Подставим количество вещества в формулу :
г/моль.
Ответ: молярная масса данного вещества 150 г/моль.
Задача 2
Какой объем займет водород в количестве 0,7 моль?
Дано:
моль.
Решение:
По формуле мы можем найти объем .
Зная, что молярный объем при обычных условиях составляет 22,4 л/моль, вычислим фактический объем водорода:
л.
Ответ: объем водорода составляет 15,68 литров.
Задача 3
В порции оксида серы SO3 содержится 8,356 · 1023 атомов кислорода. Какова масса этой порции?
Дано:
N(O) = 8,356 · 1023.
m(SO3) = ?
Решение:
Для решения задачи нам подходит формула , т. е. . Но для начала нужно найти количество вещества.
Мы знаем, что в одной молекуле SO3 есть 3 атома кислорода, исходя из этого можно вычислить количество молекул в порции оксида:
, следовательно .
Зная количество молекул, рассчитаем количество вещества:
моль.
Теперь можно узнать молярную массу SO3:
M(SO3) = 32 + 16 · 3 = 80 г/моль.
Рассчитаем фактическую массу через молярную массу:
г.
Ответ: абсолютная масса порции оксида серы 36,8 грамм.
Задача 4
Как рассчитать молярную массу простого вещества, о котором известно, что в порции 100 г содержится 15,05 · 1023 молекул? Назовите это вещество.
Дано:
m(x) = 100 г.
N(x) = 15,05 · 1023.
М(х) = ?
Решение:
В данном случае поможет вычислить молярную массу NA, с помощью которого мы сначала узнаем количество вещества:
моль.
Исходя из этого, рассчитаем молярную массу:
г/моль.
Ответ: согласно таблице Менделеева можно предположить, что это кальций Ca.
Задача 5
Определите, насколько сероводород H2S плотнее водорода H2?
Решение:
Нам требуется вычислить относительную плотность сероводорода по водороду:
.
Для этого вычислим молярные массы H2S и H2:
М(H2S) = 1 · 2 + 32 = 34 г/моль.
М(H2) = 1 · 2 = 2 г/моль.
Подставим значения в формулу:
.
Ответ: сероводород в 17 раз плотнее водорода.
Вопросы для самопроверки
Что такое число Авогадро и чему оно равно?
В чем измеряется молярная масса?
Напишите формулу молярной массы вещества.

Какая формула связывает количество вещества и его объем?
Как узнать количество вещества, если известно число молекул в порции?
эфир
эфир —
Имена и идентификаторы
| Name | Ether |
| Synonyms | 1,1′-Oxybisethane Diethyl ether Diethyl Oxide Ethoxyethane Ethyl ether pronarcol Di ethyl ether Anesthetic ether Ethyl ether absolute |
| КАС | 60-29-7 927820-24-4 |
| EINECS | 200-467-2 |
| дюйм | дюйм = 1/C4H20O/C1-3-5-4-2/H4-4H3,1-2H4 |
1. Физико-химические свойства
| Молекулярная формула | C4H20O |
| Molar Mass | 74. 12 12 |
| Плотность | 0,714 |
| Точка смещения | 0,714 |
| .-116 ℃ | |
| Болинг -точка | 34,6 ℃ |
| Флэш -точка | -45 ℃ |
| Растворимость воды | 69 г/л (20 ℃) | . |
| Физические и химические свойства | Характеристики потока бесцветной летучей жидкости, ароматический запах. Гигроскопичность, сладкий вкус. точка кипения 34,5 ℃ точка замерзания -116,3 ℃ относительная плотность 0,7145 показатель преломления 1,3527 температура вспышки -49 ℃ растворим в этаноле, бензоле, хлороформе и нефти, слабо растворим в воде. |
| Use | Mainly used as solvents, anesthetics and chemical reagents |
ether —
Risk and Safety
| Hazard Symbols | F+ — Highly flammable Xn — Harmful |
| Коды риска | R12 — Чрезвычайно легковоспламеняющийся R19 — Может образовывать взрывоопасные перекиси R22 — Вреден при проглатывании R66 — Многократное воздействие может вызвать сухость или растрескивание кожи R67 — Пары могут вызвать сонливость и головокружение |
| Описание безопасности | S16 — Хранить вдали от источников воспламенения.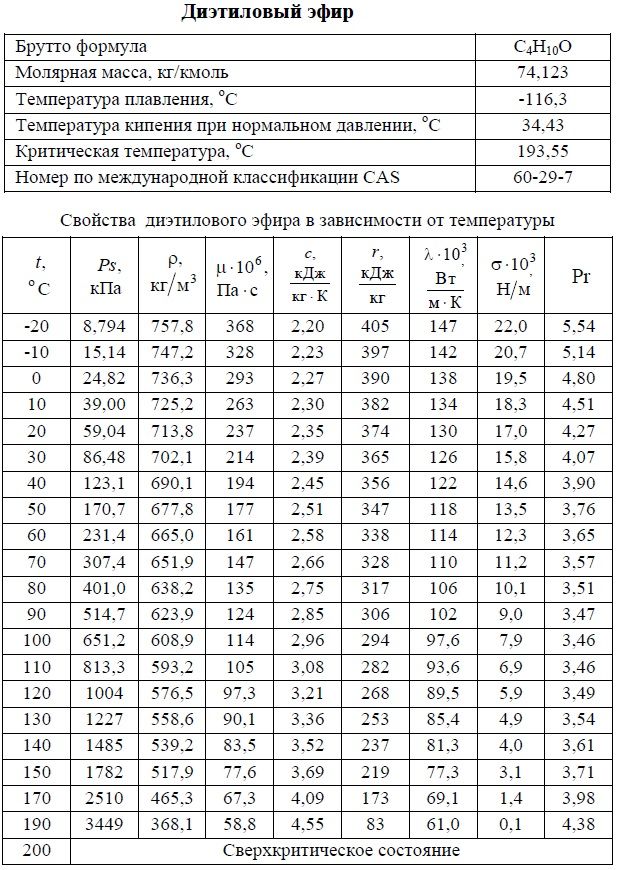 S29 — Не сливать в канализацию. S33 — Примите меры предосторожности против статических разрядов. S9 — Храните контейнер в хорошо проветриваемом месте. |
| UN ID | UN 1155 |
эфир —
Upstream Downstream Industry
| Raw Materials | Sodium metabisulfite Sulfuric acid Ethyl Alcohol Ethyl Alcohol |
| Downstream Products | ethylmaltol gold trichloride Phosphotungstic acid Phosphomolybdic Acid n-Hydrate Ether 2-Acetylthiazole D(минус)-норгестрел Карбопрост метилат Генистеин Амитриптилина гидрохлорид |
Эфир —
Природа
бесцветная прозрачная третичная летучая жидкость. С этанолом, бензолом, хлороформом, петролейным эфиром и другими произвольными смесями. Мало растворим в воде. Увидите легкий или застоявшийся воздух, постепенно окисляющийся до перекиси. Обычно в качестве стабилизатора добавляют 0,1% 2,6-трет-бутил-п-крезола. Его пары и воздух образуют взрывоопасную смесь, в случае открытого пламени высокая температура легко воспламеняется. Может произойти сильная реакция с окислителем. Воздействие воздуха или света может привести к образованию пероксидов с потенциальным риском взрыва.
Увидите легкий или застоявшийся воздух, постепенно окисляющийся до перекиси. Обычно в качестве стабилизатора добавляют 0,1% 2,6-трет-бутил-п-крезола. Его пары и воздух образуют взрывоопасную смесь, в случае открытого пламени высокая температура легко воспламеняется. Может произойти сильная реакция с окислителем. Воздействие воздуха или света может привести к образованию пероксидов с потенциальным риском взрыва.
Последнее обновление:2022-01-01 09:26:16
эфир —
Метод приготовления
Раствор бисульфита натрия добавляли к техническому диэтиловому эфиру и промывали насыщенным раствором хлорида натрия, содержащим 5% гидроксида натрия. Затем его промывают насыщенным раствором хлорида натрия, содержащим небольшое количество серной кислоты, а затем насыщенным раствором хлорида натрия. Наконец, перегонку можно проводить под защитой газообразного аммиака.
Последнее обновление:2022-01-01 09:26:16
эфир —
Использовать
в качестве аналитического реагента. Для анализа фосфора, обнаружения в моче 17-кетона и применяют в качестве растворителей, выщелачивающих средств, анестетиков.
Для анализа фосфора, обнаружения в моче 17-кетона и применяют в качестве растворителей, выщелачивающих средств, анестетиков.
Последнее обновление:2022-01-01 09:26:17
эфир —
Безопасность
крыса орально LD50:1215мг/кг; Ингаляция крысы 2hlcso: 73000×10-6. В случае высокой температуры внутреннее давление контейнера возрастает, и возникает опасность растрескивания и взрыва. Следует держать подальше от источника огня. Его нельзя хранить и смешивать с окислителем, фтором, хлором и т. д.
Последнее обновление:2022-01-01 09:26:17
Физические свойства эфира — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 35774
Диметиловый эфир и этилметиловый эфир являются газами при обычной температуре. Остальные низшие гомологи — бесцветные, приятно пахнущие, летучие жидкости с характерным эфирным запахом.
Остальные низшие гомологи — бесцветные, приятно пахнущие, летучие жидкости с характерным эфирным запахом.
Температуры кипения
Связи С-О в эфире полярны, поэтому эфиры имеют суммарный дипольный момент. Слабая полярность простых эфиров не оказывает заметного влияния на их температуры кипения, которые сравнимы с температурами кипения алкенов с сопоставимой молекулярной массой. Эфиры имеют гораздо более низкую температуру кипения по сравнению с изомерными спиртами. Это связано с тем, что молекулы спиртов связаны водородными связями, а молекулы эфира — нет.
Растворимость
Эфиры, содержащие до 3 атомов углерода, растворимы в воде благодаря образованию водородных связей с молекулами воды.
Растворимость уменьшается с увеличением числа атомов углерода. Относительное увеличение углеводородной части молекулы снижает тенденцию к образованию Н-связи. Эфиры заметно растворимы в органических растворителях, таких как спирт, бензол, ацетон и т. д.
Структура эфиров
Эфиры представляют собой класс органических соединений, которые содержат sp 3 гибридизованный кислород между двумя алкильными группами и имеют формулу R-O-R’ . эти соединения используются в красках, парфюмерии, маслах, восках и других промышленных целях. Алифатические эфиры не имеют арильных групп, непосредственно связанных с кислородом эфира.
Примеры алифатических эфиров
Ароматические эфиры имеют по крайней мере одно арильное кольцо, непосредственно связанное с кислородом эфира. В ариловых эфирах неподеленные пары атомов кислорода сопряжены с ароматическим кольцом, что существенно изменяет свойства эфира.
Пример ароматических эфиров
Гибридизация кислорода sp 3 дает эфирам примерно такую же геометрию, как спирты и вода. Валентный угол R-O-R’ близок к ожидаемому в тетраэдрической геометрии. Валентный угол диметилового эфира равен 112 9 . 0277 o , что больше валентного угла H-O-H в воде (104,5 o ) из-за стерического отталкивания метильных групп.
0277 o , что больше валентного угла H-O-H в воде (104,5 o ) из-за стерического отталкивания метильных групп.
Наличие электроотрицательного атома кислорода придает эфирам небольшой дипольный момент.
Сравнение физических свойств спиртов и простых эфиров
У простых эфиров, в отличие от спиртов, нет атома водорода на атоме кислорода (то есть нет группы ОН). Следовательно, межмолекулярная водородная связь между молекулами эфира отсутствует, что делает их температуру кипения намного ниже, чем у спирта с аналогичной массой. Несмотря на наличие небольшого дипольного момента, эфиры имеют температуры кипения примерно такие же, как у алканов сопоставимой молярной массы. (таблица 18.1.2).
| Краткая структурная формула | Имя | Молярная масса | Температура кипения (°С) | Межмолекулярные водородные связи в чистой жидкости? |
|---|---|---|---|---|
| СН 3 СН 2 Ч 3 | пропан | 44 | –42 | нет |
| СН 3 ОСН 3 | диметиловый эфир | 46 | –25 | нет |
| CH 3 CH 2 OH | спирт этиловый | 46 | 78 | да |
| CH 3 CH 2 CH 2 CH 2 CH 3 | пентан | 72 | 36 | нет |
| CH 3 CH 2 OCH 2 CH 3 | диэтиловый эфир | 74 | 35 | № |
| CH 3 CH 2 CH 2 CH 2 OH | бутиловый спирт | 74 | 117 | да |
Однако молекулы эфира содержат атом кислорода и образуют водородные связи с молекулами воды. Следовательно, эфир имеет примерно такую же растворимость в воде, как изомерный ему спирт. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) практически не растворимы в воде (8 г/100 мл воды).
Следовательно, эфир имеет примерно такую же растворимость в воде, как изомерный ему спирт. Например, диметиловый эфир и этанол (оба имеют молекулярную формулу C 2 H 6 O) полностью растворимы в воде, тогда как диэтиловый эфир и 1-бутанол (оба C 4 H 10 O) практически не растворимы в воде (8 г/100 мл воды).
Образование пероксидов
Многие простые эфиры могут реагировать с кислородом с образованием взрывоопасных пероксидных соединений в ходе свободнорадикального процесса, называемого автоокислением. По этой причине эфиры не следует хранить в течение длительного времени и не следует хранить в стеклянных бутылках. Опасность особенно велика, когда эфирные растворы перегоняются почти досуха. Гидропероксиды могут стать более концентрированными во время перегонки, потому что они, как правило, имеют несколько более высокую температуру кипения, чем соответствующий эфир. Перед проведением перегонки с эфиром необходимо тщательно проверить наличие перекисей.