Содержание
Эфир — ортокремниевая кислота — Большая Энциклопедия Нефти и Газа, статья, страница 1
Cтраница 1
Эфиры ортокремниевой кислоты — ортосиликаты — называют также тетраалкокси — или тетраароксисила-нами.
[1]
Эфиры ортокремниевой кислоты, хотя и не гидролизуются на воздухе, оказывают раздражающее действие на ткани, являются общетоксичными продуктами, поражающими почки, печень и сердечно-сосудистую систему.
[2]
Эфиры ортокремниевой кислоты — это горючие жидкости с характерным запахом, растворимые во многих органических растворителях. Они легко разлагаются водой с омылением, причем присутствие щелочей и кислот ускоряет омыление. Продукты омыления легко конденсируются, что имеет важное техническое значение.
[3]
Эфиры ортокремниевой кислоты и ее производные.
[4]
Эфиры ортокремниевой кислоты и ее производные нашли самостоятельное применение для получения чистого кремния, синтеза других кремнийорганиче-ских соединений, стабилизаторов и модификаторов различных полимерных смесей и резин, связующих для композиционных материалов, как активные отвер-дители полимеров. Особую ценность они представляют как исходные вещества для получения кремнийорганических олигомеров и полимеров.
Особую ценность они представляют как исходные вещества для получения кремнийорганических олигомеров и полимеров.
[5]
Алкоксисиланы — эфиры ортокремниевой кислоты.
[6]
Трехкратная обработка эфирами ортокремниевой кислоты обеспечивает водонепроницаемость. Алкилзамещенные эфиры дают возможность добиться такого же результата после двух пропиток, что связано с водоотталкивающим действием органических радикалов, имеющихся в конечном продукте их гидролиза.
[7]
Гидролиз и конденсация эфиров ортокремниевой кислоты идут аналогично рассмотренному процессу с галогенозамещенными.
[8]
Гидролиз и конденсация эфиров ортокремниевой кислоты идут аналогично рассмотренному процессу с галогенозамещенными.
[9]
Примером таких соединений является эфир ортокремниевой кислоты Si ( ОС2Н5) 4, применяемый для просветления оптики.
[10]
Гидролиз и — конденсация эфиров ортокремниевой кислоты идут аналогично рассмотренному процессу с галогенозамещенными.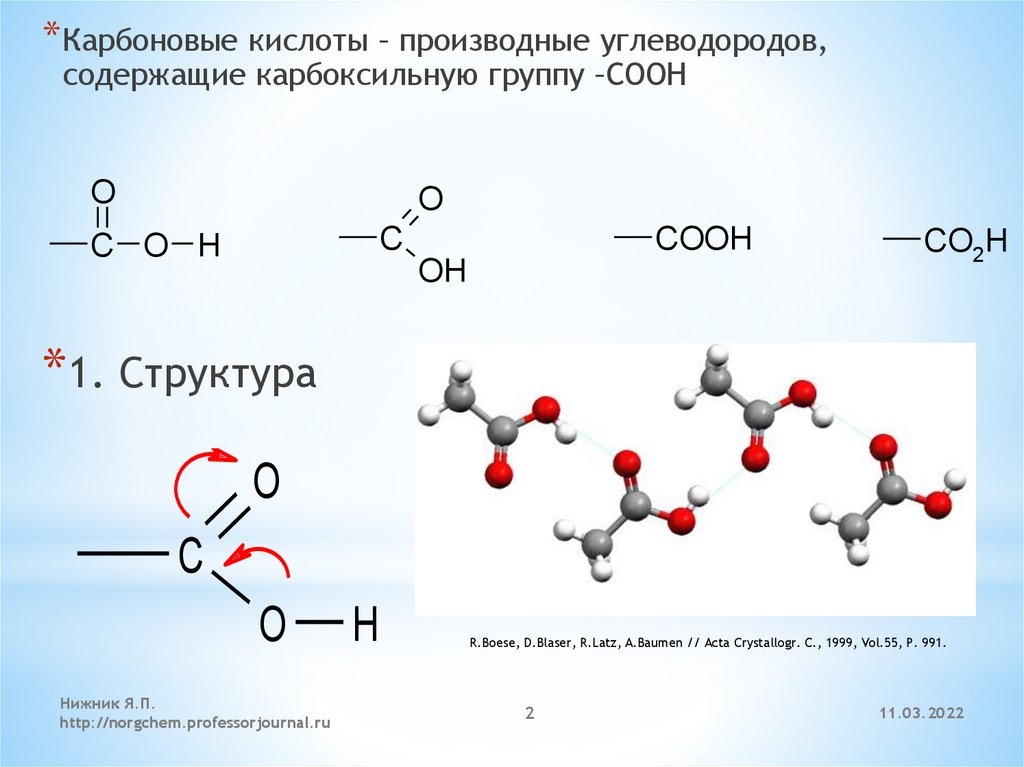
[11]
Общее название силатраны используют для эфиров ортокремниевой кислоты, содержащих азот в эфирной группировке.
[12]
Большое значение для составления кремнийорганических полимерных композиций приобрели также эфиры ортокремниевой кислоты, синтезируемые реакцией тетрахлорсилана со спиртами, например, тетра-этокси -, тетрабутокси — и фенилтрибутоксисиланы.
[13]
К полученному раствору приливают тетраэтоксисилан, в результате чего образуются полимерные эфиру ортокремниевой кислоты. Пластину кремния с нанесенной пленкой помещают в печь ( ( 00 — ( 150 С) и отжигают в атмосфере воздуха в течение 30 сек. Пленки получаются равномерными по толщине, обладают прочным сцеплением с поверхностью кремния и легко подвергаются селективному травлению слабыми растворами плавиковой кислоты.
[14]
Из кремнийсодержащих органических соединений практический интерес как смазочные масла и жидкости представляют эфиры ортокремниевой кислоты.
[15]
Страницы:
1
2
3
Ортокремниевая кислота — Госстандарт
Кремний может образовывать несколько кислот, но все они называются кремниевыми кислотами. Они могут иметь разное расположение атомов в молекуле и разные химические формулы: h3Si2F2, h5SiO4 и др. Чаще всего состав кремниевой кислоты обозначается формулой h3SiO3.
Получение
Так как диоксид кремния с водой не взаимодействует, то кремниевая кислота получается косвенным путем — взаимодействием растворимых силикатов щелочных металлов с кислотами:
Na2SiO3 + 2 HCl => 2NaCl + h3SiO3
Химические свойства
1. При нагревании она разлагается на диоксид и воду:
h3SiO3 => h3O + SiO2
2. Взаимодействует с растворами щелочей, образуя соли-силикаты:
h3SiO3 + 2NaOH => Na2SiO3 + 2h3O
Ортокремниевая кислота растворима в воде, но при стоянии гюлимеризуется. Переход ортокремниевой кислоты в поликислоты сопровождается превращением молекулярного раствора h5Si04 в коллоидные растворы — золи. Золи, в свою очередь, либо застудневают целиком, превращаясь в гель, либо выпадают в виде объемных осадков, увлекая большое количество воды. Состав полученных кислот зависит от исходных веществ и условий протекания реакций.
Золи, в свою очередь, либо застудневают целиком, превращаясь в гель, либо выпадают в виде объемных осадков, увлекая большое количество воды. Состав полученных кислот зависит от исходных веществ и условий протекания реакций.
Ортокремниевая кислота h5SiO4 и борная кислота ( гидроксид бора) В ( ОН) 3 — слабые, а гексафторосиликат водорода h3 [ SiF6 ] и тетрафтороборат водорода H [ BF4 ] — весьма сильные кислоты Гидроксиды цинка и кадмия Zn ( OH) 2 и Cd ( OH) 2 — слабые основания и амфотерные гидроксиды, а гидроксиды тетраамминцинка и гексаамминкадмия [ Zn ( Nh4) 4 ] ( OH) 2 и [ Cd ( Nh4) 6 ] ( OH) 2 — сильные основания Почему.
Ортокремниевая кислота FUSiCU легко растворяется в воде.
Полученная ортокремниевая кислота обладает очень малой стойкостью, поэтому гидролиз проводят непосредственно перед использованием у потребителя при изготовлении формы.
Золь ортокремниевой кислоты , довольно медленно стареет, превращаясь в гель. Если получали золь в среде 80 % CzHsOH, то золь сохраняет рабочие свойства 26 суток; в среде 85 % CsHsOH этот период увеличивается до 49 суток. Этого вполне достаточно для работы.
Этого вполне достаточно для работы.
Образующаяся ортокремниевая кислота выпадает в осадок.
Растворы ортокремниевой кислоты неустойчивы и проявляют стремление образовать мицеллы или перейти в студень.
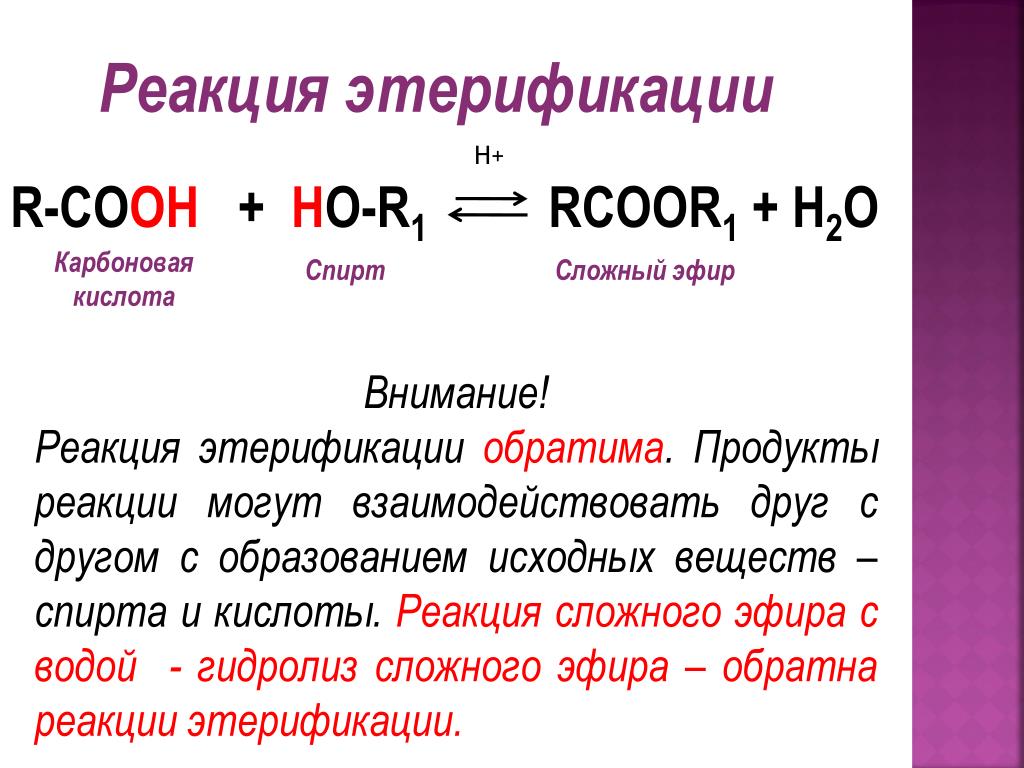
Эфиры ортокремниевой кислоты , хотя и не гидролизуются на воздухе, оказывают раздражающее действие на ткани, являются общетоксичными продуктами, поражающими почки, печень и сердечно-сосудистую систему.
Эфиры ортокремниевой кислоты — это горючие жидкости с характерным запахом, растворимые во многих органических растворителях. Они легко разлагаются водой с омылением, причем присутствие щелочей и кислот ускоряет омыление. Продукты омыления легко конденсируются, что имеет важное техническое значение.
Переход ортокремниевой кислоты в поликислоты сопровождается превращением молекулярного раствора h5Si04 в коллоидные растворы — золи.
Эфиры ортокремниевой кислоты и ее производные.
Эфиры ортокремниевой кислоты и ее производные нашли самостоятельное применение для получения чистого кремния, синтеза других кремнийорганиче-ских соединений, стабилизаторов и модификаторов различных полимерных смесей и резин, связующих для композиционных материалов, как активные отвер-дители полимеров. Особую ценность они представляют как исходные вещества для получения кремнийорганических олигомеров и полимеров.
Особую ценность они представляют как исходные вещества для получения кремнийорганических олигомеров и полимеров.
Переход ортокремниевой кислоты в поликислоты сопровождается превращением молекулярного раствора Н48Ю4 в коллоидные растворы — золи. Золь в свою очередь либо застудневает целиком, т.е. превращается в гель, либо выпадает в виде объемистого осадка, включающего большое количество воды. Состав получаемых кремниевых кислот сильно зависит от исходных веществ и условий проведения реакций.
Эфиры ортокремниевой кислоты — ортосиликаты — называют также тетраалкокси — или тетраароксисила-нами.
Монокремниевая или ортокремниевая кислота Si ( ОН) 4 является растворимой формой кремнезема. Атом кремния в этом соединении координирован с четырьмя атомами кислорода. Растворимость Si ( OH) 4 в воде при 25 С для аморфного кремнезема составляет 0 007 % ( мае.
Это свойство ортокремниевых кислот приводит к обилию различных природных силикатов. Наибольшее распространение в природе имеют силикаты, содержащие алюминий. Состав природных силикатов в большинстве случаев выражается сложными формулами, которые принято писать иначе, чем формулы других солей. Силикаты рассматриваются как бы состоящими из отдельных оксидов металлов, входящих в состав силиката, и диоксида кремния.
Состав природных силикатов в большинстве случаев выражается сложными формулами, которые принято писать иначе, чем формулы других солей. Силикаты рассматриваются как бы состоящими из отдельных оксидов металлов, входящих в состав силиката, и диоксида кремния.
Алкилариловые эфиры ортокремниевой кислоты предлагаются в качестве гидравлических, гидротормозных, амортизаторных жидкостей и теплоносителей [ англ. Соединения, полученные переэтерификацией тетраэтоксисилана эфирами рици-нолевой кислоты, применяют как тормозные жидкости. Они обладают хорошими смазывающими и противоизноснымп свойствами и не вызывают коррозии материалов, из которых изготовлены тормозные системы
Полные органические эфиры ортокремниевой кислоты представляют собой ортокремниевую кислоту h5SiO4 или Si ( OH) 4, в которой атомы водорода заменены органическими радикалами: Si ( OR) 4, где R — алкильный радикал, a OR — эфирная группа. Такие соединения называются алкил ( арил) алкоксисиланами.
Полные органические эфиры ортокремниевой кислоты представляют собой ортокремниевую кислоту h5SiO4 или Si ( OH) 4, в которой атомы водорода заменены органическими радикалами: Si ( OR) 4, где R — алкильный радикал, a OR — эфирная группа.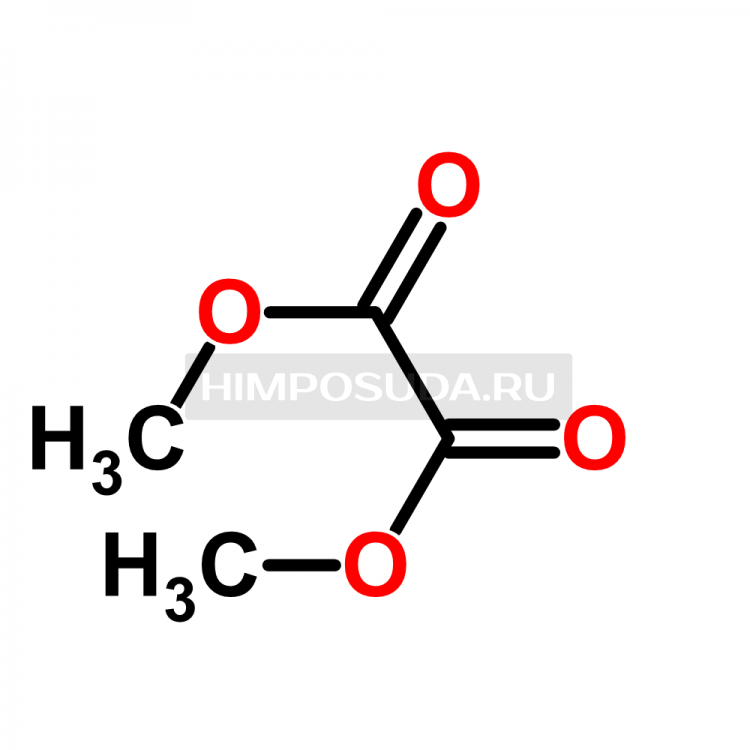 Такие соединения называются алкил ( арил) алкоксисиланами.
Такие соединения называются алкил ( арил) алкоксисиланами.
Ацилоксисиланы — ангидриды ортокремниевой кислоты и органических карбоновых кислот. Метод синтеза ацилоксисиланов заключается во взаимодействии органических карбоновых кислот или лучше их солей с тетрахлорсиланом.
Алкоксисиланы — эфиры ортокремниевой кислоты.
При смешивании золя ортокремниевой кислоты с растворами нитратов других элементов получаются полуколлоидные растворы. В силу того, что ортокремниевая кислота в смеси присутствует в виде коллоидных частиц, она не взаимодействует с солями других компонентов и поэтому силикаты не осаждаются.
Трехкратная обработка эфирами ортокремниевой кислоты обеспечивает водонепроницаемость. Алкилзамещенные эфиры дают возможность добиться такого же результата после двух пропиток, что связано с водоотталкивающим действием органических радикалов, имеющихся в конечном продукте их гидролиза.
Гидролиз и конденсация эфиров ортокремниевой кислоты идут аналогично рассмотренному процессу с галогенозамещенными.
Природные силикаты являются солями ортокремниевой кислоты или сложных поликремниевых кислот.
Приливать к коллоидному раствору ортокремниевой кислоты другие растворы следует малыми порциями в указанном порядке при интенсивном перемешивании. Срок годности полученных полуколлоидных растворов меньше, чем у чистого золя ортокремниевой кислоты, однако достигает 8 суток, что вполне достаточно для работы.
Токсические свойства аминозамещенных эфиров ортокремниевой кислоты определяются свойствами самого эфира; введение амина лишь усиливает раздражающее действие. Диаминозамещенные эфиры более токсичны, чем моноаминозамещенные. АГМ-3 обладает умеренно выраженным местным раздражающим действием и способностью проникать через кожу; АГМ-3 и продукты его превращения могут накапливаться в организме; при повторных контактах чувствительность к нему восприимчивых особей повышается.
Образовавшаяся в результате этой реакции ортокремниевая кислота h5SiO4 распадается с выделением геля 2h3OSiO2, который и является связующим материалом огнеупорного покрытия.
Так, промежуточными стадиями полимеризации ортокремниевой кислоты является образование двуортокремниевой H6Si2O7 и тетраортокремниевой HioSi4Oi3 ( 4SiO2 — 5h3O) кислот.
Опыт показывает, что растворы ортокремниевой кислоты неустойчивы во времени и имеют тенденцию образовать мицеллы или переходить в студень.
Образовавшийся в результате реакции гель ортокремниевой кислоты Н2ЗЮ4 и является связующим.
Гидролиз и — конденсация эфиров ортокремниевой кислоты идут аналогично рассмотренному процессу с галогенозамещенными.
Опыт показывает, что растворы ортокремниевой кислоты неустойчивы во времени и имеют тенденцию образовать мицеллы или переходить в студень.
Примернение
Примером таких соединений является эфир ортокремниевой кислоты Si ( ОС2Н5) 4, применяемый для просветления оптики.
Если же образовать в растворе ортокремниевую кислоту, то сначала получается прозрачный, бесэпорно истинный раствор, так как кремниевая кислота быстро диффундирует из него через пергаментные мембраны.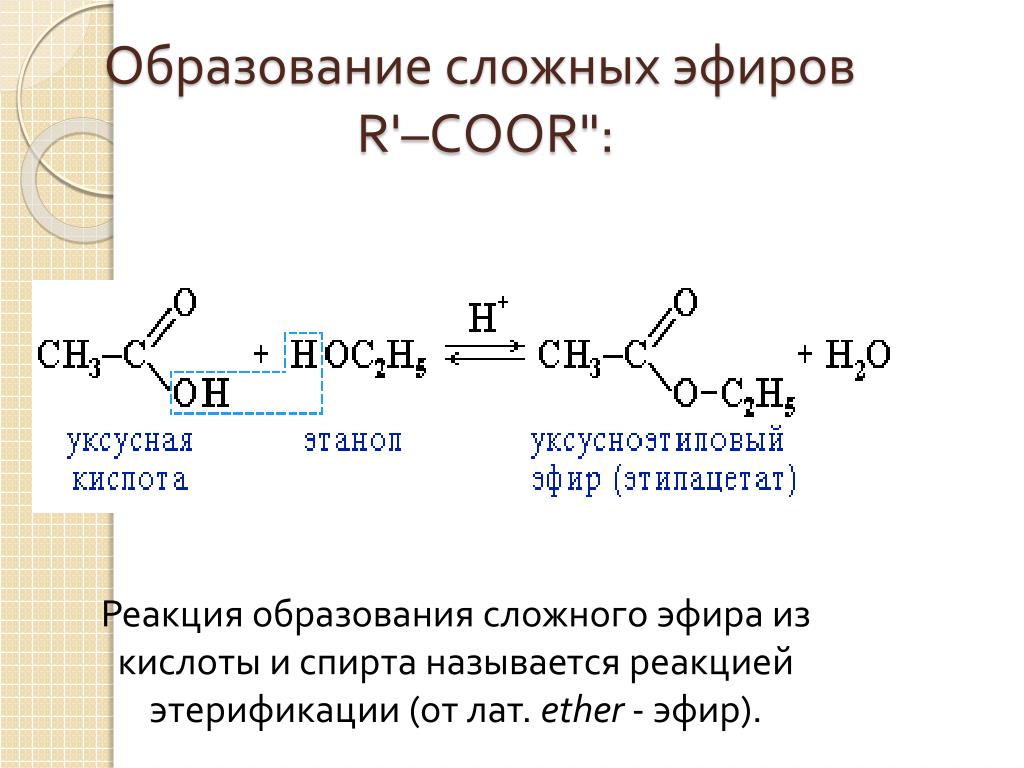 Раствор имеет вначале низкую температуру замерзания, по которой можно рассчитать, что по меньшей мере 75 — 80 % кремниевой кислоты в нем содержится в виде орто-кремниевой кислоты, но с течением времени температура замерзания, вследствие прогрессирующей поликонденсации кислоты, все более возрастает. Раствор неустойчив, он безостановочно изменяется, стареет. Через некоторое время частицы кремниевой кислоты укрупняются настолько, что перестают диффундировать сквозь пергамент, их уже можно теперь увидеть в ультрамикроскоп.
Раствор имеет вначале низкую температуру замерзания, по которой можно рассчитать, что по меньшей мере 75 — 80 % кремниевой кислоты в нем содержится в виде орто-кремниевой кислоты, но с течением времени температура замерзания, вследствие прогрессирующей поликонденсации кислоты, все более возрастает. Раствор неустойчив, он безостановочно изменяется, стареет. Через некоторое время частицы кремниевой кислоты укрупняются настолько, что перестают диффундировать сквозь пергамент, их уже можно теперь увидеть в ультрамикроскоп.
При длительной выдержке в неподвижном состоянии ортокремниевая кислота переходит в золи и гель, а гидроксид алюминия превращается в студенистый осадок. Следовательно, глинокислотные растворы из бифторида аммония не только активнее растворов из плавиковой кислоты, но являются более опасными для ПЗП и могут ухудшать ее проницаемость при нарушении технологии обработки полимиктового коллектора и наличии каолинитовой фракции в пластовом цементе.
Первое кремнийорганическое соединение ( этиловый эфир ортокремниевой кислоты) было получено Эбельманом в 1845 г.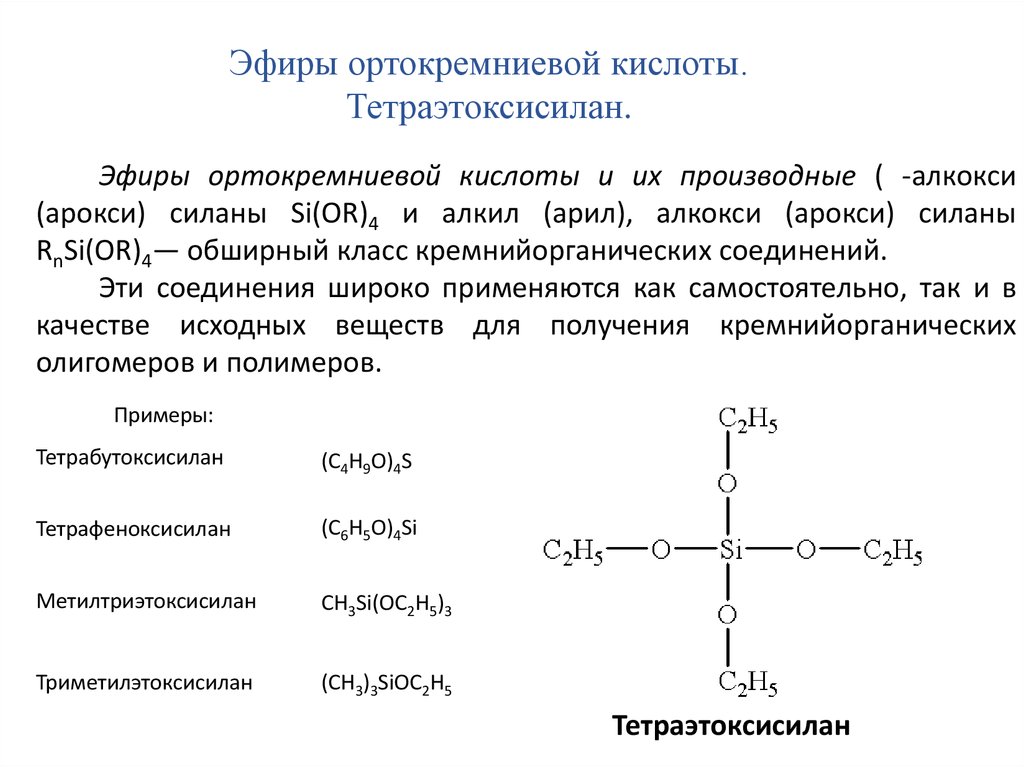 Бурное развитие химии кремнийорга-нических соединений началось в 30 — х годах нашего столетия, когда К. А. Андриановым впервые были синтезированы полиорганоси-локсаны.
Бурное развитие химии кремнийорга-нических соединений началось в 30 — х годах нашего столетия, когда К. А. Андриановым впервые были синтезированы полиорганоси-локсаны.
Общее название силатраны используют для эфиров ортокремниевой кислоты, содержащих азот в эфирной группировке.
Отвердевание замазки сопровождается образованием геля — ортокремниевой кислоты — выделяющегося в результате посте — пенного гидролиза силиката натрия, причем процесс протекает довольно медленно. Процесс может интенсифицировать добавка ускорителя — кремнефторида натрия.
Отвердевание замазки сопровождается образованием геля — ортокремниевой кислоты — выделяющегося в результате посте — пенного гидролиза силиката натрия, причем процесс протекает довольно медленно. Процесс может интенсифицировать добавка ускорителя — кремнефторида натрия.
Техническое название смесей олигомеров этиловых эфиров ортокремниевой кислоты; применяются как связующие при изготовлении форм для литья металлов.
Промышленные марки силикагелей получают, конденсируя ортокремниевую кислоту с минеральными кислотами. Такие образцы силикагелей имеют средне — и тонкопористую структуру с большим диапазоном размеров пор — от десятков до 200 А. Характеристика некоторых силикагелей по размерам пор и удельной поверхности приведена в приложении.
Такие образцы силикагелей имеют средне — и тонкопористую структуру с большим диапазоном размеров пор — от десятков до 200 А. Характеристика некоторых силикагелей по размерам пор и удельной поверхности приведена в приложении.
Не нашли что искали? Вы можете оставить заявку, в форме обратной связи.
Портал Gosstanart.info не осуществляет коммерческой деятельности, не сотрудничает с рекламодателями, производителями товаров и компаниями предоставляющими услуги. Просьба, не обращаться с коммерческими предложениями! Вся информация, представленная на портале, результат независимых исследований и является свободно распространяемой информацией.
Главная Новости портала Черный список Архив Обратная связь
Тетраэтилортосиликат — Американское химическое общество
Я сделан по технологии, разработанной в 1928 году.
Какая я молекула?
Тетраэтилортосиликат (ТЭОС) представляет собой сложный эфир ортокремниевой кислоты, которая существует в природе в небольших количествах везде, где кремнезем находится в контакте с водой. Сложный эфир также известен под несколькими другими названиями, включая этилсиликат (что несколько двусмысленно), тетраэтоксид кремния и тетраэтоксисилан.
Сложный эфир также известен под несколькими другими названиями, включая этилсиликат (что несколько двусмысленно), тетраэтоксид кремния и тетраэтоксисилан.
В знаменательной статье, опубликованной в 1928 г., А. В. Диринг и Э. Эммет Рейд* из Университета Джона Хопкинса (Балтимор) сообщили об улучшении синтеза различных алкилортосиликатов. ТЭОС был получен с выходом 70% медленным добавлением тетрахлорида кремния (SiCl 4 ) в холодный безводный этанол с последующим удалением побочного продукта хлористого водорода потоком сухого воздуха. Реакционная система должна быть строго свободна от воды, потому что, хотя ТЭОС лишь слегка растворим в воде, он гидролизуется с образованием кремнезема и этанола. Реакция лежит в основе современного производства ТЭОС.
TEOS имеет множество специальных применений, включая упрочнение камня (что останавливает распад конструкций и предметов искусства), производство строительных растворов и цемента, а также сшивание силиконовых полимеров. Его мировой рынок в 2020 году оценивается в 245 миллионов долларов США при предполагаемом объеме производства ≈120 000 тонн.
Его мировой рынок в 2020 году оценивается в 245 миллионов долларов США при предполагаемом объеме производства ≈120 000 тонн.
| Класс опасности* | Краткая характеристика опасности | |
|---|---|---|
| Легковоспламеняющиеся жидкости, категория 3 | h326 — Легковоспламеняющиеся жидкости и пары | |
| Серьезное повреждение/раздражение глаз, категория 2А | h419 — вызывает серьезное раздражение глаз | |
| Острая токсичность при вдыхании, категория 3 | h431 — Токсично при вдыхании | |
| Специфическая токсичность на орган-мишень, однократное воздействие, раздражение дыхательных путей, категория 3 | h435 — Может вызывать раздражение дыхательных путей | |
*Глобально согласованная система классификации и маркировки химических веществ.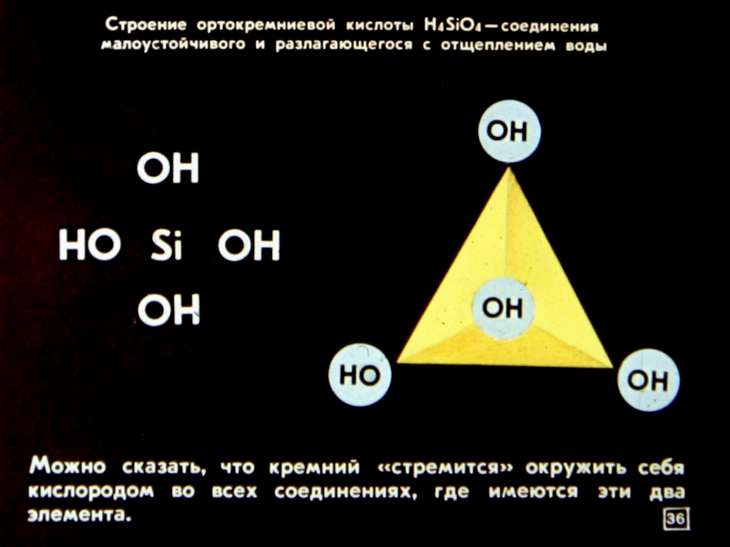
Пояснения к пиктограммам.
Обновление MOTW
Скополамин и его биохимический предшественник гиосциамин были Молекулами недели 21 октября 2013 года. Оба вещества очень токсичны и галлюциногенны. Они обнаружены в растениях семейства пасленовых, таких как паслен, мандрагора, дурман и, что удивительно, томат. Несмотря на опасный характер, оба алкалоида используются в медицине. Недавно Кристина Д. Смольке* и Прашант Шринивасан из Стэнфордского университета (Калифорния) разработали Saccharomyces cerevisiae (пивные дрожжи) для производства гиосциамина и скополамина. Путь биосинтеза считается самым длинным и сложным на сегодняшний день для искусственных дрожжей.
Эта молекула была предложена читателем. Мы представляем почти все молекулы, предложенные нашими читателями. Если у вас есть молекула, которую вы хотите, чтобы мы рассмотрели, отправьте электронное письмо по адресу [email protected]. И спасибо за интерес к Molecule of the Week! — Ред.
Тетраэтилортосиликат быстрые факты
| CAS Рег. № | 78-10-4 |
| Номенклатура SciFinder | Кремниевая кислота (H 4 SiO 4 ), тетраэтиловый эфир |
| Эмпирическая формула | C 8 H 20 O 4 Si |
| Молярная масса | 208,33 г/моль |
| Внешний вид | Бесцветная жидкость |
| Точка кипения | 169 °С |
| Растворимость в воде | 1,5 г/л (разл.) |
Узнайте больше об этой молекуле из CAS, самого авторитетного и всеобъемлющего источника химической информации.
Сложные эфиры кремниевой кислоты | Силикаты | Ортосиликаты | Полисиликат
Сложные эфиры кремниевой кислоты | Силикаты | Ортосиликаты | Полисиликат | Силановые пассиваторы
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 1989-2017 SiSiB SILICONES — ГРУППА РСС. Begin typing your search term above and press enter to search. Press ESC to cancel. Back To Top
|