Содержание
ДБЦО активированный эфир (STP-эфир)
- Товары и услуги
- Клик-химия
- Нефлуоресцентные алкины
- ДБЦО активированный эфир (STP-эфир)
Циклоалкины Безмедная клик-химия Кросс-сшивающие реагенты Мечение белков
| Артикул | Фасовка | Цена | Срок поставки | Купить товар |
|---|---|---|---|---|
| 2584-5mg | 5 mg | – | в наличии | |
| 2584-10mg | 10 mg | $90. 00 00 | в наличии | |
| 2584-25mg | 25 mg | $180.00 | в наличии | |
| 2584-100mg | 100 mg | $450. 00 00 | в наличии | |
| 2584-500mg | 500 mg | $1700.00 | в наличии | |
| 2584-1g | 1 g | $3000. 00 00 | в наличии | |
| 2584-5g | 5 g | по запросу | 10 д |
Оптовый заказ
Сульфотетрафторфениловый эфир дибензоциклооктина (STP-эфир ДБЦО) — это растворимый в воде реагент, который используется для модификации пептидов, антител, белков и других биомолекул, содержащих -Nh3 группу.
STP-эфиры гораздо медленнее гидролизуются по сравнению с NHS-эфирами, что позволяет более эффективно проводить модификацию биомолекул в водной среде.
Дибензоциклооктиновый фрагмент (ДБЦО, DBCO), также известный как ADIBO или DIBAC, является наиболее часто используемым субстратом для безмедных клик-реакций, которые промотируются напряжением цикла. В такой реакции производные DBCO в отсутствие Cu (I) катализатора реагируют с биомолекулами, функционализированными азидной группой, приводя к образованию стабильных триазолов.
Скачать в формате
ChemDraw
С этим продуктом также покупают
PEP (фенилэтинилпирен) азид
Флуорофор на основе ПАУ, флуоресцирующий в синей области. Хорошая альтернатива AMCA и другим кумариновым красителям.
Хорошая альтернатива AMCA и другим кумариновым красителям.
1 mg – $ 110.005 mg – $ 210.0010 mg – $ 310.0025 mg – $ 410.0050 mg – $ 695.00
AF 488 азид
Азид флуорофора AF 488, с эмиссией в зеленой области спектра. Реагирует с алкинами в медь-катализируемых реакциях циклоприсоединения.
1 mg – $ 110.0025 mg – $ 690.00
AF 647 активированный эфир
Яркий, водорастворимый сукцинимидный эфир AF647 для мечения белков и антител.
1 mg – $ 110.0025 mg – $ 1100.0050 mg – $ 1890.00100 mg – $ 2990.00
Общие свойства
| Вид продукта: | бежевый порошок |
| Молекулярная масса: | 569.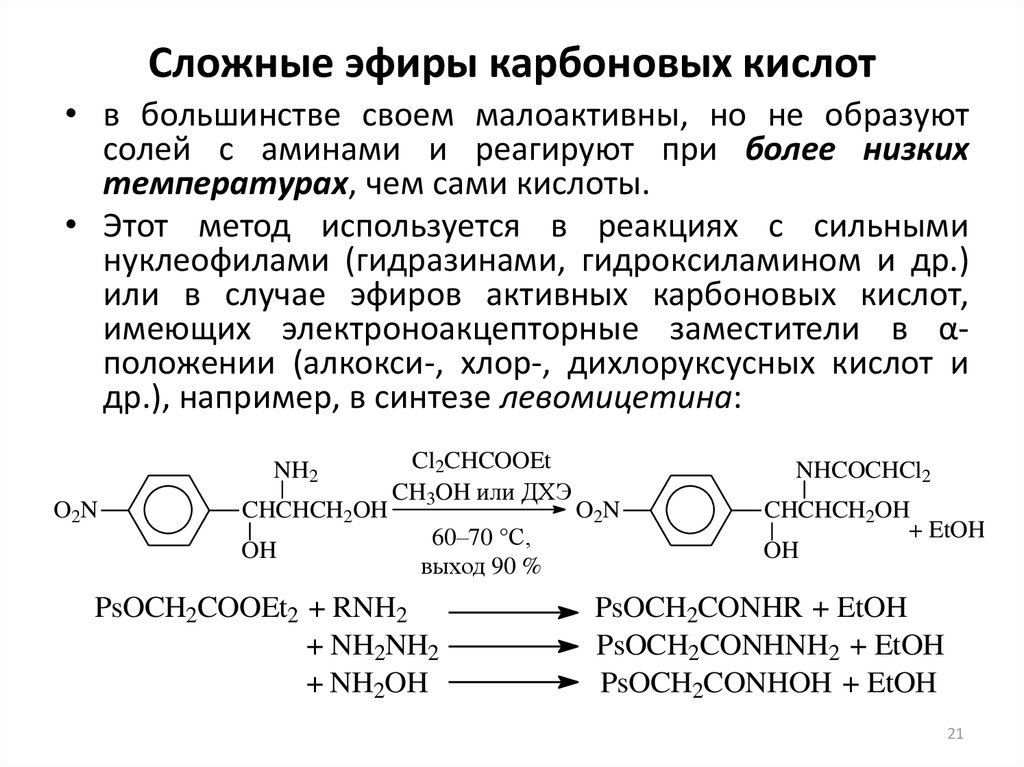 46 46 |
| Брутто-формула: | C26H16NF4O6SNa |
| Растворимость: | хорошая в воде, дихлорметане, ДМФ, ДМСО |
| Контроль качества: | ЯМР 1H, ВЭЖХ-МС (95%) |
| Условия хранения: | Хранение: 12 месяцев (с момента доставки) при -20°C в темноте.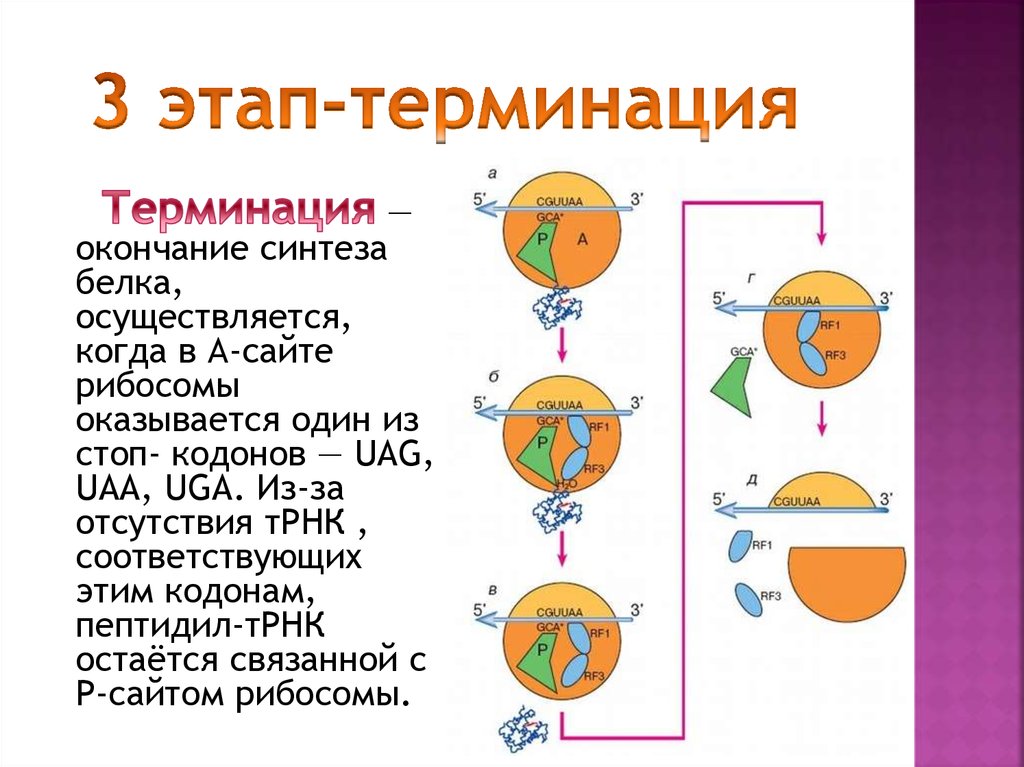 Транспортировка: до трех недель при комнатной температуре. Берегите от влаги. Транспортировка: до трех недель при комнатной температуре. Берегите от влаги. |
| Паспорт безопасности: | Скачать |
| Спецификация продукта |
Товар добавлен.
Просмотрите
корзину покупок
или
оформите заказ
Введено некорректное число товаров для добавления.
СИНТЕЗ ВИНИЛОВЫХ ЭФИРОВ НА ОСНОВЕ 2,5-ДИФЕНИЛ-ГЕКСИН-3-ДИОЛА-2,5 И АЦЕТИЛЕНА
АННОТАЦИЯ
Цель исследований — разработка технологии получения 2,5-дифенил-гексин-3-диола-2,5 и его виниловых эфиров, синтезированных из ацетофенона и ацетилена. Образование моно- и дивиниловых эфиров 2,5-дифенилгексин-3-диола-2,5 изучали в результате винильной реакции 2,5-дифенилгексин-3-диола-2,5 в наличие кислоты. Исследовано влияние температуры, продолжительности реакции, природы и количества катализаторов на процесс. При высоком давлении проводили реакцию винилирования с ацетиленом 2,5-дифенилгексин-3-диол-2,5.
Образование моно- и дивиниловых эфиров 2,5-дифенилгексин-3-диола-2,5 изучали в результате винильной реакции 2,5-дифенилгексин-3-диола-2,5 в наличие кислоты. Исследовано влияние температуры, продолжительности реакции, природы и количества катализаторов на процесс. При высоком давлении проводили реакцию винилирования с ацетиленом 2,5-дифенилгексин-3-диол-2,5.
ABSTRACT
The purpose of the research is to develop a technology for the production of 2,5-diphenyl-hexine-3-diol-2,5 and its vinyl esters synthesized from acetophenone and acetylene. The formation of mono- and divinyl esters of 2,5-diphenylhexine-3-diol-2,5 was studied as a result of the vinyl reaction of 2,5-diphenylhexine-3-diol-2,5 in the presence of acid. The effect of temperature, reaction time, nature and amount of catalysts on the process has been studied. Vinyl processes have been proposed using high pressure 2,5-diphenylhexin-3-diol-2,5 high pressure systems with acetylene.
Ключевые слова:2,5-дифенил-гексин-3-диол-2,5, ацетилен, гомогенный катализ, КОН/ДМСО.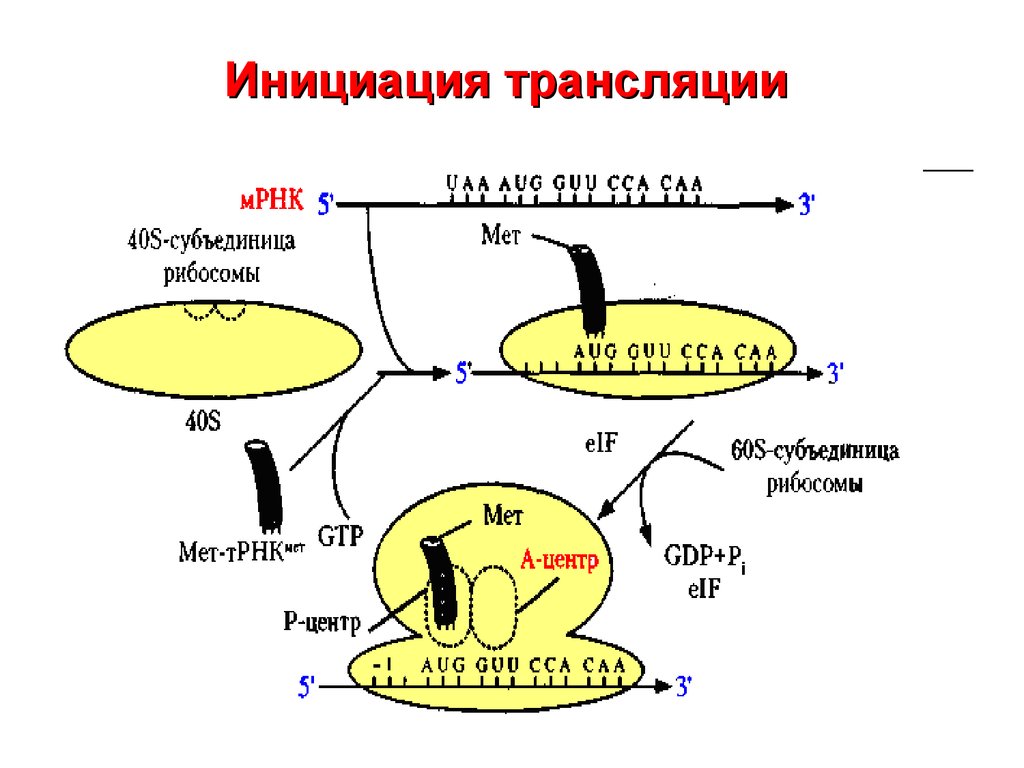
Keywords: 2,5-diphenyl-hexine-3-diol-2,5, acetylene, homogeneous catalysis, KOH/DMSO
Введение. На основе химической переработки нефти и газа, а также органического синтеза он демонстрирует высокую эффективность в производстве различных препаратов и материалов для сельскохозяйственной, химической, фармацевтической, текстильной, энергетической, автомобильной и аэрокосмической промышленности. С целью дальнейшего развития классических реакций на основе ацетилена в последнее десятилетие процесс винилорганических соединений проводят на основе высокоосновной системы и, соответственно, синтезируют виниловые продукты с высоким выходом [1,2].
Реакции ацетилена со спиртами и некоторыми другими веществами гидроксильной группы считаются хорошо изученными. Винильная реакция 2,5-дифенилгексин-3-диол-2,5 с ацетиленом не изучена. С целью дальнейшего развития классических реакций на основе ацетилена в последнее десятилетие процесс винилорганических соединений проводят на основе высокоосновной системы и, соответственно, синтезируют виниловые продукты с высоким выходом [3,4].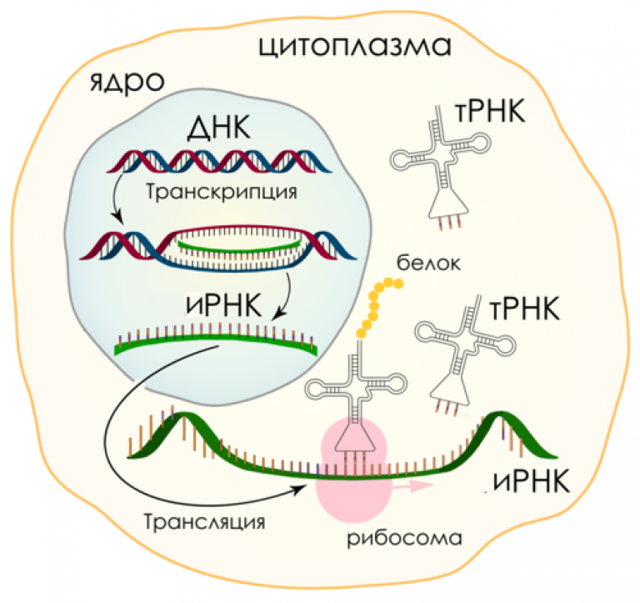
На основе МОН-ДМСО 3,6-диметилоктин-4-диол-3,6 проведена реакция гомогенного каталитического винилирования и синтезированы винилэфиры соответствующего состава [5,6,7].
Материалы и методы
Винилирование 2,5-дифенил-гексин-3-диол-2,5 ацетиленом. В реакции винилирования 2,5-дифенил-гексин-3-диол-2,5 в присутствии ацетилена использовался реактор “Реактор РЦГ” с полуавтоматическим контролем высокого давления, температуры. В реакторе смешивали 200 мл диметилсульфоксида, 0.25 моль, 66.5 г 2,5-дифенилгексин-3-диола-2,5, 5.04 г гидроксида калия. Реактор герметично закрывается, воздух внутри реактора удаляется с помощью газообразного азота. Температура повышается до 50 oC. При достижении температуры 50 °С в реактор через баллон подают ацетилен под давлением 4 атм. Газообразный азот подают в реактор до достижения давления 14 атм. Температуру доводят до 120-130 oC.
Затем процесс останавливали, реактор охлаждали и получали реакционную смесь.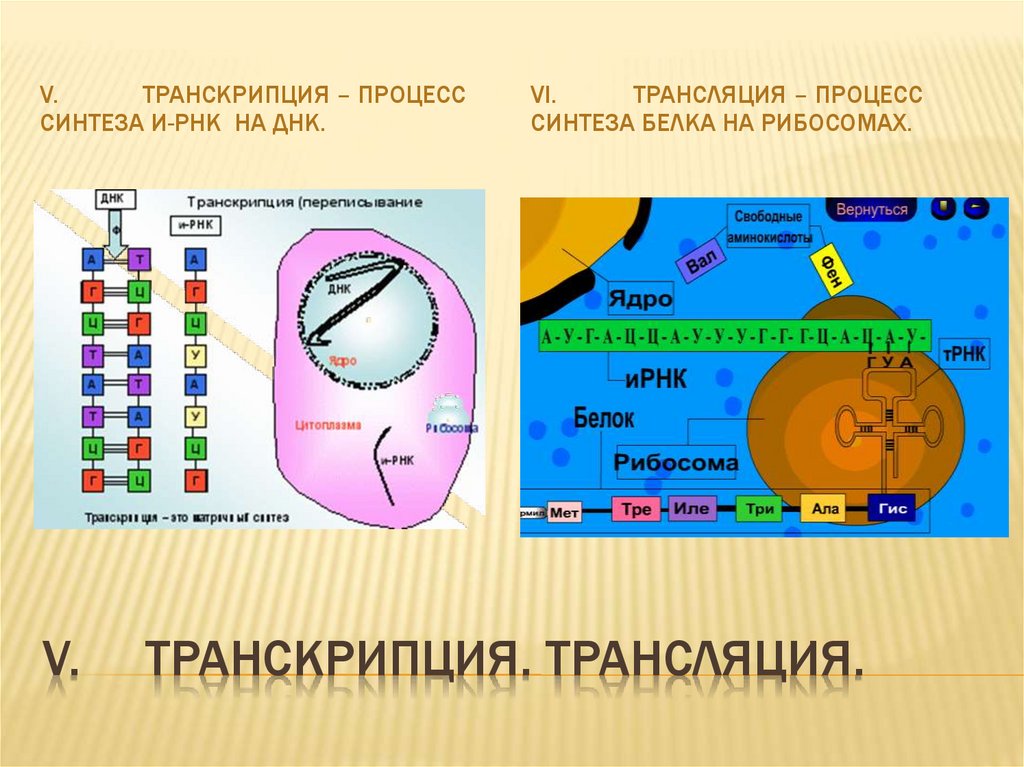 Реакционную смесь нейтрализуют 1% HCl и дважды экстрагируют диэтиловым эфиром. Экстракт сливали с использованием Na2SO4 и удаляли растворитель. Остаточный продукт разделяют на фракции, перемещая под вакуумом. После этого были выделены 2,5-дифенил-гексин-3-диол-2,5 виниловые эфиры 2,5-дифенил-5-винилокси-гексин-3-ол-2, 2,5-дифенил-2,5-дивинилокси-гексин-3.
Реакционную смесь нейтрализуют 1% HCl и дважды экстрагируют диэтиловым эфиром. Экстракт сливали с использованием Na2SO4 и удаляли растворитель. Остаточный продукт разделяют на фракции, перемещая под вакуумом. После этого были выделены 2,5-дифенил-гексин-3-диол-2,5 виниловые эфиры 2,5-дифенил-5-винилокси-гексин-3-ол-2, 2,5-дифенил-2,5-дивинилокси-гексин-3.
Результаты и обсуждение.
В данном исследовании изучался синтез виниловых эфиров в результате реакции винилирования 2,5-дифенил-гексин-3-диол-2,5 с участием высокоосновных систем. Реакция протекает, в основном, с образованием моно- и дивиниловых эфиров. Проведена реакция винилирования 2,5-дифенилгексин-3-диола-2,5 ацетиленом с участием высоко основной системы (MeOH/DMSO) гомогенно-каталитическим методом. Реакция 2,5-дифенил-гексин-3-диола-2,5 с ацетиленом в сверх ассоциированной среде протекает по следующей схеме:
В качестве катализатора использовали гидроксид калия, а в качестве растворителя диметилсульфоксид.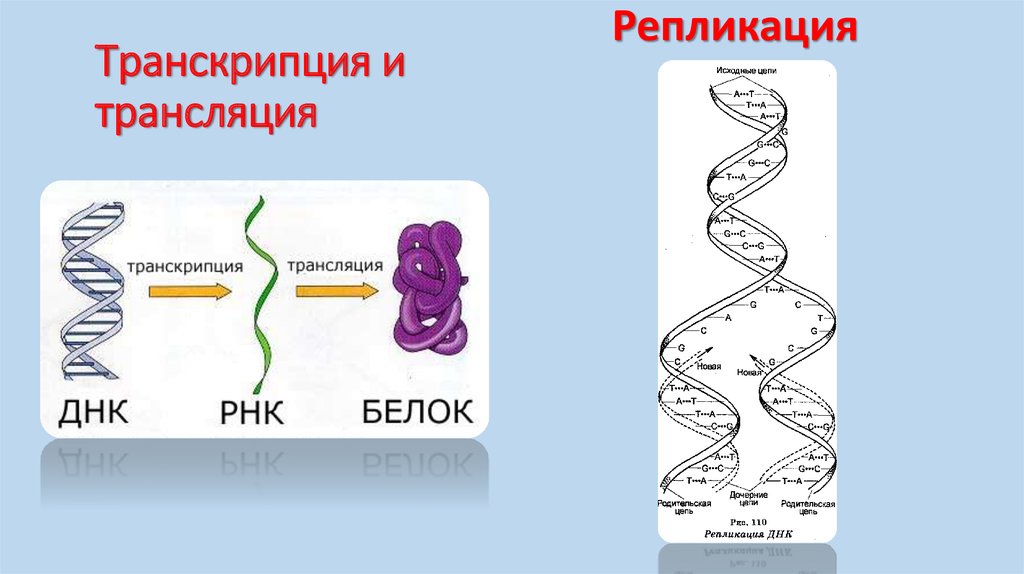 В растворах ДМСО, ДМФА и других полярных растворителей щелочи образуют высокоосновную систему, причем щелочная основность возрастает до 7 раз.
В растворах ДМСО, ДМФА и других полярных растворителей щелочи образуют высокоосновную систему, причем щелочная основность возрастает до 7 раз.
Процессы взаимодействия осуществляются на нескольких стадиях, таких как образование 2,5-дифенил-гексин-3-диол-2,5-ни спирт-иона, образование нестабильных промежуточных комплексов и образование продукта. (КОН/ДМСО) 2,5-дифенил-гексин-3-диол-2,5 взаимодействует с высокоосновной системой, частично поляризуя молекулу с образованием промежуточных продуктов. Промежуточный продукт вступает в реакцию с ацетиленом и образует соединения переходного состояния с низкой стабильностью. В результате разложения высокоосновной системы образуется основной продукт 2,5-дифенил-5-винилокси-гексин-3-ол-2 и 2,5-дифенил-2,5-дивинилкси-гексин-3. Предполагалось, что проводимый процесс проходит в соответствии со следующими руководящими принципами:
Образование 2,5-дифенил-гексин-3-диол-2,5-спирт-иона. В начальной стадии реакции молекула 2,5-дифенил-гексин-3-диол-2,5 координируется с КОН, а в результате переноса протона через комплекс образуется 2,5-дифенил-гексин калия -3-диол-2,5 превращается в спирт.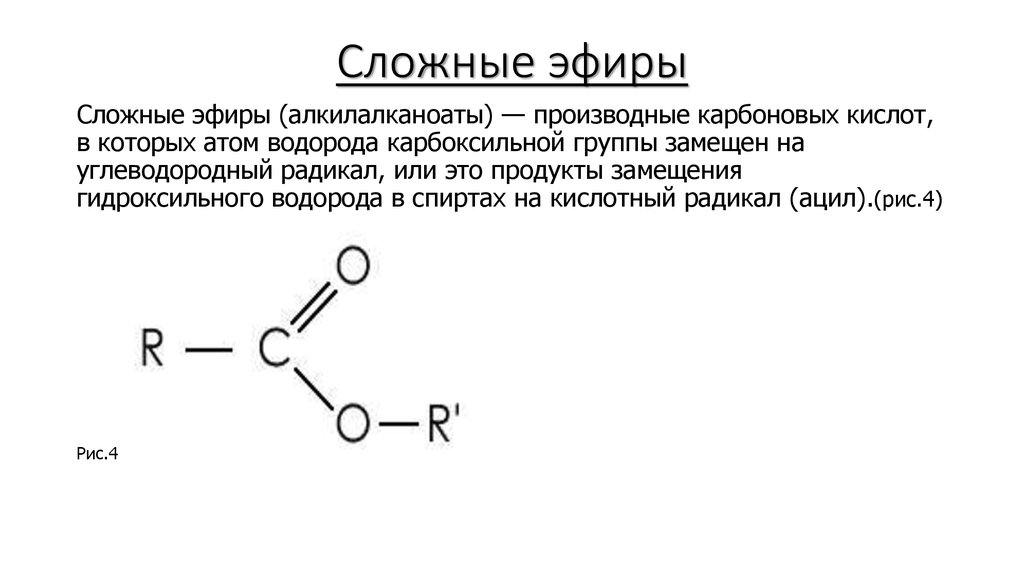
Первоначально в результате координации молекулы 2,5-дифенилгексин-3-диол-2,5 с супер основной системой образуется слабосвязанный промежуточный комплекс. Этот комплекс получается в результате взаимодействия кислорода гидроксильной группы 2,5-дифенил-гексин-3-диола-2,5 с атомом калия в супер комплексе КОН*ДМСО.
Промежуточные комплексы. От присоединения ацетилена к комплексу 2,5-дифенил-гексин-3-диол-2,5-спирта образуется промежуточный комплекс винилового процесса:
В результате этого изменения значение энтальпии системы возрастает. В промежуточном комплексе молекула ацетилена координирована с катионом К+. Окружение растворителя также важно при образовании этого промежуточного комплекса, так как на ацетилен действуют протоны в метильной группе молекулы ДМСО. В результате C2H2 частично поляризуется.
В результате прямого взаимодействия ацетилена со сверх основной средой КОН/ДМСО молекула частично поляризуется и образуется комплекс. В свою очередь, этот комплекс преобразуется в промежуточный комплекс, переходя в состояние, более удобное по структуре и энергии.
В свою очередь, этот комплекс преобразуется в промежуточный комплекс, переходя в состояние, более удобное по структуре и энергии.
В данной работе изучено влияние различных факторов на процесс винилирования 2,5-дифенил-гексин-3-диола-2,5 с ацетиленом в среде КОН/ДМСО. Определены альтернативные условия процесса. В ходе исследования эксперименты проводились при 14–16 атм. В частности, температура и время реакции винилирования в присутствии гидроксида калия (45 мол.%) по отношению к массе 2,5-дифенил-гексин-3-диола-2,5 и 2,5-дифенил-гексин-3-диола- 2.5 с ацетиленом изучалось влияние продолжительности. Полученные результаты представлены в таблице 1.
Таблица 1.
Влияние температуры и продолжительности реакции на реакцию 2,5-дифенилгексин-3-диола-2,5 и ацетилена (катализатор КОН, относительно 45 мол.% диола по массе)
|
Температура,оС
|
Продолжительность реакции, час
|
Выход виниловых эфиров 2,5-дифенилгексин-3-диол-2,5,%
| |
|
2,5-дифенил-5-винилоксигексин-3-ол-2
|
2,5-дифенил-2,5-дивинилокси-гексин-3
| ||
|
100
|
3
|
34.
|
10.2
|
|
4
|
32.1
|
13.3
| |
|
5
|
20.1
|
26.1
| |
|
6
|
12.1
|
34.7
| |
|
110
|
3
|
6.9
|
40.3
|
|
4
|
5.4
|
43.1
| |
|
5
|
5.2
|
47.3
| |
|
6
|
4.
|
48.0
| |
|
120
|
3
|
5.7
|
56.4
|
|
6
|
4.9
|
62.1
| |
|
8
|
3.5
|
61.9
| |
|
130
|
3
|
2.8
|
71.7
|
|
6
|
3.2
|
74.0
| |
|
8
|
2.8
|
68.
| |
|
140
|
3
|
4.2
|
52.0
|
|
6
|
3.1
|
54.1
| |
|
8
|
2.8
|
51.1
| |
Результаты показали, что температура значительно влияет на выход 2,5-дифенилгексин-3-диол-2,5-виниловых эфиров. Его выход увеличивается с 10.2 до 74.0% от температуры 2,5-дифенил-гексин-3-диол-2,5-дивинилового эфира (2,5-дифенил-2,5-дивинилокси-гексин-3). Содержание моновинилового эфира 2,5-дифенилгексин-3-диола-2,5 (2,5-дифенил-5-винилоксигексин-3-ол-2) уменьшилось с 34.9 до 3.2%. Таким образом, моновиниловый эфир превращается в дивиниловый эфир по мере увеличения температуры и времени. Дальнейшее повышение температуры отрицательно сказывалось на выходе продукта. Например, при 140 oC его выход дивинилового эфира составил 52.0, а моновинилового эфира 4.2%. Это объясняется уменьшением растворимости ацетилена в растворителе при очень высоких температурах, что приводит к уменьшению его концентрации, уменьшению скорости реакции и выхода образующегося продукта. Кроме того, при высоких температурах диметилсульфоксид образует смолистые промежуточные продукты с виниловыми эфирами и другими промежуточными продуктами реакции.Результаты показывают, что при повышении температуры выход продукта проходит через максимум 130 oC и составляет 3.2 и 74.0% в моно- и дивиниловых эфирах.
Дальнейшее повышение температуры отрицательно сказывалось на выходе продукта. Например, при 140 oC его выход дивинилового эфира составил 52.0, а моновинилового эфира 4.2%. Это объясняется уменьшением растворимости ацетилена в растворителе при очень высоких температурах, что приводит к уменьшению его концентрации, уменьшению скорости реакции и выхода образующегося продукта. Кроме того, при высоких температурах диметилсульфоксид образует смолистые промежуточные продукты с виниловыми эфирами и другими промежуточными продуктами реакции.Результаты показывают, что при повышении температуры выход продукта проходит через максимум 130 oC и составляет 3.2 и 74.0% в моно- и дивиниловых эфирах.
Влияние количества катализатора (КОН) на выход продукта при температуре 130 оС (как оптимальной температуре) изучали в диапазоне 15-50 моль% (2,5-дифенил-гексин-3-диол-2,5 масс.) (табл. 2).
Таблица 2.
Влияние количества катализатора КОН на выход 2,5-дифенил-5-винилоксигексин-3-ола-2 и 2,5-дифенил-2,5-дивинилоксигексина-3 (температура 130 oC, растворитель — ДМСО, продолжительность реакции 6 часов)
|
Опыт
|
Количество катализатора КОН, моль.
|
Выход 2,5-дифенилгексин-3-диол-2,5-виниловых эфиров, %
| |
|
Моновиниловый эфир
|
Дивиниловый эфир
| ||
|
1.
|
15.0
|
5.2
|
43.1
|
|
2.
|
25.0
|
4.3
|
65.3
|
|
3.
|
40.0
|
2.7
|
67.2
|
|
4.
|
45.
|
3.2
|
74.0
|
|
5.
|
50.0
|
2.1
|
74.5
|
Из таблицы видно, что увеличение количества катализатора влияет на выход 2,5-дифенилгексин-3-диол-2,5-виниловых эфиров и его количество по отношению к массе 2,5-дифенилгексин-3- диол-2,5 (45 мол.%), определяли по результатам экспериментов. Выход 2,5-дифенил-2,5-дивинилоксид-гексина-3 составляет 74.0%, а выход 2,5-дифенил-5-винилоксид-3-ола-2 составляет 3.2%. Когда количество катализатора было получено по отношению к массе диола (50.0%), было обнаружено, что выход составляет 74.5%. Это означает, что до определенных соотношений катализатора и субстрата (по массе) активные центры каталитической системы полностью активны, а при дальнейшем увеличении этого соотношения активные центры в каталитической системе остаются свободными.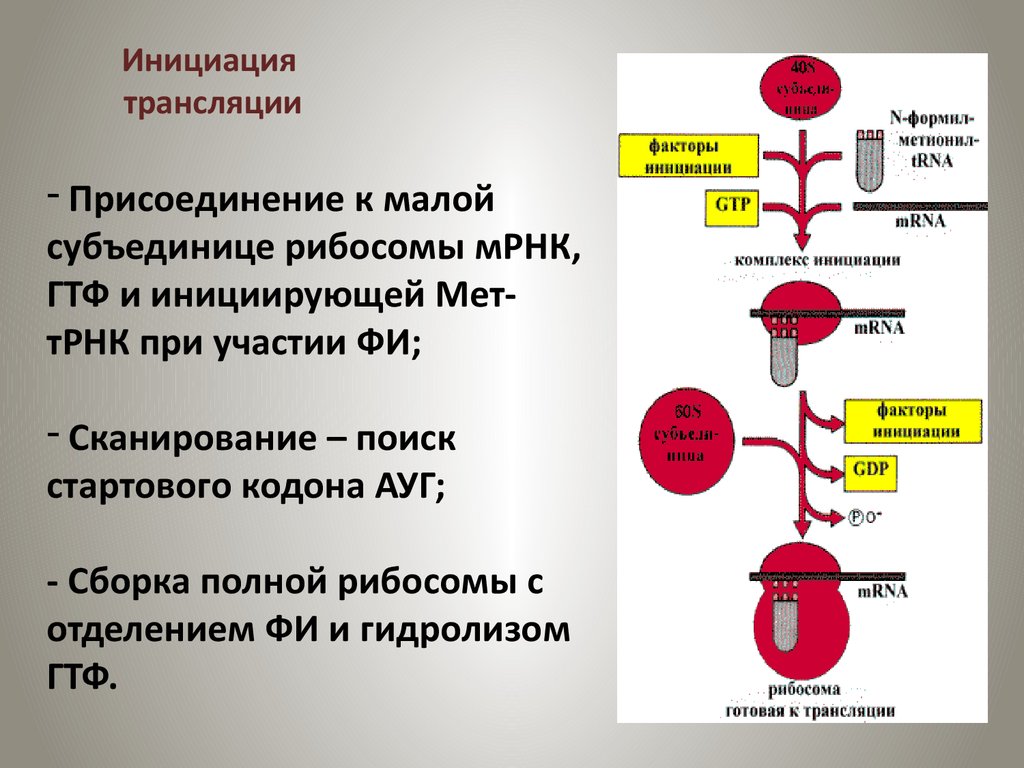
В ходе исследования изучалось влияние катализаторов LiON, NaOH и KOH на выход виниловых эфиров в растворе ДМСО. Например, моно- и дивиниловые эфиры в присутствии катализатора КОН с наибольшим выходом моно- и дивиниловых эфиров, образующиеся из 2,5-дифенилгексин-3-диол-2,5-винилового эфира составили 3.2 и 74.0%, 2.1 и 68.6%, в NaOH 1.9 и 64.2%. в LiOH (табл. 3).
В ходе исследования изучалось влияние катализаторов LiOH, NaOH и KOH на выход виниловых эфиров в растворе ДМСО. Например, самые высокие выходы 2,5-дифенилгексин-3-диол-2,5-виниловых эфиров были получены в присутствии катализатора гидроксида калия, при этом выход моно- и дивиниловых эфиров составил 3,2 и 74,0% соответственно. Из промежуточных значений, определяемых количеством катализатора, активность катализатора КОН оказалась наибольшей.
Таблица 3.
Количество и природа катализатора продуктов винилового эфира зависимости (температура 130 оС, растворитель ДМСО, реакция продолжительность 6 часов)
|
Растворитель
|
Катализатор
|
Содержание катализатора, % (относительно массы 2,5-дифенил-гексин-3-диола-2,5)
|
Выход 2,5-дифенилгексин-3-диол-2,5-виниловых эфиров, %
| ||
|
2,5-дифенил-5-винилоксид-гексин-3-ол-2
|
2,5-дифенил-2,5-дивинилоксигексин-3
| ||||
|
Диметилсульфоксид
|
NaOH
|
25.
|
7.2
|
50.0
| |
|
40.0
|
4.5
|
63.4
| |||
|
45.0
|
2.1
|
68.6
| |||
|
50.0
|
2.0
|
68.5
| |||
|
КOH
|
25.0
|
4.3
|
65.3
| ||
|
40.0
|
2.7
|
67.2
| |||
|
45.
|
3.2
|
74.0
| |||
|
50.0
|
2.1
|
71.1
| |||
|
LiOH
|
25.0
|
4.3
|
46.1
| ||
|
40.0
|
2.5
|
59.4
| |||
|
45.0
|
1.9
|
64.2
| |||
|
50.0
|
1.8
|
64.1
| |||
Заключение
Процесс осуществлялся гомогенно-каталитически под высоким давлением. Синтезированы его моно- и дивиниловые эфиры на основе 2,5-дифенилгексин-3-диола-2,5 и ацетилена. Дан механизм реакции. В результате получали 2,5-дифенил-5-винилоксигексин-3-ол-2 3,2% и 2,5-дифенил-2,5-дивинилоксигексин-3 74,0% с самым высоким выходом. Методами ИК-, 1Н-, 13С-ЯМР-спектроскопии подтверждено строение синтезированных виниловых эфиров и определены их физические константы.
Синтезированы его моно- и дивиниловые эфиры на основе 2,5-дифенилгексин-3-диола-2,5 и ацетилена. Дан механизм реакции. В результате получали 2,5-дифенил-5-винилоксигексин-3-ол-2 3,2% и 2,5-дифенил-2,5-дивинилоксигексин-3 74,0% с самым высоким выходом. Методами ИК-, 1Н-, 13С-ЯМР-спектроскопии подтверждено строение синтезированных виниловых эфиров и определены их физические константы.
Список литературы:
- Трофимов Б.А., Гусарова Н.К. Ацетилен: новые возможности классических реакций // Успехи химии. №6, 2007,- С. 550-565.
- Щелкунов А.В., Кричевский Л.А., Иванова Н.Н. Атлас превращений ацетиленовых соединений. Алма-Ата, «Наука», 1986, 232 с.
- Н.Н. Лебедев Химия и технология основного органического и нефтехимического синтеза. Москва, «Химия», 1981, 605с.
- Трофимов Б.А., Амосова С.В., Михалева А.И. Реакции ацетилена в супер основных средах. Сб. Фундаментальные исследования. Новосибирск, «Наука», 1977. – С. 174-178.

- Юсупова Л.А., Нурманов С.Э., Эргашев Ё.Т. Синтез винилоых эфиров на основе метилэтилкетона и циклогексанона // «UNIVERSUM: ХИМИЯ И БИОЛОГИЯ» Научный журнал. Москва 2020. Выпуск: 11(77) ноябрь 2020, часть 2, -С. 30-33.
- Lola Yusupova, Suvonkul Nurmonov, Shoyunus Obidov, Siroj Andaev, Dostonbek Qahhorov Development of technology for the production of acetylene diols and their vinyl ethers // «UNIVERSUM: ТЕХНИЧЕСКИЕ НАУКИ» Научный журнал. Москва 2021. Выпуск: 11(92) ноябрь 2021. Часть 6, -С. 75-83.
- Yusupova Lola, Abdukarimova Saida, Rajabov Rustambek, Khalimova Oygul. Vinylation by 3,6-dimetyloctin-4-diol-3,6 acetylene // Кимё ва кимё технологияси журнали, 2020. -№ 2, — С. 48-51.
соединений эфира могут работать как ДНК на маслянистых мирах
Солнечный свет отражается от углеводородных морей на спутнике Сатурна Титане, как это видно здесь в ближнем инфракрасном свете с космического корабля «Кассини». Предоставлено: NASA/JPL-Caltech/Univ. Аризона/Унив. Айдахо
Предоставлено: NASA/JPL-Caltech/Univ. Аризона/Унив. Айдахо
В поисках жизни за пределами Земли ученые обоснованно сосредоточили свое внимание на воде, потому что вся биология, какой мы ее знаем, нуждается в этой жидкости. Тем не менее, дикая карта заключается в том, могут ли альтернативные жидкости также быть достаточными для поддержания жизни. Например, холодный спутник Сатурна Титан омывается чернильными морями углеводородного метана.
Здесь, на теплой, водянистой Земле, молекулы ДНК и РНК служат чертежами жизни, содержащими генетические руководства существ. Эти инструкции выполняет огромное семейство белков.
Тем не менее, в углеводородной среде на Титане эти молекулы никогда не могли выполнять свои важные химические задачи. Следовательно, другие молекулы должны взять на себя ответственность, если инопланетная жизнь, не основанная на воде, должна действовать и развиваться в дарвиновском смысле, с генетическими изменениями, ведущими к разнообразию и сложности.
Новое исследование предполагает, что молекулы, называемые эфирами, не используемые ни в каких генетических молекулах на Земле, могут выполнять роль ДНК и РНК в мирах с углеводородными океанами. Исследование показало, что эти миры должны быть намного более жаркими, чем Титан, чтобы иметь место правдоподобная химия.
«Генетические молекулы, которые мы предложили, могут работать на «теплых Титанах», — сказал ведущий автор статьи Стивен Беннер, выдающийся сотрудник Фонда прикладной молекулярной эволюции, частной научно-исследовательской организации, базирующейся в Алачуа, Флорида.
Более крупные молекулярные родственники титанового метана, такие как октан, который помогает заправлять наши транспортные средства, также могли бы стать гораздо более подходящими растворителями. Хотя до сих пор в исследованиях экзопланет не было найдено ни одного «теплого Титана», близкого к своим звездам, Беннер надеется, что существует множество миров, которые отвечают всем требованиям.
«В нашей собственной солнечной системе у нас нет планеты, достаточно большой, достаточно близкой к Солнцу и с подходящей температурой, чтобы поддерживать теплые углеводородные океаны на ее поверхности», — сказал Беннер. «Но каждую неделю астрономы открывают новые солнечные системы, отличные от нашей».
Новая статья появилась в мартовском номере журнала Astrobiology и частично финансировалась подразделением экзобиологии и эволюционной биологии астробиологической программы НАСА.
Молекулярный набросок жизни на Земле
На фундаментальном уровне развитие жизни на Земле представляло собой толчок и притяжение между молекулами, изменяющимися и остающимися неизменными. Чтобы организм мог воспроизводить и создавать копии самого себя, подавляющее большинство его генетической информации должно быть сохранено, если потомство хочет выжить и продолжить жизнь. Но если жизнь не изменится и не приспособится к непостоянным условиям окружающей среды, она вымрет. Кривые окружающей среды для жизни включают колебания температуры и различную доступность воды и питательных веществ.
Кривые окружающей среды для жизни включают колебания температуры и различную доступность воды и питательных веществ.
ДНК и РНК допускают биологическую версию аксиомы «чем больше вещи меняются, тем больше они остаются неизменными». Отдельные «буквы» или нуклеооснования в четырехбуквенном коде ДНК и РНК могут мутировать без нарушения общей формы и функции молекулы.
Эти изменения азотистых оснований могут производить новые белки. Эти белки, в свою очередь, позволяют жизни химически взаимодействовать с окружающей средой новыми способами, способствуя выживанию. Совершенно новые виды возникают таким образом, поскольку свежие черты закрепляются в контрастных условиях и местах. (В середине 1800-х годов Чарльз Дарвин, как известно, интуитивно уловил эту всеобъемлющую концепцию происхождения видов, хотя биомолекулярные мельчайшие детали не были поняты до тех пор, пока не прошло много десятилетий.)
Схема молекулы ДНК. Четыре азотистых основания — A, T, C и G — показаны справа.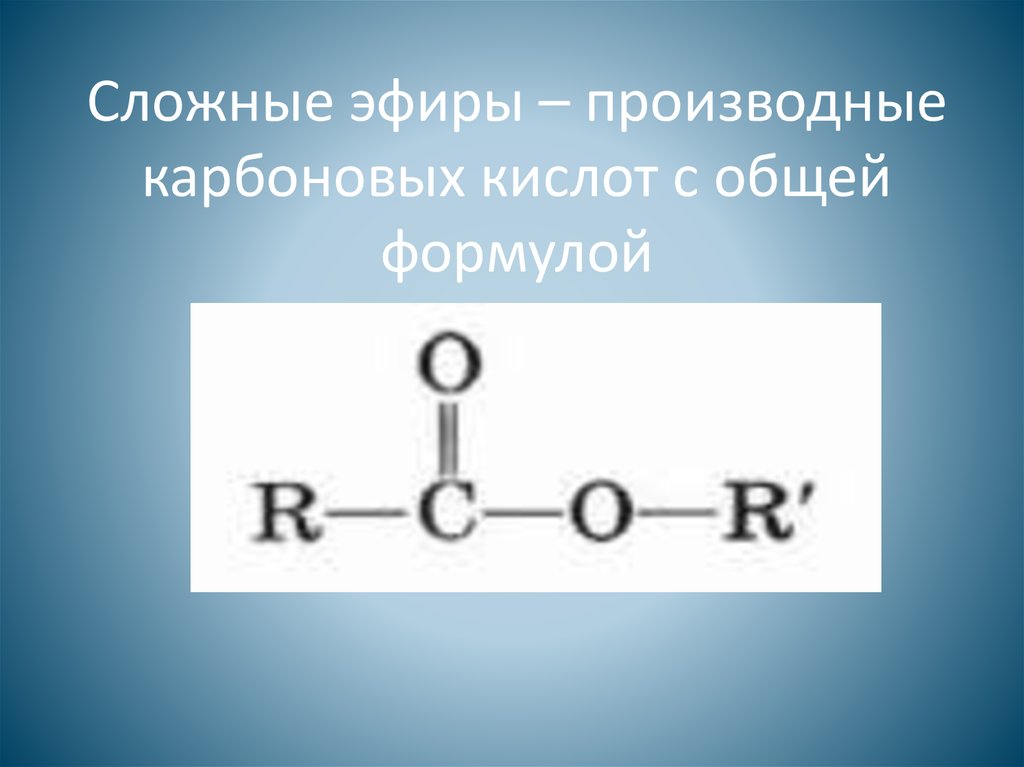 Обратите внимание на повторяющуюся основу из кислорода, углерода и фосфора по всей структуре двойной спирали ДНК. Кредит: Зефирис/Википедия
Обратите внимание на повторяющуюся основу из кислорода, углерода и фосфора по всей структуре двойной спирали ДНК. Кредит: Зефирис/Википедия
Общая структура и, следовательно, общее поведение ДНК и РНК остаются неизменными из-за повторяющихся элементов в химическом остове или основных каркасах. Молекулы обладают внешним отрицательным зарядом, который повторяется вдоль их остова, что позволяет ДНК и РНК растворяться и свободно плавать в воде. В этой жидкой среде ДНК и РНК могут взаимодействовать с другими биомолекулами, что приводит к сложности биологических систем.
«Это центральный пункт «полиэлектролитной теории генов», согласно которой любой генетический биополимер, способный поддерживать дарвиновскую эволюцию, действующую в воде, должен иметь постоянно повторяющийся основной заряд», — объяснил Беннер. «Повторяющиеся заряды настолько доминируют над физическим поведением генетической молекулы, что любые изменения в азотистых основаниях, влияющие на генетическую информацию, практически не оказывают существенного влияния на общие физические свойства молекулы».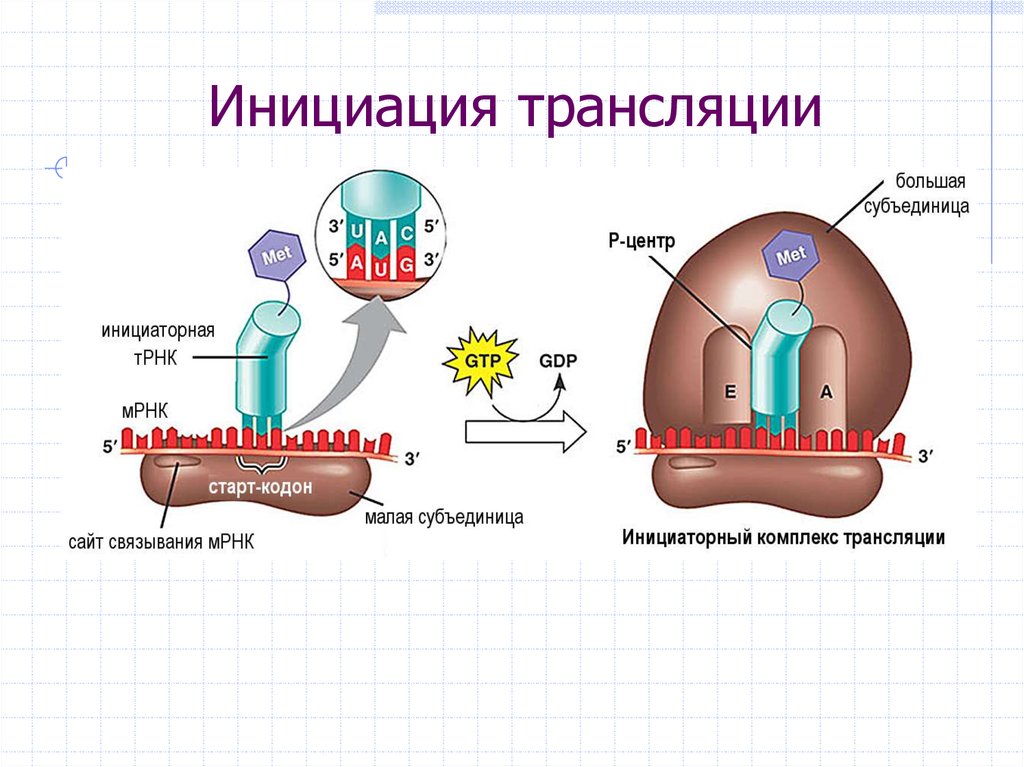
Все это хорошо для нас, водных организмов. Беда в том, что для таких безводных миров, как Титан, где царят углеводороды, такие молекулы, как ДНК и РНК, никогда не смогут его сократить. Эти биомолекулы не могут, как требуется, растворяться в углеводородах, чтобы обеспечить жизнь микроскопическим толчкам и измельчению.
«Ни у одной из этих молекул нет шансов раствориться в углеводородном океане, как на Титане или на теплом Титане», — сказал Беннер.
Еще более неприятным является то, что молекулы с любым видом внешнего заряда скапливаются в углеводородах. Чертежи жизни на Земле, содержащиеся в ДНК и РНК, не могут переноситься на миры, залегающие в углеводородах.
Войдите в эфир
Невозможна ли жизнь, по крайней мере, в том виде, в каком мы можем ее себе представить, среди углеводородов? Беннер и его коллеги считают, что нет. Соединения, называемые простыми эфирами, когда они связаны вместе, образуют сложные «полиэфиры», вероятно, могут работать таким образом, который остается верным полиэлектролитной теории генов.
Эфиры, как ДНК и ДНК, имеют простые повторяющиеся остовы, в их случае углерод и кислород. Структурно эфиры не имеют внешнего заряда, как ДНК и РНК. Но эфиры действительно обладают внутренним отталкиванием зарядов, которые открывают полезные «пространства» внутри молекул, куда могут помещаться небольшие элементарные фрагменты, работающие подобно основаниям ДНК и РНК.
Следуя этому открытию, Беннер и его коллеги проверили, насколько хорошо простые полиэфиры растворяются в различных углеводородах. Исследователи также провели эксперименты при температурах, ожидаемых для миров, подобных Титану, на разных расстояниях от родительских звезд.
Углеводороды, как и вода, могут быть твердыми, жидкими или газообразными, в зависимости от температуры и давления. Как и в случае астробиологической охоты за водной жизнью, интерес представляет жидкая фаза углеводородов, поскольку в твердых телах (таких как лед) биомолекулы не могут взаимодействовать, а в газах (водяной пар) среда слишком тонкая, чтобы поддерживать достаточное количество взаимодействие.
Художественное представление плохо освещенной поверхности Титана под густой оранжевой дымкой Луны, с жидкими углеводородами, скапливающимися и разрушающими поверхность, как вода на Земле. Фото: Стивен Хоббс (Брисбен, Квинсленд, Австралия).
Как правило, диапазон температур, при которых углеводород находится в жидком состоянии, увеличивается по мере увеличения длины углеводорода. Метан, простейший, самый короткий углеводород с одним атомом углерода, связанным с четырьмя атомами водорода, имеет очень узкий диапазон жидких температур — примерно от -300 до -280 градусов по Фаренгейту. Неудобно то, что растворимость эфиров резко падает, когда погружаешься в этот Титанианский озноб.
Согласно исследованию Беннера и к разочарованию многих ученых, Титан выглядит маловероятным местом обитания инопланетян.
«Мы показали, что метановые океаны на Титане, вероятно, слишком холодны, чтобы удерживать какой-либо генетический биополимер», — сказал Беннер.
(Однако загадочные данные о меньшем количестве водорода и ацетилена, чем ожидалось, на поверхности Титана ранее намекали на существование микробной жизни.)
Градусы градусов
Для таких растворителей, как углеводороды, могут существовать обитаемые зоны за пределами обычной зоны для воды. Авторы и права: НАСА/Лаборатория реактивного движения-Калифорнийский технологический институт.
Лучшей ставкой для жизни, чем миры метанового океана, являются те, которые вместо этого покрыты пропаном. Этот углеводород имеет три атома углерода по сравнению с одним атомом метана, и это еще одно известное здесь на Земле название газообразного топлива. Он может оставаться жидким в гораздо более широком и более подходящем для химии диапазоне от -300 до -40 градусов по Фаренгейту. Все же лучше пропана октан. Эта восьмиуглеродная молекула не замерзает примерно до -70 градусов по Фаренгейту и не превращается в газ, пока не достигает довольно высокой температуры 257 градусов по Фаренгейту.
Этот широкий диапазон с достаточной растворимостью в эфире предполагает, что теплые Титаны могут содержать действительно инопланетную биохимию, способную эволюционировать по дарвиновской схеме. Эти миры можно было найти в довольно широкой углеводородной «обитаемой зоне» вокруг других звезд. Пригодная для жизни углеводородная зона похожа на известную зону на водной основе, где планета не находится ни слишком близко, ни слишком далеко от своей звезды, чтобы ее вода полностью выкипела или замерзла.
Представляющие интерес углеводородные миры не обязательно должны быть похожи на Титан, в конце концов, в том смысле, что они не обязательно должны быть спутниками газовых гигантов. Теплые Титаны на самом деле могут быть больше похожи на маслянистые Земли или суперземли, пропитанные октаном.
По мере продолжения исследований новые и экзотические растворители, отличные от воды и углеводородов, все же могут появиться в качестве вероятной среды для жизненных отношений.
«Практически у каждой звезды есть обитаемая зона для каждого растворителя», — сказал Беннер.
Источник:
Астробио.нет
Эта история переиздана с разрешения журнала NASA Astrobiology Magazine. Исследуйте Землю и не только на www.astrobio.net.
Цитата :
Соединения эфира могут работать как ДНК на маслянистых мирах (2015, 12 мая)
получено 12 ноября 2022 г.
с https://phys.org/news/2015-05-ether-compounds-dna-oily-worlds.html
Этот документ защищен авторским правом. Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
Ether Lipids Chemistry and Biology
Select country/regionUnited States of AmericaUnited KingdomAfghanistanÅland IslandsAlbaniaAlgeriaAmerican SamoaAndorraAngolaAnguillaAntigua and BarbudaArgentinaArmeniaArubaAustraliaAustriaAzerbaijanBahamasBahrainBangladeshBarbadosBelgiumBelizeBeninBermudaBhutanBoliviaBonaire, Sint Eustatius and SabaBosnia and HerzegovinaBotswanaBrazilBritish Indian Ocean TerritoryBritish Virgin IslandsBruneiBulgariaBurkina FasoBurundiCambodiaCameroonCanadaCanary IslandsCape VerdeCayman IslandsCentral African RepublicChadChileChinaChristmas IslandCocos (Keeling) IslandsColombiaComorosCongoCook IslandsCosta RicaCroatiaCubaCuraçaoCyprusCzech RepublicDemocratic Republic of the КонгоДанияДжибутиДоминикаДоминиканская РеспубликаЭквадорЕгипетСальвадорЭкваториальная ГвинеяЭритреяЭстонияЭфиопияФолклендские (Мальвинские) островаФарерские островаФедеративные Штаты МикронезииФиджиФинляндияФранцияФранцузская ГвианаФранцузская ПолинезияГабонГамбияГрузияГерманияГанаГибралтарГрецияГринл andGrenadaGuadeloupeGuamGuatemalaGuernseyGuineaGuinea-BissauGuyanaHaitiHondurasHong KongHungaryIcelandIndiaIndonesiaIranIraqIrelandIsle of ManIsraelItalyJamaicaJapanJerseyJordanKazakhstanKenyaKiribatiKuwaitKyrgyzstanLaoLatviaLesothoLiberiaLibyaLiechtensteinLuxembourgMacaoMacedoniaMadagascarMalawiMalaysiaMaldivesMaliMaltaMarshall IslandsMartiniqueMauritaniaMauritiusMayotteMexicoMoldovaMonacoMongoliaMontenegroMontserratMoroccoMozambiqueMyanmarNamibiaNepalNetherlandsNew CaledoniaNew ZealandNicaraguaNigerNiueNorfolk IslandNorth KoreaNorthern Mariana IslandsNorwayOmanPakistanPalauPanamaPapua New GuineaParaguayPeruPhilippinesPitcairnPolandPortugalPuerto RicoQatarRéunionRomaniaRwandaSaint BarthélemySaint HelenaSaint Kitts and NevisSaint LuciaSaint Martin (French part)Saint Pierre and MiquelonSaint Vincent and the GrenadinesSamoaSan MarinoSao Tome and PrincipeSaudi ArabiaSenegalSerbiaSeychellesSierra LeoneSingaporeSint Maarten (Dutch part)SlovakiaSloveniaSolomon IslandsSomaliaSouth AfricaSouth Georgia and the South Sandwich IslandsSouth KoreaSouth SudanSpainSri LankaSudanSurinameSvalbard and Jan MayenSwazilandSwedenSwitzerlandSyriaTaiwanTajikistanTanzaniaThailandTimor LesteTogoTokelauTongaTrinidad and TobagoTunisiaTurkeyTurkmenistanTurks and Caicos IslandsTuvaluUgandaUkraineUnited Arab EmiratesUruguayUS Virgin IslandsUzbekistanVanuatuVatican CityVenezuelaVietnamWallis and FutunaWestern SaharaYemenZambiaZimbabwe
Варианты покупки
Ebook 25% скин. обеспечивает основные прорывы в области химии и биологии эфирных липидов. Эта книга содержит 16 глав и начинается с истории изучения эфирных липидов. Последующие главы посвящены химическому синтезу, аналитическим процедурам, биологическим эффектам и метаболическим путям этих липидов. Значительные главы посвящены биохимическим аспектам эфирных липидов у различных видов, таких как млекопитающие, птицы, морские организмы, моллюски, простейшие, бактерии и растения. Эти главы также иллюстрируют пригодность и полезность различных тканей для выяснения роли этих липидов в живых системах. Этот текст будет полезен химикам, биологам, ученым и исследователям в области биомедицины, а также аспирантам.
обеспечивает основные прорывы в области химии и биологии эфирных липидов. Эта книга содержит 16 глав и начинается с истории изучения эфирных липидов. Последующие главы посвящены химическому синтезу, аналитическим процедурам, биологическим эффектам и метаболическим путям этих липидов. Значительные главы посвящены биохимическим аспектам эфирных липидов у различных видов, таких как млекопитающие, птицы, морские организмы, моллюски, простейшие, бактерии и растения. Эти главы также иллюстрируют пригодность и полезность различных тканей для выяснения роли этих липидов в живых системах. Этот текст будет полезен химикам, биологам, ученым и исследователям в области биомедицины, а также аспирантам.
Оглавление
- Список авторов
Предисловие
Номенклатура
Глава I История эфиросвязанных липидов до 1960 г.
I. Плазмалогены
II. Алкоксилипиды
Ссылки
Приложение — Применение в биомедицине
Глава II Липиды, связанные с эфиром: химия и методы измерения
I. Введение
Введение
II. Алкилглицериловые эфиры (1-алкилглицеролы)
III. Диалкилглицериловые эфиры
IV. Алк-1-енилглицериловые эфиры
Ссылки
Глава III Химический синтез алкоксилипидов
I. Введение
II. Синтезы длинноцепочечных алкилглицериновых эфиров
III. Синтез длинноцепочечных эфиров глицерина
IV. Синтезы других нейтральных алкоксилипидов 90–114 V. Синтезы алкоксифосфолипидов 90–114 VI. Синтез некоторых аналогов фосфолипидов
Ссылки
Глава IV Химический синтез глицеролипидов, содержащих S-алкильные, гидрокси-O-алкильные и метокси-O-алкильные группы
I. Синтез глицеролипидов, содержащих S-алкильные группы
II. Синтез глицеролипидов, содержащих гидроксизамещенные О-алкильные группы 90–114 III. Синтез глицеролипидов, содержащих метоксизамещенные О-алкильные группы 90–114 Литература 90–114 Глава V. Химический синтез плазмалогенов 90–114 I. Введение 90–114 II. Получение алк-1-ениловых эфиров глицерина
III. Получение производных алк-1-енилглицериновых эфиров, подходящих для фосфорилирования 90–114 IV. Синтетические алк-1-енилглицериновые эфиры, содержащие группы фосфатных эфиров
Синтетические алк-1-енилглицериновые эфиры, содержащие группы фосфатных эфиров
Ссылки
Глава VI Химический синтез O-алкилдигидроксиацетонфосфата и родственных соединений
I. Введение
II. Синтез дигидроксиацетонфосфата
III. Синтез ацилпроизводных дигидроксиацетона и дигидроксиацетонфосфата 90–114 IV. Синтез O-алкилпроизводных дигидроксиацетона и дигидроксиацетонфосфата
Ссылки
Глава VII Ферментативный путь эфиросвязанных липидов и их предшественников
I. Ферментативный синтез алкилглицеролипидов
II. Ферментативный синтез плазмалогенов 90–114 III. Ферментативный синтез эфирных связей в различных липидах и других соединениях 90–114 IV. Ферментативные реакции, ответственные за биосинтез эфирных предшественников 90–114 V. Ферментативная деградация эфирных связей в глицеролипидах 90–114 VI. Связанные эфиром глицеролипиды как субстраты для липаз, фосфолипаз и фосфатаз
Ссылки
Глава VIII Биологические эффекты и биомедицинские применения алкоксилипидов
I. Введение
Введение
II. Токсичность алкоксилипидов
III. Абсорбция алкоксилипидов и использование алкоксилипидов в исследованиях абсорбции «жиров» 90–114 IV. Алкоксилипиды как субстраты для ацилгидролаз 90–114 V. Применение алкоксилипидов в терапии 90–114 VI. Возможные функции встречающихся в природе алкоксилипидов 90–114 VII. Выводы
Литература
Глава IX Содержание, состав и метаболизм липидов млекопитающих и птиц, содержащих эфирные группы
I. Введение
II. Содержание
III. Композиция
IV. Метаболизм
V. Резюме
Ссылки
Глава X Липиды, связанные с эфиром, и предшественники жирных спиртов в новообразованиях
I. Введение
II. Природа связанных эфиром алифатических фрагментов в опухолевых клетках 90–114 III. Содержание связанных с эфиром липидов в опухолевых клетках 90–114 IV. Жирные спирты в новообразованиях 90–114 V. Метаболизм глицеролипидов, связанных эфиром, в новообразованиях 90–114 Ссылки 90–114 Глава XI Эфирная связь в морских липидах 90–114 I. Введение 90–114 II. Алкилглицеролипиды
Введение 90–114 II. Алкилглицеролипиды
III. Алк-1-енилглицеролипиды
IV. Связанные эфиром фосфатиды и другие структуры
V. Диоловые липиды
Ссылки
Глава XII Связанные эфиром липиды у моллюсков
I. Введение
II. Рассылка
III. Метаболизм
Ссылки
Глава XIII Липиды, связанные с эфиром, у простейших
I. Введение
II. Рассылка
III. Метаболизм
IV. Биологическая функция
V. Выводы
Ссылки
Глава XIV Бактериальные плазмалогены
I. Распространение плазмалогенов среди бактерий
I I . Альдегидные цепи бактериальных плазмалогенов 90–114 III. Алкилглицеролипиды в бактериях 90–114 IV. Бактериальный биосинтез плазмалогена
V. Резюме
Ссылки
Глава XV Связанные эфиром липиды в экстремально галофильных бактериях
I. Введение
II. Чрезвычайно галофильные бактерии 90–114 III. Химия эфиросвязанных липидов крайне галофильных бактерий 90–114 IV. Метаболические исследования 90–114 V. Функция липидов дифитанилового эфира в клетках экстремально галофильных бактерий
Литература
Глава XVI Поиск алкоксилипидов в растениях
I.

 9
9 8
8 6
6 % (относительно массы 2,5-дифенил-гексин-3-диола-2,5)
% (относительно массы 2,5-дифенил-гексин-3-диола-2,5) 0
0 0
0 0
0