Содержание
Списки прекурсоров
Списки прекурсоров
Информацию с этой страницы можно скачать в PDF
Список прекурсоров, оборот которых в Российской Федерации ограничен и в отношении которых устанавливаются меры контроля в соответствии с законодательством Российской Федерации и международными договорами Российской Федерации (список IV)
(в ред. Постановления Правительства РФ от 28 марта 2018 г. N 337)
Таблица I
прекурсоров, оборот которых в Российской Федерации ограничен
и в отношении которых устанавливаются особые меры контроля*
Таблица II
прекурсоров, оборот которых в Российской Федерации ограничен
и в отношении которых устанавливаются общие меры контроля*
Таблица III
прекурсоров, оборот которых в Российской Федерации ограничен
и в отношении которых допускается исключение некоторых мер контроля*
Примечания
1. Отнесение вещества к соответствующему наркотическому средству, психотропному веществу или их прекурсору, внесенному в настоящий перечень, не зависит от того, какие фирменные (торговые) наименования, синонимы или аббревиатуры используются в качестве его наименования.
Отнесение вещества к соответствующему наркотическому средству, психотропному веществу или их прекурсору, внесенному в настоящий перечень, не зависит от того, какие фирменные (торговые) наименования, синонимы или аббревиатуры используются в качестве его наименования.
(п. 1 в ред. Постановления Правительства РФ от 03.06.2010 N 398)
2. Контроль распространяется на препараты, содержащие наркотические средства и психотропные вещества, указанные в настоящем перечне, независимо от их количества и наличия нейтральных компонентов (вода, крахмал, сахар, бикарбонат натрия, тальк и т.п.).
(в ред. Постановления Правительства РФ от 03.06.2010 N 398)
В отношении комбинированных лекарственных препаратов, содержащих, кроме основного контролируемого вещества, другие фармакологически активные компоненты, контроль устанавливается в индивидуальном порядке путем включения данного комбинированного лекарственного препарата в соответствующий список настоящего перечня.
3. Препарат, содержащий несколько прекурсоров, внесенных в таблицы списка IV настоящего перечня, контролируется как содержащийся в нем прекурсор, предусмотренный таблицей списка IV настоящего перечня, имеющей наименьший порядковый номер.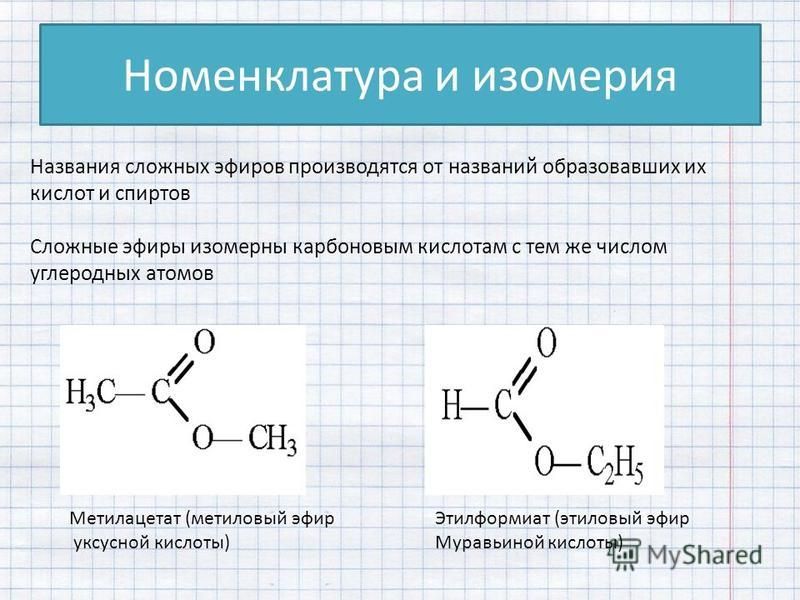
(п. 3 в ред. Постановления Правительства РФ от 03.06.2010 N 398)
4. Смеси, содержащие несколько перечисленных в таблице III списка IV веществ, подлежат контролю, если их суммарная концентрация равна или превышает концентрацию, установленную для одного из веществ, величина которой в таблице имеет наибольшее значение.
(п. 4 введен Постановлением Правительства РФ от 03.06.2010 N 398)
5. Концентрация веществ, указанных в списке IV настоящего перечня, определяется исходя из массовой доли вещества в составе смеси (раствора).
(п. 5 введен Постановлением Правительства РФ от 03.06.2010 N 398)
Список наркотических средств, психотропных веществ и их ПРЕКУРСОРОВ,
оборот которых в Российской Федерации запрещен в соответствии с законодательством Российской Федерации и международными договорами Российской Федерации
(СПИСОК I)
ПРЕКУРСОРЫ
(в ред. Постановления Правительства РФ от 22.02.2019 г. N 182)
Примечания
Изомеры, в том числе стереоизомеры (если таковые определенно не исключены), наркотических средств и психотропных веществ, перечисленных в этом списке, в том случае, когда существование таких изомеров, в том числе стереоизомеров, возможно в рамках данного химического обозначения;
Эфиры сложные и простые наркотических средств и психотропных веществ, перечисленных в данном списке;
Соли всех наркотических средств, психотропных веществ и их прекурсоров, перечисленных в данном списке, если существование таких солей возможно;
Все смеси, в состав которых входят наркотические средства и психотропные вещества данного списка, независимо от их количества.
Контакты
+7 (911) 100-30-50
[email protected]
192019, г. Санкт-Петербург, улица 2-й Луч, д. 9, литер А, оф. 303
9.00–18.00
© Все права защищены. ООО «ВЕКТОН АУДИТ»
Перечень прекурсоров в Украине
Просмотрите и сохраните себе перечень прекурсоров, утвержденых в Украине законодательно!
Внутрішній аудит у ЗОЗ: як організувати і розробити документи
Перечень прекурсоров, обращение которых ограничено и касательно которых установлены меры контроля, утвержден Постановлением КМУ «Про затвердження переліку наркотичних засобів, психотропних речовин і прекурсорів» № 770 от 6 мая 2000.
Согласно украинскому законодательству:
Прекурсоры наркотических веществ и психотропных веществ — вещества, которые используют для производства наркотических средств, психотропных веществ, которые включены в Перечень наркотических средств, психотропных веществ и прекурсоров.
За неправильное хранение наркотических средств и прекурсоров учреждение понесет ответственность. Будьте внимательны — не так давно требования к хранению изменились.
Читайте: «Стерилизация в автоклаве: безопасность, режимы»
Список N 1
Прекурсоры, обращение которых ограниченно и относительно которых устанавливаются меры контроля
Международное незарегистрированное название | Химическое название |
N-ацетилантраниловая кислота | 2-ацетиламинобензойна кислота |
Ангидрид уксусной кислоты | уксусный ангидрид |
Ергометрин | бета-пропаноламид лизергиновой кислоты малеат; 9, 10-дидегидро-N-[(S)- 1-метилетил]- метилерголин-8в-карбоксиамид малеат |
Ерготамин | ерготаман-3′,6′, 18-трион,12′-гидрокси-2’метил-5′-(фенілметил)-(5’a), [R-(R*, R*)]-2, 3-дигидроксибутандиоат |
Ефедрин | [R-(R*, S*)]-a[1-(метиламино)етил]-фенилметанол; фенил- 2-(метиламино)-пропанол |
Изосафрол | 3, 4-метилендиокси-(1′-пропенил) бензол |
Лизергиновая кислота | 9, метилерголин-8в-карбоновая кислота |
3, 2-пропанон (3, МДФ-2Г) | 3, 4-метилендиокси-(пропил-2-вон)бензол |
Пиперональ | 3,4-(метилендиокси) бензальдегид; гелиотропин |
Псевдоефедрин | (S-(R*, R*]-a-[1-(метиламино)етил]-фенилметанол; фенил- 2-(метиламино) пропанол |
Сафрол | 3, 4-метилендиоксиалилбензол |
Фенилацетон | 2-пропанон; метилбензилкетон |
Фенилнитропропен | 2-нитропропен |
Фенилоцтова кислота | альфа-толуиловая кислота |
Фенилпропаноламин (ФПА, норефедрин) | (±)- фенилпропанол-1 |
- В список также включены соли всех перечисленных в нем веществ, если образование таких солей возможно.

- Относительно растений или их частей, которые содержат любое средство, из этого списка, осуществляются те же меры контроля, как и относительно указанного средства.
Читайте: «Санепідрежим у хірургічному відділенні: вимоги до приміщень та працівників»
Список N 2
Прекурсоры, относительно которых устанавливаются меры контроля
Международное незарегистрированное название | Химическое название |
Позиция исключена | |
Антраниловая кислота | 2-аминобензойная кислота |
Ацетон | 2-пропанон |
Этиловый эфир | диэтиловый эфир |
Калия перманганат | калий марганцовокислый |
Метилетилкетон | 2-бутанон |
Пиперидин | гексагидропиридин; пентаметиленимин |
Серная кислота | сульфатная кислота |
Соляная кислота | хлористоводородная кислота |
Толуол | метилбензол |
Позиция исключена | |
Читайте: «Лицензия на медицинскую практику: документы, процедура получения, аннулирование»
Примечание
- В этот перечень также включены соли всех перечисленных в нем веществ в случае, если образование таких солей возможно, за исключением солей серной и соляной кислот.

- Вещества, которые содержат не менее чем 50 процентов таких прекурсоров, как ацетон, этиловый эфир, толуол, и 80 процентов таких прекурсоров, как метилетилкетон, подлежат тем же мерам контроля, что и прекурсоры.
- Вещества, которые содержат не менее чем 45 процентов таких прекурсоров, как серная кислота, и 15 процентов таких прекурсоров, как соляная кислота, подлежат тем же мерам контроля, который и прекурсоры.
- Смеси, которые содержат несколько перечисленных в этом списке веществ, подлежат контролю, если их суммарная концентрация равняется или превышает концентрацию, установленную для одной из веществ (с учетом положений первого и второго абзацев этого примечания).
Концентрация веществ, перечисленных в этом списке, определяется исходя из массовой доли вещества в составе смеси (раствора).
Читайте більше:
- Предстерилизационная обработка: этапы, способы очистки, средства
- Організація первинної медико санітарної допомоги по-новому: як закладу стати комунальним некомерційним підприємством
- Ведение медицинской документации: требования к бланкам, обязанности администрации, советы врачам
- Форма № 070/о: справка для получения путевки на санаторно-курортное лечение
- Декларація про відходи: зразок та правила надання
- Диспансеризация: организация и контроль за эффективностью
Диэтиловый эфир — Энциклопедия Нового Света
- Эта статья о химическом соединении.

| Диэтиловый эфир | |
|---|---|
| Название ИЮПАК | этоксиэтан |
| Другие наименования | диэтиловый эфир этиловый эфир этилоксид 3-оксапентан |
| Идентификаторы | |
| Номер CAS | [60-29-7] |
| Номер РТЭКС | КИ5775000 |
| УЛЫБКИ | ССОСС |
| Недвижимость | |
| Молекулярная формула | 74,12 г/моль |
| Внешний вид | прозрачная бесцветная жидкость |
| Плотность | 0,7134 г/см³, жидкость |
| Температура плавления | -116,3 ° С (156,85 К) |
| Точка кипения | 34,6 ° С (307,75 К) |
| Растворимость в воде | 6,9 г/100 мл (20 °C) |
| Вязкость | 0,224 сП при 25 °C |
| Структура | |
| Дипольный момент | 1,15 Д (газ) |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности |
| Основные опасности | Чрезвычайно легковоспламеняющийся (F+), Вредный (Xn) |
| NFPA 704 | 4 2
|
| R-фразы | Р12 Р19 Р22 Р66 Р67 |
| S-фразы | С9 С16 С29 С33 |
| Температура вспышки | -45 °С |
| Родственные соединения | |
| Родственные эфиры | Диметиловый эфир Метоксипропан |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 °C, 100 кПа) | |
Диэтиловый эфир, , также известный как эфир и этоксиэтан, , представляет собой прозрачную, бесцветную и легко воспламеняющуюся жидкость с низкой температурой кипения и характерным запахом. Это наиболее распространенный член класса химических соединений, известных как простые эфиры. Это изомер бутанола. Диэтиловый эфир имеет формулу CH 3 -СН 2 -О-СН 2 -СН 3 . Он используется в качестве обычного растворителя, а в прошлом применялся в качестве общего анестетика. Он умеренно растворим в воде (6,9 г/100 мл). Учитывая его высокую воспламеняемость и летучесть, его следует хранить вдали от открытого огня и устройств с электрическим нагревом.
Это наиболее распространенный член класса химических соединений, известных как простые эфиры. Это изомер бутанола. Диэтиловый эфир имеет формулу CH 3 -СН 2 -О-СН 2 -СН 3 . Он используется в качестве обычного растворителя, а в прошлом применялся в качестве общего анестетика. Он умеренно растворим в воде (6,9 г/100 мл). Учитывая его высокую воспламеняемость и летучесть, его следует хранить вдали от открытого огня и устройств с электрическим нагревом.
Содержание
- 1 История
- 2 Производство
- 3 приложения
- 3.1 Использование анестезии
- 3.2 Рекреационное использование 902:30
- 4 Метаболизм
- 5 Безопасность
- 6 См. также
- 7 Примечания
- 8 Каталожные номера
- 9 Внешние ссылки
- 10 кредитов
История
Алхимику Раймундусу Луллу приписывают открытие соединения в 1275 н. э. , хотя современных свидетельств этому нет. Впервые он был синтезирован в 1540 году Валериусом Кордусом, который назвал его «маслом сладкого купороса» (oleum dulcis vitrioli) . Это название было выбрано потому, что оно было первоначально обнаружено путем перегонки смеси этанола и серной кислоты (тогда известной как купоросное масло) и отметило некоторые его лечебные свойства. Примерно в то же время Теофраст Бомбаст фон Гогенгейм, более известный как Парацельс, открыл обезболивающие свойства эфира. Название эфир было дано веществу в 1730 году Августом Зигмундом Фробениусом.
э. , хотя современных свидетельств этому нет. Впервые он был синтезирован в 1540 году Валериусом Кордусом, который назвал его «маслом сладкого купороса» (oleum dulcis vitrioli) . Это название было выбрано потому, что оно было первоначально обнаружено путем перегонки смеси этанола и серной кислоты (тогда известной как купоросное масло) и отметило некоторые его лечебные свойства. Примерно в то же время Теофраст Бомбаст фон Гогенгейм, более известный как Парацельс, открыл обезболивающие свойства эфира. Название эфир было дано веществу в 1730 году Августом Зигмундом Фробениусом.
Производство
Диэтиловый эфир редко получают в лабораториях из-за связанной с этим опасности и потому, что он легко доступен для законных лабораторий. Большая часть диэтилового эфира производится как побочный продукт парофазной гидратации этилена с получением этанола. В этом процессе используются катализаторы на основе фосфорной кислоты на твердом носителе, и при необходимости его можно отрегулировать для получения большего количества эфира. [1] Дегидратация этанола в паровой фазе над некоторыми катализаторами на основе оксида алюминия может давать выход диэтилового эфира до 95 процентов. [2]
[1] Дегидратация этанола в паровой фазе над некоторыми катализаторами на основе оксида алюминия может давать выход диэтилового эфира до 95 процентов. [2]
Диэтиловый эфир может быть получен как в лабораторных, так и в промышленных масштабах синтезом кислого эфира. Этанол смешивают с сильной кислотой, обычно с серной кислотой, H 2 SO 4 . Кислота диссоциирует с образованием ионов водорода H + . Ион водорода протонирует электроотрицательный атом кислорода этанола, придавая молекуле этанола положительный заряд:
- CH 3 CH 2 OH + H + → CH 3 CH 2 OH 2 +
A nucleophilic oxygen atom of unprotonated ethanol displaces a water molecule from the protonated (электрофильная) молекула этанола, образующая воду, ион водорода и диэтиловый эфир.
- CH 3 CH 2 OH 2 + + CH 3 CH 2 OH → H 2 2 O6+ + CH 3 CH 2 OCH 2 CH 3
Эту реакцию следует проводить при температуре ниже 150°C, чтобы убедиться, что продукт элиминирования (этилен) не является продуктом Реакция.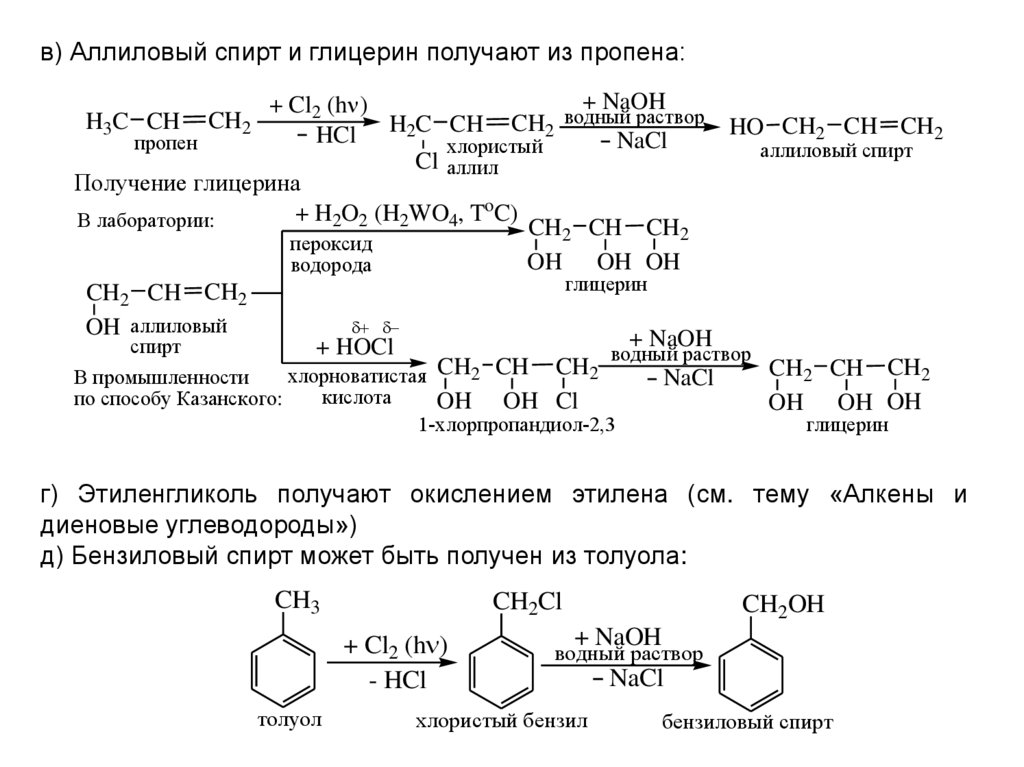 При более высоких температурах этанол дегидратируется с образованием этилена. Реакция получения диэтилового эфира обратима, поэтому в конечном итоге достигается равновесие между реагентами и продуктами. Для получения хорошего выхода эфира необходимо, чтобы эфир был отогнан из реакционной смеси до того, как он превратится в этанол, используя принцип Ле Шателье.
При более высоких температурах этанол дегидратируется с образованием этилена. Реакция получения диэтилового эфира обратима, поэтому в конечном итоге достигается равновесие между реагентами и продуктами. Для получения хорошего выхода эфира необходимо, чтобы эфир был отогнан из реакционной смеси до того, как он превратится в этанол, используя принцип Ле Шателье.
Другой реакцией, которую можно использовать для получения эфиров, является синтез эфира Вильямсона, в котором алкоксид (полученный путем растворения щелочного металла в используемом спирте) осуществляет нуклеофильное замещение алкилгалогенида.
Применение
Диэтиловый эфир — обычный лабораторный растворитель. Он имеет ограниченную растворимость в воде, поэтому обычно используется для жидкостной экстракции. Будучи менее плотным, чем вода, эфирный слой обычно находится сверху. Диэтиловый эфир является обычным растворителем для реакции Гриньяра и многих других реакций с участием металлоорганических реагентов. Он особенно важен в качестве растворителя при производстве целлюлозных пластиков, таких как ацетат целлюлозы. [1] Диэтиловый эфир имеет высокое цетановое число 85-96 и используется в качестве пусковой жидкости для дизельных и бензиновых двигателей из-за его высокой летучести и низкой температуры самовоспламенения.
Он особенно важен в качестве растворителя при производстве целлюлозных пластиков, таких как ацетат целлюлозы. [1] Диэтиловый эфир имеет высокое цетановое число 85-96 и используется в качестве пусковой жидкости для дизельных и бензиновых двигателей из-за его высокой летучести и низкой температуры самовоспламенения.
Применение анестетика
Американский врач Кроуфорд Уильямсон Лонг, доктор медицинских наук, был первым хирургом, который 30 марта 1842 года применил его в качестве общего наркоза. [3] William T.G. Ранее Мортону приписывали первую публичную демонстрацию эфирной анестезии 16 октября 1846 года в Эфирном куполе в Бостоне, штат Массачусетс, хотя теперь известно, что доктор Кроуфорд Лонг публично продемонстрировал ее использование другим официальным лицам в Джорджии.
Иногда вместо хлороформа использовали эфир, поскольку он имел более высокий терапевтический индекс, большую разницу между рекомендуемой дозировкой и токсическую передозировку. Эфир по-прежнему является предпочтительным анестетиком в некоторых развивающихся странах из-за его низкой цены и высокого терапевтического индекса (около 1,5-2,2). [4]
Эфир по-прежнему является предпочтительным анестетиком в некоторых развивающихся странах из-за его низкой цены и высокого терапевтического индекса (около 1,5-2,2). [4]
Основываясь на своих ассоциациях с Бостоном, использование эфира стало известно как «Уловка Янки».
В настоящее время эфир редко используется для анестезии. Использование легковоспламеняющегося эфира уменьшилось, когда стали доступны негорючие анестетики, такие как галотан. Кроме того, у эфира было много нежелательных побочных эффектов, таких как посленаркозная тошнота и рвота. Современные анестетики, такие как метилпропиловый эфир (неотил) и метоксифлуран (пентран), уменьшают эти побочные эффекты. [3]
Эфир можно использовать для обезболивания клещей перед их удалением из тела животного или человека. Анестезия расслабляет клеща и не позволяет ему удерживать свой ротовой аппарат под кожей.
Рекреационное использование
Обезболивающее действие эфира сделало его рекреационным наркотиком, хотя и не очень популярным.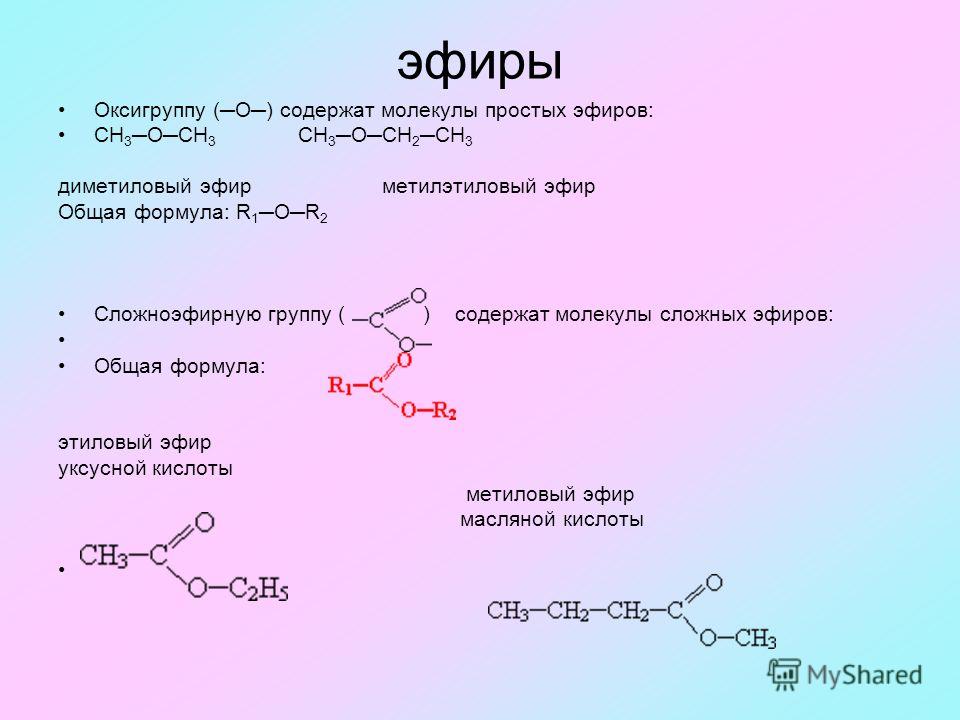 Диэтиловый эфир не так токсичен, как другие растворители, используемые в качестве рекреационных наркотиков.
Диэтиловый эфир не так токсичен, как другие растворители, используемые в качестве рекреационных наркотиков.
Эфир, смешанный с этанолом, продавался в девятнадцатом веке как панацея и рекреационный наркотик во время одного из движений западного общества за воздержание. В то время считалось неприличным для женщин употреблять алкогольные напитки на общественных мероприятиях, и иногда вместо них употребляли наркотики, содержащие эфир. Лекарство от кашля под названием «Капли Хоффмана» в то время продавалось как одно из таких лекарств и содержало в своих капсулах как эфир, так и спирт. [5] Эфир, как правило, трудно употреблять отдельно, поэтому его часто смешивали с такими наркотиками, как этанол, для рекреационного использования. Эфир также можно использовать в качестве ингалятора.
Из-за несмешиваемости с водой и того факта, что неполярные органические соединения хорошо растворяются в ней, эфир также используется в производстве свободного основания кокаина и включен в Таблицу II в качестве прекурсора в соответствии с Конвенцией Организации Объединенных Наций о борьбе с незаконным оборотом по наркотическим средствам и психотропным веществам. [6]
[6]
Метаболизм
Предполагается, что фермент цитохром Р450 метаболизирует диэтиловый эфир. [7]
Диэтиловый эфир ингибирует алкогольдегидрогеназу и тем самым замедляет метаболизм этанола. [8] Он также ингибирует метаболизм других лекарственных средств, требующих окислительного метаболизма. [9]
Безопасность
Эфир — легковоспламеняющийся материал. При использовании эфира следует избегать открытого огня и даже устройств с электрическим нагревом, поскольку он легко воспламеняется от пламени или искры. Температура самовоспламенения эфира составляет всего 170°C (338°F), поэтому он может воспламениться от горячей поверхности без пламени или искры. Наиболее распространенной практикой в химических лабораториях является использование пара (таким образом ограничивая температуру до 100 ° C (212 ° F), когда эфир необходимо нагревать или перегонять.
Диэтиловый эфир склонен к образованию перекиси и может образовывать взрывоопасную перекись диэтилового эфира.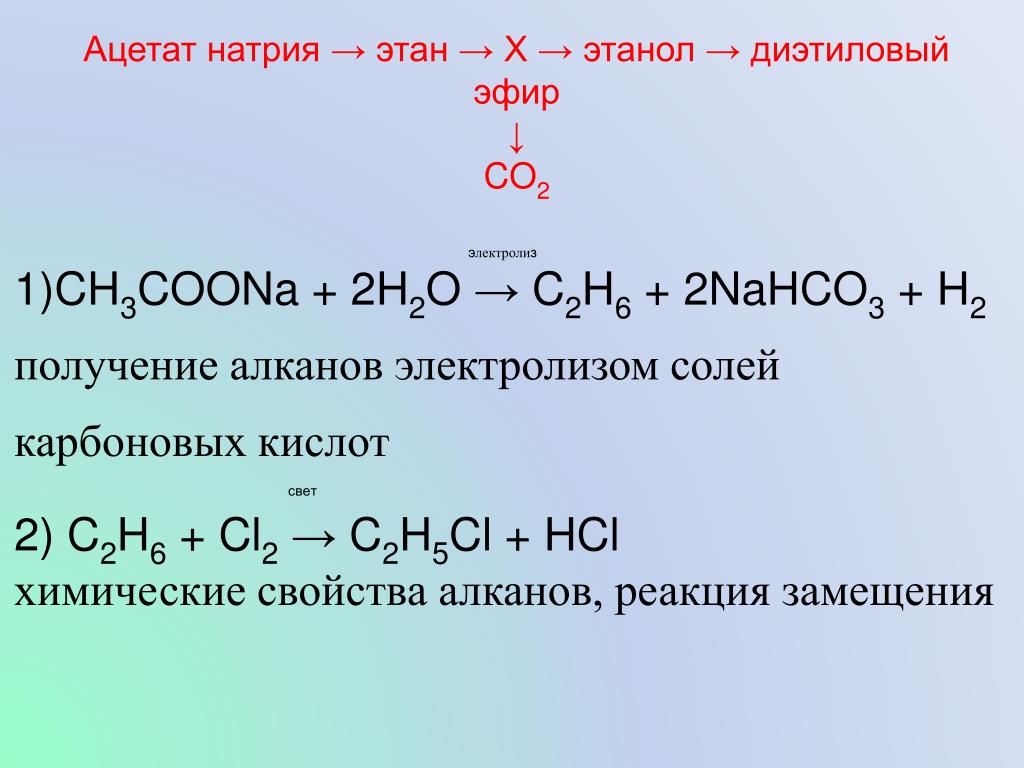 Пероксиды эфира имеют более высокую температуру кипения и в сухом виде являются контактными взрывчатыми веществами. Диэтиловый эфир обычно поставляется со следовыми количествами антиоксиданта BHT (2,6-ди-трет-бутил-4-метилфенол), который уменьшает образование пероксидов. Хранение над NaOH приводит к осаждению промежуточных гидропероксидов эфира. Воду и пероксиды можно удалить либо отгонкой натрия и бензофенона, либо пропусканием через колонку с активированным оксидом алюминия. [10]
Пероксиды эфира имеют более высокую температуру кипения и в сухом виде являются контактными взрывчатыми веществами. Диэтиловый эфир обычно поставляется со следовыми количествами антиоксиданта BHT (2,6-ди-трет-бутил-4-метилфенол), который уменьшает образование пероксидов. Хранение над NaOH приводит к осаждению промежуточных гидропероксидов эфира. Воду и пероксиды можно удалить либо отгонкой натрия и бензофенона, либо пропусканием через колонку с активированным оксидом алюминия. [10]
See also
- Ether
Notes
- ↑ 1.0 1.1 Lawrence Karas and W. J. Piel, Ethers, in Kirk‑Othmer Encyclopedia of Chemical Technology (John Wiley & Sons , Inc., 2004).
- ↑ Этиловый эфир, Chem. Справочник по экономике (Менло Парк, Калифорния: SRI International, 1991).
- ↑ 3.0 3.1 Джон У. Хилл и Дорис К. Колб, Химия для меняющихся времен, 10-е изд.
 (Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004, ISBN 0536836841).
(Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004, ISBN 0536836841). - ↑ Ф. А. Кальдероне, Исследования дозировки эфира после преанестетического лечения наркотиками, J. Pharmacology Experimental Therapeutics 55(1): 24-39. Проверено 24 ноября 2008 г.
- ↑ Эровид, Капли Гофмана. Проверено 24 ноября 2008 г.
- ↑ Международный комитет по контролю над наркотиками, Список химических веществ и прекурсоров, часто используемых при незаконном производстве наркотических средств и психотропных веществ, находящихся под международным контролем. Проверено 24 ноября 2008 г.
902:30 - ↑ Мэтью П. Браун и Гэри А. Пейн, 109. Мутантный штамм 241 Aspergillus flavus, заблокированный в биосинтезе афлатоксина, не накапливает транскрипт aflR, Университет штата Северная Каролина, Роли, Северная Каролина, 27695. Проверено 24 ноября 2008 г.
- ↑ П.Т. Норманн, А. Рипель и Дж. Морланд, Диэтиловый эфир ингибирует метаболизм этанола in vivo путем взаимодействия с алкогольдегидрогеназой, Алкоголизм: клинические и экспериментальные исследования 11(2): 163–166.
 (doi = 10.1111/j.1530-0277.1987.tb01282.х).
(doi = 10.1111/j.1530-0277.1987.tb01282.х). - ↑ Ларри К. Кифер, Уильям А. Гарланд, Нил Ф. Олдфилд, Джеймс Э. Свагздис и Брюс А. Мико, 1985, Ингибирование метаболизма N-нитрозодиметиламина у крыс с помощью эфирной анестезии, Cancer Research 45: 5457– 60.
- ↑ W.L.F. Армарего и Кристина Ли Лин Чай, Очистка лабораторных химикатов (Амстердам: Butterworth-Heinemann, 2004, ISBN 978-0750675710).
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Хилл, Джон В. и Дорис К. Колб. Химия меняющихся времен, 10-е изд. Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004. ISBN 0536836841
- Макмерри, Джон. Органическая химия, 6-е изд. Бельмонт, Калифорния: Брукс/Коул, 2004. ISBN 0534420052
- Моррисон, Роберт Т. и Роберт Н. Бойд. Органическая химия, 6-е изд. Englewood Cliffs, NJ: Prentice Hall, 1992. ISBN 0136436692
- Соломоновы острова, Т.В. Грэм и Крейг Б.
 Фрайл. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: John Wiley, 2004. ISBN 0471417998
Фрайл. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: John Wiley, 2004. ISBN 0471417998
Внешние ссылки
Все ссылки получены 28 июля 2022 г.
- «Более сильный эфир» от Dr. Nostrum.
| Общие анестетики (N01A) | |
|---|---|
| Барбитураты | Гексобарбитал, Метогекситал, Наркобарбитал, Тиопентал |
| Эфиры | Диэтиловый эфир, десфлуран, энфлуран, изофлуран, метоксифлуран, метоксипропан, севофлуран, виниловый эфир |
| Галогеналканы | Хлороформ, Галотан, Трихлорэтилен |
| Опиоиды | Алфентанил, анилеридин, фентанил, феноперидин, ремифентанил, суфентанил |
| Прочие | Альфаксалон, Дроперидол, Эскетамин, Этомидат, Гидроксимасляная кислота, Кетамин, Минаксолон, Закись азота, Пропанидид, Пропофол, Ксенон |
Кредиты
Энциклопедия Нового Света авторов и редакторов переписали и дополнили Википедия статья
в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно осуществляться в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Упоминание должно осуществляться в соответствии с условиями этой лицензии, которая может ссылаться как на авторов New World Encyclopedia , так и на самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:
- Диэтиловый эфир история
История этой статьи с момента ее импорта в New World Encyclopedia :
- История «Диэтилового эфира»
Примечание. На использование отдельных изображений могут распространяться некоторые ограничения.
Диэтиловый эфир — Энциклопедия Нового Света
- Эта статья о химическом соединении.
| Диэтиловый эфир | |
|---|---|
| Название ИЮПАК | этоксиэтан |
| Другие наименования | диэтиловый эфир этиловый эфир этилоксид 3-оксапентан |
| Идентификаторы | |
| Номер CAS | [60-29-7] |
| Номер РТЭКС | КИ5775000 |
| УЛЫБКИ | ССОСС |
| Недвижимость | |
| Молекулярная формула | 74,12 г/моль |
| Внешний вид | прозрачная бесцветная жидкость |
| Плотность | 0,7134 г/см³, жидкость |
| Температура плавления | -116,3 ° С (156,85 К) |
| Точка кипения | 34,6 ° С (307,75 К) |
| Растворимость в воде | 6,9 г/100 мл (20 °C) |
| Вязкость | 0,224 сП при 25 °C |
| Структура | |
| Дипольный момент | 1,15 Д (газ) |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности |
| Основные опасности | Чрезвычайно легковоспламеняющийся (F+), Вредный (Xn) |
| NFPA 704 | 4 2
|
| R-фразы | Р12 Р19 Р22 Р66 Р67 |
| S-фразы | С9 С16 С29 С33 |
| Температура вспышки | -45 °С |
| Родственные соединения | |
| Родственные эфиры | Диметиловый эфир Метоксипропан |
| Если не указано иное, данные приведены для материалы в их стандартном состоянии (при 25 °C, 100 кПа) | |
Диэтиловый эфир, , также известный как эфир и этоксиэтан, , представляет собой прозрачную, бесцветную и легко воспламеняющуюся жидкость с низкой температурой кипения и характерным запахом. Это наиболее распространенный член класса химических соединений, известных как простые эфиры. Это изомер бутанола. Диэтиловый эфир имеет формулу CH 3 -CH 2 -O-CH 2 -СН 3 . Он используется в качестве обычного растворителя, а в прошлом применялся в качестве общего анестетика. Он умеренно растворим в воде (6,9 г/100 мл). Учитывая его высокую воспламеняемость и летучесть, его следует хранить вдали от открытого огня и устройств с электрическим нагревом.
Это наиболее распространенный член класса химических соединений, известных как простые эфиры. Это изомер бутанола. Диэтиловый эфир имеет формулу CH 3 -CH 2 -O-CH 2 -СН 3 . Он используется в качестве обычного растворителя, а в прошлом применялся в качестве общего анестетика. Он умеренно растворим в воде (6,9 г/100 мл). Учитывая его высокую воспламеняемость и летучесть, его следует хранить вдали от открытого огня и устройств с электрическим нагревом.
Содержание
- 1 История
- 2 Производство
- 3 приложения
- 3.1 Использование анестезии
- 3.2 Рекреационное использование
- 4 Метаболизм 902:30
- 5 Безопасность
- 6 См. также
- 7 Примечания
- 8 Каталожные номера
- 9 Внешние ссылки
- 10 кредитов
История
Алхимику Раймундусу Луллу приписывают открытие соединения в 1275 н.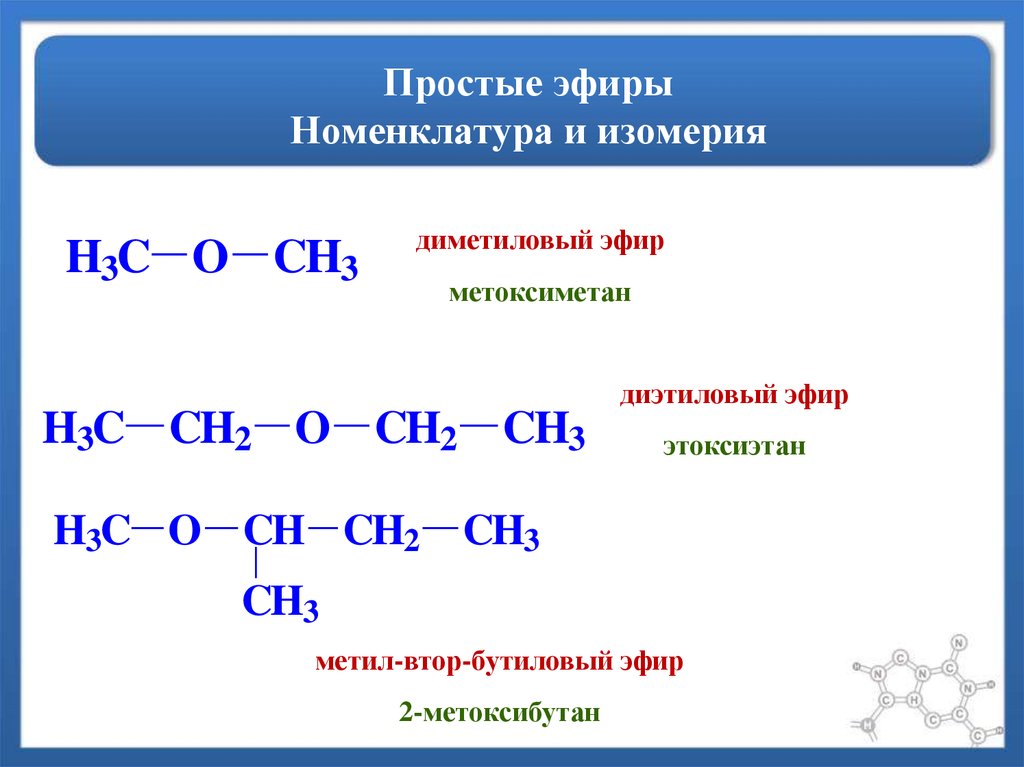 э. , хотя современных свидетельств этому нет. Впервые он был синтезирован в 1540 году Валериусом Кордусом, который назвал его «маслом сладкого купороса» (oleum dulcis vitrioli) . Это название было выбрано потому, что оно было первоначально обнаружено путем перегонки смеси этанола и серной кислоты (тогда известной как купоросное масло) и отметило некоторые его лечебные свойства. Примерно в то же время Теофраст Бомбаст фон Гогенгейм, более известный как Парацельс, открыл обезболивающие свойства эфира. Имя эфир был дан веществу в 1730 году Августом Зигмундом Фробениусом.
э. , хотя современных свидетельств этому нет. Впервые он был синтезирован в 1540 году Валериусом Кордусом, который назвал его «маслом сладкого купороса» (oleum dulcis vitrioli) . Это название было выбрано потому, что оно было первоначально обнаружено путем перегонки смеси этанола и серной кислоты (тогда известной как купоросное масло) и отметило некоторые его лечебные свойства. Примерно в то же время Теофраст Бомбаст фон Гогенгейм, более известный как Парацельс, открыл обезболивающие свойства эфира. Имя эфир был дан веществу в 1730 году Августом Зигмундом Фробениусом.
Производство
Диэтиловый эфир редко получают в лабораториях из-за связанной с этим опасности и потому, что он легко доступен для законных лабораторий. Большая часть диэтилового эфира производится как побочный продукт парофазной гидратации этилена с получением этанола. В этом процессе используются катализаторы на основе фосфорной кислоты на твердом носителе, и при необходимости его можно отрегулировать для получения большего количества эфира.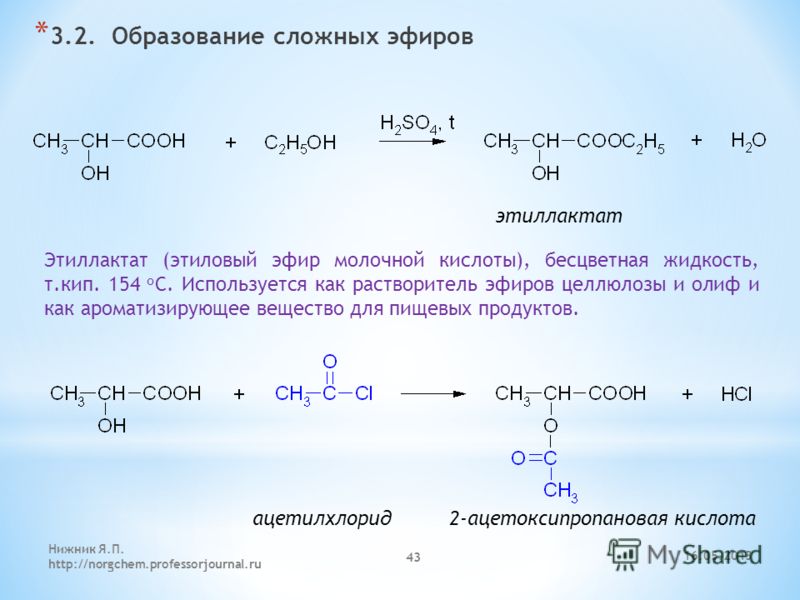 [1] Парофазная дегидратация этанола над некоторыми алюмооксидными катализаторами может давать выход диэтилового эфира до 95 процентов. [2]
[1] Парофазная дегидратация этанола над некоторыми алюмооксидными катализаторами может давать выход диэтилового эфира до 95 процентов. [2]
Диэтиловый эфир может быть получен как в лабораторных, так и в промышленных масштабах синтезом кислого эфира. Этанол смешивают с сильной кислотой, обычно с серной кислотой, H 2 SO 4 . Кислота диссоциирует с образованием ионов водорода H + . Ион водорода протонирует электроотрицательный атом кислорода этанола, придавая молекуле этанола положительный заряд:
- СН 3 СН 2 ОН + Н + → CH 3 CH 2 OH 2 +
Нуклеофильный атом кислорода непротонированного этанола вытесняет молекулу воды из протонированной (электрофильной) молекулы этанола с образованием молекулы воды, диэтилового эфира и водорода.
- CH 3 CH 2 OH 2 + + CH 3 CH 2 OH → H 2 O + H + + CH 3 CH 2 OCH 2 канал 3
Эта реакция должна проводиться при температуре ниже 150°C, чтобы продукт элиминирования (этилен) не был продуктом реакции. При более высоких температурах этанол дегидратируется с образованием этилена. Реакция получения диэтилового эфира обратима, поэтому в конечном итоге достигается равновесие между реагентами и продуктами. Для получения хорошего выхода эфира необходимо, чтобы эфир был отогнан из реакционной смеси до того, как он превратится в этанол, используя принцип Ле Шателье.
При более высоких температурах этанол дегидратируется с образованием этилена. Реакция получения диэтилового эфира обратима, поэтому в конечном итоге достигается равновесие между реагентами и продуктами. Для получения хорошего выхода эфира необходимо, чтобы эфир был отогнан из реакционной смеси до того, как он превратится в этанол, используя принцип Ле Шателье.
Другой реакцией, которую можно использовать для получения эфиров, является синтез эфира Вильямсона, в котором алкоксид (полученный путем растворения щелочного металла в используемом спирте) осуществляет нуклеофильное замещение алкилгалогенида.
Применение
Диэтиловый эфир — обычный лабораторный растворитель. Он имеет ограниченную растворимость в воде, поэтому обычно используется для жидкостной экстракции. Будучи менее плотным, чем вода, эфирный слой обычно находится сверху. Диэтиловый эфир является обычным растворителем для реакции Гриньяра и многих других реакций с участием металлоорганических реагентов.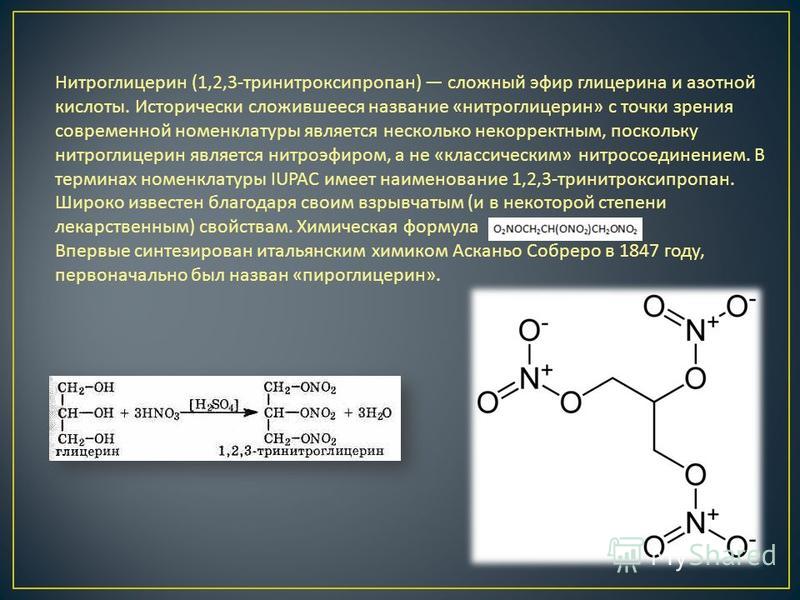 Он особенно важен в качестве растворителя при производстве целлюлозных пластиков, таких как ацетат целлюлозы. [1] Диэтиловый эфир имеет высокое цетановое число 85-96 и используется в качестве пусковой жидкости для дизельных и бензиновых двигателей из-за его высокой летучести и низкой температуры самовоспламенения.
Он особенно важен в качестве растворителя при производстве целлюлозных пластиков, таких как ацетат целлюлозы. [1] Диэтиловый эфир имеет высокое цетановое число 85-96 и используется в качестве пусковой жидкости для дизельных и бензиновых двигателей из-за его высокой летучести и низкой температуры самовоспламенения.
Применение анестетика
Американский врач Кроуфорд Уильямсон Лонг, доктор медицинских наук, был первым хирургом, который 30 марта 1842 года применил его в качестве общего наркоза. [3] William T.G. Ранее Мортону приписывали первую публичную демонстрацию эфирной анестезии 16 октября 1846 года в Эфирном куполе в Бостоне, штат Массачусетс, хотя теперь известно, что доктор Кроуфорд Лонг публично продемонстрировал ее использование другим официальным лицам в Джорджии.
Иногда вместо хлороформа использовали эфир, поскольку он имел более высокий терапевтический индекс, большую разницу между рекомендуемой дозировкой и токсическую передозировку. Эфир по-прежнему является предпочтительным анестетиком в некоторых развивающихся странах из-за его низкой цены и высокого терапевтического индекса (около 1,5-2,2). [4]
Эфир по-прежнему является предпочтительным анестетиком в некоторых развивающихся странах из-за его низкой цены и высокого терапевтического индекса (около 1,5-2,2). [4]
Основываясь на своих ассоциациях с Бостоном, использование эфира стало известно как «Уловка Янки».
В настоящее время эфир редко используется для анестезии. Использование легковоспламеняющегося эфира уменьшилось, когда стали доступны негорючие анестетики, такие как галотан. Кроме того, у эфира было много нежелательных побочных эффектов, таких как посленаркозная тошнота и рвота. Современные анестетики, такие как метилпропиловый эфир (неотил) и метоксифлуран (пентран), уменьшают эти побочные эффекты. [3]
Эфир можно использовать для обезболивания клещей перед их удалением из тела животного или человека. Анестезия расслабляет клеща и не позволяет ему удерживать свой ротовой аппарат под кожей.
Рекреационное использование
Обезболивающее действие эфира сделало его рекреационным наркотиком, хотя и не очень популярным. Диэтиловый эфир не так токсичен, как другие растворители, используемые в качестве рекреационных наркотиков.
Диэтиловый эфир не так токсичен, как другие растворители, используемые в качестве рекреационных наркотиков.
Эфир, смешанный с этанолом, продавался в девятнадцатом веке как панацея и рекреационный наркотик во время одного из движений западного общества за воздержание. В то время считалось неприличным для женщин употреблять алкогольные напитки на общественных мероприятиях, и иногда вместо них употребляли наркотики, содержащие эфир. Лекарство от кашля под названием «Капли Хоффмана» в то время продавалось как одно из таких лекарств и содержало в своих капсулах как эфир, так и спирт. [5] Эфир, как правило, трудно употреблять отдельно, поэтому его часто смешивали с такими наркотиками, как этанол, для рекреационного использования. Эфир также можно использовать в качестве ингалятора.
Из-за несмешиваемости с водой и того факта, что неполярные органические соединения хорошо растворяются в ней, эфир также используется в производстве свободного основания кокаина и включен в Таблицу II в качестве прекурсора в соответствии с Конвенцией Организации Объединенных Наций о борьбе с незаконным оборотом по наркотическим средствам и психотропным веществам. [6]
[6]
Метаболизм
Предполагается, что фермент цитохром Р450 метаболизирует диэтиловый эфир. [7]
Диэтиловый эфир ингибирует алкогольдегидрогеназу и тем самым замедляет метаболизм этанола. [8] Он также ингибирует метаболизм других лекарственных средств, требующих окислительного метаболизма. [9]
Безопасность
Эфир — легковоспламеняющийся материал. При использовании эфира следует избегать открытого огня и даже устройств с электрическим нагревом, поскольку он легко воспламеняется от пламени или искры. Температура самовоспламенения эфира составляет всего 170°C (338°F), поэтому он может воспламениться от горячей поверхности без пламени или искры. Наиболее распространенной практикой в химических лабораториях является использование пара (таким образом ограничивая температуру до 100 ° C (212 ° F), когда эфир необходимо нагревать или перегонять.
Диэтиловый эфир склонен к образованию перекиси и может образовывать взрывоопасную перекись диэтилового эфира. Пероксиды эфира имеют более высокую температуру кипения и в сухом виде являются контактными взрывчатыми веществами. Диэтиловый эфир обычно поставляется со следовыми количествами антиоксиданта BHT (2,6-ди-трет-бутил-4-метилфенол), который уменьшает образование пероксидов. Хранение над NaOH приводит к осаждению промежуточных гидропероксидов эфира. Воду и пероксиды можно удалить либо отгонкой натрия и бензофенона, либо пропусканием через колонку с активированным оксидом алюминия. [10]
Пероксиды эфира имеют более высокую температуру кипения и в сухом виде являются контактными взрывчатыми веществами. Диэтиловый эфир обычно поставляется со следовыми количествами антиоксиданта BHT (2,6-ди-трет-бутил-4-метилфенол), который уменьшает образование пероксидов. Хранение над NaOH приводит к осаждению промежуточных гидропероксидов эфира. Воду и пероксиды можно удалить либо отгонкой натрия и бензофенона, либо пропусканием через колонку с активированным оксидом алюминия. [10]
See also
- Ether
Notes
- ↑ 1.0 1.1 Lawrence Karas and W. J. Piel, Ethers, in Kirk‑Othmer Encyclopedia of Chemical Technology (John Wiley & Sons , Inc., 2004).
- ↑ Этиловый эфир, Chem. Справочник по экономике (Менло Парк, Калифорния: SRI International, 1991).
- ↑ 3.0 3.1 Джон У. Хилл и Дорис К. Колб, Химия для меняющихся времен, 10-е изд.
 (Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004, ISBN 0536836841).
(Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004, ISBN 0536836841). - ↑ Ф. А. Кальдероне, Исследования дозировки эфира после преанестетического лечения наркотиками, J. Pharmacology Experimental Therapeutics 55(1): 24-39. Проверено 24 ноября 2008 г.
- ↑ Эровид, Капли Гофмана. Проверено 24 ноября 2008 г.
- ↑ Международный комитет по контролю над наркотиками, Список химических веществ и прекурсоров, часто используемых при незаконном производстве наркотических средств и психотропных веществ, находящихся под международным контролем. Проверено 24 ноября 2008 г.
902:30 - ↑ Мэтью П. Браун и Гэри А. Пейн, 109. Мутантный штамм 241 Aspergillus flavus, заблокированный в биосинтезе афлатоксина, не накапливает транскрипт aflR, Университет штата Северная Каролина, Роли, Северная Каролина, 27695. Проверено 24 ноября 2008 г.
- ↑ П.Т. Норманн, А. Рипель и Дж. Морланд, Диэтиловый эфир ингибирует метаболизм этанола in vivo путем взаимодействия с алкогольдегидрогеназой, Алкоголизм: клинические и экспериментальные исследования 11(2): 163–166.
 (doi = 10.1111/j.1530-0277.1987.tb01282.х).
(doi = 10.1111/j.1530-0277.1987.tb01282.х). - ↑ Ларри К. Кифер, Уильям А. Гарланд, Нил Ф. Олдфилд, Джеймс Э. Свагздис и Брюс А. Мико, 1985, Ингибирование метаболизма N-нитрозодиметиламина у крыс с помощью эфирной анестезии, Cancer Research 45: 5457– 60.
- ↑ W.L.F. Армарего и Кристина Ли Лин Чай, Очистка лабораторных химикатов (Амстердам: Butterworth-Heinemann, 2004, ISBN 978-0750675710).
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- Хилл, Джон В. и Дорис К. Колб. Химия меняющихся времен, 10-е изд. Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004. ISBN 0536836841
- Макмерри, Джон. Органическая химия, 6-е изд. Бельмонт, Калифорния: Брукс/Коул, 2004. ISBN 0534420052
- Моррисон, Роберт Т. и Роберт Н. Бойд. Органическая химия, 6-е изд. Englewood Cliffs, NJ: Prentice Hall, 1992. ISBN 0136436692
- Соломоновы острова, Т.В. Грэм и Крейг Б.
 Фрайл. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: John Wiley, 2004. ISBN 0471417998
Фрайл. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: John Wiley, 2004. ISBN 0471417998
Внешние ссылки
Все ссылки получены 28 июля 2022 г.
- «Более сильный эфир» от Dr. Nostrum.
| Общие анестетики (N01A) | |
|---|---|
| Барбитураты | Гексобарбитал, Метогекситал, Наркобарбитал, Тиопентал |
| Эфиры | Диэтиловый эфир, десфлуран, энфлуран, изофлуран, метоксифлуран, метоксипропан, севофлуран, виниловый эфир |
| Галогеналканы | Хлороформ, Галотан, Трихлорэтилен |
| Опиоиды | Алфентанил, анилеридин, фентанил, феноперидин, ремифентанил, суфентанил |
| Прочие | Альфаксалон, Дроперидол, Эскетамин, Этомидат, Гидроксимасляная кислота, Кетамин, Минаксолон, Закись азота, Пропанидид, Пропофол, Ксенон |
Кредиты
Энциклопедия Нового Света авторов и редакторов переписали и дополнили Википедия статья
в соответствии со стандартами New World Encyclopedia .

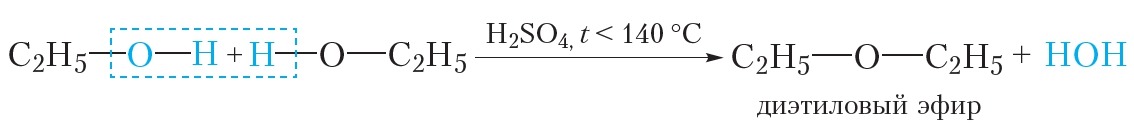


 (Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004, ISBN 0536836841).
(Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004, ISBN 0536836841). (doi = 10.1111/j.1530-0277.1987.tb01282.х).
(doi = 10.1111/j.1530-0277.1987.tb01282.х).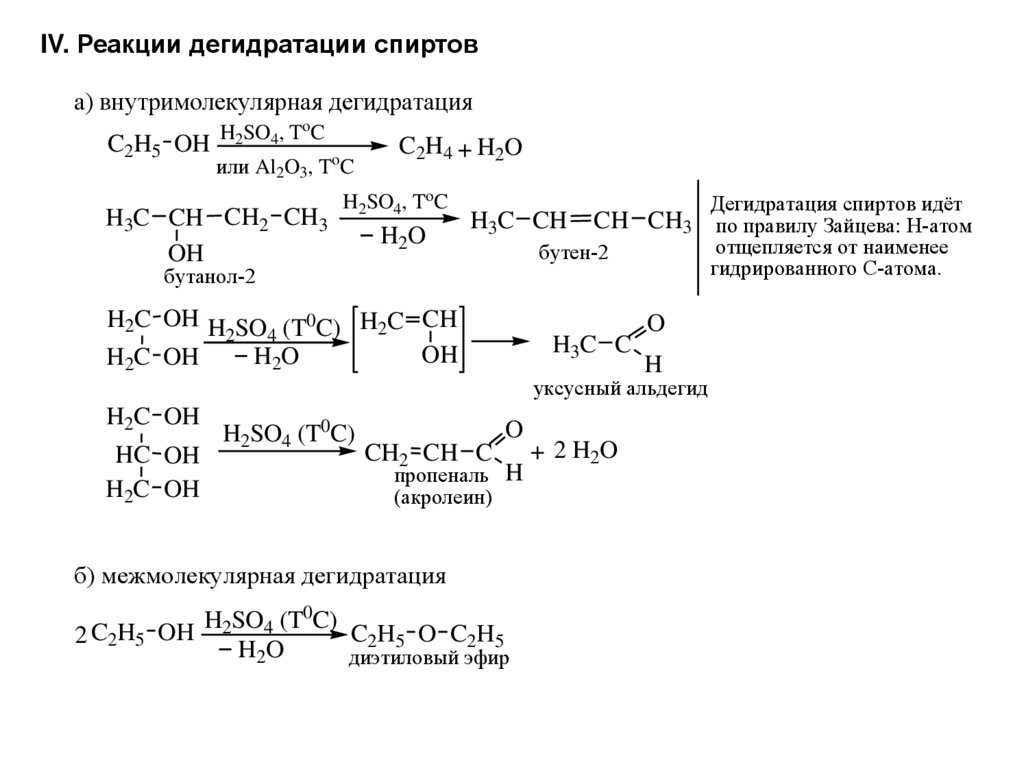 Фрайл. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: John Wiley, 2004. ISBN 0471417998
Фрайл. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: John Wiley, 2004. ISBN 0471417998 (Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004, ISBN 0536836841).
(Река Аппер-Сэдл, Нью-Джерси: Pearson Prentice Hall, 2004, ISBN 0536836841). (doi = 10.1111/j.1530-0277.1987.tb01282.х).
(doi = 10.1111/j.1530-0277.1987.tb01282.х). Фрайл. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: John Wiley, 2004. ISBN 0471417998
Фрайл. Органическая химия, 8-е изд. Хобокен, Нью-Джерси: John Wiley, 2004. ISBN 0471417998