Получение диметилового эфира дегидратацией метанола на АlPO4 +SiO2 катализаторах. Диметиловый эфир технология производства
ТЕХНОЛОГИЯ ОДНОСТАДИЙНОГО СИНТЕЗА ДИМЕТИЛОВОГО ЭФИРА ИЗ ПРИРОДНОГО ГАЗА
- Home
- Documents
- ТЕХНОЛОГИЯ ОДНОСТАДИЙНОГО СИНТЕЗА ДИМЕТИЛОВОГО ЭФИРА ИЗ ПРИРОДНОГО ГАЗА
Published on06-Apr-2017
View226
Download1
Transcript
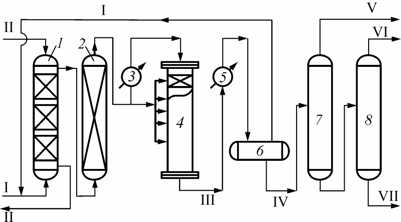
- ÄÎÁÛ×À È ÏÅÐÅÐÀÁÎÒÊÀ ÍÅÔÒÈ È ÃÀÇÀ 145 УДК 662.755:[662.767:66.093.6] И. В. Савенкова, Ю. Ю. Михайлова ÒÅÕÍÎËÎÃÈß ÎÄÍÎÑÒÀÄÈÉÍÎÃÎ ÑÈÍÒÅÇÀ ÄÈÌÅÒÈËÎÂÎÃÎ ÝÔÈÐÀ ÈÇ ÏÐÈÐÎÄÍÎÃÎ ÃÀÇÀ В настоящее время одной из важнейших проблем, волнующих человечество, является по- иск альтернативных энергоносителей. Это связано не только с наступающим дефицитом нефтя- ного сырья, но и с экологическими проблемами, поскольку использование углеводородного то- плива в двигателях внутреннего сгорания сопровождается выбросами в атмосферу огромного количества вредных веществ. Весьма привлекательной является возможность использования в качестве моторных топ- лив эфиров и спиртов. Одним из наиболее перспективных топлив для дизельных двигателей яв- ляется диметиловый эфир (ДМЭ), сырьём для производства которого служит природный газ, что позволяет экономить нефтяные ресурсы [1]. Хотя по теплотворной способности ДМЭ в полтора раза уступает традиционному дизель- ному топливу, по остальным показателям его превосходство несомненно. Наиболее важная ха- рактеристика дизельного топлива – цетановое число. Цетановое число ДМЭ составляет 55–60 против 40–55 для дизельного топлива, температура воспламенения – 235 ºС против 250 ºС соответственно. Такие свойства позволяют легко запускать холодный двигатель, а присутствие в составе ДМЭ атома кислорода обеспечивает бездымное горение топлива. Кроме того, двига- тель, работающий на ДМЭ, практически не шумит. Главное же преимущество ДМЭ как дизель- ного топлива – экологически чистый выхлоп. В выхлопе нет оксидов серы и сажи, и в результа- те сгорания ДМЭ образуется такое небольшое количество оксидов азота, что выхлоп без всякой очистки соответствует самым жестким в мире экологическим требованиям – EURO-3 и ULEV (EURO-3 – последние европейские нормы для автомобильного выхлопа, ULEV – наиболее жесткие в США нормы штата Калифорния) [2]. В настоящее время существуют два подхода к организации производства ДМЭ. 1. Использование двух последовательно работающих реакторов с получением метанола в первом реакторе и его дегидратацией во втором. 2. Использование бифункционального катализатора, когда в реакторе идёт образование метанола с его одновременной дегидратацией в ДМЭ; далее необходима лишь стадия разделе- ния этих продуктов с учетом значительной разницы в температуре кипения ДМЭ (–28 ºC), мета- нола (56 ºC) и воды (100 ºC) эта стадия осуществляется достаточно просто – ректификацией или последовательной конденсацией [1, 3]. Производство ДМЭ прямым синтезом, минуя стадию получения метанола, экономически более выгодно, т. к. характеризуется меньшими эксплуатационными и капитальными затратами даже в сравнении с производством метанола. Предполагается, что механизм образования ДМЭ из СО и Н2 отвечает схеме последова- тельного восстановления оксидов углерода водородом: ОНСОНСО 222 +↔+ ОН+O)(CH↔4Н+2СС 2232 Синтез проводят при давлении около 30,0 МПа, температуре 290–400 ºС в адиабатическом реакторе в присутствии катализатора СНМ-У модифицированного (разработка ГНИПИ «Хим- технология», производство ООО НПК «Алвиго-КС», г. Северодонецк, Украина). Ключевой ста- дией процесса химической конверсии природного газа в ДМЭ является стадия превращения ме- тана в синтез-газ, поэтому основной акцент при разработке технологий следует сделать на по- иске способа получения более дешевого синтез-газа. Кроме того, обеспечивается низкий уро- вень выбросов вредных веществ (NO2, SO2, CO) в атмосферу. В отличие от западных техноло- гий конверсию синтез-газа в ДМЭ можно осуществлять без стадии ректификации. Общая рециркуляционная схема, характерная для синтеза метанола, остается без изменений.
- ISSN 1812-9498. ÂÅÑÒÍÈÊ ÀÃÒÓ. 2008. № 6 (47) 146 Предлагаемый способ позволяет получить ДМЭ без примесей метанола. Основным аппа- ратом в синтезе ДМЭ служит 4-полочный реактор для экзотермических реакций, в котором на решётках уложен в четыре слоя катализатор в виде гранул размерами 5 × 5 мм. От синтеза метанола он отличается лишь способом размещения катализатора дегидратации метанола и циркулирующим агентом, используемым для охлаждения образующихся продуктов. Реактор предназначен для получения газообразного ДМЭ из синтез-газа, поступающего со стадии конверсии природного газа. Температурный режим реактора поддерживают подачей холодного (байпасного) газа между слоями катализатора. Производительность катализатора СНМ-У-модифицированного с учетом всех потерь по ДМЭ – 12–13 т/сут. Бифункциональный катализатор загружается в количестве 6,2 м3 в 4-полочную колонну синтеза ДМЭ. Распределение катализатора по слоям будет следующим: на первую полку загружается 0,5 м3 катализатора, на вторую полку – 0,9 м3, на третью – 1,7 м3, на четвёртую – 3,1 м3. Аппаратура процесса ректификации ДМЭ и метанола не отличается от общеизвестной ректификационной. Для ректификации используют аппараты колонного типа. Процесс обезэфи- ривания и предварительной ректификации осуществляют в колоннах как насадочного, так и та- рельчатого типа. Колонны снабжены тарелками колпачковыми с туннельными и капсульными колпачками; ситчатыми (крупнодырчатыми), клапанными с клапанами типа «Глитч» и прямо- точными клапанами. Лучше всего зарекомендовали себя ситчатые крупнодырчатые тарелки. Они просты в изготовлении и надёжны в работе. Свободное сечение тарелок по высоте колонны основной ректификации неодинаково и изменяется в пределах 6,0–8,4 % [4]. Отделение синтез-газа от циркуляционного газа осуществляется в горизонтальных или вертикальных сепараторах. При этом часть смеси ДМЭ, спиртов и воды оседает под действием гравитационных сил, а капельная и туманообразная жидкость отделяются на специально установленных в верхней части аппарата металлических сетках. Диметиловый эфир – потенциально крупнотоннажный продукт, масштабы потребления ко- торого могут оказаться сопоставимыми с масштабами потребления бензина и дизельного топлива. Предварительные технико-экономические расчеты специалистов показывают, что произ- водство ДМЭ по цене может быть конкурентоспособным с производством нефтяного дизельного топлива и быть ниже цены дизельного топлива, полученного процессом Фишера – Тропша [5]. Спрос на данную продукцию будет расти из года в год. Причина – увеличение потребно- сти в моторном топливе, недорогостоящем, имеющем высокоэффективные экологические показатели и сравнительно высокое качество. СПИСОК ЛИТЕРАТУРЫ 1. Крылов И. Ф., Емельянов В. Е. Альтернативные дизельные топлива. Диметиловый эфир // Мир нефтепродуктов. – 2007. – № 2. – С. 38–39. 2. Новое топливо из природного газа / http://www.methanol.ru. 3. Кессель И. Б. Синтетические жидкие топлива // Актуальные проблемы газохимии: тр. москов. семи- нара по газохимии. 2002–2003 гг. – М.: Нефть и газ, 2004. – С. 41–62. 4. Промышленные испытания катализатора прямого синтеза диметилового эфира из СО-содержащего газа на метанольном производстве / Д. В. Ляхин, А. П. Какичев, Л. Н. Морозов и др. // Химическая промышленность. – 2005. – Т. 82, № 10. – С. 485–491. 5. Технология синтетического метанола / М. М. Караваев, В. Е. Леонов, Е. Г. Попов, Е. Т. Шепелёв. – М.: Химия, 1984. – С. 187–189. Статья поступила в редакцию 22.10.2008
- ÄÎÁÛ×À È ÏÅÐÅÐÀÁÎÒÊÀ ÍÅÔÒÈ È ÃÀÇÀ 147 TECHNOLOGY OF ONE-PHASE SYNTHESIS OF DIMETHYL ETHER FROM NATURAL GAS I. V. Savenkova, Yu. Yu. Mikhailova Dimethyl ether is not expensive petrol, which has high-efficient ecological indices and comparatively high quality. The technology of direct synthesis of di- methyl ether with the use of bifunctional catalyst, when in the reactor the process of methanol generation with its simultaneous dehydration into dimethyl ether takes place, is described. The natural gas is used as alternative raw material, which leads to economizing of oil resources. Key words: dimethyl ether, direct synthesis, alternative energy.
documents.tips
Диссертация на тему «Получение диметилового эфира из синтез-газа на базе метанольного производства» автореферат по специальности ВАК 05.17.01 - Технология неорганических веществ
1. Бочкарёв В.В. Перспективные процессы переработки метанола в органические продукты / Бочкарёв В.В., Волгина Т.Н. // Химическая промышленность сегодня. 2008. - № 3. - С. 13-17.
2. Кильзие Ф. Тенденции и перспективы мирового рынка метанола. / Кильзие Ф. // Тезисы и доклады Московской международной конференции «Метанол 2006». Москва, - с. 72-84.
3. Смирнова Т. Н. Диметиловый эфир экологически чистое моторное топливо XXI века. Теория и практика внедрения на городском транспорте / Смирнова Т. Н., Захаров С.А. // Автогазозаправочный комплекс. — 2003. - № 3. — С. 69 — 72.
4. Розовский А.Я. Утилизация С02 — потенциальный источник углерода для нефтехимии / Розовский А.Я. // Нефтехимия. 1995. — Т. 35, № 3. — С. 34-42.
5. Розовский А.Я. Физико-химические аспекты утилизации С02 / Розовский А.Я. // Журнал физической химии. 1996. - Т. 70, № 2, С. 199 - 207.
6. Временный технологический регламент установки обезэфиривания метанола-сырца с выделением побочного продукта — ДМЭ. Дополнение к постоянному технологическому регламенту № 51 цеха Синтеза 1-С ПАМ, утв. 04.05.2001г., ОАО НАК «Азот».
7. Установка получения ДМЭ. Рабочий проект. // АООТ «НИАП», г.Новомосковск, 1995, с.56.
8. Brant A. Peppley Methanol-steam reforming on Cu/Zn0/Al203 catalysts. A comprehensive kinetic mode / Brant A. Peppley, John C. Amphlett, Lyn M. Kearns, Ronald F. Mann // Applied Catalysis A: General, Volume 179, Issues 1-2, 5 April 1999, Pages 31-49.
9. П.Шелдон P.А. Химические продукты на основе синтез-газа. М.:Химия, 1990. с.249.
10. Wang Shou-guo Получение диметилового эфира дегидратацией метанола на катализаторе HjSiWnO^-I^Os/y-AbOs / Wang Shou-guo, Wang Yuan-hong, Shao Yun, Gong Jian, Qu Lun-yu // Fenzi kexue xuebao=J. Mol. Sci. -2001, -V.17, №2, -P.99-104.
11. Hou Zhao-yin Прямой синтез диметилового эфира на нанесенных Cu-Mn-катализаторах / Hou Zhao-yin, Fei Jin-hua, Qi Gong-xin, Zheng Xiao-ming // Shiyou huagong Petrochem. Technol., -2000, -V.29, №11, -P.819-822.
12. Qi Gong-xin Влияние марганца на катализаторы Cu/АЬОз Для гидрирования СО / Qi Gong-xin, Fei Jin-hua, Hou Zhao-yin, Zheng Xiao-ming // Ranliao huax-ue xuebao. J. Fuel Chem. and Technol. -2000. -V.28, №4, -P.382-384.
13. Т.Шикада Синтез диметилового эфира из синтез-газа, полученного из природного газа/Т.Шикада, Ф.Охно, Е.Огава, М.Око, М.Мизугучи, К.Томура, К.Фуджимото//Кинетика и катализ -1999, -Т.40, №3. -С.440-446.
14. Заявка №2002101353/04 Катализатор и способ получения диметилового эфира и метанола из синтез-газа/ Розовский А .Я., Лиин Г.И., Соболевский B.C.; заявлено 01.09.2002; опубл. 10.09.2003.
15. Заявка №97114880/04 Способ получения продукта, содержащего диметиловый эфир, до 20% по массе метанола и до 20 % по массе воды/ Бодил Фосс, Финн Енсен, Ен Хансен; заявлено 29.01.1996; опубл. 27.01.2000.
16. Xu М. Synthesis of dimethyl ether from methanol over solid-acid catalysts / Xu M., Lunsford J.H., Goodman D.W., Bhattacharyya A. // Applied Catalysis A: General, -1997, -V.149, №2, P.289-301.
17. Xu M. Catalytic dehydration of methanol to dimethyl ether over Pd/Cab-O-Sil catalysts / Xu M., Goodman D.W., Bhattacharyya A. // Applied Catalysis A: General, -1997, -V.149, №2, P.303-309.
18. Co-production of dimethyl ether and methanol from C02 hydrogenation: development of a stable hybrid catalyst / Tao Jia-Lin, Jun Ki-Won, Lee Kyu-Wan // Appl. Organomet. Chem., -2001, -V.15, №2, P.105-108.
19. Zheng Jingzhi Изучение каталитического синтеза диметилового эфира из метанола с использованием модифицированного каолина / Zheng Jingzhi, Мао Liqiu, Yin Dulin, Yin Dulin, Wen Bin, Zhang Juewu, Gan Jun//Hunan hua-gong, -2000, -V.30, V.l, P.9-10.
20. Chen Song-zhe Лазеро-стимулированные поверхностные реакции метанола на гетерополисоединениях / Chen Song-zhe, Zhong Shun-he, Xin Xiu-lan, Xiao Xiu-fen//Fenzi cuihua=J. Mol. Catal. (China), -2001, V.l5, №5, -P.321-326.
21. J.S.Lee Methyl formate as a new building block in CI chemistry / J.S.Lee, J.C.Kim, Y.G.Kim // Appl. Catal., -1990, V.57, №1, P.l-30.
22. Linghu Wen-sheng Исследование активности щелочно-метоксидных катализаторов карбонилирования метанола / Linghu Wen-sheng, Liu Zhen-yu,137
23. Zhong Bing, Li Yong-wang// Ranliao huaxue xuebao=J. Fuel Chem. and Technol.,-2000, V.28, №3, P.233-238.
24. Патент США №1400195, Process of making methyl formate / Willkie, Herman F.; 13.12.1921.
25. Патент США №1975853 Catalytic dehydrogenation of primary alcohols / Lazier, Wilbur A.; 09.10.1934.
26. Патент США №2160064 Manufacture of formic acid / Eversole, James F.; 30.05.1939
27. Патент США №4778923 Process for the production of methyl formate / Aplin Richard P; 18.10.1988.
28. Патент США №4149009 Process for producing methyl formate / Yoneoka Mikio; 10.04.1979.
29. Патент США №5144062 Process for producing methyl formate / Chen Shien-Chang; 1.09.1992.
30. Патент США №4480122 Process for producing methyl formate / Horlenko; 30.10.1984.
31. M. Ai Dehydrogenation of methanol to methyl formate over copper-based catalysts / M. Ai //Applied Catalysis, -1984, -V.l 1, №2, -P,259-270.
32. Патент США 5194675 Preparation of methyl formate / Joerg; Klaus, Mueller; Franz-Josef, Irgang; Matthias, Marosi; Laszlo, Borchert; Gerhard; 16.03.1993.
33. Патент №2875172, Получение формальдегида. Мисоноо Макото, Ямамото
34. Такэси, Порипарасутиккусу, Заявл. 20.12.1985. Опубл. 10.11. 1987. Япония.
35. Патент №6410793, Способ получения формальдегида из метанола. Jancar Stefan, Bodajla Michal Kondelka, Ladislav Butkovsky Ludovit, Ridarsky Andrej, Kovac Jozef, Vasil Pavol, Заявл. 01.07.1981. ЧССР.
36. Патент №4544773, Способ получения формальдегида. Masakazu Sagou, Заявл. 22.06.1984. Опубл. 1.10.1985, Япония.
37. Патент №4420641, Получение формальдегида. Gerberich Robert М., Smith Elgred Т., Заявл. 12.01.1983. Опубл. 13.12.1983, США.
38. Патент №3485543, Катализатор для окисления метанола в формальдегид. Хохлер Р.Я., Курина Л.Н., Кудрина Н.В., Заявл. 18.05.1982. СССР, Томск.
39. Wu Jing-Tao Изучение мембранного катализа. 1. Производство формальдегида с помощью каталитического дегидрирования метанола в реакторе с палладием на керамической мембране / Wu Jing-Tao, Deng Jing-Fa // Acta chim. Sim., -1993, № 5, -P.475-480.
40. Патент №4439624, Конверсия диметилового эфира в формальдегид над Bi-Mo-Cu катализатором. Lewis Robert М, Ryan Robert С., Slaugh Lynn H., Заявл. 7.10.1982. Опубл. 27.03.1984, США.
41. Авторское свидетельство Лапидус А.Л., Третьяков В.Ф., Бурдейная Т.Н., Голубева И.А., Ковалева Н.И. Каталитическое неокислительное дегидрирог вание метанола в формальдегид.
42. Rinaldo S. A mechanistic study of the methanol dehydration reaction on y-alumina catalyst / Rinaldo S. Schiffmo, Robert P. // J. Phys. Chem. -1993, -P.6425-6435.
43. Choi Y. Fuel cell grade hydrogen from methanol on a commercial Cu/Zn0/A1203 catalyst / Choi Y., Stenger H.G. // Applied Catalysis B: Environmental, -2002, -V.38, №4, -P.259-269.
44. Розовский А.Я. Механизм и кинетика реакций одноуглеродных молекул на Си-содержащих катализаторах / Розовский А.Я. // Кинетика и катализ. -2003, -Т.44, №3, -С.391-411.
45. Ионе К.Г. Синтезы углеводородов из соединений, содержащих один углеродный атом, с применением бифункциональных цеолитных катализаторов / Ионе К.Г., Степанов В.Г., Романников В.Н., Шепелев С.С. // Химия твёрдого топлива, -1982, №6, С. 35-50.
46. Патент №2220939 Комплексный способ получения диметилового эфира из углеводородных газов/ Розовский А.Я., Лин Г.И., Кубиков В.Б., Майдуров > Н.П., Петров В.Н., Брандт Б.Б., Махлин В.А.; заявлено 09.01.2002; опубл. 10.01.2004.
47. Патент №1173696 Способ получения диметилового эфира / Ионе К.Г., Мысов В.М. и др.; заявлено 03.03.1983; опубл. 10.03.1997, бюл. №7.
48. Заявка №97114880/04 Способ получения простого диметилового эфира, применяемого в качестве топлива/ Бодил Фосс, Финн Енсен, Ен Хансен; заявлено 03.09.1997; опубл. 20.06.1999.
49. Синицына О. А. Кинетика дегидратации метанола до диметилового эфира на СВК цеолите / Синицына О. А., Чумакова В. Н., Московская Н. Ф. // Кинетика и катализ- 1986-Т. 27. №5-с. 1160-1165.
50. J.-L. Li Inui Synthesis of dimethyl ether under forced composition cycling / J.-L. Li, X. G Zhang, T. // Applied Catalysis A: General 164 (1997) 303-311.
51. Аэров М.Э., Тодес O.M., Наринский Д.А. Аппараты со стационарным слоем: гидравлические и тепловые основы работы. Л.: Химия, -1979. -176С.
52. Попов И.Г. Термодинамическое равновесие реакций образования диметилового эфира и метанола из оксидов углерода и водорода / И.Г. Попов, Л.Ф.140
53. Решетняк, А.С. Шмелёв, B.C. Соболевский // Химическая промышленность,-2000, №7, -С. 29-32.
54. Popov B.I. Effect of excess molybdenum trioxide on the activity and selectivity of some molybdates in methanol oxidation / Popov B.I., Shkuratova L.N., Orlova L.B. // React. Kinet. Catal. Lett., -1976, -V.4, №3, -P.323-328.
55. Горшков C.B. Механизм дегидрирования метанола в метилформиат и пути управления селективностью процесса / Горшков С.В., Лиин Г.И., Розовский А.Я. // кинетика и катализ, -1999, -Т.40, №3, С.372-375.
56. Minyukova Т.Р. Dehydrogenation of methanol over copper-containing catalysts / Minyukova T.P., Simentsova I.I., Khasin A.V., Shtertser N.V., Baronskaya N.A., Khassin A.A., Yurieva T.M. // Applied Catalysis A: General, -2002, -V.237, №12, P.171-180.
57. Матышак В.А. Поверхностные соединения в системе метилформиат-метанол-диметиловый эфир-уА1203 по данным ИК-спектроскопии IN SITU / Матышак В.А., Хоменко Т.И., Лиин Г.И., Завалишин Н.И., Розовский А.Я. // Кинетика и катализ, -1999, -Т.40, №2, С.295-301.
58. Шлегель Л. Разложение метанола на Cu-содержащих катализаторах синтеза метанола / Шлегель Л., Гутшик Д., Розовский А.Я. // Кинетика и катализ. -1990, -Т.31, №4, С. 1000-1003.
59. Takagi К. Catalytic Activation of Coppers in the Various Oxidation States for the Dehydrogenation of Methanol / Takagi K., Morikawa Y., Ikawa T. // Chemistry Letters, -1985, №4, P.527-530.
60. Kobayashi H. Dispersion of Copper Supported on Silica and Methanol Reforming Reaction / Kobayashi H., Takezawa N., Minochi C., Takahashi K. // Chemistry Letters, -1980, №10, P.l 197-1200.
61. Курина Л.Н. Взаимодействие участников реакции окисления метанола с окислами Ti, Mo, Fe. / Курина Л.Н., Герасимова В.Н., Давыдов А.А., Судако-ва Н.Н. // Теор.Экспер.химия, 1981, Т17, №5, С713-718.
62. Gorazd Bercic Intrinsic and Global Reaction Rate of Methanol Dehydration over у-АЬОз Pellets / Gorazd Bercic, Janez Levee // J.Ind.Eng.Chem., -1992, -V.31, -P.1035-1040.
63. Zhaoguang Nie Intrinsic Kinetics of Dimethyl Ether Synthesis from Syngas / Zhaoguang Nie, Hongwei Liu, Dianhua Liu, Weiyong Ying, Dingye Fang // Journal of Natural Gas Chemistry, -2005, -V.14, №1, -P.22-28.
64. Ali Hadipour Kinetic Parameters and Dynamic Modeling of Reactor for Direct Conversion of Synthesis Gas to Dimethyl Ether / Ali Hadipour, Morteza Sohrabi // J.Ind.Eng.Chem., 2007, Vol. 13, № 4, P. 558-565.
65. K.L. Ng Kinetics and modelling of dimethyl ether synthesis from synthesis gas / K.L. Ng, D. Chadwick, B.A. Toseland // Chemical Engineering Science, -1999, -V.54, № 15-16, -P.3587-3592.
66. Graaf G.H. Chemical equilibria in methanol synthesis / G. H. Graaf, P. J. J. M. Sijtsema, E. J. Stamhuis, G. E. H. Joosten // Chem.Eng. Science, -1986, -V.41, № 11, -P.2883-2890.
67. Graaf G.H. Intra-particle diffusion limitations in low-pressure methanol synthesis / G. H. Graaf, H. Scholtens, E. J. Stamhuis, А. А. С. M. Beenackers.// Chem.Eng. Science, -1990, -V.45, № 4, -P.773-783.
68. Сосна M.X. О выборе кинетического уравнения реакции дегидратации метанола до ДМЭ на промышленном катализаторе / Сосна М.Х., Соколинский Ю.А., Королёв Е.В.// Хим. пром-сть сегодня. -2008, № 7, -С.6-12.
69. Патент №6458856 Процессы разделения при одностадийном получении диметилового эфира из синтез-газа / Peng, Xiang-dong, Diamond, Barry W., Tsao, Tsun-chiu Robert, Bhatt, Bharat Lajjaram,; заявлено 11.07.2001; опубл. 01.10.2002.
70. Патент №3449249/23-04 Способ получения диметилового эфира/ Джованни Манара; заявлено 01.06.1982; опубл. 07.08.1987. Бюл. №29.
71. Патент №2857788/23-04 Способ получения диметилового эфира/ Ионе Г.К., Носырева Г.Н., Вострикова Л. А., Леонов В.Е, Герич А.П., Топчий, В.А.; заявлено 19.12.1979; опубл. 07.05.1982. Бюл. №17.
72. Патент №2190954/23-04 Способ получения простых эфиров/ Витторио Фат-торе, Джованни Манара, Бруно Нотари; заявлено 20.11.1975; опубл. 23.06.81. Бюл. №23.
73. Патент №2556955/23-04 Способ получения диметилового эфира/ Джованни Манара, Бруно Нотари, Витторио Фатторе; заявлено 22.12.1977; опубл. 15.03.1982. Бюл. №10.
74. Патент №27478125/23-04 Способ совместного получения N-метилморфолина и диметилового эфира/ Николаенко Ю.А., Попов А.В., Горбунов Б.Н., Царенко С.В., Новикова С.Л., Сивкова Р.И.; заявлено 06.04.1979; опубл. 30.04.1981. Бюл. №16.
75. Патент №2748629/23-04 Способ совмещённого получения морфолина и диметилового эфира/ Николаенко Ю.А., Попов А.В., Горбунов Б.Н., Царенко С.В., Новикова С.Л., Сивкова Р.И.; заявлено 06.04.1979; опубл. 07.01.1981. Бюл. №1.
76. Патент №200232017/04 Способ получения диметилового эфира/ Павлов Д.С., Павлов О.С., Телков Ю.К.; заявлено 28.11.2002; опубл. 20.07.2005.
77. Патент №1978809/23-04 Способ получения диметилового эфира / Джорд-жио Пагани; заявлено 20.12.1972; опубл. 15.05.1982. Бюл. №18.
78. Е.И. Бункина Разработка технологического процесса получения диметилового эфира с использованием бифункционального катализатора / Е.И. Бункина, А.П. Какичев, А.А. Лендер, Н.П. Павлова//Хим.пром.,1999, №3 (145). С10-15.
79. Патент США №6608114 Process to produce DME / Heydorn; Edward C., Bhatt; Bharat Lajjaram, Diamond; Barry W.; заявлено 13.03.2002. опубликовано 19.08.2003.,
80. Элвин Б. Стайлз. Носители и нанесенные катализаторы. М.:Химия, -1991. -С. 240
81. Kolbel H.The Fischer-Tropsch Synthesis in the Liquid Phase / Kolbel H., Ralek M.//Catal.Rev.Sci.Eng. -1980, -V.21, №2, -P.225.
82. Dry M.E. Practical and theoretical aspects of the catalytic Fischer-Tropsch process / Dry M.E. //Appl.Catal.A: Gen. -1996, -V.138, №2, -P.319.
83. Guy Schmitz, Deshydratation dy methanol sur silice-alumine, / Guy Schmitz // Journal de chimic physique. -1978. -V.75, №6, -P.650-655
84. Бесков B.C., Флокк В., Моделирование каталитических процессов и реакторов. М.: Химия, 1991, с. 256.
85. Rinaldo S. Schiffino A mechanistic study of the methanol dehydration reaction on y-alumina catalyst / Rinaldo S. Schiffino, Robert P. Merrill // J. Phys. Chem. -1993. -V.97, №24, -P. 6425-6435.
86. Choi Y. Fuel cell grade hydrogen from methanol on a commercial Cu/Zn0/A1203 catalyst / Choi Y., Stenger H.G. // Applied Catalysis B: Environmental, -2002, -V.38, №4, -P.259-269.
87. Горшков C.B. Механизм дегидрирования метанола в метилформиат и пути управления селективностью процесса / Горшков С.В., Лиин Г.И., Розовский А.Я. // кинетика и катализ, -1999, -Т.40, №3, -С.372-375.
88. Розовский А.Я., Лин Г.И. Теоретические основы процесса синтеза метанола. -М.: Химия, -1990. С. 160.
89. Караваев М. М., Леонов В. Е., Попов И. Г. Технология синтетического метанола. -М.: Химия, 1984. С.240.
90. A. Jonasson, О. High Pressure Solubility of Carbon Dioxide and Carbon Mo-nooxyde in Dimethyl Ether / A. Jonasson, O. Persson, A. Fredenslund // J.Chem.Eng.Data, -1995, №40, -P.296-300.
91. P. Рид, Дж. Праусниц, Т. Шервуд. Свойства газов и жидкостей: Справочное пособие. Л.: Химия, 1982. 592 с.
92. М.А. Берлин, В.Г. Гореченков, Н.П. Волков. Переработка нефтяных и природных газов. М.: Химия, 1981. 472 с.
93. Г.С. Борисов, В.П. Брыков, Ю.И. Дытнерский и др. Под ред. Ю.И. Дыт-нерского. Основные процессы и аппараты химической технологии: Пособие по проектированию. М.: Химия, 1991. 496 с.
94. Гороновский И.Т., Назаренко Ю.П., Некряч Е.Ф. Краткий справочник по химии. — Киев: издательство Академии наук Украинской ССР, 1962. — 569 с.
95. Нормируемые показатели точности измерений в методиках выполнения измерений, регламентированных в документации на химическую продукцию. МУ 6/113-30-19-83. -М., 1983. 52 с.
96. Дерффель К. Статистика в аналитической химии. — М.: Мир, 1994. — 268с.
97. Расчёт эффективности ректификационной тарелки по Мерфри
98. Данная модельная система, рассматривается аналогично схеме, представленной в разделе 2.5.2.1.
99. Расчёт параметров модельной системы Для расчета параметров модельной системы используем данные по работе промышленной установки в режиме вывода инертов из сборника флегмы.
100. Приход ДМЭ: Бдмэ = 385 кг/ч = 385 / 46 = 8,37 кмоль / ч.
101. Мольная доля С02 в питании: Nco2 = 0,9 / 10 = 0,09.
102. Мольная доля ДМЭ в питании: = 8,37 / 10 = 0,84.
103. Мольная доля инертов в питании: NHHepx = 0,68 / 10 = 0,07.
104. Поток флегмы Ф = 18 т/ч = 18000 / 46 = 390 кмоль/ч.
105. Поток жидкости в колонне L = Ф = 390 кмоль/час = 390/3600 = 0,108 кмоль/с.
106. Средняя молярная масса пара и жидкости Мх ~ Му ~ 46 кг/кмоль. Плотность паровой фазы:ру = Му-Р/(8,314-Т-1 ООО) = 46-1,1 • 10б/(8,314-(273+40>1 ООО) = 19,4 кг/м3.1. Рабочее сечение тарелки:
107. Fpa6 = f-0,785-D2 = 0,874-0,785-1,082 = 0,8 м2.
108. Скорость пара в рабочем сечении тарелки:wm = 1000-G-8,314-T/(P- Fpa6) = 1000-0,111-8,314-(273+40)/(1,1-106-0,8) = = 0,328 м/с.
109. Массовый расход жидкости: LM = L- Мх = 0,108-46 = 4,97 кг/с.
110. Плотность жидкой фазы принимаем равной плотности жидкого ДМЭ при температуре 40 °С: рх = 629,2 кг/м3.
111. Удельный расход жидкости на 1 м ширины сливной перегородки: q = LM/(b- рх) = 4,97/(0,7-629,2) = 0,0113 м2/с.
112. Вязкость, поверхностное натяжение жидкой фазы принимаем равными вязкости, поверхностному натяжению жидкого ДМЭ при температуре 40 °С: (ix = 0,130 мПа-с; <тх = 0,01 Н/м.
113. Вязкость воды при температуре 40 °С:1. Сн2о = 0,0696 Н/м.
114. Высота светлого слоя жидкости:ч0,09
115. Д2 056 (0,05-4,60,1) (-0,110,13) ( 0,01 Л h() = 0,7870,01 Is 0,1 0,32 о J (\-0,31е J) —- =0,08140,0696)01. Критерий Фруда:
116. Fr = wm2/(9,81-/70) = 0,3282/(9,81-0,0814) = 0,135. Паросодержание барботажного слоя:1 +/FV 1 + J 0,135 Плотность орошения:
117. U = Lм/( Fpa6 • рх) = 4,97/(0,8-629,2) = 0,00987 м3/м2-с.
118. Коэффициент диффузии в паровой фазе для системы ДМЭ С02 при 40 °С: Dx = 0,118-10~7 м2/с.
119. Коэффициент диффузии в жидкой фазе для системы ДМЭ С02 при 40 °С и 1,1 МПа:1. Dy = 0,866-10~б м2/с.
120. Вязкость паровой фазы принимаем равной вязкости газообразного ДМЭ при температуре 40 °С: Цу = 0,00975 мПа-с.
121. Коэффициент массоотдачи для жидкой фазы:0 5, л0,5 , л0,5u'-j I п пппоч \ /п лллтс л5 ,п6,2410' (0,11810 )0,009870,08140,009751. КО, 00975+ 0,130)1. А-0,269)
122. Коэффициент массоотдачи для паровой фазы:0,169 м/с.
123. Ру= 6,24105 0,04 ( 0,86610'6)0,328 0,269)0,08140,009751. КО,00975+ 0,130)0,551 м/с.
124. Среднее значение константы межфазового равновесия в пределах концентраций С02 0,1 -3 (% мольн.) при 40 °С и 1,1 МПа: m = 3,54.л
125. Пересчет коэффициентов массоотдачи на кмоль/м -с: Pxf = 0,169-рх/Мх = 0,169-629,2/46 = 2,31 кмоль/м2-с Pyf = 0,551-ру/ТЦ, =0,551- 19,4/46 = 0,232 кмоль/м2-с. Коэффициент массопередачи:
126. Kyf= 1 /(1 / Pyf+ш/pxf) = 1 / (1 / 0,232+ 3,54/2,31) = 0,171 кмоль/м2-с.
127. Общее число единиц переноса:п0у = КуfMy/( Py- wm) = 0,171-46/(19,4-0,328) = 1,24.1. Локальная эффективность:
128. Еу = 1 exp(-noy) = 1 - ехр(—1,24) = 0,71.1. Фактор массопередачи:
129. X = m-G/L = 3,54-400/390 = 3,63.1. Фактор скорости:1. F = wm-^= 0,328- {Ш=1,44.
130. При данном значении F принимаем долю байпасирующей жидкости 0 = 0,1. Число ячеек полного перемешивания S определим как отношение длины пути жидкости на тарелке 1т к длине, соответствующей одной ячейке (-350 мм): S = 1Т / 350 = 830 / 350 = 2,37 = 2.
131. Коэффициент, учитывающий влияние свойств жидкости и пара на унос:т' = 1,15 100,295 . .0,4251. G \ ( р р ^ г х г уР1. V У Jv
www.dissercat.com
ТЕХНОЛОГИЯ ОДНОСТАДИЙНОГО СИНТЕЗА ДИМЕТИЛОВОГО ЭФИРА ИЗ ПРИРОДНОГО ГАЗА
- Home
- Documents
- ТЕХНОЛОГИЯ ОДНОСТАДИЙНОГО СИНТЕЗА ДИМЕТИЛОВОГО ЭФИРА ИЗ ПРИРОДНОГО ГАЗА
Published on06-Apr-2017
View226
Download1
Transcript
- ÄÎÁÛ×À È ÏÅÐÅÐÀÁÎÒÊÀ ÍÅÔÒÈ È ÃÀÇÀ 145 УДК 662.755:[662.767:66.093.6] И. В. Савенкова, Ю. Ю. Михайлова ÒÅÕÍÎËÎÃÈß ÎÄÍÎÑÒÀÄÈÉÍÎÃÎ ÑÈÍÒÅÇÀ ÄÈÌÅÒÈËÎÂÎÃÎ ÝÔÈÐÀ ÈÇ ÏÐÈÐÎÄÍÎÃÎ ÃÀÇÀ В настоящее время одной из важнейших проблем, волнующих человечество, является по- иск альтернативных энергоносителей. Это связано не только с наступающим дефицитом нефтя- ного сырья, но и с экологическими проблемами, поскольку использование углеводородного то- плива в двигателях внутреннего сгорания сопровождается выбросами в атмосферу огромного количества вредных веществ. Весьма привлекательной является возможность использования в качестве моторных топ- лив эфиров и спиртов. Одним из наиболее перспективных топлив для дизельных двигателей яв- ляется диметиловый эфир (ДМЭ), сырьём для производства которого служит природный газ, что позволяет экономить нефтяные ресурсы [1]. Хотя по теплотворной способности ДМЭ в полтора раза уступает традиционному дизель- ному топливу, по остальным показателям его превосходство несомненно. Наиболее важная ха- рактеристика дизельного топлива – цетановое число. Цетановое число ДМЭ составляет 55–60 против 40–55 для дизельного топлива, температура воспламенения – 235 ºС против 250 ºС соответственно. Такие свойства позволяют легко запускать холодный двигатель, а присутствие в составе ДМЭ атома кислорода обеспечивает бездымное горение топлива. Кроме того, двига- тель, работающий на ДМЭ, практически не шумит. Главное же преимущество ДМЭ как дизель- ного топлива – экологически чистый выхлоп. В выхлопе нет оксидов серы и сажи, и в результа- те сгорания ДМЭ образуется такое небольшое количество оксидов азота, что выхлоп без всякой очистки соответствует самым жестким в мире экологическим требованиям – EURO-3 и ULEV (EURO-3 – последние европейские нормы для автомобильного выхлопа, ULEV – наиболее жесткие в США нормы штата Калифорния) [2]. В настоящее время существуют два подхода к организации производства ДМЭ. 1. Использование двух последовательно работающих реакторов с получением метанола в первом реакторе и его дегидратацией во втором. 2. Использование бифункционального катализатора, когда в реакторе идёт образование метанола с его одновременной дегидратацией в ДМЭ; далее необходима лишь стадия разделе- ния этих продуктов с учетом значительной разницы в температуре кипения ДМЭ (–28 ºC), мета- нола (56 ºC) и воды (100 ºC) эта стадия осуществляется достаточно просто – ректификацией или последовательной конденсацией [1, 3]. Производство ДМЭ прямым синтезом, минуя стадию получения метанола, экономически более выгодно, т. к. характеризуется меньшими эксплуатационными и капитальными затратами даже в сравнении с производством метанола. Предполагается, что механизм образования ДМЭ из СО и Н2 отвечает схеме последова- тельного восстановления оксидов углерода водородом: ОНСОНСО 222 +↔+ ОН+O)(CH↔4Н+2СС 2232 Синтез проводят при давлении около 30,0 МПа, температуре 290–400 ºС в адиабатическом реакторе в присутствии катализатора СНМ-У модифицированного (разработка ГНИПИ «Хим- технология», производство ООО НПК «Алвиго-КС», г. Северодонецк, Украина). Ключевой ста- дией процесса химической конверсии природного газа в ДМЭ является стадия превращения ме- тана в синтез-газ, поэтому основной акцент при разработке технологий следует сделать на по- иске способа получения более дешевого синтез-газа. Кроме того, обеспечивается низкий уро- вень выбросов вредных веществ (NO2, SO2, CO) в атмосферу. В отличие от западных техноло- гий конверсию синтез-газа в ДМЭ можно осуществлять без стадии ректификации. Общая рециркуляционная схема, характерная для синтеза метанола, остается без изменений.
- ISSN 1812-9498. ÂÅÑÒÍÈÊ ÀÃÒÓ. 2008. № 6 (47) 146 Предлагаемый способ позволяет получить ДМЭ без примесей метанола. Основным аппа- ратом в синтезе ДМЭ служит 4-полочный реактор для экзотермических реакций, в котором на решётках уложен в четыре слоя катализатор в виде гранул размерами 5 × 5 мм. От синтеза метанола он отличается лишь способом размещения катализатора дегидратации метанола и циркулирующим агентом, используемым для охлаждения образующихся продуктов. Реактор предназначен для получения газообразного ДМЭ из синтез-газа, поступающего со стадии конверсии природного газа. Температурный режим реактора поддерживают подачей холодного (байпасного) газа между слоями катализатора. Производительность катализатора СНМ-У-модифицированного с учетом всех потерь по ДМЭ – 12–13 т/сут. Бифункциональный катализатор загружается в количестве 6,2 м3 в 4-полочную колонну синтеза ДМЭ. Распределение катализатора по слоям будет следующим: на первую полку загружается 0,5 м3 катализатора, на вторую полку – 0,9 м3, на третью – 1,7 м3, на четвёртую – 3,1 м3. Аппаратура процесса ректификации ДМЭ и метанола не отличается от общеизвестной ректификационной. Для ректификации используют аппараты колонного типа. Процесс обезэфи- ривания и предварительной ректификации осуществляют в колоннах как насадочного, так и та- рельчатого типа. Колонны снабжены тарелками колпачковыми с туннельными и капсульными колпачками; ситчатыми (крупнодырчатыми), клапанными с клапанами типа «Глитч» и прямо- точными клапанами. Лучше всего зарекомендовали себя ситчатые крупнодырчатые тарелки. Они просты в изготовлении и надёжны в работе. Свободное сечение тарелок по высоте колонны основной ректификации неодинаково и изменяется в пределах 6,0–8,4 % [4]. Отделение синтез-газа от циркуляционного газа осуществляется в горизонтальных или вертикальных сепараторах. При этом часть смеси ДМЭ, спиртов и воды оседает под действием гравитационных сил, а капельная и туманообразная жидкость отделяются на специально установленных в верхней части аппарата металлических сетках. Диметиловый эфир – потенциально крупнотоннажный продукт, масштабы потребления ко- торого могут оказаться сопоставимыми с масштабами потребления бензина и дизельного топлива. Предварительные технико-экономические расчеты специалистов показывают, что произ- водство ДМЭ по цене может быть конкурентоспособным с производством нефтяного дизельного топлива и быть ниже цены дизельного топлива, полученного процессом Фишера – Тропша [5]. Спрос на данную продукцию будет расти из года в год. Причина – увеличение потребно- сти в моторном топливе, недорогостоящем, имеющем высокоэффективные экологические показатели и сравнительно высокое качество. СПИСОК ЛИТЕРАТУРЫ 1. Крылов И. Ф., Емельянов В. Е. Альтернативные дизельные топлива. Диметиловый эфир // Мир нефтепродуктов. – 2007. – № 2. – С. 38–39. 2. Новое топливо из природного газа / http://www.methanol.ru. 3. Кессель И. Б. Синтетические жидкие топлива // Актуальные проблемы газохимии: тр. москов. семи- нара по газохимии. 2002–2003 гг. – М.: Нефть и газ, 2004. – С. 41–62. 4. Промышленные испытания катализатора прямого синтеза диметилового эфира из СО-содержащего газа на метанольном производстве / Д. В. Ляхин, А. П. Какичев, Л. Н. Морозов и др. // Химическая промышленность. – 2005. – Т. 82, № 10. – С. 485–491. 5. Технология синтетического метанола / М. М. Караваев, В. Е. Леонов, Е. Г. Попов, Е. Т. Шепелёв. – М.: Химия, 1984. – С. 187–189. Статья поступила в редакцию 22.10.2008
- ÄÎÁÛ×À È ÏÅÐÅÐÀÁÎÒÊÀ ÍÅÔÒÈ È ÃÀÇÀ 147 TECHNOLOGY OF ONE-PHASE SYNTHESIS OF DIMETHYL ETHER FROM NATURAL GAS I. V. Savenkova, Yu. Yu. Mikhailova Dimethyl ether is not expensive petrol, which has high-efficient ecological indices and comparatively high quality. The technology of direct synthesis of di- methyl ether with the use of bifunctional catalyst, when in the reactor the process of methanol generation with its simultaneous dehydration into dimethyl ether takes place, is described. The natural gas is used as alternative raw material, which leads to economizing of oil resources. Key words: dimethyl ether, direct synthesis, alternative energy.
docslide.net
ТЕХНОЛОГИЯ ОДНОСТАДИЙНОГО СИНТЕЗА ДИМЕТИЛОВОГО ЭФИРА ИЗ ПРИРОДНОГО ГАЗА
- Home
- Documents
- ТЕХНОЛОГИЯ ОДНОСТАДИЙНОГО СИНТЕЗА ДИМЕТИЛОВОГО ЭФИРА ИЗ ПРИРОДНОГО ГАЗА
Post on 06-Apr-2017
226 views
TRANSCRIPT
- ÄÎÁÛ×À È ÏÅÐÅÐÀÁÎÒÊÀ ÍÅÔÒÈ È ÃÀÇÀ 145 УДК 662.755:[662.767:66.093.6] И. В. Савенкова, Ю. Ю. Михайлова ÒÅÕÍÎËÎÃÈß ÎÄÍÎÑÒÀÄÈÉÍÎÃÎ ÑÈÍÒÅÇÀ ÄÈÌÅÒÈËÎÂÎÃÎ ÝÔÈÐÀ ÈÇ ÏÐÈÐÎÄÍÎÃÎ ÃÀÇÀ В настоящее время одной из важнейших проблем, волнующих человечество, является по- иск альтернативных энергоносителей. Это связано не только с наступающим дефицитом нефтя- ного сырья, но и с экологическими проблемами, поскольку использование углеводородного то- плива в двигателях внутреннего сгорания сопровождается выбросами в атмосферу огромного количества вредных веществ. Весьма привлекательной является возможность использования в качестве моторных топ- лив эфиров и спиртов. Одним из наиболее перспективных топлив для дизельных двигателей яв- ляется диметиловый эфир (ДМЭ), сырьём для производства которого служит природный газ, что позволяет экономить нефтяные ресурсы [1]. Хотя по теплотворной способности ДМЭ в полтора раза уступает традиционному дизель- ному топливу, по остальным показателям его превосходство несомненно. Наиболее важная ха- рактеристика дизельного топлива – цетановое число. Цетановое число ДМЭ составляет 55–60 против 40–55 для дизельного топлива, температура воспламенения – 235 ºС против 250 ºС соответственно. Такие свойства позволяют легко запускать холодный двигатель, а присутствие в составе ДМЭ атома кислорода обеспечивает бездымное горение топлива. Кроме того, двига- тель, работающий на ДМЭ, практически не шумит. Главное же преимущество ДМЭ как дизель- ного топлива – экологически чистый выхлоп. В выхлопе нет оксидов серы и сажи, и в результа- те сгорания ДМЭ образуется такое небольшое количество оксидов азота, что выхлоп без всякой очистки соответствует самым жестким в мире экологическим требованиям – EURO-3 и ULEV (EURO-3 – последние европейские нормы для автомобильного выхлопа, ULEV – наиболее жесткие в США нормы штата Калифорния) [2]. В настоящее время существуют два подхода к организации производства ДМЭ. 1. Использование двух последовательно работающих реакторов с получением метанола в первом реакторе и его дегидратацией во втором. 2. Использование бифункционального катализатора, когда в реакторе идёт образование метанола с его одновременной дегидратацией в ДМЭ; далее необходима лишь стадия разделе- ния этих продуктов с учетом значительной разницы в температуре кипения ДМЭ (–28 ºC), мета- нола (56 ºC) и воды (100 ºC) эта стадия осуществляется достаточно просто – ректификацией или последовательной конденсацией [1, 3]. Производство ДМЭ прямым синтезом, минуя стадию получения метанола, экономически более выгодно, т. к. характеризуется меньшими эксплуатационными и капитальными затратами даже в сравнении с производством метанола. Предполагается, что механизм образования ДМЭ из СО и Н2 отвечает схеме последова- тельного восстановления оксидов углерода водородом: ОНСОНСО 222 +↔+ ОН+O)(CH↔4Н+2СС 2232 Синтез проводят при давлении около 30,0 МПа, температуре 290–400 ºС в адиабатическом реакторе в присутствии катализатора СНМ-У модифицированного (разработка ГНИПИ «Хим- технология», производство ООО НПК «Алвиго-КС», г. Северодонецк, Украина). Ключевой ста- дией процесса химической конверсии природного газа в ДМЭ является стадия превращения ме- тана в синтез-газ, поэтому основной акцент при разработке технологий следует сделать на по- иске способа получения более дешевого синтез-газа. Кроме того, обеспечивается низкий уро- вень выбросов вредных веществ (NO2, SO2, CO) в атмосферу. В отличие от западных техноло- гий конверсию синтез-газа в ДМЭ можно осуществлять без стадии ректификации. Общая рециркуляционная схема, характерная для синтеза метанола, остается без изменений.
- ISSN 1812-9498. ÂÅÑÒÍÈÊ ÀÃÒÓ. 2008. № 6 (47) 146 Предлагаемый способ позволяет получить ДМЭ без примесей метанола. Основным аппа- ратом в синтезе ДМЭ служит 4-полочный реактор для экзотермических реакций, в котором на решётках уложен в четыре слоя катализатор в виде гранул размерами 5 × 5 мм. От синтеза метанола он отличается лишь способом размещения катализатора дегидратации метанола и циркулирующим агентом, используемым для охлаждения образующихся продуктов. Реактор предназначен для получения газообразного ДМЭ из синтез-газа, поступающего со стадии конверсии природного газа. Температурный режим реактора поддерживают подачей холодного (байпасного) газа между слоями катализатора. Производительность катализатора СНМ-У-модифицированного с учетом всех потерь по ДМЭ – 12–13 т/сут. Бифункциональный катализатор загружается в количестве 6,2 м3 в 4-полочную колонну синтеза ДМЭ. Распределение катализатора по слоям будет следующим: на первую полку загружается 0,5 м3 катализатора, на вторую полку – 0,9 м3, на третью – 1,7 м3, на четвёртую – 3,1 м3. Аппаратура процесса ректификации ДМЭ и метанола не отличается от общеизвестной ректификационной. Для ректификации используют аппараты колонного типа. Процесс обезэфи- ривания и предварительной ректификации осуществляют в колоннах как насадочного, так и та- рельчатого типа. Колонны снабжены тарелками колпачковыми с туннельными и капсульными колпачками; ситчатыми (крупнодырчатыми), клапанными с клапанами типа «Глитч» и прямо- точными клапанами. Лучше всего зарекомендовали себя ситчатые крупнодырчатые тарелки. Они просты в изготовлении и надёжны в работе. Свободное сечение тарелок по высоте колонны основной ректификации неодинаково и изменяется в пределах 6,0–8,4 % [4]. Отделение синтез-газа от циркуляционного газа осуществляется в горизонтальных или вертикальных сепараторах. При этом часть смеси ДМЭ, спиртов и воды оседает под действием гравитационных сил, а капельная и туманообразная жидкость отделяются на специально установленных в верхней части аппарата металлических сетках. Диметиловый эфир – потенциально крупнотоннажный продукт, масштабы потребления ко- торого могут оказаться сопоставимыми с масштабами потребления бензина и дизельного топлива. Предварительные технико-экономические расчеты специалистов показывают, что произ- водство ДМЭ по цене может быть конкурентоспособным с производством нефтяного дизельного топлива и быть ниже цены дизельного топлива, полученного процессом Фишера – Тропша [5]. Спрос на данную продукцию будет расти из года в год. Причина – увеличение потребно- сти в моторном топливе, недорогостоящем, имеющем высокоэффективные экологические показатели и сравнительно высокое качество. СПИСОК ЛИТЕРАТУРЫ 1. Крылов И. Ф., Емельянов В. Е. Альтернативные дизельные топлива. Диметиловый эфир // Мир нефтепродуктов. – 2007. – № 2. – С. 38–39. 2. Новое топливо из природного газа / http://www.methanol.ru. 3. Кессель И. Б. Синтетические жидкие топлива // Актуальные проблемы газохимии: тр. москов. семи- нара по газохимии. 2002–2003 гг. – М.: Нефть и газ, 2004. – С. 41–62. 4. Промышленные испытания катализатора прямого синтеза диметилового эфира из СО-содержащего газа на метанольном производстве / Д. В. Ляхин, А. П. Какичев, Л. Н. Морозов и др. // Химическая промышленность. – 2005. – Т. 82, № 10. – С. 485–491. 5. Технология синтетического метанола / М. М. Караваев, В. Е. Леонов, Е. Г. Попов, Е. Т. Шепелёв. – М.: Химия, 1984. – С. 187–189. Статья поступила в редакцию 22.10.2008
- ÄÎÁÛ×À È ÏÅÐÅÐÀÁÎÒÊÀ ÍÅÔÒÈ È ÃÀÇÀ 147 TECHNOLOGY OF ONE-PHASE SYNTHESIS OF DIMETHYL ETHER FROM NATURAL GAS I. V. Savenkova, Yu. Yu. Mikhailova Dimethyl ether is not expensive petrol, which has high-efficient ecological indices and comparatively high quality. The technology of direct synthesis of di- methyl ether with the use of bifunctional catalyst, when in the reactor the process of methanol generation with its simultaneous dehydration into dimethyl ether takes place, is described. The natural gas is used as alternative raw material, which leads to economizing of oil resources. Key words: dimethyl ether, direct synthesis, alternative energy.
vdocuments.site
Получение диметилового эфира дегидратацией метанола на АlPO4 +SiO2 катализаторах
Из возможных направлений использования ДМЭ (топливо для бытовых нужд, моторное топливо, сырье для теплоэлектростанций) для европейского рынка наиболее вероятен транспорт. Несмотря на то, что в настоящее время ДМЭ используется исключительно в качестве пропелента и ежегодное мировое потребление не превышает 150 тыс. тонн, ожидается, что в ближайшие годы сформируется рынок ДМЭ как моторного топлива.
10.3. Выбор технологии переработки
В основе существующего процесса промышленного синтеза ДМЭ лежит экзотермическая реакция дегидратации метанола. Это относительно простой процесс, который целесообразен только для установок небольшой мощности и капиталоемкости. Синтез проводят при давлении около 1,0 МПа, температуре 290-4000С в адиабатическом реакторе в присутствии катализатора (оксид алюминия). Конверсия метанола за один проход составляет около 80%.
Рекомендовать данную технологию для крупнотоннажного производства ДМЭ нельзя, так как себестоимость ДМЭ, образующегося при дегидратации метанола, существенно (в 2 раза) выше, чем метанола. Так как получение ДМЭ в любом случае проходит стадию образования метанола, то все предлагаемые к реализации технологии синтеза ДМЭ из природного газа являются, в общем случае, развитием метанольного производства и включают в себя ряд общих стадий: стадию риформинга природного газа в синтез-газ (смесь водорода и окиси углерода), на которую приходится до 70% общего объема затрат на процесс; стадию каталитического превращения синтез-газа в смесь метанола и ДМЭ, на которую приходится 20-25% капитальных затрат на процесс; стадию разделения метанола и ДМЭ.
В Российских академических институтах (ИНХС им. А.В.Топчиева, ИОХ им. А.Д.Зелинского) также проводятся работы по созданию технологии производства ДМЭ из природного газа. Исследования носят преимущественно академический характер, направлены на создание новых катализаторов получения ДМЭ из синтез-газа. Исследования, проводимые в ГНЦ НИФХИ им Л.Я.Карпова, направлены на разработку технологической схемы и конструктивного оформления процесса.
По-нашему мнению, ключевой стадией процесса химической конверсии природного газа в ДМЭ является стадия превращения метана в синтез-газ. Поэтому основной акцент при разработке технологий следует сделать на получение более дешевого синтез-газа по сравнению с существующими способами.
Технология "Тандем" (двухступенчатая парокислородная конверсия природного газа с трубчатым реактором), разработанная ГИАП (Россия) и фирмой Linde (Германия), в настоящее время является одной из самых эффективных технологий получения метанола из природного газа. В промышленном масштабе она реализована на ПО "Азот" (Беларусь). Производительность установки по перерабатываемому газу - 130 млн м3/год. По данной технологии проектируется установка производства метанола на АО "Нитроферт" (Эстония) производительностью по природному газу 400 млн м3/год.
Процесс "Тандем" имеет ряд очевидных преимуществ по сравнению с паровой конверсией природного газа в шахтном реакторе.
К ним следует отнести автотермичность процесса и замкнутый энергетический цикл, минимальный удельный расход природного газа на 1 тонну вырабатываемого продукта (расходный коэффициент получения 1 тонны метанола из природного газа составляет 85% от потенциально возможного, т.е. только 15% или 150 м3 природного газа из взятых 1 000 м3 потребляется для обеспечения энергетики процесса "Тандем"). Кроме того, обеспечивается низкий уровень выбросов вредных веществ (NOx, SO2, CO) в атмосферу.
В отличие от западных технологий конверсию синтез-газа в ДМЭ можно осуществлять без стадии ректификации. Общая рециркуляционная схема, характерная для синтеза метанола, остается без изменений. Реактор, как и в синтезе метанола, состоит из адиабатических слоев (полок), но отличается способом размещения катализатора дегидратации метанола и используемым циркулирующим агентом для охлаждения образующихся продуктов.
Конденсация состоит из трех ступеней: конденсатора влаги, конденсатора метанола и конденсатора ДМЭ. Предлагаемый способ позволяет получить ДМЭ без примесей метанола.
Процесс "Тандем" обеспечивает необходимый для последующей стадии состав синтез-газа при давлении в реакторе 30-90 атм. Это определяет благоприятные условия для создания агрегата производства ДМЭ без компрессора синтез-газа, что, безусловно, значительно повысит его технико-экономические показатели.
Предварительный анализ процесса показывает возможность создания агрегата производительностью 500-800 тыс. тонн в год по ДМЭ, оборудование которого имеет промышленные аналоги и может быть создано в однолинейном исполнении транспортабельных габаритов.
В настоящее время ВНИИГАЗ совместно с ГНЦ НИФХИ, ИВТАН, РГУНГ им. И.М.Губкина разрабатывает ТЭО по созданию завода производства ДМЭ единичной мощности 500 тыс. тонн в год. Работа проводится в рамках научно-технической подпрограммы "Прогрессивные технологии комплексного освоения топливно-энергетических ресурсов недр России" федеральной целевой научно-технической программы "Исследования и разработки по приоритетным направлениям развития науки и техники гражданского назначения" Министерства науки и технологий Российской Федерации. [27]
11. Производство ДМЭ из угля
Речь идет, прежде всего, о применении на угледобывающих предприятиях технологий и установок по переработке угля в особо ценные виды высокоэффективных и экологически чистых синтетических моторных топлив, таких например, как диметиловый эфир (ДМЭ). Тем более что именно сжиженный природный газ и синтетические моторные топлива, как известно, являются одним из приоритетов уже в только что принятой Энергетической стратегии России.
Применение этого высококачественного дизельного и энергетического топлива, альтернативного нефтяному, является настолько перспективным, что не только многие зарубежные компании и фирмы (BP, Marubeni, NKK, Air Products & Chemicals Inc.), но и ряд российских предприятий ведут работы по промышленному освоению этого весьма привлекательного в коммерческом отношении направления. Это обусловлено тем, что ДМЭ, как моторное топливо, в частности, имеет более высокое цетановое число (55-60 в отличие от 40-55 для нефтяного дизельного топлива), а при его сгорании в выхлопных газах практически отсутствуют сажа и оксиды азота.
Независимо от технологии промышленного синтеза ДМЭ получение этого топлива проходит стадию образования метанола путем риформинга природного газа в синтез-газ (смесь водорода и окиси углерода), на которую приходится почти две трети общих энергетических затрат на процесс. Последующие же стадии каталитического превращения синтез-газа в смесь метанола и ДМЭ, а затем их разделения требуют значительно более низких энергозатрат, но являются достаточно капиталоемкими.
Сегодня некоторые зарубежные фирмы (NKK, Air Products & Chemicals Inc.) уже имеют опытно-промышленные технологии и установки производства ДМЭ из угля в шламовых реакторах, работающих при соотношениях h3/CO от 0,7 до 1. По данным корпорации NKK (Япония) установка по производству 2500 т/сут ДМЭ будет перерабатывать 4000 т угля в сутки. Синтез ДМЭ осуществляется при температуре 250-2700С и давлении 30-70 атм., процент конверсии за один цикл прохода метанола составляет 55-60 и на выходе реактора ДМЭ составляет 95-99%. Минимальная стоимость такой установки составляет 365 млн долл. США.
Ориентировочный расчет экономической эффективности работы такой установки по специально разработанной Excel-программе, выполненный при следующих исходных данных:
- производительность установки по ДМЭ, млн. т/год - 0,83
- стоимость 1т у.т., $/т – 50
- стоимость установки, млн $ - 365
- дополнительные капиталовложения, $/т ДМЭ - 18,5
- прочие переменные издержки, $/т ДМЭ - 5,5
- транспортные расходы по доставке ДМЭ, $/т ДМЭ - 2,5
- длительность эксплуатации установки, год - 20подтверждает достаточно высокую экономическую эффективность осуществления такого проекта.
При расчетах определялись стандартные показатели, характеризующие эффективность проекта: чистый дисконтированный доход NPV = 359,85 млн $; внутренняя норма доходности IRR = 26%; индекс доходности PI = 0,95 и tд = 6 лет.
Как видим, при принятых исходных данных не все критерии эффективности, строго говоря, свидетельствуют в пользу реализации данного проекта. Так, индекс доходности проекта является несколько меньшим единицы, хотя другие показатели, такие как IRR и дисконтированный срок окупаемости являются достаточно высокими.
Ситуация в этом смысле изменяется существенным образом при изменении таких параметров, как ставка дисконтирования, цена исходного топлива, ставка налогообложения, стоимость реализации (поставки) одной тонны ДМЭ и пр. В частности, только при снижении ставки дисконтирования с 12 до 10 % индекс доходности проекта уже становится равным 1,21, а дисконтированный срок окупаемости снижается с 6 до 5 лет. Если же принять стоимость исходного топлива на уровне 30 $/т, что находится даже несколько выше существующих сегодня цен на уголь, то рассматриваемый проект становится “эффективным” по всем показателям и при ставке дисконтирования 12%.
Еще большие возможности для перспективного развития угольной промышленности открываются на путях комплексного энергохимического использования (сжигания) каменного угля, при котором в значительной мере снижаются и выбросы в окружающую среду инертного газа СО2, являющегося, как известно (в силу парникового эффекта), своего рода барьером на пути развития угольной энергетики.[28]
12. Каталитические системы на основе алюмофосфатов цеолитного типа
Важным направлением работ в области синтеза новых адсорбентов и катализаторов является получение цеолитных структур на основе неорганических фосфатов. В последние годы пристальное внимание исследователей привлекли фосфорсодержащие цеолиты. Однако получить алюмофосфатные молекулярные сита, свободные от кремний-кислородных тетраэдров, не удавалось, поскольку синтез проводили в присутствии алюмосиликатного геля. В 1982 г., проведя гидротермальный синтез с использованием структурообразующих реагентов, получили новый класс алюмофосфатных молекулярных сит, в которых кремний-кислородные тетраэдры полностью изоморфно замещены на фосфор-кислородные. Разнообразие размеров пор и структуры в сочетании с высокой термической устойчивостью делают каталитические и адсорбционные свойства алюмофосфатных молекулярных сит уникальными.
По данным работы [29] фосфорсодержащие цеолиты обладают мягкими кислотными свойствами, а в [30, 31] указывается, что при каталитическом разложении метанола на алюмофосфатах в атмосфере азота единственным продуктом конверсии метанола при Т до 400°С был диметиловый эфир, но при дальнейшим увеличении температуры наблюдается образование формальдегида и закоксовывание катализатора. Алюмофосфаты обладают высокой удельной поверхностью, которая достигает 440 м2 /г, что является очень важным, так как их активность значительно возрастает с увеличением их удельной поверхности [32].
В литературе [31-33] представлены способы получения алюмофосфатов путем гидротермальной обработки реакционных гелей, полученных взаимодействием активного золя гидроксида алюминия с концентрированной фосфорной кислотой. Кристаллизацию гидрогеля проводят при температуре Т = 303-523 К в присутствии органических оснований или мочевины, выполняющих структурно-направляющую роль в процессе синтеза. Органические основания и мочевина, применяемые в процессе синтеза, определяют направление кристаллизации алюмофосфатного геля [33], что приводит к воспроизводимому формированию различных кристаллических структур с развитой системой микропор. Тип структуры алюмофосфатов обусловлен главным образом природой и свойствами структурообразующих реагентов. В ряде случаев алюмофосфаты цеолитного типа как по структуре, так и по способности к поглощению газов и паров подтверждают свою близость к эталонным образцам известных алюмосиликатных сит [31]. Поскольку формирование структуры алюмофосфатов происходит с заполнением микропор органическими соединениями, которые удаляются при нагревании, по завершении приготовления таких катализаторов необходимо их прокаливание с целью удаления органических составляющих, а также остатков влаги.
В [32, 34] представлен способ получения аморфных фосфатов алюминия осажденем из растворов азотнокислого алюминия и фосфорной кислоты аммиаком. Кроме того в [32] предложен способ получения гелеобразных фосфатов путем осаждения из раствора нитрата алюминия и фосфорной кислоты аммиаком с добавлением мочевины в качестве структурообразующего компонента.
Несомненным плюсом алюмофосфатов является их высокая термическая стабильность. По сравнению с алюмосиликатными молекулярными ситами, имеющими сравнительно низкий температурный предел устойчивости, в большинстве случаев 400-600°С [31], алюмофосфаты характеризуются высокой термической устойчивостью, и появление экзоэффектов, соответствующих перестройке их кристаллических структур наблюдается в области температур 900-980°С [30- 33].
Стоит заметить, что на алюмофосфатах диметиловый эфир можно получать как путем дегидратации метанола, так и путем прямого его синтеза из синтез-газа [34].
В связи с этим представляет интерес исследования каталитической активности алюмофосфатов в реакции дегидратации метанола.
На основании анализа литературного обзора можно сделать следующее заключение о том, что на протяжении уже нескольких лет интенсивно ведутся разработки процессов получения альтернативных топлив, взамен нефтяным. Это связано в первую очередь с тем, что запасы нефти с каждым годом истощаются и, кроме того, нефть является ценнейшим сырьем для нефтехимической промышленности, поэтому следует всячески снижать долю нефтепродуктов, используемых в качестве автомобильного топлива. Еще одной немаловажной причиной является экологическая ситуация, сложившаяся сегодня во многих крупных городах нашей планеты.
В настоящее время в различных странах мира проявляется значительный интерес к процессам производства диметилового эфира, который в 1995 году на Международном конгрессе и выставке в Детройте рядом крупных фирм (Amoco Co., Haldor Topsoe A/S и др.), представляющих специализацию по нефте- и газопереработке, по катализу, по двигателям и транспорту, был представлен как новое экологически чистое дизельное топливо 21 -го века.
Наиболее перспективными процессами получения ДМЭ являются газо- и жидкофазные синтезы на основе монооксида углерода и водорода. Метод получения ДМЭ дегидратацией метанола менее эффективен, однако если он происходит непосредственно в автомобильном двигателе, то решается ряд проблем с транспортировкой и хранением топлива. Недостатком является то, что данный процесс, проводимый при Т=250-300°С, атмосферном давлении и в присутствии катализатора - g-оксида алюминия идет с невысокой производительностью по ДМЭ, что является проблемой для устройства такого двигателя. В связи с этим, нами предлагается процесс переработки метанола в диметиловый эфир на фосфатном катализаторе, на котором, из-за его большей активности, синтез протекает с большей скоростью, а, следовательно, при дальнейшем сжигании полученного топлива в цилиндрах двигателя выделяется больше тепловой энергии.
turboreferat.ru