Содержание
Опыт 13. Получение простого диэтилового эфира
Реактивы и
оборудование: смесь
этилового спирта и концентрированной
серной кислоты в объемном соотношении
1:1, этиловый спирт; пипетки,
прямые газоотводные трубки с оттянутыми
концами, пробирки.
В сухую пробирку наливают 2—3 мл смеси
этилового спирта и концентрированной
серной кислоты (1:1) и осторожно нагревают
до начинающегося кипения. Затем горелку
убирают и к горячей смеси по стенке
пробирки добавляют пипеткой 5—10 капель
этилового спирта.
СН3СН2ОН
+ H2SO4
СН3СН2OSO3H
+ Н2О
этилсерная кислота
t
СН3СН2OSO3H
+ СН3СН2ОН
СН3СН2ОСН2СН3
+ H2SО4
диэтиловый эфир
Образование диэтилового эфира обнаруживают
по запаху. Потом пробирку закрывают
Потом пробирку закрывают
пробкой с прямой газоотводной трубкой
с оттянутым концом, осторожно ее нагревают
и поджигают выделяющийся эфир.
Напишите механизмы
реакций образования этилсерной кислоты
и диэтилового эфира (SN2).
3.2. Фенолы Осторожно! Фенолы вызывают ожоги кожи Опыт 14. Образование и разложение фенолятов
Реактивы и
оборудование: фенол, 10%-ный раствор
гидроксида натрия, 10%-ный раствор серной
кислоты, пробирки.
К 2 мл смеси фенола с водой прибавляют
по каплям при перемешивании 10%-ный
раствор гидроксида натрия до полного
растворения фенола:
К полученному раствору фенолята натрия
по каплям приливают 10%-ный раствор серной
кислоты. Наблюдают помутнение раствора
в результате разложения фенолята натрия
серной кислотой и выделения малорастворимого
в воде фенола:
Объясните происходящее. Сравните
свойства фенолов с алифатическими
спиртами в данной реакции.
Опыт 15. Взаимодействие фенола с бромной водой
Реактивы и
оборудование: 5%-ный раствор фенола,
бромная вода; пробирки.
В пробирку наливают 1 мл 5%-ного раствора
фенола и по каплям приливают бромную
воду. Наблюдают образование белого
осадка. При добавлении избытка бромной
воды осадок становится желтым.
Рассмотрите механизм реакции бромирования
фенола (SE). Почему реакция
бромирования фенола идет в более мягких
условиях по сравнению с толуолом и
бензолом? Какой продукт образуется при
действии избытка бромной воды на
трибромфенол?
Опыт 16. Окисление фенола
Реактивы и
оборудование: 5%-ный раствор фенола,
5%-ный раствор карбоната натрия, 1%-ный
раствор перманганата калия; пипетки,
пробирки.
В пробирке смешивают 1 мл 5%-ного раствора
фенола и 1 мл 5%-ного раствора карбоната
натрия. По каплям при перемешивании
приливают 1%-ный раствор перманганата
калия. Наблюдают обесцвечивание раствора
Наблюдают обесцвечивание раствора
и выпадение бурого осадка оксида марганца
(IV).
Объясните наблюдаемое изменение окраски.
Напишите реакцию окисления фенола.
Опыт 17. Взаимодействие фенолов с хлоридом железа (III)
Реактивы и
оборудование: 1%-ный раствор фенола,
1%-ный раствор пирокатехина, 1%-ный раствор
резорцина, 1%-ный раствор гидрохинона,
1%-ный раствор пирогаллола, 2%-ный раствор
хлорида железа (III), 2М раствор гидроксида
натрия; пипетки, фильтровальная бумага.
Реакция с хлоридом железа (III) является
качественной на енольные и фенольные
гидроксильные группы.
В четыре пробирки наливают по 1 мл 1%-ных
растворов: в первую — фенола, во вторую
— пирокатехина, в третью — резорцина,
в четвертую — гидрохинона. В каждую
пробирку добавляют по 3—4 капли 2%-ного
раствора хлорида железа (III). В пробирке
с фенолом появляется сине-фиолетовая
окраска, с пирокатехином — зеленая, с
резорцином — фиолетовая, с гидрохиноном
— зеленая, очень быстро переходящая в
желтую (гидрохинон окисляется в хинон).
Следует помнить, что растворы фенолов
должны быть приготовлены не ранее, чем
за 1-2 дня до проведения реакции, так как
фенолы легко окисляются и их растворы
темнеют.
Диэтиловый эфир – использование в медицине
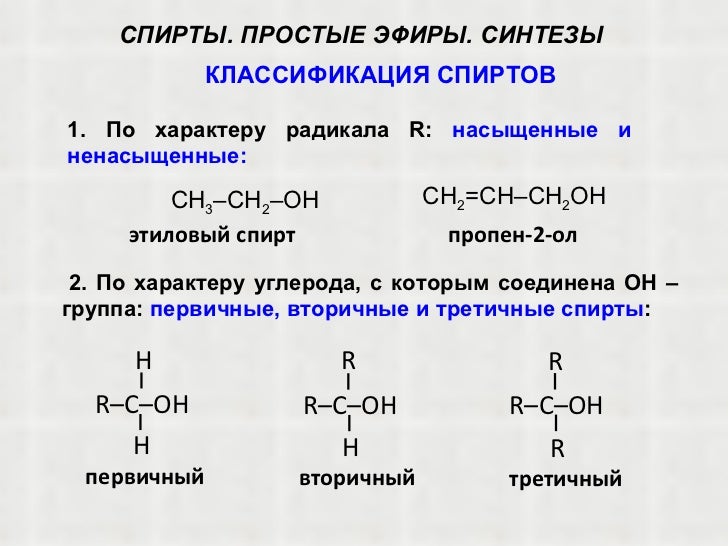
Эфиры – продукты замещения атома гидрогена гидроксильной группы спиртов или фенолов на карбоновый радикал R: R1-O-R2. Диэтиловый эфир – формула Н3С-О-СН3. Для эфиров характерны изомерия углеводородной цепи и метамерия. Первый вид изомерии обусловлен разветвлением углеводородной цепи. Метамерия – вид изомерии, при котором два и больше эфира имеют одинаковую молекулярную формулу, но при этом разное строение молекул, обусловленное различными радикалами по обе стороны от кислородного «мостика».
Диэтиловый эфир: получение
Эфиры получают синтетическим путем (в природе в свободном состоянии они не встречаются). Для того, чтобы синтезировать эфиры, можно использовать несколько способов: дегидратация спиртов при помощи минеральных кислот, взаимодействие алкоголятов с галогена алкилами. Диметиловый, а также метилэтиловый эфиры имеют газообразное состояние, следующие несколько представителей – растворы, высшие – твердые вещества. Эфиры плохо растворяются в воде, но хорошо в органических растворителях, а средние представители (диэтиловый эфир, пропиловый и дипропиловый эфиры) — отличные органические растворители. Физические свойства их изменяются в зависимости от молекулярной массы. Диэтиловый эфир хорошо смешивается со спиртом, хлороформом, бензолом, эфирными, а также с жирными маслами. При нарушении условий хранения эфира в нем образуются токсические и взрывоопасные соединения – гидропероксиды.
Диметиловый, а также метилэтиловый эфиры имеют газообразное состояние, следующие несколько представителей – растворы, высшие – твердые вещества. Эфиры плохо растворяются в воде, но хорошо в органических растворителях, а средние представители (диэтиловый эфир, пропиловый и дипропиловый эфиры) — отличные органические растворители. Физические свойства их изменяются в зависимости от молекулярной массы. Диэтиловый эфир хорошо смешивается со спиртом, хлороформом, бензолом, эфирными, а также с жирными маслами. При нарушении условий хранения эфира в нем образуются токсические и взрывоопасные соединения – гидропероксиды.
Диэтиловый эфир применяют в медицине. Его используют для ингаляционного наркоза. Этот вид наркоза характеризируется ярко выраженной стадией возбуждения (усиливается сердечная деятельность, повышается тонус сосудов, активируется экскреция катехоламинов, в крови увеличивается концентрация глюкозы, пировиноградной и лактатной кислот, угнетается секреторная и моторная функции пищеварительного тракта).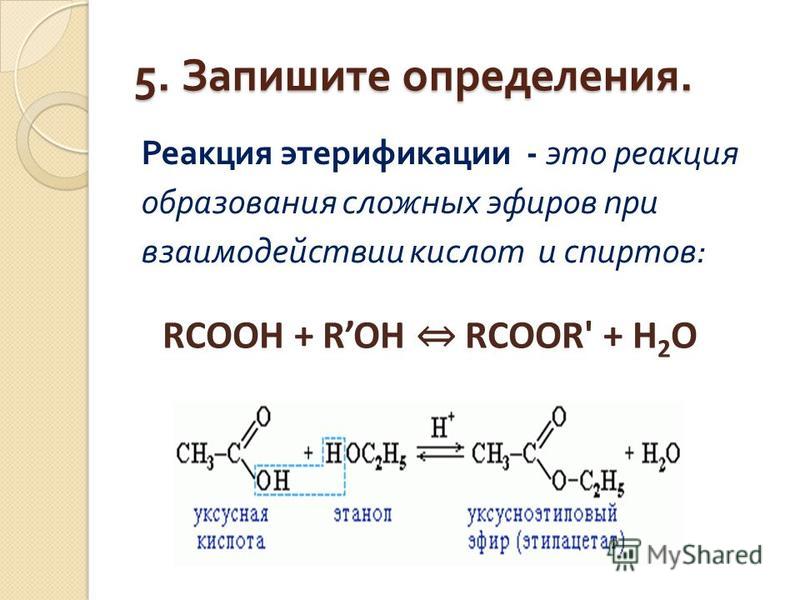 Следует знать, что при использовании данного вида эфира наркоз наступает медленно, при этом очень часто приходится наблюдать сильное возбуждение и двигательную активность. А вообще наркоз оказывает многогранное действие на организм человека (мышечно-расслабляющее, анальгезирующее и наркотическое).
Следует знать, что при использовании данного вида эфира наркоз наступает медленно, при этом очень часто приходится наблюдать сильное возбуждение и двигательную активность. А вообще наркоз оказывает многогранное действие на организм человека (мышечно-расслабляющее, анальгезирующее и наркотическое).
Местное действие эфира проявляется в виде раздражения нервных окончаний, вследствие чего пациент ощущает охлаждающее действие. В связи с этим иногда его используют внутрь для регуляции моторной функции желудка, а подкожно – для рефлекторного возбуждения дыхания и улучшения кровообращения. При вдыхании пары эфира раздражают дыхательные пути, что сначала вызывает рефлекторное торможение дыхания, после чего активирует секрецию бронхиальных желез. Впервые для ингаляционного наркоза диэтиловый эфир был использован выдающимся российским хирургом Н.И. Пироговым, основателем военно-полевой хирургии, в период Крымской войны (1853–1856 гг.).
Диэтиловый эфир легко всасывается слизистой оболочкой дыхательного тракта, однако полный наркоз наступает чуть позже по сравнению с хлороформом. Наркотическое действие проявляется лишь при вдыхании 5–8 % смеси паров эфира, а полный наркоз наступает в течение 30 минут при вдыхании 10 % смеси. Наркотическое действие препарата проявляется в концентрации от 110 до 150 мг на 100 мл крови, паралич центра дыхания наступает при 200 мг/100 мл крови. Общая токсичность эфира незначительная. Пробуждение после наркоза происходит через 20–40 минут после прекращения ингаляции эфира, однако к нормальному состоянию организм приходит только через несколько часов. Выделяется эфир дыхательными путями и через почки. Приблизительно 50 % от общего его количества выводится с организма в первые 30–60 минут после окончания наркоза. Следует сказать, что некоторые продукты гидролиза диэтилового эфира могут локализироваться в триглицеридах и других липидах до нескольких суток.
Наркотическое действие проявляется лишь при вдыхании 5–8 % смеси паров эфира, а полный наркоз наступает в течение 30 минут при вдыхании 10 % смеси. Наркотическое действие препарата проявляется в концентрации от 110 до 150 мг на 100 мл крови, паралич центра дыхания наступает при 200 мг/100 мл крови. Общая токсичность эфира незначительная. Пробуждение после наркоза происходит через 20–40 минут после прекращения ингаляции эфира, однако к нормальному состоянию организм приходит только через несколько часов. Выделяется эфир дыхательными путями и через почки. Приблизительно 50 % от общего его количества выводится с организма в первые 30–60 минут после окончания наркоза. Следует сказать, что некоторые продукты гидролиза диэтилового эфира могут локализироваться в триглицеридах и других липидах до нескольких суток.
HTML и редакция Metwurst Это довольно опасно выполнять с правильным снаряжением, а без правильного снаряжения очень опасно! Диэтиловый эфир , или CH 3 CH 2 -O-CH 2 CH 3 , является отличным растворителем для многих веществ, но чрезвычайно легко воспламеняется. Диэтиловый эфир получают из этанола (также известного как зерновой спирт, этиловый спирт, спирт питьевой) путем нагревания его с концентрированным. Реакция протекает через Подготовка 1от Zaphraud Реакцию проводят следующим образом: Сухой (безводный) или почти сухой этиловый спирт вливают в смесь спирта и серной кислоты, нагретую до 130-140°С. Пары собираются, и эфир Следует тщательно контролировать температуру реакции. При температуре ниже 130°С реакция протекает слишком медленно, и перегоняется в основном этанол. Более 150С, 95% этанола можно извлечь из воды + CH 3 CH 2 OH, извлеченного из нижней части ректификационной колонны (обозначенной ‘out’)… Его можно превратить в 100% этанол путем смешивания 95% этанола с оксидом кальция и дистилляции — вода используется для получения гидроксида кальция! Это, в свою очередь, может быть повторно подано Подготовка 2от Элевсина Хотя это и не самый приятный процесс, диэтиловый эфир можно получить путем конденсации этанола. Для этого соберите типичную дробную перегонку Добавьте в колбу 2 моля (где x — множитель, 1 = 2 моля, 1,5 = 3 моля и т. д.) азеотропа этанола (т. е. 95% этанола, Everclear). Добавьте 2x молей После начала перегонки медленно добавьте еще 2 моля этанола через капельную воронку со скоростью, равной количеству капель, выходящих из холодильника. 2 родинки Вылейте содержимое приемной колбы в большой химический стакан или миску и взболтайте с 10% раствором гидроксида натрия, пока pH не станет нейтральным. Эфир перегоняют из хлорида кальция нагреванием на бане (масляной или водяной) при температуре не выше 45°С! Соберите дистиллят с температурой 31-36°С. Подготовка 3Диэтиловый эфир Его также называют этиловым эфиром или эфиром , и его не следует путать с петролейным эфиром . Если, например, вы видите формулу, призывающую к эфиру, Безводный этиловый эфир . Это для тех формул, которые требуют сухого, чистого или безводного эфира. Эфирный продукт сверху сушат над тонкими ломтиками металлической |
эфир | химическое соединение | Britannica
- Ключевые люди:
- Дж.
 Фрейзер Стоддарт
Фрейзер Стоддарт
Александр Уильям Уильямсон
- Похожие темы:
- этиловый эфир
метиловый эфир
тетрагидрофуран
метил-трет-бутиловый эфир
Неролин II
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
простой эфир , любое из класса органических соединений, характеризующееся атомом кислорода, связанным с двумя алкильными или арильными группами. Эфиры по структуре аналогичны спиртам, а эфиры и спирты по структуре аналогичны воде. В спирте один атом водорода в молекуле воды замещен алкильной группой, тогда как в эфире оба атома водорода замещены алкильной или арильной группами.
При комнатной температуре эфиры представляют собой бесцветные жидкости с приятным запахом. По сравнению со спиртами простые эфиры обычно менее плотные, менее растворимы в воде и имеют более низкие температуры кипения. Они относительно нереакционноспособны, поэтому их можно использовать в качестве растворителей жиров, масел, восков, отдушек, смол, красителей, смол и углеводородов.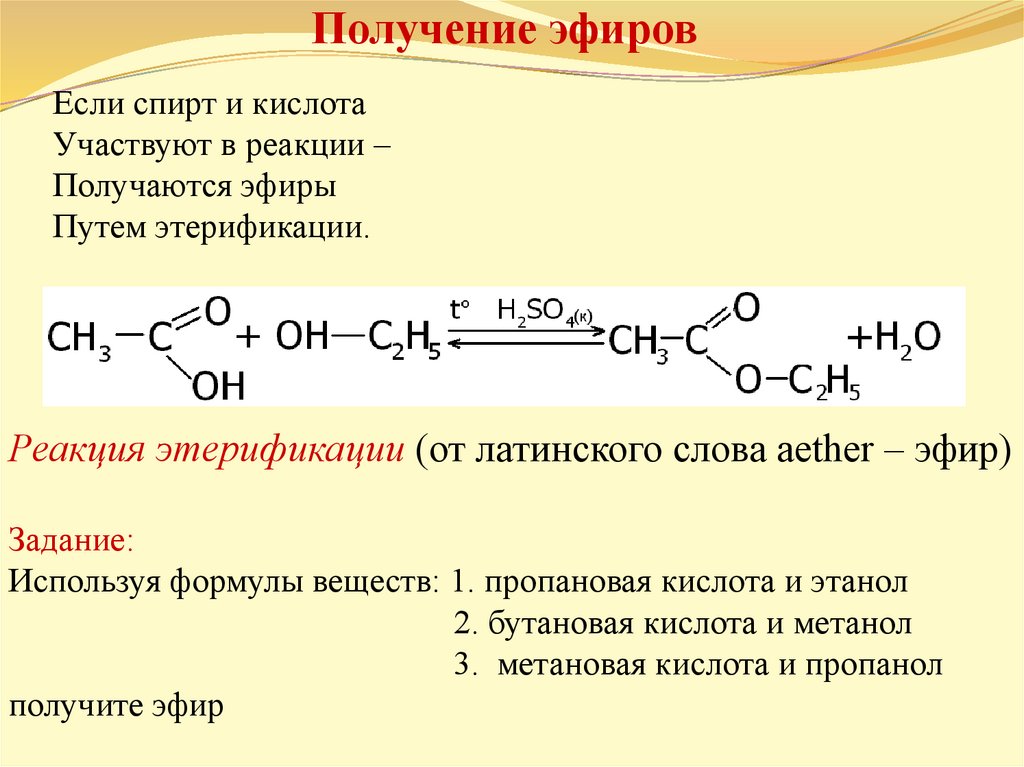 Пары некоторых эфиров используются как инсектициды, акарициды и фумиганты для почвы.
Пары некоторых эфиров используются как инсектициды, акарициды и фумиганты для почвы.
Эфиры также важны в медицине и фармакологии, особенно для использования в качестве анестетиков. Например, этиловый эфир (CH 3 CH 2 ―O―CH 2 CH 3 ), известный просто как эфир, впервые был использован в качестве хирургического анестетика в 1842 году. Кодеин, сильнодействующее болеутоляющее средство , представляет собой метиловый эфир морфина. Поскольку эфир легко воспламеняется, его заменили менее воспламеняющимися анестетиками, включая закись азота (N 2 O) и галотан (CF 3 — CHClBr).
Этиловый эфир является отличным растворителем для экстракции и широкого спектра химических реакций. Он также используется в качестве летучей пусковой жидкости для дизельных двигателей и бензиновых двигателей в холодную погоду. Диметиловый эфир используется в качестве топлива для распыления и хладагента. Метил t -бутиловый эфир (МТБЭ) представляет собой присадку к бензину, повышающую октановое число и снижающую содержание оксидов азота в выхлопных газах.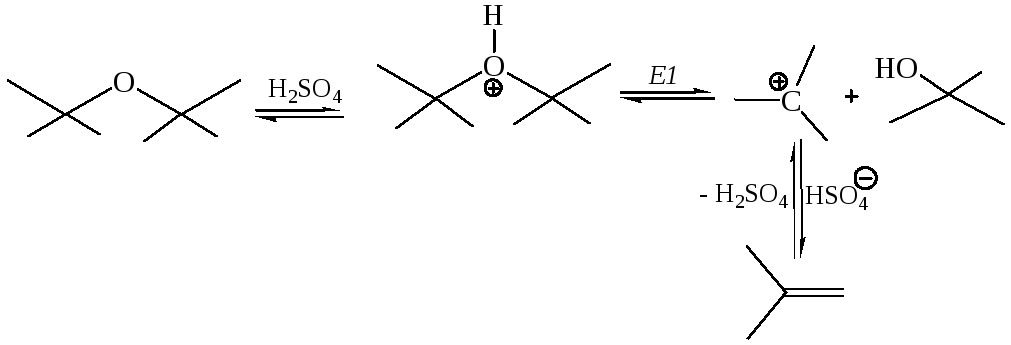 Эфиры этиленгликоля используются в качестве растворителей и пластификаторов.
Эфиры этиленгликоля используются в качестве растворителей и пластификаторов.
Общие названия простых эфиров просто дают названия двух алкильных групп, связанных с кислородом, и добавляют слово эфир . Текущая практика состоит в том, чтобы перечислять алкильные группы в алфавитном порядке ( t -бутилметиловый эфир), но более старые названия часто перечисляют алкильные группы в порядке возрастания размера (метил t -бутиловый эфир). Если в названии описана только одна алкильная группа, это подразумевает две идентичные группы, как в этиловом эфире для диэтилового эфира.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Систематические (IUPAC) названия простых эфиров используют более сложную группу в качестве корневого названия, с атомом кислорода и меньшей группой, называемой алкоксизаместителем. Примерами, приведенными выше, являются этоксиэтан (диэтиловый эфир), метоксиэтан (метилэтиловый эфир), 2-метокси-2-метилпропан (МТБЭ) и феноксибензол (дифениловый эфир). Номенклатура ИЮПАК хорошо работает для соединений с дополнительными функциональными группами, поскольку другие функциональные группы могут быть описаны в корневом названии.
Номенклатура ИЮПАК хорошо работает для соединений с дополнительными функциональными группами, поскольку другие функциональные группы могут быть описаны в корневом названии.
Физические свойства простых эфиров
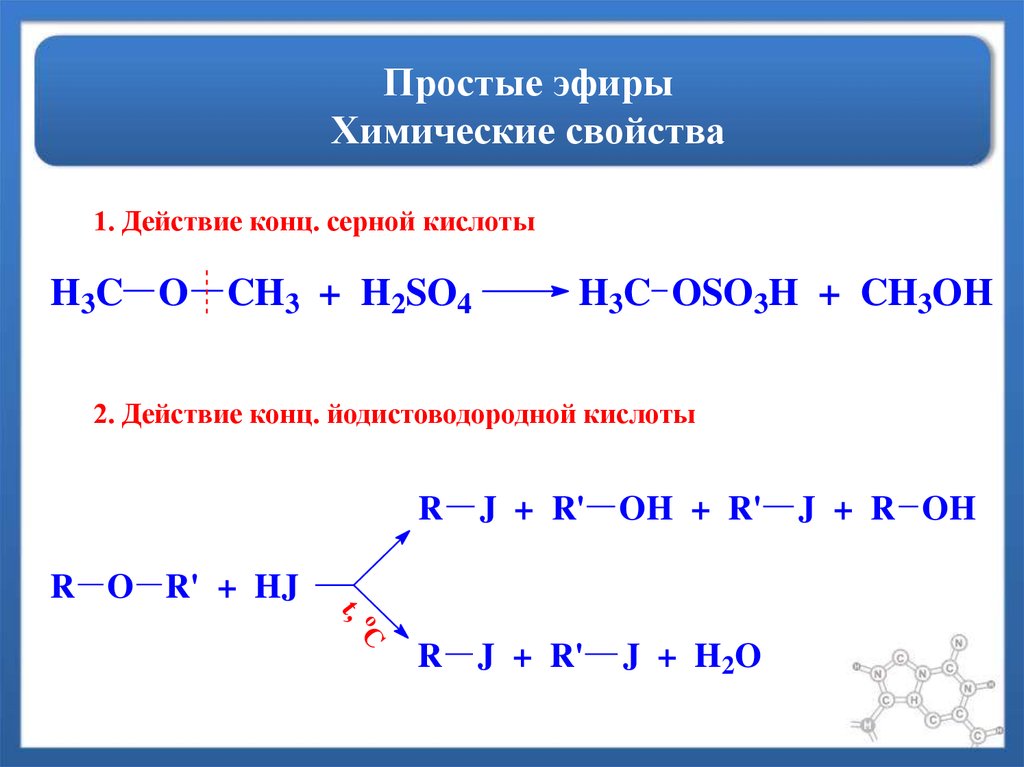
В эфирах отсутствуют гидроксильные группы спиртов. Без сильно поляризованной связи O—H молекулы эфира не могут образовывать водородные связи друг с другом. Однако у простых эфиров есть несвязывающие электронные пары на атомах кислорода, и они могут образовывать водородные связи с другими молекулами (спиртами, аминами и т. д.), которые имеют связи O—H или N—H. Способность образовывать водородные связи с другими соединениями делает эфиры особенно хорошими растворителями для широкого круга органических соединений и удивительно большого числа неорганических соединений. (Для получения дополнительной информации о водородных связях, см. химическая связь: межмолекулярные силы.)
Щелкните здесь, чтобы увидеть таблицу в полном размере. Поскольку молекулы эфира не могут образовывать водородные связи друг с другом, они имеют гораздо более низкую температуру кипения, чем спирты с аналогичной молекулярной массой.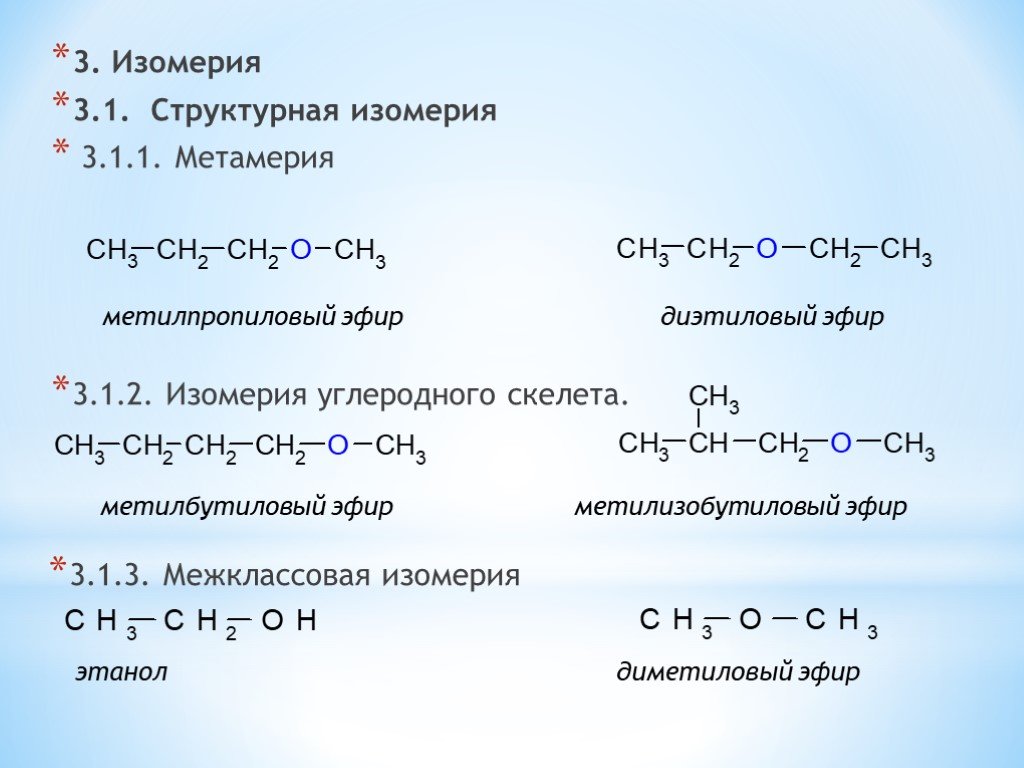 Например, температура кипения диэтилового эфира (C 4 H 10 O, молекулярная масса [MW] 74) составляет 35 °C (95 °F), но температура кипения 1-бутанола (или n -бутиловый спирт C 4 H 10 O, молекулярная масса 74) составляет 118 ° C (244 ° F). На самом деле точки кипения простых эфиров намного ближе к точкам кипения алканов с аналогичным молекулярным весом; температура кипения пентана (C 5 H 12 , молекулярная масса 72) составляет 36 ° C (97 ° F), что близко к температуре кипения диэтилового эфира.
Например, температура кипения диэтилового эфира (C 4 H 10 O, молекулярная масса [MW] 74) составляет 35 °C (95 °F), но температура кипения 1-бутанола (или n -бутиловый спирт C 4 H 10 O, молекулярная масса 74) составляет 118 ° C (244 ° F). На самом деле точки кипения простых эфиров намного ближе к точкам кипения алканов с аналогичным молекулярным весом; температура кипения пентана (C 5 H 12 , молекулярная масса 72) составляет 36 ° C (97 ° F), что близко к температуре кипения диэтилового эфира.
Комплексы простых эфиров с реагентами
Уникальные свойства простых эфиров (то есть, они сильно полярны, с несвязывающими электронными парами, но без гидроксильной группы) способствуют образованию и использованию многих реагентов. Например, реактивы Гриньяра не могут образовываться, если не присутствует эфир, который разделяет свою неподеленную пару электронов с атомом магния. Комплексообразование атома магния стабилизирует реактив Гриньяра и помогает удерживать его в растворе.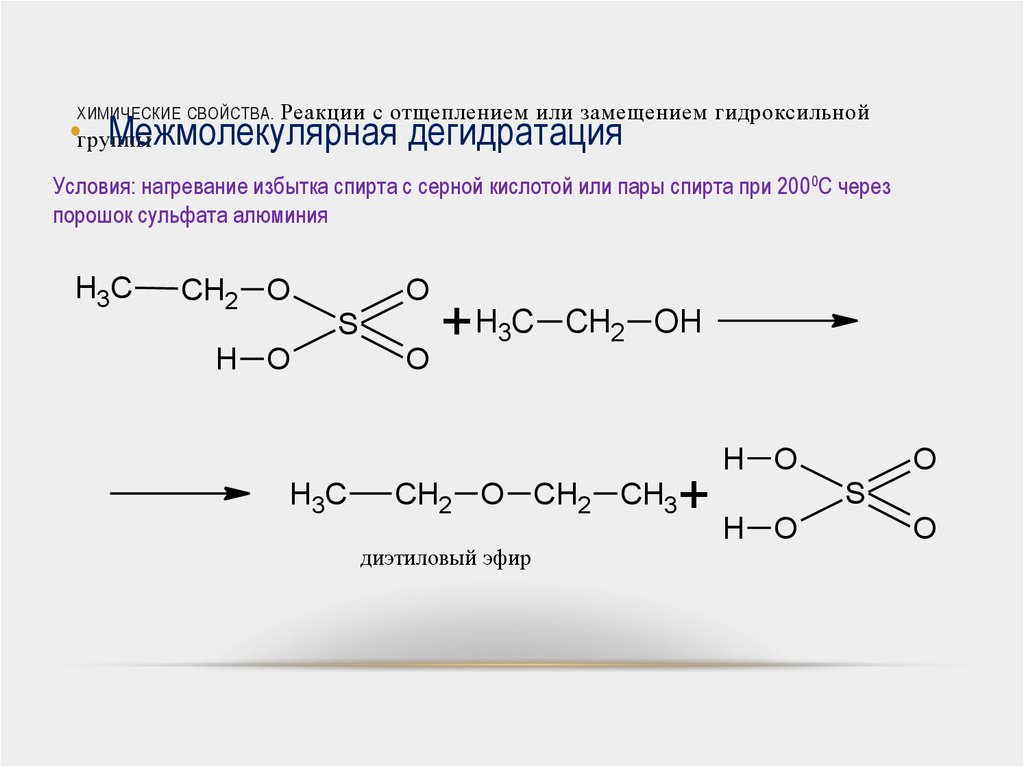
Электронодефицитные реагенты также стабилизируются эфирами. Например, боран (BH 3 ) является полезным реагентом для получения спиртов. Чистый боран существует в виде его димера, диборана (B 2 H 6 ), токсичного газа, который неудобен и опасен в использовании. Однако боран образует стабильные комплексы с простыми эфирами, и его часто поставляют и используют в виде жидкого комплекса с тетрагидрофураном (ТГФ). Точно так же газообразный трифторид бора (BF 3 ) легче использовать в виде его жидкого комплекса с диэтиловым эфиром, называемого BF 3 эфират, а не как токсичный коррозионный газ.
Краун-эфиры представляют собой специализированные циклические полиэфиры, которые окружают определенные ионы металлов, образуя циклические комплексы в форме короны. Они названы с использованием родительского имени корона , которому предшествует число, описывающее размер кольца, а за ним следует количество атомов кислорода в кольце.



 Вылейте эту смесь в сепаратор.
Вылейте эту смесь в сепаратор. 100 г этанола (лучше всего сухого этанола) помещают в 1/2-литровую банку.
100 г этанола (лучше всего сухого этанола) помещают в 1/2-литровую банку.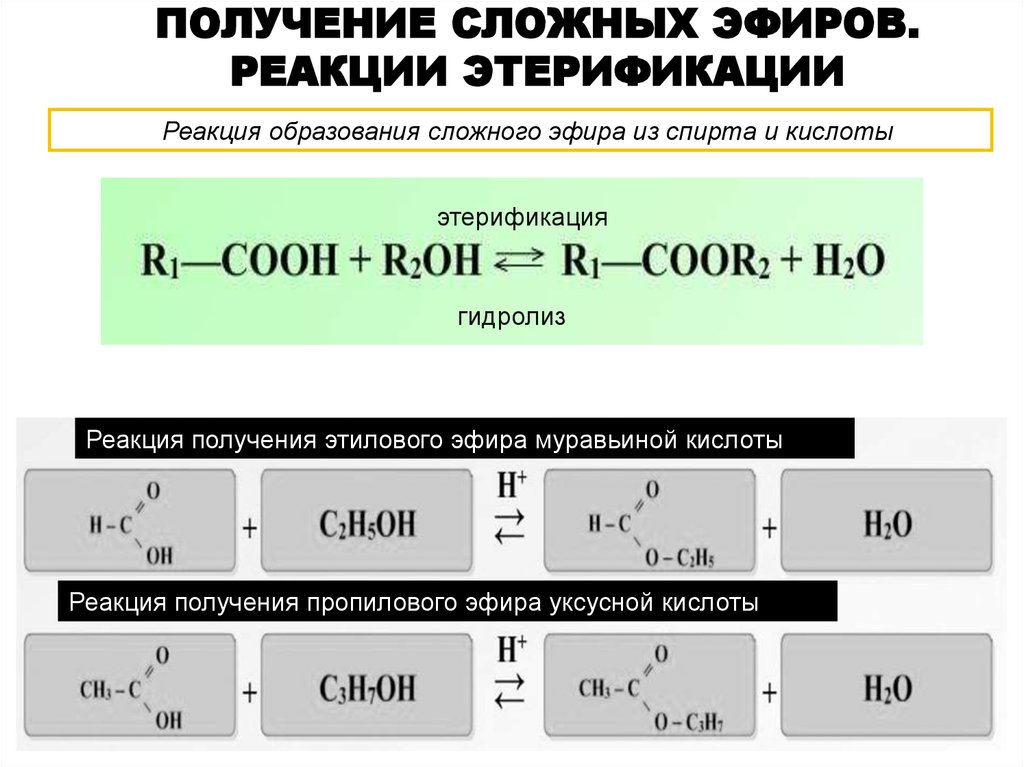 Затем эфир сушат над безводным хлористым кальцием в течение 24 часов и перегоняют на водяной бане.
Затем эфир сушат над безводным хлористым кальцием в течение 24 часов и перегоняют на водяной бане. Фрейзер Стоддарт
Фрейзер Стоддарт