3.6 Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Альдегиды сложные эфиры
Химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров.
Химические свойства альдегидов и кетонов
Альдегидами называют соединения, молекулы которых содержат карбонильную группу, соединенную с атомом водорода, т.е. общая формула альдегидов может быть записана как
где R – углеводородный радикал, который может быть разной степени насыщенности, например, предельный или ароматический.
Группу –СНО называют альдегидной.
Кетоны – органические соединения, в молекулах которых содержится карбонильная группа, соединенная с двумя углеводородными радикалами. Общую формулу кетонов можно записать как:
где R и R’ – углеводородные радикалы, например, предельные (алкилы) или ароматические.
Гидрирование альдегидов и кетонов
Альдегиды и кетоны могут быть восстановлены водородом в присутствии катализаторов и нагревании до первичных и вторичных спиртов соответственно:
Окисление альдегидов
Альдегиды легко могут быть окислены даже такими мягкими окислителями, как гидроксид меди и аммиачный раствор оксида серебра.
При нагревании гидроксида меди с альдегидом происходит исчезновение изначального голубого окрашивания реакционной смеси, при этом образуется кирпично-красный осадок оксида одновалентной меди:
В реакции с аммиачным раствором оксида серебра вместо самой карбоновой кислоты образуется ее аммонийная соль, поскольку находящийся в растворе аммиак реагирует с кислотами:
Кетоны в реакцию с гидроксидом меди (II) и аммиачным раствором оксида серебра не вступают. По этой причине эти реакции являются качественными на альдегиды. Так реакция с аммиачным раствором оксида серебра при правильной методике ее проведения приводит к образованию на внутренней поверхности реакционного сосуда характерного серебряного зеркала.
Очевидно, что если мягкие окислители могут окислить альдегиды, то само собой это могут сделать и более сильные окислители, например, перманганат калия или дихромат калия. При использовании данных окислителей в присутствии кислот образуются карбоновые кислоты:
Химические свойства карбоновых кислот
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп.
Карбоксильная группа:
Как можно видеть, карбоксильная группа состоит из карбонильной группы –С(О)- , соединенной с гидроксильной группой –ОН.
В связи с тем, что к гидроксильной группе непосредственно прикреплена карбонильная, обладающая отрицательным индуктивным эффектом связь О-Н является более полярной, чем в спиртах и фенолах. По этой причине карбоновые кислоты обладают заметно более выраженными, чем спирты и фенолы, кислотными свойствами. В водных растворах они проявляют свойства слабых кислот, т.е. обратимо диссоциируют на катионы водорода (Н+) и анионы кислотных остатков:
Реакции образования солей
С образованием солей карбоновые кислоты реагируют с:
1) металлами до водорода в ряду активности:
2) аммиаком
3) основными и амфотерными оксидами:4) основными и амфотерными гидроксидами металлов:
5) солями более слабых кислот – карбонатами и гидрокарбонатами, сульфидами и гидросульфидами, солями высших (с большим числом атомов углерода в молекуле) кислот:
Систематические и тривиальные названия некоторых кислот и их солей представлены в следующей таблице:
| Формула кислоты | Название кислоты тривиальное/систематическое | Название соли тривиальное/систематическое |
| HCOOH | муравьиная/ метановая | формиат/ метаноат |
| Ch4COOH | уксусная/ этановая | ацетат/ этаноат |
| Ch4 Ch3COOH | пропионовая/ пропановая | пропионат/ пропаноат |
| Ch4 Ch3 Ch3COOH | масляная/ бутановая | бутират/ бутаноат |
Следует помнить и обратное: сильные минеральные кислоты вытесняют карбоновые кислоты из их солей как более слабые:
Реакции с участием ОН группы
Карбоновые кислоты вступают в реакцию этерификации с одноатомными и многоатомными спиртами в присутствии сильных неорганических кислот, при этом образуются сложные эфиры:
Данного типа реакции относятся к обратимым, в связи с чем с целью смещения равновесия в сторону образования сложного эфира их следует осуществлять, отгоняя более летучий сложный эфир при нагревании.
Обратный реакции этерификации процесс называют гидролизом сложного эфира:
Необратимо данная реакция протекает в присутствии щелочей, поскольку образующаяся кислота реагирует с гидроксидом металла с образованием соли:
Реакции замещения атомов водорода в углеводородном заместителе
При проведении реакций карбоновых с хлором или бромом в присутствии красного фосфора при нагревании происходит замещение атомов водорода при α-атоме углерода на атомы галогена:
В случае большей пропорции галоген/кислота может произойти и более глубокое хлорирование:
Реакции разрушения карбоксильной группы (декарбоксилирование)
Особые химические свойства муравьиной кислоты
Молекула муравьиной кислоты, несмотря на свои малые размеры, содержит сразу две функциональные группы:
В связи с этим она проявляет не только свойства кислот, но также и свойства альдегидов:
При действии концентрированной серной кислоты муравьиная кислота разлагается на воду и угарный газ:
scienceforyou.ru
Свойства спиртов, альдегидов, кислот, сложных эфиров, фенола
Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола
Предельные одноатомные и многоатомные спирты
Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп $—ОН$), соединенных с углеводородным радикалом.
По числу гидроксильных групп (атомности) спирты делятся на:
— одноатомные, например:
${CH_3-OH}↙{метанол(метиловый спирт)}$ ${CH_3-CH_2-OH}↙{этанол(этиловый спирт)}$
— двухатомные (гликоли), например:
${OH-CH_2-CH_2-OH}↙{этандиол-1,2(этиленгликоль)}$
${HO-CH_2-CH_2-CH_2-OH}↙{пропандиол-1,3}$
— трехатомные, например:
По характеру углеводородного радикала выделяют следующие спирты:
— предельные, содержащие в молекуле лишь предельные углеводородные радикалы, например:
— непредельные, содержащие в молекуле кратные (двойные и тройные) связи между атомами углерода, например:
${CH_2=CH-CH_2-OH}↙{пропен-2-ол-1 (аллиловый спирт)}$
— ароматические, т.е. спирты, содержащие в молекуле бензольное кольцо и гидроксильную группу, связанные друг с другом не непосредственно, а через атомы углерода, например:
Органические вещества, содержащие в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца, существенно отличаются по химическим свойствам от спиртов и поэтому выделяются в самостоятельный класс органических соединений — фенолы. Например:
Существуют и полиатомные (многоатомные) спирты, содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит):
Номенклатура и изомерия
При образовании названий спиртов к названию углеводорода, соответствующего спирту, добавляют родовой суффикс -ол. Цифрами после суффикса указывают положение гидроксильной группы в главной цепи, а префиксами ди-, три-, тетра- и т. д. — их число:
В нумерации атомов углерода в главной цепи положение гидроксильной группы приоритетно перед положением кратных связей:
Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы (пропанол-1 и пропанол-2), а с четвертого — изомерия углеродного скелета (бутанол-1, 2-метилпропанол-1). Для них характерна и межклассовая изомерия — спирты изомерны простым эфирам:
${CH_3-CH_2-OH}↙{этанол}$ ${CH_3-O-CH_3}↙{диметиловый эфир}$
Физические и химические свойства спиртов
Физические свойства.
Спирты могут образовывать водородные связи как между молекулами спирта, так и между молекулами спирта и воды.
Водородные связи возникают при взаимодействии частично положительно заряженного атома водорода одной молекулы спирта и частично отрицательно заряженного атома кислорода другой молекулы. Именно благодаря водородным связям между молекулами спирты имеют аномально высокие для своей молекулярной массы температуры кипения. Так, пропан с относительной молекулярной массой $44$ при обычных условиях является газом, а простейший из спиртов — метанол, имея относительную молекулярную массу $32$, в обычных условиях — жидкость.
Низшие и средние члены ряда предельных одноатомных спиртов, содержащие от $1$ до $11$ атомов углерода, — жидкости. Высшие спирты (начиная с $С_{12}Н_{25}ОН$) при комнатной температуре — твердые вещества. Низшие спирты имеют характерный алкогольный запах и жгучий вкус, они хорошо растворимы в воде. По мере увеличения углеводородного радикала растворимость спиртов в воде понижается, а октанол уже не смешивается с водой.
Химические свойства.
Свойства органических веществ определяются их составом и строением. Спирты подтверждают общее правило. Их молекулы включают в себя углеводородные и гидроксильные радикалы, поэтому химические свойства спиртов определяются взаимодействием и влиянием друг на друга этих групп. Характерные для данного класса соединений свойства обусловлены наличием гидроксильной группы.
1. Взаимодействие спиртов со щелочными и щелочноземельными металлами. Для выявления влияния углеводородного радикала на гидроксильную группу необходимо сравнить свойства вещества, содержащего гидроксильную группу и углеводородный радикал, с одной стороны, и вещества, содержащего гидроксильную группу и не содержащего углеводородный радикал, — с другой. Такими веществами могут быть, например, этанол (или другой спирт) и вода. Водород гидроксильной группы молекул спиртов и молекул воды способен восстанавливаться щелочными и щелочноземельными металлами (замещаться на них):
$2Na+2H_2O=2NaOH+H_2↑$,
$2Na+2C_2H_5OH=2C_2H_5ONa+H_2↑$,
$2Na+2ROH=2RONa+H_2↑$.
2. Взаимодействие спиртов с галогеноводородами. Замещение гидроксильной группы на галоген приводит к образованию галогеналканов. Например:
$C_2H_5OH+HBr⇄C_2H_5Br+H_2O$.
Данная реакция обратима.
3. Межмолекулярная дегидратация спиртов — отщепление молекулы воды от двух молекул спирта при нагревании в присутствии водоотнимающих средств:
В результате межмолекулярной дегидратации спиртов образуются простые эфиры. Так, при нагревании этилового спирта с серной кислотой до температуры от $100$ до $140°С$ образуется диэтиловый (серный) эфир:
4. Взаимодействие спиртов с органическими и неорганическими кислотами с образованием сложных эфиров (реакция этерификации):
Реакция этерификации катализируется сильными неорганическими кислотами.
Например, при взаимодействии этилового спирта и уксусной кислоты образуется уксусноэтиловый эфир — этилацетат:
5. Внутримолекулярная дегидратация спиртов происходит при нагревании спиртов в присутствии водоотнимающих средств до более высокой температуры, чем температура межмолекулярной дегидратации. В результате образуются алкены. Эта реакция обусловлена наличием атома водорода и гидроксильной группы при соседних атомах углерода. В качестве примера можно привести реакцию получения этена (этилена) при нагревании этанола выше $140°С$ в присутствии концентрированной серной кислоты:
6. Окисление спиртов обычно проводят сильными окислителями, например, дихроматом калия или перманганатом калия в кислой среде. При этом действие окислителя направляется на тот атом углерода, который уже связан с гидроксильной группой. В зависимости от природы спирта и условий проведения реакции могут образовываться различные продукты. Так, первичные спирты окисляются сначала в альдегиды, а затем в карбоновые кислоты:
При окислении вторичных спиртов образуются кетоны:
Третичные спирты достаточно устойчивы к окислению. Однако в жестких условиях (сильный окислитель, высокая температура) возможно окисление третичных спиртов, которое происходит с разрывом углерод-углеродных связей, ближайших к гидроксильной группе.
7. Дегидрирование спиртов. При пропускании паров спирта при $200–300°С$ над металлическим катализатором, например медью, серебром или платиной, первичные спирты превращаются в альдегиды, а вторичные — в кетоны:
Присутствием в молекуле спирта одновременно нескольких гидроксильных групп обусловлены специфические свойства многоатомных спиртов, которые способны образовывать растворимые в воде ярко-синие комплексные соединения при взаимодействии со свежеполученным осадком гидроксида меди (II). Для этиленгликоля можно записать:
Одноатомные спирты не способны вступать в эту реакцию. Поэтому она является качественной реакцией на многоатомные спирты.
Фенол
Строение фенолов
Гидроксильная группа в молекулах органических соединений может быть связана с ароматическим ядром непосредственно, а может быть отделена от него одним или несколькими атомами углерода. Можно ожидать, что в зависимости от этого свойства, вещества будут существенно отличаться друг от друга из-за взаимного влияния групп атомов. И действительно, органические соединения, содержащие ароматический радикал фенил $С_6Н_5$—, непосредственно связанный с гидроксильной группой, проявляют особые свойства, отличные от свойств спиртов. Такие соединения называются фенолами.
Фенолы — органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами.
Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:
Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:
Существуют и другие многоатомные фенолы, содержащие три и более гидроксильные группы в бензольном кольце.
Познакомимся подробнее со строением и свойствами простейшего представителя этого класса — фенолом $С_6Н_5ОН$. Название этого вещества и легло в основу названия всего класса — фенолы.
Физические и химические свойства.
Физические свойства.
Фенол — твердое, бесцветное, кристаллическое вещество, $t°_{пл.}=43°С, t°_{кип.}=181°С$, с резким характерным запахом. Ядовит. Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой. При попадании на кожу он вызывает ожоги, поэтому с фенолом необходимо обращаться осторожно!
Химические свойства.
Кислотные свойства. Как уже было сказано, атом водорода гидроксильной группы обладает кислотным характером. Кислотные свойства у фенола выражены сильнее, чем у воды и спиртов. В отличие от спиртов и воды, фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:
Однако кислотные свойства у фенолов выражены слабее, чем у неорганических и карбоновых кислот. Так, например, кислотные свойства фенола примерно в $3000$ раз слабее, чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол:
Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:
Качественная реакция на фенол.
Фенол реагирует с хлоридом железа (III) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.
Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах. Другие фенолы, содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа (III).
Реакции бензольного кольца.
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
1. Бромирование фенола. В отличие от бензола, для бромирования фенола не требуется добавления катализатора (бромида железа (III)).
Кроме того, взаимодействие с фенолом протекает селективно (избирательно): атомы брома направляются в орто- и параположения, замещая находящиеся там атомы водорода. Селективность замещения объясняется рассмотренными выше особенностями электронного строения молекулы фенола.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:
Эта реакция, так же, как и реакция с хлоридом железа (III), служит для качественного обнаружения фенола.
2. Нитрование фенола также происходит легче, чем нитрование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пара-изомеров нитрофенола:
При использовании концентрированной азотной кислоты образуется взрывчатое вещество — 2,4,6-тринитрофенол (пикриновая кислота):
3. Гидрирование ароматического ядра фенола в присутствии катализатора происходит легко:
4. Поликонденсация фенола с альдегидами, в частности с формальдегидом, происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:
Вы, наверное, заметили, что в молекуле димера сохраняются «подвижные» атомы водорода, а значит, возможно дальнейшее продолжение реакции при достаточном количестве реагентов:
Реакция поликонденсации, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта (воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:
Образование линейных молекул происходит при обычной температуре. Проведение же этой реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде. В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимеры на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению, действию воды, щелочей и кислот, обладающих высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин, полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы, сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе. Теперь вам понятно, почему фенол и продукты на его основе находят широкое применение.
Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров
Альдегиды и кетоны
Альдегиды — органические вещества, молекулы которых содержат карбонильную группу , соединенную с атомом водорода и углеводородным радикалом.
Общая формула альдегидов имеет вид:
В простейшем альдегиде — формальдегиде — роль углеводородного радикала играет второй атом водорода:
Карбонильную группу, связанную с атомом водорода, называют альдегидной:
Органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами, называют кетонами.
Очевидно, общая формула кетонов имеет вид:
Карбонильную группу кетонов называют кетогруппой.
В простейшем кетоне — ацетоне — карбонильная группа связана с двумя метильными радикалами:
Номенклатура и изомерия
В зависимости от строения углеводородного радикала, связанного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды:
В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются от названия алкана с тем же числом атомов углерода в молекуле с помощью суффикса -аль. Например:
Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. По этому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение нет необходимости.
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи). Например:
Для альдегидов характерен только один вид структурной изомерии — изомерия углеродного скелета, которая возможна с бутаналя, а для кетонов — также и изомерия положения карбонильной группы. Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).
Тривиальные названия и температуры кипения некоторых альдегидов.
| Альдегид | Систематическое название (ИЮПАК) | Тривиальное название | $t_{кип.}, °С$ |
| $НСНО$ | Метаналь | Муравьиный альдегид, формальдегид | $–21$ |
| $СН_3CHО$ | Этаналь | Уксусный альдегид | $21$ |
| $СН_3CH_2CHО$ | Пропаналь | Пропионовый альдегид | $48$ |
| $СН_2=CHCHО$ | 2-Пропеналь | Акролеин | $53$ |
| $CH_3СН_2CH_2CHО$ | Бутаналь | Масляный альдегид | $74$ |
| $CH_3СН_2CH_2CH_2CHО$ | Пентаналь | Валериановый альдегид | $103$ |
| $C_6Н_5CHО$ | Бензальдегид | Бензойный альдегид | $179$ |
Физические и химические свойства
Физические свойства.
В молекуле альдегида или кетона вследствие большей электроотрицательности атома кислорода по сравнению с углеродным атомом связь $С=О$ сильно поляризована за счет смещения электронной плотности $π$-связи к кислороду:
Альдегиды и кетоны — полярные вещества с избыточной электронной плотностью на атоме кислорода. Низшие члены ряда альдегидов и кетонов (формальдегид, уксусный альдегид, ацетон) растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов. Это связано с тем, что в молекулах альдегидов и кетонов, в отличие от спиртов, нет подвижных атомов водорода и они не образуют ассоциатов за счет водородных связей. Низшие альдегиды имеют резкий запах; у альдегидов, содержащих от четырех до шести атомов углерода в цепи, неприятный запах; высшие альдегиды и кетоны обладают цветочными запахами и применяются в парфюмерии.
Химические свойства
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов.
Реакции восстановления.
Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе:
Продуктом гидрирования альдегидов являются первичные спирты, кетонов — вторичные спирты.
Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, при гидрировании ацетона — пропанол-2:
Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
Реакции окисления.
Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты. Схематично этот процесс можно представить так:
Из пропионового альдегида (пропаналя), например, образуется пропионовая кислота:
Альдегиды окисляются даже кислородом воздуха и такими слабыми окислителями, как аммиачный раствор оксида серебра. В упрощенном виде этот процесс можно выразить уравнением реакции:
Например:
Более точно этот процесс отражают уравнения:
Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее ровной тонкой пленкой. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
Окислителем альдегидов может выступать и свежеосажденный гидроксид меди (II). Окисляя альдегид, $Cu^{2+}$ восстанавливается до $Cu^+$. Образующийся в ходе реакции гидроксид меди (I) $CuOH$ сразу разлагается на оксид меди (I) красного цвета и воду:
Эта реакция, так же, как и реакция «серебряного зеркала», используется для обнаружения альдегидов.
Кетоны не окисляются ни кислородом воздуха, ни таким слабым окислителем, как аммиачный раствор оксида серебра.
Отдельные представители альдегидов и их значение
Формальдегид (метаналь, муравьиный альдегид $HCHO$) — бесцветный газ с резким запахом и температурой кипения $–21С°$, хорошо растворим в воде. Формальдегид ядовит! Раствор формальдегида в воде ($40%$) называют формалином и применяют для дезинфекции. В сельском хозяйстве формалин используют для протравливания семян, в кожевенной промышленности — для обработки кож. Формальдегид используют для получения уротропина — лекарственного вещества. Иногда спрессованный в виде брикетов уротропин применяют в качестве горючего (сухой спирт). Большое количество формальдегида расходуется при получении фенолформальдегидных смол и некоторых других веществ.
Уксусный альдегид (этаналь, ацетальдегид $CH_3CHO$) — жидкость с резким неприятным запахом и температурой кипения $21°С$, хорошо растворим в воде. Из уксусного альдегида в промышленных масштабах получают уксусную кислоту и ряд других веществ, он используется для производства различных пластмасс и ацетатного волокна. Уксусный альдегид ядовит!
Карбоновые кислоты
Вещества, содержащие в молекуле одну или несколько карбоксильных групп, называются карбоновыми кислотами.
Группа атомов называется карбоксильной группой, или карбоксилом.
Органические кислоты, содержащие в молекуле одну карбоксильную группу, являются одноосновными.
Общая формула этих кислот $RCOOH$, например:
Карбоновые кислоты, содержащие две карбоксильные группы, называются двухосновными. К ним относятся, например, щавелевая и янтарная кислоты:
Существуют и многоосновные карбоновые кислоты, содержащие более двух карбоксильных групп. К ним относится, например, трехосновная лимонная кислота:
В зависимости от природы углеводородного радикала карбоновые кислоты делятся на предельные, непредельные, ароматические.
Предельными, или насыщенными, карбоновыми кислотами являются, например, пропановая (пропионовая) кислота:
или уже знакомая нам янтарная кислота.
Очевидно, что предельные карбоновые кислоты не содержат $π$-связей в углеводородном радикале. В молекулах непредельных карбоновых кислот карбоксильная группа связана с ненасыщенным, непредельным углеводородным радикалом, например, в молекулах акриловой (пропеновой) $СН_2=СН—СООН$ или олеиновой $СН_3—(СН_2)_7—СН=СН—(СН_2)_7—СООН$ и других кислот.
Как видно из формулы бензойной кислоты, она является ароматической, так как содержит в молекуле ароматическое (бензольное) кольцо:
Номенклатура и изомерия
Общие принципы образования названий карбоновых кислот, как и других органических соединений, уже рассматривались. Остановимся подробнее на номенклатуре одно- и двухосновных карбоновых кислот. Название карбоновой кислоты образуется от названия соответствующего алкана (алкана с тем же числом атомов углерода в молекуле) с добавлением суффикса -ов-, окончания -ая и слова кислота. Нумерация атомов углерода начинается с карбоксильной группы. Например:
Количество карбоксильных групп указывается в названии префиксами ди-, три-, тетра-:
Многие кислоты имеют и исторически сложившиеся, или тривиальные, названия.
Названия карбоновых кислот.
| Химическая формула | Систематическое название кислоты | Тривиальное название кислоты |
| $Н—СООН$ | Метановая | Муравьиная |
| $СН_3—СООН$ | Этановая | Уксусная |
| $СН_3—СН_2—СООН$ | Пропановая | Пропионовая |
| $СН_3—СН_2—СН_2—СООН$ | Бутановая | Масляная |
| $СН_3—СН_2—СН_2—СН_2—СООН$ | Пентановая | Валериановая |
| $СН_3—(СН_2)_4—СООН$ | Гексановая | Капроновая |
| $СН_3—(СН_2)_5—СООН$ | Гептановая | Энантовая |
| $НООС—СООН$ | Этандиовая | Щавелевая |
| $НООС—СН_2—СООН$ | Пропандиовая | Малоновая |
| $НООС—СН_2—СН_2—СООН$ | Бутандиовая | Янтарная |
После знакомства с многообразным и интересным миром органических кислот рассмотрим более подробно предельные одноосновные карбоновые кислоты.
Понятно, что состав этих кислот выражается общей формулой $С_nН_{2n}О_2$, или $С_nН_{2n+1}СООН$, или $RCOOH$.
Физические и химические свойства
Физические свойства.
Низшие кислоты, т.е. кислоты с относительно небольшой молекулярной массой, содержащие в молекуле до четырех атомов углерода, — жидкости с характерным резким запахом (вспомните запах уксусной кислоты). Кислоты, содержащие от $4$ до $9$ атомов углерода, — вязкие маслянистые жидкости с неприятным запахом; содержащие более $9$ атомов углерода в молекуле — твердые вещества, не растворяющиеся в воде. Температуры кипения предельных одноосновных карбоновых кислот увеличиваются с ростом числа атомов углерода в молекуле и, следовательно, с ростом относительной молекулярной массы. Так, например, температура кипения муравьиной кислоты равна $100.8°С$, уксусной — $118°С$, пропионовой — $141°С$.
Простейшая карбоновая кислота — муравьиная $НСООН$, имея небольшую относительную молекулярную массу $(M_r(HCOOH)=46)$, при обычных условиях является жидкостью с температурой кипения $100.8°С$. В то же время бутан $(M_r(C_4H_{10})=58)$ в тех же условиях газообразен и имеет температуру кипения $–0,5°С$. Это несоответствие температур кипения и относительных молекулярных масс объясняется образованием димеров карбоновых кислот, в которых две молекулы кислоты связаны двумя водородными связями:
Возникновение водородных связей становится понятным при рассмотрении строения молекул карбоновых кислот.
Молекулы предельных одноосновных карбоновых кислот содержат полярную группу атомов — карбоксил и практически неполярный углеводородный радикал. Карбоксильная группа притягивается молекулами воды, образуя с ними водородные связи:
Муравьиная и уксусная кислоты растворимы в воде неограниченно. Очевидно, что с увеличением числа атомов в углеводородном радикале растворимость карбоновых кислот снижается.
Химические свойства.
Общие свойства, характерные для класса кислот (как органических, так и неорганических), обусловлены наличием в молекулах гидроксильной группы, содержащей сильную полярную связь между атомами водорода и кислорода. Рассмотрим эти свойства на примере растворимых в воде органических кислот.
1. Диссоциация с образованием катионов водорода и анионов кислотного остатка:
$CH_3-COOH⇄CH_3-COO^{-}+H^+$
Более точно этот процесс описывает уравнение, учитывающее участие в нем молекул воды:
$CH_3-COOH+H_2O⇄CH_3COO^{-}+H_3O^+$
Равновесие диссоциации карбоновых кислот смещено влево; подавляющее большинство их — слабые электролиты. Тем не менее, кислый вкус, например, уксусной и муравьиной кислот объясняется диссоциацией на катионы водорода и анионы кислотных остатков.
Очевидно, что присутствием в молекулах карбоновых кислот «кислого» водорода, т.е. водорода карбоксильной группы, обусловлены и другие характерные свойства.
2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода: $nR-COOH+M→(RCOO)_{n}M+{n}/{2}H_2↑$
Так, железо восстанавливает водород из уксусной кислоты:
$2CH_3-COOH+Fe→(CH_3COO)_{2}Fe+H_2↑$
3. Взаимодействие с основными оксидами с образованием соли и воды:
$2R-COOH+CaO→(R-COO)_{2}Ca+H_2O$
4. Взаимодействие с гидроксидами металлов с образованием соли и воды (реакция нейтрализации):
$R—COOH+NaOH→R—COONa+H_2O$,
$2R—COOH+Ca(OH)_2→(R—COO)_{2}Ca+2H_2O$.
5. Взаимодействие с солями более слабых кислот с образованием последних. Так, уксусная кислота вытесняет стеариновую из стеарата натрия и угольную из карбоната калия:
$CH_3COOH+C_{17}H_{35}COONa→CH_3COONa+C_{17}H_{35}COOH↓$,
$2CH_3COOH+K_2CO_3→2CH_3COOK+H_2O+CO_2↑$.
6. Взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров — реакция этерификации (одна из наиболее важных реакций, характерных для карбоновых кислот):
Взаимодействие карбоновых кислот со спиртами катализируется катионами водорода.
Реакция этерификации обратима. Равновесие смещается в сторону образования сложного эфира в присутствии водоотнимающих средств и при удалении эфира из реакционной смеси.
В реакции, обратной этерификации, которая называется гидролизом сложного эфира (взаимодействие сложного эфира с водой), образуются кислота и спирт:
Очевидно, что реагировать с карбоновыми кислотами, т.е. вступать в реакцию этерификации, могут и многоатомные спирты, например глицерин:
Все карбоновые кислоты (кроме муравьиной) наряду с карбоксильной группой содержат в молекулах углеводородный остаток. Безусловно, это не может не сказаться на свойствах кислот, которые определяются характером углеводородного остатка.
7. Реакции присоединения по кратной связи — в них вступают непредельные карбоновые кислоты. Например, реакция присоединения водорода — гидрирование. Для кислоты, содержащей в радикале одну $π$-связь, можно записать уравнение в общем виде:
$C_{n}H_{2n-1}COOH+H_2{→}↖{катализатор}C_{n}H_{2n+1}COOH.$
Так, при гидрировании олеиновой кислоты образуется предельная стеариновая кислота:
${C_{17}H_{33}COOH+H_2}↙{\text"олеиновая кислота"}{→}↖{катализатор}{C_{17}H_{35}COOH}↙{\text"стеариновая кислота"}$
Непредельные карбоновые кислоты, как и другие ненасыщенные соединения, присоединяют галогены по двойной связи. Так, например, акриловая кислота обесцвечивает бромную воду:
${CH_2=CH—COOH+Br_2}↙{\text"акриловая(пропеновая)кислота"}→{CH_2Br—CHBr—COOH}↙{\text"2,3-дибромпропановая кислота"}.$
8. Реакции замещения (с галогенами) — в них способны вступать предельные карбоновые кислоты. Например, при взаимодействии уксусной кислоты с хлором могут быть получены различные хлорпроизводные кислоты:
$CH_3COOH+Cl_2{→}↖{Р(красный)}{CH_2Cl-COOH+HCl}↙{\text"хлоруксусная кислота"}$,
$CH_2Cl-COOH+Cl_2{→}↖{Р(красный)}{CHCl_2-COOH+HCl}↙{\text"дихлоруксусная кислота"}$,
$CHCl_2-COOH+Cl_2{→}↖{Р(красный)}{CCl_3-COOH+HCl}↙{\text"трихлоруксусная кислота"}$
Отдельные представители карбоновых кислот и их значение
Муравьиная (метановая) кислота ХЦООХ — жидкость с резким запахом и температурой кипения $100.8°С$, хорошо растворима в воде. Муравьиная кислота ядовита, при попадании на кожу вызывает ожоги! Жалящая жидкость, выделяемая муравьями, содержит эту кислоту. Муравьиная кислота обладает дезинфицирующим свойством и поэтому находит свое применение в пищевой, кожевенной и фармацевтической промышленности, медицине. Она используется при крашении тканей и бумаги.
Уксусная (этановая) кислота $CH_3COOH$ — бесцветная жидкость с характерным резким запахом, смешивается с водой в любых cоотношениях. Водные растворы уксусной кислоты поступают в продажу под названием уксуса ($3–5%$-ный раствор) и уксусной эссенции ($70–80%$-ный раствор) и широко используются в пищевой промышленности. Уксусная кислота — хороший растворитель многих органических веществ и поэтому используется при крашении, в кожевенном производстве, в лакокрасочной промышленности. Кроме этого, уксусная кислота является сырьем для получения многих важных в техническом отношении органических соединений: например, на ее основе получают вещества, используемые для борьбы с сорняками, — гербициды.
Уксусная кислота является основным компонентом винного уксуса, характерный запах которого обусловлен именно ею. Она — продукт окисления этанола и образуется из него при хранении вина на воздухе.
Важнейшими представителями высших предельных одноосновных кислот являются пальмитиновая $C_{15}H_{31}COOH$ и стеариновая $C_{17}H_{35}COOH$ кислоты. В отличие от низших кислот, эти вещества твердые, плохо растворимы в воде.
Однако их соли — стеараты и пальмитаты — хорошо растворимы и обладают моющим действием, поэтому их еще называют мылами. Понятно, что эти вещества производят в больших масштабах. Из непредельных высших карбоновых кислот наибольшее значение имеет олеиновая кислота $C_{17}H_{33}COOH$, или $CH_3 — (CH_2)_7 — CH=CH —(CH_2)_7COOH$. Это маслоподобная жидкость без вкуса и запаха. Широкое применение в технике находят ее соли.
Простейшим представителем двухосновных карбоновых кислот является щавелевая (этандиовая) кислота $HOOC—COOH$, соли которой встречаются во многих растениях, например в щавеле и кислице. Щавелевая кислота — это бесцветное кристаллическое вещество, хорошо растворяется в воде. Она применяется при полировке металлов, в деревообрабатывающей и кожевенной промышленности.
Сложные эфиры
При взаимодействии карбоновых кислот со спиртами (реакция этерификации) образуются сложные эфиры:
Эта реакция обратима. Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ — спирта и кислоты. Таким образом, реакция сложных эфиров с водой — гидролиз сложного эфира — обратна реакции этерификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификация) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира присутствием водоотнимающих средств.
Жиры — производные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот.
Все жиры, как и другие сложные эфиры, подвергаются гидролизу:
При проведении гидролиза жира в щелочной среде $(NaOH)$ и в присутствии кальцинированной соды $Na_2CO_3$ он протекает необратимо и приводит к образованию не карбоновых кислот, а их солей, которые называются мылами. Поэтому гидролиз жиров в щелочной среде называются омылением.
examer.ru
Эфиры альдегидов - Справочник химика 21
Производные углеводородов. Радикалы и функциональные группы. Реакции замещения. Спирты, простые эфиры, альдегиды, кетоны, карбоновые кислоты, сложные эфиры, амины, аминокислоты. Пептидные связи, пептиды и белки. [c.263]Синтетические душистые вещества —летучие органические соединения, преимущественно сложные эфиры, альдегиды или [c.12]
Сложные эфиры Альдегиды Жирные кислоты Нитрованные мае- —N02 ла [c.201]В процессе окисления наряду с желаемыми кислотами образуются еще летучие соединения, которые удаляются с отходящими газами. Основные продукты окисления, не обладающие летучестью, состоят из высокомолекулярных жирных кислот, спиртов, кетонов, альдегидов, сложных эфиров, лактонов, эстолидов и т. д. Летучими продуктами, кроме углекислоты и воды, являются низшие жирные кислоты и их эфиры, альдегиды, спирты и перекиси они конденсируются при охлаждении и образуют водный и маслянистый слои. [c.449]
НЕКОТОРЫЕ РЕАКЦИИ ОБРАЗОВАНИЯ СЛОЖНЫХ ЭФИРОВ И ДЕГИДРИРОВАНИЯ СПИРТОВ ДО ЭФИРОВ, АЛЬДЕГИДОВ И КЕТОНОВ [c.363]
Прокаленный хлорид кальция. Хлорид кальция применяется довольно часто ввиду своей доступно сти. Однако он обладает рядом существенных недо-статков осушает медленно и не до конца, реагирует со спиртами, фенолами, аминами, амидами и нитрилами кислот, сложными эфирами, альдегидами и другими соединениями, а поэтому не может применяться для их осушки. [c.175]
При сульфатировании протекает ряд побочных реакций, из которых важнейшими являются образование диалкилсульфатов, простых эфиров, альдегидов и кетонов (см. раздел 7.1), а также дегидратация спиртов (особенно вторичных) с образованием олефинов. [c.243]
В качестве побочных продуктов образуется большое число соединений различных классов —углеводороды, спирты, эфиры, альдегиды, кетоны и др. Для производства дивинила пригоден технический этанол — продукт брожения или гидролиза растительных углеводов, гидратации этилена и т. д. [c.361]
Температура холодного пламени эфиров, альдегидов, углеводородов значительно ннже температуры горячего пламени и обычно лишь на 50—200° превышает температур окружающей среды. [c.344]
В бензинах присутствуют кислородные соединения, переходящие из сырья или образующиеся в результате окисления углеводородов. Содержание кислых коррозионно-агрессивных соединений в товарных бензинах не превышает 0,01% мае. (кислотность не более 3 мг/100 см ). Около 10% суммы кислых соединений в бензинах составляют фенолы, остальное - кислоты. Кислые соединения удаляются при производстве бензинов защелачиванием. Нейтральные кислородные соединения (спирты, эфиры, альдегиды, кетоны) содержатся в бензинах в незначительных количествах и практически не влияют на эксплуатационные свойства. [c.15]
Парафиновые, олефи-новые углеводороды, галогенопроизводные, ацетон, простые эфиры, альдегиды, нитросоединения. нейтральные газы, H I, сероуглерод Газы, в том числе Nh4 [c.287]
Записывать структурные формулы молекул, выбранных в качестве примеров спирта, простого эфира, альдегида, ке-тона, карбоновой кислоты, сложного эфира и амида. [c.436]
Спирты, эфиры, альдегиды, кетоны. кислоты [c.556]
К кислородсодержащим органическим соединениям относятся спирты, фенолы, простые эфиры, альдегиды, кетоны, кислоты, сложные эфиры и др. [c.268]
Присоединение спиртов, аминов, сложных эфиров, альдегидов и т. д. [c.207]
Галогенозамещенные карбоновые кислоты, сложные эфиры, альдегиды и кетоны (см. Галогенозамещенные карбонильные соединения) Галогенозамещенные простые эфиры и ацетали [c.420]
В этой главе мы прошли долгий путь рассуждений, начав с рассмотрения сравнительной химии элементов В, С, N и Si. Углерод несомненно играет особую роль, обусловленную наличием у его атомов одинакового числа валентных электронов и орбиталей, отсутствием отталкивающих неподеленных электронных пар и способностью образовывать двойные и тройные связи. Простые алканы, или соединения углерода и водорода, с простыми связями иллюстрируют многообразие соединений, которые может образовывать углерод благодаря своей способности создавать длинные устойчивые цепи. Алкилгалогениды - это своеобразный мостик от алканов с их сравнительно низкой реакционной способностью к изобилию производных углеродов спиртам, простым эфирам, альдегидам, кетоиам, сложным эфирам, кислотам, аминам, аминокислотам и соединениям других типов, которые не обсуждались в данной главе. Способность углерода образовывать двойные и тройные связи была проиллюстрирована на примере алкенов и алкинов, она играет чрезвычайно важную роль при образовании сопряженных и ароматических молекул. [c.337]
Ненасыщенные кислоты, сложные эфиры, альдегиды, кетоны (см. Ненасыщенные карбонильные соединения) Ненасыщенные спирты и фенолы [c.435]
Глава XVIIL Простые эфиры. Альдегиды. Кетоны [c.384]
Н, Л — ДЛЯ разделения сложных эфиров, альдегидов, кетонов К — для отделения олефинов от ароматических углеводородов, спиртов, эфиров Ь = = НЖФ универсального назначения N — для разделения терпеновых спиртов, фенолов, кислот Для разделения смеси СО , Н3О, Н З, [c.104]
Получение из сложных эфиров, альдегидов й кетонов с помощью металлоорганических соединений мы рассмотрим при изучении соответствующих разделов органической химии. [c.99]
К нейтральным кислородным соединениям относят спирты, эфиры, альдегиды, кетоны, а также вещества с несколькими функциональными группами. Многообразие химического строения нейтральных кислородных соединений сильно затрудняет их изучение. Именно этим следует объяснить весьма ограниченные сведения, втречаю щиеся по данному вопросу в литературе [68]. [c.27]
Например, продуктами гидроформилирования пропена, кроме С -альдегидов и спиртов (н- и зо-бутилового), являются С5-СОЛИ или эфиры муравьиной кислоты, Св-сложные эфиры, альдегиды или спирты, Св-простые эфиры, Сд- эфироальдегиды и эфироспирты и, возможно, (З з-ацетали, образованные путем следующих реакций [c.195]
Продукты этой отрасли промышленностн отличаются большим много( бразием строения, свойств и областей применения. Это различные углеводороды, хлор- и фторпроизводные, спирты и фенолы, простые эфиры, альдегиды и кетоны, карбоновые кислоты и их прсизводные (сложные эфиры, ангидриды, нитрилы и др.), амины и нитросоединения, вещества, содержащие серу и фосфор, и т. д. По назначению все они подразделяются на две группы ]) промежуточные продукты для синтеза других веществ в этой же илн в других отраслях органической технологии 2) продукты целевого применения в разных отраслях народного хозяйства. [c.9]
Чолимерные материалы отличаются высоким содержанием углерода большинство из них не содержит кислорода или содержит его в небольшом количестве. Поэтому для их горения необходим значительный объем воздуха (10—12 м кг) горение их происходит с образованием продукта неполного сгорания — технического углерода. При нагревании большинство полимерных материалов плавится с образованием на поверхности горения жидкого слоя. При дальнейшем нагревании расплавленной массы на воздухе происходит термоокислительная деструкция с образованием горючих и часто ядовитых паров и газов (диоксида и оксида углерода, непредельных углеводородов, органических кислот, эфиров, альдегидов и др.). За исключением диоксида углерода, все продукты деструкции горючие, поэтому, когда концентрация их в воздухе достигает предельного значения, полимерные материалы воспламеняются от источника воспламенения. [c.187]
Кислородсодержащие соединения. Проблема выделения кислородсодержащих соединений из нефтяных фракций наиболее полно разработана для соединений кислого характера (кислот, фенолов), но недостаточно для нейтральных соединений (пероксидов, спиртов, эфиров, альдегидов, кетонов и иолигетероатомных соединений). Нейтральные соединения выделяются из смесей с углеводородами хроматографически, однако в концентраты наряду с кислородсодержащими попадают сбру- и азотсодержащие соединения. [c.91]
Синтезы на основе оксидов углерода и водорода дают возможность по-хучать широкую гамму продуктов углеводороды, спирты, карбоновые кис-юты, сложные эфиры, альдегиды, кетоны. Потребность народного хозяйства ) этих продуктах исчисляется сотнями тысяч и миллионами тонн в год. В вязи с ограниченностью мировых запасов нефти эти синтезы в последние ОДЫ приобретают все более важное значение. [c.105]
Были описаны методы идентификации ацеталей в сложных смесях, содержащих эфиры, альдегиды, кетоны и другие соединения [231]. Поток нз капиллярной колонки поступал непосредственно на время-пролетный масс-спектрометр. Один из коллекторов прибора настраивался на ионы с массой 15, которые использовались для регистрации хроматограммы. На втором коллекторе отбирались все ионы в диапазоне 24— 200 ат. ед. массы полный спектр регистрировался на осцилло- графе в течение 6 сек. При хроматографическом разделении земляничного масла с помощью этой методики удалось идентифицировать 150 компонентов. Аналогичным образом исследовалась сложная смесь углеводородов [232]. [c.128]
Исходным продуктом для получения чистых транс- и цис-/изомеров пиперилена служила амилен-пипериленовая фракция, являющаяся побочным продуктом в синтезе бутадиена-1,3 из этилового спирта. Фракция представляет собой в основном смесь продуктов из цис- и транс-пиперилена, амиленов, диэтилового эфира, альдегидов, циклопентадиена и изопрена. Большую часть в ней составляют пиперилен (около 85%), амилены и диэтиловый эфир. Диэтиловый эфир -сравнительно легко удаляется из исходного (Продукта многократной промывкой его водой. От альдегидов продукт. может быть освобождай путем осмоления их при повышенной температуре над твердой щелочью (при кипячении) и обра- боткой раствором соляношслого шдрокоилам1ина. Из оставшейся смеси углеводородов выделение пиперилена и разде- [c.83]
Как яспо из рис. 64 и 65, Уайту и Тоуненду с сотр. при употреблении в качестве источника зажигания горячей проволочки удавалось инициировать холодные пламена в эфиро-воздушных и кислородных смесях только с таким содержанием эфира, которое превосходит верхний предел нормального воспламенения (по составу), вызываемого поджиганием искрой высокого напряжения. В позднейших опытах Спенс и Тоуненд [63] нашли способ возбуждать холоднонламенное и двухстадийное воспла-мененпе в кислородных и воздушных смесях эфиров, альдегидов и углеводородов таких составов, которые взрываются при поджигании электрической искрой высокого напряжения. Добиться этого удалось, употребляя в качестве источника зажигания электрически нагреваемый керамический элемент, допускающий точную регулировку температуры. [c.187]
Норриш, как и ряд авторов до него, подчеркивает то обстоятельство, что феноменология холоднопламенного окисления одинакова для углеводородов, алифатических эфиров, альдегидов, кетонов, спиртов. Это дает основание предположить обш,ую причину возникновения холодных пламен у всех этих классов соединений. Такое заключение получает серьезное подтверждение в том, что ддя холодных пламен всех названных соединений характерен один и тот же спектр флуоресценции формальдегида. Тот же факт, что, с одной стороны, холодные пламена возникают при окислении альдегидов, а с другой стороны, альдегиды являются обш,ими промежуточными продуктами, возникаюш ими при окислении всех соединений, дающих холодные пламена,— заставляет искать причину холоднопламенного явления в реакциях, связанных с альдегидами. При этом, хотя холоднопламенное свечение обусловлено возбужденным формальдегидом, сам формальдегид при своем окислении не дает холодного пламени. Таким образом, не он и не его превращения, а реакции, связанные с высшими альдегидами, ответственны за возникновение холодных пламен. А так как эти пламена характерны для нижнетемпературного окисления, то, следовательно, высшие альдегиды, а не формальдегид являются активными промежуточными продуктами окисления в этой температурной области. [c.256]
Диоктилфталат jHi ( OO gHiijj. Мол. вес 390,56, плотн. 0,982 при 20° С, т. плавл. 25° С, т. кип. 386° С, диэлектрическая проницаемость 5,1, показатель преломления 1,484. Максимальная рабочая температура колонки 150° С Рекомендуемый растворитель — дихлорметан. Универсальная жидкая фаза. Применяется для разделения углеводородов, спиртов, фенолов, сложных эфиров, альдегидов, жирных кислот.[c.282]
Известны многочисленные органические соединения со смешанными функциями, в состав которых включаются одновременно различные функциональные группы. К ним относятся галопроизводные спиртов, эфиров, альдегидов, кетонов, кислот, аминов, нитрилов и т. д., гидроксопроизводные альдегидов, кетонов, кислот, аминопроизводные различных кислородсодержащих соединений, производные элементорганических соединений и многие другие. [c.75]
Из нефтяных углеводородов путем последовательной химической переработки получают целый ряд различных химических соединений непредельные углеводороды, спирты, кислоты, эфиры, альдегиды—продукты, играющие огромную роль как для изготовления предметов бытового потребления, так и для развития современной техники. Так, содержащийся в газах крекинга этилен при взаимодействии с хлором образует дихлорэтан, являющийся исходным сырьем для получения поливинилхлорида. Гидратацией этилена под действием катализаторов получается синтетический этиловый спирт, являющийся важным исходным сырьем для ряда химических процессов. Эта реакция, открытая А. М. Бутлеровым и В. Горяйновым, сохранила важное техническое значение и до настоящего времени. [c.69]
Эфиры муравьиной кислоты от третичных спиртов Эфиры уксусной кислоты от третичных спиртов Альдегиды от третичных спиртов Третичные сю1р-ты от ацеталей Кетоны от простых эфиров Кетоны от эфиров муравьиной кислоты Кетоны (Jт эфиров уксусной кислоты Альдегиды от кетонов Кетоны от ацеталей Эфиры муравьиной кислоты от простых эфиров Эфиры уксусной кислоты от простых эфиров Альдегиды от простых эфиров Ацетали от простых эфиров [c.185]
chem21.info
Сложные эфиры альдегид - Справочник химика 21
Сложные эфиры Альдегиды Жирные кислоты Нитрованные мае- —N02 ла [c.201]Прокаленный хлорид кальция. Хлорид кальция применяется довольно часто ввиду своей доступно сти. Однако он обладает рядом существенных недо-статков осушает медленно и не до конца, реагирует со спиртами, фенолами, аминами, амидами и нитрилами кислот, сложными эфирами, альдегидами и другими соединениями, а поэтому не может применяться для их осушки. [c.175]
Синтетические душистые вещества —летучие органические соединения, преимущественно сложные эфиры, альдегиды или [c.12]Присоединение спиртов, аминов, сложных эфиров, альдегидов и т. д. [c.207]
Галогенозамещенные карбоновые кислоты, сложные эфиры, альдегиды и кетоны (см. Галогенозамещенные карбонильные соединения) Галогенозамещенные простые эфиры и ацетали [c.420]
Ненасыщенные кислоты, сложные эфиры, альдегиды, кетоны (см. Ненасыщенные карбонильные соединения) Ненасыщенные спирты и фенолы [c.435]
Н, Л — ДЛЯ разделения сложных эфиров, альдегидов, кетонов К — для отделения олефинов от ароматических углеводородов, спиртов, эфиров Ь = = НЖФ универсального назначения N — для разделения терпеновых спиртов, фенолов, кислот Для разделения смеси СО , Н3О, Н З, [c.104]
Получение из сложных эфиров, альдегидов й кетонов с помощью металлоорганических соединений мы рассмотрим при изучении соответствующих разделов органической химии. [c.99]
Типичные примеры реакции Дильса—Альдера описаны ниже. Легко заметить, что в результате реакции всегда образуется новая двойная связь. При синтезе углеводородов в диенофиле отсутствует электроноакцепторная группа. Однако в более общих случаях, т. е. при образовании аддуктов ангидридов, карбоновых кислот, сложных эфиров, альдегидов, хинонов и т. п., в диенофиле имеется электроноакцепторная группа. [c.144]
Синтезы на основе оксидов углерода и водорода дают возможность получать широкую гамму продуктов углеводороды, спирты, карбоновые кислоты, сложные эфиры, альдегиды, кетоны. Потребность народного хозяйства в этих продуктах исчисляется сотнями тысяч и миллионами тонн в год. В связи с ограниченностью мировых запасов нефти эти синтезы в последние годы приобретают все более важное значение. [c.105]
Расщепление по связям О—С при действии щелочных металлов, их гидроксидов или алкоголятов, карбоновых и неорг. к-т, их ангидридов, а в присут. сильных к-т-при действии простых и сложных эфиров, альдегидов, кетоиов. [c.98]
Впервые изучены реакции гомолитического расщепления гипогалогенитов бензиловых, вторичных спиртов и диолов. Показано, что в зависимости от структуры, они превращаются в линейные или циклические сложные эфиры, альдегиды, кетоны, дикетоны и спирты. [c.4]
В процессе получения бутанола через альдоль и кротоновый альдегид необходим быстрый и оперативный контроль образующихся нродуктов. Эти продукты представляют собой смеси, содержащие простые и сложные эфиры, альдегиды, кетоны, спирты и др. [c.171]
Обобщая данные о сорбируемости на АУ низкомолекулярных органических соединений, можно сделать вывод, что менее других сорбируются структурно простые вещества в ионной форме, лучше других — в молекулярной форме. Сорбируемость органических веществ возрастает в ряду гликоли сложные эфиры — альдегиды [c.515]
Многочисленные соединения каждой группы отличаются друг от друга видом циклизации (соединения с открытой цепью, моно-, бициклические и т. д.), числом и положением двойных связей, центрами асимметрии и природой и числом функциональных групп. Поэтому целесообразно осуществить дополнительную разбивку внутри терпеновых групп по функциональным группам, расположив их в ряд с увеличивающейся полярностью углеводороды, сложные эфиры, альдегиды, кетоны, спирты, кислоты. [c.186]
Синтезы на основе оксидов углерода и водорода чрезвычайно интересны не только с теоретической, но и с практической точки зрения, так как дают возможность на основе простейших газов (СО, СОг и Нг) получать широкую гамму продуктов углеводороды— от метана до твердых высокоплавких парафинов, спирты — от метанола до эйкозанола и выше, карбоновые кислоты, сложные эфиры, альдегиды, кетоны. Потребность народного хозяйства в этих продуктах исчисляется сотнями тысяч и миллионами тонн в год. В связи с ограниченностью мировых запасов нефти эти синтезы в последние годы приобретают все более важное значение. [c.263]
Установлено, что в синтетическом метаноле-сырце содержится более 50 органических соединений. Это — простые и сложные эфиры, альдегиды, кетоны, формали, ацетали, высшие спирты, карбоновые кислоты, амины. Общее содержание их в пересчете на органические соединения колеблется от 0,3 до 5,2% (масс.) в зависимости от качества сырья, применяемого катализатора и условий процесса (табл. 3.8). [c.96]
Например, продуктами гидроформилирования пропена, кроме С -альдегидов и спиртов (н- и зо-бутилового), являются С5-СОЛИ или эфиры муравьиной кислоты, Св-сложные эфиры, альдегиды или спирты, Св-простые эфиры, Сд- эфироальдегиды и эфироспирты и, возможно, (З з-ацетали, образованные путем следующих реакций [c.195]
Диоктилфталат jHi ( OO gHiijj. Мол. вес 390,56, плотн. 0,982 при 20° С, т. плавл. 25° С, т. кип. 386° С, диэлектрическая проницаемость 5,1, показатель преломления 1,484. Максимальная рабочая температура колонки 150° С Рекомендуемый растворитель — дихлорметан. Универсальная жидкая фаза. Применяется для разделения углеводородов, спиртов, фенолов, сложных эфиров, альдегидов, жирных кислот.[c.282]
Через несколько минут начинается реакция, жидкость кипит, и выделяются белые пары, содержащие азотный и уксусный сложные эфиры, альдегид, угольную кислоту и синильную кислоту. По мере протекания реакции цвет паров изменяется от белого до красьых паров/ вуокиси азота. [c.82]
В колоннах, особенно в бражной, наряду с процессом ректификации идут сложные химические процессы новообразования сложных эфиров, альдегидов, ацеталей, органических кислот и других летучих соединений. Снижение температуры и сокращение времени пребывания бражки в колонне уменьщают скорость новообразований и позволяют получить бражной дистиллят со значительно меньшим содержанием примесей спирта. [c.343]
Так, для разделения углеводородов и их производных, молекулы которых обладают малой полярностью (например, гало,генпро-изводных углеводородов), вполне пригодны парафиновые и силиконовые масла и трикрезилфосфат напротив, диалкилфталаты рекомендуется применять для разделения кислородсодержащих соединений (простых н сложных эфиров, альдегидов, кетонов и др.). Смеси, содержащие воду, хорошо разделяются иа полигликолях. [c.98]
Таблица разбита па разделы разде-т А посвящен углеводородам и замещенным углеподородам Б — стеринам В — кислотам Г—спиртам Д — сложным эфирам -—альдегидам и кетонам (включая углеводы) Ж — прсктым эфирам 3 другим соединениям. [c.499]
Для углеводородов, перфторсоединений, галогеносодсржащих соединений, сложных эфиров, альдегидов, кетонов и нитросоединений (группа I) А1= 0,0287 для спиртов и кислот (фуппа II) А2 = 0,0181 для нитрилов (группа 111) = 0,0229. Напомним, что АГ- выражается в Джо лях, AI, - в А , и тогда с указанными коэффициентами Aj величина Ур выражается в динУсм. [c.356]
Многие A. . играют важную роль в биол. процессах. К таким соед. относятся, в частности, жиры, продукты их метаболизма, ми. аминокислоты, входящие в состав белков, углеводы. В эфирных маслах мн. растений содержатся сложные эфиры, альдегиды, спирты и другие A. . [c.82]
БАЛЬЗАМЫ (от греч. balsamon-ароматическая смола), р-ры прир. смол в сопутствующих им эфирных маслах. Б. накапливаются в растениях, гл. обр. в особых межклеточных вместилищах или ходах коры. Добывают Б, как правило, подсочкой (нанесение спец. надрезов на стволы деревьев в период вегетации). В состав Б обычно входят ароматичные соед. (ванилин, коричная и бензойная к-ты, их сложные эфиры, альдегиды, кетоны, спирты). Б,-вязкие жидкости на воздухе постепенно твердеют из-за испарения эфирного масла и окисления обладают горьким острым вкусом и кислой р-цией, практически нерастворимы в воде, [c.239]
Обобщая данные о сорбируемости на активированных углях низкомолекулярных органических соединений, можно сделать вывод, что менее других сорбируются структурно-простые вещества в ионной форме, лучше - в молекулярной. Сорбируемость органических веществ возрастает в ряду Гликоли Сложные эфиры - Альдегиды рованные кислоты [c.73]
Геннлцианиды важны не только как промежуточные соединения в синтезе тиенилуксусных кислот (имеющих большое значение для получения синтетических аналогов пенициллина и родственных фармацевтических препаратов), но также как системы с активной метиленовой группой, способные легко конденсироваться со сложными эфирами, альдегидами, карбонатами и алкилгалогенидами. Циклизация о-бис(цианометил) производных используется как эффективный метод аннелирования [142, 146, 147]. [c.276]
Перенос протона на атом углерода и обратно. На лимитирующей стадии протон может переноситься от общей кислоты на карбанион, олефин или ароматическое соединение. Некоторые из этих реакций приведены в табл. 5.1. Поскольку общий основной и общий кислотный катализ являются взаимообрат-иыми процессами, каждая из вышеупомянутых реакций в обратном направлении катализируется общими основаниями. В качестве примера можно привести депротонирование кетонов, сложных эфиров, альдегидов и нитросоединений. [c.125]
Для ориентировочной оценки времени удерживания веществ различной природы на газожццкостной хроматограмме может служить сравнение природы жццкой фазы и анализируемых молекул. На неполярной жцдкой фазе неполярные молекулы движутся медленнее, чем полярные, и пики их появляются позднее. Наоборот, с увеличением полярности жидкой фазы полярные вещества удерживаются сильнее неполярных. Так, для разделения углеводородов и их галогенопроизводных наиболее пригодны парафины, силиконовые масла или трикрезилфосфат. Для разделения кислородосодержащих щ)оизводных (простых и сложных эфиров, альдегидов и кетонов) более подходит диалкилфталат. Чувствительность метода газожидкостной хроматографии достигает 0,01—0,001% паров вещества в токе N3. [c.100]
Из схемы 9.1 очевидно, что фундаментом всей органической химии являются углеводороды. От алканов происходят все остальные классы углеводородов. Из углеводородов в результате химических реакций замещения Н-атома С-Н-связи и присоединения реагентов по л-связям возникают основные классы функциональных производных углеводородов — галогенопроизводные, сульфопроиз-водные, нитросоединения, спирты, простые и сложные эфиры, альдегиды, кегоны и карбоновые кислоты. Дальнейшее химическое преобразование (химический дизайн) этих производных за счет замещения или химического видоизменения функциональных групп создает все труднообозримое многообразие полифунк-ционапьных органических соединений, в том числе аминокислоты, пептиды, и белки, жиры и углеводы, гетероциклы различной сложности, витамины, гормоны, нуклеотиды и нуклеиновые кислоты, ферменты. [c.317]
Металлический натрий используется для высушивания парафиновых, циклопарафиновых, этиленовых и ароматических углеводородов, простых эфиров и третичных аминов. Предварительно ббльшую часть воды удаляют из жидкости одним из указанных выше осушителей. Наиболее удобно применять натрий в виде тонкой проволоки, которую выдавливают прямо в жидкость при помощи специального пресса, или в виде тонкой ленты (таким путем создается большая поверхность для соприкосновения с жидкостью). Нельзя сушить металлическим натрием галогенопроизводные углеводородов, которые реагируют с натрием в ряде случаев (например, СНС1з) со взрывом. Нельзя также применять натрий для высушивания спиртов, кислот, сложных эфиров, альдегидов, кетонов и некоторых аминов. [c.19]
При понижении температуры в системе охлаждения двигателя количество образующихся углеродистых отложений возрастает в несколько раз. На этом режиме (рис. 22) механизм образования отложений отличается от рассмотренного выше для двигателей, работающих на высокотемпературном режиме. На такте сжатия топливо-воздушная смесь подвергается интенсивному окислению с образованием перекисей углеводородов, сложных эфиров, альдегидов, кислот и т. д. Эти газообразные мономеры проникают через кольцевой пояс поршней в картер двигателя и загрязняют масло. Пока они удерживаются в растворе их взаимодействие очень незначительно. Однако масло быстро насыщается мономерами, и они, конденсируясь, образуют вторую жидкую фазу продуктов окисления. Эти продукты имеют низкую относительную молекулярную массу (60—300), содержат гидроксильные, карбонильные и карбоксильные группы, а также нитро- н нитроэфирные группы. [c.54]
Непосредственное окисление одноатомных первичных спиртов в соответственные кислоты лучше всего производится при действии щелочного раствора перманганата Худшие результаты пол 4чаются при применении хромового ангидрида с серной кислотой, так как при этом в качестве побочных продуктов также получаются сложные эфиры, альдегиды и ацетали. [c.125]
В 1940 г. Венцелем был разработан процесс каталитического гидрирования оксида углерода в стационарном слое плавленого железного катализатора — синол-процесс. Синтез проводили при относительно низких температурах (180— 200 °С) и 0,5—2,5 МПа. В жидких продуктах синтеза кроме спиртов имелось-2—7°/о (масс.) других кислородсодержащих соединений (сложные эфиры, альдегиды, кетоны и карбоновые кислоты). Выход первичных алифатических спиртов достигал 60—70% от суммы жидких продуктов. [c.307]
Метиловыи спирт Сложные эфиры Альдегиды Кетопы Смола отстойная растворимая Другие соединения Водт (по разности) [c.51]
chem21.info
Спирты 14. Эфиры 15. Альдегиды 15. Кислоты 16. Сложные эфиры
Источники загрязнения окружающей среды. При окислении н-бутана выбросы в атмосферу состоят в основном из бутана, пропана, этана и др. Источником загрязнения сточных вод является стадия очистки, после которой в сточные воды попадают уксусная кислота, различные спирты, альдегиды, кетоны, эфиры, органические кислоты, сложные эфиры и другие высококипящие примеси. [c.273] Основное применение борогидрид лития находит в органической химии в качестве восстановителя [6 . Он восстанавливает альдегиды и сложные эфиры до первичных спиртов, кетоны до вторичных спиртов, но не восстанавливает нитрилы, амиды, ароматические кислоты. Борогидрид лития используют для получения боразола, который применяется как инициатор горения топлива [7], в электролитах для осаждения циркония [8], как источник водорода при получении губчатых материалов [9]. [c.27]Г. Нейтральные вещества. С двунормальными растворами едкого натра или соды солей не дают. Сюда относятся углеводороды, спирты, эфиры, альдегиды, кетоны, сложные эфиры, ароматические нитросоединения, производные амидов кислот, амины с очень слабым основным характером, галоидные соединения и др. Нейтральные вещества могут находиться во всех вышеупомянутых группах. [c.216]
Биологически активные соединения — те, которые будучи введенными в живой организм в малых дозах, вызывают четко выраженные физиологические эффекты. Среди природных алифатических веществ — углеводородов, спиртов, кетонов, альдегидов, кислот, сложных эфиров и других — существует большое число как биологически важных, так и биологически активных соединений. Различие между двумя понятиями лучше всего уяснить на примерах. [c.27]
Превращение продуктов, содержащих кислород (спирты, альдегиды, кислоты, сложные эфиры, простые эфиры, ацетали и т. д.), протекает по сравнению с парафиновыми углеводородами почти всегда не- [c.373]
Синтезы на основе оксидов углерода и водорода дают возможность получать широкую гамму продуктов углеводороды, спирты, карбоновые кислоты, сложные эфиры, альдегиды, кетоны. Потребность народного хозяйства в этих продуктах исчисляется сотнями тысяч и миллионами тонн в год. В связи с ограниченностью мировых запасов нефти эти синтезы в последние годы приобретают все более важное значение. [c.105]
Металлический натрий. Натрий применяется для абсолютирования углеводородов и простых эфиров. Нельзя использовать его для сушки кислот, сложных эфиров, спиртов, галогенпроизводных жирного и ароматического рядов, альдегидов, кетонов, аминов. [c.172]
Прн перегонке и ректификации этилового спнрта постоянно контролируют содержание в готовом продукте и отходах этилового спирта, альдегидов, кислот, сложных эфиров и т. д. и при превышении допустимых норм содержания их устраняют возникшие неполадки технологии. [c.303]
Кетоны по устойчивости к окислению находятся между легко разлагаемыми спиртами, альдегидами, кислотами, сложными эфирами и более стойкими простыми эфирами [135]. [c.161]
Спирты и фенолы. В зависимости от pH среды, т, е. наличия частиц К-ОН или К-О, а также от материала анода (платина, золото или никель) могут получаться альдегиды, кислоты, сложные эфиры и другие продукты. При электролизе на никелевом аноде окислителем может выступать не ток непосредственно, а оксиды никеля [c.307]
Восстановление карбонильных соединений, окислов углерода, кетонов, альдегидов, кислот, сложных эфиров из окиси углерода и водорода при 300—370° и 85—150 ат получается метиловый спирт [c.147]
Помимо нескольких десятков химических реагентов [1, 2, 3, 17] в методе вычитания в качестве селективного реагента успешно применяют молекулярные сита, селективно адсорбирующие и удерживающие химические соединения, молекулы которых по своим геометрическим размерам могут пройти через окна цеолитов. Впервые молекулярные сита в методе вычитания использовали Бреннер и Коутс [20]. Они показали, что н-парафины Сз-Сц количественно поглощаются цеолитом 5А, а ароматические углеводороды, нафтены и разветвленные парафины проходят через колонку с этим адсорбентом без изменения. В дальнейшем Бреннер [71] применил этот метод для селективного поглощения спиртов, альдегидов, кислот, сложных эфиров и некоторых других соединений. Некоторые молекулярно-ситовые свойства цеолитов приведены в табл. V.3, а более подробная характеристика цеолитов обсуждается в монографиях [14, 74, 75]. [c.197]
С этой точки зрения в школьном курсе должны быть представлены такие основные классы органических соединений, как углеводороды, спирты, альдегиды, кислоты, сложные эфиры, углеводы, нитро- и аминосоединения, белки. Выпадают многие вещества с двойственной функцией, красители, гетероциклические соединения, алкалоиды и ряд других классов, не доступных усвоению школьника в отведённое время. [c.11]
По химическому составу эфирные масла представляют собой смеси различных органических соединений. В состав эфирных масел входят углеводороды (в частности, терпены), спирты, фенолы, альдегиды, кетоны, сложные эфиры, кислоты, окиси, хиноны, лактоны, амидо-, имидо- и тиосоединения и т. д. В отдельных эфирных маслах может содержаться от 5 до 20 различных веществ, а иногда и больше. При этом какие-то соединения могут содержаться в очень больших количествах, а другие — в ничтожно малых. [c.285]
Курс органической химии характеризуется стройной структурой, взаимосвязью классов соединений углеводороды — спирты — альдегиды — кислоты — сложные эфиры — углеводы — амины — аминокислоты — белки. Это обстоятельство позволяет широко применять в системе самостоятельных работ учащихся генетические связи между классами соединений (переход от менее сложного к более сложному и, наоборот, от сложного к простому), логические операции, особенно сравнения, систематизация и обобщения. [c.153]
Каталитическое восстановление окиси углерода в присутствии железа стало известным в 1912 г. были получены метиловый и высшие спирты, альдегиды, кетоны, кислоты, сложные эфиры и небольшое количество жидких углеводородов. [c.248]
Прокаленный хлорид кальция. Хлорид кальция применяется довольно часто ввиду своей доступно сти. Однако он обладает рядом существенных недо-статков осушает медленно и не до конца, реагирует со спиртами, фенолами, аминами, амидами и нитрилами кислот, сложными эфирами, альдегидами и другими соединениями, а поэтому не может применяться для их осушки. [c.175]
В дальнейших процессах окисления алканов образуются спирты, альдегиды, кетоны, гидропероксиды, кислоты, сложные эфиры и т.д. по следующей принципиальной схеме [c.50]
Ненасыщенные кислоты, сложные эфиры, альдегиды, кетоны (см. Ненасыщенные карбонильные соединения) Ненасыщенные спирты и фенолы [c.435]
Реакция Канниццаро. Для ароматических альдегидов характерна реакция, открытая в 1853 г. итальянским ученым С. Канниццаро и заключающаяся в том, что под действием крепких щелочей две молекулы альдегида вступают друг с другом в окислительно-восстановительное взаимодействие одна — окисляется в кислоту, другая — восстанавливается в спирт. Эта реакция является частным случаем реакции сложноэфирной конденсации (В. Е. Тищенко, стр. 147) очевидно, вначале из двух молекул альдегида образуется сложный эфир, который в этих условиях под действием щелочи сразу же гидролизуется [c.370]
Позднее Кинг и сотр. (1961) применили этот метод для анализа очень разбавленных водных растворов низших спиртов, альдегидов и сложных эфиров. При применении 50%-ного раствора можно уже в реакционной трубке длиной 15 см, заполненной карбидом кальция, достигнуть полного превращения растворителя, в то время как для растворов, содержащих 90% воды, требуется реактор длиной 30 см. Водные растворы органических кислот, однако, нельзя анализировать этим методом, так как они реагируют с образующейся в реакции окисью кальция. [c.274]
Синтез альдегидов и кетонов. Производные кислот — сложные эфиры, ангидриды, хлорангидриды, амиды — могут служить исходными веществами не только для синтеза вторичных и третичных спиртов, но в определенных условиях н для синтеза альдегидов или кетонов. [c.272]
Содержащиеся в газах спиртового брожения воздух, водяные пары, спирты, альдегиды, органические кислоты, сложные эфиры, а иногда и сернистые соединения не только снижают качество углекислоты, но и отрицательно отражаются на ее производстве. Так, при повышенном содержании воздуха нарушается режим работы углекислотной установки водяные пары и сернистые соединения усиливают коррозию оборудования. [c.391]
Спирты Альдегиды Органические кислоты Сложные эфиры 0,5 0,06 0,02—0,04 0,02 10 1 0,5—1,0 0,5 0,3 0,05 0,02—0,04 0,01 5 Менее 1 0,5-1.0 Менее 0.5 [c.392]
В этой главе мы прошли долгий путь рассуждений, начав с рассмотрения сравнительной химии элементов В, С, N и Si. Углерод несомненно играет особую роль, обусловленную наличием у его атомов одинакового числа валентных электронов и орбиталей, отсутствием отталкивающих неподеленных электронных пар и способностью образовывать двойные и тройные связи. Простые алканы, или соединения углерода и водорода, с простыми связями иллюстрируют многообразие соединений, которые может образовывать углерод благодаря своей способности создавать длинные устойчивые цепи. Алкилгалогениды - это своеобразный мостик от алканов с их сравнительно низкой реакционной способностью к изобилию производных углеродов спиртам, простым эфирам, альдегидам, кетоиам, сложным эфирам, кислотам, аминам, аминокислотам и соединениям других типов, которые не обсуждались в данной главе. Способность углерода образовывать двойные и тройные связи была проиллюстрирована на примере алкенов и алкинов, она играет чрезвычайно важную роль при образовании сопряженных и ароматических молекул. [c.337]
Согласно нормативным документам идущий на приготовление кальвадоса спирт яблочный (молодой) при 20°С должен иметь крепость 62 — 70 об.% содержать примесей в 100 мл безводного спирта высших спиртов — 180 — 600 мг сложных эфиров — 50 — 250 летучих кислот — не более 80 альдегидов — не более 50 фурфурола — не более 3 мг метилового спирта — не более 0,15 об.% [22]. [c.166]
Обратимся теперь к результатам исследования некоторых побочных продуктов, содержащихся в оксидате, полученном в реакторе окисления Условно их можно подразделить на такие группы органические кислоты, сложные эфиры, спирты, альдегиды и кетоны, выкипающие при атмосферном давлении между циклогек--саном и циклогексаноном, тяжелокипящие примеси, входящие в состав так называемого масла X (кубового остатка после ректификации) [c.69]
В качестве компонента АН могут быть применены водород, вода, спирты и амины, причем будет происходить, соответственно, гидроформилирование, гидрокарбоксилировапие, гидрокарбалко-ксилирование, гидрокарбамидирование олефинов с получением альдегидов, кислот, сложных эфиров и амидов. [c.27]
В дальнейшем Бреннер с сотр. распространили этот метод и на другие классы органических соединений, применив его для селективного поглощения спиртов, альдегидов, кислот, сложных эфиров и других соединений. Молекулярные сита СаЛ количественно адсорбируют пропан, н-бутан, н-шентан, н-гексан, этилен, пропилен, гексен-2, метанол, этанол, н-бутанол, уксусный, пропионовый и изовалериановый альдегиды, уксусную и про пионовую кислоты. Через колонку с молекулярными ситами СаЛ проходят изобутан, изонентан, 2,3-диме-талбутан, бензол, толуол, ксилол, циклопентан, циклогексан, изобутилен, 2-метилбутадиен-1,3, этилформнат, этилацетат, этилпропионат, ацетон, метилэтилкетон, оксид мезителена, метиленхлорид, хлороформ, изопро-панол, метилбутанол, диэтиловый и диизопропиловый эфиры, тиофен, оксид углерода, метан, диоксид азота, сероуглерод, кислород, азот, нитрометан. Молекулярные сита NaX поглощают все указанные соединения, за исключением газов (азота, кислорода, оксида углерода и метана). Молекулярные сита NaA поглощают только низшие члены гомологических рядов (метан, этилен, пропилен, метанол, этанол, пропанол). Характеристика адсорбционных свойств цеолитов приведена в табл. V-1. [c.147]
Наибольшее распространение получил метод определения спиртов фракции С1—С10, основанный на их взаимодействии с ванадий-( кспхинолпновым комплексом. Отбор проб проводится на активированный уголь. Предел обнаружения 0,5 мг/м при отборе 30 д.м воздуха. Диапазон определяемых концентраций от 0,5 до 10 мг/м . Данный метод обладает высокой чувствительностью, а также избирательностью в присутствии сопутствующих химических веществ (альдегиды, кислоты, сложные эфиры). [c.66]
В этом разделе изучаются номенклатура, строение и свойства большой группы производных углевс1Доро-дов, содержащих кислородсодержащие функциональные группы. Простейшими представителями этой группы являются спирты, поэтому они открывают настс ящий раздел. Далее в нем последовательно рассматриваются фенолы, содержащие такую же функциональную группу, как и спирты, альдегиды, карбоновые кислоты, сложные эфиры, в частности, жиры-триглицериды, углеводы [c.526]
Полный анализ лшдких продуктов синтеза из водяного газа на кобальтовом катализаторе в условиях циркуляции был произведен [62] в 1943 г. в лаборатории завода Лейна . Целью анализа было определить пригодность этого продукта в качестве сырья для оксосинтеза. В табл. 157 приведено содержание спиртов, альдегидов, кислот, сложных эфиров и олефинов в семи фракциях того продукта. По мере повышения температуры кипения содержание олефинов понижается от 43% во фракции С —до 14,5% во фракции 12—С д. Содержание олефинов вычисляли по йодному числу и молекулярному весу фракции. В вышеприведенных таблицах (в частности, в табл. 153—156) величину, обозначенную как содержание олефинов и кислородсодержащих соединений определяли путем обработки масла смесью серной и фосфорной кислот. Для сравнения эта величина введена и в табл. 157 под названием сульфируемые вещества , и разность между нею и содержанием олефинов и кислородсодержащих соединений показывает, что эти величины для низкокипящих фракций заметно отличаются друг от друга. Так как величины графы Сульфируемые вещества выражены в объемных процентах, а другие данные таблицы приведены в весовых процентах, то эти расхождения частично обусловлены разницей удельных весов кислородсо-дернощих соединений и углеводородов. Для фракций, кипящих выше 175°, определение содержание сульфируемых веществ совпадает с содержанием олефинов и кислородсодержащих соединений. [c.321]
Получение бутиловых спиртов гидрированием масляных альдегидов. Сырые масляные альдегиды, полученные оксосинтезом, имеют сложный состав. Основными компонентами этой смеси являются масляный и изомасляный альдегиды, спирты, которые присутствуют в продукте реакции за счет гидрирования альдегидов в процессе карбонилирования пропилена, и растворитель (пентан-гексано-вая фракция, ароматические углеводороды, смесь бутилового и изобутилового спиртов). В меньших количествах присутствуют-кислоты, сложные эфиры (в частности, формиаты и ацетали), простые эфиры и продукты конденсации. Эти примеси гидрируются значительно хуже основных продуктов и многие из них оказывают отравляющее действие на катализатор. Некоторые примеси образуются во время декобальтизации продуктов синтеза. Поэтому принятый способ деко-бальтизации в значительной мере предопределяет выбор катализатора и условий гидрирования. [c.24]
Кислородные соединения топлив чрезвычайно разнообразны по химическому строению и свойствам гидроперекиси, п )екиси, спирты, фенолы, альдегиды, кислоты, простые и сложные эфиры, полнфункциональные соединения. [c.18]
В большинстве случаев разделению подвергают карбоновые кислоты, и если молекула не содержит карбоксильную группу, ее превращают в карбоновую кислоту перед попыткой разделения. Однако превращение в диастереомеры не ограничивается реакциями карбоновых кислот для сочетания с оптически активными реагентами можно использовать и другие функциональные группы [76, 77]. Рацемические основания можно превратить в диастереомерные соли реакцией с активными кислотами, спирты превращают в диастереомерные сложные эфиры [78], альдегиды — в диастереомерные гидразоны и т. д. Даже углеводороды можно превратить в диастереомерные соединения включения, используя мочевину, которая хотя и не хиральна, но имеет структуру клетки [79]. Для разделения смесей энантио-мерных алкильных и арильных аммониевых ионов были использованы хиральные краун-эфиры (разд. 3.2), образующие диастереомерные комплексы [80. В этом случае разделение упрощается благодаря тому, что один из диастереомеров может образовываться значительно быстрее другого. транс-Циклооктен (17) был разделен путем превращения в комплекс платины, содержащий оптически активный амин [81]. [c.159]
Металлический натрий (N3) применяется для высушивания парафиновых, циклопарафиновых, этиленовых и ароматических углеводородов, а также простых эфиров. Предварительно большую часть воды из жидкости или раствора удаляют безводным хлористым кальцием или сернокислым магнием. Применение натрня наиболее эффективно п виде тонкой проволоки, которую выдавливают прямо в жидкость при помощи специального пресса таким путем создается большая поверхность для соприкосновения с жидкостью. Нельзя применять иатрий для высушивания таких соединений, с которыми он реагирует, которым может быть вредна образующаяся щелочь или когда высущиваем.5е соединение может восстанавливаться водородом, выделяющимся при обезвоживании. Следовательно, Нельзя применять натрий для высушивания спиртов, кислот, сложных эфиров, органических галоге-нидов, альдегидов, кетонов и некоторых аминов. [c.41]
Триэтоксиалюмогидрнд лнтия или натрия получают при действии гидрида лития или натрня на триэтилат алюминия [273 274] Их восстанавливающая способность выше, чем у Ь1А [0—С-—(СНя)а]з Оии восстанавливают альдегид ,I и кетоны а также хл0ран1ндрнды кислот, сложные эфиры и ангидриды до спиртов и, кроме того, действуют на нитрилы, из которых при комнатной температуре получаются альдегиды с выходом 80— 90% [2741- [c.238]
Насыгценные альдегиды и кетоны обычно легко восстанавливаются электрохимическим путем. Электрохимическое восстановление карбонильной группы в кислотах, сложных эфирах, амидах и нмидах протекает с большим трудом, а в ряде случаев не идет вообще. Однако иногда из этих соединений удается получить альдегиды или спирты [c.319]
chem21.info
3.6 Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров
Видеоурок 1: Альдегиды и кетоны: Химические свойства
Видеоурок 2: Карбоновые кислоты и их соли: Химические свойства
Лекция: Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров
Химические свойства альдегидов и кетоновАльдегидами называют органические соединения, молекулы которых содержат карбонильную группу, соединенную с атомом водорода и углеводородным радикалом.
Карбонильная (альдегидная) функциональная группа:
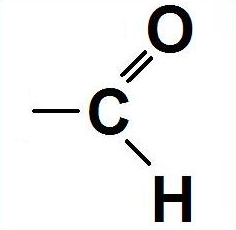
Общая формула альдегидов:
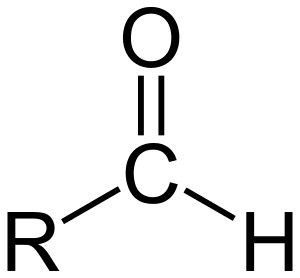
Простейший альдегид метаналь имеет отличную от общей формулы структуру, в ней роль углеводородного радикала играет атом водорода:
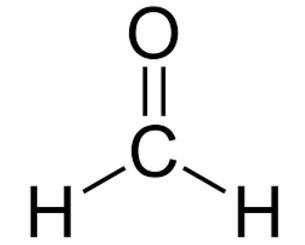
Кетоны – органические соединения, в молекулах которых содержится карбонильная группа, соединенная с двумя углеводородными радикалами.
Общая формула кетонов:
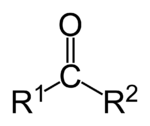
Рассмотрим основные химические свойства данных органических соединений:
При гидрировании альдегидов образуются первичные спирты. К примеру, гидрирование уксусного альдегида в присутствии катализатора никеля и при нагревании образует этиловый спирт:
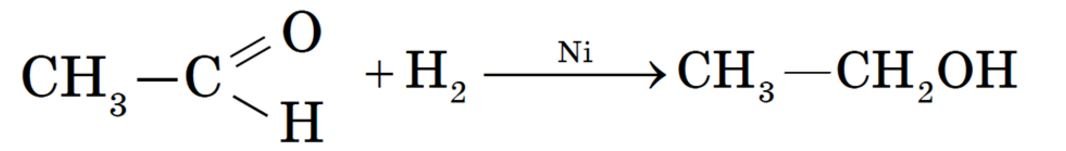
Гидрирование простейшего кетона ацетона в тех же условиях приводит к образованию пропанола-2:

Таким образом, гидрирование кетонов приводит к образованию вторичных спиртов.
- Нуклеофильное присоединение синильной кислоты (HCN) к альдегидам и кетонам образует a-оксинитрилы (циангидрины) - нитрилы оксикислот:
Реакция имеет важное значение в органической химии и решает две задачи: удлинение углеродной цепи и получение гидроксинитрилов для синтеза гидроксикарбоновых кислот.
- Нуклеофильное присоединение гидросульфата натрия (NaHSO3) к альдегидам и метилкетонам (кетонам, имеющим группировку Ch4) образует гидросульфитные производные альдегидов и кетонов:
Образовавшиеся в данной реакции соединения при нагревании с минеральными кислотами или содой разлагаются до первоначальных карбонильных соединений (кристаллических веществ).
Окисление альдегидов происходит легко, даже при таких слабых окислителях, как гидроксид меди или аммиачный раствор оксида серебра и приводит к образованию карбоновой кислоты.
Нагревание гидроксида меди с альдегидом способствует исчезновению изначального голубого окрашивания реакционной смеси, при этом образуется кирпично-красный осадок оксида меди (I):
Н-СОН + 2Cu(OH)2 → HCOOH + Cu2O↓+ 2h3O
В реакции с аммиачным раствором оксида серебра образуется аммонийная соль, а не карбоновая кислота. Это происходит потому что находящийся в растворе аммиак реагирует с кислотами. К примеру, реакция уксусного альдегида с аммиачным раствором оксида серебра:
Ch4-COH + 2[Ag(Nh4)2]OH → Ch4-COONh5 + 2Ag↓ + 3Nh4↑ + h3O
Кетоны в данные реакции не вступают. Поэтому их называют качественными реакциями на альдегиды.
Галогенирование характерно и для альдегидов, и для кетонов. Галоген замещает водород в атоме углерода, находящегося по соседству с карбонильной группой, т.е. галогенирование осуществляется исключительно в α-положение:
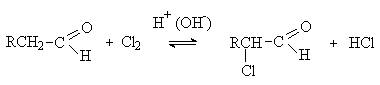 Химические свойства карбоновых кислот
Химические свойства карбоновых кислотКарбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп (—COOH):
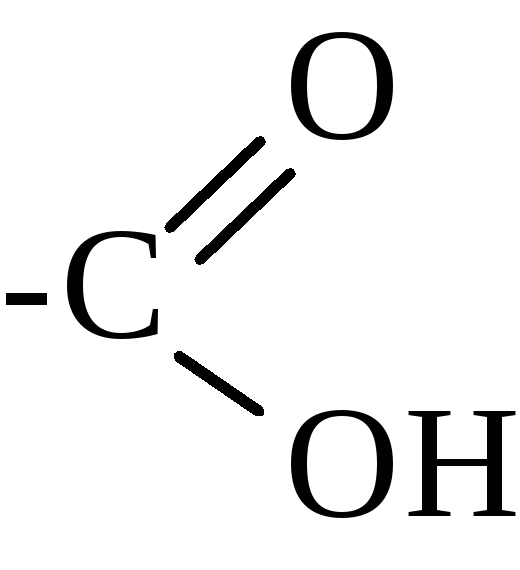
Как видно, карбоксильная группа состоит из карбонильной –С(О)- и гидроксильной групп –ОН. Последняя обладает отрицательным индуктивным эффектом. Поэтому связь О-Н в карбоновых кислотах более полярна, чем в спиртах и фенолах. Поэтому кислотные свойства карбоновых кислот больше.
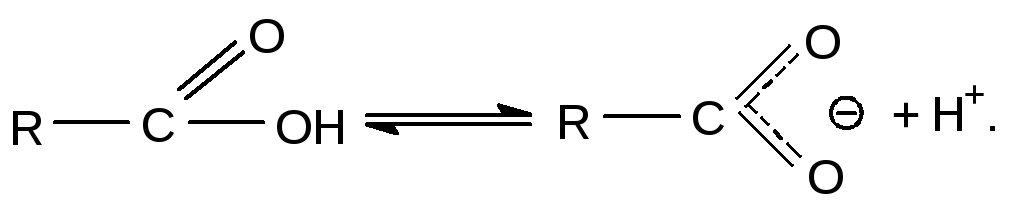
Реагируют с металлами, располагающимися в электрохимическом ряду до Н, в результате чего образуются соли:
2R-COOH + 2Na → 2R-COONa + h3↑
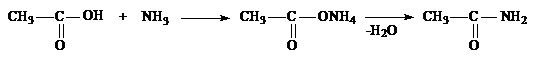
Реагируют с оксидами, с образованием соли и воды. К примеру, реакция уксусной кислоты и оксида кальция:
2Ch4COOH + CaO → (Ch4COO)2Ca + h3O
Реагируют с гидроксидами металлов - реакция нейтрализации. К примеру, реакция уксусной кислоты и гидроксида калия:
Ch4COOH+KOH → Ch4COOK+h3O
Реагируют с солями более слабых кислот – карбонатами и гидрокарбонатами, сульфидами и гидросульфидами, солями высших (с большим числом атомов углерода в молекуле) кислот. К примеру, реакция уксусной кислоты и карбоната натрия:
2СН3СООН + Na2CO3→ h3O + CO2 + 2Ch4COONa
Уксусная кислота вытеснила угольную кислоту из раствора ее соли. Угольная кислота является непрочным соединением, поэтому распалось на углекислый газ и воду.
Следует помнить, что сильные минеральные кислоты, вытесняют карбоновые кислоты из их солей.
Реакция этерификации с одноатомными и многоатомными спиртами в присутствии сильных неорганических кислот образует сложные эфиры. К примеру, реакция муравьиной кислоты с этанолом, в присутствии конц.серной кислоты и при нагревании, образует этиловый эфир муравьиной кислоты и воду:

Как видите, реакция эта обратимая и для того, чтобы сместить равновесие в сторону образования сложного эфира необходимо провести реакцию с избытком одного из реагирующих веществ, или связывают одно из веществ, образовавшихся в ходе реакции (эфир или воду). Обратная этерификация - гидролиз сложного эфира, приведет к образованию кислоты и спирта.
Реакции присоединения для предельных карбоновых кислот нехарактерны.
Химические свойства сложных эфировСложные эфиры - это производные карбоновых кислот, у которых гидроксил в карбоксиле замещен спиртовым остатком:
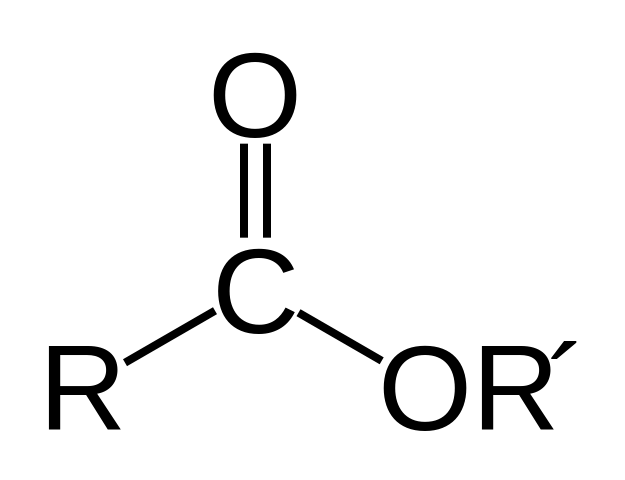
- Гидролиз - реакция обратная этерификации, является основной для сложных эфиров реакцией. Имеет общий вид:
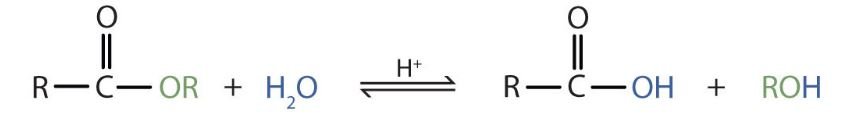
Гидролиз сложных эфиров в щелочной среде называется омылением:
cknow.ru
Альдегиды - n1.doc
приобрестиАльдегидыскачать (122.5 kb.)Доступные файлы (1):n1.doc
| Реферат по органической химии |
| Альдегиды |
| Строение. Номенклатура. Изомерия. Способы получения. Свойства. Применение. |
| 01.12.2009 |
СОДЕРЖАНИЕ
| Введение………………………………………………………………...
Литература……………………………………………………………… | 2 4 7 9 18 20 21 |
ВВЕДЕНИЕ.Производство органических веществ зародилось очень давно, но первоначально оно базировалось на переработке растительного или животного сырья – выделение ценных веществ (сахар, масло) или их расщепление (мыло, спирт и т. д.). Получение более сложных веществ из простых (т. е. органический синтез) зародилось в середине XIX века на основе побочных продуктов коксования каменного угля, содержавших ароматические соединения. Затем, уже в XX веке как источники органического сырья стали играть нефть и природный газ.
В своем развитии промышленность органического синтеза разделилась на ряд отраслей, среди которых важное место занимает промышленность основного органического и нефтехимического синтеза. Продукты этой отрасли отличаются большим многообразием строения , свойств и областей применения. Это различные углеводороды, хлор- и фторпроизводные, спирты и фенолы, простые эфиры, альдегиды и кетоны, карбоновые кислоты и их производные, амины и нитросоединения, вещества, содержащие серу и фосфор, и т. д. По назначению они подразделяются на две группы: промежуточные продукты для синтеза других веществ и продукты целевого применения.
Альдегиды – это органические соединения, содержащие карбонильную группу, связанную с атомом водорода. Альдегиды играют большую роль в биологических процессах. Широко применяются в синтезе полимеров (например, полиформальдегида, поливинилацеталей, различных смол), карбоновых кислот, в производстве пестицидов и т. д. В медицинской практике применяются как непосредственно альдегиды (формалин, паральдегид и др.), так и их производные - гексаметилентетрамин (уротропин), хлоралгидрат и др. Альдегиды токсичны. Пары их оказывают резкое раздражающее действие на слизистые оболочки глаз и верхних дыхательных путей, одновременно альдегиды действуют наркотически. Наибольшее токсикологическое значение имеют формальдегид и акролеин.
- СТРОЕНИЕ, НОМЕНКЛАТУРА И ИЗОМЕРИЯ
Слово "альдегид" буквально означает "спирт, лишенный водорода" (от лат. alcohol dehydrogenatus), т. е. окисленный спирт.
Альдегиды представляют собой производные углеводородов, в молекулах которых имеется карбонильная группа, называемая также карбонилом — С—
О
Альдегидами называют соединения с карбонильной группой, в которых атом углерода этой группы связан, по крайней мере, с одним атомом водорода. Строение альдегидов можно представить следующей общей формулой: R— С —Н
О
Характерное для альдегидов сочетание карбонильной группы с водородом — СН = О, называют альдегидной группой. По международной номенклатуре карбонильная группа называется также оксогруппой, а альдегиды – соответственно оксосоединениями. В зависимости от строения углеводородных радикалов альдегиды бывают алифатическими, алициклическими и ароматическими.
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2-гибридизации. Углерод своими sp2-гибридными орбиталями образует 3 -связи (одна из них - связь С–О), которые располагаются в одной плоскости под углом около 120° друг к другу. Одна из трех sp2-орбиталей кислорода участвует в -связи С–О, две другие содержат неподеленнные электронные пары. p-Связь образована р-электронами атомов углерода и кислорода.
Связь С=О сильно полярна. Ее дипольный момент (2,6-2,8D) значительно выше, чем у связи С–О в спиртах (0,70D). Электроны кратной связи С=О, в особенности более подвижные p-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд.
Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе Н+.
В молекулах альдегидов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) - газ, альдегиды С2–C5 - жидкости, высшие - твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
Изомерия альдегидов связана со строением радикалов. Альдегиды называют или по кислотам, в которые они переходят при окислении ( с тем же количеством углеродных атомов), или по предельным углеводородам с добавлением суффикса -аль.
Простейший альдегид содержит один атом углерода – это муравьиный альдегид или формальдегид (метаналь):
Н — С — Н или Н —СН = О или СН2 = О
О
Это единственный альдегид, в котором карбонильная группа связана с двумя водородными атомами. Все другие альдегиды имеют строение, соответствующее приведенной выше общей формуле.
Альдегид, содержащий в молекуле два углеродных атома - это уксусный альдегид или ацетальдегид (этаналь): СН3 — С — Н
О
Альдегид, содержащий три углеродных атома - это пропионовый альдегид или пропиональдегид (пропаналь): СН3— СН2— С— Н
О
Альдегиды с четырьмя углеродными атомами, состав которых можно представить формулой С3Н7—СН = О, называют масляными альдегидами (бутаналь), они существуют в виде двух изомеров, различающихся строением углеродного скелета: масляный альдегид и изомасляный альдегид
СН3
СН3— СН2— СН2— С—Н СН3— СН— С— Н
О О
Альдегидная группа может быть образована только первичным углеродным атомом, поэтому она всегда расположена на конце углеродной цепи молекулы альдегида. Альдегиды С4Н9—СН=О с пятью углеродными атомами (четыре изомера) называются валериановыми альдегидами.2. СПОСОБЫ ПОЛУЧЕНИЯ
1 - Окисление или каталитическое дегидрирование (отщепление водорода) первичных спиртов. Кислород воздуха окисляет спирты только при высокой температуре., при этом они горят. Первичные спирты, имеющие при спиртовом углероде два атома водорода, при окислении образуют альдегиды – вещества, в которых карбонильная группа соединена с водородом и с углеводородным радикалом, например:
СН3—СН2—ОН ? СН3—СН=О+Н2О
этиловый спирт уксусный альдегид
При пропускании паров первичных спиртов над поверхностью накаленных мелкораздробленных металлов (медь, железо) от спиртового углерода и кислорода гидроксильной группы отщепляются атомы водорода. При этом образуются газообразный водород и из первичного спирта – альдегид:
СН3—СН2—ОН ? СН3—СН=О+Н2
этиловый спирт уксусный альдегид
Формальдегид получают из метилового спирта путем каталитического окисления его кислородом воздуха или путем дегидрирования (отщепления водорода):
2СН3—ОН+О2 ? 2СН2=О+2Н2О
СН3—ОН ? СН2=О+Н2
Эти реакции протекают при пропускании паров метилового спирта над нагретыми катализаторами.
2 - Гидролиз дигалогенпроизводных, т. е. действие воды на дигалогенпроизводные углеводороды, в которых оба атома галогена находятся при одном углеродном атоме. Предполагают, что при этом вначале образуются двуатомные спирты с двумя гидроксилами при одном углероде; но, как уже известно,они неустойчивы и в момент образования выделяют воду и преращаются в соединения с карбонильной группой. Реакция ускоряется в присутствии щелочей. Из дигалогенпроизводных с галогеном при первичном углероде образуются альдегиды.
О Н
СН3 — СНСl2 ? CН3—СН ? СН3—СН=О
ОН
1,1 дихлорэтан уксусный альдегид
3 - Гидратация ацетиленовых углеводородов, т. е. присоединение воды к углеводородам с тройной связью. Уксусный альдегид получается присоединением воды к ацетилену в присутствии солей ртути в качестве катализатора:
СН ? СН+Н2О ? СН3—СН=О
ацетилен уксусный альдегид
Эта реакция называется реакцией Кучерова. Уксусный альдегид затем может быть окислен в уксусную кислоту, его используют и для многих других синтезов.
4 - Оксосинтез, т. е. присоединение окиси углерода и водорода к углеводородам ряда этилена при 100-200° С и под давлением1-2*107 Па (100-200 атм) в присутствии кобальтового или никелевого катализаторов. Так из пропилена может быть получена смесь масляного и изомасляного альдегидов:
?СН3—СН2—СН2—СН=О
СН3 — СН=СН2+СО+Н2 — масляный альдегид
пропилен ?СН3—СН—СН3
СН=О
изомасляный альдегид
Исходную смесь газов под высоким давлением пропускают над нагретым катализатором, содержащим кобальт. В качестве сырья используют этиленовые углеводороды из газов переработки нефти, а также водяной или синтез-газ. Образующие альдегиды могут быть восстановлены в соответствующие первичные спирты или окислены в кислоты.
3. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА.
- физические свойства:
Первый представитель альдегидов формальдегид – газообразное вещество, ацетальдегид – уже легколетучая жидкость, следующие гомологи – жидкости, температура кипения которых по мере увеличения числа атомов углерода в молекулах закономерно возрастают. Карбонильная группа обуславливает высокую реакционную способность альдегидов. Кипят они при более низкой температуре, чем соответствующие спирты, например пропионовый альдегид при 48,8 °С, а пропиловый спирт - при 97,8 °С. Плотность альдегидов меньше единицы. Муравьиный и уксусный альдегиды хорошо растворяются в воде, последующие - хуже. Низшие альдегиды имеют резкий, неприятный запах, некоторые высшие - приятный запах. Высшие по числу углеродных атомов – альдегиды – твердые вещества. Формальдегид и ацетальдегид хорошо растворяются в воде, растворимость последующих гомологов постепенно падает.
- химические свойства:
Благодаря наличию в молекулах альдегидов карбонильной группы эти вещества очень активны в химических реакциях.
* Реакции окисления:
Альдегиды окисляются очень легко; это обусловлено тем, что в их молекулах при уже окисленном углеродном атоме карбонильной группы имеется водород, который под действием различных окислителей (и даже кислорода воздуха) окисляется, образуя группу – ОН. Таким образом, альдегидная группа превращается в карбоксильную, и альдегиды, следовательно, окисляются в карбоновые кислоты с таким же, как в исходном альдегиде, числом углеродных атомов.
R—C—H ? R—C—OH или
О О
альдегид кислота
СН3—С—Н ? СН3—С—ОН
О О
уксусный альдегид уксусная кислота
Окисление альдегидов оксидом серебра в аммиачном растворе. Аммиачный раствор окиси серебра [Ag(Nh4)2]OH при легком нагревании с альдегидами окисляет альдегид в кислоту с образованием свободного металлического серебра (реакция "серебряного зеркала"). Таким образом, при нагревании оксид серебра окисляет альдегид и сам восстанавливается до чистого серебра, восстановленное серебро, покрывая стенки сосуда тонким слоем, образует серебряное зеркало.
R — C — H + AgO ? R — C — OH + 2Ag
O O
Альдегид кислота
В технике эту реакцию используют для серебрения зеркал и елочных игрушек.
Окисление альдегидов гидроксидом меди. Свежеосажденный голубого цвета осадок гидрата меди при нагревании с альдегидами, в результате окисления последних и восстановления окиси меди, превращается в осадок закиси меди кирпично-красного цвета. Часто для проведения этой реакции используют жидкость Фелинга - смесь растворов сульфата меди со щелочным раствором винной кислоты. При нагревании с альдегидом синий цвет реактива исчезает и выпадает осадок закиси меди.
R—C—H+2Cu(OH)2?R—C—OH+Cu2O?+2h3O
O O
альдегид кислота
* Реакции присоединения к карбонильной группе:
За счет двойной связи карбонильной группы альдегиды вступают в различные реакции присоединения.
Восстановление альдегидов. Присоединение водорода к альдегидам происходит в присутствии катализаторов гидрирования (Ni, Cu, Pt, Pd и др.) При этом альдегиды переходят в первичные спирты. На этом основан один из методов получения спиртов:
О
Ch4 — C ? Ch4 — Ch3 — OH
Н
уксусный альдегид этиловый спирт (первичный)
Эту реакцию можно осуществить, пропуская над мелкораздробленным никелем, платиной или палладием смесь водорода с парами альдегида или действуя водородом в момент выделения.
Присоединение синильной кислоты. Альдегиды присоединяют к карбонильной группе синильную кислоту. При этом образуются
?-оксинитрилы, в них оксигруппа (—ОН) находится при углероде, соседнем с нитрильной группой (остатком синильной кислоты
—С ? N), т.е. в ? – положении.омылением которых получают ? -оксикислоты.
Ch4—CH—C ? N ? Ch4—CH—C? N
O H OH
уксусный синильная ?-оксинитрил
альдегид кислота
Присоединение воды. Образуются гидраты альдегида, водород воды присоединяется к карбонильному кислороду, а гидроксил – к углероду. Это двухатомный спирт. Но такие спирты неустойчивы: образуясь при реакциях, они выделяют воду и превращаются в соединения с карбонильной группой.
R—CH OH R—CH—OH
O H OH
Альдегид гидрат альдегида
Поэтому гидраты альдегидов существуют в основном в водном растворе. Реакция обратима.
Взаимодействие со спиртами. Образуются полуацетали (неполные простые эфиры двухатомных спиртов гидратов альдегидов, т.е. не существующих в свободном виде, они неустойчивы: разлагаются на исходные спирт и альдегид, и реакция их образования обратима) и ацетали (полные простые эфиры – получаются при нагревании альдегидов со спиртами в присутствии катализатора (сухого хлористого водорода).
Например:
СН3 — СН СН3 — СН — О — СН2 — СН3
О ОН
уксусный альдегид полуацеталь
СН3 — СН — О — СН2 — СН3 + Н2О
О—СН2—СН3
Диэтилацеталь уксусного альдегида
Ацетали, в отличии от неустойчивости полуацеталий, устойчивы и могут быть выделены в чистом виде. Это обычно приятно пахнущие, трудно растворимые в воде жидкости. Их используют в парфюмерии и в виноделии.
Бисульфитная реакция. Присоединяется молекула бисульфита натрия NaHSO4, образуя кристаллические бисульфитные производные.
R—CH SO3Na R—CH — SO3Na
O H OH
Альдегид бисульфитное производное
Реакцию с бисульфитом применяют для выделения альдегидов из различных смесей. Образующееся бисульфитное производное можно отделить, а затем разложить кислотой или щелочью; при этом вновь выделяется альдегид.
Реакция на альдегиды с фуксинсернистой кислотой. Краситель красного цвета – фуксин, при насыщении его раствора газообразным сернистым ангидридом (SO2) образует бесцветные раствор фуксинсернистой кислоты. Этот реактив при взаимодействии с альдегидами дает красно-фиолетовое окрашивание, что является качественной реакцией на альдегидную группу.
* Реакция замещения кислорода карбонильной группы:
Замещение кислорода галогеном. При действии пятихлористого (PCl5)
или пятибромистого (PBr5) фосфора альдегиды кислород карбоксильной группы замещается двумя атомами галогена. Например:
СН3 —СН2—СН = О + PCl5 ? Ch4—Ch3—CHCl2 + POCl3Пропионовый альдегид 1,1 дихлорпропан хлорокись фотографа;Образуются дигалогенпроизводные, в которых оба атома галогена находятся при одном углеродном атоме.* Реакции за счет углеводородного радикала:
Альдегиды вступают в реакции не только при участии их карбонильной группы, но и при участии связанных с ней углеводородных радикалов.
Замещение водорода в радикале на галоген. Водородные атомы в радикалах альдегидов замещаются на галоген легче, чем в предельных углеводородах, при этом в первую очередь галоген замещает подвижные атомы водорода в ?-положении к карбонильной группе.
СН3—СН2—СН2—СН = О ?СН3—СН2—СН—СН = О+НСl
Сl
Реакции на двойную связь для непредельных альдегидов.
Подобно этиленовым углеводородам непредельные альдегиды дают характерные реакции на этиленовую двойную связь. Например, они обесцвечивают раствор брома; с непредельным альдегидом – акролеином реакция протекает по схеме:
СН2 = СН2 — СН ? СН2 — СН — СН
О Вr Br О
Акролеин ?, ? -дибромпропионовый альдегидПрисоединение галогеноводородов к непредельным альдегидам, в которых карбонильная группа непосредственно связана с этиленовой группировкой, протекает так, что галоген присоединяется к углероду в ?-положении к карбонильной группе. Так, бромистый водород присоединяется к акролеину по схеме:
СН2 = СН—СН ? СН2—СН2—СН
О Вr О
Акролеин ? -бромпропионовый альдегид* Межмолекулярные реакции:
Для соединений с карбонильной группой, особенно для альдегидов, характерны межмолекулярные реакции, при которых происходит взаимодействие (уплотнение) нескольких или многих молекул с образованием продуктов, обладающих большим молекулярным весом.
Полимеризация альдегидов. Альдегиды, особенно их низшие представители, очень склонны к полимеризации. Реакция идет с разрывом двойных связей альдегидных групп, причем атомы карбонильного кислорода одной молекулы альдегида соединяются с атомами карбонильного углерода другой молекулы. Число молекул, участвующих в образовании полимерной цепи (число n), зависит от условий полимеризации и природы альдегида. Формальдегид образует полимеры – полиформальдегиды с различной степенью полимеризации (с различной величиной n), обладающие разнообразными свойствами. Склонность к полимеризации с образованием линейных полимеров проявляется также у уксусного альдегида, но не характерна для других альдегидов. Альдегиды полимеризуются и с образование не очень сложных циклических полимеров. Так, из уксусного альдегида под влиянием минеральных кислот образуется жидкий циклический тример (полимер, образованный тремя молекулами мономера), называемый паральдегидом.
Описанные процессы полимеризации обратимы, особенно в присутствии следов минеральных кислот, они деполимеризуются и распадаются на молекулы исходного альдегида.Альдольная и кротоновая конденсация.
Реакциями конденсации обычно называют различные процессы уплотнения органических молекул, приводящие к образованию более сложных соединений в результате возникновения новых связей между углеродными атомами.
Например, конденсация уксусного альдегида под влиянием разбавленных щелочей, при которой в реакцию вступают две молекулы альдегида, одна реагирует своей карбонильной группой, а вторая – углеродным атомом в ?-положении к карбонильной группе, содержащим подвижный атом водорода, по схеме
СН3—СН СН2—СН ? СН3—СН—СН2—СН
О Н О ОН О
уксусный уксусный альдоль
альдегид альдегид В результате возникает новая С—С - связь и образуется вещество, содержащее одновременно альдегидную и спиртовую группы, оно было названо альдолем (альдегидоалкоголь), а конденсация карбонильных соединений, протекающая по такому пути, назавается реакцией адольной конденсации. В природе сложный процесс фотосинтеза углеводов в растениях проходит через стадию альдольной конденсации.
При соответствующих условиях реакция альдольной конденсации двух молекул альдегида не останавливается на образовании альдоля; она может протекать дальше с отщеплением воды за счет подвижного водорода в a-положении к карбонильной группе и гидроксила при b-углеродном атоме (т.е. при втором от карбонильной группы). В этом случае, в результате взаимодействия двух молекул альдегида, через альдоль образуется непредельный альдегид.
СН3—СН—СН2—СН?СН3—СН—СН—СН?СН3—СН = СН—СН + Н2О
О Н О ОН Н О О
уксусный альдегид альдоль непредельный (кротоновый)
альдегид
Из уксусного альдегида, таким образом, получается кротоновый альдегид, от названия которого конденсация молекул карбонильных соединений, протекающая с выделением воды и образованием непредельных карбонильных соединений, получила название кротоновой конденсации. Конденсация этого типа уже не может быть отнесена к реакциям полимеризации, так как новое, более сложное вещество образуется с выделением воды, и его молекулярный вес не является суммой молекулярных весов исходных молекул.
Альдегиды вступают в реакции конденсации и с соединениями других классов, например с фенолами, ароматическими аминами и другими. На этом основано, в частности, очень важное использование их в промышленности пластических масс.
Сложноэфирная конденсация альдегидов (реакция Тищенко (1906 г)).
Это особый вид межмолекулярного взаимодействия альдегидов. Под влиянием алкоголята алюминия две молекулы, например уксусного альдегида взаимодействуют следующим образом:
Ch4—C—H + O = CH—Ch4 ? Ch4—C—O—Ch3—Ch4
O O
уксусный альдегид уксусный альдегид сложный эфир (этилацетат)
Одна молекула присоединяется к карбонильной группе второй молекулы и образуется сложный эфир. Поэтому реакции такого типа и называются сложноэфирной конденсацией. Сложные эфиры при гидролизе распадаются с образованием спирта и кислоты. Из этого следует, что при сложноэфирной конденсации по существу одна молекула альдегида восстанавливает вторую в спирт, а сама при этом окисляется в кислоту. Сложноэфирная конденсация имеет важное значение в ряде биохимических процессов (например, в процессах брожения).4. ПРИМЕНЕНИЕ.Формальдегид. Первым членом гомологического ряда предельных альдегидов является формальдегид СН2=О. Его называю также метаналь и муравьиный альдегид. Он представляет собой бесцветный газ с характерным резким запахом. Обладает антисептическими, а также дубящими свойствами. Хорошо растворяется в воде. Водный раствор с массовой долей формальдегида 30-40% называется формалином. Формалин является хорошим дезинфицирующим и консервирующим средством. При длительном стоянии водных растворов формальдегида, особенно при низких температурах, а также при упаривании в них осаждается белый осадок – полимер формальдегида состава (СН2О)n, который называют параформальдегидом (или параформом). Он представляет собой смесь низкомолекулярных полиформальдегидов с величиной n от 10 до 50. При нагревании до 140-160 С параформальдегид деполимеризуется и превращается в газообразный формальдегид; процесс ускоряется в присутствии кислот. Вырабатывают формальдегид в больших количествах, он применяется в производстве пластмасс. Полиформальдегид с большим молекулярным весом – ценный синтетический материал, используемый в качестве заменителя металлов. В кожевенной промышленности формальдегид применяется для дубления кожи, в медицине и санитарии – для дезинфекции. В сельском хозяйстве формальдегид используется для протравливания семян перед посевом (уничтожают паразитические споры). Так как формальдегид образуется при неполном сгорании различных органических веществ, то он содержится в дыме угля, дерева; на этом основано консервирующее действие дыма при получении мясных и рыбных копченостей.
Большое количество метаналя используется для получения фенолформальдегидной смолы, которую получают при взаимодействии метаналя с фенолом. Эта смола необходима для производства различных пластмасс. Пластмассы, изготовленные из фенолформальдегидной смолы в сочетании с различными наполнителями, называются фенопластами. При растворении фенолформальдегидной смолы в ацетоне или спирте получают различные лаки.
При взаимодействии метаналя с карбамидом СО(МНг)2 получают карбамидную смолу, а из нее — аминопласты. Из этих пластмасс изготовляют микропористые материалы для нужд электротехники.
Метаналь идет также на производство некоторых лекарственных веществ и красителей.
Особенно широко применение альдегидов в медицине. Это и выше описанный формалин, формидрон (жидкость для протирания кожи при повышенной потливости), мазь формальдегидная, лизоформ (применяют в гинекологии), уротропин ( при инфекционных процессах мочевыводящих путей), уросал, кальцекс, циминаль ( при лечеии ран, ожогов).
Ацетальдегид. Ацетальдегид (этаналь, уксусный альдегид)
СН3СОН представляет собой бесцветную жидкость с резким запахом. Хорошо растворяется в воде. В больших количествах вырабатывается химической промышленностью. Основное количество вырабатываемого ацетальдегида окисляют до уксусной кислоты. Еще получают этиловый спирт, бутиловый спирт, ацетали и ряд других веществ. Ацетальдегид используется и для получения других органических продуктов, в том числе полимеров. Подобно формальдегиду, он конденсируется с фенолом, аминами и другими веществами, образуя синтетические смолы, которые используются в производстве различных пластмасс.ЗАКЛЮЧЕНИЕ.
Человек не знакомый с органической химией и в частности со свойствами, особенностями, применением альдегидов может быть поражен насколько наша жизнь зависит от группы этих веществ.
Благодаря тому, что получение альдегидов возможно различными простыми и доступными способами, мы не испытываем недостатка во многих предметах необходимых для нашего существования. Можно привести огромное число примеров. Вот только некоторые из них: альдегиды необходимы для получения пластмасс, лаков, лекарственных веществ, красителей, уксусной кислоты. Так же они находят применение в медицине и электротехнике, парфюмерии и кулинарии.
ЛИТЕРАТУРА.
- А.А. Петров, Х.В. Бальян, А.Т. Трощенко, Органическая химия. М. «Высшая школа»,1981.
- А.П. Писаренко, З.Я. Хавин, Курс органической химии, М. «Высшая школа», 1975.
- Н.Л. Глинка, Общая химия, Ленинград, «Химия», 1984.
- Г.Б. Шульпин. Химия для всех. М.:Знание,1987
- О.С. Габриелян, Химия, учебник для общеобразовательных учреждений, М. «Дрофа», 2007.
- И.И. Грандберг, Органическая химия, М., «Дрофа», 2001 г.
nashaucheba.ru




















