Содержание
Жиры | CHEMEGE.RU
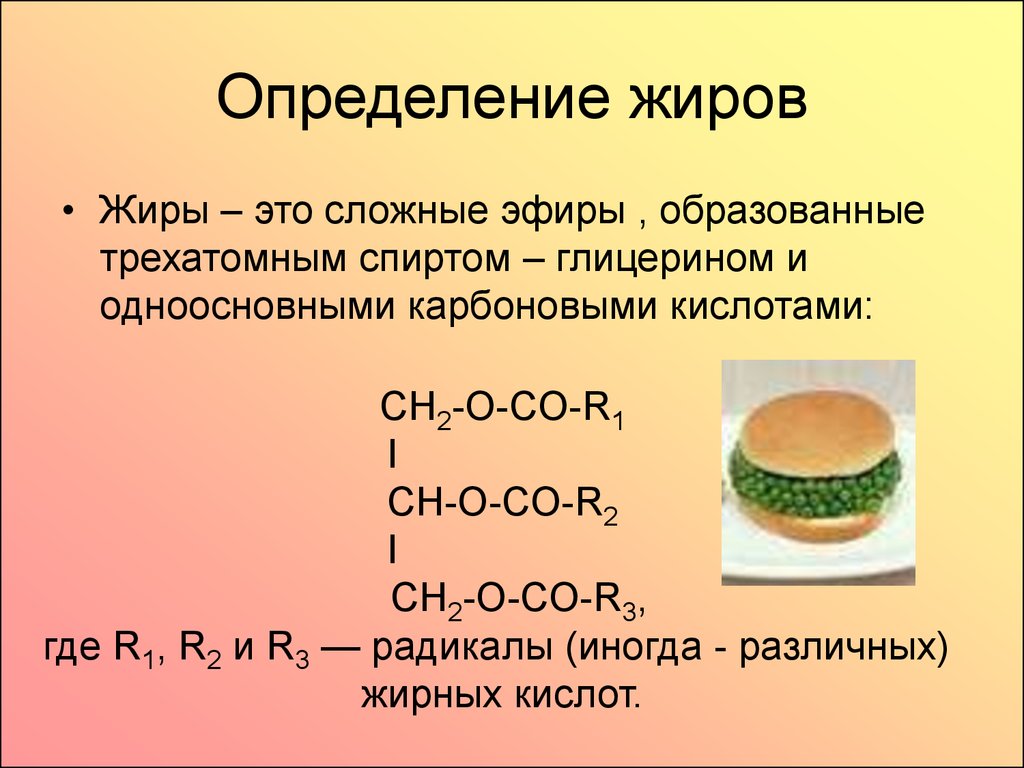
| Жиры – это сложные эфиры, образованные глицерином и высшими одноосновными карбоновыми кислотами (жирными кислотами). . |
Жиры образуются при взаимодействии глицерина и высших карбоновых кислот:
| Жирные (высшие) кислоты | |
| Предельные кислоты | Непредельные кислоты |
| Масляная кислота С3Н7 -СООН | Олеиновая кислота С17Н33СООН (содержит одну двойную связь в радикале) СН3—(СН2)7—СН = СН—(СН2)7—СООН |
| Пальмитиновая кислота С15Н31 — СООН | Линолевая кислота С17Н31СООН (две двойные связи в радикале) |
| Стеариновая кислота С17Н35 — СООН | Линоленовая кислота С17Н29СООН (три двойные связи в радикале) СН3СН2СН=CHCH2CH=CHCH2CH=СН(СН2)4СООН |
Общее название жиров – триацилглицерины (триглицериды).
Существует несколько способов назвать молекулу жира.
Например, жир, образованный тремя остатками стеариновой кислоты, будет иметь следующие названия:
Жиры растворимы в органических растворителях и нерастворимы в воде. С водой жиры не смешиваются.
| Животные жиры — предельные | Растительные жиры (масла) — непредельные |
| Твёрдые, образованы предельными кислотами – стеариновой и пальмитиновой. Все животные жиры, кроме рыбьего – твёрдые. | Жидкие, образованы непредельными кислотами – олеиновой, линолевой и другими. Все растительные жиры, кроме пальмового масла – жидкие. |
1. Гидролиз (омыление) жиров
Жиры подвергаются гидролизу в кислой или щелочной среде или под действием ферментов.
1. 1. Кислотный гидролиз
1. Кислотный гидролиз
Под действием кислот жиры гидролизуются до глицерина и карбоновых кислот, которых входили в молекулу жира.
| Например, при гидролизе тристеарата глицерина в кислой среде образуется стеариновая кислота и глицерин |
1.2. Щелочной гидролиз — омыление жиров
При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира.
| Например, при гидролизе тристеарата глицерина гидроксидом натрия образуется стеарат натрия. |
2. Гидрирование (гидрогенизация) ненасыщенных жиров
Гидрогенизация жиров — это процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жира.
При этом остатки непредельных кислот переходят в остатки предельных, жидкие растительные жиры превращаются в твёрдые (маргарин).
| Например, триолеат глицерина при гидрировании превращается в тристеарат глицерина: |
| Количественной характеристикой степени ненасыщенности жиров служит йодное число, показывающее, какая масса йода может присоединиться по двойным связям к 100 г жира. |
3. Мыло и синтетические моющие средства
При щелочном гидролизе жиров образуются мыла – соли высших жирных кислот.
Стеарат натрия – твёрдое мыло.
Стеарат калия – жидкое мыло.
Моющая способность мыла зависит от жесткости воды. Оно хорошо мылится и стирает в мягкой воде, плохо стирает в жёсткой воде и совсем не стирает в морской воде, так как содержащие в ней ионы Ca2+ и Mg2+ образуют с высшими кислотами нерастворимые в воде соли.
| Например, стеарат глицерина взаимодействует с сульфатом кальция |
Поэтому наряду с мылом используют синтетические моющие средства.
Их производят из других веществ, например из алкилсульфатов — солей сложных эфиров высших спиртов и серной кислоты.
Спирт реагирует с серной кислотой с образованием алкилсульфата.
Далее алкилсульфат гидролизуется щелочью:
Эти соли содержат в молекуле от 12 до 14 углеродных атомов и обладают очень хорошими моющими свойствами. Кальциевые и магниевые соли этих веществ растворимы в воде, а потому такие мыла моют и в жесткой воде. Алкилсульфаты содержатся во многих стиральных порошках.
Понравилось это:
Нравится Загрузка…
Жиры и углеводы 9 класс онлайн-подготовка на Ростелеком Лицей
Состав и строение жиров
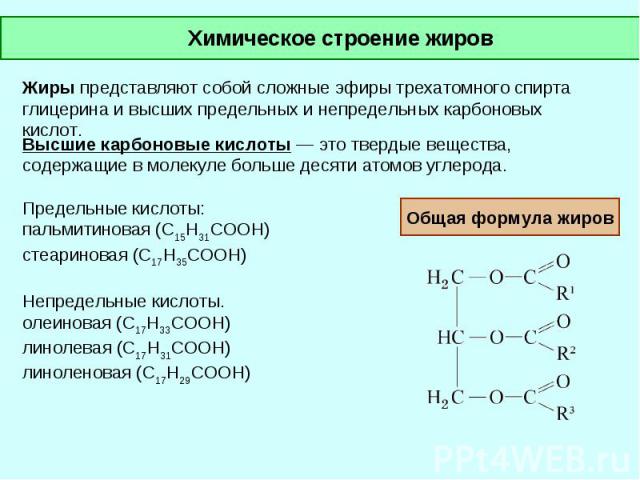
Жиры – это сложные эфиры глицерина и высших жирных карбоновых кислот. Общая формула жиров выглядит следующим образом:
Твердые жиры образованы преимущественно высшими предельными карбоновыми кислотами – стеариновой С17Н35СООН, пальмитиновой С15Н31СООН и некоторыми другими.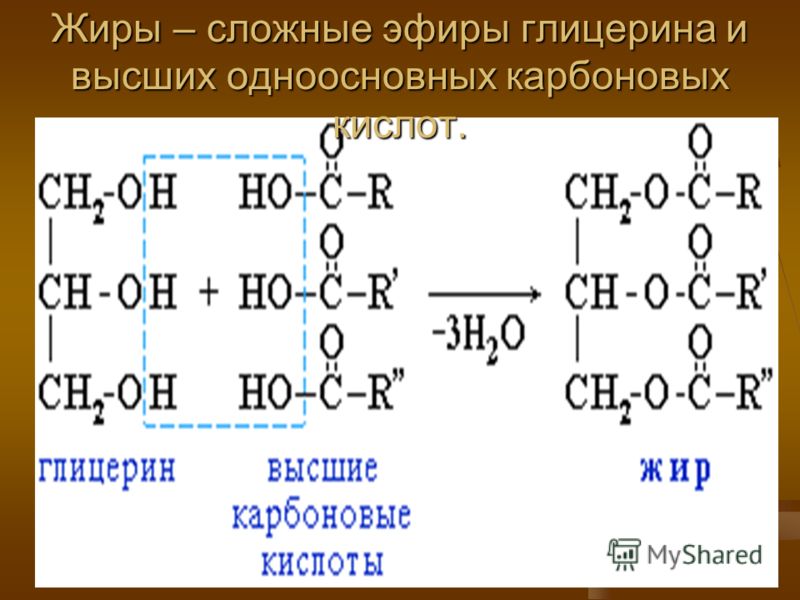
Жидкие жиры образованы высшими непредельными карбоновыми кислотами – олеиновой С17Н35СООН, линолевой С17Н31СООН и линоленовой С17Н29СООН. Названия жиров образуются прибавлением окончания —ат. Например, тристеарат, трипальмиат.
В зависимости от происхождения жиры делят на животные и растительные (см. рис. 1).
Рис. 1. Животные и растительные жиры
Жиры животного происхождения твердые. Исключением является рыбий жир. Жиры растительного происхождения жидкие. Их называют маслами. Исключением является кокосовое масло.
Углеводы
Углеводы используются с глубокой древности. Самым первым углеводом (точнее, смесью углеводов), с которым познакомился человек, был мед. Крахмал был известен еще древним грекам. Родиной сахарного тростника является северо-западная Индия – Бенгалия. Европейцы познакомились с тростниковым сахаром благодаря походам Александра Македонского в 327 г. до н.э. Свекловичный сахар в чистом виде был открыт лишь в 1747 г. немецким химиком А. Маргграфом. Целлюлоза, как составная часть древесины, используется с глубокой древности.
до н.э. Свекловичный сахар в чистом виде был открыт лишь в 1747 г. немецким химиком А. Маргграфом. Целлюлоза, как составная часть древесины, используется с глубокой древности.
Название «углеводы» возникло в связи с тем, что химический состав большинства соединений этого класса выражается общей формулой Сn(Н2О)m. Но оказалось, что такое название является неточным, потому что были найдены углеводы, состав которых не отвечает этой формуле.
Глюкоза
Формула глюкозы – С6Н12О6. Она относится к моносахаридам. Это бесцветное кристаллическое вещество, хорошо растворимое в воде. Ее иногда называют виноградным сахаром: она содержится в фруктах, меде, а в очень малом количестве – в крови человека и животных. В молекуле глюкозы имеются различные функциональные группы. Она проявляет свойства как альдегидов, так и многоатомных спиртов. Установлено, что у третьего атома углерода группа ОН расположена иначе, чем у других атомов С, и распространенное строение глюкозы выглядит так:
Важным химическим свойством глюкозы является ее брожение под действием ферментов, вырабатываемых микроорганизмами.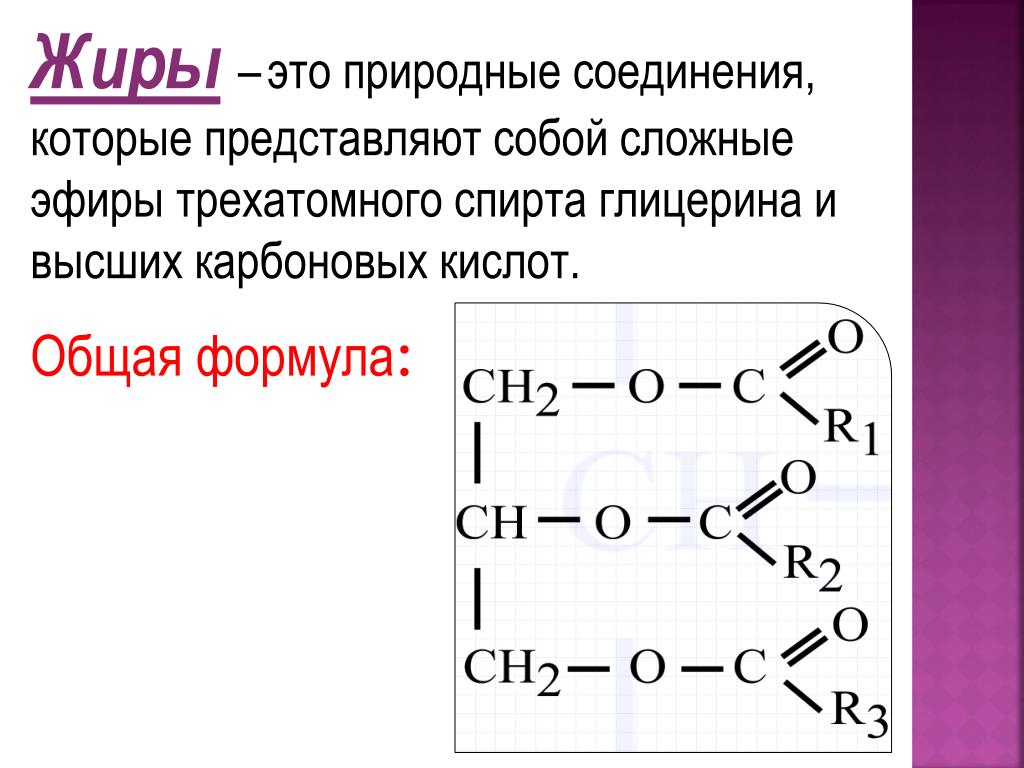 Спиртовое брожение идет под действием фермента дрожжей. Сложный химизм этого процесса суммарно выражается уравнением:
Спиртовое брожение идет под действием фермента дрожжей. Сложный химизм этого процесса суммарно выражается уравнением:
С6Н12О6 → 2С2Н5ОН + 2СО2↑
Глюкоза – необходимый компонент пищи, один из главных участников обмена веществ в организме. Она очень питательна и легко усваивается. При ее окислении выделяется больше трети используемой в организме энергии. Ресурс – жиры, но роль жиров и глюкозы в энергетике разных органов различна. Сердце в качестве топлива использует жирные кислоты. Скелетным мышцам глюкоза нужна для «запуска», а вот нервные клетки, в том числе и клетки головного мозга, работают только на глюкозе. Их потребность составляет 20-30 % вырабатываемой энергии. Нервным клеткам энергия нужна каждую секунду.
Сахароза
Сахароза – соединение, известное каждому, как обычный сахар. Ее формула – С12Н22О11. Она относится к дисахаридам. Сахароза может не только растворяться в воде, но и взаимодействовать с ней под воздействием ферментов или кислот.
Сахароза может не только растворяться в воде, но и взаимодействовать с ней под воздействием ферментов или кислот.
С12Н22О11 + Н2О → С6Н12О6 + С6Н12О6
Образуются глюкоза и фруктоза. Фруктоза является изомером глюкозы.
Применение отдельных представителей
Крахмал и целлюлоза. Крахмал и целлюлоза относятся к полисахаридам. Они являются природными полимерами. Их молекулы состоят из сотен и тысяч групп атомов (C6H10O5)n, остатков молекулы глюкозы. Значения n в них разные. Молекулы целлюлозы намного длиннее, чем крахмала.
nцеллюлозы > nкрахмала
По своему строению их можно отнести к высокомолекулярным соединениям.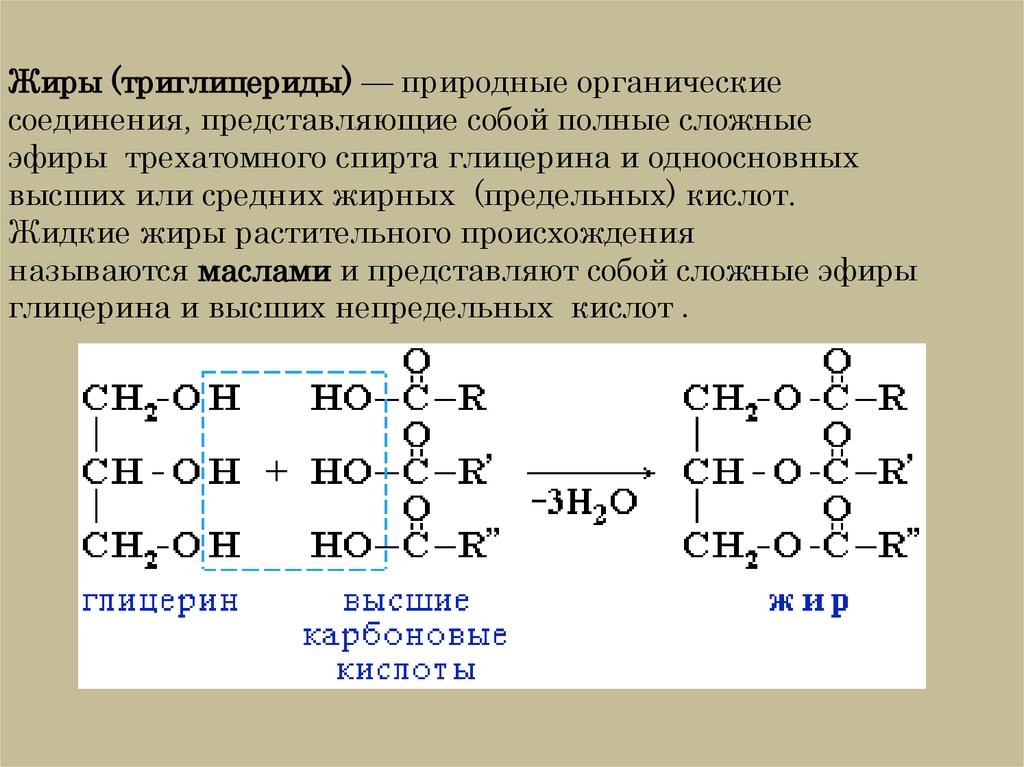 Крахмал в основном образуется в процессе фотосинтеза.
Крахмал в основном образуется в процессе фотосинтеза.
n С6Н12О6 → (C6H10O5)n+ n Н2О
Этот процесс происходит в зеленых листьях растений. Накапливается крахмал в зернах, корнеплодах или плодах. Качественной реакцией на крахмал является взаимодействие с йодом. Появляется синее окрашивание (см. рис. 2).
Рис. 2. Качественная реакция на крахмал с раствором йода. Синее окрашивание
Целлюлоза, или, как ее еще называют, клетчатка, с йодом не взаимодействует. Целлюлоза является основной частью оболочек клеток растений. В древесине содержится около 50 % по массе целлюлозы. Именно из древесины получают метанол, уксусную кислоту, бумагу и многие другие ценные продукты.
Общим свойством углеводов является способность разлагаться при нагревании. При термическом разложении углеводов образуются сажа и вода.
При термическом разложении углеводов образуются сажа и вода.
Подведение итога урока
Вы узнали состав, строение и свойства таких жизненно важных органических веществ, как жиры и углеводы. Жиры – это сложные эфиры глицерина и высших карбоновых кислот. Общим свойством углеводов является способность разлагаться при нагревании.
Список рекомендованной литературы
- Рудзитис Г. Е. Неорганическая и органическая химия. 9 класс: Учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, 2009.
- Попель П. П. Химия. 9 класс: Учебник для общеобразовательных учебных заведений / П. П. Попель, Л. С. Кривля. – К.: ИЦ «Академия», 2009. – 248 с.: ил.
- Габриелян О. С. Химия. 9 класс: Учебник. – М.: Дрофа, 2001. – 224 с.
Рекомендованные ссылки на интернет-ресурсы
- Интернет-портал «interneturok.ru» (Источник)
- Интернет-портал «hemi.
 nsu.ru» (Источник)
nsu.ru» (Источник) - Интернет-портал «chemPort.Ru» (Источник)
- Интернет-портал «ХиМиК.ру» (Источник)
Рекомендованное домашнее задание
- Рудзитис Г. Е. Неорганическая и органическая химия. 9 класс: Учебник для общеобразовательных учреждений: базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, 2009. – №№ 8, 9, 10 (с. 173).
- Какая реакция является качественной на крахмал?
- Что такое жиры?
Жиры и мыла
Жиры и мыла
| Биосинтез жиров | Омыление и мыло | Моющая структура |
Последний раз мы
посмотрел на несколько реакций производных карбоновых кислот и узнал
как получить сложные эфиры и амиды. Сегодня мы рассмотрим некоторые дальнейшие реакции
сложных эфиров. Мы также рассмотрим химию функциональной группы сложного эфира.
в жирах.
Мы видели, что производные карбоновых кислот реагируют с нуклеофилами
для получения продуктов замещения, в которых уходящая группа заменена на
атакующий нуклеофил.
Эта же схема описывает первые стадии реакции сложных эфиров.
с алюмогидридом лития и реактивами Гриньяра, но в обоих случаях
реакция идет дальше, так как первый образовавшийся продукт также реагирует
с реагентом. Например, давайте посмотрим на восстановление сложного эфира.
с алюмогидридом лития.
Когда «ион гидрида» (H: — ) из алюмогидрида лития
заменяет группу OR’ сложного эфира, образуется альдегид. мы уже
видно, что и альдегид восстанавливается алюмогидридом лития, поэтому получается
неудивительно, что альдегид сразу же восстанавливается до первичного спирта.
На самом деле альдегид более электрофилен, чем сложный эфир, поэтому, как только
когда образуется несколько молекул альдегида, гидрид атакует их
предпочтительнее эфира. Реакция завершается последующим добавлением
водной кислоты для протонирования O — атомов.
В результате сложные эфиры восстанавливаются алюмогидридом лития до
первичные спирты, в которых углерод сложного эфира стал углеродом спирта.
Боргидрид натрия недостаточно реакционноспособен, чтобы осуществить это восстановление.
Это полезный способ получения первичных спиртов.
Очень похожий процесс происходит, когда сложный эфир
реагирует с реактивом Гриньяра. Помните, что реактив Гриньяра служит
как источник углеродных нуклеофилов. Мы можем использовать тот же шаблон, что и работал
для восстановления алюмогидрида лития путем замены «H: — »
с «C: — » из реактива Гриньяра. Вот пример
в котором реактив Гриньяра представляет собой метилмагнийбромид:
Здесь первым продуктом является кетон, в котором группа OR сложного эфира
был заменен алкильной группой реактива Гриньяра. Этот кетон
немедленно подвергается атаке другой молекулы реактива Гриньяра. После
нейтрализации водной кислотой продукт представляет собой спирт, в котором
две идентичные группы, присоединенные к углероду спирта, взяты из реакции Гриньяра.
реагент. Если группа R сложного эфира представляет собой углеродную группу, это будет третичная группа.
алкоголь.
В обоих этих случаях мы объединили общую схему для карбоновых
производные кислоты, замещение нуклеофила вместо уходящего
группа, с образцом, который относится к альдегидам и кетонам, чтобы получить
при «двойной» реакции. Первая часть является заменой, а вторая часть
дополнение. Мы не можем остановить реакцию на полпути, потому что альдегиды и
кетоны более реакционноспособны, чем сложные эфиры, поэтому альдегиды и кетоны сожрут
реагент быстрее, чем сложные эфиры.
Мы потратили некоторое время на альдольную конденсацию
когда мы изучали альдегиды, и мы узнали, что альфа-С-Н связи
Альдегиды и кетоны могут быть атакованы основаниями с образованием енолятов.
то же самое может произойти с эфирами, хотя мы должны быть очень конкретными.
об идентичности базы, которую мы используем — она должна быть такой же, как
OR’ (спиртовая) часть сложного эфира. (Это сделает немного больше
смысл позже).
Первая стадия такой реакции полностью аналогична приготовлению
енолят из альдегида. Затем следует атака нуклеофилов.
альфа-углерод енолята на карбонильном углероде второй молекулы
эфира. Опять же, это строго аналогично ситуации в
альдольной реакции, в результате которой происходит нуклеофильное присоединение к карбонилу
углерод. Как это типично для производных карбоновых кислот, следующим этапом является
потеря уходящей группы, так что карбонильная группа, которая была добавлена
проявляется как кетон. (Поскольку новообразованный кетон находится в бета-положении
относительно сложноэфирной функциональной группы эти соединения называются бета-кетоэфирами.)
Эта общая реакция называется конденсацией Клайзена в честь Людвига Клайзена.
видный немецкий химик-органик конца 19го и начала 20 века.
Хотя эта реакция имеет большое значение для синтеза в органических
химии, мы собираемся обратить наше внимание на участие этого
механизм биологического синтеза жирных кислот.
Сначала нам нужно кое-что узнать о структурах
жиров. Жиры представляют собой сложные эфиры, в которых OR’ (спиртовая) часть молекулы
представляет собой тригидроксисоединение, глицерин (HOCH 2 CHOHCH 2 OH).
В этих молекулах три части карбоновой кислоты, так как каждая глицериновая
молекула может быть этерифицирована другой карбоновой кислотой. Следовательно, они
называются триацилглицеринами или триглицеридами. Эти карбоновые кислоты обычно
имеют длинные углеводородные цепи из четырнадцати-двадцати атомов углерода (включая
карбонильный углерод). Эти цепи, как правило, неразветвленные и, что особенно поразительно,
они содержат четное число атомов углерода. Карбоновые кислоты, полученные
при гидролизе жиров называются жирными кислотами.
Поскольку большинство углеродов в жирах полностью восстановлены (максимальное количество
водорода, а не кислорода), окисление жиров приводит к образованию значительных количеств
энергии, примерно в два раза больше энергии на грамм, получаемой из более
окисленные углеводы и белки. Таким образом, жиры используются для получения долгосрочной энергии.
Таким образом, жиры используются для получения долгосрочной энергии.
хранение в организмах.
Наблюдение, что жирные кислоты имеют четное число атомов углерода
дает представление о механизме их биологического синтеза.
Самая очевидная идея состоит в том, что жирные кислоты состоят из двух атомов углерода одновременно.
это означало бы, что каждая жирная кислота должна иметь четное число
углерода. Распространенной двухуглеродной молекулой в биохимии является уксусная кислота.
(При кислотно-щелочной нейтральности, которая преобладает в биологических системах,
уксусная кислота присутствует в виде сопряженного основания, ацетат-иона).
Это предположение было подтверждено кормлением организмов радиоактивно
меченый ( 14 C) ацетат. Радиоактивная метка появилась на
жиры. Более конкретно, если 14 C был помещен в карбонил
углерод ацетата, он появился в нечетных местах в
жирная кислота. Если его поместить в метиловый углерод ацетата, он появится
четных атомов углерода в жирной кислоте.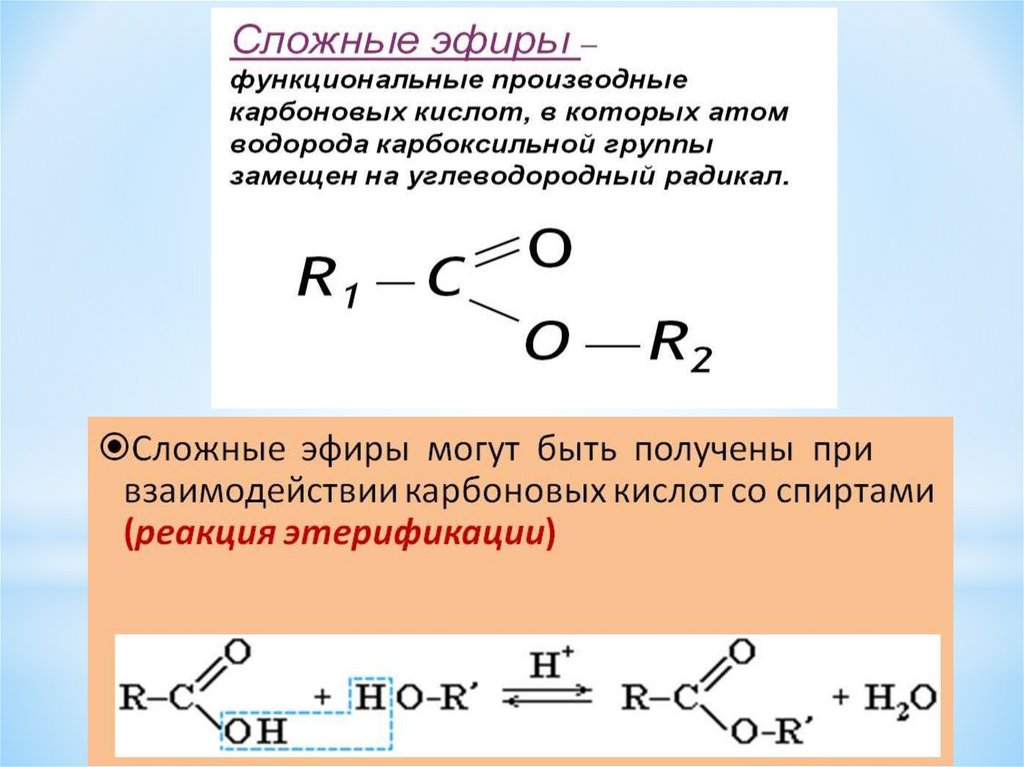
Это интерпретируется как означающее, что жирная кислота состоит из двух атомов углерода.
вовремя. Каждые две углеродные единицы добавляются путем реакции альфа-углерода
одно ацетатное звено с карбонильным углеродом следующего — в точности по образцу
что мы видим в конденсации Клайзена.
Конечно, это еще не все, но главное
Стадия образования связи имеет ту же схему, что и конденсация Клайзена. Что
то есть атака нуклеофильным атомом углерода по карбонильному углероду сложного эфира,
за которым следует потеря спиртовой части сложного эфира в виде остаточной
группа. В биологической реакции сложные эфиры содержат серу.
чем кислород, и присоединяются к ферментам или другим белкам, а нуклеофильные
углерод окружен не одной, а двумя карбонильными группами. Тем не менее,
базовая схема та же.
За рассмотренной нами биологической конденсацией Клайзена следует
дальнейшие биохимические стадии, которые заменяют карбонильный кислород двумя атомами водорода.
Полученный таким образом четырехуглеродный эфир подвергается атаке по его карбонильной
углерода другой молекулой углеродного нуклеофила, и цикл продолжается.
Важно понимать, что в биологической химии используются те же механизмы
которые мы используем в лаборатории. Механизмы органических реакций лежат в основе всех
биохимии, особенно обмена веществ.
Далее мы рассмотрим реакцию жиров, которая
большое экономическое значение. Никто не знает, когда было сделано первое мыло,
но это было очень важно в средние века и раннеиндустриальный период
потому что его использовали для вымывания шерстяного жира из шерсти при подготовке к окрашиванию
и спиннинг. В те времена это было слишком дорого, чтобы использовать его для общей чистоты.
Общедоступность мыла привела к повышению стандартов чистоты.
и соответствующее улучшение общего состояния здоровья.
Мыло производится путем обработки жиров крепким раствором щелочи (NaOH).
Функциональные группы сложного эфира гидролизуются с высвобождением спиртовой части.
в виде глицерина и кислотных частей в виде смеси солей натрия
жирной кислоты. Глицерин растворяется в воде и отделяется от
соли жирных кислот. Они почти нерастворимы в воде и смываются
и спрессованный в лепешку — мыло.
Механизм этой реакции, которая называется омылением) может
легче проиллюстрировать на простом эфире, чем на жире. Это следует за
нормальная картина для производного карбоновой кислоты, и первая стадия аналогична
к катализируемой основанием гидратации альдегидов — атаке гидроксида нуклеофила
ион у карбонильного атома углерода. Далее следует обычный отъезд
уходящей группы (в данном случае ИЛИ’ — эфира).
Поскольку ОР’ — более базовый, чем РКОО — , последний
стадия – реакция нейтрализации. (Последний шаг будет иметь больше смысла
после следующего раза)
Чтобы закончить, нам нужно посмотреть, как работает мыло.
и как это связано с их структурой. Мыла представляют собой молекулы-«мосты».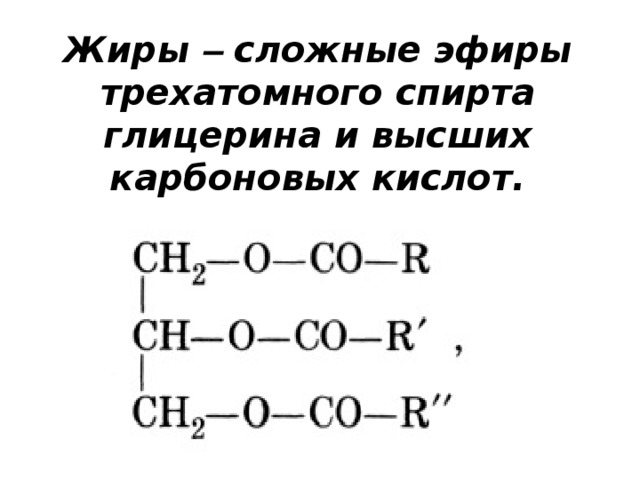
Их длинные углеводородные цепи очень похожи на масла, поэтому они хорошо смешиваются.
с маслами. Фактически можно сказать, что цепочки мыла растворяются в маслах.
В то же время их ионные головки достаточно полярны, чтобы растворяться в воде.
Если мы представим себе маленькую каплю маслянистого вещества, которая растворила сгусток
молекул мыла мы видим, что полярные ионные головки будут торчать
(не растворяется в масле) на поверхности. Эти полярные бугорки на поверхности притягивают
молекулы воды, так что маслянистый шарик покрывается молекулами воды,
удерживаются там ионами. Шар теперь готов быть смытым в
вода. Поскольку большая часть грязи, от которой мы надеемся избавиться, удерживается на месте
жирные пленки, удаление масла удаляет грязь.
Структурные требования к мылу (или, в более общем смысле, к моющему средству)
представляют собой длинный углеводородный хвост (12 или более атомов углерода) и полярный (часто ионный)
главный. В синтетических моющих средствах углеводородный хвост обычно образуется
связывание нескольких молекул этилена вместе и присоединение их к бензолу
звенеть.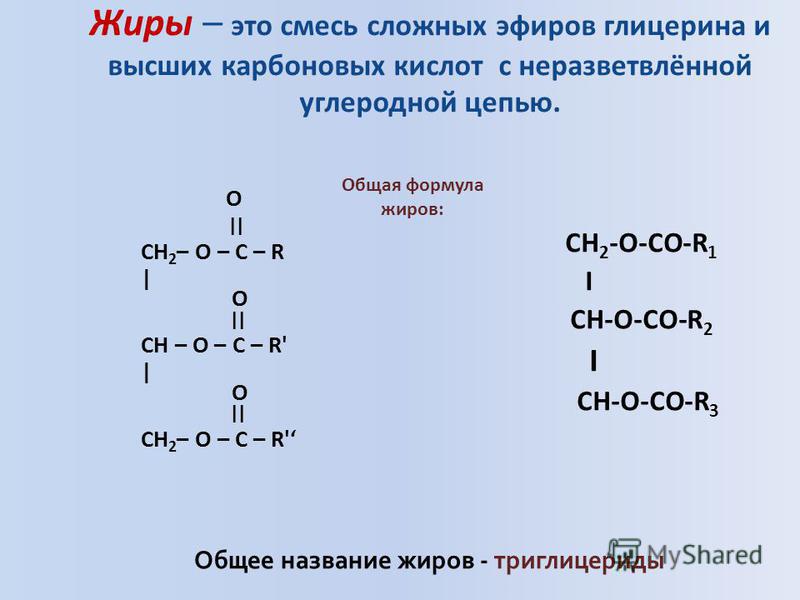 Полярная часть образуется путем ковалентного связывания серы сульфата.
Полярная часть образуется путем ковалентного связывания серы сульфата.
ион к бензольному кольцу. Мы узнаем больше о химии изготовления
эти позже. Если ответвлений на углеводородном хвосте мало, синтетический
моющее средство будет биоразлагаемым, важная характеристика.
Вернуться к плану курса
Жиры
Жиры
Жиры, масла, воски и стерины в совокупности известны как липиды. Широкий класс веществ, известных как жиры, не имеет общей структуры, но в целом может быть классифицирован как сложные эфиры жирных кислот и глицерина. Может быть от одной до трех сложноэфирных связей цепей жирных кислот с глицерином, что приводит к классификации моноглицеридов, диглицеридов и триглицеридов. Иногда использование слова «жир» ограничивается триглицеридами. Термин жирная кислота является подструктурой липидов и не должен использоваться как синоним слова «жир». Встречающиеся в природе жирные кислоты почти всегда имеют четное число атомов углерода.
| Index Biochemical concepts Chemistry concepts Reference | ||
| Назад |
Полностью насыщенный жир не имеет двойных связей между атомами углерода в цепях жирных кислот. Вообще говоря, животные жиры более насыщены, чем растительные жиры. Высоконасыщенные жиры обычно твердые при комнатной температуре. | Индекс Биохимические концепции Химические концепции Ссылка | ||
| Назад |
Полностью насыщенный жир не имеет двойных связей между атомами углерода в цепях жирных кислот. Begin typing your search term above and press enter to search. Press ESC to cancel. Back To Top
|

 nsu.ru» (Источник)
nsu.ru» (Источник)